-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Rekonstrukce po gastrektomii
Post-Gastrectomy Reconstruction
Aim:
Authors present review of current opinion in reconstruction of gastrointestinal tract after gastrectomy, in pouch benefit and benefit of retaining of the duodenum in food transit, and the importance of antireflux procedure.Method:
Authors searched the Medline database for current trials regarding the reconstruction of gastrointestinal tract after gastrectomy. The key words were gastrectomy, reconstruction, and upper GI. The search was limited to those languages: English, German, and Czech. The authors identified 41 trials altogether. The trials were analysed regarding the pouch benefit and the retaining of duodenum in food transit. The comparison was done.Conclusion:
The trials’ results are not homogenous. Many patients are not possible to be evaluated because of the tumor recurrence with weight loss and other symptoms. There is no ideal reconstruction according to the trials. Patients can benefit from the reconstruction retaining the duodenum in food transit and with pouch creation. The retained duodenum in food transit is anormal stage from the anatomical and physiological view. In the case that pouch allows the proportional evacuation of food, the retaining of duodenum is advantageous. The pouch combined with antireflux procedure has a potential to improve life duality from longer perspective. On the other side, some authors present opinion that the reconstruction with pouch is too complicated with worse patient perioperative tolerance and its benefit is minimal. There is a very small number of prospective randomized trials which present a very small number of patients without statistical significance. It is important to perform a larger prospective randomized trial.Key words:
gastrectomy – reconstruction – upper GI
Autoři: T. Malý 1; P. Zonča 2; Č. Neoral 1; A. Jurytko 2
Působiště autorů: 1. chirurgická klinika, LF UP a FN Olomouc, přednosta: Doc. MUDr. Č. Neoral, CSc. 1; Zentrum für Viszeral und Minimal Invasive Chirurgie, Wesseling, Köln am Rhein, Nordrhein-Westfallen Germany, přednosta: Prof. Dr. med. C. A. Jacobi 2
Vyšlo v časopise: Rozhl. Chir., 2008, roč. 87, č. 7, s. 367-375.
Kategorie: Monotematický speciál - Původní práce
Souhrn
Cíl:
Autoři prezentují review současných názorů na problematiku rekonstrukce trávicího ústrojí po gastrektomii, významu pouche, významu zachování pasáže duodenem a významu antirefluxních výkonů.Metoda:
Autoři vyhledali v databázi Medline současné studie týkající se rekonstrukce po gastrektomii. Jako klíčová slova byla zadána gastrektomie, rekonstrukce a horní GIT. Vyhledávání bylo provedeno s jazykovou limitací (angličtina, němčina, čeština). Autoři celkem identifikovali 41 studií. Tyto studie pak následně analyzovali pokud jde o benefit pouche, význam zachování pasáže duodenem a závěry studií vzájemně srovnali.Závěr:
Závěry studií nejsou homogenní. Mnoho pacientů není možno hodnotit pro rekurenci onemocnění a vzdálené metastázy, které mohou způsobit ztrátu hmotnosti nebo jiné symptomy. Podle studií prakticky žádná rekonstrukce není ideální. Pacienti mohou profitovat z rekonstrukce zachovávající pasáž duodenem a vytvořeným pouchem. Z hlediska anatomického a fyziologického představuje zachování pasáže duodenem normální stav. V případě, že pouch umožní proporcionální vyprazdňování potravy, zachování pasáže duodenem je výhodné. V kombinaci s antirefluxním výkonem má pouch potenciál zlepšit z dlouhodobější perspektivy kvalitu života po gastrektomii. Na druhé straně řada autorů udává, že tento typ rekonstrukce je příliš komplikovaný, zatěžuje pacienty a benefit je minimální. Velmi málo studií porovnává různé rekonstrukce formou prospektivní randomizované studie. Tyto studie mají jen velmi limitovaný počet pacientů bez statisticke signifikace. Je proto potřebné provést rozsáhlejší prospektivní randomizovanou studii.Klíčová slova:
gastrektomie – rekonstrukce – horní GITÚVOD
Operace žaludku v rozsahu totální gastrektomie představuje často nezbytný zákrok u pacientů s maligním onemocněním. Ve svém důsledku tato operace přináší dostatečnou radikalitu, zároveň však způsobuje pacientům řadu potíží. Na jedné straně se potíže obvykle zmírňují s prodlužujícím se časovým intervalem od operace. Na druhé straně jsou potíže v důsledku odejmutí žaludku ještě potencovány progresí základního onemocnění. Chirurg může přispět k zajištění dostatečné kvality života vhodným typem rekonstrukce po gastrektomii. Při rekonstrukci je vždy nutné zvážit, zda vytvoříme rezervoár a zda zachováme pasáž duodenem.
HISTORIE TOTÁLNÍ GASTREKTOMIE A NÁSLEDNÉ REKONSTRUKCE
První totální gastrektomie u člověka byla provedena v roce 1884 Connorem s provedením ezofagoduodeno-anastomózy, avšak pacient nepřežil operaci [1]. V roce 1897 provedl Schlatter v Zürichu první úspěšnou totální gastrektomii. K rekonstrukci byla použita omega klička a pacient přežil 14 měsíců [2]. V roce 1892 Roux popsal svou techniku, která se stala nejrozšířenější technikou rekonstrukce. Hlavní výhodou této rekonstrukce je jednoduchost provedení a relativně nízké riziko komplikací [3]. Počátky rekonstrukce s tvorbou rezervoáru spadají do 20. let minulého století. Hoffman v roce 1922 použil dlouhou kličku jejuna s dlouhou anastomózou side to side mezi oběmi rameny kličky [4]. Tato technika byla doporučována Engelem v roce 1945 a Lefévrem v roce 1950, ale později nebyla přijata pro perzistující refluxní ezofagitidu u většiny pacientů. Horsley prováděl podobnou enteroenteroanastomózu [5]. Graham v roce 1940 použil antekolicky lokalizovanou omega kličku jako substitut žaludku [6]. Jejunální pouch byl poprvé popsán Huntem a Rodinem v roce 1952 [7]. Jejich technika patří k nejpoužívanějším. Lawrence lehce modifikoval Huntův pouch využitím delší side to side anastomózy mezi dvěmi kličkami tenkého střeva a dosáhl dobrých výsledků [8]. Hlavní výhodou této techniky je velký rezervoár, který snižuje incidenci postprandiální plnosti a regurgitace. Občas je po tomto typu rekonstrukce pozorován reflux. Day a Cunha vytvořili další typ rekonstrukce s přídavnou rezervoárovou kapacitou kombinací omega kličky s distální side-to-side enteroanastomózou [9]. Mandl navrhnul rovněž podobnou rekonstrukci [10]. Nakayama popsal rekonstrukci tvaru obráceného písmene „b“, kdy Rouxova klička je formována do cirkulární kličky, někdy také označována jako 1-9 rekonstrukce [11]. Tolley, Daido, Paulino, Nadrowski a Doherty vytvořili další modifikace Rouxovy kličky [12, 13, 14]. V roce 1981 Lygidakis modifikoval 1-9 rekonstrukci konverzí 9 na 8 přidáním další anastomózy [15].
Uvádí se, že aktuálně existuje více než 80 typů rekonstrukce horního GITu po resekci žaludku nebo po gastrektomii. Řada autorů prezentuje další a další modifikace.
PASÁŽ DUODENEM
V roce 1941 Seo popsal rekonstrukci s použitím interpozita jejuna k zachování pasáže duodenem [16]. Longmire a Beal zdůrazňovali rovněž výhody zachování pasáže duodenem. Hays interponoval trojitý pouch mezi jícen a duodenum [17]. Gütgemann doporučil interpozici velmi dlouhé kličky jejuna délky nejméně 30 cm ke zlepšení rezervoárové funkce interponované kličky jejuna [18]. Poth preferoval interpozici antiperistaltického jejunálního pouche [19]. Kieninger a Koslowski interponovali 10 cm přídatný jejunální segment antiperistalticky distálně od Longmireho rekonstrukce [20]. Tento měl za úkol zpomalit evakuaci substitutu a působit jako neopylorus. Morii použil 10 cm dlouhý jejunální segment interponovaný izoperistalticky mezi zbytek žaludku a duodenum po parciální gastrektomii k redukci postgastrektomických symptomů [21]. V roce 1982 Cushieri navrhnul velký jejunální pouch interponovaný mezi jícen a duodenum [22]. V devadesátých letech Nakane a Schwarz doporučili pouch interponovaný mezi jícen a duodenum vycházející z rekonstrukce podle Hunta-Lawrence [23, 24].
OPERAČNÍ TECHNIKY S TVORBOU POUCHE
Gastrický substitut má za úkol poskytnout adekvátní rezervoár. Technika musí být bezpečná a jednoduchá a musí redukovat reflux na minimum. V případě zachování pasáže duodenem vytváří relativně nejfyziologičtější stav. Nejčastější rekonstrukcí v tomto smyslu je Huntův-Lawrencův-Rodinův pouch a interponovaná jejunální klička podle Longmire.
Substituty z tenké kličky
Huntův-Lawrencův-Rodinův pouch
K vytvoření HL pouche je použito jejunum. Distální část rozdělené aferentní části kličky délky 20 cm je protažena přes mezokolon a je plikovaná k proximální eferentní kličce, je přeložena a pak je vytvořena sutura. Anastomózy mohou být vytvořeny ručně nebo pomocí stapleru. Ve střední části každého pahýlu plikovaných kliček je vytvořen drobný otvor, přes který je zaveden lineární cutter a je vytvořena side-to-side anastomóza na antimezenteriální straně. Je důležité ponechat otvor pro ukazovák mezi proximálním koncem a anastomózou v oblasti apexu přeložené kličky, abychom se vyhnuli poškození cévního zásobení jejunální stěny v oblasti následné ezofagojejunoanastomózy. Následně je vytvořena EEA přes centrální otvor pouche. Tento otvor je uzavřen příčně pokračující suturou po provedení EEA (Obr. 1).
Obr. 1. Huntova-Lawrencova-Rodinova rekonstrukce Fig. 1. Hunt-Lawrence-Rodino reconstruction 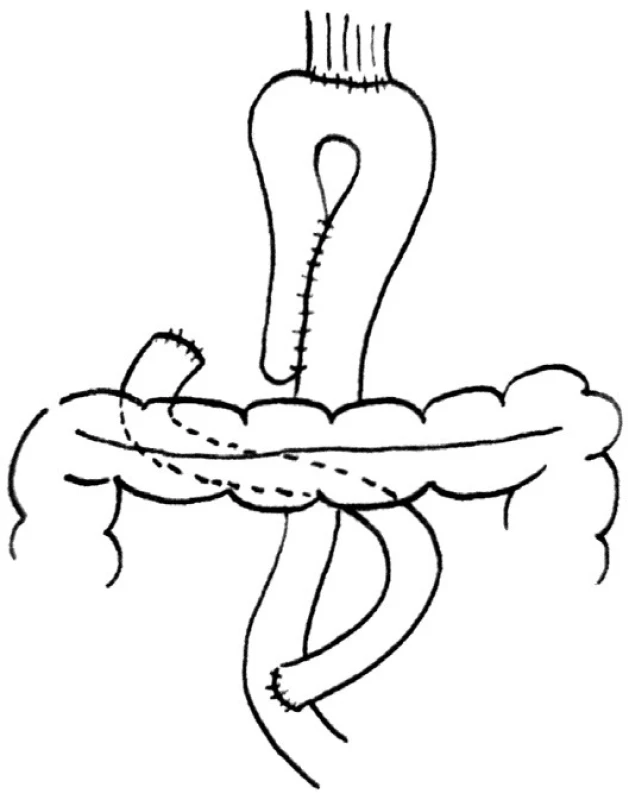
Pouch podle Longmire
První jejunální klička je kompletně mobilizována a exkludována v délce 25–35 cm. Klička je protažena retrokolicky a je připojena na jícen a duodenum izoperistalticky. Je třeba se vyhnout torzi a napětí mezenteria. Ezofagojejunoanastomóza může být provedena end-to-end nebo end-to-side. Distální část interponovaného jejuna je napojena end-to-end k pahýlu duodena (Obr. 2).
Obr. 2. Rekonstrukce podle Longmire Fig. 2. Longmire reconstruction 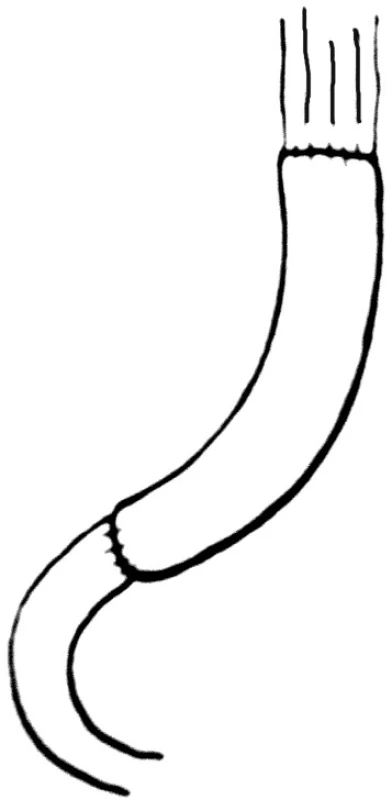
Ezofagojejunoplikace (Siewert-Peiper pouch)
První klička jejuna je protažena retrokolicky. 8 cm pod vrcholem kličky je v délce 15 cm vytvořena široká side-to-side anastomóza. Na horním okraji je provedena sutura a otevřený zbytek je anastomózován k ezofageálnímu pahýlu. Dva konce přeložené jejunální kličky jsou zabaleny kolem ezofagojejunoanastomózy. Konce plně pokrývají tenkou kličku. To je důležité k zajištění přední stěny anastomózy (Obr. 3).
Obr. 3. Rekontrukce Siewertova-Peiperova Fig. 3. Siewert-Peiper reconstruction 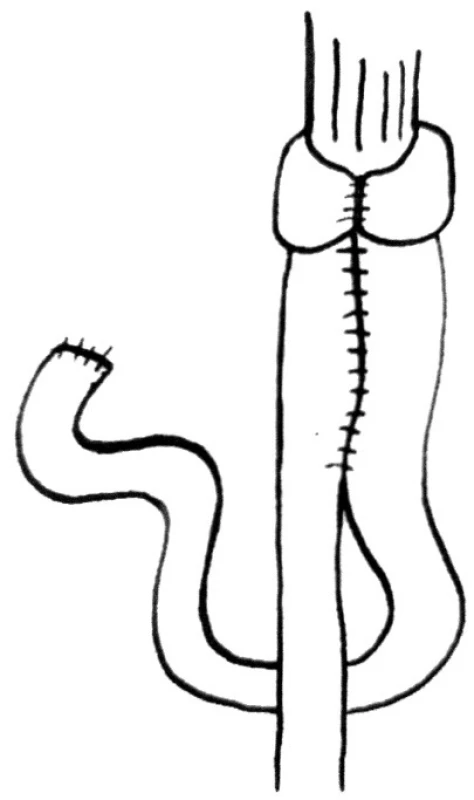
Jejunální pouch podle Cushieriho
Pouch je vytvořen z izoperistaltického segmentu horního jejuna na vaskulárním pediklu obsahujícím jednu arterii a jednu vénu. Je zvolen vaskulární pedikl distálně od prvních dvou jejunálních větví. Délka izolované kličky je od 30 do 50 cm. Proximální konec izolované jejunální kličky je uzavřen invaginací a klička je přeložena tak, že otevřená distální část je delší než uzavřená část o 5 cm. Mezi dvěmi přiléhajícími kličkami je vytvořena entero-entero anastomóza. Autor zdůrazňuje důležitost ponechání širokého okna k prostrčení ukazováku mezi proximálním koncem anastomózy a apexem přehnuté kličky. To usnadňuje formaci proximální anastomózy a vyhneme se poškození cévního zásobení „T“ tvarované sutury. Kompletní pouch je vložen do supramezokolického prostoru transmezokolicky. Na proximálním konci pouche je vytvořena 3 cm incize k anastomóze s jícnem. Nakonec je izoperistaltické rameno pouche anastomózováno end-to-end k duodenu (Obr. 4).
Obr. 4. Rekonstrukce podle Cushieriho Fig. 4. Cushieri rekonstruction 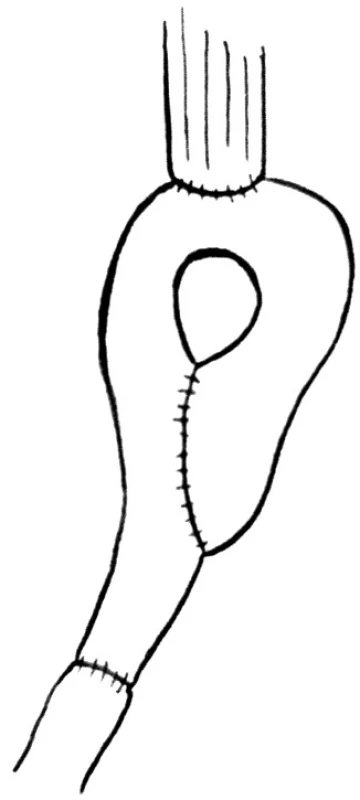
Substituty z tlustého střeva
State, Moroney a Gerwig použili k rekonstrukci kontinuity trávicího ústrojí segment z colon transversum [25]. Moroney a Gerwig používali izoperistaltickou interpozici, State preferoval anizoperistaltickou interpozici c. transversum. Lee a Hunnicutt byli první v interpozici ileocekálním segmentem jako gastrického substitutu [26, 27]. Na Slovensku byl průkopníkem této techniky Fraštacký.
Ileocekální segment
Cékum má vynikající compliance jako krátkodobý rezervoár. V roce 1931 bylo Hurstem označeno jako žaludek kolon. Navíc obsahuje antirefluxní chlopeň. První zprávy o užití ileocekálního segmentu pocházejí z USA a jsou popsány v literatuře v časných 50. letech. Ve stejné době se objevily zprávy Hunnicutta (Kalifornie), Leeho (Cincinnati), Dérica (Itálie) a Moroneyho (Anglie). Řada faktů hovoří ve prospěch využití ileocekálního segmentu. Cékum a přilehlá část c. ascendes je dost velká, aby mohla sloužit jako rezervoár a má zároveň dobrou schopnost absorpce vody a peristaltickou aktivitu. Terminální ileum a pravé kolon tvoří anatomickou jednotku včetně cirkulace a lymfatické drenáže. Když se odstraní, neobjeví se negativní efekt intestinálního tranzitu. Průměr ilea a jícnu je srovnatelný, je možno provést anastomózu end-to-end. Ileocekální chlopeň může zabránit refluxu. Ileocekální segment je dostatečně daleko od primárního tumoru a nebývá postižen tumorem.
Colon transversum
Někteří autoři využili segment colon transversum. Tato metoda je nyní užívána zřídka.
Substitut z levého kolon s tvorbou Hisova úhlu a refluxní bariéry
Ohwada popsal techniku s užitím levého kolon k substituci žaludku v kombinaci s vytvořením nového Hisova úhlu jako antirefluxní bariéry. Asi 25 cm levého kolon s ascendentní větví levé kolické arterie je izoperistalticky přiloženo k jícnu. Proximální konec kolon je přichycen k jícnu a je vytvořen nový Hisův úhel.
DISKUSE
Studie podporující tvorbu pouche
Retrospektivní studie 23 pacientů s použitím pouche podle Lygidakise ukazuje akceptovatelnou mortalitu (8,7 %) a příznivý vývoj hmotnosti. Lygidakis dříve prezentoval retrospektivní studii srovnávající 118 pacientů po různých typech rekonstrukce žaludku. Pooperační hmotnost a incidence dumpingu a refluxu byla lepší ve skupině Lygidakisova pouche ve srovnání s Rouxovou rekonstrukcí a Lawrencovým pouchem. 82,5 % pacientů dosáhlo předoperační hmotnosti 1 rok po operaci. Endoskopické vyšetření prokázalo biliární reflux do jícnu 1 rok po operaci u 6 z 10 pacientů s Lawrencovým pouchem a u 2 pacientů s Rouxovou rekonstrukcí a u žádného pacienta s Lygidakisovým pouchem. Dumping syndrom u Lygidakisova pouche se nevyskytnul u žádného pacienta (0/74), u Lawrencova pouche u 2 pacientů (2/10) a v případě Rouxovy rekonstrukce u 4 pacientů (4/11) (93, 94). Nebyla nalezena další studie s užitím Lygidakisova pouche z jiného pracoviště [28].
Malé studie ukázaly výhodu Lawrencova pouche před Rouxovou rekonstrukcí pokud jde o dumping, pooperační hmotnost, regurgitaci žluče a množství požitého jídla [29]. Troidl ve své práci dospěl k závěru, že HLR pouch nabízí lepší kvalitu života ve srovnání s Rouxovou rekonstrukcí u pacientů přežívajících více než 1 rok [30]. Problém těchto malých studií je v tom, že jen 39 % pacientů bylo naživu 1 rok po chirurgickém zákroku.
Berglund měřil maximální kapacitu u tří skupin pacientů 1 rok po zákroku. První skupina obsahovala 16 pacientů, kteří podstoupili Rouxovu rekonstrukci. Kapacita byla jen 180 ml a bazální tlak byl 40,4 cm H2O v proximální části Rouxovy kličky. U žaludečního pouche tvaru „S“ byl objem 400 ml, což bylo srovnatelné s pacienty po subtotální gastrektomii. Maximální kapacita u těchto pacientů byla 475 ml [31].
Prospektivní randomizovaná studie Iivonena z Finska srovnávala 26 pacientů po HL rekonstrukci s 23 pacienty po Rouxově operaci se zaměřením na BMI, kapacitu jídla, postprandiální plnost a dumping syndrom. Pacienti s HL pouchem mohli jíst plně ve sledovaném období 2 let po operaci. Po 6 měsících pacienti mohli přijímat standardní jídlo hmotnosti 640 g s energetickou hodnotou 520 kcal. Skupina s pouchem ukázala větší kapacitu než skupina s Roux rekonstrukcí: 501 ± 236 g vs. 372 ± 222 g. Dumping a časná plnost byla větší v Rouxově skupině [32]. U stejné skupiny pacientů byla studovaná evakuace pomocí dynamické scintigrafie radioizotopem 99mTc. 15 měsíců po operaci bylo vyprazdňování signifikantně pomalejší u skupiny s rekonstrukcí s pouchem oproti Rouxově rekonstrukci.
V současnosti japonské studie ukazují, že délka jejunálního pouche může ovlivňovat metabolismus po totální gastrektomii [33]. Použili modifikovaný HLR pouch s užitím 15 nebo 20 cm pouche. 21 pacientů podstoupilo totální gastrektomii s rekonstrukcí pomocí kratšího jejunálního pouche (délka 15 cm) nebo delšího jejunálního pouche (délka 20 cm). Autoři pozorovali, že příjem jídla, tělesná hmotnost a dumping syndrom byly podobné v každé skupině, ale skupina s kratším pouchem měla méně refluxních symptomů. Na druhé straně skupina s kratším pouchem měla redukovanou glukózovou toleranci. Vliv velikosti pouche byl ověřen Hokschem [34]. Zjistil, že malý jejunální pouch (7 cm) není dostatečný k překonání pooperačních nutričních problémů. Hoksch srovnal dvě skupiny s a bez pouche se zachováním duodenální pasáže. 19 pacientů podstoupilo interpozici jejunálním pouchem a 8 pacientů interpozici jednoduchou jejunální kličkou (Longmire). Standardizované scintigrafické vyšetření bylo provedeno 1 rok po operaci a ukázalo signifikantně delší tranzitní čas u skupiny s pouchem. Rekonstrukce s pouchem umožnila pacientům zachovat lepší stravovací vzorce a tito pacienti dosáhli vyšší kvality života. Stejný autor se snažil zjistit optimální velikost pouche srovnáním 7 a 15 cm interponovaného pouche. Skupina s delším pouchem měla vyšší pooperační hmotnost, prolongovaný tranzitní čas jídla a méně problémů s příjmem jídla 1 rok po operaci. Autoři zdůrazňovali význam adekvátní techniky a vyšetření. Nejsenzitivnější technikou ke zjištění abnormalit vyprazdňování substitutu je využití radionuklidu 99mTc. Správný okamžik k provedení evakuačních studií je stále kontroverzní. Hoksch navrhuje 12 měsíců po zákroku, protože potenciální výhoda je zřejmější než 3 nebo 6 měsíců po operaci.
Schwarz a Beger shrnuli nálezy u 6 kontrolovaných prospektivních randomizovaných studií, které pojednávaly o různých metodách rekonstrukce pouche po totální gastrektomii [35]. 6 měsíců po operaci pacienti s pouchem měli lepší příjem jídla, pomalejší pasáž, menší váhový úbytek a tendenci k lepší kvalitě života. Studie Fujiwary z Japonska vyhodnotila, že hodnota J-pouche ve srovnání s P-rekonstrukcí není ve snížení pooperační ztráty hmotnosti, ale je ve zlepšení proteinového metabolismu, umožňuje lepší příjem jídla a má nižší incidenci refluxní ezofagitidy [36].
Optimální délka pouche je stále věcí debaty. Příliš velký objem pouche může způsobit stázu netrávené potravy. V současnosti většina autorů navrhuje maximální délku pouche mezi 10–15 cm [37, 38]. Rovněž je otázkou tvar pouche. Může být vytvořen pouch ve tvaru písmene „J“, „S“, „H“, „B“ a další. Nejčastěji užívaným typem v současnosti je „J“ pouch [39].
Studie hovořící proti použití pouchů
Někteří autoři nenašli klinický benefit pouche ve srovnání s jednoduchou Rouxovou rekonstrukcí. Zelnick u 24 pacientů po rekonstrukci (9 pacientů s jejunálním pouchem a 15 s Rouxovou rekonstrukcí) nenašel, že by pouch zlepšil nutriční stav po gastrektomii. Bozzetti provedl randomizovanou kontrolovanou studií, kde srovnal HLR pouch (24 pacientů) s Roux skupinou 24 pacientů. Nenašel rozdíl v pooperační morbiditě nebo mortalitě, evakuačním čase, frekvenci jídla nebo změnách v tělesné hmotnosti. Liedman použil 50 až 60 cm dlouhou Rouxovu kličku k rekonstrukci po totální gastrektomii (49 pacientů) a srovnal ji s rezervoárem ve tvaru písmene „S“ na proximálním konci Rouxovy kličky. Kontrolní skupina 12 pacientů měla provedenou subtotální gastrektomii. Byly zjišťovány biomechanické charakteristiky rekonstruované části s měřením tlaku. Pacienti po totální gastrektomii s rekonstrukcí podle Rouxe měli rozdíl bazálního tlaku a tlaku po požití potravy vyšší než pacienti s rekonstrukcí pouchem nebo po subtotální gastrektomii. I přes toto pacienti s pouchem neměli schopnost konzumovat větší objem jídla oproti pacientům s Roux rekonstrukcí. Ale zkoumaný vzorek byl velmi malý. Závěr této studie je, že konstrukce gastrického rezervoáru nezlepší nutriční adaptaci (váhový rozvoj, příjem energetický nebo množství jídla) [40, 41, 42]. Stejný autor zkoumal složení těla u tří různých skupin pacientů. 75 pacientů podstoupilo totální gastrektomii nebo subtotální gastrektomii, 42 s rekonstrukcí podle Rouxe a 23 s HL pouchem a 10 subtotální gastrektomii. Předoperačně, 6 a 12 měsíců po chirurgickém zákroku autor změřil celkový tělesný sodík a celkovou vodu. Nebyla prokázána diference mezi těmito třemi skupinami. Časně po operaci se objevila ztráta hmotnosti o 10 % u všech tří skupin, ale hmotnost se později stabilizovala. Ztráta hmotnosti byla hlavně díky selektivní ztrátě tuku, i když je známá situace asociovaná s porušením nutričního příjmu. Při pozdějších vyšetřeních stejné populace 3 roky po operaci se ukázalo, že rekonstrukce se substitucí žaludku tvaru „S“ zlepšuje dlouhodobý stav a má být preferována v případě lepší prognózy pacienta stran onkologického onemocnění. Neobjevily se rozdíly v časném pooperačním období, vyskytla se pouze tendence k většímu příjmu porcí potravy. Právě tak byly demonstrovány menší ztráty energie stolicí u této skupiny pacientů. Rozdíly však byly minimální.
Studie zdůrazňující výhody duodenální pasáže
Jejunální interpozice si klade za cíl snížit tranzitní čas jídla s redukcí dumpingu a dalších funkčních problémů asociovaných s Rouxovou rekonstrukcí.
Zachování duodenální pasáže
Cushieri prezentoval nerandomizovanou skupinu 29 pacientů, kteří podstoupili rekonstrukci jejunální interpozici po gastrektomii. Leak z ezofagojejunoanastomózy byl 11 %. 13 pacientů bylo hodnoceno 1–11 let. Po operaci 5 pacientů mělo slabý až těžký refluxní syndrom a navíc u 2 pacientů se vyskytly občasné průjmy. Vazomotorický dumping nebyl pozorován, ale dietní restrikce byla nutná u 2 pacientů. 38 % pacientů mělo ezofagitidu díky biliárnímu refluxu [43].
Miholic a kol. studoval BMI, postprandiální symptomy a sociální úspěšnost u 61 pacientů po Longmirově pouchi (31 pacientů) a Rouxově rekonstrukci (30 pacientů). BMI bylo lepší u jejunální interpozice [44]. Po Rouxově rekonstrukci 63 % pacientů bylo pod 25 percentilem zdravé kontrolní skupiny, zatímco jen 35 % pacientů u skupiny s rekonstrukcí podle Longmire bylo pod 25 percentilem zdravé kontrolní skupiny. Potíže s pozdním dumping syndromem byly více časté u Rouxovy rekonstrukce (17 % vs. 10 %). Obecně dumping syndrom byl asociován s urychlením gastrického vyprazdňování měřeným scintigraficky. Autoři uzavřeli, že zachování duodenální pasáže je hlavním cílem po totální gastrektomii zlepšující nejen dlouhodobé výsledky, ale také krátkodobý nutriční výsledek.
Schmitz hodnotí zachování pasáže duodenem s a bez pouche. Našel lepší kvalitu života (Cushieri index) u skupiny s pouchem, ale rozdíl nebyl signifikantní.
Schwarz a kolektiv zkoumali klinický průběh, kvalitu života a fyziologickou regulaci gastrointestinálních hormonů po různých typech rekonstrukce. 60 pacientů bylo předoperačně randomizováno s následujícími 5 rekonstrukcemi: Ulmský pouch (zachování duodenální pasáže, pouch délky 10 cm), Ulmský pouch (zachování duodenální pasáže, pouch délky 20 cm), HLR pouch (délka 10 cm), HLR (délka 20 cm) a Roux rekonstrukce [45]. U skupin 1 a 2 vzdálenost mezi koncem pouche a duodenem byla 15 cm. 12 zdravých dobrovolníků sloužilo jako kontrola. Kvalita života u skupiny s Ulmským pouchem začala stoupat 6 měsíců po zákroku, zatímco u dalších skupin skóre kontinuálně klesalo. Rozdílný objem pouche u skupin 1 a 2 a mezi 3 a 4 skupinou neměl vliv na kvalitu životu. Stejné rozdíly byly pozorovány u hmotnosti. Při zachování duodenální pasáže (skupiny 1 a 2) tělesná hmotnost stoupala 6 měsíců oproti dalších třem skupinám. Patologické hodnoty glukózové tolerance se nerozvíjí v případě zachování pasáže duodenem. Tato studie ukázala, že zachování pasáže duodenem vede k lepší kvalitě života 6 měsíců po operaci. Výhody zachování duodenální pasáže byly opakovaně popsány.
Bypass duodena postihuje sekreci gastrointestinálních hormonů a alteruje funkci celého trávicího ústrojí. Zachování duodenální pasáže vede k signifikantnímu vzestupu sekrece inzulinu. Když pasáž obchází duodenum, regulace cukru je porušena a vznikají patologické hodnoty glykemie. Je změněna distribuce buněk produkujících peptidové hormony, které mají vliv na regulaci gastrointestinálních hormonů a resorpční kapacitu. Je porušen lipidový metabolismus, což vede k steatorei. Toto může být způsobeno horším promícháním chymu s biliárními solemi a pankreatickými enzymy. Experimentální studie podtrhují pozitivní vliv zachování pasáže duodenem [46].
Studie poukazující na nevýhody zachování pasáže duodenem
Nakane v prospektivní randomizované studii srovnal skupinu s pouchem z tenkého střeva interponovaného mezi jícen a duodenum (skupina 3) s Rouxovou rekonstrukcí (skupina 1) a skupinou s pouchem z tenkého střeva bez zachování pasáže duodenem (skupina 2) [47]. 30 pacientů podstoupilo kurativní totální gastrektomii. Pacienti byli randomizovaně rozděleni do 3 skupin. Sledované cíle byly postprandiální symptomy, změny hmotnosti, nutriční parametry a evakuační čas rekonstruované části. U Rouxovy rekonstrukce použil Nakane 40 cm dlouhou kličku jejuna. U skupiny s HL pouchem byl pouch dlouhý 20 cm. Před vytvořením ezofagojejuno - anastomózy byla vytvořena end-to-end jejunoduodeno-anastomóza asi 20 cm pod pouchem. Jejunální kontinuita byla obnovena end-to-end anastomózou asi 20 cm distálně od Treitzova ligamenta. Dumping se nevyskytnul u žádného pacienta 1 rok po operaci. Nejvyšší frekvence postprandiální plnosti byla u skupiny 3 a pak následovala skupina 1. Rouxova skupina měla nejvyšší incidenci biliárního refluxu. Pacienti ve skupině 2 měli nejvyšší hmotnost. Příjem jídla a hladiny serových proteinů byl u této skupiny signifikantně vyšší než u dalších pacientů. U skupiny 1 byla evakuace rychlá a chyběla rezervoárová funkce. U skupiny 3 i přes zachování fyziologické pasáže duodenem, byl zpožděn tranzit pouchem a hodně pacientů mělo pocit epigastrické plnosti nebo nevolnosti. Dobrá evakuace byla u skupiny 2. Pouze 30 % pacientů s Rouxovou rekonstrukcí mělo dietní příjem vyšší než 80 % předoperačního stavu 1 a 2 roky po operaci. U HL skupiny byla frekvence postprandiálních symptomů velmi nízká a příjem potravy stoupal ihned po operaci. Toto bylo ověřeno i u dalších. Výsledkem bylo, že HL pouch a Rouxova rekonstrukce jsou více užitečné v redukci postprandiálních symptomů a ve zlepšení kvality života.
Fuchs a kol. provedl randomizovanou studii, kde srovnal interponovaný pouch s HLR pouchem s 53 pacienty v každé skupině [48]. Nebyly rozdíly v incidenci komplikací, v morbiditě a mortalitě. Tři roky po operaci nedošlo k rekurenci u 46 pacientů. Ke sledování pacientů bylo použito Visickovo skóre a Spitzer index. Nebyl rozdíl mezi oběmi skupinami pokud jde o hmotnost nebo kvalitu života v průběhu 3 let. Autoři uzavřeli, že pacienti s karcinomem žaludku nemají benefit z jejunální interpozice a doporučili méně náročnou rekonstrukci HLR.
Mendes de Almeida a kol. provedl 64 totálních gastrektomií [49]. Do studie byli zahrnuti pouze pacienti s R0 resekcí. Byly sledovány výsledky u rekonstrukce s omega kličkou (2 pacienti), u rekonstrukce podle Rouxe (20 pacientů) a u rekonstrukce s izoperistaltickou ezofagoduodenojejunální kličkovou interpozicí (5 pacientů). Pro všechny typy rekonstrukcí byla použita 60–70 cm dlouhá jejunální klička. Oba pacienti s omega kličkou měli těžké digestivní symptomy a ezofagitidu. Medián vzestupu tělesné hmotnosti a glukózové tolerance nebyl rozdílný u Rouxovy rekonstrukce a interpozice kličkou. Nebyly shledány zásadní rozdíly. Autoři uzavírají, že Rouxova rekonstrukce je vhodnější než interponovaná klička, i když je tato anatomicky bližší fyziologickému stavu. Tato studie však má málo pacientů a nerovná čísla.
Heimbucher studoval motilitu u HL pouche a interpozice kličkou [50]. U 21 pacientů byl vytvořen HL pouch a u 12 pacientů interpozice jejunální kličkou. Čtyři pacienti z HL skupiny a 1 pacient s interpozicí byli symptomatičtí při hodnocení pomoci Visickova skóre (III-V). Motilita byla měřena systémem perfuze vody. Motilita byla kratší ve srovnání se zdravými dobrovolníky, ale velmi podobná skupinám ve studii. Autoři uzavřeli, že rekonstrukce HL pouchem nemá vliv na motilitu.
Důsledky alkalického refluxu
Substituce žaludku, kde je provedena ezofagojejuno-plikace má dvě potenciální výhody. Na jedné straně redukuje incidenci biliárního refluxu a zároveň chrání ezofagojejunoanastomózu. Ukazuje se, že jejunoplikace má význam jen tehdy, když je přítomen neporušený dolní jícnový svěrač.
Žaludeční kyseliny a motilita tenkého střeva jsou faktory, které regulují intestinální flóru. Přítomnost bakteriální kolonizace tenkého střeva je pak po Rouxově rekonstrukce nevyhnutelná. Nebyla provedena studie, která by srovnávala kolonizaci mikroorganismy po různých typech žaludečních substitutů. Hypoteticky adekvátní antirefluxní bariéra zabraňuje kolonizaci distálního jícnu. Scintigrafické studie ukazují, že pouch zajišťuje dobrou bariéru proti alkalickému refluxu do distálního jícnu. Přídatné jejunální plikace po ezofagojejunoanastomóze zlepšují kvalitu života pacienta ve srovnání s Rouxovou rekonstrukcí.
Touto problematikou se mimo jiné zabývá Roder. Sledoval soubor 178 pacientů po totální gastrektomií, který byl rozdělen do dvou skupin. Jedna skupina pacientů s ezofagojejunoplikací s pouchem, další skupina pacientů se samotnou ezofagojejunostomií [51]. Kvalita života byla hodnocena standardizovaným dotazníkem kvality života. Pacienti s rekonstrukcí s pouchem dosáhli lepších výsledků. Lepší kvalita života u skupiny pacientů s pouchem byla spojena s lepší pooperační nutricí a vyšší hmotností. Gastrická evakuace u 18 pacientů z každé skupiny ukázala, že tranzitní čas pouchem je lineárně se snižující funkcí a je signifikantně nižší než po rekonstrukci s ezofagojejunoanastomózou, kde je vyprazdňování exponenciální.
Pouch a antirefluxní procedury
Ikeda a kol. použili rekonstrukci kombinující rezervoár z tenkého střeva s antirefluxním výkonem [52]. Jejunální pouch byl vytvořen použitím double stapling techniky a byl vytvořen z 20 až 30 cm dlouhého jejunálního segmentu. Proximální konec pouche byl napojen k jícnu side-to-end technikou s vytvořením neoHisova úhlu. Celkem podstoupilo tuto operaci 18 pacientů a byli sledováni 2 roky. BMI 1 a 2 roky po operaci byl 97,2 % a 98,3 % předoperační hmotnosti. Vyprazdňování žaludku bylo 67,8 ±4,5 minuty u pacientů s pouchem. Toto bylo rovněž prokázáno při pozorování pasáže s použitím baria.
Morii studoval 42 pacientů, který podstoupili B I výkon nebo rekonstrukci s 10cm jejunálním segmentem interponovaného izoperistalticky mezi zbytek žaludku a duodenum [53]. Hodnotil, že jejunální interpozice způsobuje antirefluxní bariéru a efektivně snižuje postgastrektomické syndromy.
SOUHRN
Rouxova rekonstrukce je stále nejčastěji používaným typem rekonstrukce v Evropě, USA a Japonsku. Heberer ukázal, že pouze 16 % z 62 evropských klinik provádí rekonstrukci pouchem po totální gastrektomii. Za posledních 100 let bylo popsáno mnoho typů rekonstrukcí. Velmi málo studií porovnává různé rekonstrukce formou prospektivní randomizované studie. Mnoho pacientů není možno hodnotit pro rekurenci onemocnění a vzdálené metastázy, které mohou způsobit ztrátu hmotnosti nebo jiné symptomy. Otázkou je rovněž velikost pouche. Často je zmiňován trend k lepší kvalitě života u pouche se zachováním pasáže duodenem. Při tomto způsobu rekonstrukce je rovněž výhoda možnost endoskopického vyšetření duodena při zachování pasáže. Z hlediska anatomického a fyziologického představuje zachování pasáže duodenem normální stav. V případě, že pouch umožní proporcionální vyprazdňování potravy, zachování pasáže duodenem je výhodné.
Pacient s pouchem, ať už s nebo bez zachování pasáže duodenem, nebude mít dříve signifikantní benefit z této rekonstrukce než po 6 měsících. Tento výkon by měl být proveden u pacientů s očekávaným přežitím delším než 1 rok. Rouxova rekonstrukce by měla být provedena tehdy, pokud se nejedná o kurativní výkon. Každopádně pouch v kombinaci s antirefluxním výkonem má potenciál zlepšit z dlouhodobější perspektivy kvalitu života po gastrektomii.
MUDr. T. Malý, Ph.D.
Šmeralova 6
701 00 Ostrava
e-mail: tomas.maly@post.cz
Zdroje
1. Connor, P. S. Report of a case of complete resection of the stomach. Med. News, 45 : 1884, 578.
2. Schlatter, C. Über Ernahrung und Verdauung nach vollstandiger Entfernung des Magens und Oesophagoenterostomie beim Menschen. Beitrag zur klinischen Chirurgie, 19, 1897, 757.
3. Roux, C. De la gastro-enterostomie. Etude basee sur les operations pratiques du 21 juin 1888 au 1 er Septembre 1896. Rev. Gynecol. Chir. Abdominale, 1 : 1897, 67–122.
4. Hoffman, V. Eine Metode des plastischen Magenersatzes. Zentralbl. Chir., 49 : 1922, 1477.
5. Horsley, J. S. Operative surgery, vol. 2. Mosby, St Louis, 1940, 1032.
6. Graham, R. R. Technique for total gastrectomy. Surgery, 8 : 1940, 257–264
7. Hunt, C. J. Construction of a food pouch from segment of jejunum as substitute for stomach in total gastrectomy (abstract). Arch. Surg., 64 : 1952, 601.
8. Lawrence, W. Reservoir reconstruction after total gastrectomy: an instructive case. Ann. Surg., 155 : 1962, 191.
9. Largiader, F., Sauberli, H. Reconstruction nach Gastrektomie, insbesondere mit Jejunumersatzmagen. Helv. Chir. Acta, 39, 1972, 883–886.
10. Mandl, F. Operative Versuche zur Behandlung der Sturzentleerung nach totaler Magenresektion. Chirurg, 26 : 1955, 403–404.
11. Nakayama, K. New reconstructive Metod after excision of lower esophagus and cardial portion of stomach with anastomoses combined with antrectomy. Surgery, 54, 1963, 281.
12. Paulino, F., Roselli, A. Carcinoma of the stokách. Curr. Probl. Surg., 1973.
13. Nadrowski L. Is a distal jejunojejunal pouch nutritionally ideal in total gastrectomy? Am. J. Surg., 2003, Apr, 185(4): 349–353.
14. Doherty, C. Restoration of the alimentary tract using autosuture staples. Am. J. Surg., 131 : 1976, 629–633.
15. Lygidakis, N. J. 1981, Total gastrectomy for gastric carcinoma Koussidis, A., Apsokardou-Koussidou, M., 1990, Fragment of alkaline gastritis and recurrent ulcer following Roux-en-Y gastrectomy and construction of a Rumph‘s antireflux valve. Zentralbl. Chir., 115, 95-102
16. Seo, S. Stomach resection transplanting jejunum. J. Jpn. Clin. Surg. Soc., 42 : 1941, 1004.
17. Hays, R. P. Anatomic and physiologic reconstruction following total gastrectomy by the use of the jejunal pouch. Surg. forum Clin. Congr. Amer. Coll. Surg., WB Sauders Co, Philadephia: 1953, 291.
18. Gutgeman, A., Schreiber, H. W. Erfahrungen mit der totalen Gastrektomie. Langenbecks Arch. Klin. Chir., 303, 1963, 73.
19. Poth, E. J., Smith, L. B. Gastric pouch, their evaluation. Am. J. Surg., 112 : 1966, 721–727.
20. Kieninger, G., Koslowski, I., Durst, J., et al. Clinical experience with a new method of gastric replacement following total gastrectomy. World J. Surg., 3, 1979, 737–743.
21. Morii, Y., Arita, T., Shimoda, K. a kol. Jejunal interposition to prezent postgastrectomy syndromes. Br. J. Surg., 87, 2000, 1576–1579.
22. Cushieri, A. Long-term evaluation of a reservoir jejunal interposition with an isoperistaltic konduit in the management of patients with the small stomach syndrome. Br. J. Surg., 11 : 1982, 127–139.
23. Nakane, Q., Okumura, S., Akehira, K., et al. Jejunal pouch reconstruction after total gastrectomy for cancer. A randomized controlled trial. Ann. Surg., 222 : 1995, 27–35.
24. Schwarz, A., Beger, H. G. Veranderungen im gastrointestinalen Hormonhaushalt nach Gastrektomie: Was ist klinisch relevant? Chir. Gastroenterol., 16 (Suppl 2), 2000, 25–30.
25. State, D., Barclay, T., Kelly, W. D. Total gastrectomy with utilization of a segment of transverse colon to replace the excised stomach. Ann. Surg., 134 : 1951, 1035.
26. Hunnicutt, A. J. Replacing stomach after total gastrectomy with right ileocolon. Arch. Surg., 65 : 1952, 1–11.
27. Lee, M. C. Transposition of a colon segment as a gastric reservoir after total gastrectomy as a gastric reservoir after total gastrectomy. Surg. Gyn. Obst., 92 : 1951, 456–465.
28. Lygidakis, N. J. Long-term results of a new method of reconstruction for continuity of the alimentary tract after total gastrectomy. Surg. Gyn. Obstetr, 158 : 1984, 335–338
29. Largiader, F., Sauberli, H. Rekonstrucktion nach Gastrektomie, insbesondere mit Jejunumersatzmagen. Helv. Chir. Acta, 39, 1972, 883–886.
30. Troidl, H., Kusche, J., Vestweber, K. H., et al. Pouch versus esophagojejunostomy after total gastrectomy: A randomized clinical trial. World J. Surg., 11 : 1987, 699–712
31. Berglund, B., Liedman, B., Olbe, L., a kol. Reservoir function after subtotal or total gastrectomy with or without gastric substitute. Eur. J. Surg., 157 : 1991, 201–204.
32. Iivonen, M., Matikainen, M., Nordback, I. Jejunal pouch reconstruction diminishes postoperative symptoms after total gastrectomy. Dig. Surg., 14 : 1997, 260–266.
33. Tanaka, T., Kusonoki, M., Fujiwara, Y, Nakagawa, K., Utsunomiya, J. Jejunal pouch length influences metabolism after total gastrectomy. Hepatogastroenterology, 44 : 1997, 891–896.
34. Hoksch, B., Zippel, K., Sandrock, D., et al. Does the pouch jodid food transit after gastrectomy? Langenbecks Arch. Chir. Suppl. Kongressbd., 115 : 1998, 1377–1379.
35. Schwarz, A., Beger, H. G. Veranderungen im gastrointestinalen Hormonhaushalt nach Gastrektomie: Was ist klinisch relevant? Chir. Gastroenterol., 16 (Suppl 2), 2000, 25–30.
36. Fujiwara, Q., Kusunoki, M., Nakagawa, K., et al. Evaluation of J-pouch reconstruction after total gastrectomy: rho-double tract vs. J-pouch double tract. Dig. Surg., 17 : 2000, 475–482.
37. Schuhmacher, C., Bottcher, K. A., Siewert, J. R. Instestinale Pouches: Magenersatz. Chirurg, 70 : 1999, 520–529.
38. Tanaka, T., Kusonoki, M., Fujiwara, Y, Nakagawa, K., Utsunomiya, J. Jejunal pouch length influences metabolism after total gastrectomy. Hepatogastroenterology, 44 : 1997, 891–896.
39. Zonca, P., Maly, T., Herokova, J., Kvetensky, M., Halva, Z. Reconstruction after total gastrectomy. Bratisl. Lek. Listy, 2002 : 103(11): 414–417
40. Bozzetti, F., Bonfanti, G., Castellani, R., et al. Comparing reconstruction with Roux-en-Y to a pouch following total gastrectomy. J. Am. Coll. Surg., 183 : 1996, 243–248.
41. Liedman, B., Bosaeus, I., Hugossson, I., et al. Long-term beneficia effects of a gastric reservoir on weight control after total gastrectomy. A study of potential mechanisms. Br. J. Surg., 85 : 1998, 542–547.
42. Zelnick, R., Auguste, L. J., Wise, L. Nutritional effects of postgastrectomy reconstruction: a clinical evaluation. J. Surg. Oncol., 40, 1989, 20–21.
43. Cushieri, A. Jejunal pouch reconstruction after total gastrectomy for cancer: experience in 29 patients. Br. J. Surg., 77 : 1990, 421–424.
44. Miholic, J., Meyer, H. J., Balks, J., et al. Effect of reconstruction method on nutritional status after gastrectomy. Comparison of Roux-Y esophagojejunostomy and jejunum interposition. Chirurg, 62 : 1991, 300–305.
45. Schwarz, A., Beger H. B. Gastric substitute after total gastrectomy clinical relevance for reconstruction techniques. Langenbecks Arch. Surg., 383 : 1998, 484–491.
46. Aujeský, R., Neoral, Č., Koranda, P. Restoration of the Passage after Total Gastrectomy. Rozhl. Chir., 77, 1998, č. 1, s. 42–44.
47. Nakane, Q., Okumura, S., Akehira, K., et al. Jejunal pouch reconstruction after total gastrectomy for cancer. A randomized controlled trial. Ann. Surg., 222 : 1995, 27–35.
48. Fuchs, K. H., Thiede, A., Engemann, R., et al. Reconstruction of the food passage after total gastrectomy: randomized trial. World J. Surg., 19 : 1995, 698–705.
49. De Almeida, A. C., dos Santos, N. M., Aldeia, F. J. Total gastrectomy for cancer: is reconstruction or a gastric replacement reservoir essentials? World J. Surg., 18 : 1994, 883–888.
50. Heimbucher, J., Fuchs, K. H., Freys, S. M. et al. Motility in the Hunt-Lawrence pouch after total gastrectomy. Am. J. Surg., 168 : 1994, 622–626.
51. Roder, J. D., Herschbach, P., Henrich, G., et al. The quality of life after total gastrectomy for stomach carcinoma. Esophagojejunal plication with pouch versus esophagojejunostomy without pouch. Dtsch. Med. Wochenschr., 117 : 1992, 241–247.
52. Ikeda, M., Ueda, T., Shiba, T. Reconstruction after total gastrectomy by the interposition of a double jejunal pouch using a double stapling technique. Br. J. Surg., 85 : 1998, 398–404.
53. Morii, Y., Arita, T., Shimoda, K., a kol. Jejunal interposition to present postgastrectomy syndromes. Br. J. Surg., 87, 2000, 1576–1579.
Štítky
Chirurgie všeobecná Ortopedie Urgentní medicína
Článek vyšel v časopiseRozhledy v chirurgii
Nejčtenější tento týden
2008 Číslo 7- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Stillova choroba: vzácné a závažné systémové onemocnění
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
-
Všechny články tohoto čísla
- Expertní činnost v chirurgii
- Zkušenosti s radiofrekvenční termoablací mozkových nádorů
- Ischemické poškození míchy následkem tupého poranění hrudníku – kazuistika
- Reexpanzný pľúcny edém, ako komplikácia drenáže hrudníka pri spontánnom pneumotoraxe – kazuistika
- Pacientka s fibrosarkomem srdce. Kazuistika
- Stenty – paliativní a kurativní ošetření jícnu. Sedmileté zkušenosti chirurgického pracoviště
- Pseudoaneurysma arteria hepatica manifestující se hemobilií jako komplikace laparoskopické cholecystektomie
- Ojedinělé případy liposarkomů retroperitonea obrovských rozměrů
- Rekonstrukce po gastrektomii
- Masivní hemotorax po kanylaci v. subclavia – kazuistika
- Ruptura šlachy m. pectoralis maior a anabolické steroidy v anamnéze – kazuistika
- Hybridní postupy v léčbě pseudoaneurysmat oblouku aorty – kazuistika
- Komentář k článku
- Zemřel doc. MUDr. Ladislav Krušina, CSc.
- Rozhledy v chirurgii
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Ruptura šlachy m. pectoralis maior a anabolické steroidy v anamnéze – kazuistika
- Ojedinělé případy liposarkomů retroperitonea obrovských rozměrů
- Reexpanzný pľúcny edém, ako komplikácia drenáže hrudníka pri spontánnom pneumotoraxe – kazuistika
- Stenty – paliativní a kurativní ošetření jícnu. Sedmileté zkušenosti chirurgického pracoviště
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



