-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Masivní hemotorax po kanylaci v. subclavia – kazuistika
Massive Hemothorax following Canylation of the Subcalvian Vein – a Case Review
Introduction:
Cannulation v. subclavia is connected with many complications. Haemothorax is occurs approximately in 2% of cases. Surgical revision is indicated immediately if a major blood loss or a circulation insufficiency occur. Surgical treatment of bleeding in cupola of pleural cavity is due to its bad accesability difficult and conventional surgical methods aren’t sufficient. In these cases one can use local haemostyptic.Case report:
The authors present a case review of a 36-years old patient with a developed massive haemothorax on the left side post a catheterization of v. subclavia. During surgical revision it was found out that a source of bleeding in superior thoracic aperture is present. It wasn’t able to be stopped by classical surgical procedure. TachoSil and Arista preparations were used in this case with a good effect.Key words:
Central Venous Cathetrization – Haemothorax – Local hemostyptic
Autoři: Michal Černý
; K. Havlíček; L. Sákra; J. Flašar
Působiště autorů: Chirurgická klinika Krajské nemocnice Pardubice, a. s., přednosta: doc. MUDr. K. Havlíček, CSc.
Vyšlo v časopise: Rozhl. Chir., 2008, roč. 87, č. 7, s. 376-379.
Kategorie: Monotematický speciál - Původní práce
Souhrn
Úvod:
Kanylace v. subclavia je spojena s celou řadou komplikací. Hemotorax se vyskytuje přibližně ve 2 % případů. Při větších krevních ztrátách nebo přítomné oběhové nedostatečnosti je indikována neodkladná chirurgická revize hrudní dutiny. Ošetření krácení v kupole pleurální dutiny je však pro svou nepřístupnost velmi náročné a často nevystačíme s konvenčními chirurgickými postupy. V těchto případech je možné použití lokálních hemostyptik.Kazuistika:
Autoři prezentují případ 36letého pacienta se vzniklým masivním levostranným hemotoraxem po katetrizaci v. subclavia. Při chirurgické revizi byl zjištěn zdroj krvácení v oblasti horní hrudní apertury, které se nedařilo zastavit klasickými chirurgickými postupy. V tomto případě bylo použito preparátu TachoSil a Arista s dobrým efektem.Klíčová slova:
centrální žilní katétr – hemotorax – lokální hemostyptikaÚVOD
V současné medicíně se přístupy do centrálních žilních kmenů a srdečních dutin považují za standardní. Indikace zavedení centrálního žilního katétru viz tabulka 1 [1]. Kanylace cestou v. subclavia je spojena s celou řadou mechanických komplikací a obecně znamená větší riziko než kanylace vnitřní jugulární žíly. Incidence mechanických komplikací při kanylaci v. subclavia se pohybuje v rozmezí 0–21 % a současně s mírou závažnosti těchto komplikací závisí na praktických zkušenostech lékaře a na obtížnosti zavádění katétru u daného pacienta. Lékaři, kteří provedli více jak 50 punkcí, mají o 50 % menší riziko vzniku komplikací než ti, kteří mají zkušeností méně [2]. Mezi nejčastější mechanické komplikace související se zaváděním nebo odstraňováním katétru do podklíčkové žíly patří, vedle malého krvácení a lokálního hematomu v místě vpichu, punkce a. subclavia (19 %), malpozice katétru (6,5 %) – nejčastěji do vena jugularis interna, pneumotorax (6 %), poškození plexus brachialis, vzduchová embolie a další [3]. Hemotorax se vyskytuje přibližně ve 2 % případů. Přehled časných a pozdních komplikací ukazuje tabulka 2 [4]. Riziko krvácení během zavádění centrálního žilního katétru významně zvyšuje koagulopatie. S opatrností výběru místa punkce a metody techniky mohou být krvácivé komplikace sníženy na minimum. Jelikož arteria subclavia a vena subclavia nejsou přístupné k přímé kompresi, subklaviální přístup je nejméně vhodný pro pacienty s rizikem krvácení [5, 6].
Tab. 1. Indikace CŽK Tab. 1. Indications of CVC 
Tab. 2. Komplikace katetrizace v. subclavia Tab. 2. Complications of catheterization v. subclavia 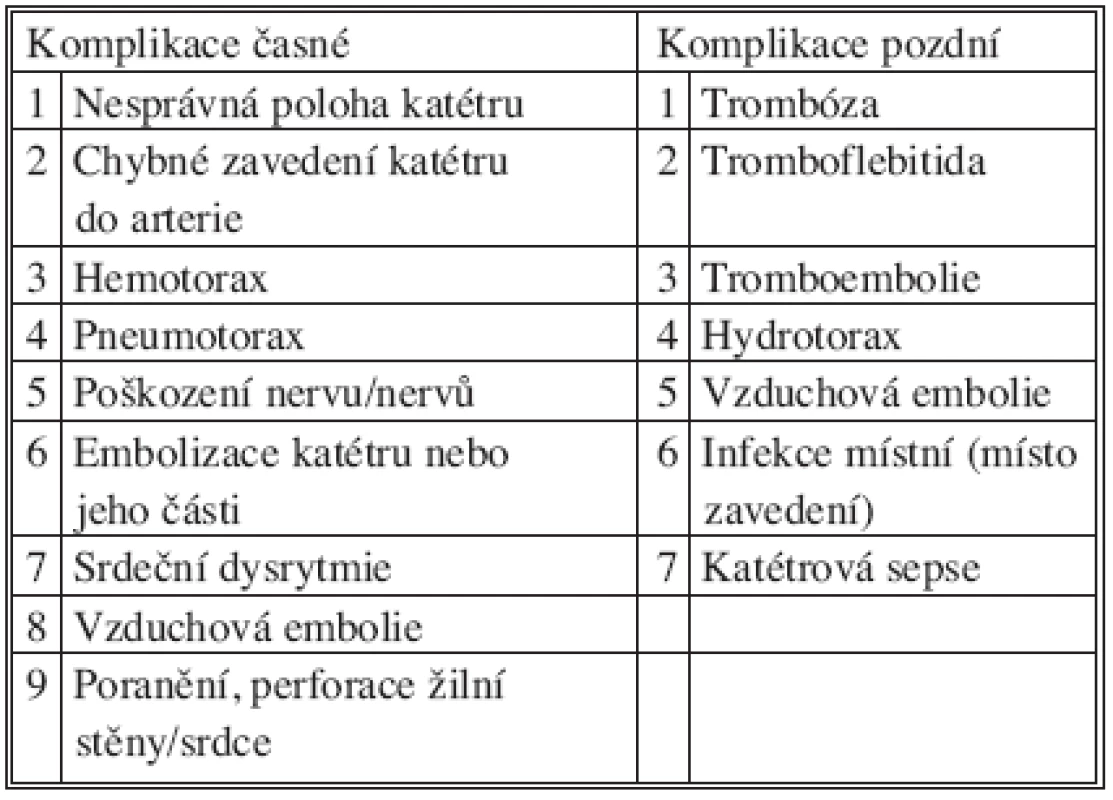
Vzniklý hemotorax lze podle objemu krve rozdělit na malý (při množství menším než 350 ml), střední a velký (při objemu nad 1000–1500 ml). Při posuzování o léčbě nerozhoduje jen velikost hemotoraxu, ale rovněž rychlost jeho vzniku. U menších krvácení obvykle vystačíme s jednorázovou punkcí a odsátím. Větší krvácení je však třeba zajistit hrudním drénem. Jestliže pleurální dutina absorbuje více než polovinu objemu cirkulující krve, hrozí smrtelná hypovolemie s ireverzibilním stadiem hemo - ragického šoku. Indikací k torakotomické revizi dutiny hrudní pro krvácení je iniciální krevní ztráta přesahující 1000–1500 ml a dále narůstající či setrvávající krvácení do drénu více než 200 ml/h nebo známky oběhové nedostatečnosti [7, 8]. Menší krvácení je možné ozřejmit a případně ošetřit rovněž videotorakoskopicky [9].
Prezentujeme případ rozsáhlého hemotoraxu u 36letého muže, přeloženého na chirurgickou kliniku z kardiologie Pardubické krajské nemocnice pro akutní levostranný hemotorax.
Pacient se léčil od roku 2003 s arteriální hypertenzí, pro flutter síní byla zahájena terapie nízkomolekulárním heparinem. Na kardiologické oddělení byl přijat k elektro-fyziologickému vyšetření a radiofrekvenční ablaci ložiska myokardu pro perzistující symptomatický flutter síní. Během výkonu byla kanylována vena subclavia l. sin. a vena femoralis l. dx. Ve večerních hodinách téhož dne si začal pacient stěžovat na bolesti na hrudi. Následně provedený rentgenový snímek hrudníku byl v té době bez známek pneumotoraxu či jiné patologie. Druhý den ráno pro progredující bolesti na hrudi a zhoršené dýchání byl proveden kontrolní rentgenový snímek hrudníku, na kterém bylo zachyceno nehomogenní zastření levého dolního plicního pole, chovající se expanzivně a přetlačující srdeční stín doprava (Obr. 1.). Pro podezření na levostranný hemotorax bylo indikováno provedení akutního CT hrudníku a překlad na JIP Chirurgické kliniky Pardubice.
Obr. 1. RTG hrudníku při přijetí Fig. 1. X-ray of chest on admission 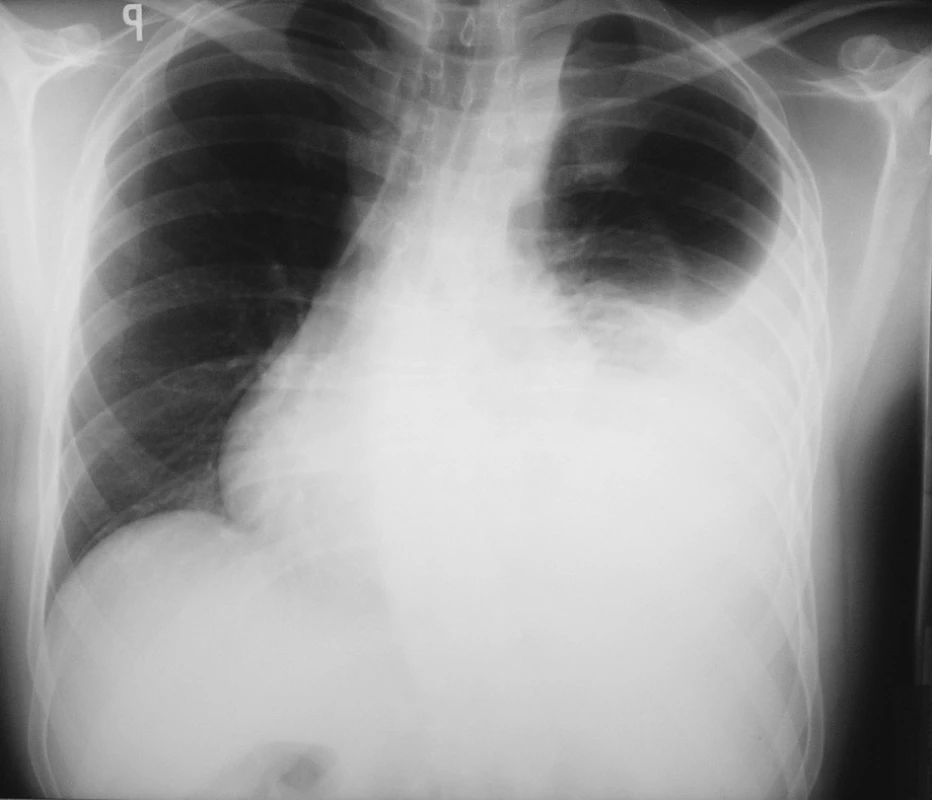
Při přijetí na chirurgickou JIP byl pacient plně při vědomí, bledý, spontánně ventilující, bez nápadnější klidové dušnosti. Auskultačně bylo dýchání oslabené až neslyšitelné nad celým levým hemitoraxem. TK 130/80, P 110–130/min. V krevním obraze erytrocyty 3,68 1012/l, Hb 116 g/l, Ht 0,33. Akce srdeční nepravidelná. Saturace H2O měřena pulzním oxymetrem 98%. Ostatní somatický nález byl v mezích normy. Subjektivně přetrvával pocit zhoršeného dýchání. Provedené spirální nativní CT hrudníku (Obr. 3, 4) prokázalo přítomný masivní hemotorax vlevo (denzita tekutiny kolem 42 HU – krev), krev vyplňovala většinu levého hemitoraxu a utlačovala levou plíci. Zbytková vzdušná část levé plíce zobrazena ventromediálně, mediastinální struktury byly přesunuty doprava. Nebyl zaznamenán pneumotorax ani známky hemoperikardu. Vpravo bez přítomného fluidotoraxu.
Obr. 2. CT hrudníku, levostranný hemotorax Fig. 3. CT of chest, haemothorax on the left side 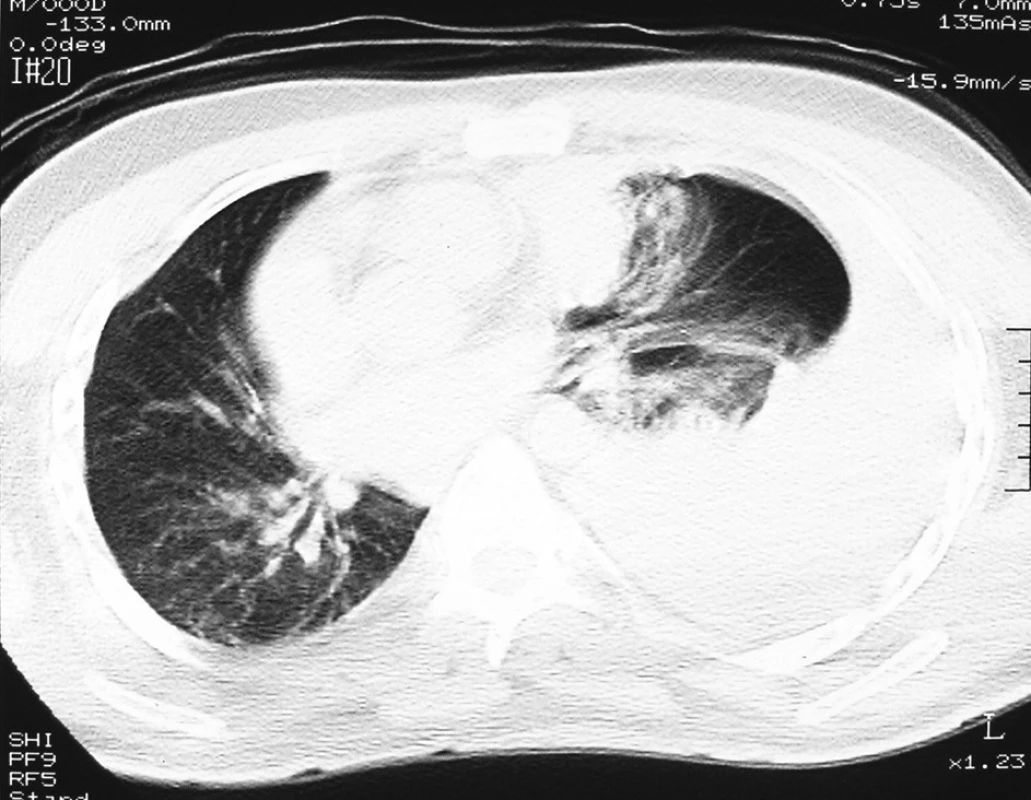
Obr. 3. CT hrudníku, levostranný hemotorax Fig. 4. CT of chest, haemothorax on the left side 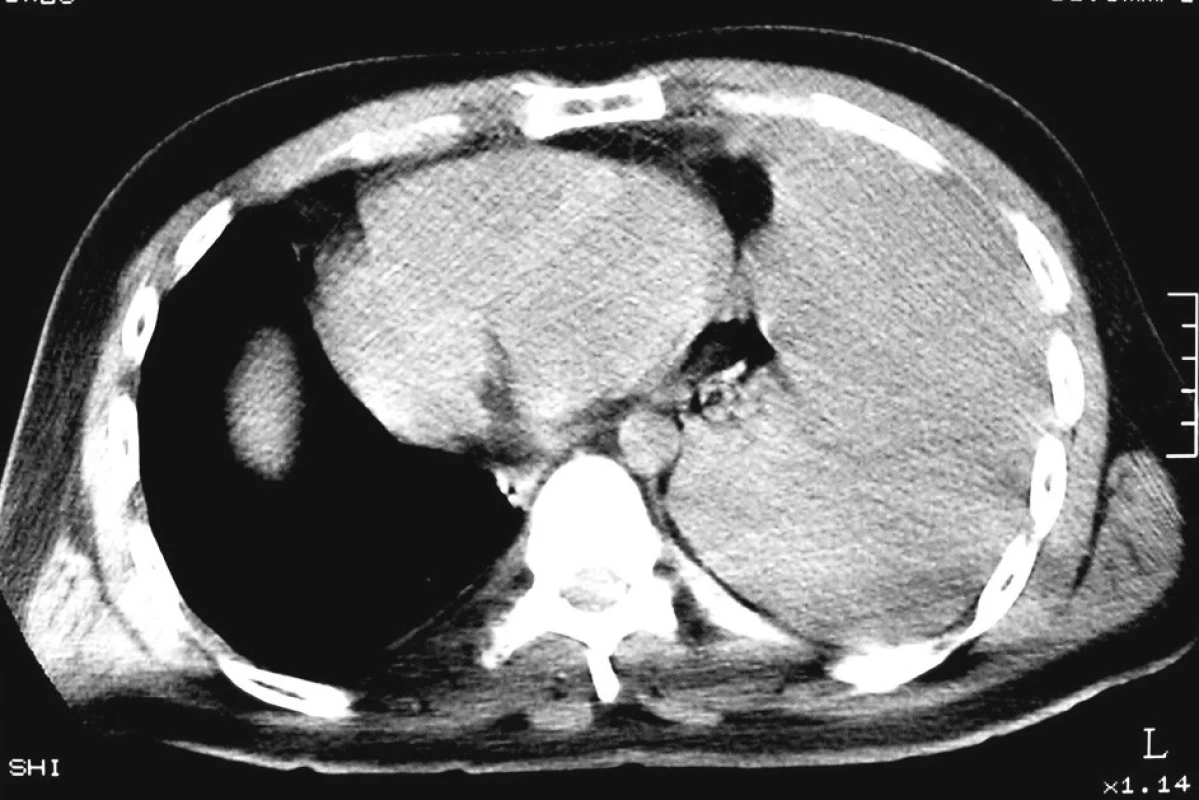
Již v průběhu prvé hodiny po překladu na JIP došlo k výraznému poklesu hematologických hodnot a klinickým známkám oběhové nestability. Od plánované hrudní drenáže bylo opuštěno a byla indikována neodkladná operační revize levého hemitoraxu.
V celkové anestezii v poloze na pravém boku byla otevřena levá pleurální dutina posterolaterální torakotomií v 5. mezižebří. Z levého hemitoraxu bylo jednorázově odsáto 4000 ml tekuté krve a krevních koagul. Revizí pleurální dutiny zjištěno v místě vena brachiocephalica sinistra a vena subclavia sinistra prokrvácení tkáně. Malým otvorem v pleuře vytékala jasně červená krev. Po protětí parietální pleury v kupole pleurální dutiny a po izolaci magistrálních žil a tepny v oblasti horní hrudní apertury krvácení téměř ustalo. V pleurální dutině, již kromě výše popsaného malého krvácejícího otvoru, nebyl prokázán další zdroj krvácení. Celá vypreparovaná oblast pod levým klíčkem byla vyplněna hemostatickou pěnou TachoSil, defekt vytvořený protnutím pleury byl zasypán tkáňovým lepidlem preparát Arista. Po ošetření byla hemostáza v této krajině dostatečná. Do levé pleurální dutiny byl zaveden hrudní drén.
Celková doba operace byla 1,75 hodiny. Během výkonu bylo podáno 1000 ml krystaloidů, 1000 ml koloidů, 4 jednotky erytrocytové masy a 4 jednotky plazmy. V průběhu operace byl pacient tlakově i oběhově kompenzován bez nutnosti podpory katecholaminy.
Po operaci byl pacient dále ošetřován na JIP, tlakově i oběhově stabilní, spontánně ventilující. Dýchání bylo oboustranně slyšitelné, vlevo s vedlejšími fenomény. Hrudní drén odvedl během prvních 8 hodin po operaci 300 ml hemoragické tekutiny, za dalších 9 hodin 350 ml tekutiny stejné kvality. Po 53 hodinách byl drén extrahován, celkem odvedl 1350 ml. Na kontrolním rentgenovém snímku hrudníku po odstranění drénu byla zobrazena rozvinutá levá plíce s nevýznamným reziduálním fluidotoraxem v levém kostofrenickém úhlu (Obr. 2). Kontrolní krevní obraz ukazoval výrazný hraniční pokles ještě 3. pooperační den (erytrocyty 2,52x1012/l, Hb 80 g/l, Ht 0,22), krevní preparáty však již po výkonu nepodávány. Během hospitalizace bylo pokračováno v subkutánním podávání LWMH v profylaktické dávce jedenkrát denně, dále podávána analgetika, mukolytika a byla prováděna dechová rehabilitace. Pacient byl 3. pooperační den v celkově uspokojivém stavu, kardiopulmonálně kompenzovaný přeložen zpět na kardiologické oddělení.
Obr. 4. RTG hrudníku po chirurgické léčbě Fig. 2. X-ray of chest after surgical treatment 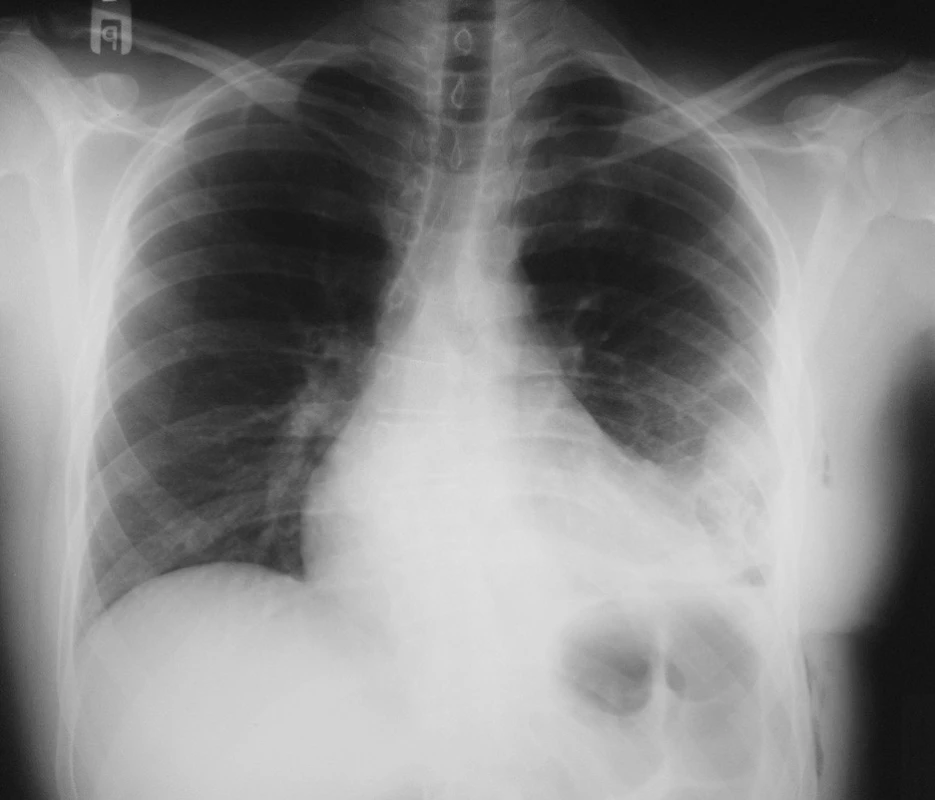
DISKUSE
Při poranění v. subclavia lze k ošetření krvácení použít supraklavikulární krční přístup nebo přístup transklavikulární s protnutím nebo luxací klíční kosti. Další možností je ošetření krvácení z torakotomie, které lze s výhodou využít k zajištěním přítomného hemotoraxu. Případně lze ošetřit místo vpichu ze sternotomie. Předpokladem úspěšného stavění krvácení je vypreparování všech magistrálních cév a ozřejmení jejich vzájemných anatomických vztahů. Pokud nelze k hemostáze použít některou z konvenčních chirurgických metod, kterými jsou ligace či elektrokoagulace, je možné spolehlivě použít některý z preparátů ze skupiny lokálních hemostyptik. Tyto látky zasahují na různých úrovních do procesu krevního srážení a napomáhají tvorbě krevního koagula [10]. Jsou vyrobeny ze syntetického či přírodního základu, kterým může být kolagen (TachoSil, Tissucol Kit), želatinová houba (Spongostan) nebo oxidovaná regenerovaná celulóza (Surgicel, Traumacel) [11, 12, 13].
Základem preparátu TachoSil firmy Nycomed je kolagenová pěna odvozená od koňského kolagenu, na jejímž povrchu je vrstva lidského fibrinogenu a trombinu. Po kontaktu s krví nebo jinými tělesnými tekutinami dochází k aktivaci těchto koagulačních faktorů a vzniká tak fibrinová sraženina, která pevně spojuje základní matrix s okolními tkáněmi již během několika minut. Tento výrobek je organismem dobře tolerován a je zcela vstřebatelný do 12 týdnů od operace [14, 15].
Dalším použitým preparátem byl výrobek Arista firmy Medafor. Ten se aplikuje v práškové formě. Je vyroben z přírodního polysacharidu, který je extrahován z bramborového škrobu. Hemostaticky působí jako molekulární filtr, který absorbuje sérum a tím zvětší svůj objem až na patnáctinásobek svého suchého objemu. Koncentrované krevní elementy formují gelovou matrix, která zpomalí proudění krve v této oblasti a tím přispěje ke zvýšení srážlivosti bez ohledu na pacientův stav hemokoagulace. Je vstřebatelný a jelikož absorbce nastupuje okamžitě a je ukončena během 24–48 hodin, nezvyšuje riziko infekce. Pro nebezpečí fatální trombózy nesmí být však aplikován přímo do cév a nesmí být používán při masivním krvácení [16].
Aplikace lokálních hemostatik snižuje potřebu podání transfuzních přípravků jak peroperačně tak i po operaci a přispívají ke snížení výskytu postoperačních krvácivých komplikací. Používání lokálních hemostyptik se rozšířilo do všech chirurgických oborů, zejména při řešení difuzních parenchymových krvácení nebo při menším krvácení v hůře přístupných oblastech. V hrudní chirurgii je dále časté užití těchto látek při poranění viscerální nebo parietální pleury. Byl prokázán vliv těchto preparátů ke snížení vzniku pleurálních adhezí [11, 17, 18].
ZÁVĚR
Hemotorax nepatří mezi nejčastější komplikace při kanylaci v. subclavia, jeho výskyt není však zcela vzácný a je zapotřebí na tuto komplikaci při klinických známkách oběhové nestability či respirační nedostatečnosti včas pomýšlet. Ošetření spočívá v neodkladné chirurgické revizi pleurální dutiny. U menšího hemotoraxu videotorakoskopicky, u velkého spíše torakotomií. Ošetření v kupole pohrudniční dutiny je vždy velmi obtížné a vypreparování všech struktur v této krajině umožní zvolit racionální a bezpečný postup léčby.
MUDr. M. Černý
Kyjevská 44
532 03 Pardubice
e-mail: cernymilos@nem.pce.cz
Zdroje
1. Drábková, J. Centrální žilní katétry – funkce, základy zavádění a ošetřování. MSM, 2004.
2. Taylor, R. W., Palagiri, A. V. Central Venous Catheterization: Concise Definitive. Review Posted 05/16/2007.
3. Larsen R. Anestezie. Grada, 2004, str. 672–675.
4. Ševčík, P., Černý, V. Vítovec, J. Intenzivní medicína. Praha, Galén-Karolinum, 2000. Kap. 3., odst. 3.3.3 Přístupy do centrálního žilního řečiště, s. 14–15.
5. Nakamura, V., Allaouchiche, B., Mahon, L., Lansiaux, S., Chasard, D. Pulmonary hematoma: unusual complication of central catheterization. Ann. Fr. Anesth. Reanim., 2000, Nov;19(9): 678–681.
6. Ueki, R., Okutani, R., Fukushima, A., Kurehara, H., Sasaki, K., Tashiro, C. Iatrogenic extrapleural hematoma. Masui, 2000, Jan; 49(1): 37–39.
7. Šiller, J., Havlíček, K., Motyčka, V. Tupá poranění hrudníku, patofyziologické aspekty a léčba. IV. slovenský chirurgický kongres s medzinárodnou účasťou a XXXV. spoločný kongres slovenských a českých chirurgov, 6.–8. 9. 2006, Nitra. Zborník abstraktov, s. 56.
8. Motyčka, V., Šiller, J., Havlíček, K. Urgentní chirurgická intervence u úrazů hrudníku. VIII. ostravské traumatologické dny, říjen 2006, sborník abstrakt, s. 29–30.
9. Šiller, J., Havlíček, K., Motyčka, V. Naše zkušenosti s videotorakoskopií. 4. mezinárodní konference CMCIE Miniinvaz. Terap., 2000; 5 : 43.
10. Kondler, R., Fuchs, T. Clinical application of a human-collagen fleece as haemostatic agent. Arzneimittelforschung, 1989, Mar; 39(3): 401–403.
11. Haas, S. The use of a surgical patch coated with human coagulation factors in surgical routine: a multicenter postauthorization surveillance. Clin. Appl. Thromb. Hemost., 2006; 12(4): 445–450.
12. Havlíček, K., Tecl, F., Šiller, J. Fibrin sealant in pulmonary and thoracic surgary. Scr. Med., 1994; 67 : 15–19.
13. Nordentoft, T., Romer, J., Sorensen, M. Sealing of gastrointestinal anastomoses with a fibrin glue-coated collagen patch:a safety study. J. Invest. Surg., 2007 Nov-Dec; 20(6): 363–369.
14. Meisner, H., Struck, E., Schmidt-Habelmann, P., Sebening, F. Fibrin seal application. Clinical experience. Thorac. Cardiovasc. Surg., 1982, Aug; 30(4): 232–233.
15. Silverstein, M. E., Chvapil, M. Experimental and clinical experiences with collagen fleece as a hemostatic agent. J. Trauma, 1981, May; 21(5): 388–393.
16. Medscape Medical News FDA Approvals: Aptima, Harmony Bionic Ear, Arista AH.
17. Izbicki, J. R., Kreusser, T., Trupka, A., et al. Fibrin-coated collagen fleece in thoracic surgery. Initial clinical experience. Chirurg, 1991, Jun; 62(6): 479–481.
18. Getman V., Devyatko E., Wolner E., et al. Fleece bound sealing prevents pleural adhesions. Interact. CardioVasc. Thorac. Surg., 2006; 5 : 243–246.
Štítky
Chirurgie všeobecná Ortopedie Urgentní medicína
Článek Expertní činnost v chirurgiiČlánek Reexpanzný pľúcny edém, ako komplikácia drenáže hrudníka pri spontánnom pneumotoraxe – kazuistikaČlánek Stenty – paliativní a kurativní ošetření jícnu. Sedmileté zkušenosti chirurgického pracovištěČlánek Rekonstrukce po gastrektomiiČlánek Komentář k článku
Článek vyšel v časopiseRozhledy v chirurgii
Nejčtenější tento týden
2008 Číslo 7- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Jak souvisí postcovidový syndrom s poškozením mozku?
- Hojení análních fisur urychlí čípky a gel
-
Všechny články tohoto čísla
- Expertní činnost v chirurgii
- Zkušenosti s radiofrekvenční termoablací mozkových nádorů
- Ischemické poškození míchy následkem tupého poranění hrudníku – kazuistika
- Reexpanzný pľúcny edém, ako komplikácia drenáže hrudníka pri spontánnom pneumotoraxe – kazuistika
- Pacientka s fibrosarkomem srdce. Kazuistika
- Stenty – paliativní a kurativní ošetření jícnu. Sedmileté zkušenosti chirurgického pracoviště
- Pseudoaneurysma arteria hepatica manifestující se hemobilií jako komplikace laparoskopické cholecystektomie
- Ojedinělé případy liposarkomů retroperitonea obrovských rozměrů
- Rekonstrukce po gastrektomii
- Masivní hemotorax po kanylaci v. subclavia – kazuistika
- Ruptura šlachy m. pectoralis maior a anabolické steroidy v anamnéze – kazuistika
- Hybridní postupy v léčbě pseudoaneurysmat oblouku aorty – kazuistika
- Komentář k článku
- Zemřel doc. MUDr. Ladislav Krušina, CSc.
- Rozhledy v chirurgii
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Ruptura šlachy m. pectoralis maior a anabolické steroidy v anamnéze – kazuistika
- Ojedinělé případy liposarkomů retroperitonea obrovských rozměrů
- Reexpanzný pľúcny edém, ako komplikácia drenáže hrudníka pri spontánnom pneumotoraxe – kazuistika
- Stenty – paliativní a kurativní ošetření jícnu. Sedmileté zkušenosti chirurgického pracoviště
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



