-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaNaše zkušenosti s léčbou pooperační bolesti u Crohnovy nemoci
Experience With Treatment of Postoperative Pain in Crohn’s Disease
When conservative options for the treatment of Crohn’s disease are exhausted, surgical treatment of complications is indicated. Based on our experience, it appears that the pain thershold is reduced in these patients and, compared to other patients undergoing comparable procedures, they poorly tolerate postoperative algesia. In the report, the authors concentrated on postoperative analgesia, considering the altered pain perception of the subjects, with the aim to define the best analgesic procedure.
Key words:
Crohn’s disease – postoperative analgesia – visual analog pain scale
Autoři: B. Garajová; I. Hanke; V. Procházka
Působiště autorů: Chirurgická klinika FN Brno-Bohunice, přednosta: prof. MUDr. J. Vomela, CSc
Vyšlo v časopise: Rozhl. Chir., 2007, roč. 86, č. 5, s. 233-235.
Kategorie: Monotematický speciál - Původní práce
Souhrn
Po vyčerpání konzervativních možností léčby Morbus Crohn je u komplikací indikována léčba chirurgická. Podle našich zkušeností mají tito pacienti snížený práh bolesti a oproti ostatním nemocným s obdobnými výkony hůře tolerují pooperační algezii. Ve sdělení jsme se zaměřili na pooperační analgetickou terapii s přihlédnutím ke změněnému vnímání bolesti s cílem nalezení nejvýhodnějšího analgetického postupu.
Klíčová slova:
Crohnova choroba – pooperační analgezie – vizuální analogová škála bolestiÚVOD
Morbus Crohn (CN) je chronické zánětlivé onemocnění zažívacího traktu s typickým segmentálním postižením úseků střeva v celé šíři stěny zánětem. Po vyčerpání konzervativních možností terapie je při komplikovaném průběhu nemoci možným řešením chirurgická resekce. Kromě resekčních výkonů bývají indikovány i operace neresekční povahy [1, 2].
V konzervativní terapii se uplatňují léky jako kortikosteroidy (často podávané ve vysokých dávkách) či imunosupresiva [4, 5]. Nežádoucí účinky uvedených lékových skupin (myopatie, polyneuropatie, psychózy, deprese) mohou být jednou z příčin modulace odpovědi na pooperační analgetickou terapii. Navíc nemoc sama o sobě, nejen jako komplikace léčby, ale také jako průvodní jev dlouhodobého trvání, vede ke vzniku polyneuropatií i psychických poruch [1, 2, 3].
Při retrospektivním sledování nemocných jsme zjistili, že vykazují nižší práh bolesti s nutností výrazně vyšší analgetizace oproti pacientům s obdobnými operačními výkony, ale pro jinou diagnózu.
Naším cílem bylo stanovit optimální pooperační analgezii včetně cesty podání tak, aby byl zohledněn možný vliv předchozí konzervativní terapie.
METODA
Sledovaní pacienti byli před operací standardně premedikovaní Diazepamem per os podle tělesné hmotnosti. Operační analgezie byla vedena sufentanylem, doplněným rajským plynem a případně i potentním inhalačním anestetikem.
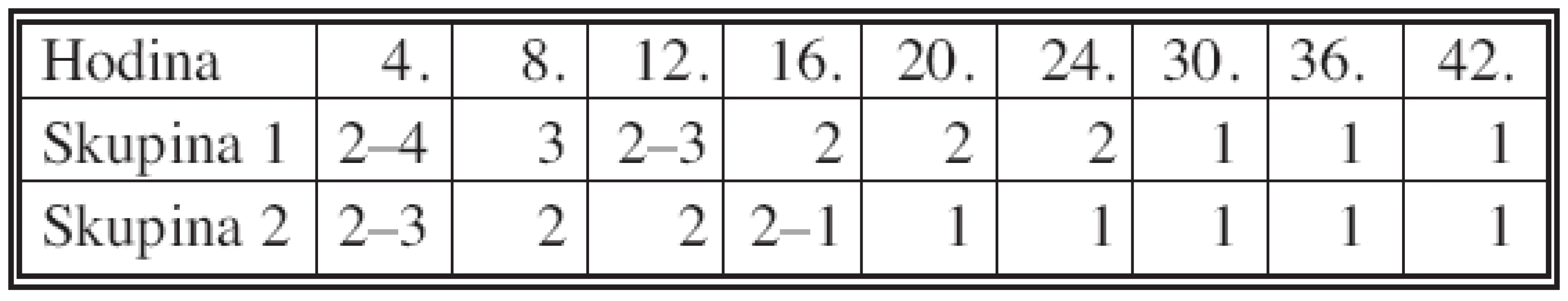
Pooperační analgezii jsme sledovali od příjezdu ze sálu na JIP a dále ve čtyřhodinových intervalech po dobu prvních 24 hodin a šestihodinových intervalech do celkově 48 hodin po operaci – čili 0. a 1. pooperační den.
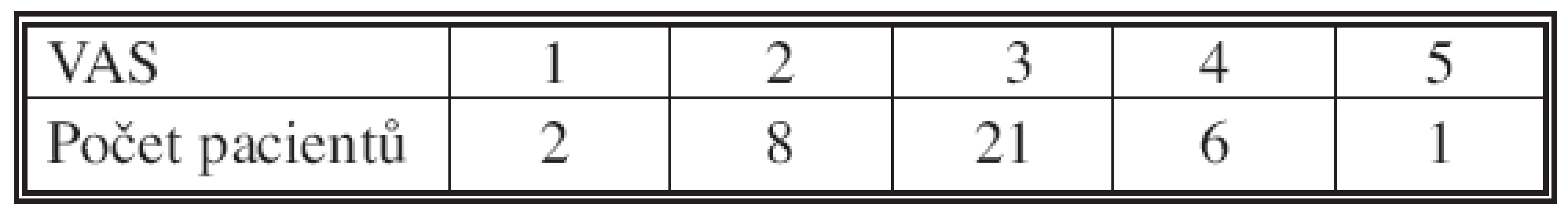
Pooperační analgezii jsme vedli dvěma způsoby a srovnávali jsme účinnost obou analgetických postupů pomocí vizuální analogové škály (VAS) v rozmezí 1–5 (1 žádná bolest, 5 nesnesitelná bolest). Rozdělení do skupin bylo proporcionální podle operačního výkonu, k stejnoměrnému zastoupení všech provedených výkonů v obou skupinách.
První způsob pooperační analgezie byl bolusový, kdy jsme podávali opioidy (tramadol, pethidin, morphin) dle tělesné hmotnosti pacienta v šestihodinových intervalech intravenozní či subkutánní cestou v kombinaci s periferním analgetikem metamizolem (1 g po 6 hodinách nebo 2,5 g po 12 hodinách intravenózně). První dávka analgetika byla podána do 1 hodiny po operaci.
Druhý způsob analgezie spočíval v kontinuálním podáváním opioidu (sufentanyl forte 2 ml/20 ml fyziologického roztoku nebo morphin 1% 2 ml/20 ml fyziologického roztoku), kdy dávka byla titrována do uspokojivé kontroly bolesti podle VAS. Analgetizace byla nasazena do 30 minut po příjezdu na JIP.
Cílem bylo zjistit výhodnější způsob analgezie tak, aby hodnota VAS byla 1–2.
VÝSLEDEK
V roce 2005 u nás bylo operováno 38 pacientů s CN s výkony resekční i neresekční povahy. V souboru bylo 24 mužů a 14 žen s věkovým průměrem 37,5 let (19–56 let), průměrná hmotnost byla 77 kg (45–109 kg), ASA klasifikace v rozmezí I–III.
Algezie při příjezdu ze sálu byla v obou sledovaných skupinách v rozmezí VAS 1–5, s mediánem na hodnotě VAS 3 (Tab. 1).
Dále jsme pooperační bolest sledovali ve čtyřhodinových intervalech během prvních 24 hodin a po 6 hodinách do 48 hodin po operaci (Tab. 2). První skupina tvořili pacienti s bolusovým vedením pooperační bolesti, druhou pacienti s kontinuálním řešením pooperační bolesti (Tab. 2).
Kontinuální podávání trvalo maximálně 48 hodin od operace. Při bolusovém podání vycházely hodnoty VAS v operační den řádově o jednotku vyšší než při kontinuálním dávkování analgetika, což svědčí pro lepší toleranci tohoto způsobu analgezie. První pooperační den se hodnoty VAS postupně srovnaly.
DISKUSE
Při sledování pacientů operovaných pro CN jsme zjistili, že nemocní vykazují výrazně nižší práh pooperační bolesti. Domníváme se, že vnímání pooperační bolesti u těchto nemocných je pravděpodobně modifikováno předcházející terapií i specifiky dané nemoci [1, 2, 5], z nichž rezultují nežádoucí účinky ve smyslu myopatií, polyneuropatií, depresí a psychóz. Tím pravděpodobně dochází k ovlivnění vnímání bolesti na úrovni periferního i centrálního nervového systému. Kromě toho je pooperační algezie ovlivněna i dalšími faktory jako je pohlaví, věk, eventuální předchozí analgetická terapie a velikost operačního výkonu [6].
Podle našeho pozorování pooperační bolest je lépe tolerována staršími než mladšími pacienty. Časová naléhavost operace (akutní či elektivní výkon) z hlediska pooperační analgezie nebyla podstatná, taktéž nebylo rozhodující, byla-li operace vedena laparoskopickou či otevřenou cestou. Kontinuální vedení pooperační analgezie vycházelo lépe bez ohledu na výše uvedené faktory (věk, pohlaví, velikost operačního výkonu).
Zjistili jsme, že důležitější než volba analgetika, je udržení dostatečné kontinuální hladiny analgetika v séru. Dospěli jsme k názoru, že pacienti hůře tolerují výkyvy hladin analgetik při bolusovém podávání pro pocit dyskomfortu, který v nich tento způsob analgezie vyvolává (nestejnoměrná analgezie, z toho rezultující psychický stres s odmítáním spolupráce a rehabilitace). Navíc při bolusovém podávání byla spotřeba analgetik vyšší než při udržení stabilní hladiny při kontinuálním podávání. Bolusové podání také zvyšuje možnost projevů nežádoucích účinků léků, které se dále mohou podílet na dyskomfortu pacienta [6, 7]. Rozdíly v analgezii podle typu jejího vedení byly patrné do 2. pooperačního dne, v dalších dnech jsme již žádné významné rozdíly v kontrole bolesti podle VAS ve většině případů nezaznamenali.
Podle literatury lze v pooperační léčbě bolesti využít jak bolusové, tak kontinuální podávání analgetik [6, 7] bez jednoznačné preference některé z metod. Opakovaně je ale poukazováno na výhody pacientem kontrolované analgezie (PCA), která ale vyžaduje nejen technické vybavení, ale i dobře spolupracujícího a poučeného pacienta i vyškolený personál.
ZÁVĚR
Nemocní podstupující operační výkon pro CN vykazují nižší práh bolesti, který je podmíněn nejen chorobou a její léčbou jako takovou, ale i psychickou odezvou na celkový průběh choroby [6]. V pooperační kontrole bolesti vyžadují individuální přístup s vyšší hladinou analgetika v séru oproti pacientům s obdobnými operačními výkony.
Ověřili jsme, že kontinuální vedení pooperační analgezie s cílem udržení VAS na hodnotách 1–2 vede k dostatečné kontrole bolesti, napomáhá dobré psychické kondici pacienta a tím i jeho ochotě a schopnosti spolupracovat a rehabilitovat. Nedílnou součástí pooperační analgezie jsou samozřejmě i nefarmakologické postupy a psychická podpora pacienta.
Myslíme si, že tito pacienti by byli vhodnými kandidáty k preemptivní analgezii v rámci premedikace vhodným perorálním analgetikem spíše periferního typu v kombinaci s anxiolytikem [7].
Otázkou zůstává širší využití epidurální pooperační analgezie či PCA [7, 8].
MUDr. B. Garajová
Chirurgická klinika FN
Jihlavská 20
625 00 Brno
e-mail: bgarajova@fnbrno.cz
Zdroje
1. Mařatka, Z., a spol. Gastroenterologie. UK Praha, 1999, s. 247–273.
2. Lukáš, K. Idiopatické střevní záněty. Triton, 1997, s. 69–77.
3. Jarnerot, G., Lennard-Jones, J., Truelove, S. Inflammatory Bowel Disease. Corona AB, Astra 1992, str. 306–308, 339–341, 344.
4. Lullmann, H., Mohr, K., Wehling, M. Farmakologie. Grada, 2004, s. 439–446, 573–578.
5. Matulka, M. Imunopatologie chronických střevních zánětů. Čas. Alergie, roč. 3 2001, č. 3.
6. Larsen, R., a kol. Anestezie. Grada 1998, s. 515–545.
7. Charlton, E. The management of postoperative pain. UK Update of Anaesthesie, roč. 7, 1997, č. 2, s. 1–7.
8. Ramsey, M. Acute postoperative pain management. BUMC Proceedings, 2000, 13 : 244–247.
Štítky
Chirurgie všeobecná Ortopedie Urgentní medicína
Článek vyšel v časopiseRozhledy v chirurgii
Nejčtenější tento týden
2007 Číslo 5- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Stillova choroba: vzácné a závažné systémové onemocnění
- Hojení análních fisur urychlí čípky a gel
- Jak souvisí postcovidový syndrom s poškozením mozku?
-
Všechny články tohoto čísla
- Poznámky k operační taktice a technice dekompresivní kraniotomie – přehledný referát
- Aorto-intestinální píštěl – závažná komplikace chirurgie aorty a pánevních tepen
- Paliativní chirurgie
- Radiofrekvenčně asistovaná resekce jater. Analýza skupiny pacientů operovaných v jednom centru
- Naše zkušenosti s léčbou pooperační bolesti u Crohnovy nemoci
- Cysta choledochu ako komplikácia gravidity
- Porovnání různých typů farmakologické prevence hluboké žilní trombózy dolních končetin u pacientů se zlomeninou proximální části stehenní kosti
- Súčasný trend liečby zlomenín krčka stehnovej kosti u seniorov
- Použití hřebu Targon PH long u etážových zlomenin a zlomenin metafýzy proximálního humeru
- Náhrada obratlového těla implantátem Synex
- NF- κB, kolorektální karcinom a radioterapie: výsledky klinické a experimentální studie
- Historie chirurgie a lékařství v Čechách: Významné osobnosti I
- Prof. MUDr. Vladimír Kořístek, DrSc. – 80 let
- Rozhledy v chirurgii
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Súčasný trend liečby zlomenín krčka stehnovej kosti u seniorov
- Použití hřebu Targon PH long u etážových zlomenin a zlomenin metafýzy proximálního humeru
- Náhrada obratlového těla implantátem Synex
- Historie chirurgie a lékařství v Čechách: Významné osobnosti I
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání