-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Celiakální sprue – staronová diagnóza*
Celiac sprue – old and newdiagnosis
The communication describes present knowledge about celiac disease from the clinical and diagnostic points of view and draws attention to most frequent complica-tions. Unified European regulations for labeling foodstuff for the content of gluten are presented.
Celiac disease is not an allergy to gluten, but an autoimmune disease of children as well as adults. In adhering to gluten free diet, low levels of antibodies, good nutritional state without the signs of malabsorption syndrome, celiac disease can be maintained in a resting state without deteriorated quality of life or limitations to the working and personal life. The exclusive effective therapy is adherence to gluten free diet, which is costly and is presently not adequately supported by medical insurance companies.Keywords:
celiac disease – gluten sensitive enteropathy – tissue transglutaminase – T lymphoma – gluten free diet
Autoři: Prokešová Jitka
Působiště autorů: Interní gastroenterologická klinika, FN Brno a Lékařská fakulta MU přednosta prof. MUDr. Aleš Hep, CSc.
Vyšlo v časopise: Reviz. posud. Lék., 16, 2013, č. 3, s. 95-100
Kategorie: Přehledový článek
* Předneseno na Posudkových dnech v Brně dne 5. 10. 2012.
Souhrn
Sdělení uvádí současné poznatky o celiakii z hlediska klinického a diagnostického, upozorňuje i na nejčastější komplikace. Uvedena jsou i jednotná evropská pravidla pro označování potravin z hlediska obsahu lepku.
Celiakie není alergií na lepek, ale autoimunitním onemocněním nejen dětského, ale i dospělého věku. Při dodržování bezlepkové diety, nízké hladině protilátek, dobrém nutričním stavu bez známek malabsorpčního syndromu, lze udržovat celiakii v klidovém stavu bez zhoršení kvality života či omezení v pracovním či osobním životě. Jedinou účinnou léčbou je dodržování bezlepkové diety, ta je ale finančně náročná a nemá v současnosti adekvátní podporu zdravotních pojišťoven.Klíčová slova:
celiakie – gluten senzitivní enteropatie – tkáňová transglutamináza – T lymfom – bezlepková dietaÚVOD
Celiakie (gluten senzitivní enteropatie, celiakální sprue – CS) je onemocnění, u kterého známe přesně spouštěč – trigger, specifické protilátky, histopatofyziologické změny sliznice tenkého střeva, klinický korelát, genetickou vazbu a terapii. Je tedy typickým představitelem autoimunitního onemocnění.
Triggerem v případě celiakie je lepek – gluten, komplex bílkovin uplatňující se v autoimunitní reakci. V případě pšenice se jedná o prolaminy, u žita o hordeliny a u ječmene o sekaniny. Ovesné bílkovinné frakce – aveniny, mají velmi specifickou odpověď. O jejich roli jako spouštěče imunitní reakce se stále diskutuje a zvažuje se uvolnění do bezlepkové diety [1].
AKTUÁLNÍ STAV V ČR
Prevalence v ČR v roce 2011 byla 1 : 200 až 250/100 000 obyvatel, tedy 40 000–50 000 nemocných v celkové populaci. Tento výskyt kopíruje současný stav ve střední a západní Evropě. Incidence postupně narůstá, což je způsobeno zlepšením diagnostických metod a jejich dostupností, větší informovaností lékařů a snahou o screening u cílových skupin populace. Alarmující zůstává stále nízké procento dispenzarizovaných pacientů, a to jen 10–15 %. Lze tedy předpokládat obrovské množství jedinců dosud nediagnostikovaných, bez léčby. Do této skupiny patří rodinní příslušníci pacientů, pacienti léčení s jinými autoimunitními chorobami – nejčastěji thyreoiditida, diabetes, astma bronchiale a další. S cílem zvýšení informovanosti, zlepšení situace pacientů s celiakií a rozšíření rodinného screeningu byla založena komise pro celiakální sprue, která pracovala při Ministerstvu zdravotnictví ČR. Ta byla bohužel zrušena v r. 2005 a prozatím byly další aktivity v tomto smyslu odloženy [2].
HISTORIE
První zmínka o celiakii pochází již z 2. století n. l. od známého lékaře Galéna, který sepsal spisy s názvem „Náchylnost k celiakii“. Samotné slovo celiakie pochází pravděpodobně od řeckého výrazu „koiliakos“, což je překládáno jako náchylný na střeva. Samuel Gee v roce 1888 první popsal celiakii jako onemocnění, které je způsobeno dietním faktorem. Na začátku 20. století se objevovaly teorie různých autorů o etiologii onemocnění. Mezi nejznámější autory patřili Herter (1908), Still (1918), Howland (1921), Haas (1924), Andersonová, Van de Kamer, Paulley, MacDonald (1965). Druhá světová válka paradoxně nejvíce pomohla odhalení etiologie onemocnění. V období nedostatku mouky byly totiž využívány ve stravě dětí jiné, bezglutenové náhražky. Na této zavedené dietě se klinický stav nemocných dětí prudce zlepšil, aby se po skončení války, se zavedením mouky zpět do jídelníčku, potíže opět objevily. Z tohoto důvodu je za „otce“ celiakie považován nizozemský lékař dr. K. W. Dicke, který odhalil v roce 1950 příčinu potíží v mouce. V pozdějších letech docházelo ke zpřesňování diagnostiky onemocnění, byla objevena genetická vazba a založena klasifikace histopatologických změn střevní sliznice [3].
PATOFYZIOLOGIE
U geneticky predisponovaných jedinců jsou prolaminy vyhodnocovány buňkami imunitního systému jako cizorodé a stimulují B lymfocyty střevní sliznice k tvorbě protilátek. Dochází k zvýšení permeability buněčné membrány a uvolňování tkáňové transglutaminázy (tTG) do cirkulace. tTG výrazně zvyšuje afinitu (asi 400krát) ke štěpným produktům prolaminů, a tak se zahajuje „bludný kruh” stimulace antigenem a tvorby protilátek. Ty pak poškozují sliznici tenkého střeva, ale i další orgány a systémy. Reaktivita imunitního systému celiaka v průběhu let postupně klesá až k jeho kolapsu za současné manifestace různých komplikací, včetně zvýšeného výskytu zhoubných nádorů.
Míru poškození sliznice tenkého střeva hodnotí několik klasifikací, klasická Marshova, modifikovaná Oberhuberova nebo Corazzova. Není souvislost mezi tíží postižení střeva a klinickými příznaky. Maximum slizničních změn je lokalizováno v duodenu a jejunu. U některých forem celiakie má zánět ložiskový charakter, nebo může dokonce chybět. Ani negativní nález v bioptickém vzorku však celiakii zcela nevylučuje. Důsledkem poškození sliznice tenkého střeva je pak malabsorpce, maldigesce, malnutrice a změny střevního mikrobiomu [3, 7].
KLINICKÉ PROJEVY
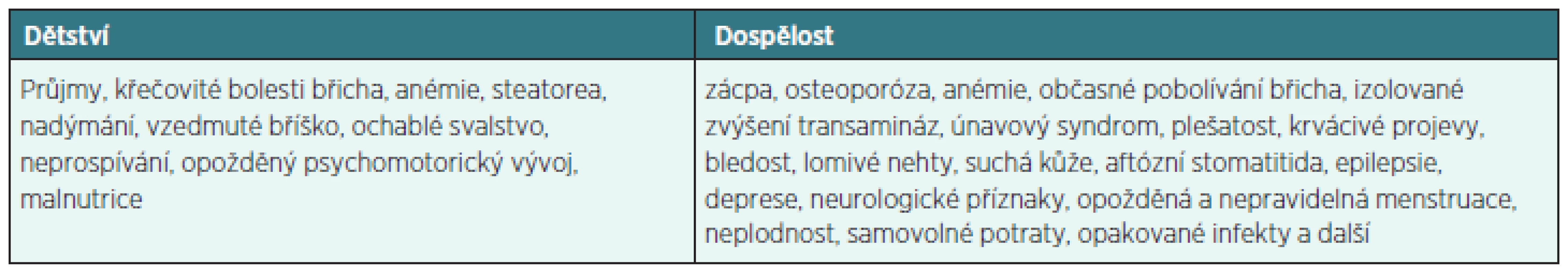
Klinické projevy onemocnění jsou variabilní a různorodé. Již dávno víme, že celiakii nelze chápat jako onemocnění dětského věku. Tento mýtus pramení z výskytu typických klinických projevů v dětství, a to především gastrointestinálních. V období puberty a dospívání dochází ke spontánnímu zlepšení a ústupu klinických příznaků. Toto období bývá rizikové pro udržení compliance u pacientů, u kterých absence klinických příznaků při dietních chybách může vést ke zvažování správné diagnostiky a tím k nedodržování diety. V dospělosti dominují atypické klinické příznaky, které vznikají v důsledku maldigesce, malnutrice a aktivace jiných autoimunitních onemocnění či zhoršení imunitního dozoru (tab. 1). Část pacientů je zcela asymptomatických a je zachycena jen při cíleném screeningu.
Výskyt přidružených autoimunitních onemocnění u dětí do 15 let věku je přibližně 8% a do 30 let věku asi 16%, přičemž při dodržování diety se riziko snižuje asi o 10 %. Mezi nejčastější asociovaná autoimunitní onemocnění patří diabetes mellitus 1. typu (3–8 % pacientů má CS), autoimunitní thyreoiditida a jiné autoimunitní endokrinopatie, autoimunitní hepatitida, systémový lupus erythematodes, primární sklerózující cholangitida, primární biliární cirhóza, Sjögrenův syndrom,IgA nefropatie a další [2].
DIAGNOSTIKA
Mezi základní screeningová vyšetření při podezření na CS patří vyšetření periferní krve ke zjištění přítomnosti protilátek. Vysoce specifickou protilátkou je protilátka proti tkáňové transglutamináze (anti-tTG) ve třídě IgA. Stejnou specificitu vykazuje protilátka proti deaminovaným gliadinovým peptidům (anti-DGP) ve třídě IgA i IgG.
Důležité je současné stanovení celkové hladiny IgA v séru k vyloučení selektivního deficitu IgA. Tito pacienti tvoří v populaci ČR až 3 % a mohou vykazovat falešně negativní hodnoty autoprotilátek v této třídě. Při celkovém snížení IgA má pak vypovídací hodnotu hodnota protilátek ve třídě IgG.
Protilátky s nižší specificitou a senzitivitou, jako anti-endomysium, není nutné v rámci screeningu stanovovat. Lze je však využít ke sledování dynamiky nebo v rámci diagnostiky atypické CS. Protilátky proti gliadinu, dříve hojně odebírané, se v diagnostice celiakie již neuplatňují pro nízkou specificitu a senzitivitu.
Dalším krokem v diagnostice CS je histologické vyšetření vzorku sliznice tenkého střeva. Z dostupných údajů není patrný rozdíl v odběru entero-biopsie při provedení enteroskopie či gastroskopie.Je doporučen odběr za Vaterskou papilou, z vrcholků Kerkringových řas. V literatuře lze najít i práce o dostatečné výtěžnosti při odběru histologie z duodena [14]. Endoskopické vyšetření slouží nejen k odběru histologie, ale i k vyloučení jiné patologie horního gastrointestinálního traktu.
Mezi histologické změny typické pro celiakii patří různý stupeň atrofie klků, hypertrofie Lieberkühnových krypt, zvýšený počet intra-epiteliálních lymfocytů a přítomnost zánětu. Různý stupeň těchto změn zahrnuje Marshova klasifikace z r. 1992. Aktuálně se diskutuje o její modifikaci podle Corazza z r. 2005, kde je pro dia-gnostiku celiakie snížena hranice přítomnosti intraepiteliálních lymfocytů ze 40 na 20/100 buněk. Lze tedy předpokládat do budoucna nárůst incidence onemocnění při tomto diagnostickém rozhraní.
U malých dětí je preferován odběr enterobioptickou kapslí. U starších dětí (nad 12 let) se provádí endoskopické vyšetření s odběrem sliznice aborálního duodena při použití endoskopů vhodných pro dětský věk, obvykle v celkové anestezii.
U pacientů s vysoce rizikovými symptomy, s trvajícím podezřením na celiakii, je doporučeno odeslat pacienta na endoskopické vyšetření i při negativním sérologickém vyšetření PL [3, 15].
Diagnostika celiakie podle směrnice Evropské společnosti pro pediatrickou gastroenterologii, hepatologii a výživu (ESPGHAN) zahrnuje tato kritéria [8]:
- Anamnéza, klinický obraz, stanovení autoprotilátek a histologie střevní biopsie jsou kompatibilní s diagnózou.
- Bezlepková dieta vede k úpravě klinického stavu a autoprotilátek.
- Proband je starší než 2 roky.
- Diferenciální diagnostika vyloučila onemocnění s podobným klinickým obrazem.
Doporučení pro indikaci kontrolního odběru histologie po nastavení bezlepkové diety se rozcházejí. AGA (Americká gastroenterologická společnost) doporučuje kontrolní biopsii tenkého střeva po 3–4 měsících od zahájení bezlepkovédiety ke zhodnocení zlepšení histologických změn, NASPGHAN (severoamerická Společnost pro gastroenterologii a výživu) toto nedoporučuje [11]. V ČR není rebiopsie zařazena do doporučených postupů, ale je doporučena.
Ultrazvukové vyšetření tenkých kliček nepatří v současné době jednoznačně do diagnostiky celiakie, nicméně lze ho s výhodou využít v rámci diferenciální diagnostiky a ke sledování dynamiky změn. S vědomím všech limitací této metody má neinvazivní vyšetření svá nesporná pozitiva. Vyšetření ultrazvukem lze provádět opakovaně, nevyžaduje zvláštní přípravu a nezatěžuje pacienta. Lze porovnávat s výsledky vyšetření před stanovením diagnózy a následně také vyhodnocovat efekt nasazené bezlepkové diety z hlediska sledování morfologických změn střeva. V typickém případě se setkáváme s obrazem úbytku řas v orální části tenkého střeva, tzv. „kolonizace jejuna“, atrofií nepravidelných a zesílených řas, dysmotility, chaotické peristaltiky tenkého střeva, vzácně vystupňované až do obrazu intermitentních invaginací.
Dále je sledovatelná hypersekrece ve střevě podmíněná špatnou vstřebávací schopností střeva. Typická pro celiakii je přítomnost zvětšených, ovoidních a hyperechogenních mezente-riálních uzlin, menší velikost sleziny. Benefitem užití sonografie v iniciální fázi vyšetřování je i možnost vyloučení jiných příčin obtíží, např. nespecifického střevního zánětu aj. Ultrazvukové vyšetření však v žádném případě nemůže nahradit enterobiopsii [9].
FORMY CELIAKIE
Podle přítomnosti protilátek, nálezu ve střevní biopsii a klinických příznaků rozeznáváme 5 forem celiakie. Pro svoje nespecifické nálezy jsou diagnosticky nejobtížnější potenciální a latentní formy (tab. 2).
Tab. 2. Formy celiakie 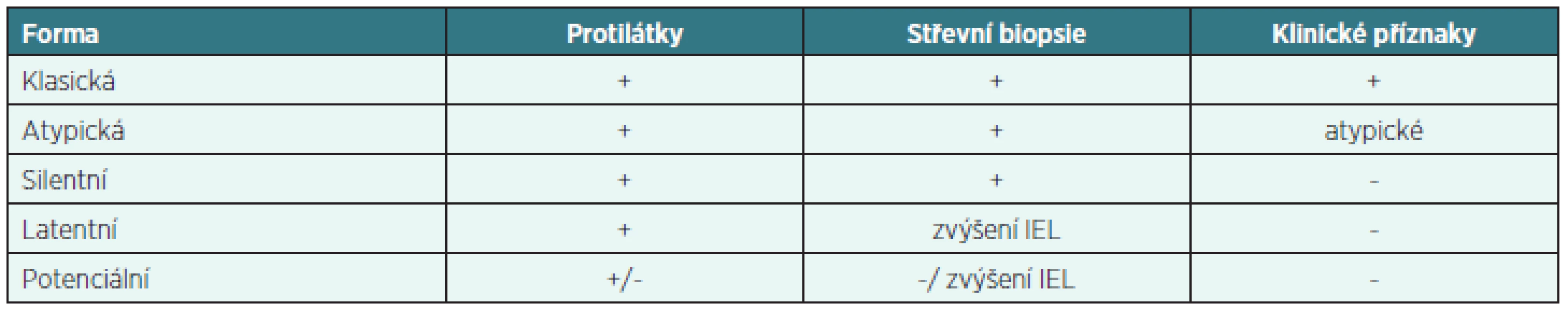
IEL – intraepiteliální lymfocyty Genetická predispozice
Predispoziční geny pro CS jsou HLA-DQ2 a -DQ8 na krátkém raménku 6. chromozomu (6p21), které se vyskytují u 95 % celiatiků. Bílkovinným produktem těchto genů je glykoprotein, který na enterocytech pomáhá rozpoznávat a vychytávat štěpné produkty lepku. Samotná přítomnost predisponující alely ale neznamená diagnózu celiakie. V české populaci je tato alela zastoupena ve 20–30 %, ale pouze 3–5 % z nich onemocní celiakií. Naopak až 99 % pacientů s celiakií má pozitivní genetickou predispozici DQ2 nebo DQ8, a proto chybění této predispoziční alely diagnózu CS téměř vylučuje. Raritní výjimkou může být genetická vazba jinde než v systému HLA [10].
CÍLENÝ SCREENING CELIAKIE
Recentní studie z r. 2012 ukázala, že CS je stále opomíjená diagnóza. Přes 60 % pacientů bylo proto před stanovením diagnózy celiakie vyšetřeno více než 2 lékaři [4]. Vzhledem k riziku poddiagnostikování byl v r. 2011 vydán Metodický pokyn Ministerstva zdravotnictví ČR „Cílený screening celiakie“. Provádí se u definovaných cílových skupin, kde lze předpokládat vyšší výskyt jedinců s nepoznanou celiakií (tab. 3) [3].
Tab. 3. Skupiny pacientů indikovaných ke screeningu 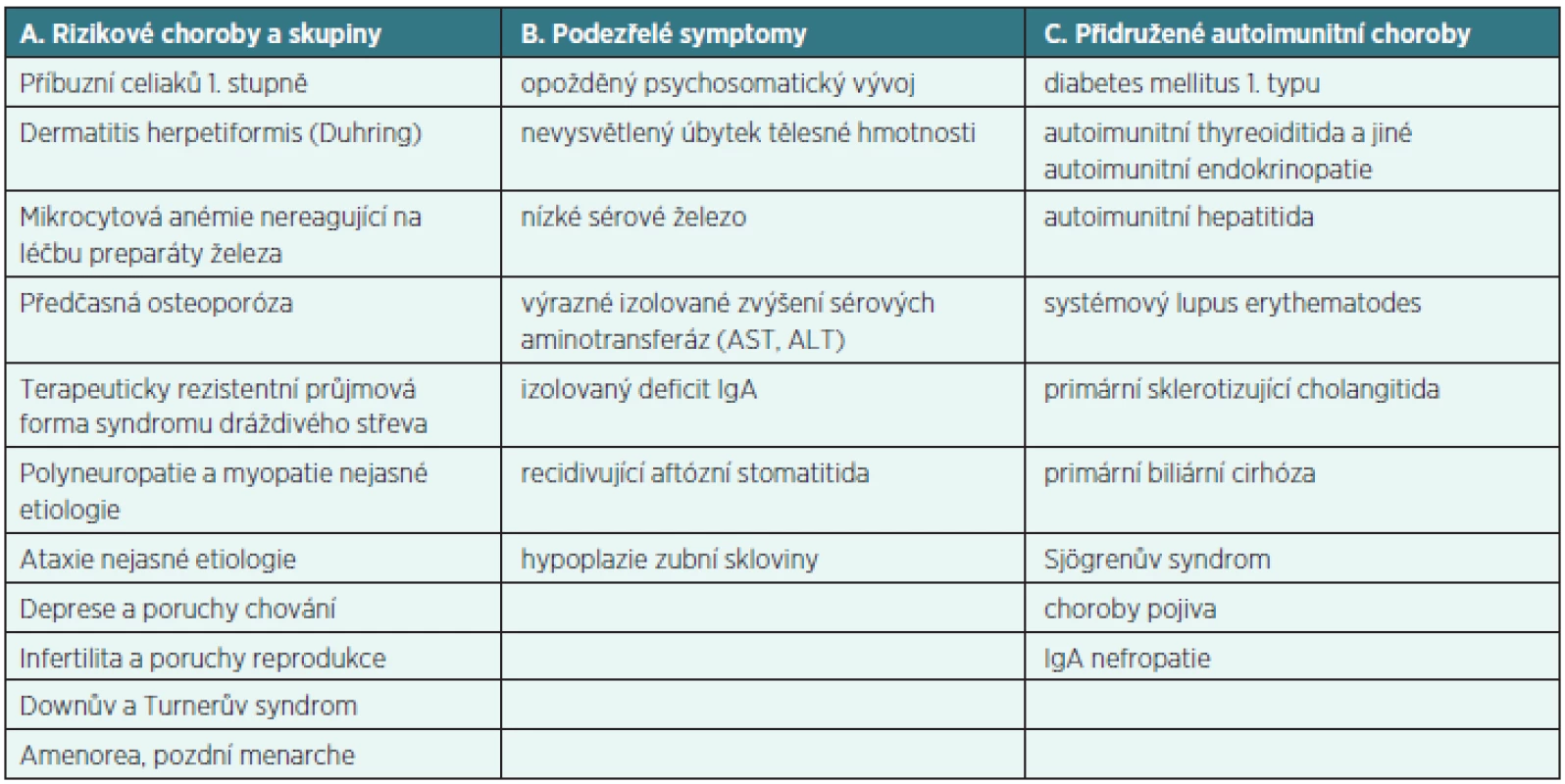
TERAPIE
Jedinou skutečně účinnou léčbou pacientů s celiakií je celoživotní striktní dodržování bezlepkové diety. Jde o absolutní vyloučení potravin obsahujících lepek z jídelníčku. Mezi potraviny vhodné při bezlepkové dietě patří např. brambory, rýže, kukuřice, pohanka, sója, luštěniny, amarant, proso (jáhly), ovoce, zelenina, maso a další. Kontroverzní zůstává oves, který má více kultivarů a v ČR není pro bezlepkovou dietu povolen (tab. 4 – potraviny s obsahem lepku). Česká norma pro bezlepkový produkt je 100 mg gliadinu/1 kg výrobku ve stavu určeném ke spotřebě.
Tab. 4. Potraviny s obsahem lepku 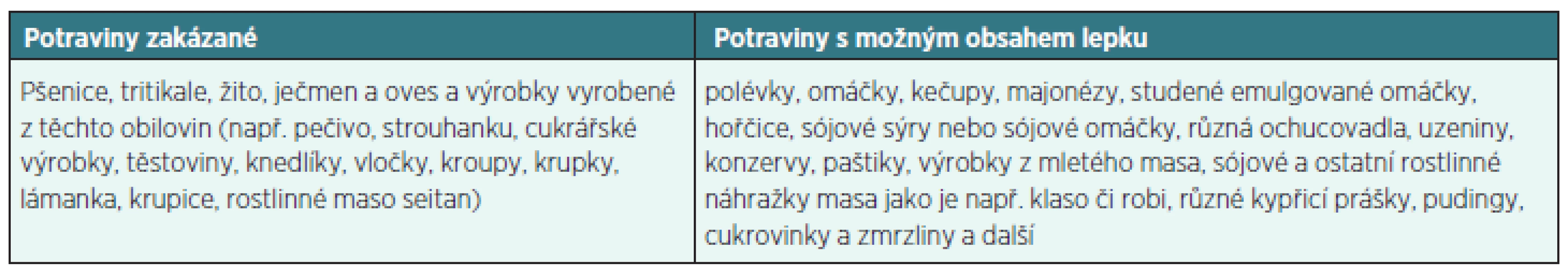
NOVINKY V LEGISLATIVĚ OD 1. 1. 2012
Legislativní požadavky jsou upraveny nařízením ES č. 41/2009 o složení a označování potravin vhodných pro osoby s nesnášenlivostí lepku, které stanovuje jednotná evropská pravidla pro označování potravin z hlediska obsahu lepku. Toto nařízení vymezuje dvě základní kategorie, které se odlišují jak požadavky na obsah lepku, tak stanoveným způsobem označení potravin [5]:
- „Bez lepku“ – obsah lepku musí činit nejvýše 20 mg/kg v potravině ve stavu, v němž je prodávána konečném spotřebiteli.
- „ S velmi nízkým obsahem lepku“ – obsah lepku musí činit nejvýše 100 mg/kg v potravině ve stavu, v němž je prodávána konečnému spotřebiteli.
Databáze bezlepkových potravin na internetu (http://www.szpi.gov.cz) [5] je spravována Státní zemědělskou a potravinářská inspekcí. V databázi jsou uvedeny analyzované výrobky, které vyhovují vyhlášce č. 54 ze dne 30. 1. 2004 o potravinách určených pro zvláštní výživu a o způsobu jejich použití. Databáze by měla především sloužit pacientům s celiakií, rodičům dětí s celiakií, dietním sestrám a lékařům. Je zde možné najít průběžné výsledky sledování a testování bezlepkových potravin v ČR.
COMPLIANCE K LÉČBĚ
Podle již zmíněné studie z r. 2012 bylo zjištěno, že jen asi 55 % pacientů se zjištěnou CS dodržuje dietu zcela, 41 % pacientů připouští občasné chyby a 4 % pacientů dietu nedodržují vůbec [4]. Je to mimo jiné důsledek vyšších finančních nákladů vynaložených na přípravu bezlepkové diety (nehrazené z prostředků veřejného pojištění), horší dostupností těchto potravin v místě bydliště, nemožnosti zajištění bezlepkového stravování ve školních zařízeních a v neposlední řadě nedostatečné informovanosti pacientů o důsledcích a rizicích vyplývajících z nedodržování diety.
KOMPLIKACE CELIAKIE
Při přetrvávání vysoké hladiny protilátek, klinických či histologických změn i při dodržování bezlepkové diety je nutno pomýšlet na celiakii neodpovídající na léčbu – CNL (non-responsive celiac disease). Vyskytuje se u 5–7 % nemocných s původní diagnózou CS a má různou příčinu [6].
I v tomto případě jsou rozhodující buněčnou populací intraepiteliální lymfocyty (IEL). Rozlišují se dvě buněčné populace, které mají zásadní význam pro další léčebný postup i prognózu. Prvním vyšetřením je imunohistochemické vyšetření znaků CD3 a CD8. U zdravých osob a celiaků reagujících na bezlepkovou dietu jsou oba tyto znaky lokalizovány v buněčné membráně IEL (refrakterní celiakie 1. typu, RC1). U zbývajících celiaků bez odpovědi na bezlepkovou dietu je znak CD3 lokalizován v cytoplazmě IEL, membránová lokalizace chybí a znak CD8 není přítomen vůbec (refrakterní celiakie 2. typu, RC2) [6].
Změny IEL stejné jako u RC2 se vyskytují i u T lymfomu vzniklého jako komplikace RC2 (EATL, enteritis associated T-lymphoma). Nález tohoto fenotypu při RC2 se proto označuje jako kryptogenní T-lymfom a RC2 se považuje za spojovací článek mezi celiakií a T-lymfomem [6]. Důvodem, proč je nutná přesná diagnostika, je velmi špatná prognóza a možnosti terapie EATL [12].
V terapii CNL se v indikovaných případech vedle striktní bezlepkové diety uplatňují kortikoidy, topické steroidy, imunosupresiva – cyklosporin, biologická terapie – infliximab. T-lymfom je radiorezistentní, kurabilitu může zajistit chirurgická terapie. Podávaná chemoterapie zahrnuje cyclofosfamid + vinkristin + adriamycin, prednison [13].
Vzhledem k uváděným rizikům komplikací je doporučena pravidelná dispenzarizace pacientů s kontrolou laboratorní, hladiny PL, podle potřeby ultrazvuk střev, denzitometrie, kolonoskopie v indikovaných případech a možnost konzultace nutričního terapeuta.
ZÁVĚR
Celiakii nelze zaměnit za alergii na lepek, což je stále jeden z nejčastějších mýtů v ambulancích jak praktických, tak specializovaných lékařů, ale i laické veřejnosti. Pro zlepšení diagnostiky je nutné chápat CS jako onemocnění vyskytující se jak v dětském věku, tak se změnou fenotypu i v dospělosti. Je naprosto nevhodné zahájení bezlepkové diety před jasným stanovením diagnózy. Při dodržování bezlepkové diety, nízké hladině PL, dobrém nutričním stavu bez známek malabsorpčního syndromu, lze udržovat celiakii v klidovém stavu bez zhoršení kvality života či omezení v pracovním či osobním životě. Nezanedbatelnou zůstává finanční náročnost bezlepkové diety, která je stále bez adekvátní podpory zdravotních pojišťoven.
Do redakce došlo dne 9. 7. 2013.
Adresa pro korespondenci:
MUDr. Jitka Prokešová
Interní gastroenterologická klinika,FN Brno a LF MU
Jihlavská 20, 625 00 Brno
e-mail: jprokesova@fnbrno.cz
Zdroje
1. Frič, P., Keil, R. Celiakie pro praxi. Medicína pro praxi, 2011,8 (9), s. 354–359.
2. Věstník MZ ČR, částka 2 z 28. 2. 2011, s. 51–54.
3. Kohout, P. Celiakie. Postgraduální medicína, 2012, 14, č. 2, s. 207–210.
4. Chvátalová, T., Vepřeková, G., Houska, A., Frič, P. Celiakie – opomíjená diagnóza. Vnitřní lékařství, 2012, 58 (2), s. 99–103.
5. http://www.szpi.gov.cz
6. Frič, P. Celiakální sprue. In Bureš, J. et al. Gastroenterologie. Kap. 19, s. 219–238, 9 : 273. Triton: Praha, 2006.
7. Marsh, M. N., Crowe, P. T. Morphology of the mucosal intestinal lesion in gluten senzitivity. Baillieres Clin. Gastroenterol., 1995.
8. Tion, J. M., van Bergen, J., Koning, F. Celiac disease – how complicated can it get? Immunogenetics, 2010, 62, p. 641–651.
9. Bartušek, D., Vavříková, M., Hustý, J. Využití ultrazvuku v diagnostice onemocnění střev. Česká a slovenská gastroenterologie a hepatologie, 2010, roč. 64, č. 4, s. 18–24.
10. Biagi, F., Corazza, G. R. Mortality in celiac disease. Nat. Rev. Gastroenterol. Hepatol., 2010, 7 (3), s. 158–162.
11. Fei, Bao, Liping, Yu, Sunanda, Babu, Tianbao, Wang, E., Hoffenberg, J., Rewers, M., Eisenbarth, G. One Third of HLA DQ2 Homozygous Patients with Type 1 Diabetes Express Celiac Disease-Associated Transglutaminase Autoantibodies. Journal of Autoimmunity, 1999, 13 : 1, p. 143–146.
12. Agostini, C., Decsi, T., Fewtrell, M. et al. Complementary feeding: a commentary by the ESPGHAN Committee on nutrition.J. Pediatr. Gastroenterol. Nutr., 2008, 46, p. 99–110.
13. Di Sabatino, A., Corazza, G. R. Coeliac disease. Lancet, 2009, 373 (9785), s. 1480–1493.
14. Frič, P. Endoskopická diagnostika celiakální sprue. Endoskopie, 2002, 11, s. 69–73.
15. Kollárová, H., Pektor, R., Šmajstrla, V. et al. Rutinní biopsie z duodena prováděná během gastroskopie – jedna z možností vyhledávání asymptomatické celiakie. Česká a slovenská gastroenterologie a hematologie, 2007, 61, s. 245–248.
Štítky
Posudkové lékařství Pracovní lékařství
Článek Vzácná onemocněníČlánek Zprávy
Článek vyšel v časopiseRevizní a posudkové lékařství
Nejčtenější tento týden
2013 Číslo 3- Úhrada léčivých přípravků podle § 16: Jak přesně postupovat?
- Vedolizumab v klinické praxi: pro koho, kdy a jak
- Vedolizumab v léčbě středně těžké až těžké aktivní Crohnovy nemoci
- Vedolizumab je vhodný i pro déletrvající léčbu pacientů s IBD
- Nové možnosti v terapii zánětlivých střevních onemocnění
-
Všechny články tohoto čísla
- Vzdělávání v oboru posudkové lékařství
- Problematika posuzování duševních chorob v praxi posudkového lékaře podle zákona č. 155/1995 Sb. a vyhlášky č. 359/2009 Sb., v platném znění
- Vzácná onemocnění
- Doktor Hynek Dolanský šedesátiletý
- Zprávy
- Stresové zatížení posudkových lékařů
- Ambulantní geriatrie v systému zdravotních služeb ČR očima geriatrů
- Celiakální sprue – staronová diagnóza*
- Revizní a posudkové lékařství
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Problematika posuzování duševních chorob v praxi posudkového lékaře podle zákona č. 155/1995 Sb. a vyhlášky č. 359/2009 Sb., v platném znění
- Vzdělávání v oboru posudkové lékařství
- Ambulantní geriatrie v systému zdravotních služeb ČR očima geriatrů
- Celiakální sprue – staronová diagnóza*
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání