-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Poranenia kľbnej chrupky kolenného kľbu a možnosti jej reparácie
Diseases of the knee cartilage and the repair options
Articular cartilage is a highly-specified tissue ideally built-up to fit its function on the surface of weight-bearing mobile joints. The cartilage is biomechanically composed of a complex matrix, strengthened by fibres and it is able to bear and distribute the physiological load without mechanic failure. For many people the cartilage functions and provides great joint mobility all their life, nevertheless cartilage injury and degeneration still remain a serious medical problem. There has been substantial progress in the field of treatment recently. The principal premise of finding an optimal therapeutic plan is the understanding of cartilage structure and metabolism, optimal diagnostics and correct classification of the type of cartilage injury, according to which we designate a therapeutic algorithm. The options of treatment include the stimulation of bone marrow through microfractures, autologous osteochondral mosaicplasty, transplantation of osteochondral allograft, implantation of autologous chondrocytes, cell methods and methods applying biological carriers or conservative methods including the application of growth factors, preparations containing hyaluronic acid and platelet-rich plasma.
Key words:
cartilage, cartilage treatment, current options of cartilage treatment
Autoři: P. Polan; R. Totkovič; T. Ševčík
Působiště autorů: Ortopedické oddelenie ; Primár: MUDr. Roman Totkovič ; 1. súkromná nemocnica Košice-Šaca a. s., Slovenská republika
Vyšlo v časopise: Prakt. Lék. 2012; 92(6): 316-321
Kategorie: Přehledy
Souhrn
Kľbna chrupka je vysokošpecializované tkanivo ideálne vytvorené pre svoju funkciu nosného povrchu mobilných kľbov. Biomechanicky je chrupka zložitou matrix, ktorá je posilnená vláknami, a je schopná uniesť a distribuovať fyziologické nároky bez mechanického zlyhania. Pre mnohých ľudí chrupka funguje celý život a zabezpečuje optimálny pohyb kľbov, napriek tomu však poškodenia a degenerácie chrupky zostávajú významným medicínskym problémom. Na poli liečby týchto ochorení boli v poslednom čase zaznamenané viaceré pokroky. Základným predpokladom nájdenia optimálneho terapeutického postupu je pochopenie štruktúry a metabolizmu chrupky, optimálna diagnostika a správna klasifikácia typu poškodenia chrupky, na základe ktorých stanovujeme liečebný algoritmus. Stratégia ošetrenia poškodenej chrupky zahŕňa stimuláciu kostnej drene – mikrofraktúry, autológnu osteochondrálnu mozaikoplastiku, transplantáciu osteochondrálneho alloštepu, implantáciu autológnych chondrocytov, bunkové metódy a metódy s použitím biologických nosičov či konzervatívne postupy, zahrňujúce aplikáciu rastových faktorov, preparátov s obsahom kyseliny hyalurónovej, plazmu s vysokým obsahom trombocytov.
Kľúčové slová:
chrupka, ošetrenie chrupky, súčasné možnosti ošetrenia chrupkyŠtruktúra chrupky
Kľbna chrupka má tri vrstvy – povrchovú, v ktorej sú kolagénové vlákna usporiadané paralelne s kľbnym povrchom, strednú, kde kolagénové vlákna prebiehajú palisádovito a viac náhodne, hlbokú, kde sú vlákna usporiadané viac radiálne. Pod touto vrstvou sa nachádza vrstva kalcifikovanej chrupky, mineralizovaná zóna, ktorá naväzuje na subchondrálnu kosť. Od povrchu do hľbky sa mení aj tvar chondrocytov, ktoré čím sú hlbšie, tým majú viac okrúhly tvar a majú aj viac organel.
Voda tvorí 70–80 % hmotnosti, práve vysoký obsah vody svojím pohybom umožňuje deformácie chrupky ako odpoveď na mechanický tlak. Voda nie je distribuovaná homogénne (65 % v hlbokej vrstve, 80 % v povrchovej vrstve). Pri artróze je obsah vody zvýšený. Zvýšený obsah vedie ku zvýšenej permeabilite, zníženiu sily a zníženiu elastického modulu chrupky.
Kolagén tvorí 20 % hmotnosti chrupky. Kolagén typu II má najväčšie zastúpenie, tvorí až 80 % všetkého kolagénu. Z ďalších kolagénov je vo väčšej miere zastúpený kolagén typu VI, ktorý vytvára matrix obklopujúcu chondrocyty, a tým zabezpečuje ich mechanickú ochranu a kolagén typu IX, ktorý zodpovedá za ukotvenie proteoglykánov v sieti.
Proteoglykány tvoria 10–15 % hmotnosti a zodpovedajú za kompresívnu silu chrupky. Proteoglykány takisto ako kolagény sú produkované chondrocytmi. Sú tvorené glykosaminoglykánmi (chondroitin 4-sulfát, chondroitin 6-sulfát a keratin sulfát). Glykosaminoglykány sa viažu na centrálny proteín a spojovacím proteínom na kyselinu hyalurónovú a vytvárajú makromolekuly nazývané proteoglykánové agregáty. Glykosaminoglykány obsahujú karboxylové a sulfátové skupiny, ktoré viažu vodu a sú zodpovedné za osmotický efekt proteoglykánov (1, 2, 3, 5, 6).
Metabolizmus chrupky
Chrupka je vyživovaná difúziou, energiu získava glykolýzou. Vzťah rastových faktorov ku metabolizmu chrupky ukazuje obr. 1 (obr. 1)
Obr. 1. Vzťah rastových faktorov ku metabolizmu chrupky 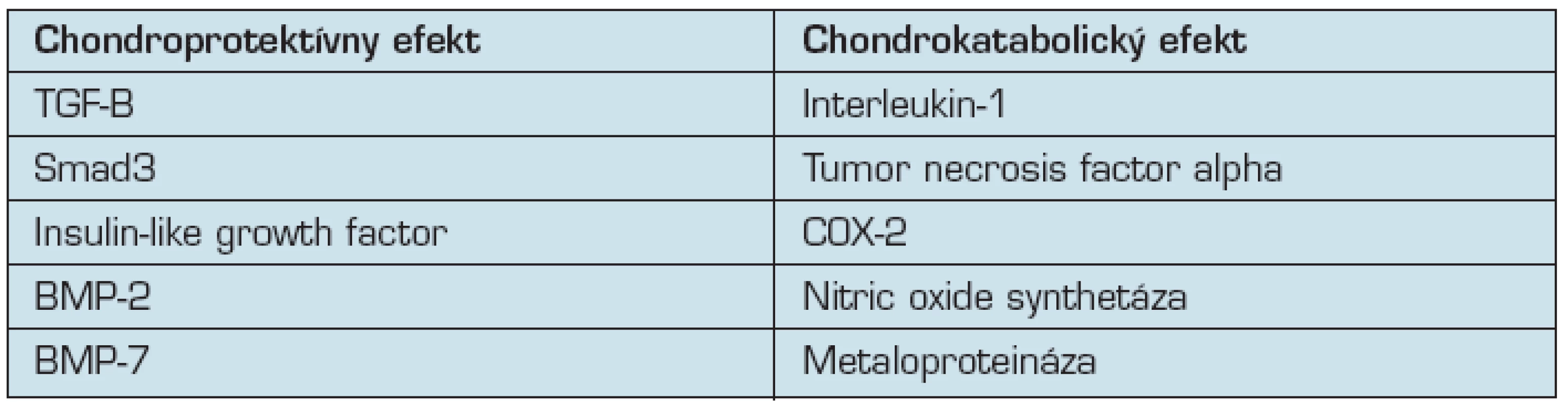
Transformujúci rastový faktor beta /TGF-B/ má chondroprotektívny efekt, takisto ako Smad3, čo je transkripčný faktor aktivovaný TGF-B,
- inzulinu podobný rastový faktor /IGF/ zvyšuje syntézu kolagénu a proteoglykánov,
- kostné rastové faktory BMP-2 a BMP-7 zvyšujú syntézu proteoglykánov a udržujú fenotyp chondrocytov,
- interleukín-1 inhibuje syntézu proteoglykánov a stimuluje aktivitu metaloproteináz /čo sú katabolické enzými/,
- tumor necrosis faktor /TNF/ inhibuje syntézu kolagénu a stimuluje aktivitu metaloproteináz,
- cyklooxygenáza /COX-2/ má katabolický efekt,
- NO syntetáza má katabolický efekt.
Artróza
Artróza je degeneratívne ochorenie chrupky, ktoré sa delí na primárnu (idiopatická) a sekundárnu osteoartrózu. Pri sekundárnej artróze je jasný etiologický činiteľ, ide najčastejšie o poúrazové stavy (intraartikulárne zlomeniny a opakovaná „mikrotraumatizácia“ chrupky), trvalé preťažovanie vysokej intenzity, osteochondrosis dissecans, kľbna dysplázia, aseptická osteonekróza kondylu (morbus Ahlbäck), deštrukciu kľbu pri reumatických a metabolických ochoreniach (ochronóza, hemofília, Pagetova choroba, Ehler-Danlosov syndrom, Gaucherová choroba a ďalšie), alebo pri neuropatických artropatiách.
Primárna artróza, kde etiologický činiteľ nie je jednoznačný, zostáva enigmou súčasnej medicíny. Spolupodiel na jej vzniku majú faktory hormonálne (je známy nástup artrózy u postmenopauzálnych žien), metabolické, mechanické, ale predovšetkým sa stále viac zdôrazňujú faktory genetické. Odhalený bol variant chromzómu 7 – (C alela z oblasti re3815148 chromozómu 7q22), ktorý má vplyv na zvýšenú prevalenciu a progresiu osteoartrózy. Tento gén kóduje proteín GPR22 – združený G proteínový receptor, ktorý by mohol v budúcnosti slúžiť ako terapeutický cieľ. Takisto je zvýšené riziko artrózy u pacientov s defektmi kolagénu II, IX,X (1, 2, 5).
Patológia zmien pri artróze
Zmeny v oblasti chrupky:
- strata proteoglykánov, prejavujúca sa zmäknutím chrupky a menšou odolnosťou na fyziologickú záťaž,
- klonácia chondrocytov, pri smrti chondrocytov vznikajú prázdne lakúny a prežívajúce chondrocyty proliferujú a agregujú sa do skupín,
- fibrilácia – vytvárajú sa trhliny v chrupke, ako zasahujú do hlbších partií chrupky, tak sa uvoľňujú kúsky chrupky a následne sa odhaľuje subchondrálna kosť.
Zmeny v subchondrálnej kosti:
- V oblasti, kde sú prítomné trhliny a odhalená subchondrálna kosť, dochádza k vytváraniu nových ciev. Tento proces zahŕňa osteoklastickú kostnú resorbciu a zvýšené aktivitu priľahlých osteoblastov, ktoré má za následok zhrubnutie subchondrálnej kosti.
- S pokračujúcou neovaskularizáciou mezenchymálne bunky vytvárajú fibrokartilaginóznu zátku, ktorá nahrádza chrupku. Táto náhrada je nekvalitná a rýchlo dochádza k jej opotrebeniu.
- Neskôr dochádza k úplnému odhaleniu subchondrálnej kosti na oboch komunikujúcich kostiach a kosť sa stáva hladkou a podlieha procesu eburnizácie (makroskopicky vyzerá ako slonovina).
- Následne vznikajú osteofyty, čo je pokus prírody o znehybnenie kľbu.
Klasifikácia izolovaných defektov chrupky
Pre izolované chondrálne defekty existuje niekoľko klasifikácii, ktoré sa v súčasnosti používajú. Najznámejšou artroskopickou klasifikáciou je klasifikácia vytvorená Outbridgom pochádzajúca z roku 1961 (3, 4). Tento skórovací systém delí defekty chrupky na 4 stupne, jeho nevýhodou je, že stupeň II a III nezahrňuje popis hľbky defektu, čo z terapeutického hľadiska má zásadný význam. V roku 1997 bola vypracovaná ICRS klasifikácia (International Cartilage Repair Society), ktorá sa blíži dnešným požiadavkám, vychádzajúc z hľbky defektu. Táto klasifikácia vychádza z Noyes-Stablerovej klasifikácie – publikovaná v roku1989 (3, 4).
A: Outerbridge klasifikácia
- stupeň 0: normálna chrupka,
- stupeň I: zmäknutie a opuch chrupky, veľkosť defektu do 0,5 cm,
- stupeň II: defekt s čiastočným stenčením a rozvláknením, trhlinami na povrchu, ktoré nedosahujú subchondrálnu kosť, veľkosť defektu do 1,5 cm,
- stupeň III: fragmentácia a trhliny po subchondrálnu kosť s priemerom väčším ako 1,5 cm,
- stupeň IV: odkrytá subchondrálna kosť.
B: ICRS klasifikácia:
Stupeň 0: Normálna chrupka (Obr. 2)
Obr. 2. ICRS klasifikácia izolovaných defektov chrupky – stupeň, normálna chrupka 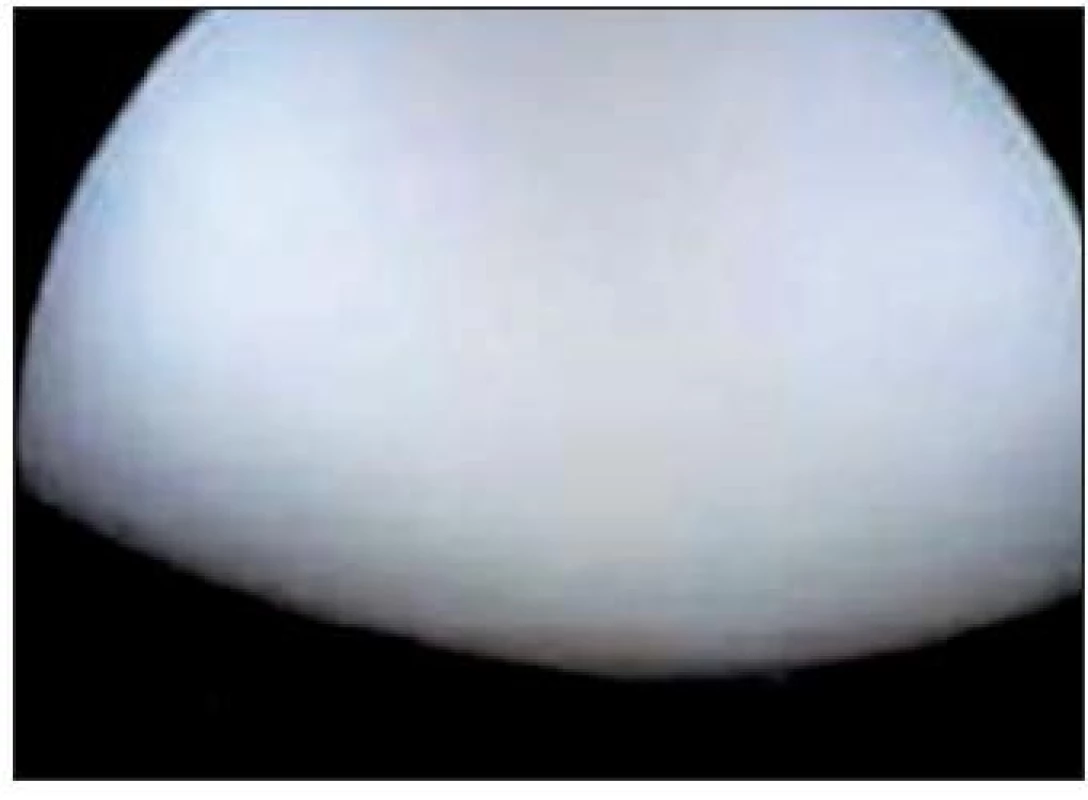
Stupeň 1: Skoro normálna chrupka
- A: Superficálne lézie, jemné zárezy, zmäknutie chrupky (Obr. 3)
- B: Superficiálne fisúry a trhliny (Obr. 4)
Obr. 3. ICRS klasifikácia izolovaných defektov chrupky – stupeň 1A, povrchová lézia, jemné zárezy, zmäknutie chrupky 
Obr. 4. ICRS klasifikácia izolovaných defektov chrupky – stupeň 1B, povrchové trhliny 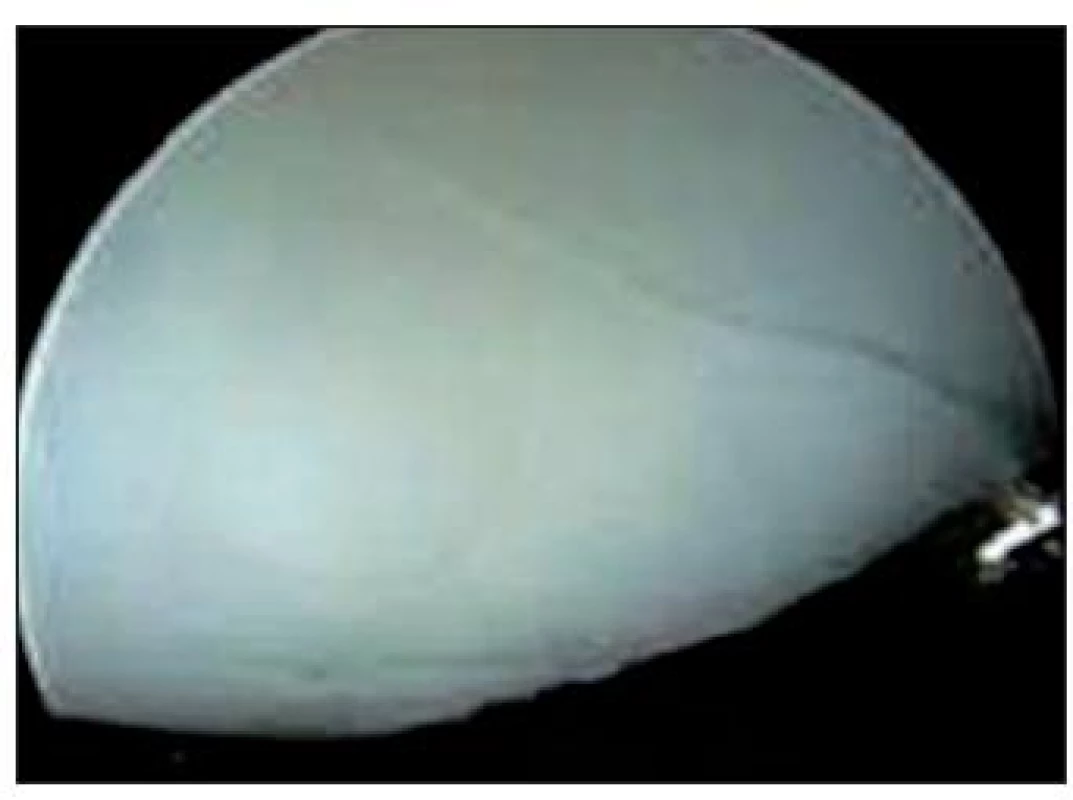
Stupeň 2: Abnormálny povrch – lézie nepresahujúce 50 % hrúbky chrupky (Obr. 5)
Obr. 5. ICRS klasifikácia izolovaných defektov chrupky – stupeň 2, defekt nepresahuje 50 % hrúbky chrupky 
Stupeň 3: Výrazne abnormálny povrch – lézie presahujúce 50 % hrúbky chrupky, až do kalcifikovanej vrstvy. Lézie nepresahujú subchondrálnu kosť. Môžu byť prítomné vydutiny, pľuzgiere chrupky (Obr. 6)
Obr. 6. ICRS klasifikácia izolovaných defektov chrupky – stupeň 3, defekt presahuje 50 % hrúbky chrupky, nepresahuje subchondrálnu kosť 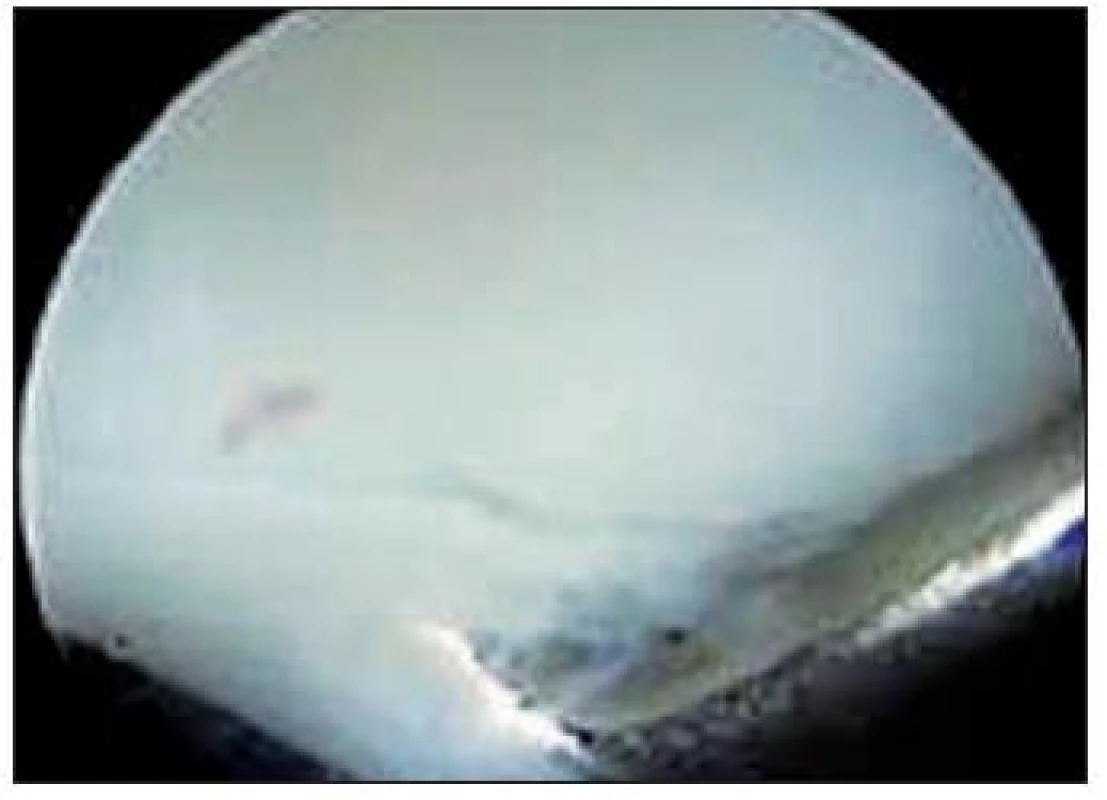
Stupeň 4: Ťažko abnormálny povrch – lézia sa šíri do subchondrálnej kosti (Obr. 7)
Obr. 7. ICRS klasifikácia izolovaných defektov chrupky – stupeň 4, ťažké poškodenie chrupky v celom rozsahu 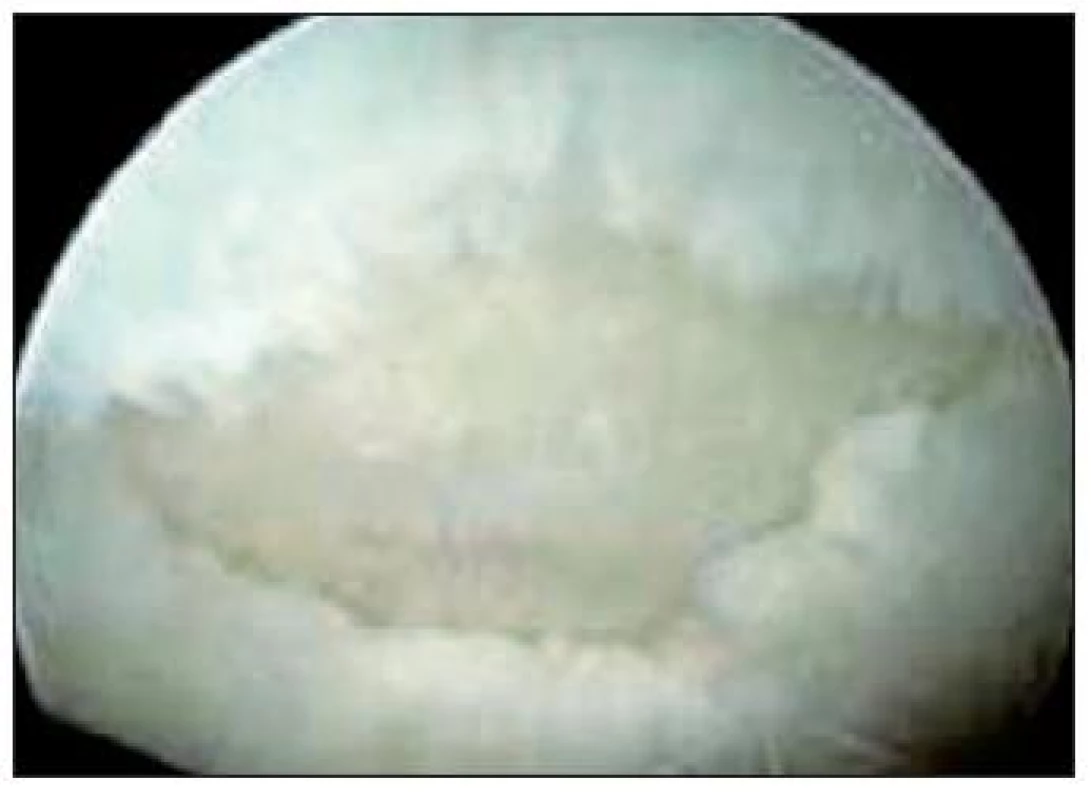
Diagnostika
Pri bolestiach kolenného kľbu, predovšetkým pri úrazoch a poraneniach kolenného kľbu anamnéza predstavuje základný článok v diagnostike. Úrazové poškodenie chrupky vzniká pôsobením priamych, alebo nepriamych síl. Priamym (direktným) mechanizmom vznikajú na chrupke defekty hviezdicového tvaru. Väčšina defektov vzniká pôsobením nepriameho násilia, alebo na podklade mikrotraumatizácie. K najčastejším prejavom chondrálneho poranenia patria:
- bolesť (väčšinou sa zvýrazňuje pri záťaži v flexii kolenného kľbu, vtedy dochádza k prenosu záťažových síl na defekt),
- hemartros – krvný výron do kľbu (najčastejšou príčinou hemartrosu je však roztrhnutie predného skríženého väzu, zriedkavejšie meniskov a chrupky. Pri obnažení subchondrálnej kosti je v kľbe krv s tukovými kvapôčkami), opuch kľbu vzniká v chronickom štádiu ako reaktívna synovitída, vzniká uvolnením degradačných produktov z poranenej chrupky.
Súčasťou klinického vyšetrenia je posúdenie osi končatiny, testy na stabilitu kolenného kľbu (valgózny a varózny stresový test k posúdeniu pevnosti kolaterálnych väzov, zásuvkové testy, lachmanov a pivot – shift test k posúdeniu pevnosti krížnych väzov), testy na poškodenie meniskov a vyšetrenie pately. Súčasťou každého vyšetrenia je RTG (AP projekcia v plnej extenzii, laterálna snímka a snímka na patelofemorálne skĺbenie (eventuálne dlhé snímky zo zachytením bedrá a členka). Na posúdenie závažnosti postihnutia chrupky sa používa MRI vyšetrenie, avšak podľa randomizovaných štúdii senzitivita tohto vyšetrenia je 45–60 %, zvyšuje sa pri ťažších postihnutiach chrupky. Nenahraditeľným preto ostáva artroskopické vyšetrenie, pri ktorom je možné okrem diagnostiky lézie, túto aj primárne respektíve definitívne ošetriť. Podľa výsledku následne stanoviť ďalší priebeh liečby a prognózu (3, 4).
Indikácie liečby
Nie všetky defekty chrupky sú indikáciou na operačné riešenie, preto je dôležité dôkladné vyšetrenie a presné určenie príčiny bolestí kolena. Operačné ošetrenie defektu chrupky vzniklé v dôsledku chronického preťaženia (napríklad pri uhlovej deformite kľbu), vedie iba k dočasnému a čiastočnému efektu. V takomto prípade je optimálnym riešením prevedenie osteotómie súbežne s výkonom na chrupke. Veľa defektov chrupky vzniká v kombinácii s poranením meniskov a väzov. V týchto prípadoch je nutné ošetriť aj ostatné poranené vnútrokľbne štruktúry.
Neoperačná liečba je indikovaná hlavne pri poškodení patelofemorálnej chrupky. Dôkladná rehabilitácia trvajúca od 3 do 6-tich mesiacov, podporená znížením váhy, aktívnym pohybom, patelofemorálnym posilňovaním, má veľmi dobré výsledky. U starších pacientov pár rokov pred implantáciou totálnej endoprotézy kolenného kľbu je indikovaná intraartikulárna injekčná terapia použitím steroidov eventuálne, viskosuplementačná liečba. Ak to nie je nevyhnutné vyhýbame sa operačnej liečbe chrupkových defektov u starších ľudí, pretože podľa štúdii je doba hojenia chrupky po týchto operáciách výrazne dlhšia ako doba hojenia po implantácii endoprotézy.
Operačné riešenie sa odporúča u pacientov s izolovaným poškodením kľbnej chrupky 2 až 4 stupňa, po pretrvávaní bolestí po vyčerpaní možností konzervatívnej liečby.
Kontraindikácie operačnej liečby
Kontraindikovaní k operácii sú pacienti s BMI nad 35 kg/m2, fajčiari, pacienti so prebiehajúcim zápalovým procesom v tele, so ťažkou deformáciou kolenného kľbu, s poškodením meniskov a laxicitouligamentózneho komplexu kolena (8, 9).
Jednotlivé metodiky ošetrenia poškodení kľbnej chrupky
Stimulácia kostnej drene:
MikrofraktúryStimulácia kostnej drene je jednou z najpoužívanejších metód na liečbu malých symptomatických defektov kľbnej chrupky kolena. Realizácia tejto techniky je pomerne jednoduchá a náklady sú oproti iným možnostiam nízke. Podstatou je perforácia subchondrálnej kosti (Obr. 8), čím dochádza k migrácii mezenchymálnych kmeňových buniek z kostnej drene do miesta poškodenia (10,11). Mezenchymálne bunky sú schopné diferencovať sa na fibrochondrocyty, čo prispeva k fibrokartiláginoznému hojeniu poškodeného miesta. Množstvo mezenchymálnych buniek je nízke a s pribúdajícim vekom pacienta sa ešte znižuje, práve preto je táto metodika vhodná skôr pre mladších pacientov . Veľmi dôležitou súčasťou hojenia je tvorba stabilného trombu, ktorá vyplňuje miesto chondrálneho defektu a súvisí s úspechom tejto procedúry (Obr. 9, 10).
Obr. 8. Stimulácia kostnej drene: Mikrofraktúry – podstatou výkonu je perforácia subchondrálnej kosti (reprodukcia z Mithoefer K, Williams RJ, Potter HG, et al. Chondral resurfacing of articular cartilage defects in the knee with microfracture technique. J Bone Joint Surg Am 2006, 88: 294–304) 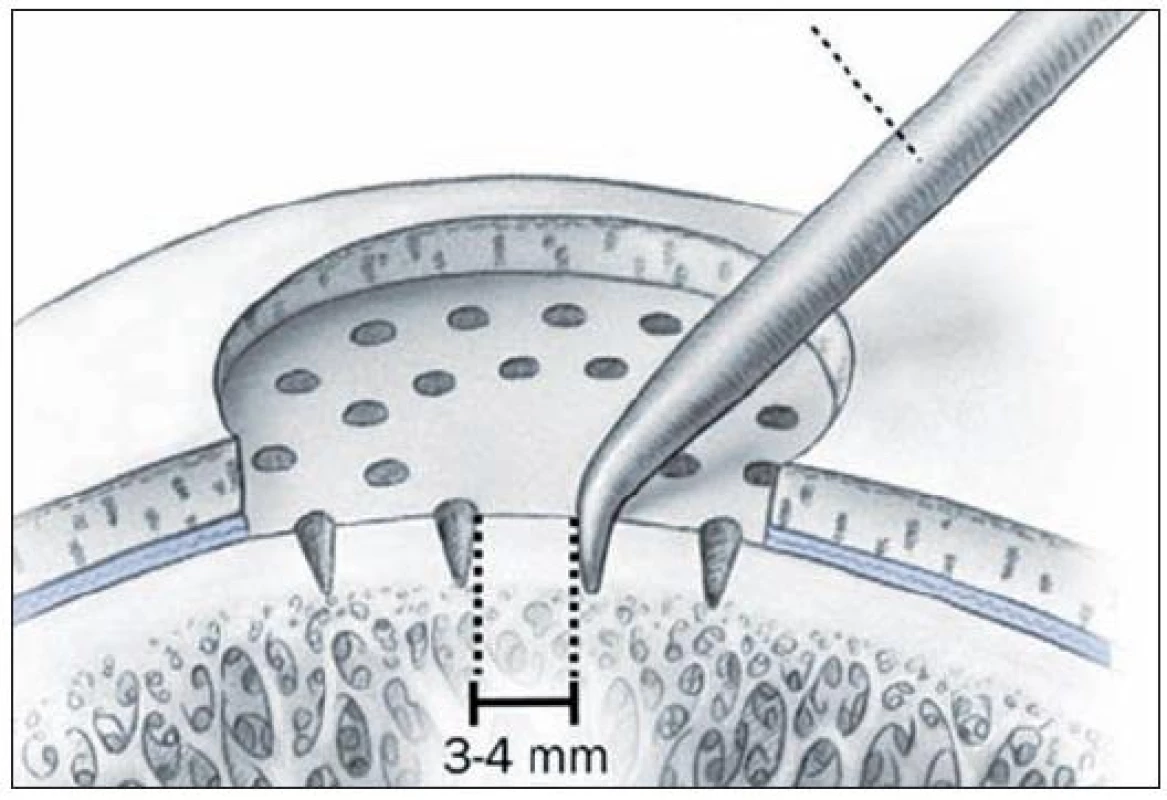
Obr. 9. Stimulácia kostnej drene: Mikrofraktúry – súčasťou peroperačnej prípravy je dôkladné obnaženie spodiny defektu (reprodukcia z Mithoefer K, Williams RJ, Potter HG, et al. Chondral resurfacing of articular cartilage defects in the knee with microfracture technique. J Bone Joint Surg Am 2006, 88: 294–304) 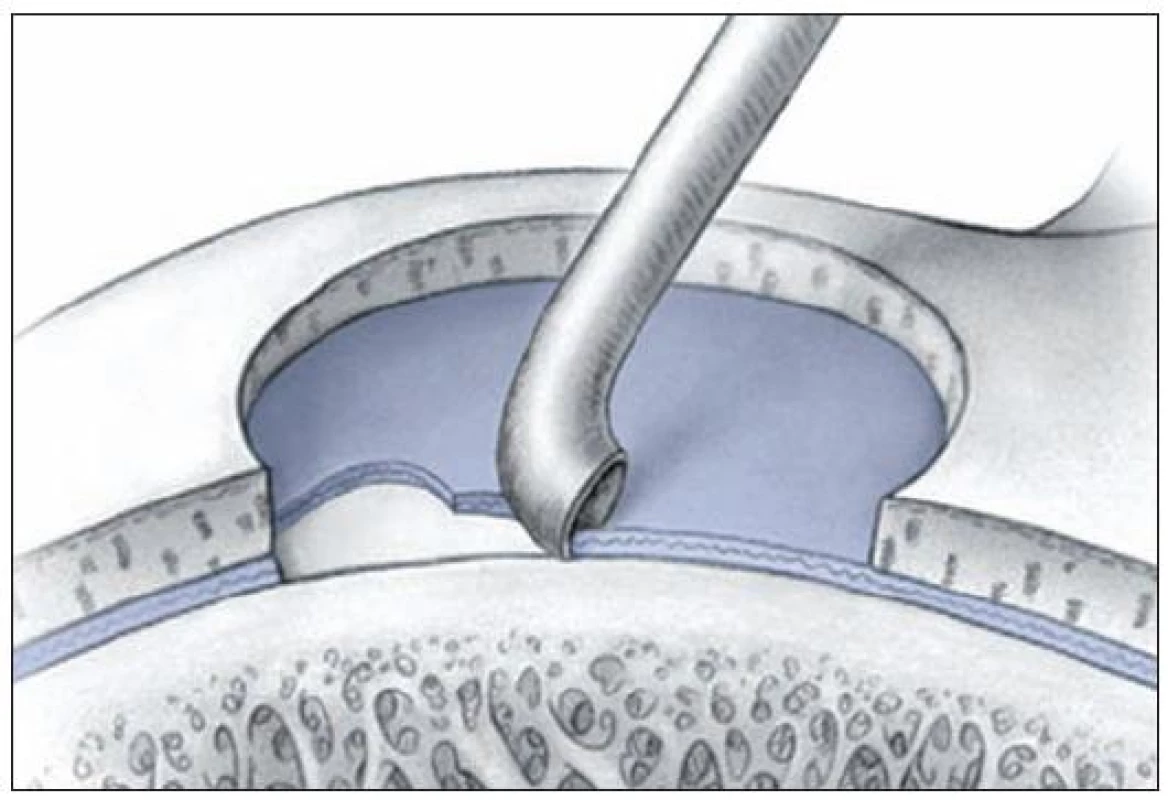
Obr. 10. Stimulácia kostnej drene: Mikrofraktúry – výsledok operácie v artroskopickom obraze 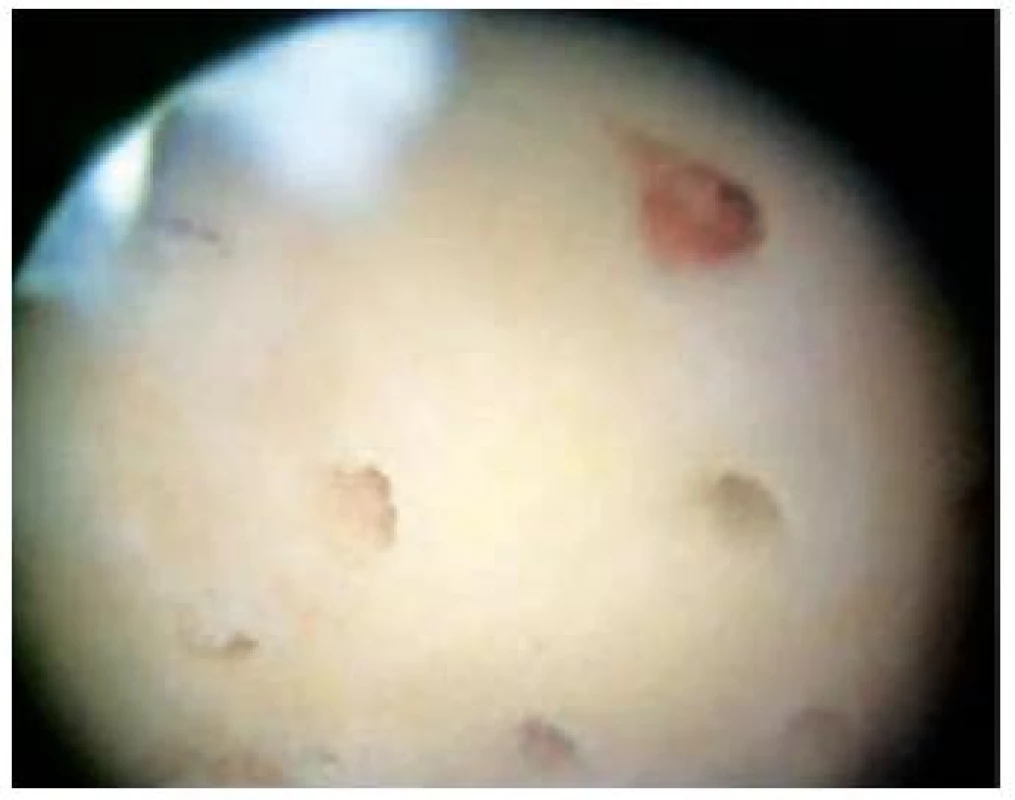
Dochádza k tvorbe reparačnej fibróznej chrupky, ktorá pozostáva z kolagénu typu I, II, III v rôznom zastúpení (11, 12). Obsahuje menej kolagénu typu II a nepodobá sa obklopujúcej hyalínnej chrupke. Pooperačný režim je náročný a závisí od neho výsledný efekt liečby. Pri poškodení femorálneho kondylu je odporúčaná pasívna flexia do 60° po dobu 6 týždňov od operácie (13, 14).
V súčasnej dobe sú skúšané prípravky na zvýšenie stability vytvoreného trombu v mieste poškodenia a podpora stimulácie kostnej drene. Používajú sa rastové faktory, ktoré pôsobia ako biologický augment pri in vivo ošetrení kľbnej chrupky.
Inzulinu – podobný rastový faktor aplikovaný do fibrínovej zátky v chondrálnom defekte podporuje kvalitu aj kvantitu hojenia reparačného tkaniva chrupky a redukuje percento pooperačných zápalových komplikácií (15).
Doštičkový rastový faktor je ďaľši potencinálny mitogén pre mezenchymálne bunky, ktorý má podľa štúdií sľubné výsledky pri stimulácii tvorby hyalínnej chrupky a proliferácii chondrocytov (16, 17). Tretím prípravkom v súčasnej dobe relatívne často požívaným sú preparáty s obsahom kyseliny hyalurónovej – viskosuplementačná liečba.
Plazma s vysokým obsahom trombycytov (platelet rich plasma, PRP)
Je definovaná ako koncentrát autológnych ľudských trombocytov v malom množstve plazmy. Biologické vlastnosti PRP sú založené na účinku viacerých rastových faktorov, ktoré sa uvoľňujú z aktivovaných trombocytov. Tieto faktory majú kľúčovú úlohu v regulácii a stimulácii procesu hojenia a regenerácie rôznych tkanív. Dokážu ovplyvňovať mitotickú aktivitu, chemotaxiu, diferenciáciu a proliferáciu cieľových buniek.
Plazma s vysokým obsahom trombocytov (získava sa centrigugáciou séra pacienta) sa používa na liečbu širokého spektra muskuloskeletárnych porúch. Výhoda týchto autológnych krvných produktov spočíva vo vysokej koncentrácii trombocytov a množstva asociovaného doštičkového rastového faktora a iných mitogénnych faktorov, ktoré podporujú hojenie chondrálnych lézií (18, 19).
V súčasnosti je dokázané, že TGF-ß (transforming growth factor beta), FGF (fibroblast growth factor) a BMPs (bone morphogenetic proteins), dokážu efektívne podporiť regeneráciu chrupky (18, 20).
Prenosy celých tkanív
Autológna osteochondrálna mozaikoplastika (používaná aj pod názvom OATS – osteoartikular tranfer system) je efektívnou metódou na znovuobnovenie krytu osteochondrálnych defektov kolenného kľbu. Technika spočíva v transplantácii zväčša viacerých malých cylindrických autogénnych osteochondrálnych valčekov odobratých z menej zaťažovaných periférnych častí kľbneho povrchu femorálneho kondylu a ich následná aplikácia na miesto osteochondrálneho poškodenia s cieľom dosiahnuť kongruentné a trvalé obnovenie kľbneho povrchu na postihnutom mieste (21). (Obr. 11)
Obr. 11. Autológna osteochondrálna mozaikoplastika – technika spočíva v transplantácii viacerých malých cylindrických autológnych osteochondrálnych válčekov 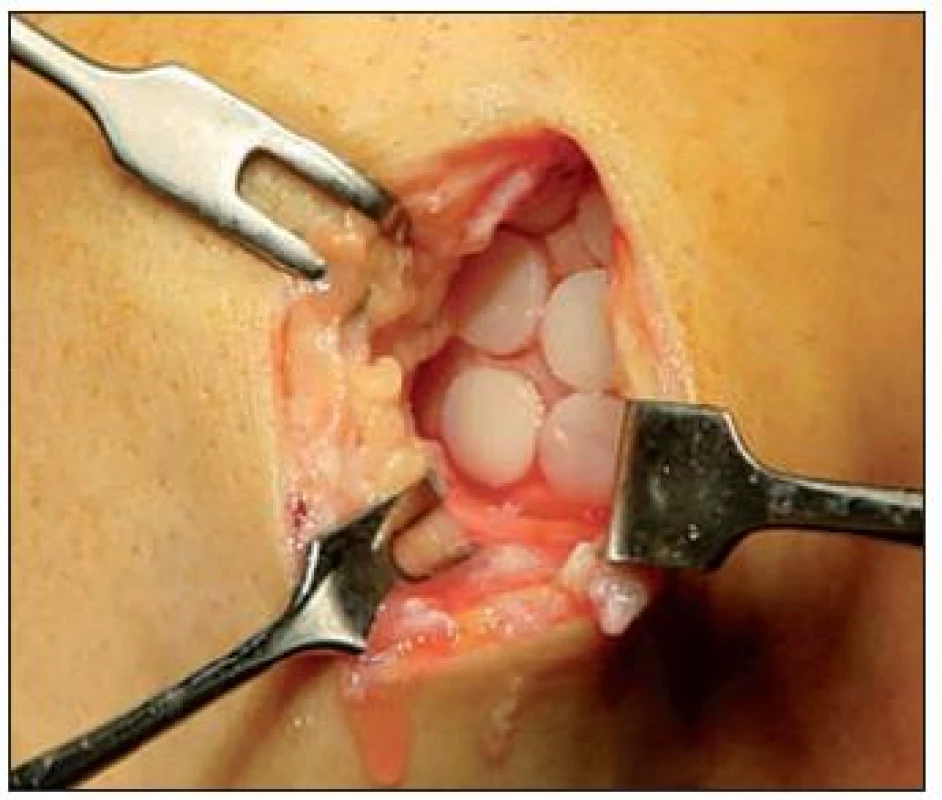
Táto metóda má v porovnaní z ostatnými niekoľko výhod:
- transplantuje sa vitálna hyalinná chrupka,
- relatívne krátka doba rehabilitácie,
- možnosť vykonať túto procedúru v jednom sedení.
Limitáciou metódy je morbidita odberového miesta, dostupnosť transplantátu, ktorý môže byť odobratý len z patelofemorálneho kľbu a interkondylárneho priestoru. (Obr. 12, 13) Iné potencionálne limitácie sú problémy s orientáciou v kolene, stenčenie chrupky, zlé mechanické vlastnosti chrupky.
Obr. 12. Autológna osteochondrálna mozaikoplastika – odberové miesto 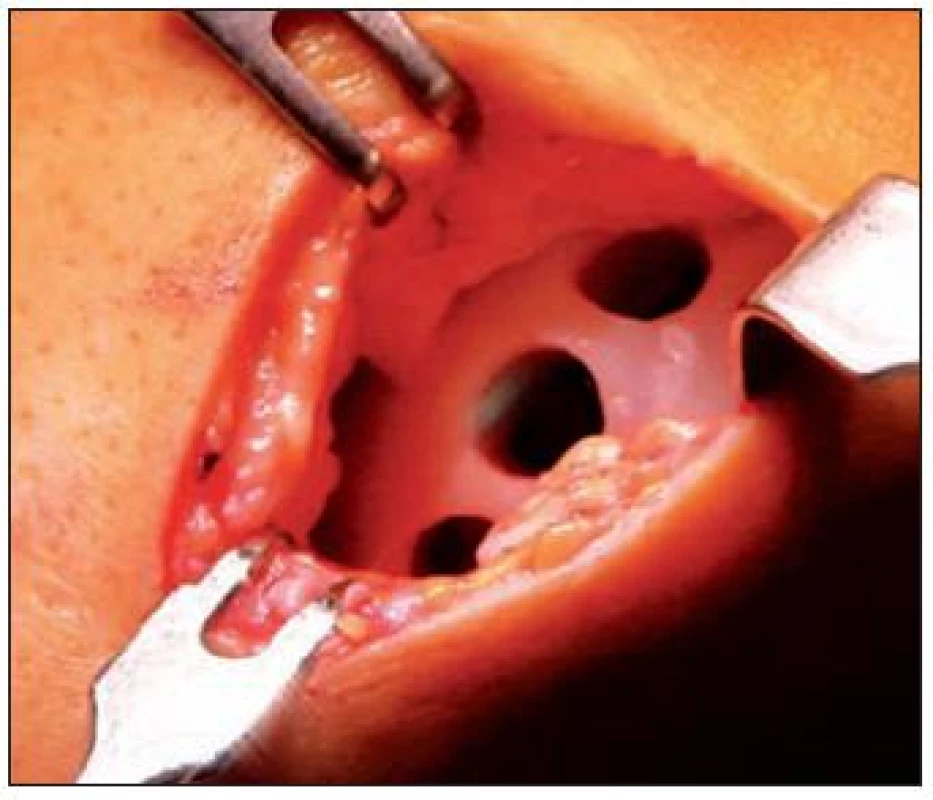
Obr. 13. Autológna osteochondrálna mozaikoplastika – technika odberu a schématické znázornenie odberových miest. (Reprodukcia z Hangody L, Ráthonyi GK, Duska Z, et al. Autologous osteochondral mosaicoplasty. Surgical technique. J Bone Joint Surg Am 2004, 86, Suppl 1: 65–72) 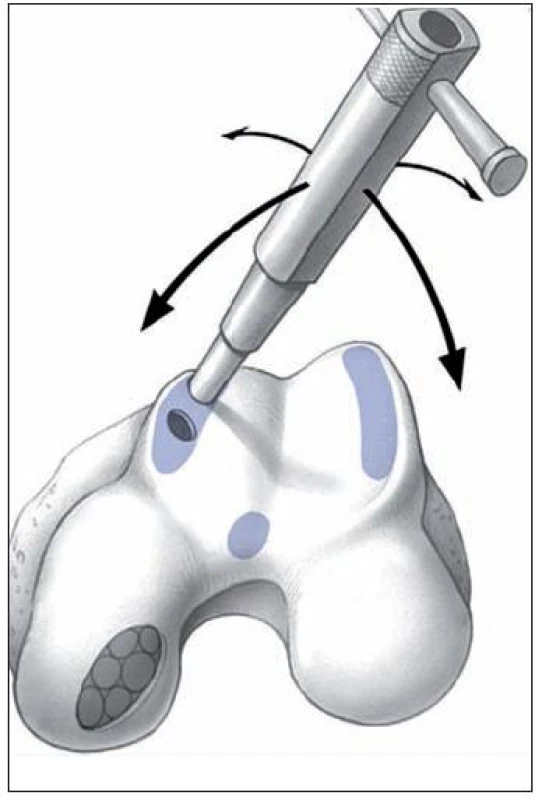
Neúplné vyplnenie defektu, eventuálne voľný priestor medzi jednotlivými valčekmi môžu negatívne ovplyvniť kvalitu a integritu výplne. Biomechanická stabilita valčekov po autológnej transplantácii je dôležitá a závisí od viacerých technických faktorov. Podľa experimentov dochádza ku kostnej integrácii zhruba za 4 týždne. Dôležitým momentom pre hojenie a stabilitu transplantátu je press-fit mechanizmus pri aplikácii valčekov. Valčeky s rovnakou dľžkou sú výrazne stabilnejšie ako krátke valčeky, medzi ktorými pôsobia cirkumferenčné trecie sily a zabezpečujú stabilitu. Táto stabilita je oslabená u početných konfigurácii valčekov, kde medzery medzi valčekmi a okolitou kosťou redukujú trecie sily (22).
Transplantácia osteochondrálneho alloštepu
Podstatou je prekrytie defektu v chrupke kadaveróznym transplántátom – zdravou intaktnou kľbnou chrupkou, spolu so subchondrálnou kosťou. Veľkosť, hrúbka a miesto defektu u príjemcu sú faktormi ovplyvňujúcimi odber štepu. Výhodou tejto procedúry je možnosť obnovenia povrchovej architektúry chrupky priamo transplantáciou zdravej hyalinnej chrupky v jednom sedení a možnosť nahradiť pomerne rozsiahly defekt až po náhradu hemikondylu a súčasne neovplyvnenie morbidity darcu. Pri použití veľkého osteochondrálneho štepu nevzniká voľný priestor medzi štepom a okolitou chrupkou ako pri autológnej mozaikoplastike. Limitáciou je ťažká dostupnosť štepov, vysoké náklady, riziko imunologickej rejekcie, nekompletná inkorporácia štepu, prenos rôznych chorôb a technické možnosti hlavne správny výber a veľkosť štepu (23).
Alloštep sa môže implantovať ako čerstvý, čo naráža na nemalé technické a organizačné problémy, alebo sa môže uchovať spracovaním v tkanivovej banke – zmrazením, čo však znižuje vitalitu tkaniva (24).
Implantácia autológnych chondrocytov
Metóda bola popísaná v roku 1994 ako inovatívna technika riešenia chondrálnych defektov (26), ktoré postihujú celú hrúbku chrupky. (Obr. 14) Teoretickou výhodou implantácie autológnych chondrocytov je tvorba chrupky, ktorá je veľmi podobná hyalínnej, oproti tvorbe fibróznej chrupky u iných metód, s dlhodobým lepším efektom. Hoci v súčasnej dobe nie je používanie tejto metódy ničím limitované, procedúra zahŕňa minimálne dve operácie, jednu na odber tkaniva a druhú na implantáciu chondrocytov. (Obr. 15, 16) Okrem toho ide o technicky veľmi náročnú metódu a boli popísané komplikácie s periostálnymi štepmi.
Obr. 14. Rozsiahly chondrálny defekt postihujúci celú hrúbku chrupky lokalizovaný v nosnej časti mediálneho kondylu femoru 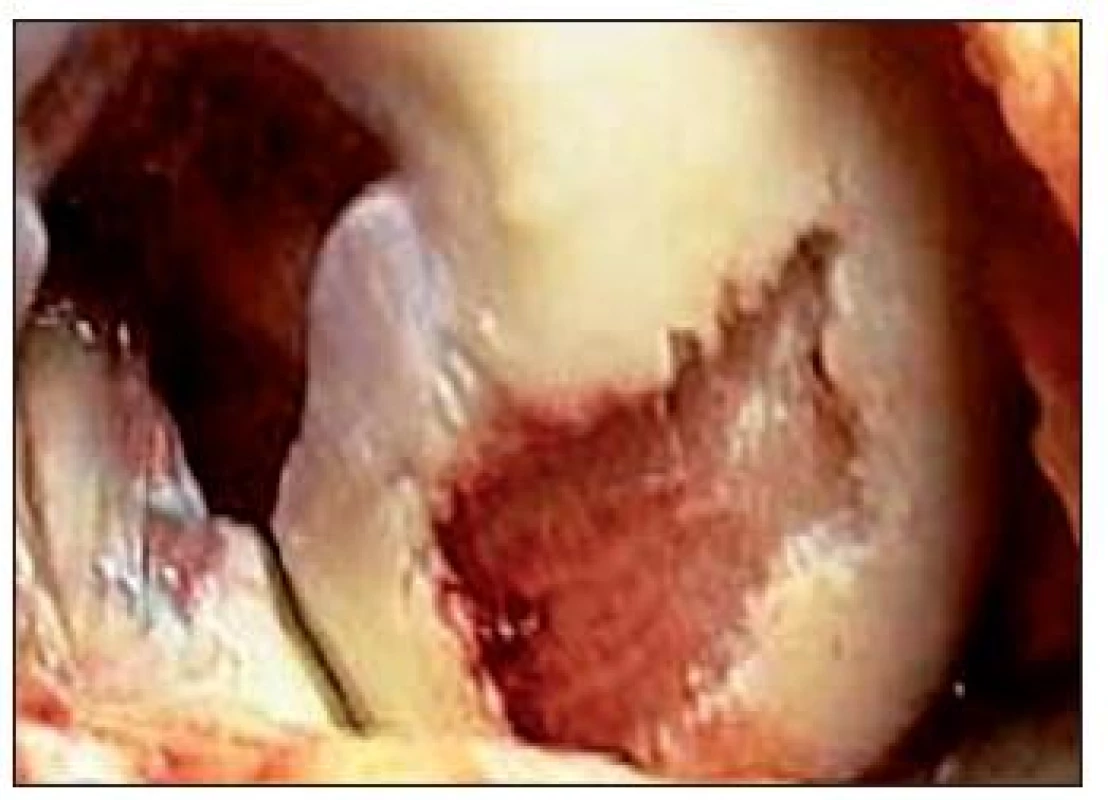
Obr. 15. Implantácia autológnych chondrocytov – operačná technika 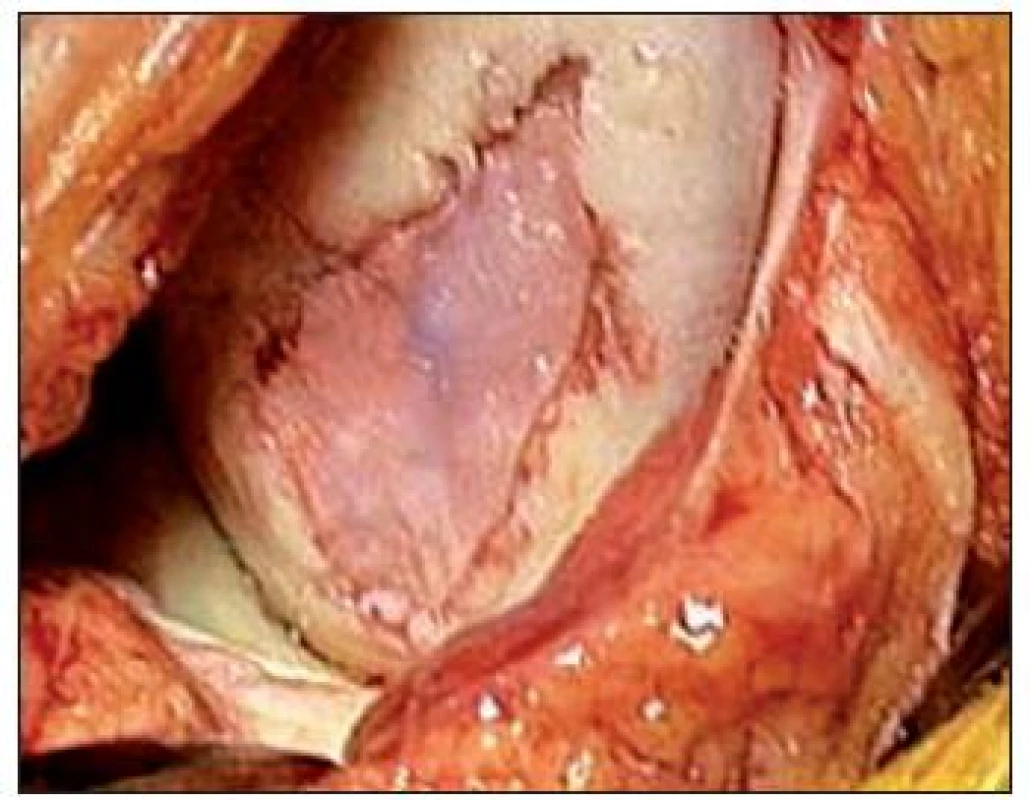
Obr. 16. Implantácia autológnych chondrocytov – operačná technika, prekrytie defektu 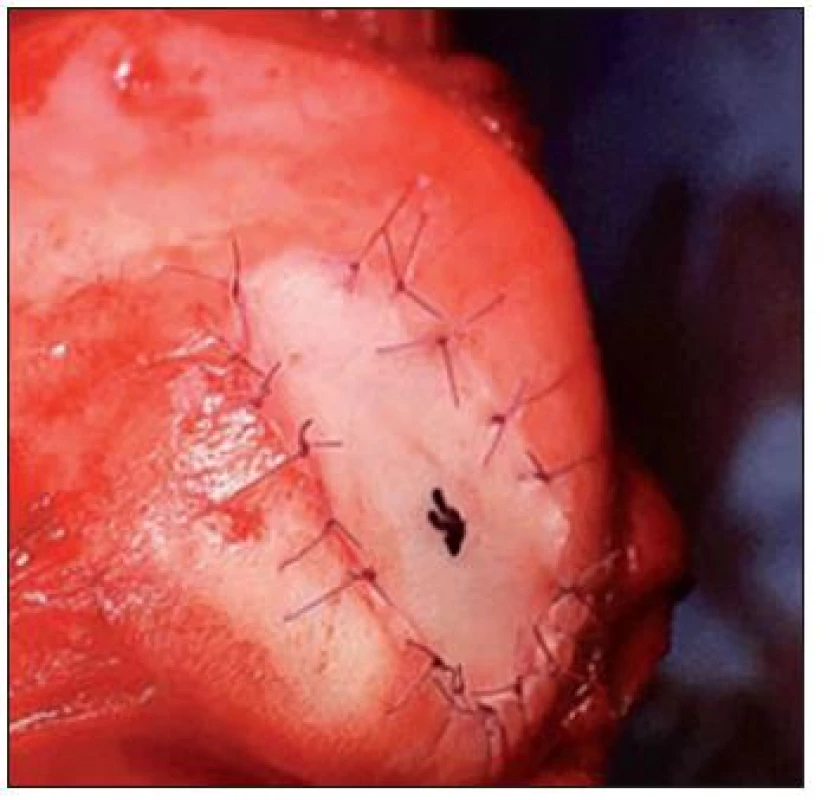
Bunkové metódy a metódy s použitím biologických nosičov
Terapeutické možnosti ošetrenia chrupky s použitím buniek, ako autológna implantácia chondrocytov zaznamenali progres, avšak výsledky ešte do značnej miery nie je možné predpovedať. Limitáciou je, že ide o dvojdobú procedúru, technicky náročnú, a nemožnosť podporiť bunky v pooperačnej fáze hojenia a inkorporácie.
Metódy druhej generácie. V predimplantačnom období sa odobraté vzorky aplikujú na vstrebateľné nosiče, ktoré podporujú bunky a zlepšujú fázu hojenia. Základnými podmienkami nosičov je ich biokompatibilita a biodegradabilita cestou bezpečnej biomechanickej cesty a v primeranom čase.
Tieto metodiky zahŕňajú implantáciu nielen chondrocytov, ale aj kolagénovej matrix a hovoríme o matrix asociovaných implantáciách chondrocytov. Pomnožené autológne alebo allogénne chondrocyty sú inkorporované do prasačej kolagénovej membrány typu I/III. Jedna strana membrány má relatívne vysoký obsah kolagénnych vlákien, ktoré vytvárajú hladký povrch s nízkym trením, kým druhá má povrch hrubý, pre obsah dutín medzi kolagénnymi vláknami, ktoré umožňujú usídlenie chondrocytov. Výhodou metódy je rovnomerná distribúcia buniek na implantáte, vyhnutie sa odobratiu respektíve impantácii štepu z periostu, ľahšie technické prevedenie bez potreby sutúry implanátu k okolitej kľbnej chrupke (28).
Hoci odber týchto chondrocytov sa nijak nelíši od predošlých metód, metóda minimalizuje morbiditu darcu vyhnutím sa odberu a implantácie periosteálneho štepu, bráni dediferenciácii chondrocytov počas kultivácie a umožňuje artroskopickú implantáciu . Nosičom môže byť aj kyselina hyaluronová a v poslednom čase sa vyvíjajú aj kolagénové membrány vytvorené tkanivovým inžinierstvom.
Záver
Liečba chondrálnych defektov a poškodení chrupky ešte stále nie je optimálne vyriešená. Žiadna z popísaných operačných techník neprináša ideálne riešenie, ktoré by umožnilo obnoviť komplexnú štruktúru a funkciu kľbnej chrupky. Metodiky využívajúce tkanivové inžinierstvo a tkanivové banky sú extrémne drahé a nie všade dostupné. Pacient chce čo najrýchlejší návrat do normálneho života a športu a na to ortopéd potrebuje to, čo zatiaľ nemá - metodiku lacnú, ľahko dostupnú, spoľahlivú, technicky jednoduchú, ktorá by obnovovala chrupku ad integrum. Uvidíme, čo prinesie budúcnosť.
MUDr. Peter Polan
Ortopedické oddelenie
1. súkromná nemocnica a.s.
Košice-Šaca
Lúčna 57
Slovenská Republika
E-mail: peterpolan@yahoo.com
Zdroje
1. Buckwalter, J.A., Mankin, H.J. Articular cartilage I. Tissue design and chondrocyte-matrix interactions. J Bone Joint Surg 1997, 79A(4): 600–611.
2. Buckwalter, J.A., Martin, J.A., Mankin, H.J. Synovial joint degeneration and the syndrome of osteoarthritis. Instr Course Lect, 2007, 49 : 481–489.
3. Višňa, P., Hart, R. a kol. Chrupavka kolena. Praha: Maxdorf, 2006.
4. Dungl, P. a kol. Ortopedie. Praha: Grada, 2005, 978–992.
5. Šteňo, B., Šeliga, J. Farmakologická liečba osteoartrózy. Ambulantná terapia, 2008, 6 : 164–168.
6. Kokavec, M., Novorolský, K., Bdžoch, M. Pohľad ortopéda na komplexnú liečbu artróz. Ambulantná terapia, 2005, 3 : 26–28.
7. Simon, T.M., Jackson, D.W. Articular cartilage: injury pathways and treatment options. Sports Med Arthrosc. 2006; 14 : 146–154.
8. Bedi, A., Feeley, B.T., Williams, R.J. Management of articular cartilage defects of the knee. J Bone Joint Surg Am, 2010, 92 : 994–1009.
9. Brittberg, M., Imhoff, A., Madry, H., Mandelbaum, B. (Eds.) Cartilage repair-current concepts. Guildford, UK: DJO Publications, 2010.
10. Williams, R.J. III. Cartilage repair strategies. Totowa, NJ: Humana Press, 2007.
11. Frisbie, D.D., Trotter, G.W., Powers, B.E., et al. Arthroscopic subchondral bone plate microfracture technique augments healing of large chondral defects in the radial carpal bone and medial femoral condyle of horses. Vet Surg. 1999, 28 : 242–255.
12. Bae, D.K., Yoon, K.H., Song, S.J. Cartilage healing after microfracture in osteoarthritic knees. Arthroscopy 2006, 22 : 367–374.
13. Frisbie, D.D., Morisset, S., Ho, C.P., et al. Effects of calcified cartilage on healing of chondral defects treated with microfracture in horses. Am J Sports Med. 2006, 34 : 1824–1831.
14. Steadman, J.R., Briggs, K.K., Rodrigo, J.J., et al. Outcomes of microfracture for traumatic chondral defects of the knee: average 11-year followup. Arthroscopy 2003, 19 : 477–484.
15. Fortier, L.A., Nixon, A.J., Lust, G. Phenotypic expression of equine articular chondrocytes grown in three-dimensional cultures supplemented with supraphysiologic concentrations of insulin-like growth factor-1. Am J Vet Res, 2002; 63 : 301–305.
16. Kieswetter, K., Schwartz, Z., Alderete, M., et al. Platelet derived growth factor stimulates chondrocyte proliferation but prevents endochondral maturation. Endocrine, 1997, 6 : 257–264.
17. Lohmann, C.H., Schwartz, Z., Niederauer, G.G., et al. Pretreatment with platelet derived growth factor-BB modulates the ability of costochondral resting zone chondrocytes incorporated into PLA/PGA scaffolds to form new cartilage in vivo. Biomaterials, 2000, 21 : 49–61.
18. Sun, Y., Feng, Y., Zhang, C.Q., et al. The regenerative effect of platelet-rich plasma on healing in large osteochondral defects. Int Orthop, 2010, 34(4): 589–597.
19. Akeda, K., An, H.S., Okuma, M., et al. Platelet-rich plasma stimulates porcine articular chondrocyte proliferation and matrix biosynthesis. Osteoarthritis Cartilage, 2006, 14 : 1272–1280.
20. Lacko, M., Tóthová, T., Rosocha, J., a kol. Liečba osteoartrózy kolenného kľbu intraartikulárnou aplikáciou autológnej plazmy bohatej na trombocyty. Ortopedie, 2010, 4 : 251–257.
21. Lane, J.G., Massie, J.B., Ball, S.T., et al. Follow-up of osteochondral plug transfers in a goat model: a 6-month study. Am J Sports Med, 2004, 32 : 1440–1450.
22. Hangody, L., Vásáhelyi, G., Hangody, L.R., et al. Autologous osteochondral grafting-technique and long-term results. Injury, 2008; 39, Suppl 1: S32–39.
23. Bugbee, W.D. Fresh osteochondral allografts. J Knee Surg, 2002; 15 : 191–195.
24. Bakay, A., Csönge, L., Papp, G., Fekete, L. Osteochondral resurfacing of the knee joint with allograft. Clinical analysis of 33 cases. Int Orthop, 1998, 22 : 277–281.
25. Beaver, R.J., Mahomed, M., Backstein, D., et al. Fresh osteochondral allografts for post-traumatic defects in the knee. A survivorship analysis. J Bone Joint Surg Br, 1992, 74 : 105–110.
26. Brittberg, M., Lindahl, A., Nillson, A., et al. Treatment of deep cartilage defects in the knee with autologous chondrocyte transplantation. N Engl J Med, 1994, 331 : 889–895.
27. Kish, G., Hangody, L. A prospective, randomised comparison of autologous chondrocyte implantation versus mosaicplasty for osteochondral defects in the knee. J Bone Joint Surg Br, 2004, 86 : 619.
28. Gikas, P.D., Aston, W.J., Briggs, T.W. Autologous chondrocyte implantation: where do we stand now? J Orthop Sci, 2008, 13 : 283–292.
Štítky
Praktické lékařství pro děti a dorost Praktické lékařství pro dospělé
Článek vyšel v časopisePraktický lékař
Nejčtenější tento týden
2012 Číslo 6- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Magnosolv a jeho využití v neurologii
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
-
Všechny články tohoto čísla
-
Základy kognitivní, afektivní a sociální neurovědy
XIX. Mozek a stres - Poranenia kľbnej chrupky kolenného kľbu a možnosti jej reparácie
- Metalothionein a jeho role v detoxikaci těžkých kovů a predispozici k chorobám
- Hypertenze, spánek a syndrom obstrukční spánkové apnoe
- Vek ako potenciálny faktor ovplyvňujúci patologické ukazovatele a prognózu ochorenia u pacientov s karcinómom obličky
- Budúcnosť nanotechnológie v medicíne a stomatologii
- Vztah konzumace alkoholu a kouření cigaret
- Prevence návykových nemocí v rodině
- Informovaný souhlas u seniorů v dlouhodobé péči
- Mezinárodní výzkum problematiky paliativní péče u pacientů s demencí
- Porovnání péče soukromých a ambulantních porodních asistentek
- Primární zdravotní péče novou kategorií impaktovaných časopisů databáze Journal Citation Reports
- Přírodovědecké, literární a lékařské tradice Faustova domu
-
Miniportréty slavných českých lékařů
Tošovský Václav – dětský chirurg a ortoped - Jedničkou nejen české neurochirurgie
- Jubilea
-
Základy kognitivní, afektivní a sociální neurovědy
- Praktický lékař
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Poranenia kľbnej chrupky kolenného kľbu a možnosti jej reparácie
-
Základy kognitivní, afektivní a sociální neurovědy
XIX. Mozek a stres - Vztah konzumace alkoholu a kouření cigaret
- Metalothionein a jeho role v detoxikaci těžkých kovů a predispozici k chorobám
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



