-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaSyndrom Guillain-Barré Specifika intenzivní péče, možnosti terapeutického využití plazmaferézy a naše zkušenosti
Guillain-Barré syndrome. Specific features of intensive care, potential for therapeutic use of plasmapheresis, and our experience
Guillain-Barré syndrome (GBS) is a group of autoimmune diseases consisting of demyelinization forms and axonal degenerative forms. The individual subtypes can be distinguished using electrophysiological investigation, particularly by conduction studies. The disease is usually preceded by infection by some known pathogen triggering an autoimmune-based cross-reaction affecting peripheral nerve tissue. The patient develops symmetrical muscular weakness persisting for some time, with subsequent progressive improvement of the condition, usually with complete recovery without any sequels. The risk of death with the severe forms is associated primarily with dysautonomy and respiratory failure requiring mechanical lung ventilation. It is particularly these most severe cases which require comprehensive intensive care. Management involves specific immunomodulatory therapy with therapeutic plasmapheresis or intravenous immunoglobulin administration, combined with supportive therapy including mechanical lung ventilation, required by about one in ten patients. The review includes our own experience with the management of severe GBS in the authors’ department.
Key words:
Guillain-Barré syndrome, mechanical lung ventilation, plasmapheresis, intravenous immunoglobulin.
Autoři: R. Zazula
; T. Řezáč; J. Cihlář
Působiště autorů: Přednosta: MUDr. Roman Zazula Ph. D. ; Anesteziologicko-resuscitační klinika 1. LF UK a FTNsP, Praha
Vyšlo v časopise: Prakt. Lék. 2008; 88(10): 582-588
Kategorie: Z různých oborů
Souhrn
Guillain-Barrého syndrom (GBS) je skupina autoimunitních onemocnění skládajících se z forem demyelinizačních a forem axonálně degenerativních. Jednotlivé podtypy mohou být rozlišeny elektrofyziologickým vyšetřením především kondukčními studiemi. Onemocnění obvykle předchází infekce některým ze známých patogenů, která spustí zkříženou reakci na autoimunitním podkladě, postihující periferní nervovou tkáň. U nemocného se rozvine symetrická svalová slabost, která určitou dobu přetrvává, a posléze dochází k pozvolnému zlepšování stavu s obvykle úplnou úpravou bez následků. Riziko úmrtí u těžkých forem je spojeno především s dysautonomií a respirační insuficiencí s potřebou umělé plicní ventilace. Obzvláště tyto nejtěžší případy onemocnění vyžadují komplexní intenzivní péči. Terapie se skládá ze specifické imunomodulační terapie léčebnou plazmaferézou nebo podání intravenosního imunoglobulinu a dále z podpůrné léčby včetně umělé plicní ventilace, kterou vyžaduje přibližně desetina nemocných. Přehledný referát uvádí i vlastní zkušenosti s léčbou těžké formy GBS na pracovišti autorů.
Klíčová slova:
Guillain-Barrého syndrom, umělá plicní ventilace, plazmaferéza, intravenózní imunoglobulin.Úvod
Guillain-Barrého syndrom (GBS) postihuje pacienty na celém světě ve všech věkových kategoriích. Poprvé byl popsán Landrym v roce 1859 a následně Guillainem, Barrém a Strohlem v roce 1916.
GBS je heterogenní skupina akutních autoimunitních periferních polyneuropatií a v rozvinutých zemích patří mezi nejčastější příčinu chabé svalové paralýzy. Je charakterizován akutním začátkem s rychlou progresí během 2 týdnů, svalovou slabostí, sníženými až vymizelými šlachookosticovými reflexy, proteinocytologickou disociací v likvoru a spontánní úpravou u většiny nemocných. V minulosti vzhledem k nejčastější příčině – demyelinizaci periferních nervů – byl pokládán za synonymum akutní zánětlivé demyelinizační polyneuropatie (AIDP – acute inflammatory demyelinating polyradiculoneuropathy). To dokládaly studie Asburyho z roku 1969, prokazující infiltraci myelinu periferních nervů zánětlivými buňkami. V roce 1991 se zjistilo, že se jedná o skutečně heterogenní skupinu onemocnění a skutečný syndrom (tab. 1). Studie z Shijizuangu v Číně prokázaly primární axonální poškození u akutní motorické axonální neuropatie (AMAN – acute motor axonal neuropathy). Dále se rozlišuje akutní motorická a senzitivní axonální neuropatie (AMSAN – acute motor sensory axonal neuropathy), Miller-Fisherův syndrom (MFS) a akutní panautonomní neuropatie.
Tab. 1. Varianty GBS – volně dle Newswangerové (22) 
Patogeneze a patofyziologie
Všechny varianty GBS jsou autoimunitními onemocněními, jejichž podstatou je patologická imunitní reakce proti jednotlivým částem periferního nervu.
U AIDP jde o multifokální zánětlivé demyelinizační postižení periferních nervů, kterého se účastní jak humorální, tak buněčné faktory, antigangliosidové protilátky a aktivované T-lymfocyty, následně pak napadení myelinové pochvy a membrány Schwannových buněk makrofágy. Výsledkem je zánět a lokalizovaná demyelinizace periferního nervového systému v oblasti kořenů, plexů, nervů, některých hlavových nervů i autonomních vláken. Tyto lokalizované oblasti demyelinizace vedou ke zpomalení či přerušení vedení periferním nervem v závislosti na tíži postižení nervu.
U akutních axonálních forem AMAN a AMSAN je patologický proces odlišný, dochází k imunitnímu napadení gangliosidových antigenů axolemy. Makrofágy infiltrují Ranvierovým zářezem nebo oblastí nervových zakončení mezi axon a myelinovou pochvu, která sama zůstává intaktní, a dochází k axonální lézi. Podle poškození izolovaně motorických, či současném napadení motorických i senzitivních axonů se pak dělí na jednotlivé varianty. Existují též teorie o těžším patologickém a klinickém projevu AMSAN pramenícího ze stejného imunopatologického základu. U MFS je patofyziologický proces nejasný, vzhledem k nemožné biopsii dané části autonomního nervového systému. Uvažuje se o významné roli protigangliosidových IgG protilátek (8).
Epidemiologie a rizikové faktory
GBS je relativně vzácné onemocnění s incidencí 1–3 případy na 100 000 obyvatel za rok. Postihuje více muže než ženy, častěji starší (špička výskytu je v adolescenci a ve stáří), postihuje celosvětově všechny rasy. AIDP je v 90 % příčinou GBS v Evropě, Severní Americe a Austrálii, naproti tomu v severní Číně jde 60–80 % případů na vrub AMAN a typicky postihuje děti a mladší dospělé jedince, v Japonsku je vyšší výskyt MFS.
Určité předcházející onemocnění, takzvaný spouštěč, lze detekovat u asi 70 % případů vzniku GBS. Obvykle se jedná o respirační infekt či gastroenteritidu předcházející rozvoji klinických symptomů GBS 1–3 týdny (maximálně až 6 týdnů). Etiologicky je vztah k následnému vzniku GBS připisován některým bakteriím (Campylobacter jejuni, Mycoplasma pneumoniae, Borrelia Burgdorferi), virům (chřipka, hepatitida, EBV, CMV, HIV) či vakcinaci (chřipka). Žádné z těchto infekcí nevedou k specifickému rozvoji konkrétní varianty GBS, kromě úzké souvislosti mezi gastroenteritidou vyvolanou C. jejuni a axonálními formami GBS, vyskytujícími se endemicky v Číně.
Klinické projevy a diagnostika
Průběh GBS je uniformní a lze jej rozdělit na čtyři hlavní fáze
- předcházející fáze (spouštěč);
- progresivní fáze;
- fáze plató;
- odeznívání příznaků.
Hlavními příznaky jsou svalová slabost, parestézie a snížené šlachookosticové reflexy.
V úvodu jsou nemocní vcelku v dobrém stavu bez výraznějších systémových příznaků. Latentní období předcházející fáze od spouštěcí infekce k rozvoji symptomů periferního nervového sytému trvá obvykle 2–3 týdny. Iniciální neurologické příznaky se liší pacient od pacienta. Obvykle počínají parestéziemi distálně na prstech, chodidlech a patách (ve více jak 50 % případů), a šíří se proximálně, obvykle však nepřesáhnou úroveň zápěstí a kotníků. Obličejové parestézie, zejména periorální, jsou méně časté.
V postupující progresivní fázi dochází obvykle několik dní po objevení se parestézií k rozvoji svalové slabosti, typicky nejdříve na dolních končetinách (vzestupná forma – 56 %). Nemocný v této fázi obtížně vstává ze židle, či mu činí problémy chůze po schodech, slabost se pak šíří na horní končetiny – ascendentní progrese. Méně frekventně slabost začíná na všech končetinách současně (32 %) ale může začínat i na horních končetinách u descendentní formy (12 %). Slabosti jsou symetrické, obličejové svaly jsou postiženy často, naopak okohybné svaly s výjimkou MFS zůstávají ušetřeny.
Dalšími častými příznaky jsou snížení citlivosti a bolesti, myalgie hlubokých svalů, obzvláště v oblasti zadních stehenních svalů, zad a ramenního pletence u přibližně 50 % postižených a jsou výraznější v noci. Progrese onemocnění trvá obvykle dva až čtyři týdny (v 98 % případů) (14).
Formy onemocnění jsou velmi variabilní, kromě různého rozsahu motorického postižení končetin dochází při postižení hlavových nervů k bulbárnímu syndromu, oboustrannému postižení faciálního nervu (faciální diplegie). K postižení respiračních svalů s rozvojem respirační insuficience vyžadující umělou plicní ventilaci (UPV), dochází až v 10 % případů.
V klinickém obraze nacházíme také projevy autonomní dysfunkce, nejčastěji u nemocných s výraznějším motorickým deficitem, a tudíž těžšími formami GBS. Projevem dysautonomie bývají poruchy srdečního rytmu (bradykardie i tachykardie, nejčastěji sinusová, snížená odpověď na masáž karotického sinu), hypertenze (může být časným projevem), posturální hypotenze jako důsledek snížení vaskulárního tonu, hypotenze, poruchy motility GIT (gastroparéza, ileózní stavy), močová retence. K dalším možným autonomním poruchám, již mnohem méně častým, patří například bronchokonstrikce, zvýšení bronchiální sekrece, snížené pocení, začervenání kůže, diabetes insipidus či Hornerův syndrom (20).
Ke kategorizaci motorického deficitu a hodnocení výsledků léčby byly vyvinuty nejrůznější skórovací systémy, nejvíce je užíváno a obecně akceptováno Hughesovo skóre, které rozděluje pacienty podle míry postižení motorických nervových funkcí do 6 stupňů (tab. 2).
Tab. 2. Hughesovo skóre závažnosti motorického deficitu u GBS 
Diagnóza GBS vychází z anamnézy, klinického nálezu, elektrofyziologického vyšetření a likvorového nálezu. V objektivním nálezu nacházíme symetrický neurologický deficit, snížené či vymizelé šlachookosticové reflexy. Areflexie je zpravidla generalizovaná a obvykle následuje několik dní po nástupu svalové slabosti (ale může i předcházet). Poruchy čití jsou oproti tomu nepravidelné a nepříliš těžké, nejčastěji ve formě postižení propriocepce a čití vibrace (modality přenášené silnými myelinovými vlákny). V některých případech může porucha vyústit do senzorické ataxie a pseudoathetosy.
Elektrofyziologické nálezy mají v diagnostice GBS dominantní roli, především v časném stadiu, ukazující známky demyelinizace. Hlavně kondukční studie EMG jsou senzitivní již v prvních dvou týdnech a taktéž slouží k určení typu GBS. U AIDP dochází ke zpomalení rychlosti či bloku vedení, prodloužení latence či absence F odpovědi (pozdní komponenta v testu proximálního úseku nervu, je vyvolána antidromním vedením impulzu po motorických vláknech) a prodloužení distální motorické latence. U AMSAN jsou senzorické akční potenciály pod dolní hranicí normy u senzitivních kondukčních studií. Normální nálezy EMG mohou mít až 2 % pacientů, i u ostatních nemocných mohou chybět jejich změny v časném stádiu (2).
Tab. 3. Diagnostická kriteria GBS – dle Asburyho a Cornblatha (3) 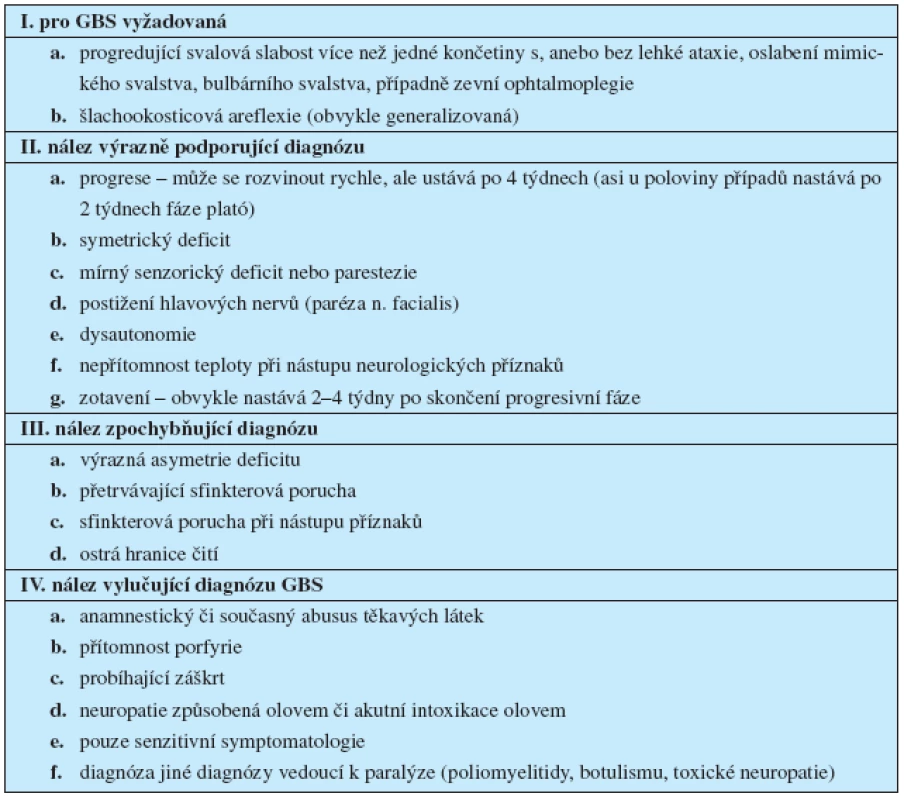
Likvorový nález je typický – proteinocytologická disociace s hyperproteinorhachií (nad 0,5 g/l) při normálním počtu elementů (obvykle nepřevyšuje 10/mm3, zřídka může být lehká pleocytóza 10–20/mm3). V časném stádiu může být likvorový nález normální, takže elektrofyziologický nález má v úvodu větší specificitu a senzitivitu.
Diferenciální diagnóza
Přestože je GBS nejčastější akutní generalizovanou periferní polyneuropatií, může být zaměněna za řadu jiných onemocnění, obzvláště v úvodních fázích onemocnění. Ropper a spol. například uvádí až 50 nozologických jednotek, které musí být vzaty v potaz v diferenciální diagnostice GBS (23). Klinická rozvaha musí být komplexní s ohledem na předchozí onemocnění a řadu možných jiných akutních poruch (tab. 4). Například při anamnéze předchozího pobytu v tropech či rozvojových zemích je třeba myslet na možnosti otravy hadím jedem či jedem z jedovatých ryb, dále vzteklinu, poliomyelitidu, záškrt. Dále toxické neuropatie – intoxikace například těžkými kovy, především subakutní otrava arzénem nebo thaliem. Zde v iniciálních fázích nacházíme obdobný likvorový a EMG nález, a diagnosticky je bereme v potaz obzvláště při předchozím záchvatu gastroenteritidy.
Tab. 4. Diferenciální diagnóza GBS (8, 16) 
Neuropatie u vaskulitid mohou příležitostně imponovat jako GBS. Nicméně u nich bývají přítomny systémové příznaky, především teploty. V neurologickém nálezu bývá postižení smíšené motorické i senzitivní, distální a především asymetrické. Obvykle nedochází k postižení hlavových nervů a respiračním komplikacím. Likvorový nález je normální (kromě systémového lupus erytematodes), při elektrofyziologickém vyšetření je nález typické axonální léze.
Akutní intermitentní porfyrie může vyvolat poruchu periferního nervového systému podobnou GBS. Nástup potíží však bývá delší a bývají v podstatě standardně nálezy bolestí břicha, obstipace a alterace psychických funkcí. Motorický deficit obvykle začíná na horních končetinách, ztráta senzorické funkce je obvykle proximálně. Nález proteinů v likvoru je v normě, elektrofyziologické nálezy svědčí pro axonální lézi, nikoliv demyelinizaci. V moči je významný nález porfobilinogenu a kyseliny aminolevulové při akutní atace onemocnění.
Botulismus je postižení alimentární, které může simulovat klinické příznaky nalézané u GBS. Předcházejí gastrointestinální příznaky a v průběhu postižení obvykle zácpa. Rozmazaný vizus, sucho v ústech, ptoza, mydriasa bývají velmi častým nálezem. Svalová slabost sestupuje z bulbární oblasti, takže postižení krční oblasti a respiračního svalstva často dominují ve srovnání s postižením končetin. Senzorický deficit je vzácný a nález likvorový v normě.
Diferenciálně diagnosticky je třeba pomýšlet i na funkční poruchy, jako např. hysteroidní reakce. Dochází k ní obvykle u pacientů s anamnézou psychiatrického onemocnění.
U nemocných v kritickém stavu, především v sepsi a s multiorgánovým selháním, je obvyklou příčinou svalové slabosti polyneuromyopatie kriticky nemocných. Rozvíjí se akutně, ale elektrofyziologické vyšetření neprokazuje známky multifokální demyelinizace (jedná se o axonální neuropatii) a likvorový nález je normální (20).
U chronické formy onemocnění – chronické zánětlivé demyelinizační polyneuropatie (CIDP – chronical inflammatory demyelinating polyradiculoneuropathy) klinické příznaky progredují minimálně 2 měsíce (chronicko-progresivní forma) či jsou přítomny opakované recidivy (recidivující forma).
Terapie a specifika intenzivní péče
Terapeutický přístup můžeme rozdělit na léčbu podpůrnou a specifickou:
Podpůrná terapiezůstává základem, protože u většiny nemocných dochází ke spontánní reparaci funkcí po akutní atace onemocnění. Většina autorů považuje za plně indikované pacienty s podezřením na GBS hospitalizovat nezávisle na tíži poruchy v úvodu onemocnění, a to s ohledem na možné riziko rychlé progrese postižení vedoucí k respirační insuficienci. Velké snížení mortality v posledních dekádách je dáno právě rozvojem možností umělé plicní ventilace, která tuto fázi překlene. Současná publikovaná léčebná doporučení obsahují důraz na monitoraci nemocného a obecné postupy podpůrné léčby.
Kromě monitorace ventilace je třeba sledovat postižení hlavových nervů a vegetativní dysautonomii – monitorace krevního tlaku vzhledem k objevujícím se těžkým hypertenzím či naopak ortostatickým hypotenzím, EKG k zachycení arytmií, sledování gastrointestinální pseudoobstrukce (riziko vzniku ileózního stavu a bakteriální translokace) a retence moči (17).
Dysautonomie komplikuje zvláště některé výkony, jako tracheální intubaci s podáním suxamethonia, a obecně manipulace s dýchacími cestami (odsávání z hypofaryngu a tracheobronchiálního stromu). Je zvýšené riziko závažných arytmií až srdeční zástavy.
Dále je podpůrná terapie cílena k prevenci sekundárních komplikací – tromboembolické nemoci, která se objevuje asi u 5 % imobilizovaných nemocných, spočívá v podávání frakcionovaného heparinu subkutánně a bandážích dolních končetin (8). V prevenci stresového vředu je doporučeno podání inhibitorů protonové pumpy, je nutná prevence infekčních komplikací (nejvíce močových infekcí, obzvláště při derivaci moči zavedeným močovým katétrem) a dekubitů náležitou ošetřovatelskou péčí (16).
Laboratorní vyšetření je cíleno na sledování vnitřního prostředí nemocného, častá je hyponatremie při syndromu inadekvátní sekrece ADH (antidiuretického hormonu). U pacientů s bulbárními příznaky pak důraz klademe na enterální výživu, podávanou žaludeční sondou, případně zavedení gastrostomie. Specifický význam samozřejmě má intenzivní rehabilitace, včetně rehabilitace dechové, péče o expektoraci a toaletu dýchacích cest inhalační terapií mukolytiky.
V podpůrné léčbě GBS nelze opomíjet léčbu možné bolesti a psychických poruch nemocného. Bolest se vyskytuje v 30–70 % případů a často může být úporná. Vhodné je použití běžných nesteroidních analgetik – antiflogistik, ale často je potřeba sáhnout k podání účinnějších opioidních analgetik. Fyzikální a fyzioterapeutické postupy, jako masáže měkkými technikami, pasivní metody rehabilitace (k zabránění tvorby kontraktur a udržení mobility kloubů), aplikace střídavě teplých a studených obkladů na končetiny, časté změny polohy, mívají rovněž dobrý efekt.
Respirační insuficience je nejvážnější komplikací a vysvětluje potřebu přibližně desetinu hospitalizovaných s GBS umístit na „ventilovaném“ lůžku intenzivní péče. Obvykle jsou na pracoviště intenzivní péče přijímání nemocní se skórem 4 a více dle Hughese. Tito pacienti jsou navíc indikování k léčbě specifickou terapií (viz níže), která sama o sobě ospravedlňuje uložení pacienta na JIP. Ve snaze objektivizovat důvody přijetí na JIP se vedle klinických příznaků hodnotí i elektrofyziologické vyšetření amplitudy kondukčního motorického akčního potenciálu (CMAP). Hodnoty nižší než 20 % dolní hranice fyziologické amplitudy jsou významným predikčním faktorem morbidity a mortality.
Slabost respiračních svalů, hlavně bránice, je dominujícím důvodem rozvoje respirační insuficience. Nepříznivým faktorem je bulbární postižení jako příčina plicních komplikací – atelaktázy a pneumonie. Respirační funkce hodnotíme vyšetřením arteriálních krevních plynů (hyperkapnie), měřením maximálního výdechového proudu při usilovném exspiriu a vitální kapacity plic. Ačkoliv retence CO2 je obvyklou známkou selhání mechaniky ventilace u respirační insuficience, u nemocného s GBS hyperkapnie se zvýšením paCO2 může být pozdním ukazatelem při plicní hypoventilaci (14). Normální vitální kapacita plic (VC) je v rozmezí 45–65 ml/kg. Při poklesu pod 45 ml/kg se stává kašel slabším a méně efektivním v odstraňování sekretu z dýchacích cest. Zde může napomoci fyzioterapie hrudníku a dechová rehabilitace spolu s odsáváním sekretu.
Při poklesu VC pod 30 ml/kg dochází ke kolapsu periferních alveolů, ventilačně perfúznímu nepoměru, zvýšení žilní příměsi, a tím k poklesu parciálního arteriálního tlaku kyslíku paO2. V plicích se rozvíjí atelaktáza, zvyšuje se dechová práce, zvyšuje se únava pacienta. Tracheální intubace je obvykle indikována při poklesu VC pod 20 ml/kg, či při poklesu maximálního expiračního tlaku pod 30 cm H2O. Jako další prediktory endotracheální intubace a potřeby mechanické ventilace literatura uvádí:
- doba od nástupu GBS po přijetí do nemocnice kratší než sedm dní;
- neschopnost nadzvednout lokty či hlavu nad podložku;
- neschopnost stoje bez opory;
- nedostatečný kašlací reflex;
- elevace jaterních enzymů.
Tracheostomie je obvykle indikována v období 7.–10. dne od intubace při trvání potřeby zajištění dýchacích cest pro umělou plicní ventilaci nebo dostatečnou toaletu dýchacích cest. Může být provedena chirurgicky či perkutánně, dilatační technikou.
Specifická terapie – plazmaferéza a podání intravenózního imunoglobulinu
Ze specifické imunomodulační terapie, vyhrazené pro těžší formy GBS, jsou v klinických podmínkách akceptovány dva postupy:
- první možností je od roku 1978 používaná léčebná plazmaferéza,
- druhou podání intravenózního imunoglobulinu (IVIG).
Indikačními kritérii jsou zpravidla neschopnost samostatné chůze bez dopomoci, bulbární syndrom a rychlá progrese onemocnění. V úvahu bereme i rizikové faktory, které predikují horší prognózu – viz tab. 5. Oba způsoby léčby jsou cíleny na humorální složku imunity jako významný patogenetický faktor onemocnění.
Tab. 5. Faktory predikující horší prognózu GBS – volně dle Amblera a van Koningsvelda (2, 15) 
Léčebná plazmaferéza
Plazmaferéza je mimotělní eliminační metoda již dlouhá desetiletí používaná v léčbě různých typů onemocnění. Historicky se její indikace postupně měnily a v současné době je její užití omezeno na úzký počet stavů, u nichž je považována za léčbu volby nebo součást kombinované standardní terapie. K těmto stavům patří
- glomerulonefritida s protilátkami proti bazální membráně,
- trombotická trombocytopenická purpura,
- myastenia gravis, a konečně
- akutní a chronické demyelinizující polyneuropatie.
V některých indikacích – kryoglobulinémie, idiopatická trombocytopenická purpura a revmatoidní artritida – je plazmaferéza akceptována jako podpůrná nebo adjuvantní terapie k terapii kauzální. Z dalších, ne zcela obecně uznávaných sporných indikací, lze uvést například septický šok s multiorgánovou dysfunkcí nebo paraproteinémii při myelomu.
Příznivý terapeutický efekt plazmaferézy je přičítán eliminaci potenciálně patologických součástí plazmy, mezi něž patří autoprotilátky, cirkulující imunokomplexy, cytokiny nebo toxiny. Dalším předpokládaným mechanismem léčby plazmaferézou je posílení efektivity clearance retikuloendotelového systému nebo stimulace lymfocytárních klonů s příznivým dopadem na buněčnou imunitu. Náhrada plazmy pacienta plazmou dárcovskou je principem léčby plazmaferézou u deficitů některých plazmatických faktorů.
Technické aspekty plazmaferézy zahrnují invazivní vstup do krevního řečiště, přístroj mimotělního oběhu s pumpou pro krev a substituční roztok, plazmafiltr nebo odstředivku a antikoagulaci. Principem léčby je separace plazmy a krevních elementů a náhrada odebrané plazmy substitučním roztokem. Při každé terapeutické kůře by měl být separován zhruba kompletní objem plazmy z krevního oběhu pacienta (cca 40 ml/kg) a nahrazen stejným objemem substitučního roztoku. K separaci plazmy jsou běžně užívány dvě metody vycházející ze dvou odlišných fyzikálních principů.
- Centrifugace krve, tedy její odstředění na jednotlivé komponenty podle specifické hmotnosti. Tato laboratorní metoda je dnes běžně užívána na transfuzních stanicích k přípravě krevních derivátů.
- Druhou metodou je membránová filtrace s použitím kapilárových polopropustných membrán s definovanou velikostí otvorů o průměru 0,2–0,6 mikronů, umožňující průtok plazmy a zadržující krevní buněčné elementy – viz obr. 1. Plazmaferéza membránovou filtrací tvoří převážnou část léčebné výměny plazmy v klinických podmínkách. K jejímu provedení jsou vhodné přístroje běžně užívané k intermitentním i kontinuálním mimotělním eliminačním technikám.
Obr. 1. Schéma mimotělního okruhu membránové plazmaferézy 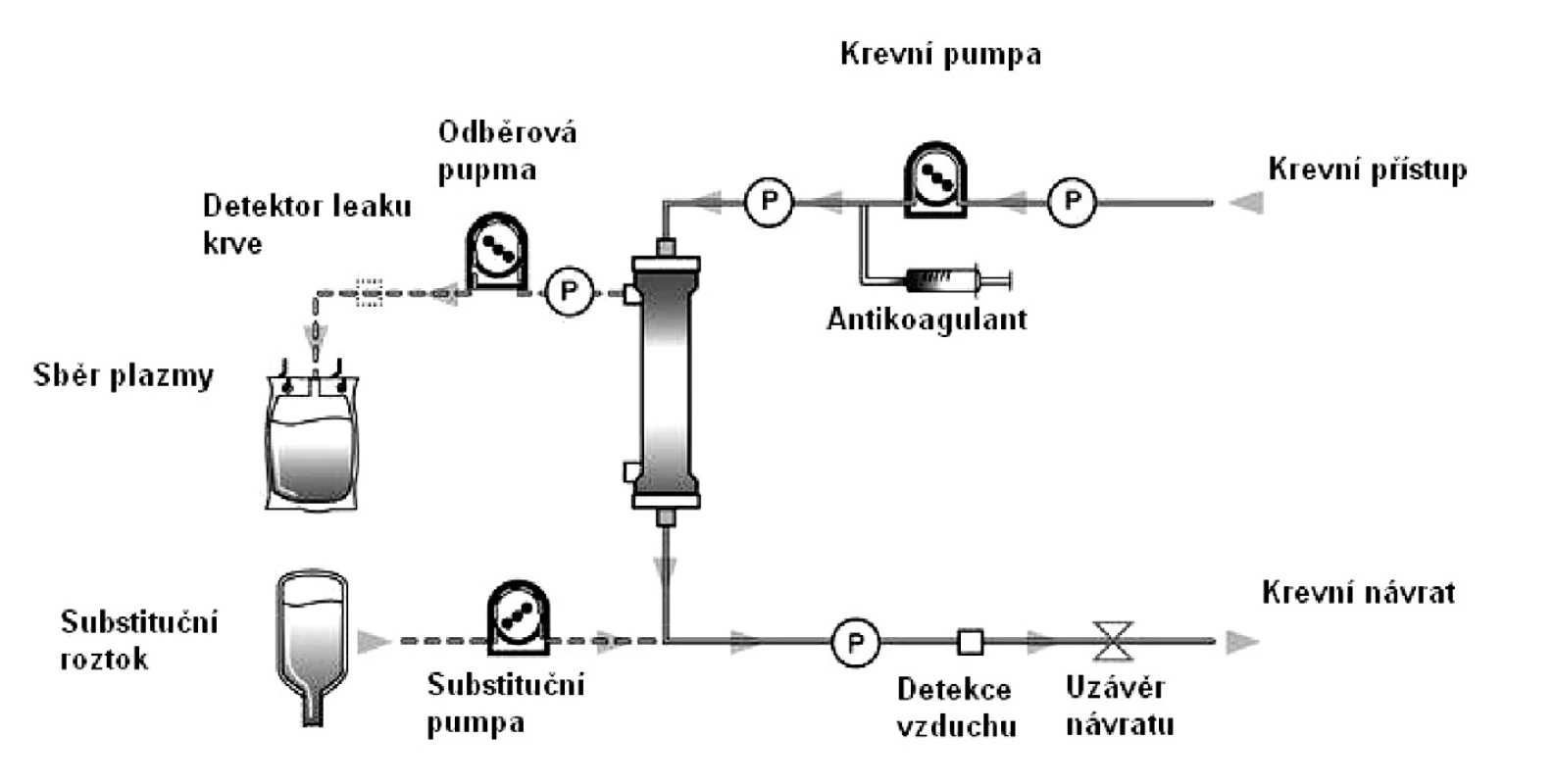
K zajištění cévního přístupu je užívána dvojcestná hemodialyzační kanyla zavedená do centrálního žilního řečiště. Antikoagulace je nejčastěji zajištěna systémovou heparinizací. Doporučena je kontrola účinnosti antikoagulace u lůžka vyšetřením aktivovaného času srážení ACT (Activated clotting time). Každý plazmafiltr vyžaduje doporučené parametry antikoagulace ve vztahu ke krevnímu průtoku filtrem. Ten se pro plazmaferézu pohybuje v rozpětí 80–250 ml/min. s ohledem na oběhovou toleranci pacienta.
K náhradě odfiltrované plazmy se podává krystaloidní roztok (FR – fyziologický roztok nebo RL Ringer-laktát) a albumin (např. 20% albumin + RL v poměru 1 : 5) nebo lidská plazma.
Ke komplikacím a nežádoucím účinkům plazmaferézy patří komplikace obecně související s kanylací centrálního žilního řečiště včetně katetrových infekcí (0,2–0,4 % případů), poruchy koagulace (odstraněním koagulačních faktorů, fibrinogenu a aplikací antikoagulancií), komplikace vázané na podání substitučního roztoku.
U náhrady čerstvou zmraženou plazmou jsou komplikace (především infekční) stejné jako při jejím podání v jiných indikacích. Při použití substitučního roztoku albuminu s krystaloidem může dojít k hypotenzi, krvácivým komplikacím nebo i anafylaxi. Opakovaná plazmaferéza může mít imunosupresivní účinek způsobený deplecí imunoglobulinů s rizikem infekčních komplikací. Náklady na provedení plazmaferézy jsou vysoké a obsahují pořízení přístroje na filtraci, hemofiltrační okruhy a substituční roztoky. Taktéž personální nároky i náklady se v dnešní době zvyšují.
Většina autorů u GBS doporučuje celkovou výměnu plazmy 200–250 ml/kg rozděleně do 4–6 cyklů jednotlivých plazmaferéz v průběhu 7–10 dnů léčby u těžkých případů (17). Francouzská skupina zkoumající použití plazmaferézy u GBS prokázala i benefit dvou cyklů plazmaferézy u nemocných s lehčími až středně těžkými formami AIDP, zatímco těžké formy vyžadují až čtyři cykly (7).
Ačkoliv použití plazmaferézy nemá přímý vliv na mortalitu nebo četnost relapsů, nejméně u poloviny nemocných dochází k evidentnímu objektivizovatelnému zlepšení v řadě aspektů onemocnění. Ve srovnání s nemocnými neléčenými plazmaferézou fáze odeznívání příznaků nastupuje dříve a zlepšení nálezu v průběhu jednoho měsíce od vzplanutí GBS je prokazatelné. Taktéž je snížen počet nemocných vyžadujících umělou plicní ventilaci z důvodu respirační insuficience, délka pobytu na JIP i celková doba hospitalizace jsou kratší. Efekt plazmaferézy vzrůstá s časným zahájením léčby a je nejvyšší při zahájení plazmaferézy v prvním týdnu onemocnění. Účinnost je však prokazatelná ještě po zahájení do 30 dnů od počátku GBS u nemocných neschopných chůze bez dopomoci (13).
Intravenózní imunoglobuliny (IVIG)
Podání intravenózního imunoglobulinu (IVIG) bylo poprvé použito před více než 10 lety. Vzhledem k jednoduchosti podání, nižšímu výskytu nežádoucích účinků, a o něco většímu komfortu pro nemocného je některými autory indikováno podání IVIG jako léčba první volby. IVIG je doporučován pro nemocné, kteří jsou neschopni chůze bez dopomoci v rozmezí do dvou až čtyř týdnů od počátku neuropatie. Doporučovaná dávka 400 mg/kg/den po dobu 5 dnů byla prokázána jako statisticky stejně účinná ve srovnání s plazmaferézou (5 cyklů v rozmezí 5–8 dnů) na velké randomizované multicentrické studii 150 pacientů (21). Modulace imunitních funkcí se děje několika mechanismy zahrnujícími ovlivnění skupiny imunoglobulinů skupiny G (IgG), receptory makrofágů a B-lymfocytů. Patologické protilátky jsou vázány na IgG, a tím se zvyšuje jejich clearance. Navíc se zatím ne zcela jasným mechanismem zlepšuje funkce CD8+ lymfocytů.
Ani podání IVIG není prosto rizika. Vzhledem k expanzi plazmatického objemu je třeba opatrnosti u nemocných s městnavým srdečním selháním a renální insuficiencí. Mezi nežádoucí účinky kromě hypervolémie a hypertenze patří horečka, třesavka, erytém, myalgie, bolesti hlavy, neutropenie, aseptická meningitida a anafylaktická reakce. Riziko přenosu virových infekcí (např. hepatitidy, HIV) se v posledních letech s důkladnějším testováním dárců, změnou výroby a purifikace derivátů lidské plazmy snížilo.
U dětí s GBS je podání IVIG v posledních letech metodou volby, především proto, že není potřebné zavedení centrálního žilního katétru. V této skupině nemocných je také upřednostňována terapie ve 2 dnech při podání 1 g/kg/d, která u dětských pacientů může být efektivnější (14).
Obdobně jako u plazmaferézy je účinnost IVIG nejlepší při časném zahájení terapie, nejlépe do 2 týdnů od prvních příznaků. Metaanalýza studií Cochrane Database ukazuje, že efektivita terapie IVIG je stejná jako u plazmaferézy v případě urychlení odeznění příznaků GBS ve skupině nemocných neschopných samostatné chůze (12). V další multicentrické studii 380 pacientů publikované v Lancet 1997 nebyl prokázán benefit kombinace terapie plazmaferézou a IVIG, taktéž četnost relapsů onemocnění nebyla statisticky signifikantně rozdílná (10). Cena terapie IVIG je vysoká, ekonomická náročnost o něco vyšší než u plazmaferézy, i když při započítání všech nákladů spojených s plazmaferézou se cenové rozdíly spíše snižují.
Použití terapie kortikosteroidy v konvenčním dávkování se ukázalo jako neúčinné, některé studie dokonce prokázaly nepříznivý vliv použití adrenokortikotropního hormonu. Další studie srovnávající podání vysokodávkovaného metylprednisolonu v kombinaci s IVIG oproti terapii IVIG izolovaně, neprokázala žádný rozdíl ve výsledcích terapie.
Dle závěrů doporučení zprávy Quality Standarts Subcomitee of the American Academy of Neurology (2003), které přejímají i země Evropy, lze uvést:
- léčba plazmaferézou a i.v. imunoglobuliny zlepšuje prognózu pacientů s GBS;
- kombinace těchto dvou terapeutických postupů nemá efekt;
- léčba steroidy v monoterapii nemá efekt.
Léčebná doporučení jsou uvedena v tab. 6.
Tab. 6. Léčebná doporučení specifické terapie GBS 
Zotavení a prognóza
Ještě v roce 1953 Guillain tvrdil, že GBS je benigní, nikdy fatální onemocnění, které zanechává minimální, pokud vůbec nějaké následky. Tento optimismus nebyl však v následujících letech podpořen. Vyjma nemocných s nejmírnějšími formami onemocnění, většina pacientů je hospitalizována nejméně po dobu 1 měsíce a často déle, obzvláště při potřebě umělé plicní ventilace. Celkem 2–5 % pacientů na následky onemocnění zemře.
V rozsáhlé studii bezmála 5 tisíc nemocných v USA byla zjištěna mortalita 2,6 % (1). Mortalita 10–15 % je udávána u nemocných v intenzivní péči, nejčastěji na komplikace UPV a infekce. Ve skupině morbidit komplikujících UPV jednoznačně dominuje ventilátorová pneumonie – VAP (30–70 % u dlouhodobé UPV).
Zásady prevence vzniku VAP, její včasná diagnostika a terapeutický přístup včetně správně vedené antibiotické strategie a neoddalované odvykání od UPV, jsou u pacientů s GBS stejné jako u ostatních nemocných v intenzívní péči. Z infekčních komplikací je vedle plicních infekcí nejčastější katétrová sepse a infekce močových cest. Četnost komplikací souvisejících se specifickou léčbou GBS je v porovnání s ostatními zanedbatelná.
Průměrně 75 % nemocných se po GBS zotaví bez vážnějších neurologických následků a dochází k němu v období 6–12 měsíců od počátku onemocnění, maximálně do 18 měsíců. U některých pacientů může přetrvávat mírná svalová slabost, parestézie, nebo ztráta čití. Průměrně 7 až 15 % pacientů má trvalé vážnější neurologické následky (např. svalovou slabost dolních či horních končetin, senzorickou ataxii, bolestivé dysestézie). Naštěstí velmi málo pacientů zůstává v důsledku onemocnění upoutáno na lůžko.
Existují některé faktory, které se vztahují k horšímu zotavení. Patří k nim vyšší věk nemocného (přes 60 let věku), rychlý rozvoj symptomů vedoucí až ke kvadruparéze během jednoho týdne a již výše uvedené snížení CMAP v elektromyografickém vyšetření (1).
Relaps onemocnění se objevuje zřídka, přibližně u 3–5 % nemocných. Nebývá vztahován k určitému typu specifického terapeutického postupu GBS.
Řada záležitostí zůstává nadále u GBS nejasná. Jaký je například přesný iniciální mechanismus demyelinizace u AIDP? Vzhledem k počtu nemocných dlouhodobě imobilizovaných GBS je třeba vyvinout efektivnější terapii. Mohly by jí být specifické modulátory imunitního systému, jako třeba inhibitory cyklooxygenázy 2, aktivátory komplementu nebo farmaka podporující regeneraci myelinu nebo axonů.
Naše zkušenosti s intenzívní péčí o pacienty s GBS
Na anesteziologicko-resuscitační klinice bylo v období 5/2004 až 5/2008 hospitalizováno celkem 10 pacientů s diagnózou GBS, kteří vyžadovali intenzivní péči. Relativně nízký počet pacientů s těžkým průběhem onemocnění nedovoluje statistické hodnocení.
Přijato bylo 6 mužů a 4 ženy, průměrného věku 60,1 roku. Devět pacientů mělo stanovenou diagnózu GBS již v době přijetí na naše oddělení – jednalo se většinou o pacienty přijaté z Neurologické kliniky IPVZ a FTNsP, s níž v jejich léčbě úzce spolupracujeme. Jeden pacient v těžkém septickém šoku s multiorgánovým selháním byl přijat z terénu od služby RLP. Již v čase příjmu byl mechanicky ventilován. Po vyvedení ze šokového stavu a stabilizaci přetrvávala chabá kvadruplegie a bylo vysloveno podezření na GBS, později potvrzené EMG vyšetřením, vyšetřením mozkomíšního moku a pozitivitou protilátek proti perifernímu nervu.
Všichni naši pacienti přežili a byli k další péči předáni zpět na neurologické pracoviště. Průměrná doba hospitalizace pacientů na ARK byla 23 dní (4–55 dní), 2 pacienti vyžadovali rehospitalizaci na našem oddělení pro relaps příznaků onemocnění. Doba mezi jednotlivými readmisemi byla 31 a 34 dní. Závažnost motorického deficitu jsme u našich pacientů posuzovali dle Hughesova skórovacího systému. 5 pacientů během hospitalizace dosáhlo skóre 5 – tzn., že u nich byla nutná umělá plicní ventilace. Průměrná doba UPV byla 14 dní (2–32 dní). U tří z ventilovaných pacientů jsme provedli tracheostomii. Zbývajících pět pacientů mělo za hospitalizace na ARK nejvyšší skóre 4 dle Hughese.
Kromě motorického deficitu jsme u našich pacientů sledovali také přítomnost dystonie vegetativního nervového systému. Za známky dysautonomie jsme považovali přítomnost alespoň jednoho z následujících symptomů:
- oběhová nestabilita (tachy - a bradyarytmie, jinou příčinou nevysvětlitelné hypo či hypertenze),
- poruchy motility GIT (obstipace, subileózní stav), a
- retence moči.
Příznaky dysautonomie se projevily u 7 pacientů. To považujeme za poměrně značný podíl (70 % ze všech našich pacientů), který je možné vysvětlit celkově těžkým průběhem GBS s odpovídajícím vysokým skóre dle Hughese. Léčba příznaků dysautonomie byla symptomatická.
Všichni pacienti s diagnózou GBS, přijatí na naše oddělení, byli léčeni plazmaferézou. Celkem jsme u těchto 10 pacientů provedli v průběhu 12 hospitalizací (2 rehospitalizace) 45 plazmaferéz, tj. průměrně 3,75 plazmaferézy na hospitalizaci (1–6 plazmaferéz/hospitalizace). Plazmaferézy byly prováděny obvykle v režimu obden, někdy doporučovaném k dosažení vyšší účinnosti jednotlivých plazmaferéz. Ta je zdůvodňována lepší plazmatickou ekvilibrací humorálních imunitních faktorů obviňovaných z etiopatogeneze GBS v plazmě po 48 hodinách od předchozí plazmaferézy. Jako substituční roztok používáme Ringerův roztok s laktátem a 20% roztok lidského albuminu v poměru 4 : 1 doplněné o kalcium chloratum v množství 1g/litr substitučního roztoku.
Objem výměny plazmy během jedné plazmaferézy se pohybuje kolem 50 ml/kg váhy pacienta, tak abychom dosáhli celkového doporučovaného objemu výměny plazmy v průběhu celé léčby. Délka provádění jedné plazmaferézy se obvykle pohybuje mezi 3 až 4 hodinami. K antikoagulaci standardně používáme heparin podávaný systémově za bedside kontroly ACT. U našich pacientů jsme nepozorovali žádné komplikace, které by bylo možno dávat do příčinné souvislosti s prováděním plazmaferéz.
Z ostatních komplikací jsme se v našem souboru pacientů setkali s komplikacemi infekčními, a to v jednom případě uroinfekcí a taktéž v jednom případě ventilátorovou pneumonií.
Efekt léčby je prokazatelný snížením počtu pacientů závislých na UPV (při přijetí 5 pacientů závislých na UPV oproti 1 pacientovi při překladu) a snížením motorického deficitu při skórování dle Hughese.
Závěr
Guillain-Barrého syndrom s odhadovanou incidencí pro Českou republiku 100–200 nových případů ročně jistě nepředstavuje běžnou diagnózu pacienta, přijímaného na pracoviště intenzivní péče. Přesto je část nemocných, zhruba jedna třetina, k hospitalizaci na JIP plně indikována.
Cílem sdělení bylo seznámit lékařskou veřejnost se současným stavem diagnostických a terapeutických přístupů k nemocných s GBS, které je možné na dobře vybaveném pracovišti JIP/ARO standardně poskytnout.
MUDr. Roman Zazula, Ph.D
Anesteziologicko-resuscitační klinika
1. LF UK a FTNsP
Fakultní Thomayerova nemocnice s poliklinikou
Vídeňská 800
140 59 Praha 4
E-mail: roman.zazula@ftn.cz
Zdroje
1. Alshleklee, A., Hussain, Z., Sultan, B., Katirji, B. Guillain-Barré syndrome: Incidence and mortality rates in US hospitals. Neurology 2008, 70, p. 1608-1613.
2. Ambler, Z. Akutní polyneuropatie. Čes. a slov. Neurol. Neurochir. 2006, 69/102, 1, s. 4-16.
3. Asbury, A.K., Cornblath, D.R. Assessment of current diagnostic criteria for the diagnosis of Guillain-Barré syndrome. Ann. neurol. 1990, 27 (suppl), p. 21-24.
4. Bednařík, J. Zánětlivé polyneuropatie. Neurologie pro praxi, 2001, 3, s. 115-121.
5. van Doorn, PA. Treatment of Guillain-Barré syndrome and CIDP. J. Peripher. Nerv. Syst, 2005, 10, p. 113-127.
6. Farkkila, M., Kinnlinen, E. The Guillain-Barré syndrome study group : Plasmapheresis and acute Guillain-Barré syndrome, Neurology 1985, 35, p. 1096-1104.
7. French cooperative group on plasma exchange in Guillain-barré syndrome. Appropriate numer of plasma Exchange in Guillain-Barré syndrome. Ann. neurol. 1997, 41, p. 298-306
8. Goetz, C.G. Textbook of clinical neurology, 3rd ed. Philadelphia: Saunders, an imprint of Elsevier Inc. 2008. ISBN-13 : 978-1-4160-3618-0.
9. Hiraga, A., Mori, M., Ogawara, MD. Differences in patterns of progresion in demyelinating and axonal Guillain-Barré syndromes, Neurology 2003, 61, p. 471-474.
10. Hughes, RA. Randomised trial of plasma exchange, intravenous immunoglobulin, and combined treatments in Guillain-Barré syndrome. Plasma exchange / sandoglobulin Guillain-Barré trial group. Lancet 1997, 349, p. 225-230.
11. Hughes, R.A., van der Meche, F.G.A. Corticosteroids for treating Guillain-Barré syndrome. Cochrane Database Syst. Rev. 2003 (4), CD001446.
12. Hughes, R.A., Raphaël, J.C., Swan, A.V., van Doorn, PA. Intravenous immunoglobulin for Guillain-Barré syndrome, Cochrane database syst. rev. 2004 (1), CD002063.
13. Hughes, R.A., Wijdicks, E.F., Barohn, R. et al. Practice parameter: immunoterapy for Guillain-Barré syndrome: report of the quality standarts subcomitee of the American Academy of neurology. Neurology, 2003, 61, p. 736-740.
14. Joseph, S.A., Teak, Ch.Y. Guillain-Barré syndrome. Adolescent med. 2002, 13(3), p. 487-494.
15. van Koningsveld, R., Steyerberg, E.W., Hughes, R.A. et al. A clinical scoring system for Guillain-Barré syndrome. The Lancet neurology 2007, 6(7), p. 589-594.
16. Lewis, R.A. Guillain-Barré syndrome. In: Kruse, J. Saunders manual of critical care. 1st ed. Philadelphia: Saunders, an imprint of Elsevier Inc., 2003.
17. Lindenbaum. Y., Kissel, J., Mendell, J.R. Treatment aproaches for Guillain-Barré syndrome and chronic inflammatory demyelinating polyradiculopathy. Neurologic clinic 2001, 19(1), p. 187–204.
18. Madore, F. Plasmapheresis – technical aspects and indications. Critical care clinics 2002, 18(2), p. 375-392.
19. Maramottom, B.V., Wijdicks, E.F., Dellinger, R.P. Acute neuromuscular weakness in the intensive care unit. Critical care medicine 2006, 34(11), p. 2835-2841.
20. McGillicuddy, D.C., Walker, O., Shapiro, N.I., Edlow, J.A. Guillain-Barré syndrome in the emergency department, Annals of emergency medicine 2006, 47(4), p. 390-393.
21. van der Meche, F.G., Schmitz, P.I. Dutch Guillain-Barré study group: A randomised trial comparing intravenous immune globulin and plasma exchange in Guillain-Barré syndrome. N. Engl. J. Med.1992, 326, p. 1123-1129.
22. Newswanger, D.L., Warren, C.R. Guillain-Barré syndrome. American fam. physician, 2004, 69(10), p. 2405-2410.
23. Ropper, A.H. The Guillain-Barré syndrome. N. Engl. J. Med. 1992, 326, p. 1130-1136.
Štítky
Praktické lékařství pro děti a dorost Praktické lékařství pro dospělé
Článek MentalizaceČlánek Konference DNA diagnostikyČlánek Everything I CanČlánek Komunitní pneumonieČlánek Jubilea
Článek vyšel v časopisePraktický lékař
Nejčtenější tento týden
2008 Číslo 10- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Trazodon pohledem praktického lékaře
-
Všechny články tohoto čísla
- Od Masarykových domovů k Thomayerově nemocnici
- Mentalizace
- Základní obecná klasifikační schémata dětských zlomenin
- Primární extragonadální germinální nádory u mužů Analýza souboru z let 1994–2008
- Syndrom Guillain-Barré Specifika intenzivní péče, možnosti terapeutického využití plazmaferézy a naše zkušenosti
- Historie a současnost registrace vrozených vad v České republice
- Netypický tumor nosohltanu ve vyšším věku – angiofibrom nosohltanu?
- Komunitní pneumonie
- Historie a současnost pneumologie ve Fakultní Thomayerově nemocnici
- Péče o děti s tuberkulózou v rámci Fakultní Thomayerovy nemocnice
- Jubilea
- Miniportréty slavných českých lékařů Profesor MUDr. Jan Maršálek, hradecký a olomoucký gynekolog a porodník
- Ceny předsednictva ČLS JEP za nejlepší knižní publikace a odborné články v roce 2007
- Jednoduchá odpověď na složité problémy: chůze!
- Konference DNA diagnostiky
- Everything I Can
- Více než 1 500 lidí porušilo léčebný režim
- Netradiční projekt pro odvykání kouření aneb dokuřte s Radiožurnálem
- Praktický lékař
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Syndrom Guillain-Barré Specifika intenzivní péče, možnosti terapeutického využití plazmaferézy a naše zkušenosti
- Základní obecná klasifikační schémata dětských zlomenin
- Mentalizace
- Netypický tumor nosohltanu ve vyšším věku – angiofibrom nosohltanu?
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



