-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Komunitní pneumonie
Community – acquired pneumonia
Community-acquired pneumonia (CAP) is one of the most common infectious diseases all over the world, and it remains a serious condition despite modern treatment methods. Pneumonias are a large group of diseases, which differ according to the epidemiological, pathogenetic, clinical, therapeutic and prognostic point of view. Our paper mainly focuses on community-acquired pneumonia and its aetiology, pathophysiology, factors that affect its course and severity, and on the treatment possibilities. It offers a review of the basic and complementary investigations that facilitate the differential diagnosis and diagnosis of the disease and draws attention to the possible complications of this serious illness.
Key words:
community-acquired pneumonia, typical and atypical agents, clinical signs, treatment, complications.
Autoři: P. Žáčková; M. Vašáková
Působiště autorů: Primářka: doc. MUDr. Martina Vašáková, Ph. D. ; Přednosta: prof. MUDr. Jiří Homolka, DrSc. ; Pneumologická klinika 1. LF UK, Praha ; Fakultní Thomayerova nemocnice s poliklinikou ; Univerzita Karlova v Praze
Vyšlo v časopise: Prakt. Lék. 2008; 88(10): 603-609
Kategorie: Kazuistika
Souhrn
V celosvětovém měřítku jsou pneumonie nejčastějším infekčním onemocněním, jehož závažnost neklesá přes veškeré současné terapeutické možnosti. Pneumonie nepředstavují jedinou chorobu, ale skupinu onemocnění, která se liší epidemiologií, patogenezí, klinickým obrazem, průběhem, léčbou a prognózou. Sdělení se zaměřuje se především na komunitní pneumonie, jejich etiologii, patofyziologii, faktory ovlivňující průběh a závažnost onemocnění a na možnosti terapie. Podává přehled indikovaných základních a doplňkových vyšetření, které usnadňují diferenciální diagnostiku a stanovení diagnózy a upozorňuje na možné komplikace tohoto stále závažného onemocnění.
Klíčová slova:
komunitní pneumonie, typická a atypická agens, klinické příznaky, terapie, komplikace.Úvod
Pneumonie provází lidstvo od nepaměti. Vzhledem ke své závažnosti a často smrtícímu průběhu je pneumonie jednou z nejstarších chorob, která byla pojmenována a u které byla stanovena diagnostická kritéria (8).
Pneumonie je akutní zánět plicního parenchymu postihující respirační bronchioly, plicní alveoly a plicní intersticium. Jedná se o nejčastější zánětlivé onemocnění respiračního traktu a také, přes veškeré současné terapeutické možnosti, o onemocnění s nejvyšší mortalitou. Celosvětově jsou pneumonie jako příčina úmrtí na 1. místě z infekčních onemocnění a na 3. místě ze všech příčin úmrtí. Ročně na pneumonii umírá 3 až 5 miliónu lidí (2).
V České republice onemocní pneumonií ročně průměrně 100 000 osob, z toho přibližně 20 000 nemocných je pro závažný průběh indikováno k hospitalizaci. Mortalita pneumonií je v České republice 29,6 úmrtí na 100 000 obyvatel (8).
Pneumonie nepředstavují jedinou chorobu, ale skupinu onemocnění, která se liší epidemiologií, patogenezí, klinickým obrazem, průběhem, léčbou a prognózou (4). Lze je dělit podle různých kriterií:
- na primární a sekundární podle toho, zda se jedná o samostatné postižení plicního parenchymu nebo komplikaci jiného onemocnění,
- podle etiologie na infekční a neinfekční,
- podle patologickoanatomické lokalizace, charakteru rentgenového nálezu nebo časového průběhu (akutní, chronické, recidivující), ale také
- podle závažnosti (lehké, středně těžké a těžké pneumonie) nebo podle vyvolávajícího agens.
Z klinického hlediska se v současnosti jeví jako nejúčelnější dělení na pneumonie komunitní, nozokomiální a ventilátorové, pneumonie u imunokompromitovaných osob, pneumonie v ústavech sociální péče a pneumonie asociované s lékařskou péčí. Dalším do určité míry svébytným typem je pneumonie aspirační. Přínos tohoto dělení spočívá v možnosti odhadu vyvolávajícího agens, což při současné znalosti epidemiologické situace usnadňuje volbu adekvátní antimikrobiální léčby.
Komunitní pneumonie (community acquired pneumonia – CAP) postihuje jedince v běžném životě. Jedná se o nemocné, kteří nepobývají v zařízeních sociální péče a nemají v předchorobí údaj o hospitalizaci 14 dnů před onemocněním. Pokud se však pneumonie rozvine u jedince do dvou dnů od zahájení hospitalizace, je považována za komunitní. CAP mohou být (častěji u dětí) virové etiologie, ale převážně jsou působeny běžnými patogeny , které bývají dobře citlivé na antibiotika.
Nozokomiální pneumonie (hospital acquired pneumonia – HAP) je definována jako pneumonie, která se u nemocného rozvíjí s odstupem 48 hodin od zahájení hospitalizace. Podle doby vzniku se dělí na časnou HAP, která se rozvíjí se do čtyř dnů od počátku hospitalizace a na pozdní HAP, která vzniká od čtvrtého dne po začátku hospitalizace. Celosvětově je HAP třetí nejčastější nozokomiální infekcí a je obecně spojena s vysokou mortalitou. Vyvolávající agens pochází u HAP ze stávající nemocniční mikroflóry, méně často je zdrojem infekce ošetřující personál, okolní nemocní nebo přístrojové vybavení a zdravotnický materiál. Závažnost nozokomiálních pneumonií tkví v tom, že vyvolávající patogeny jsou často kmeny vysoce rezistentní vůči antimikrobiální léčbě.
HAP postihuje nemocné prakticky na všech nemocničních odděleních, nejčastěji se však rozvíjí u nemocných hospitalizovaných na jednotkách intenzivní péče a na anesteziologicko-resuscitačních odděleních.
Samostatným typem nozokomiální pneumonie je pneumonie ventilátorová (ventilator associated pneumonia – VAP). Pacienti léčení mechanickou ventilací jsou ohroženi vznikem nozokomiální pneumonie podstatně více než neventilovaní nemocní. Mortalita VAP je velmi vysoká, pohybuje se v rozmezí 50 až 90 %. Prognózu VAP ovlivňuje celá řada faktorů. Důležitá je celková doba hospitalizace nemocného, předchozí antibiotická léčba, délka samotné umělé plicní ventilace (UPV) a také doba rozvoje VAP. Časná ventilátorová pneumonie se rozvíjí u pacientů v průběhu čtyř dnů od zahájení UPV, pozdní vzniká od pátého dne dále. U nemocných, u kterých je UPV zahájena v úvodu hospitalizace např. z důvodů traumatu a kteří nebyli v předchorobí léčeni antibiotiky, se jako vyvolávající agens často uplatňují komunitní patogeny, které jsou zpravidla dobře citlivé na antimikrobiální léčbu. S narůstající délkou hospitalizace, předchozí opakovanou či kombinovanou antibiotickou léčbou a s délkou UPV vzrůstá podíl gramnegativních bakterií a multirezistentních kmenů, jejichž léčba bývá velmi obtížná.
Pro pneumonie u imunokompromitovaných osob (immunocompromised associated pneumonia – IAP) je typická odlišnost mikrobiálního spektra, která se uplatňuje při jejich vzniku. Vedle běžných patogenů se na jejich vzniku často podílí tzv. oportunní mikroorganismy, tedy mikroorganismy, které u zdravého jedince onemocnění většinou nevyvolají. Diferenciálně diagnosticky je nutno pomýšlet na infekci cytomegalovirem, pneumocystovou pneumonii, houbové infekce ale také na nokardie, legionely, virus herpes simplex a mykobakterie včetně tuberkulózních. Skupina nemocných trpících imunodeficitem je přitom velmi rozsáhlá. Patří sem nejen nemocní s vrozenými imunodeficity, které jsou relativně vzácné, ale především nemocní se získanými poruchami imunity. Jedná se o nemocné s hematologickými malignitami, solidními maligními tumory, pacienty léčené chemoterapií, transplantované nemocné a nemocné léčené z různých důvodů imunosupresivy a systémovými kortikosteroidy.
Pneumonie v ústavech sociální péče (social houses pneumonia – SHP) je pneumonie vznikající u jedinců žijících v zařízeních sociální péče. Etiologicky se uplatňují jak patogeny typické pro komunitní pneumonie, tak nozokomiální kmeny, které jsou však v jednotlivých zařízeních rozdílné a samozřejmě se liší i od bakteriálních kmenů typických pro nemocniční prostředí. Rezistentní formy jsou méně obvyklé, častější jsou však infekce gramnegativními bakteriemi.
Pneumonie asociované s lékařskou péčí (health care associated pneumonia – HCAP) jsou nově vzniklým pojmem, který se užívá v souvislosti s pacientem s anamnézou nedávné hospitalizace, s pacientem který byl v kontaktu s osobou trpící nozokomiální pneumonií, s nemocným chronicky užívajícím imunosupresiva atp. Upozorňují na možnost vzájemného kauzálního vztahu mezi zdravotní péčí a vznikem pneumonie
Aspirační pneumonie mohou vzniknout jak v domácím prostředí, tak za hospitalizace. Typicky se na jejich vzniku podílí smíšená bakteriální flóra včetně anaerobních mikroorganismů, i když se dle některých studií z posledních let v případě komunitních aspiračních pneumonií anaeroby izolovat nepodařilo (8). Patofyziologicky se uplatňuje aspirace orofaryngeálního sekretu do dýchacích, ke které dochází během spánku běžně i u zdravých jedinců. K výraznější aspiraci, která se pak podílí na rozvoji pneumonie, dochází u nemocných s gastroesofagelním refluxem, s poruchami vědomí (alkoholici, narkomani, neurologicky nemocní, po celkové anestézii, při intoxikacích), při poruchách polykání nebo mechanických překážkách v dýchacích cestách jako jsou endotracheální kanyly.
U těchto nemocných dochází typicky k hromadění sekretu nad těsnícím balonkem kanyly, při jehož uvolnění dochází k zatékání nahromaděného sekretu kolem kanyly do dýchacích cest. Dalším predisponujícím faktorem je porucha mukociliárního transportu, porucha protektivního reflexu dýchacích cest (kašel) a infekty v zubní a ORL oblasti. Závažnost aspiračních pneumonií spočívá v tom, že u nich často dochází ke vzniku tkáňové nekrózy a následně k tvorbě plicních abscesů.
Etiologie
Komunitní pneumonie (CAP – Community-acquired pneumonia) jsou jedním z nejčastějších infekčních onemocnění se kterými přichází do styku především praktiční lékaři, pneumologové, internisté a lékaři urgentních příjmů. Celosvětově jsou CAP důležitou příčinou morbidity a mortality.
Patofyziologicky dochází k průniku infekčního agens do plicního parenchymu inhalací infekčního agens (infekční aerosol) nebo aspirací patogenních mikroorganismů lokalizovaných v oblasti orofaryngu. Méně často se CAP může rozvinout na podkladě bakteriémie při infekčním onemocnění jiných orgánů (gastrointestinální, urogenitální trakt).
Mikroorganismy, které se nejčastěji uplatňují při rozvoji CAP se v současnosti z mikrobiologického hlediska dělí na typická a atypická agens. Z typických bakterií jde o:
- Streptococcus pneumonie,
- Haemophilus influenzae,
- Moraxella catarrhalis,
méně často se uplatňuje
- Klebsiella pneumonie,
- Escherichia coli,
- Staphylococcus aureus, a vzácně
- Pseudomonas aeruginosa.
Mezi typická agens se řadí
- Mycoplasma pneumoniae,
- Chlamydophila pneumoniae, a
- Legionella pneumophila.
Průkaz vyvolávajícího agens se daří méně než v 50 % případů.
Zatímco dle literárních údajů je především v USA i v Evropě v naprosté většině bakteriologicky ověřených případů verifikován S. pneumoniae (80 %, respektive 25 %) a z atypických agens Legionella (15 %, respektive 5 %), v naší populaci je S. pneumoniae zachycen pouze v 10 % a legionelová pneumonie je diagnostikována spíše ojediněle.
V u nás provedených epidemiologických studiích jednoznačně převažovaly gramnegativní bakterie, především H. influenzae a z atypických agens M. pneumoniae, a to jak u ambulantních, tak u hospitalizovaných nemocných. Nižší záchyt S. pneumoniae lze z části vysvětlit jeho citlivostí vůči zevním podmínkám, nezbytné je bakteriologické vyšetření sputa do dvou hodin po odběru, z části se jistě uplatňuje i fakt, že CAP častěji postihuje starší nemocné s preexistujícími plicními onemocněními, především s chronickou obstrukční plicní nemocí (CHOPN), u kterých se při vzniku onemocnění často uplatňuje smíšená bakteriální flóra (3).
Obecně lze však říci, že CAP je ve většině případů působena jedním patogenem, smíšená bakteriální flóra se uplatňuje přibližně u 10–20 % nemocných a je typická především pro aspirační pneumonie.
Velmi důležitým faktorem při vzniku CAP rovněž s ohledem na vyvolávající patogen je věk. Vyšší výskyt CAP je jednak v dětském věku (do 5 let), kdy typickým vyvolávajícím patogenem je H. infuenzae. U mladistvých se nejčastěji uplatňuje M. pneumonie a onemocnění se často vyskytuje v menších epidemiích. Typicky je CAP onemocnění starších osob s chronickým plicním onemocněním či jinými komorbiditami (ischemická choroba srdeční, diabetes mellitus, renální insuficience), především ve věku nad 65 let. Etiologicky se v těchto případech nejčastěji uplatňuje K. pneumoniae a E. coli.
Zvýšený výskyt CAP je pozorován v zimním období. Podkladem je bakteriální superinfekce nasedající na sezónně častější virové infekty dýchacích cest. K bakteriální superinfekci může docházet bezprostředně nebo s odstupem několika dnů, kdy po přechodné úlevě dochází opět ke zhoršení klinické symptomatologie.
Rizikové faktory vzniku CAP
Rozsáhlá Almiraliho populační studie se zabývala řadou rizikových faktorů a prokázala jejich vliv na vznik CAP. V souladu s ostatními studiemi prokázala negativní vliv jak snížené hmotnosti, tak obezity a negativní vliv kouření. U pacientů exkuřáků se přitom riziko vzniku CAP snižuje až po dvou letech. Jednoznačně však byl prokázán i negativní vliv pasivního kouření u pacientů nekuřáků starších 65 let. Význam abúzu alkoholu byl patrný především u mužů.
Z faktorů zevního prostředí mají význam náhlé teplotní změny. Vdechování chladného vzduchu vede k poklesu teploty v nosní dutině, což vede ke snížení mukociliární clearence, k poklesu fagocytární aktivity leukocytů, a tím i k usnadnění průniku infekce. Dalším rizikovým faktorem je bydlení více než 10 osob ve společné domácnosti a přítomnost dětí předškolního věku v rodině. Kontakt s domácími zvířaty představuje riziko nejen z hlediska přenosu psitakózy a jiných zoonotických plicních infekcí, ale zvyšuje i riziko vzniku CAP. Vyšší výskyt CAP byl zaznamenán u jedinců žijících osaměle, u ovdovělých a rozvedených. Negativní vliv na vznik CAP byl prokázán při léčbě N-acetylcysteinem, amiodaronem a orálními steroidy a především při užití inhalačních steroidů. Podkladem je zde kontaminace a špatná hygiena plastikových inhalátorů a hluboké inspirium, které může být příčinou průniku orofaryngeální mikroflóry do bronchiálního stromu.
Jako protektivní faktor se naopak uplatňuje důsledná hygiena dutiny ústní, preventivní zubní prohlídky a včasné ošetření zubních afekcí, očkování proti chřipce a pneumokoková vakcína (1).
Klinická symptomatologie
Přestože klinická symptomatologie CAP je obdobná, lze diferencovat určité rozdíly. Bakteriální CAP je charakterizována akutním horečnatým začátkem s třesavkami a zimnicí, produktivní expektorací purulentního sputa, které zvláště v případě klebsielové pneumonie může obsahovat drobnou příměs krve. Hemoragické nebo rezavě zbarvené sputum bývá přítomno u pneumokokových infekcí, zelená barva sputa se objevuje u hemofilových a pseudomonádových infekcí, hnilobně páchnoucí sputum svědčí pro infekci anaerobní. Častá je pleurální bolest. Poslechově jsou typickým nálezem chrůpky, poklepové ztemnění a zesílena bronchofonie a fremitus pectoralis.
CAP vyvolaná atypickým agens se často projevuje mimoplicními příznaky (bolesti hlavy, myalgie, ekzantém, únavnost, bolesti v krku, zvracení a průjmy). Nástup onemocnění je spíše pozvolný, kašel bývá suchý bez výraznější expektorace, fyzikální nález je chudý v rozporu s se skiagrafickým nálezem, který může být rozsáhlý. Dušnost závisí na rozsahu postižení plicního parenchymu.
Průběh onemocnění bývá modifikován přítomným chronickým plicním onemocněním a přidruženými komorbiditami. U starých nebo těžce nemocných pacientů se může omezit na horečku, tachypnoe, neklid a mentální alteraci (4). Závažnost pneumonie je determinována především přítomným chronickým onemocněním srdečním a plicním a stavem imunitního systému, nikoliv virulencí samotného patogena. Rozvoj pneumonie může ovlivnit celá řada faktorů (tab. 1).
Tab. 1. Faktory ovlivňující rozvoj pneumonie 
Vyšetření v ambulantní praxi
V ambulantní praxi je nezbytným základem anamnéza, fyzikální vyšetření se zaměřením na přítomnost horečky, tachypnoe a dyspnoe, na přítomnost cyanózy a distančních dechových fenoménů, tachykardie nebo bradykardie, přítomnost pleurálního třecího šelestu, bolestivý poklep hrudní stěny a mentální alteraci. Nedílnou součástí je skiagram hrudníku ve dvou projekcích, které umožňují korektně posoudit charakter, rozsah a lokalizaci postižení plicního parenchymu.
Z laboratorních vyšetření je namístě provedení sedimentace, C reaktivního proteinu (CRP), krevního obrazu včetně diferenciálního rozpočtu leukocytů (leukopenie může být projevem rozvíjeného se septického stavu!), vyšetření urey a v závislosti na klinickém stavu nemocného a komorbiditách i vyšetření kreatininu, jaterních testů a glykémie.
Před nasazením antibiotické léčby by vždy mělo být odebráno sputum na mikroskopické a kultivační vyšetření. Vhodné je makroskopicky posoudit validitu sputa, vyšetření slin není diagnosticky přínosné. Cenné je již mikroskopické vyšetření sputa. Validní vzorek sputa obsahuje v zorném poli méně než 10 dlaždicových epitelií a více než 25 neutrofilních leukocytů. Mnohočetná bakteriální flora svědčí spíše pro kontaminaci z dutiny ústní. Pokud mikroskopické vyšetření nesplňuje daná kritéria, nelze očekávat validní výsledek kultivačního vyšetření.
Nesmírně důležitým momentem po stanovení diagnózy pneumonie je posouzení celkového stavu nemocného a zvážení možností terapie, především zda je možno zahájit ambulantní léčbu, či zda je nezbytná hospitalizace nemocného. Z toho důvodu byla vytvořena různá kritéria, která umožňují posoudit závažnost onemocnění, respektive rizika mortality. V podstatě se v současné době užívají kritéria britská – CURB-65 a americké hodnocení PSI (Pneumonia Severity Index). Systém CURB-65 je jednodušší a dle provedených studií by měl být používán v rutinní klinické praxi, respektive u všech nemocných s CAP v rámci vyšetření na pohotovosti a u praktického lékaře (9) (tab. 2).
Vyšetření zahrnuje zhodnocení stavu vědomí, (zmatenost), renálních funkcí (urea vyšší než 7 mmol/l), dechová frekvence nad 30/min, hodnoty krevního tlaku (systola nižší než 90 torr, diastola pod 60 torr) a věku vyšší než 65 let. Jsou li spolu s věkem „splněna“ alespoň 2 kritéria, stoupá riziko smrti 10–20x. (5). Z mnoha provedených studií vyplývá řada dalších rizikových faktorů, které mohou výrazně zvýšit závažnost probíhajícího onemocnění (tab. 3).
Tab. 3. Ostatní rizikové faktory výrazně zvyšující závažnost CAP 
Kritéria Americké hrudní společnosti (ATS) jsou považována za nejpropracovanější z hlediska hodnocení rizika mortality u nemocných s pneumonií. Nemocní jsou zařazování do skupin podle rizikových bodů, které se přidělují na podkladě určených kriterií (tab. 4). Skupin podle propočteného rizika mortality je pět. Zařazení do skupiny také určuje způsob léčby.
Nemocní bez komorbidit s věkem do 50 let nemají přidělovány rizikové body, očekávaná mortalita je nízká. Od 50 let (respektive 55 let u žen) rizikových bodů věkem přibývá, další rizikové body jsou podmíněny komorbiditami a patologickými laboratorními hodnotami (tab. 4).
Tab. 4. Rizikové skupiny dle PSI 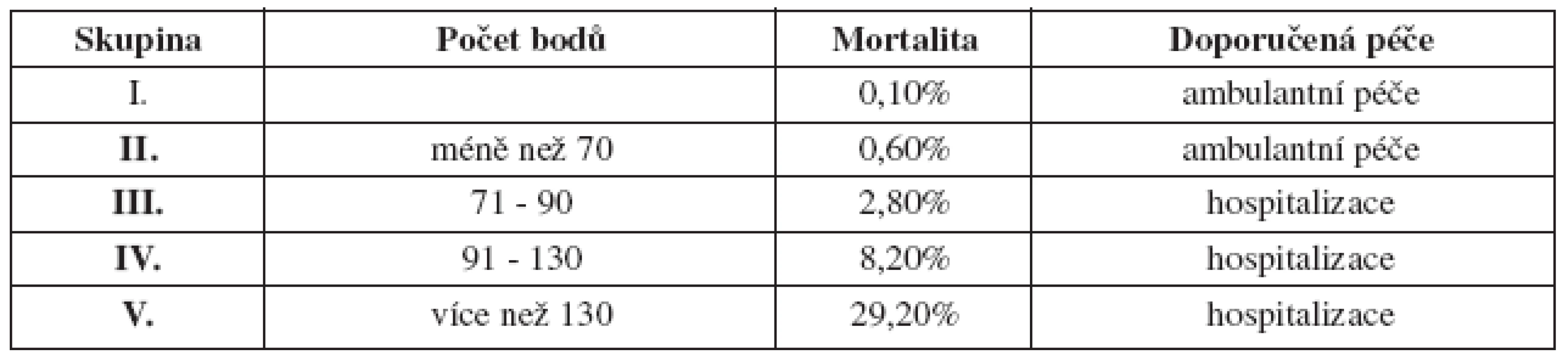
U pacientů I. skupiny je možná ambulantní antibiotická léčba. U nemocných zařazených do II. či III. skupiny je možno léčbu zahájit ambulantně, nezbytná je však kontrola nemocného nejpozději s odstupem 48 hodin. Pokud je stav uspokojivý, je možno v léčbě pokračovat. Pokud nedochází ke zlepšení stavu, je nutná změna antibiotika nebo hospitalizace nemocného. U pacientů ve IV. a V. skupině je namístě okamžitá hospitalizace. Jestliže se u nemocného rozvíjí porucha vědomí, respirační insuficience či šokový stav, je indikována hospitalizace na jednotce intenzivní péče (JIP).
Přestože lze dle PSI i CURB-65 poměrně přesně posoudit riziko mortality, žádný těchto systému nebere v úvahu sociální problematiku. Potřeba hospitalizace je jistě jiná u nemocných bezdomovců či intoxikovaných jedinců. Stejně tak je nutno zvažovat propuštění nemocných, u kterých klinický stav již ambulantní léčbu umožňuje, ale kteří nemají dobré zázemí (7).
Vyšetření za hospitalizace
Vyšetření za hospitalizace je zaměřeno nejen na upřesnění vlastního onemocnění z hlediska posouzení rozsahu onemocnění, určení patologického agens a posouzení postižení ventilačních a respiračních parametrů, ale také na posouzení závažnosti existujících komorbidit a především na diferenciální diagnostiku. Samozřejmostí je laboratorní vyšetření zánětlivých parametrů, kompletního krevního obrazu, jaterních testů, renálních funkcí, mineralogramu, glykémie a parametrů nutrice.
Kromě opakovaného mikroskopického a kultivačního vyšetření sputa je vždy nutné odeslat vzorek sputa i na vyšetření mykobakterií. Sekret z dýchacích cest lze také získat transtracheální aspirací nebo lze materiál na bakteriologické vyšetření získat perkutánní transtorakální punkcí plicního parenchymu. Obě metody mají svá nezanedbatelná rizika a běžně se neprovádějí. Prakticky standardně je však prováděno fibrobronchoskopické vyšetření, které umožňuje cílený odběr sekretu a současně i posouzení endobronchiálního nálezu, což je důležité z diferenciálně diagnostického hlediska. I u mladého nemocného může být podkladem pneumonie dosud nerozpoznané nádorové onemocnění, a diskrepance mezi rentgenologickým a endobronchiálním nálezem může být značná. Absolutní indikací bronchoskopického vyšetření je hemoptýza.
V současně době je získaný sekret možno rovněž vyšetřovat molekulárně biologickými metodami, běžné a relativně spolehlivé je vyšetření antigenů v moči při podezření na pneumokokovou či legionelovou pneumonii.
Již vstupně, pokud možno ještě před nasazením antibiotika, je vhodné opakované vyšetření hemokultury i když pozitivní hemokultura potvrzující bakteriémii je přítomna pouze u 10–30 % pneumonií.
V případě přítomnosti pleurálního výpotku je nezbytná diagnostická punkce. Již samotné makroskopické posouzení přítomného výpotku je velmi cenné a bezprostředně ovlivňuje i terapeutický postup. Má li výpotek makroskopický purulentní charakter, je plně indikována hrudní drenáž.
Kromě mikrobiologického vyšetření punktátu, které je včetně vyšetření na mykobakterie samozřejmostí, se standardně provádí i cytologické a biochemické vyšetření. Je li výpotek makroskopicky pouze mírně zkalený, může být terapeuticky dostačující pouze evakuační hrudní punkce. Pokud je však cytologicky v pleurálním sekretu vysoké zastoupení neutrofilních leukocytů, je rovněž indikována hrudní drenáž, která dle našich zkušeností významně zkracuje léčbu této komplikace.
Sérologická vyšetření napomáhají určení etiologie – význam mají především protilátky proti respiračním virům, chlamydiím a mykoplazmatům, ale diagnóza je pozdní a volbu antimikrobiální léčby samozřejmě neovlivní. Průkaz vysokých titrů protilátek však může ovlivnit délku léčby – terapii makrolidy je v tomto případě vhodné prodloužit na 2–3 týdny.
Z dalších laboratorních vyšetření prováděných v rámci užší diferenciální diagnostiky se provádí vyšetření imunitního systému, koagulačních parametrů, plazmatických D dimerů a dalších.
Běžnou součástí základního vyšetření za hospitalizace je také EKG a případně echokardiografické vyšetření, které umožňuje nejen posoudit velikost a funkci srdečních oddílů (diferenciální diagnóza srdečního selhávání), ale také přítomnost plicní hypertenze (embolizace).
Při suspekci na plicní embolii, která je stále velmi často poddiagnostikovaná, je spolehlivým vyšetřením ventilačně-perfuzní plicní scintigrafie nebo spirální výpočetní tomografie.
Výpočetní tomografie (CT) či CT s vysokou rozlišovací schopností (HRCT) má význam především v rámci diferenciální diagnostiky nádorového onemocnění, intersticiálních plicních chorob, bezpečně také posoudí přítomnost bronchiektázií.
Ultrasonografie (USG) má význam pro upřesnění rozsahu a lokalizace přítomného pleurálního sekretu. Pomůže při volbě optimálního místa pro punkci či drenáž, umožní posouzení podbrániční krajiny, což může ozřejmit indukci zánětu ze subfrenia.
Terapie pneumonií
Terapie pneumonií vychází z platnosti určitých principů, které byly ověřeny v řadě studií. Ve většině případů se při vzniku CAP uplatňuje jediný patogen, smíšená bakteriální flóra je typická pro aspirační pneumonie. Chronická onemocnění ovlivňují průběh onemocnění a jsou významným prognostickým faktorem, neovlivňují však volbu antibiotika. Monoterapie je stejně účinná jako kombinovaná léčba, která tak ztrácí opodstatnění. Většina antibiotik užívaných v terapii CAP pokrývá rovněž orální anaerobní mikroflóru.
Závažnost CAP je podmíněna přítomných chronickým onemocněním plic, kardiovaskulárního a imunitního systému. Objeví li se v průběhu CAP hypotenze či šokový stav, je podkladem chronické plicní a kardiální onemocnění či akutní infarkt myokardu.
Přítomnost rychle progredujících rozpadů na skiagramu hrudníku není pro CAP typická. Fulminantní průběh CAP s rychle se rozvíjející nekrotizující rozpadovou pneumonií bývá podmíněn infekcí penicilin-rezistentními nebo multirezistentními kmeny pneumokoků. Predisponujícími faktory jsou v tomto případě věk na 65 let, podání beta laktamových antibiotik v posledních 3 měsících, poruchy imunitního systému, imunosupresivní léčba a mnohočetné komorbidity (4). Obecně jsou lékem první volby v ambulantní praxi makrolidy, aminopeniciliny, tetracykliny a fluorochinolony.
Základem terapie pneumonií je léčba antibiotiky. Cílem farmakoterapie je eradikace kauzálního patogena, potlačení symptomů a normalizace klinického stavu, snížení potřeby hospitalizace a zabránění reinfekce (6). U mladších nemocných v dobrém klinickém stavu a bez závažných komorbidit je možná ambulantní léčba.
Léčba antibiotiky by měla být zahájena nejpozději do 8 hodin po stanovení diagnózy. Volba antibiotika je tedy empirická a odvíjí se od znalosti epidemiologické situace a předpokládaného vyvolávajícího agens. Obecně nejčastěji je v naší populaci vyvolávajícím patogenem z atypických agens C. pneumoniae a M. pneumoniae, z typických agens H. influenzae a S. pneumoniae.
Předpokládáme li spíše atypické agens, je na místě léčba makrolidy vyšší generace (azitromycin, klaritromycin), které mají dobrou účinnost i proti H. influenzae, případně tetracykliny (doxycyklin) při uvážení, že řada patogenů je na tetracyklinová antibiotika rezistentní. V případě intolerance je možné podat fluorochinolon.
Předpokládáme li spíše účast typického agens jsou indikovány aminopeniciliny, při jejich nesnášenlivosti makrolidy s vědomím, že přibližně 25 % kmenů S. pneumoniae je vůči makrolidům rezistentní.
Při ambulantní léčbě je důležitá kontrola nemocného s odstupem 48 hodin. Pokud nedochází ke zlepšení, je namístě změna antimikrobiální léčby, při zhoršujícím se klinickém stavu je nutno zvážit hospitalizaci. Léčba antibiotiky trvá průměrně 7 až 10 dnů, u atypických agens je vhodné léčbu prodloužit na 2 až 3 týdny.
I u hospitalizovaných nemocných je antibiotická léčba zpravidla zahajována empiricky. 1. dávka antibiotika by měla být podána do 2 až 4 hodin po přijetí na lůžko, před zahájením léčby je nezbytné provést odběr validního vzorku sputa na mikrobiologické vyšetření a opakovaně odebrat krev na hemokultivace. Volba antimikrobiální léčby závisí do určité míry na tom, jakými antibiotiky a v jakých dávkách byl nemocný léčen ambulantně a musí samozřejmě respektovat známé alergie.
V současnosti se zpočátku zpravidla podává intravenózní kombinace betalaktamových antibiotik (aminopeniciliny nebo cefalosporiny) s makrolidy, možná je také monoterapie či kombinace s fluorochinolony. V optimálním případě dochází ke zlepšení klinického stavu a laboratorních parametrů do 3 dnů od zahájení léčby a je možno přejít na léčbu perorální a případně zvážit dimisi nemocného do ambulantní léčby. V případě zhoršujícího se stavu a rozvíjejících se komplikací je nezbytná léčba komplexní, která je však individuální. Závisí především na přítomných chronických onemocnění a jejich aktuálním stavu a na povaze komplikace.
Antimikrobiální léčba by měla být pokud možno již cílená na podkladě opakovaných mikrobiologických vyšetření (sputum, bronchiální aspirát, pleurální výpotek, hemokultury). V případě jejich negativity je nutno zvážit možnou účast rezistentních kmenů, pseudomonádové infekce, méně obvyklých patogenů, případně smíšené infekce včetně anaerobní flóry, a vzhledem k délce hospitalizace nelze opominout ani možnou superinfekci nozokomiálními patogeny. V některých případech, zvláště u starých nemocných s dalšími rizikovými faktory, může CAP rychle vyústit v život ohrožující stav s projevy multiorgánového selhávání. Na místě je hospitalizace na JIP či anesteziologicko-resuscitačních odděleních.
Komplikace
1) Protrahovaný průběh onemocnění – příčiny
- vysoký věk, chronický alkoholismus;
- chybná diagnóza, respektive nediagnostikovaná embolizace do plicnice či levostranná kardiální insuficience;
- méně obvyklý patogen, který není citlivý na podané antibiotikum;
- obvyklý patogen, který je však vůči podávanému antibiotiku rezistentní;
- chronická plicní onemocnění (CHOPN), přítomnost bronchiektázií, nerozpoznaný bronchogenní karcinom;
- rozvoj intratorakální komplikace – pleurální výpotek, hrudní empyém;
- extrapulmonální komplikace – rozvoj septického stavu;
- komplikace terapie – kanylová sepse, alergická reakce na antibiotika;
- noncompliance – pacient neužívá antibiotika;
- nedostatečné dávkování antibiotika či jeho nedostatečná resorpce (respiratory);
2) Pleurální výpotek
je vůbec nejčastější komplikací, postihuje přibližně jednu třetinu nemocných s pneumonií a jeho léčba bývá velmi často podceněna. Bývá podkladem přetrvávajících febrilií a při inadekvátní léčbě může dojít až k rozvoji hrudního empyému, kdy má výpotek makroskopicky purulentní charakter. Současně dochází k fibroprodukci a k rozvoji pachypleury, která znemožňuje reexpanzi plíce. Tato komplikace vyžaduje intenzivní terapii (hrudní drenáž), některých případech je definitivním řešení teprve operační výkon.
3) Plicní absces
je méně častou komplikací, která provází především klebsielové pneumonie. Dojde li k provalení abscesu do bronchiálního stromu, je typickým příznakem vomika – náhlé vykašlání většího objemu často páchnoucího a hemoragického sputa. V těchto případech je na místě dlouhodobá antibiotická terapie, často až několikatýdení, inhalační léčba a intenzivní rehabilitace s polohovou drenáží, jejímž cílem je vykašlání obsahu abscesové dutiny drenážním bronchem. Možná jsou opakovaná bronchoskopická vyšetření (terapeutická bronchoskopie) s cíleným odsáváním hnisu a lokální aplikací mukolytik. Variantou je perkutánní drenáž plicního abscesu prováděná zpravidla tenkými drény (tzv. pigtaily) pod kontrolou CT. Rizikem tohoto výkonu je možná infekce pleurální dutiny a rozvoj hrudního empyému, eventuálně vznik podkožního emfyzému. I u takto nemocných je někdy nezbytné operační řešení.
4) Kryptogenní organizující pneumonie
(COP) je rovněž jednou z možných, i když nepříliš častých komplikací. V závislosti na rozsahu postižení může docházet k trvalému výraznému snížení respiračních a ventilačních parametrů
5) Mimoplicní komplikace
jsou méně časté, ale zpravidla velmi závažné. Patří k nim meningitida, artritida, endokarditida, ale také řada neinfekčních komplikací jako plicní embolie, srdeční selhání, akutní infarkt myokardu či renální selhání. Jinou život ohrožující komplikací je rozvoj syndromu akutní dechové tísně a multiorgánové selhání (4).
Vlastní pozorování
Nemocná ve věku 55 let s negativní osobní anamnézou byla přijata na naši kliniku v červnu 2008. V průběhu letní dovolené tři týdny před hospitalizací se u nemocné objevily bolesti v zádech pod levou lopatkou. Byla vyšetřena na interní ambulanci, stav byl hodnocen jako vertebrogenní algický syndrom a nemocné byly několik dnů ambulantně podávány infúze s Guajacuranem a Mesocainem. Bolesti přetrvávaly, navíc se objevily subfebrilní teploty a mírná námahová dušnost.
S touto symptomatologií byla nemocná doporučena k vyšetření na neurologii. Zde byl proveden jednorázově obstřik páteře a byla nasazena nesteroidní antirevmatika a myorelaxancia.
Stav se však nadále zhoršoval, i když bolesti v zádech mírně polevily, objevily se febrilie a došlo také k výrazné progresi dušnosti. Vzhledem k dušnosti byla nemocná doporučena k vyšetření do pneumologické ambulance. Zde byl proveden skiagram hrudníku, na kterém bylo patrno prakticky kompletní zastření levého hemitoraxu (obr. 1) a nemocná byla doporučena k hospitalizaci na plicní oddělení. Zde bylo urgentně provedeno CT vyšetření hrudníku, nález byl hodnocen jako pleurální výpotek. Byla provedena probatorní hrudní punkce, při které bylo s obtížemi evakuováno 20 ml zkaleného sekretu a nemocná byla doporučena k přijetí na naši kliniku. Bylo to 3 týdny poté, co se objevily první příznaky onemocnění, a poprvé za celou dobu byla nemocná fyzikálně vyšetřena až v pneumologické ambulanci.
Obr. 1. Skiagram hrudníku s pneumonií vpravo bazálně a kompletním zastřením levého hemitoraxu. 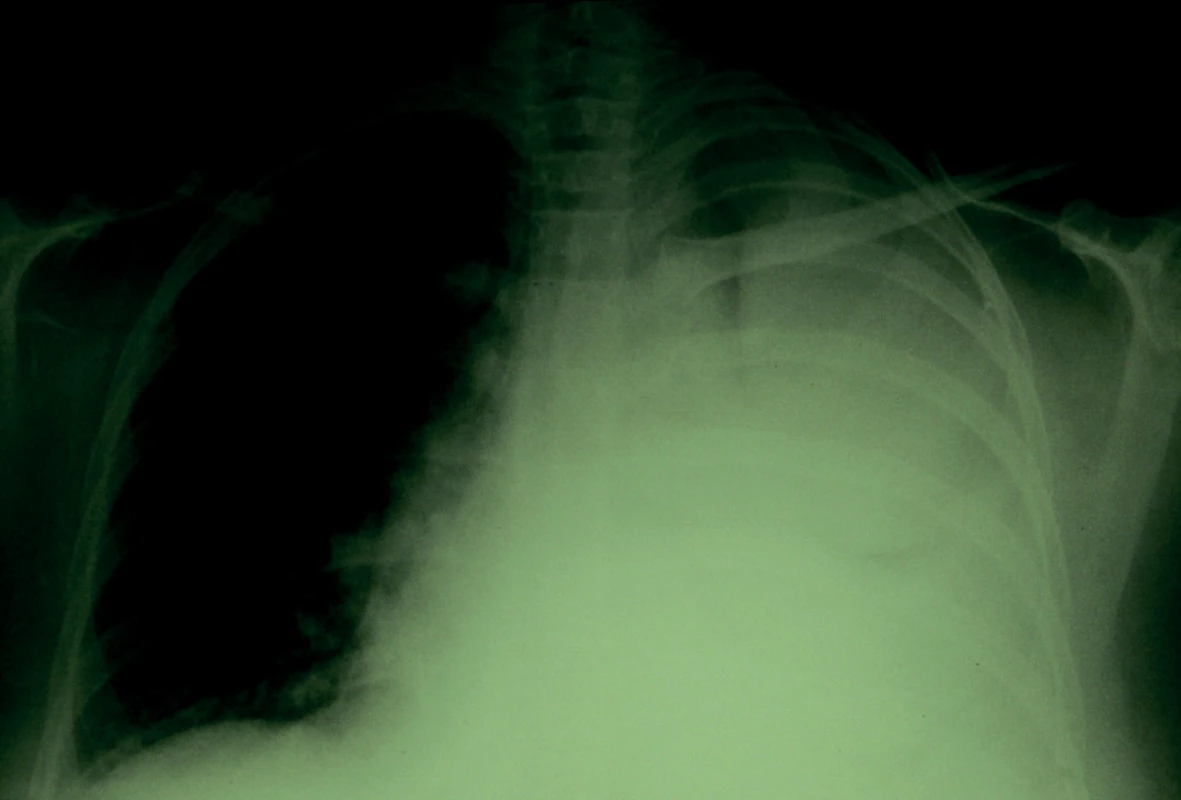
Při přijetí byla nemocná somnolentní, febrilní, schvácená, klidově dušná, opakovaně zvracela, hypotenzní (TK 90/60) s tachykardií a významnou hypoxemií, saturace měřená oxymetrem byla 88 %. Pacientka byla ameningeální, fyzikálně byly vpravo dorzálně při bazi hrudní slyšitelné četnější chrůpky, vlevo bylo dýchání neslyšné, poklep temný v rozsahu téměř celého hemitoraxu. Kardiálně byla nemocná kompenzovaná.
V laboratorních nálezech byla patrná leukocytóza s počtem leukocytů 18,6 109/l, anémie (hemoglobin 105 g/l), C reaktivní protein (CRP) byl výrazně zvýšen (426 mg/l), hodnota prokalcitoninu byla 6,25 mg/l. Renální funkce byly v normě, v mineralogramu byla přítomna hypokalémie (K 3,2 mmol/l). Dále byly lehce zvýšené hodnoty transamináz a výrazně zvýšené hodnoty obstrukčních jaterních enzymů (alkalická fosfatáza 6,7 μkat/l, GMT 15,5 μkat/l). Nález na zapůjčeném skiagramu hrudníku jsme hodnotili jako oboustrannou pneumonii s levostranným multilokulárním fluidotoraxem.
Ihned po přijetí byla po probatorní hrudní punkci zavedena vlevo dorzálně při dolním úhlu lopatky hrudní drenáž, evakuováno bylo pouze 250 ml páchnoucího zelenošedého hnisu. Následně byla proto intrapleurálně s dobrým efektem aplikována fibrinolytika, celkově bylo v průběhu 24 hodin evakuováno 850 ml hnisu, kontrolní skiagram vykazoval částečnou regresi nálezu (obr. 2 a 3), klinický stav nemocné se částečně zlepšil.
Obr. 2. Částečná regrese levostranného nálezu po zavedení hrudní drenáže a evakuaci hnisu. 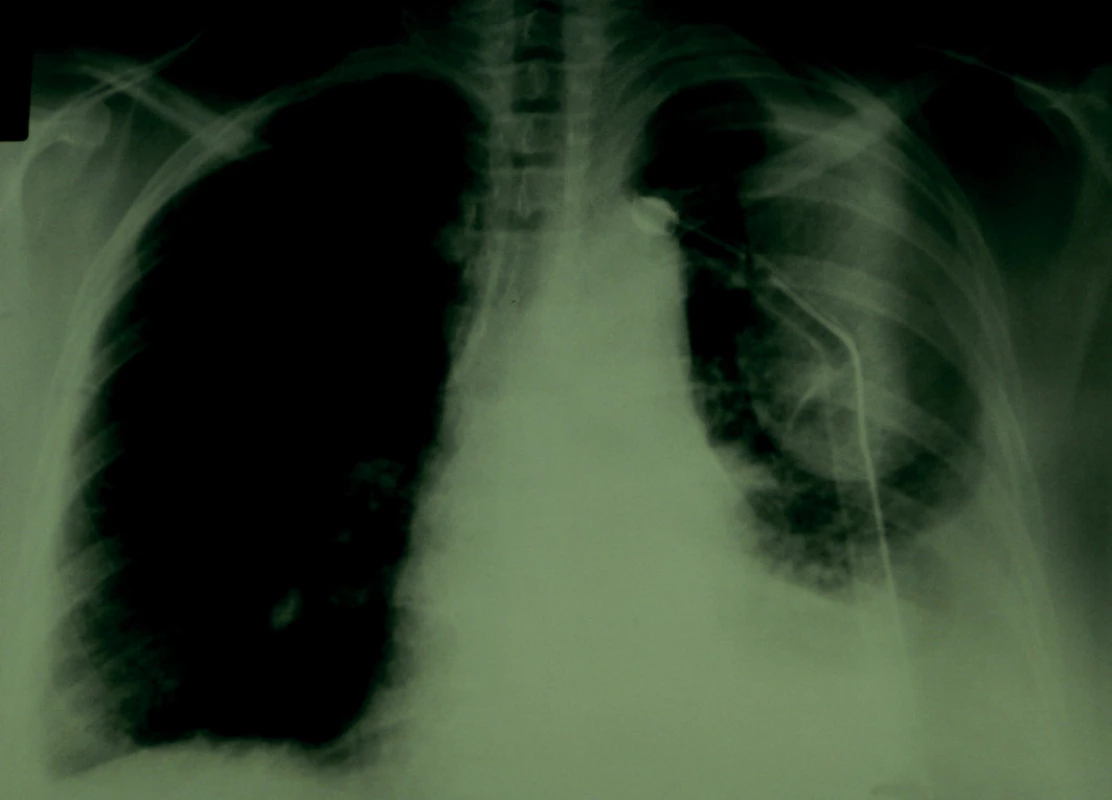
Obr. 3. Boční projekce s patrným dorzálně zavedeným hrudním drénem a perzistujícím opouzdřeným fluidotoraxem ventrokraniálně 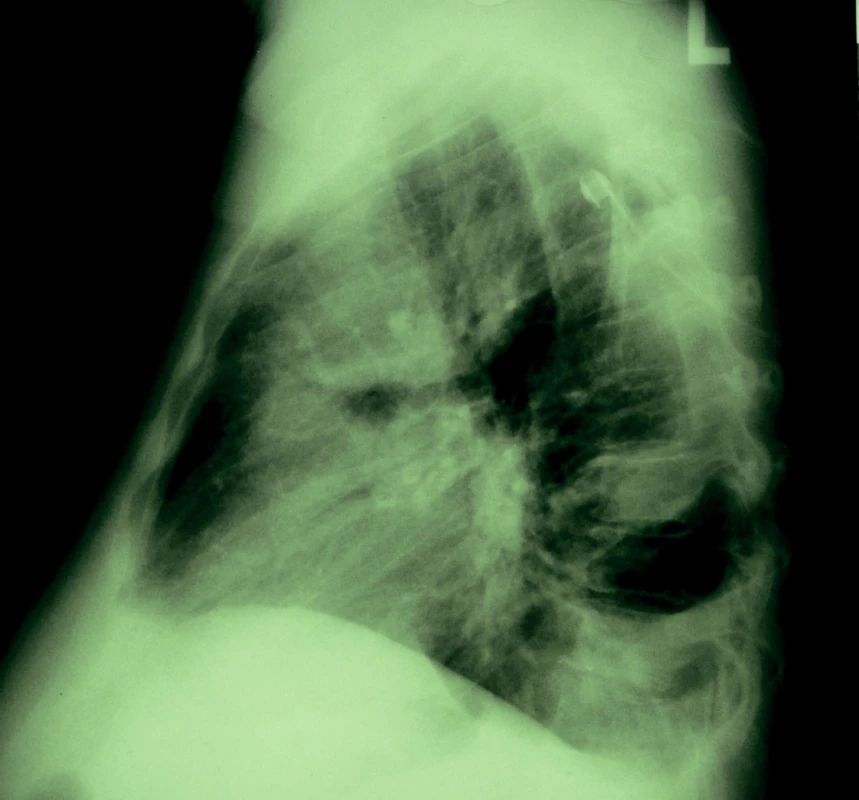
Vstupně byly opakovaně nabrány hemokultury a následně zahájena parenterálně antibiotická léčba v kombinaci Fortum + Neloren. Nemocná byla celkově přešetřena. Hemokultivace aerobní i anaerobní byly opakovaně negativní, pneumokokový antigen v moči byl rovněž negativní. Ve sputu, pleurálním sekretu a v bronchiálním aspirátu byla kultivačně zachycena gramnegativní, blíže nespecifikovaná tyčinka citlivá na podané cefalosporinové antibiotikum. Bylo provedeno fibrobronchoskopické vyšetření s nálezem difúzních zánětlivých změn s maximem postižení bronchů pro dolní laloky, s patrnou hlenohnisavou sekrecí z bronchu pro levý dolní lalok. USG břicha prokázalo normální nález na orgánech dutiny břišní, rovněž echokardiografické vyšetření bylo v normě.
Při komplexní terapii došlo k výraznému zlepšení klinického stavu i ke zlepšení laboratorních parametrů, odpady drénem byly minimální, sekret jen mírně zkalený, po 6 dnech byla provedena exdrenáž. Přetrvávaly však intermitentní teploty, ojediněle i febrilie a na skiagramu hrudníku nadále perzistoval poměrně rozsáhlý nález – přes opakovanou intrapleurální aplikaci fibrinolytik nedošlo ke sjednocení empyémové dutiny. Byla proto provedena cílená drenáž ventrálně lokalizovaného opouzdřeného sekretu (obr. 4 a 5).
Obr. 4. Cílená drenáž ventrálního lokulu. 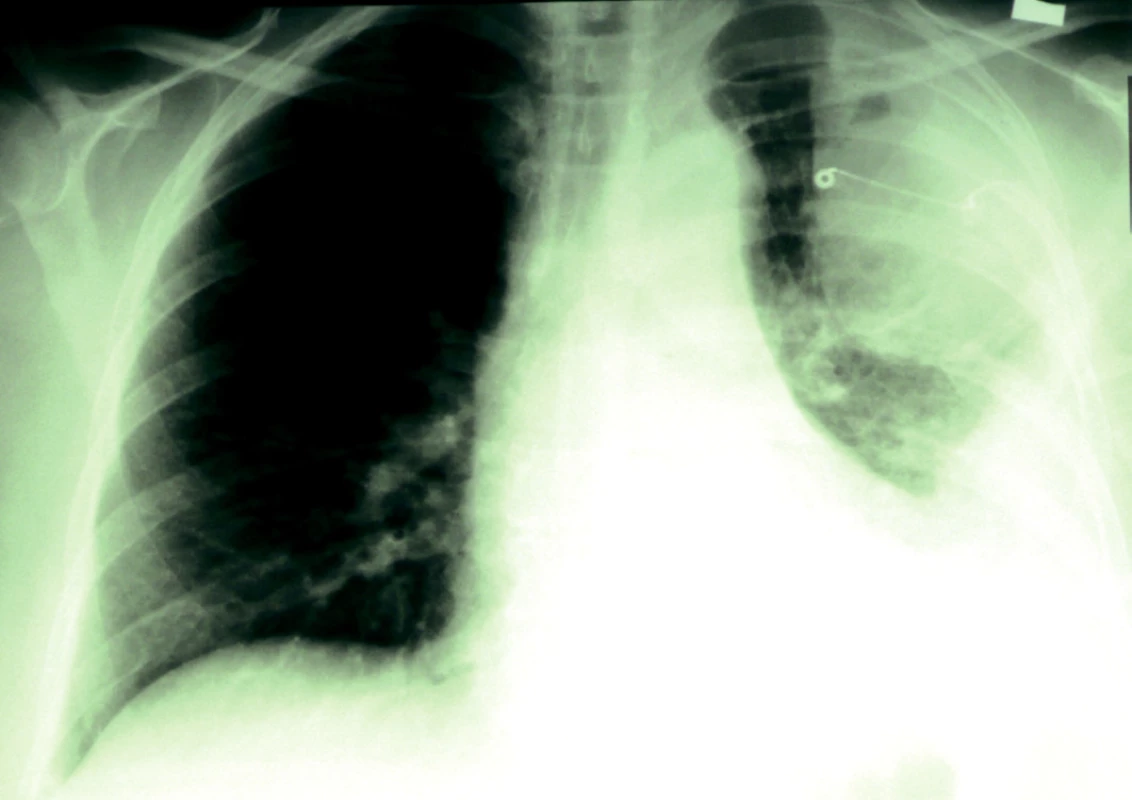
Obr. 5. Boční projekce – cílená drenáž ventrálního lokulu. 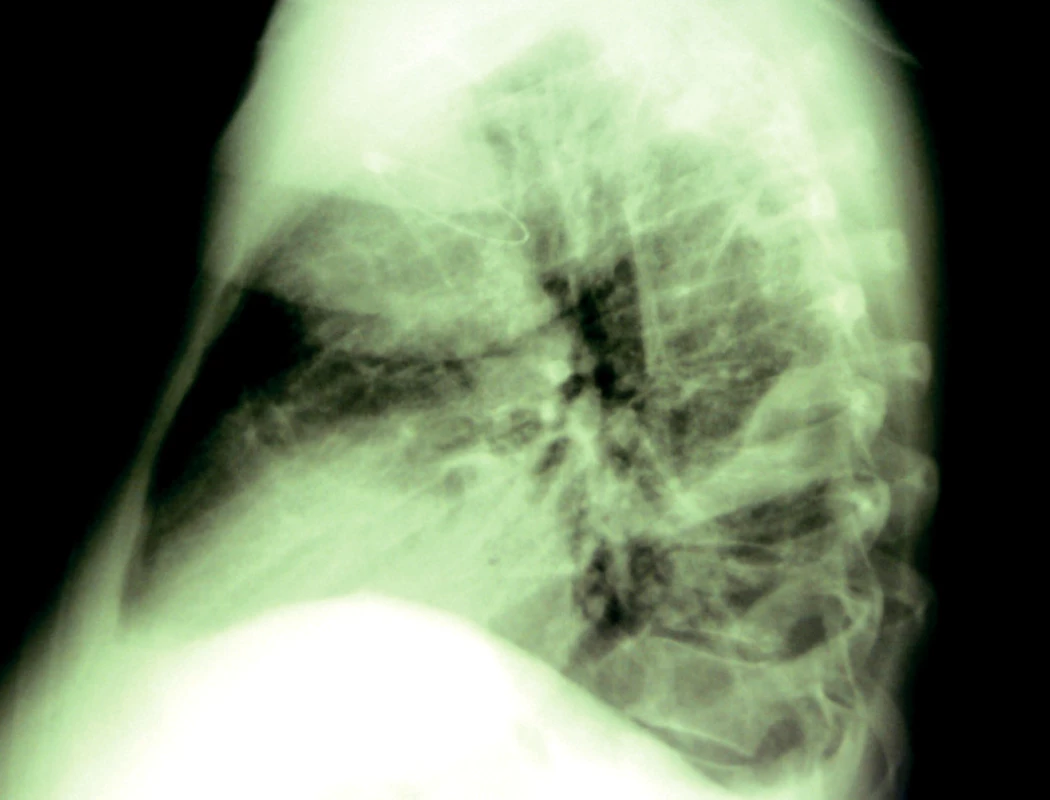
Celkem zde bylo postupně evakuováno 320 ml zkaleného, sanguinolentního sekretu. Současně byla po konzultaci s antibiotickým centrem doplněna antimikrobiální terapie o Ciphin a Mycomax a ukončena léčba cefalosporinem. Extrakce tohoto drénu byla provedena po 3 dnech. Dále již byl průběh bez komplikací, nemocná byla po celkové době hospitalizace 14 dnů v dobrém stavu propuštěna.
Laboratorní parametry byly při dimisi prakticky v normě: CRP 20 mg/l, hemoglobin 119 g/l, přetrvávala mírná elevace transamináz a obstrukčních jaterních enzymů. Respirační parametry byly v normě, hodnoty ventilace byly při propuštění při dolní hranici normy (FVC 83 %, FEV1 78 %). Na skiagramu hrudníku byla patrná oboustranně téměř kompletní regrese nálezu (obr. 6).
Obr. 6. Skiagram hrudníku před dimisí – výrazná regrese oboustranného nálezu. 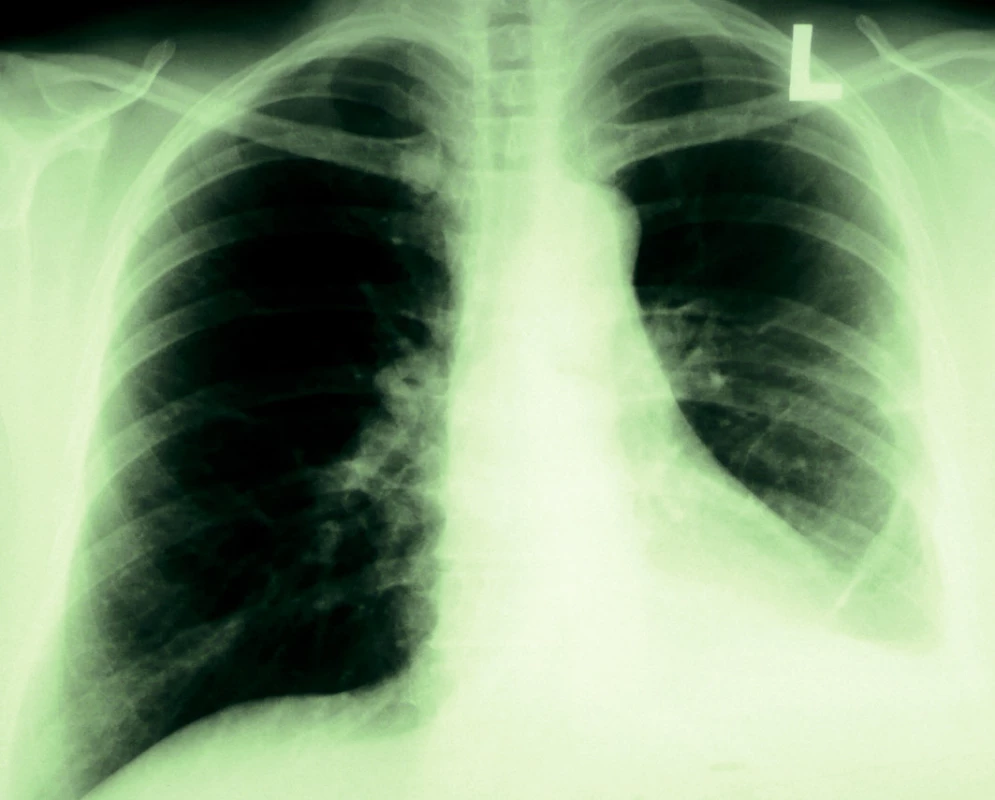
V současnosti je nemocná dispenzarizována v ambulanci pleurálních komplikací naší kliniky, subjektivně je zcela bez obtíží, skiagram hrudníku je bez patologického nálezu, došlo k normalizaci ventilačních parametrů.
Závěr
I v dnešní době je bakteriální pneumonie závažným onemocněním a může představovat diagnostický a především terapeutický problém. Celosvětově se jedná o vůbec nejčastější infekční onemocnění s relativně vysokou mortalitou, která stoupá s věkem a přítomnými chronickými chorobami. Přestože stanovení diagnózy většinou není obtížné, dochází někdy k podhodnocení klinické symptomatologie, zvláště u mladších a jinak zdravých nemocných, nebo naopak u starých jedinců, u kterých klinická symptomatologie nemusí být zcela typická. Může tak dojít k rozvoji dalších závažných komplikací, které výrazně prodlužují morbiditu, mohou zanechat trvalé následky nebo mohou končit letálně.
Z uvedeného vyplývá klíčové postavení lékaře prvního kontaktu, na kterém je nejen stanovení diagnózy a zahájení adekvátní terapie, ale rovněž rozhodnutí o ambulantní či nemocniční léčbě. Základem celého diagnostického a rozhodovacího procesu nadále zůstává pečlivá anamnéza, důkladné fyzikální vyšetření a zvážení všech faktorů, které mohou ovlivnit průběh onemocnění a výsledek terapie.
MUDr Pavla Žáčková
Pneumologická klinika 1. LFUK
Fakultní Thomayerova nemocnice s poliklinikou
Vídeňská 800
140 59 Praha 4
E mail: pavla.zackova@ftn.cz
Zdroje
1. Almirali, J., Bolibar, I., Serra-Prat, M. et al. New evidence of risk factors for community - acquired pneumonia: a population-based study. Eur. Respir. J. 2008, 31, p. 1274-1284.
2. Kolek, V. Standard diagnostiky a léčby komunitní pneumonie dospělých. Dostupné na http://www.pneumologie.cz/odborne/doc/Pneumonie%20standard%20RESP2%202007.pdf, 16.1. 2007, aktualizace 1. 4. 2007.
3. Kolek, V. Jak v ČR léčíme pneumonie v ambulanci a v nemocnici? Kazuistiky v alergologii, pneumologii a ORL, mimořádná příloha časopisu, 2008, s. 4-5.
4. Krofta, K. Pneumologie. Praha: Triton, 2005, s. 126-146. ISBN 80-7254-710-0.
5. Macfarlane, J. T. Lung infections. In: Respiratory Medicine. Specialist handbook. 2 vyd. United Kingdom: Overseas Publisher Association, 2002, p. 331-354. ISBN 90-5823-077-5.
6. Nawal Lutfiyya, M., Henley, E., Chang, L.F. et al. Diagnosis and treatment of community-acquired pneumonia. Am. Fam. Physician. 2006, 73, p. 442-450.
7. Niederman, M.S. Recent advances in community-acquired pneumonia. Chest 2007, 131, p. 1205-1215.
8. Skřičková, J. Záněty plic – úvod do problematiky. Stud. Pneumol. Phthiseol. 2006, 1 , p. 3-9.
9. Spindler, C., Ortvist, A. Prognostic score systems and community-acquired bacteraemic pneumococcal pneumonia. Eur. Respir. J. 2006, 28, p. 816-823.
Štítky
Praktické lékařství pro děti a dorost Praktické lékařství pro dospělé
Článek vyšel v časopisePraktický lékař
Nejčtenější tento týden
2008 Číslo 10- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- S MUDr. Štěpánem Budkou o rizicích obezity pro fertilitu ze všech úhlů pohledu
- Lokální antiseptická terapie faryngitidy – účinnost oktenidinu a zachování integrity střevní mikrobioty
- S prof. Vladimírem Paličkou o racionální suplementaci kalcia a vitaminu D v každodenní praxi
-
Všechny články tohoto čísla
- Od Masarykových domovů k Thomayerově nemocnici
- Mentalizace
- Základní obecná klasifikační schémata dětských zlomenin
- Primární extragonadální germinální nádory u mužů Analýza souboru z let 1994–2008
- Syndrom Guillain-Barré Specifika intenzivní péče, možnosti terapeutického využití plazmaferézy a naše zkušenosti
- Historie a současnost registrace vrozených vad v České republice
- Netypický tumor nosohltanu ve vyšším věku – angiofibrom nosohltanu?
- Komunitní pneumonie
- Historie a současnost pneumologie ve Fakultní Thomayerově nemocnici
- Péče o děti s tuberkulózou v rámci Fakultní Thomayerovy nemocnice
- Jubilea
- Miniportréty slavných českých lékařů Profesor MUDr. Jan Maršálek, hradecký a olomoucký gynekolog a porodník
- Ceny předsednictva ČLS JEP za nejlepší knižní publikace a odborné články v roce 2007
- Jednoduchá odpověď na složité problémy: chůze!
- Konference DNA diagnostiky
- Everything I Can
- Více než 1 500 lidí porušilo léčebný režim
- Netradiční projekt pro odvykání kouření aneb dokuřte s Radiožurnálem
- Praktický lékař
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Syndrom Guillain-Barré Specifika intenzivní péče, možnosti terapeutického využití plazmaferézy a naše zkušenosti
- Základní obecná klasifikační schémata dětských zlomenin
- Mentalizace
- Netypický tumor nosohltanu ve vyšším věku – angiofibrom nosohltanu?
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání




