-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Multimodální magnetické nanomateriály v diagnostice a terapii
Multimodal magnetic nanomaterials for diagnostics and therapy
Aim: Application of magnetic nanoparticles as multimodal materials for current diagnostics and therapy.
Introduction: Rapid developments in nanotechnology have facilitated the emergence of new nanomaterials. This trend is also associated with an increased interest in nano and micro systems consisting of magnetic carriers. By combining a magnetic vector with a biologically active substance, unique properties can be achieved which can be used in many areas of biotechnology and medicine. Issues description: The most common materials are magnetic nanoparticles synthesised of iron oxides. Currently, widely studied are superparamagnetic iron oxide nanoparticles, socalled SPIONs, which below a certain size range (1–20 nm) exhibit a single-domain character, which causes a phenomenon called superparamagnetism. In addition to particle size, surface properties are important. The surface size (in the order of 100 m2/g) allows its modification, which increases the biocompatibility of particles and reduces toxicity. Magnetic nanoparticles have considerable potential for use in biomedical applications, especially in the field of teranostics. At present, nanoparticle systems are studied mainly as contrast agents in MR imaging techniques, in positron emission tomography, or the conversion of magnetic energy into thermal energy can be used, which uses a method called hyperthermia. Other uses include separation, cell analysis, or cell labeling, which appear promising in imaging methods.
Conclusion: As shown, the application of magnetic nanoparticles in medicine is extensive. The primary challenge is the synthesis of these nanoparticles, and there are a number of processes that provide nanoparticles with different properties. Due to the nature of nanoparticles, the care must also be taken to stabilize them in order to prevent aggregation, and in the case of their use as carriers, it is also necessary to solve the problem of entrapment of the desired substance. These problems are still the subject of research, but despite these difficulties, magnetic nanoparticles are a potentially powerful tool for current diagnostics and therapy.
Keywords:
SPIONs – megnetism – hyperthermy
Autoři: Martin Vlk 1,2; Veronika Valová 1,2; Matěj Štíbr 1; Zuzana Sobkuliaková 1; Ján Kozempel 1
Působiště autorů: Katedra jaderné chemie, Fakulta jaderná a fyzikálně inženýrská, České vysoké učení technické v Praze 1; Klinika nukleární medicíny a endokrinologie, Fakultní nemocnice v Motole, Praha, ČR 2
Vyšlo v časopise: NuklMed 2022;11:22-31
Kategorie: Přehledová práce
Souhrn
Cíl: Využití magnetických nanočástic jako multifunkčních materiálů pro současnou diagnostiku a terapii.
Úvod: Rychlý vývoj v oblasti nanotechnologií usnadnil vznik nových nanomateriálů. S tímto trendem je také spojen zvýšený zájem o nano a mikro systémy tvořené magnetickými nosiči. Spojením magnetického nosiče s biologicky aktivní látkou lze dosáhnout unikátních vlastností využitelných v mnoha oblastech biotechnologie a medicíny.
Popis problematiky: Mezi nejvíce studované materiály se řadí magnetické nanočástice tvořené oxidy železa. V současné době se velká pozornost věnuje superparamagnetickým nanočásticím oxidů železa, tzv. SPIONs (superparamagnetic iron oxide nanoparticles), které pod určitou hranicí velikosti (1–20 nm) vykazují jednodoménový charakter, který způsobuje jev zvaný superparamagnetismus. Vedle velikosti částic jsou důležité povrchové vlastnosti. Velikost povrchu (řádově 100 m2/g) umožňuje jeho modifikaci, čímž je zvýšena biokompatibilita částic a snížena toxicita. Magnetické nanočástice mají značný potenciál využití v biomedicínských aplikacích, a to zejména v oblasti teranostiky. V současnosti jsou nanočásticové systémy studovány zejména k zesílení kontrastu u zobrazovacích technik MRI, v pozitronové emisní tomografii, případně lze využít přeměny magnetické energie na energii tepelnou, čehož využívá metoda zvaná hypertermie. Další využití představuje separace, analýza buněk nebo značení buněk, které se zdá být slibné v oblasti zobrazovacích metod.
Závěr: Jak se ukazuje, problematika uplatnění magnetických nanočástic v lékařství je rozsáhlá. Prvotní výzvou je syntéza těchto nanočástic, přičemž existuje řada postupů, které poskytují nanočástice o různých vlastnostech. Kvůli povaze nanočástic je také nutné věnovat velikou pozornost jejich stabilizaci, aby se předcházelo agregaci a v případě jejich použití jakožto nosiče je taktéž nutné vyřešit problém zachycení požadované látky. Tyto problémy jsou stále předmětem výzkumu, ale i přes tyto obtíže představují magnetické nanočástice potenciální mocný nástroj pro současnou diagnostiku a terapii.
Klíčová slova:
SPIONs – magnetismus – hypertermie
Úvod
Nanotechnologie patří v současnosti k jednomu z nejrychleji se rozvíjejících multidisciplinárních oborů na poli vědy. Do popředí zájmu se dostaly v posledních desetiletích, kdy byla dána velká pozornost různým typům nanočástic. Mezi ně se řadí i magnetické nanočástice, které mají značný potenciál využití v biomedicínských aplikacích, a to díky svým fyzikálním, chemickým, mechanickým a magnetickým vlastnostem. Magnetické nanočástice představují multifunkční nástroj, který nalézá uplatnění v řadě odvětví lidské činnosti. Tato práce podává krátký přehled o syntéze, stabilizaci a využití magnetických nanočástic při zobrazování magnetickou rezonancí, dále jejich značení různými radionuklidy a využití těchto značených nanočástic při zobrazování PET a SPECT a také využití v radioterapii.
Mezi různými typy magnetických nanočástic hrají významnou roli superparamagnetické nanočástice oxidů železa (SPIONs). Jedná se hlavně o hematit (α-Fe2O3), maghemit (γ-Fe2O3), magnetit (Fe3O4) a různě dopované či kompozitní variace feritů.1 Magnetické nosiče jsou považovány za slibné kandidáty v oblasti terapie a diagnostiky, a to díky jejich superparamagnetickým vlastnostem, modifikaci povrchu částic a velikosti. Velikost částic umožňuje dobrou tkáňovou difuzi, zajišťuje distribuci nanočástic co nejblíže k místu biologického zájmu a jejich povrch může být funkcionalizován podle potřeby použité aplikace. SPIONs mající velikost několika nanometrů (1–20 nm) vykazují jednodoménový charakter, který způsobuje jev zvaný superparamagnetismus. 2 Superparamagnetické materiály po odstranění vnějšího magnetického pole nezachovávají žádnou zbytkovou magnetizaci, čímž je zabráněno možnému shlukování nanočástic v krevním řečišti a vytváření případných embolií.
Magnetické nanočástice jsou studovány v mnoha odvětvích medicíny, např. jako potencionální nosiče léčiv, které by mohly být použity při tzv. cíleném transportu léčiv. V nanochirurgii jsou vyvíjeny ke zničení maligních buněk vlivem lokálně zvýšené teploty ve střídavém magnetickém poli (tzv. hypertermie). Dále jsou studovány a využívány jako kontrastní látky v zobrazovacích technikách magnetické rezonance (MRI). V klinické a preklinické praxi jsou rovněž studovány značené nanočásticové systémy, zejména radionuklidy 18F, 68Ga, 67Ga, 89Zr, 90Y, 99mTc a terapeutickými alfa zářiči, které by mohly vést k vývoji nových diagnostik nebo terapeutik.
Příprava magnetických nanočástic
S rostoucím počtem studií zabývajících se SPIONs v biomedicínských aplikacích byla popsána řada metod, které vedou k jejich syntéze. Nejběžnějším postupem pro přípravu magnetických nanočástic je koprecipitace solí železa. 3 Spolusrážení v bazickém prostředí je velmi rozšířená a robustní metoda, která byla poprvé použita před více než třiceti lety. Principem je smíchání roztoků železnatých (Fe2+) a železitých (Fe3+) solí v molárním poměru Fe3+:Fe2+ rovném 2 : 1 v rozmezí pH 8–14 za laboratorní až zvýšené teploty (25–85 °C), dle rovnice (1): 4
Fe2+ + 2Fe3+ + 8OH – → Fe3O4 + 4H2O. (1)
Vlastnosti připravovaných nanočástic, zejména velikost, tvar a charakter povrchu, je možné ovlivnit vhodně zvolenými experimentálními podmínkami při jejich syntéze 5, např.: molární poměr Fe2+ : Fe3+, rychlost míchání, reakční teplota 25–85 °C, volba vhodného pH a koncentrace použité báze (NH4OH, NaOH). 6 Nevýhodou této metody je snadná oxidace částic magnetitu (Fe3O4) za přítomnosti kyslíku na maghemit (γ-Fe2O3). Aby se zabránilo případné oxidaci na vzduchu, provádí se syntéza v podmínkách inertní atmosféry. Metoda také umožňuje syntetizovat velké množství částic, avšak se širokou distribucí velikostí připravených částic. Proto je důležité vybrat separační proces, který by co nejjednodušeji izoloval magnetické nanočástice o definované velikosti. Takovými separačními procesy obvykle bývají ultracentrifugace nebo magnetická filtrace. 5
Některé výše zmíněné nevýhody koprecipitační metody vedly k rozvoji pokročilých metod syntézy magnetitu. Mezi ty nejčastější patří: termické rozklady prekurzorů obsahujících železo, sol-gel syntézy, mikroemulzní techniky či sonochemické reakce. 7
Termální rozklad komplexních nebo organických prekurzorů železa se nejčastěji využívá k syntéze magnetických nanočástic s úzkou distribucí velikostí oproti běžné koprecipitační metodě. Nejběžněji se jako výchozí sloučenina využívá acetylacetonát železitý Fe(acac)3, (acac = acetylacetonát), pentakarbonyl železa Fe(CO)5 a N-nitrosofenylhydroxylamin železitý komplex Fe(cup)3 (cup = N-nitrosofenylhydroxylamin). 8 Termální rozklad je prováděn přidáním jednoho z výše uvedených prekurzorů do vysokovroucího organického rozpouštědla (např. oktadekan) společně se surfaktanty, jako jsou mastné kyseliny (nejčastěji kyselina olejová), které stabilizují nanočástice proti případné agregaci. Reakce mohou být prováděny jak za běžné, tak inertní atmosféry při teplotách blízkých 300 °C. 9 Velikost vzniklých nanočástic je poté závislá na poměru prekurzoru ku použité mastné kyselině a také na druhu použité mastné kyseliny. V případě použití dvou různých mastných kyselin lze tak získat nanočástice o dvou různých velikostních distribucích. 9 Ukazuje se také, že kromě použitého poměru prekurzoru k surfaktantu a druhu surfaktantu, má vliv na výslednou velikost a polydispersitu rychlost, s jakou je reakční směs zahřívána na požadovanou teplotu. 10 Nevýhodou syntézy pomocí termálního rozkladu je využívání vysokých teplot spolu v kombinaci s organickými rozpouštědly, což představuje značné bezpečnostní riziko. Další problém nastává, když se takto připravené nanočástice chtějí využít pro biologické aplikace, neboť jejich povrch je obalen hydrofobními molekulami. Nanočástice je ale často vhodné využít dispergované ve vodném prostředí, a proto musejí být dále promývány polárními rozpouštědly, např. ketony a alkoholy. 11
Kontrolu nad velikostí a tvarem syntetizovaných nanočástic umožňuje mikroemulzní technika, při které dochází k vytvoření tzv. mikroemulze, tedy malých kapiček vzájemně nemísitelných kapalin. K udržení tvaru těchto kapiček je využíváno přídavku surfaktantu, který vytváří vrstvu mezi oběma kapalnými fázemi. Často je využívána mikroemulze vody v oleji, kdy kapičky vody stabilizované pomocí surfaktantu jsou emulgovány v organické kapalné fázi. Tyto kapičky vody mají v průměru od 1–50 nm a můžou tak sloužit jako nanoreaktory pro tvorbu nanočástic o požadované velikosti. 2 Nanočástice jsou pak syntetizovány obdobně jako při koprecipitaci, kdy jedna mikroemulze obsahuje železnaté a železité ionty a druhá identická mikroemulze obsahuje rozpuštěnou bázi. Smícháním těchto dvou mikroemulzí dojde ke kontaktu vodných fází a tvorbě nanočástic, které se oddělí přídavkem ketonů nebo alkoholů a následnou filtrací nebo centrifugací. Nevýhodou této metody jsou nízké výtěžky, a tedy nutnost použít velká množství rozpouštědel, aby se dosáhlo přijatelného množství vznikajících nanočástic. Tento problém se podařilo vyřešit pomocí zahřívání mikroemulze za vyšší teploty, přičemž je dosaženo vysokých výtěžků i ve větším měřítku a taktéž byly syntetizovány vysoce krystalické monodisperzní nanočástice magnetitu. Tímto postupem bylo demonstrováno, že velikost vzniklých nanočástic je možné kontrolovat pomocí změny koncentrace solí železa, změny množství přidávaného surfaktantu a rozpouštědla a dále poměrem polárního rozpouštědla k surfaktantu. Lze tak získat nanočástice o poměrně úzké distribuci velikosti 2–10 nm. Metodu lze také využít k syntéze smíšených oxidů železa s jinými kovy. 12
Vysoce krystalické nanočástice s úzkou distribucí velikostí částic jsou získávány hydrotermální metodou. Tento přístup je založen na zahřívání reakční směsi ve vodném prostředí na teploty okolo 130 °C až 250 °C a tlaku 0,3 MPa až 4 MPa 13, přičemž může probíhat jak koprecipitace, tak i termální rozklad v autoklávu. V případě jiného rozpouštědla se jedná o solvotermální metodu. Kromě kontroly nad velikostí nanočástic a krystalinity umožňuje tato metoda také ovlivnění tvaru výsledných SPIONs. Bylo zjištěno, že přídavek aniontů do reakční směsi a taktéž koncentrace Fe3+ iontů mají vliv na výsledný tvar. Přídavek fosforečnanových PO43- iontů a vyšší koncentrace Fe3+ vede ve prospěch tvorby nanotrubiček, zatímco přídavek síranových SO42- aniontů favorizuje tvorbu dutých nanočástic. 13 Takto připravované nanočástice je však vždy nutné dodatečně stabilizovat. Ve variantě navržené Xiao et al. jsou hydrotermálně připravené nanočástice stabilizovány parciální redukcí hydroxidu železitého Fe(OH)3 pomocí kyseliny askorbové. Využitím určitého poměru kyseliny askorbové k hydroxidu železitému bylo dosaženo tvorby přesného množství hydroxidu železnatého Fe(OH)2 in situ. Kyselina dehydroaskorbová, která vznikala jako vedlejší produkt, zároveň sloužila jako stabilizátor vznikajících nanočástic. Takto připravené nanočástice byly jednak biokompatibilní a zároveň vykazovaly dobré vlastnosti pro využití jako negativní kontrastní látky v MRI. 14
Zajímavou alternativou k ostatním metodám je využití mikrovlnného záření pro syntézu nanočástic. Mikrovlnné generátory jsou v organické syntéze využívány od 80. let minulého století a v současné době nalézají širšího uplatnění. Při interakci mikrovlnného záření (konkrétně jeho elektrické složky) s dipóly molekul ozařované látky dochází k „rozkmitání” těchto molekul, což má za následek zahřátí reakční směsi. Tento způsob zahřívání oproti konvenčnímu má tu výhodu, že teplo je v reakční směsi distribuováno rovnoměrně, zatímco v konvenčním způsobu je teplo soustředěno hlavně na stěnách reakční nádoby. Další nespornou výhodou je možnost automatizace procesu syntézy, úspora energie, a hlavně podstatné snížení reakční doby, která se pohybuje v řádu sekund až minut. 15 K syntéze jsou využívány postupy založené jak na koprecipitaci železitých a železnatých iontů, tak i termální rozklad. Pro přípravu nanočástic magnetitu lze také využít částečné redukce železitých iontů in situ, kdy do vodného roztoku FeCl3 a polyethylenglykolu (PEG) je přidáván roztok hydrazinu, přičemž PEG slouží ke stabilizaci vznikajících nanočástic. Následně je reakční směs 10 minut zahřívána v mikrovlnném reaktoru na 100 °C. Takto lze získat nanočástice magnetitu o velikosti menší než 20 nm. Hydrazin slouží nejenom jako redukční činidlo, ale svým rozkladem za vyšších teplot, uvolňuje dusík, který chrání vznikající magnetit před oxidací. Přídavkem peroxidu vodíku do reakční směsi lze poté získat nanočástice hematitu. 16
Stabilita nanočástic
Stabilitu SPIONs v suspenzi zajišťují hydrofobně – hydrofilní, magnetické a Van der Waalsovy síly. Vlivem hydrofobně – hydrofilních sil dochází ke shlukování SPIONs, což je vyvolané hydrofobními interakcemi mezi částicemi (poměr povrchu nanočástic k jejich malému objemu je velký). Shluky (klastry) řádově o rozměrech mikrometrů dále agregují v důsledku magnetických dipól-dipólových interakcí, které způsobují magnetizaci sousedních klastrů. V přítomnosti externího magnetického pole může dojít k další magnetizaci těchto klastrů, a tím ke zvýšení jejich agregace. 17 V případě využití magnetických nanočástic v biomedicínských aplikacích je nutné povrch částic vhodně upravit, aby agregace nenarušovala účinnost SPIONs, např. při cílené vektorizaci léčiv. Modifikací povrchu lze nejen zabránit jejich agregaci, ale lze zvýšit i jejich biokompatibilitu a snížit cytotoxicitu. 7,18
Ke stabilizaci nanočástic existuje několik přístupů. První možností je vytvoření tzv. core-shell struktury. V tomto případě neobalené nanočástice reprezentují „jádro” (core) vznikajícího útvaru, které je obaleno vrstvou nějaké látky (shell), která tak odděluje nanočástice od okolního prostředí. (Obr. 1) Druhým přístupem je jejich rozptýlení nebo uzavření do polymerní matrice nejčastěji na bázi křemíku nebo uhlíku. Nicméně tento přístup není zrovna vhodný, jelikož nanočástice jsou poté pevně fixovány v prostoru vůči sobě. 2
Obr. 1. Core-shell struktura nanočástic (zdroj: autor). 
Při vytváření core-shell struktur je povrch nanočástic obalen povrchovými materiály, např. přírodními polymery (dextran, chitosan), syntetickými polymery (polyethylenglykol, polyvinylalkohol (PVA)), organickými látkami (kyselina stearová, olejová, palmitová, citrónová) nebo anorganickými materiály (oxid křemičitý). Jednotlivé vrstvy látek následně zvětšují povrch nanočástic. Modifikace povrchu může být provedena in situ nebo po skončení syntézy. Případné stabilizátory by s výhodou měly být biokompatibilní a biologicky odbouratelné.
Povrch nanočástic (obalených např. oxidem křemičitým) může být dále chemicky modifikován (např. silanizací). Následně konjugované funkční skupiny (např. -NH2, -COOH, -OH, -SH, halogenidy, nebo -CONH2) slouží k navázání bioaktivních molekul (např. nukleových kyselin, proteinů, peptidů, protilátek, enzymů) na povrch nanočástice a mohou sloužit jako cílový ligand pro transport nebo navázání radionuklidu, ev. fluorescenční značky.
V případě využití polymerních látek lze využít dvou způsobů stabilizace nanočástic. Prvním způsobem je in situ stabilizace (v průběhu přípravy) a druhým způsobem je post-syntetická stabilizace, přičemž mohou být využity např.: dextran, škrob, chitosan, PEG, PVA a další, případně jejich syntetické deriváty.
Dextran je přírodní, biokompatibilní polysacharid sestávající z α-D-glukózových jednotek s vazbou 1,6 a 1,3. Lze jej využít v širokém intervalu molekulárních hmotností. S povrchem nanočástic interaguje buď pomocí vodíkových můstků nebo chelatací iontů železa. Taktéž se ukazuje, že při využití redukovaného dextranu jsou vytvářeny mnohem stabilnější nanočástice. 7 Pokud jsou nanočástice syntetizovány v přítomnosti dextranu v reakční směsi, dochází k ovlivnění velikosti vznikajících nanočástic. Příkladem může být studie Khalkhali et al., kde autoři připravili nanočástice magnetitu pomocí koprecipitace iontů Fe3+ a Fe2+ v přítomnosti dextranu (13–20 kDa). Takto připravené nanočástice vykazovaly velikost 17 nm oproti nanočásticím připraveným bez přídavku dextranu, které byly v průměru velké 55 nm. 19 Nicméně díky relativně slabým interakcím dextranu s povrchem nanočástic může docházet s časem k jeho uvolňování nebo výměně za silnější ligand. Možným řešením je zavedení funkčních skupin na dextran, jako je karboxymethylová skupina, nebo zesíťováním dextranu pomocí epichlorhydrinu. (Obr. 2). Tento přístup byl například využíván v přípravku Feridex®. 20
Obr. 2. 1. krok: stabilizace povrchu nanočástic dextranem. 2. krok: zesíťování dextranu epichlorhydrinem (převzato a upraveno podle citace 20). 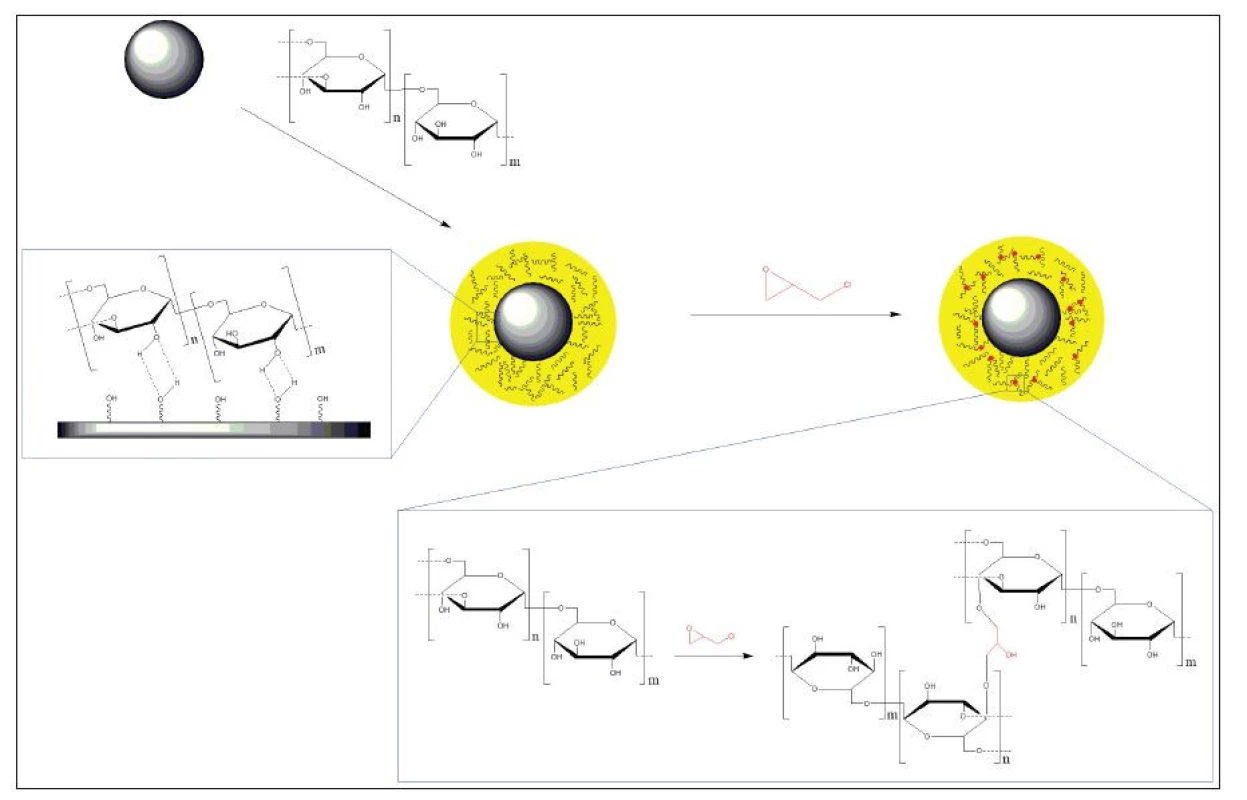
Polyethylenglykol je lineární biokompatibilní polymer, který nanočástice v těle „maskuje“ před retikuloendotelovým systémem (RES), což má za následek prodlouženou dobu cirkulace nanočástic v těle. Nicméně tato vlastnost znamená, že takovéto nanočástice nelze využít pro zobrazování buněk RES. Další výhodou je možnost jeho modifikace, což jednak umožňuje silnější vazbu PEG k povrchu nanočástic a také umožňuje navázání další funkčních molekul. Poslední výhoda, která je právě často využívána k navázání PEG na nanočástice nebo k jeho modifikaci, souvisí s jeho hmotností. PEG s hmotností pod 100 kDa je považován za amfifilní, tedy je rozpustný jak ve vodě, tak i různých organických rozpouštědlech. 21 Příkladem může být využití PEG-bis(trifluorethylesteru), který představuje slibnou výchozí molekulu pro další reakce. Například reakcí s (3-aminopropyl)triethoxysilanem vzniká derivát PEG, který je schopen se kovalentně vázat na povrchu SPIONs přes silanové skupiny. Volné trifluorethylové skupiny poté představují snadno odstupující skupiny pro navázání například kyseliny folové, která slouží jako cílící molekula pro nádorové buňky s vysokým počtem receptorů této kyseliny. 11
Poměrně často je ke stabilizaci využíván křemík, především kvůli stabilitě připraveného obalu a obsahu hydrofilních skupin, což usnadňuje suspendaci nanočástic ve vodném prostředí a navíc stabilizuje nanočástice i v prostředích o nižším pH. 13 Stabilizace nanočástic je umožněna dvěma způsoby. Obal odstiňuje magnetické dipólové interakce mezi nanočásticemi a silanolové skupiny jsou záporně nabité, což zvyšuje Coulombické odpuzování mezi nanočásticemi. 7 Nespornou výhodou tohoto přístupu je vytvoření obalu, který lze díky celé paletě reakcí silanolových skupin modifikovat pro specifické využití nanočástic.
Nejčastěji používaný způsob příprav silanolových kompozitů s nanočásticemi je Stöberova metoda, založená na in situ hydrolýze sol-gel prekurzoru, jakým je například tetraethylorthosilikát (TEOS) v prostředí alkoholů s přídavkem vody nebo vodného roztoku amoniaku nebo kyseliny. Ve studii provedené kolektivem Deng et al. byl studován vliv různých reakčních komponent na tvorbu obalu nanočástic. Jako nejlepší se ukázalo použití ethanolu jako reakčního média, neboť při použití methanolu docházelo k nežádoucí tvorbě nanočástic čistého křemíku, zatímco při použití propanolu a isopropylalkoholu zase docházelo ke shlukování částic. Poměr vody k použitému alkoholu hraje zásadní roli, neboť za určitých poměrů vůbec nemusí dojít k vytvoření obalu. Také odhalili vliv přídavku roztoku amoniaku na tvorbu obalu, kdy velký přídavek roztoku amoniaku způsobuje příliš rychlou hydrolýzu TEOS, což vede k nežádoucí tvorbě křemíkových nanočástic. S rostoucím přídavkem TEOS roste tloušťka křemíkové vrstvy, což má za následek snížení saturační magnetizace nanočástic. 22
Dalším možným způsobem syntézy, který umožňuje větší kontrolu nad tloušťkou křemíkového obalu, je využití mikroemulze. Stejně jako při syntéze SPIONs pomocí mikroemulze, i zde slouží kapičky jako nanoreaktory o určité velikosti. Tento přístup je však náročný na izolaci nanočástic z reakční směsi. 7 Pro zavádění funkčních skupin na povrch nanočástic je často využíváno bifunkčních organosilanů nesoucích trichlorosilanovou (-SiCl3) nebo trialkoxysilanovou skupinu (-SiR3, kde R = OCH3, OC2H5 atd.). Sekundární funkční skupina je nejčastěji aminoskupina -NH2, sulfanylová skupina -SH nebo nitrilová skupina -CN. Při reakci těchto organosilanů s povrchem nanočástic dochází k tzv. silanizaci, což je druh reakce často využívané k získání monovrstev na površích díky vazbám kyslík-křemík. 20 Sekundární funkční skupina se do reakce nezapojuje, popřípadě může být vhodným způsobem chráněná, a je možné ji tak využít pro následné reakce, například pro konjugaci určitého ligandu, anebo linkeru, který tak obohatí povrch o ještě další funkční skupiny. Výhodou těchto povrchů je, že jenom minimálně snižují saturační magnetizaci oproti neobaleným nanočásticím. 8 Nejčastěji používanými organosilany jsou (3-aminopropyl)triethoxysilan pro zavádění aminoskupiny a (3-sulfanylpropyl)trimethoxysilan pro zavádění sulfanylové skupiny. (Obr. 3)
Obr. 3. (3-aminopropyl)triethoxysilan (vlevo) a (3-sulfanylpropyl)trimethoxysilan (vpravo). Reakce trialkoxysilanů s hydroxylovými skupinami na povrchu nanočástic (dole) (zdroj: autor). 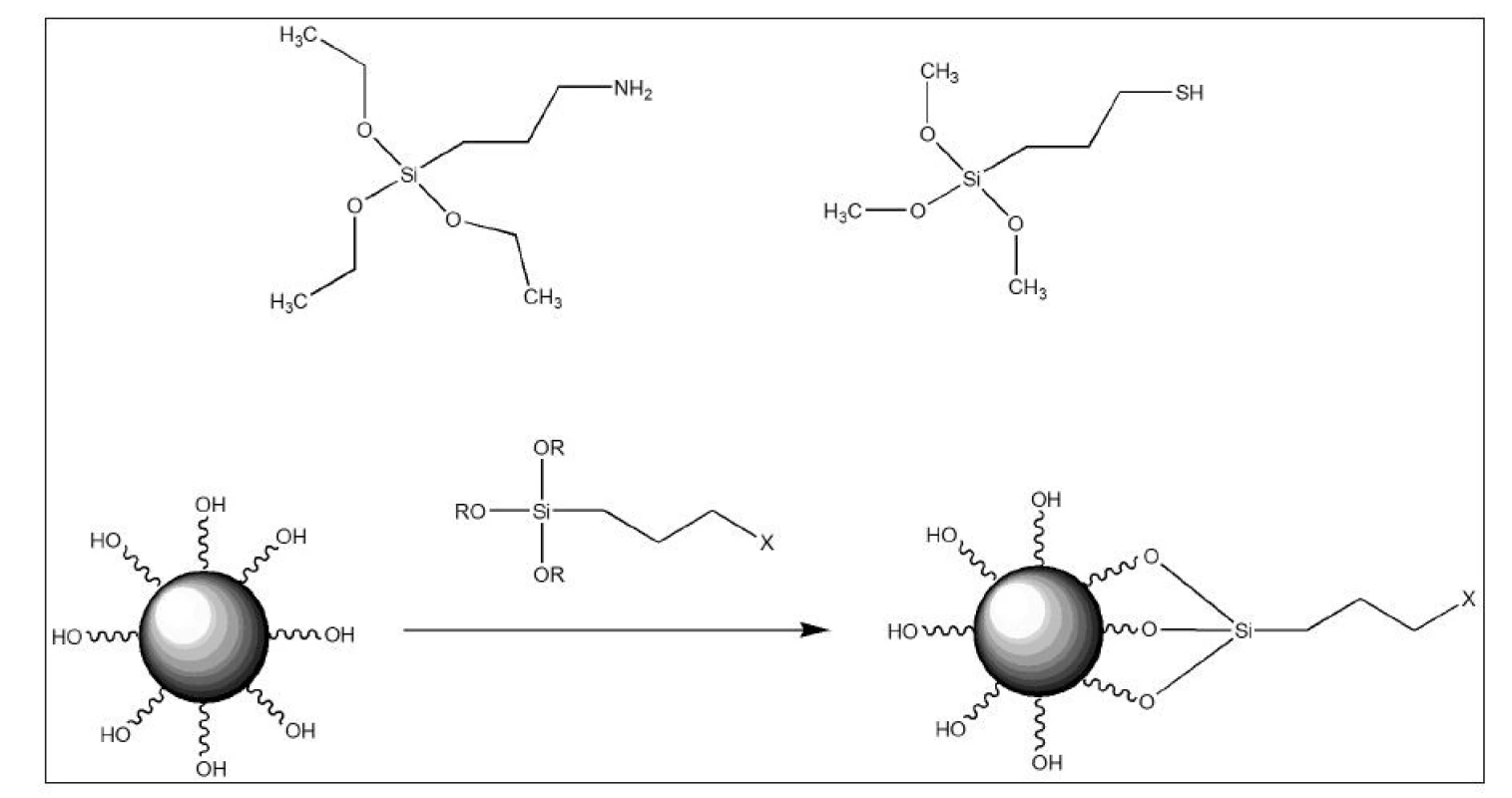
Teranostika
Cílem přípravy magnetických nanočástic je jejich využití jako multimodálních materiálů, a to jak pro současnou diagnostiku, tak pro terapii. Spojením různých účinných látek nebo metod, které kombinují obě aplikace, vznikají systémy, teranostika, která umožňují spojit cílený transport diagnostika i terapeutika, citlivé zobrazování a monitorování odezvy na léčbu. 3 Pokroky v nanotechnologii umožňují využití teranostik v podobě platforem. 23 Na platformě mohou být chemicky vázány diagnostické a terapeutické látky, např. protilátky, aptamery nebo ligandy, které mohou zajistit cílení platformy na vybraný povrchový antigen nádorových buněk a umožnit tak kombinaci terapie a zobrazování. (Obr. 4) Teranostika jsou u molekulárního zobrazování aplikována ve formě zobrazovacích sond, u kterých je využita kombinace vlastností nanomateriálů s jejich velikostí a citlivostí radionuklidů pro zvýšení citlivosti obrazu a specifičnosti vůči cílové tkáni. Zobrazovací sonda se skládá z nanočástic s konjugovaným aktivním cílovým ligandem, specifickými linkery a chelátory. 24 Na nosiči se nachází směrovací částice – vektor, která navede transportér s léčivem do cílového místa. Směrovací částicí může být např. externí spouštěč využívající magnetické pole nebo interní spouštěč, který je schopen uvolnit léčivo při změně pH. Cílení do nádorů však může probíhat i pasivně prostřednictvím zvýšené permeability a retence (EPR – Enhanced Permeability and Retention Effect).
Obr. 4. Využití SPIONs jako multimodálního nosiče (převzato a upraveno podle citace 25). 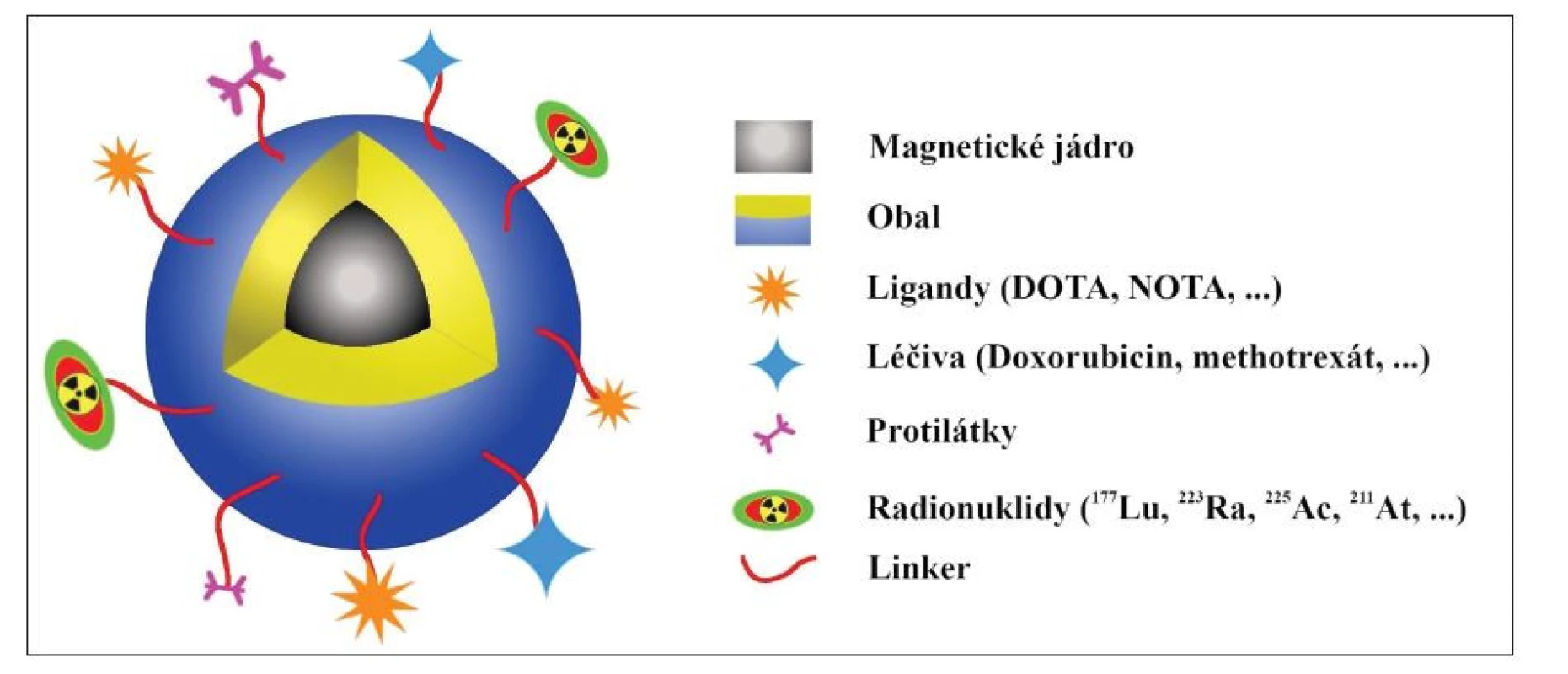
Mezi různými typy nosičů získaly SPIONs velkou pozornost v oblasti teranostik z důvodu jejich studií zabývajícími se dopravením terapeutické látky, např. protinádorového léčiva (doxorubicin nebo methotrexát používané pro léčbu maligních nádorů prostaty nebo revmatoidní artritidy) 25, nebo pro jejich možné využití jako kontrastních látek pro MRI.
Magnetická rezonance (MRI)
Magnetická rezonance patří mezi nejúčinnější a nejvíce využívané zobrazovací techniky, která neinvazivně získává anatomické a metabolické/funkční informace s vysokým prostorovým a časovým rozlišením. 26 Magnetické nanočástice zde nacházejí široké využití zejména jako kontrastní látky při zobrazování např. měkkých tkání nebo průtoku krve, a to zkrácením T1 nebo T2 relaxačního času excitovaných spinů vodíkových atomů ve vodném prostředí. Ke zvýšení citlivosti zobrazení se užívají kontrastní látky obsahující paramagnetické kovové ionty, které svým působením ovlivňují délku relaxačních procesů, podle čehož jsou děleny na skupinu T1 (pozitivní) a T2 (negativní). Mezi tradiční kontrastní látky urychlující T1 relaxační dobu patří například paramagnetické cheláty gadolinia (III) nebo manganu (II). 27 SPIONs se ukazují být možnou alternativou k těmto komplexům a schopností měnit oba relaxační časy vytvářejí lepší kontrast pro vizualizaci oblasti zasažené nádorem 28 a nepůsobí pacientovi žádnou radiační nebo jinou zátěž. Pro biomedicínské aplikace jsou vhodné díky snadnému rozptýlení, jedinečným magnetickým vlastnostem a své mikrostruktuře. K použití superparamagnetických částic je potřeba jejich povrch upravit tak, aby se zabránilo jejich agregaci. Shlukování částic by jednak způsobovalo negativní změny mobility v tělních tekutinách a jejich následné pohlcení makrofágy, jednak by zvyšovalo riziko ucpání cévních kapilár (embolizaci). Superparamagnetická kontrastní látka pro MRI bývá proto tvořena jadérky částic obalených vrstvou např. dextranu nebo oxidu křemičitého.
Značené magnetické nanočástice pro PET zobrazování
Pozitronová emisní tomografie (PET) se využívá ke studiu biochemických a fyziologických procesů v těle pomocí magnetických nanočástic značených PET zářiči 68Ga, 18F a 64Cu. 29 V posledních letech se tyto magnetické sondy začaly zkoumat hybridní modalitou PET/MRI, která využívá morfologické zobrazování měkké tkáně magnetickou rezonancí (MR) a funkční zobrazování pomocí pozitronové emisní tomografie. Příkladem může být využití 64Cu v přípravě SPIONs konjugovaných aminoskupinou dekorovanou DOTA (1,4,7,10-tetraazacyklododekan-1,4,7,10-tetraoctová kyselina) pro zobrazení vaskulárního zánětu. Sondy [64Cu]-SPIONs vykazují silné MRI a PET signály. Této vlastnosti bylo také využito při vývoji sond tvořených SPIONs obalených dextranem (konkrétně komerčně dostupným Endorem/Feridex). Zde bylo využito přímého značení jejich anorganického povrchu bisfosfonátem modifikovaným tak, aby obsahoval dithiokarbamát a sloužil jako chelátor 64Cu(II). Komplex [64Cu(dtcbp)2] byl následně konjugován na povrch nanočástic, a to bez narušení polymerního obalu. 30 Studie in vitro prokázaly stabilitu komplexu po dobu nejméně 48 hodin, zatímco studie PET/CT a MR ukázaly jeho absorpci v lymfatických uzlinách. 30 Pro studium lymfatických uzlin byly rovněž syntetizovány a na krysím modelu studovány [124I]-SPIONs. 31
Lee a kolektiv studovali poly(aspartovou kyselinou) dekorované [64Cu]DOTA-SPIONs s povrchem modifikovaným aminoskupinami pro konjugaci cyklických arginylglycylaspartátových (RGD) peptidů za účelem cílení αvβ3-integrinu. Pozitronová emisní tomografie i T2 vážená MRI ukázaly specifické vychytávání [64Cu]DOTA-SPIONs-RGD na linii U87MG lidského glioblastomu. 32,33
Magnetické nanočástice obalené dextranem byly též značeny 18F (T1/2 = 109,7 min) a studovány v zobrazování lymfatických uzlin s potenciálním využitím v zobrazení PET/MRI malých lymfatických uzlin (~ 1 mm). Pro značení magnetických částic 18F bylo využito polymerního obalu nanočástic tvořeného kyselinou polyakrylovou (PAA) a oleylaminy, které vytváří (hřebenovitě) rozvětvenou strukturu zajišťující koloidní stabilitu a do které je inkorporován chelátor 1,4,7-triazacyklononanu (NOTA). Značení bylo provedeno v jednom reakčním kroku pomocí iontů aluminium fluoridu (18F-AlF). Tato metoda byla vyvinuta pro fluoraci peptidů a proteinů a je využitelná i za zvýšené reakční teploty nebo nízkých hodnot pH. 34
V současné době se pozornost v PET soustřeďuje na radionuklid 68Ga (T½ = 68 min), který je možné získat elucí 68Ge/68Ga generátoru. 35 Pro komplexaci trojmocného galia mohou být použity např. chelatační motivy (Obr. 5) typu DOTA (kyselina 1,4,7,10-tetraazacyklododekan-1,4,7,10-tetraoctová) nebo NOTA (kyselina 1,4,7-triazacyklononan-1,4-7-trioctová) a jejich strukturní analoga. 35,36
Obr. 5. Struktury ligandů: DOTA, NOTA. 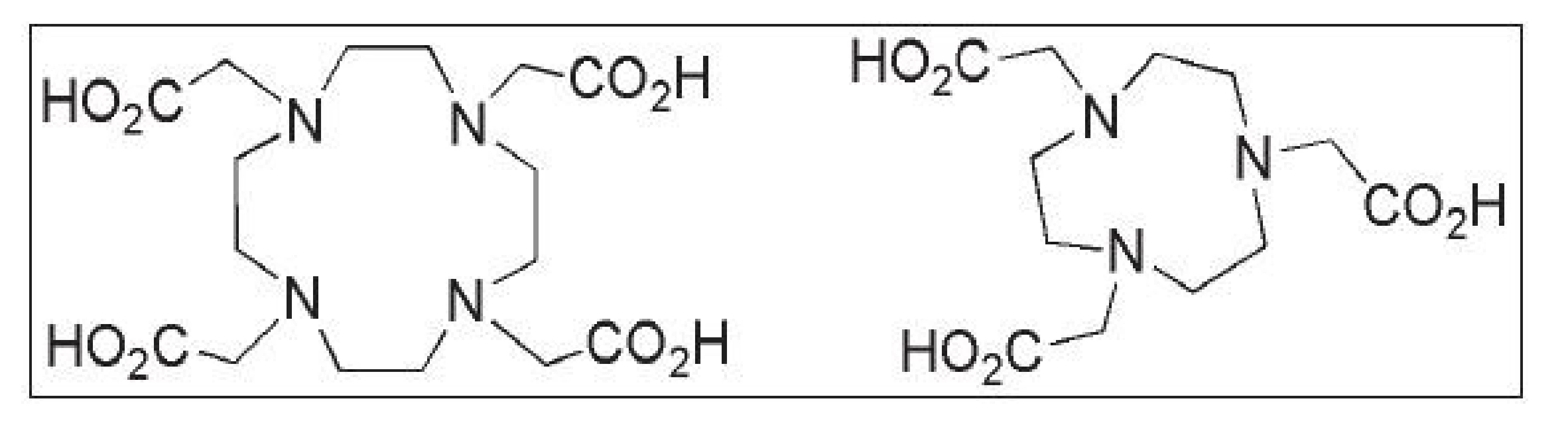
V posledních letech se několik skupin zaměřilo na vývoj radioaktivně značených sond tvořených [68Ga]-SPIONs, které by byly vhodné pro zobrazování sentinelových lymfatických uzlin (SLN). Madru a kol. vyvinuli modifikované SPIONs, které jsou značeny 68GaCl3 v 1M acetátovém pufru (pH 5,5). Výtěžky značení při těchto experimentech dosahovaly 95 % po 10minutové inkubaci. Značené SPIONs se také ukázaly být stabilními v lidském séru při 37 °C po dobu 4 hodin. 37,38
Jiným způsobem, jak označit [68Ga]-SPIONs, je pomocí objemového značení. K tomu lze využít mikrovlnnou syntézu. K syntéze byl využit vodný roztok hydrazinu pro redukci roztoku FeCl3 s eluátem 68GaCl3 a přídavek kyseliny citronové pro stabilizaci. Reakční směs byla zahřívána 10 minut v mikrovlnném reaktoru při 120 °C. Radiochemický výtěžek dosahoval 95 %. Díky použité in situ stabilizaci pomocí kyseliny citronové mají takto připravené nanočástice střední hydrodynamický průměr 7,9 nm. 39
Dalším PET radionuklidem využívaným pro zobrazování je 89Zr, který byl konjugován např. na lipoproteiny a fosfolipidy. 40 Značení 89Zr je také možné jeho navázáním na povrch magnetitu povrchovou sorpcí nebo iontovými interakcemi. 41
Značené magnetické nanočástice pro SPECT
Kompozitní nanočástice SPIONs/(3-aminopropyl)triethoxysilan (APTES)-PEG/trastuzumab a SPIONs/APTES-PEG/doxorubicin byly navrženy pro specifické cílení do nádorové tkáně jako multimodální sondy pro SPECT/MR diagnostiku a zároveň řízené uvolňování léčiva. Právě pro tyto účely byly kompozitní SPIONs značeny 111In (T1/2 = 2,80 d) a 99mTc. 40 Rovněž byly studovány pro vizualizaci retikuloendoteliálního systému nebo také pro zobrazování plicní perfúze a kostní dřeně i pro zobrazování sentinelových lymfatických uzlin. Madru a kolektiv připravili [99mTc]-SPIONs redukcí technecistanu (99mTcO4-) chloridem cínatým, kdy reakční směs byla inkubována 60 minut při laboratorní teplotě. Radiochemický výtěžek dosahoval 99 %, přičemž byly nanočástice stabilní i po 24 hodinách ve vodě a lidském séru. Tyto nanočástice poté využili pro studie na myším modelu. 42
Kompozit [153Sm]-SPIONs/diethylentriaminpentaoctová kyselina (DTPA) byl připraven jako sonda pro SPECT/MR. Následné studie in vivo ukázaly vysokou retenci v retikuloendoteliálním systému, poměrně rychlou clearence z krevního řečiště a dalších orgánů, přičemž se ukázal vysoký potenciál využití v teranostice. 41,43
Značené magnetické nanočástice v terapii
Nanočástice značené terapeutickými radionuklidy představují novou modalitu s potenciálem pro klinické aplikace v radioterapii. Alfa zářiče používané v klinické praxi a preklinickém výzkumu, jako 223Ra nebo 225Ac, mohou být účinnými terapeutiky proti malým nádorům díky svému vysokému LET (lineární přenos energie) a krátkému dosahu záření (např. v měkkých tkáních do 100 µm, v kostech do 100 nm), což představuje vzdálenost o průměru několika nádorových buněk (max. 10). Rozpadové schéma 223Ra je uvedeno na Obr. 6. 44 Nanokonstrukce také napomáhají stabilizaci odražených atomů v případě kaskády několika po sobě jdoucích přeměn, tak jak je tomu právě v případě 223Ra a 225Ac. Energie uvolněná při rozpadu řádově převyšuje energii chemické vazby a nascentní dceřiné odražené atomy nesetrvávají lokalizované v cílové tkáni. Migraci dceřiných odražených atomů účinně snižují právě nanomateriály, v nichž jsou imobilizovány. 45,46
Obr. 6. Rozpadová řada 223Ra (převzato a upraveno podle citace 45). 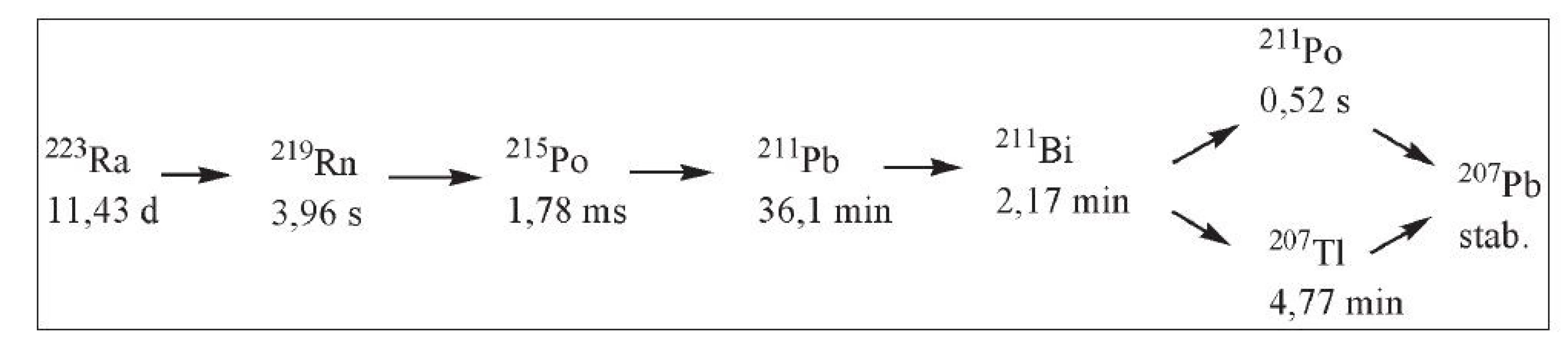
Studie s využitím 223Ra (11,43 d), klinicky využívaným na paliativní léčbu kostních metastáz u kastračně rezistentního karcinomu prostaty 44, byly prováděny in vitro s magnetickými nanočásticemi. Studie prováděné v fosfátovém pufru (PBS), plazmě a séru po 11,4 a 22,8 dnech, ukázaly maximální průměrné uvolnění aktivity 223Ra pod 5 %. 47
Beta zářiče jsou nejrozšířenějšími radionuklidy pro terapeutickou léčbu nádorových onemocnění s delším dosahem v tkáni oproti alfa zářičům. Jedním ze skupiny studovaných β-zářičů je 188Re používané v paliativní terapii. Rhenium-188 je krátkodobý radionuklid (16,9 h) získávaný elucí generátoru 188W/188Re. Ke značení magnetických částic obalených oxidem křemičitým a imobilizovaných histidinem bylo využito přímé metody značení redukcí 188ReO4- na povrchu nanočástic přídavkem chloridu cínatého. Radiochemické výtěžky dosahovaly 90 %, přičemž jejich stabilita v albuminu byla 80 % po 10 h a značené nanočástice byly studovány na modelu jaterní linie SMMC-7721. 48
Radionuklid 90Y s poločasem 64,1 hod je získáván elucí generátoru 90Sr/90Y. Díky vyšší energii částic beta a větší pronikavosti v tkáních (do 12 mm) je vhodný k léčbě větších lézí. Značení 90Y bylo studováno na magnetických částicích obalených fosfátovými ligandy (imidofosfát), které činí SPIONs biokompatibilními a zvyšují jejich koloidní stabilitu. Radiochemický výtěžek se pohyboval kolem 98 %. In vitro studie prováděné ve fyziologickém roztoku a lidském séru ukázaly stabilitu částic i po 72 hodinách. 49 Stejně jako SPIONs stabilizovány iminodifosfátem byla i jejich PEG600 modifikace značena přímou inkubací s YCl3 za laboratorní teploty (37 MBq). Radiochemický výtěžek [90Y]-Fe3O4-PEG600 přesahoval 97 %. Studované radioaktivně značené magnetické částice [90Y]-Fe3O4-PEG600 mají vysoký potenciál uplatnění v duální radioterapii v kombinaci s hypertermií. 49
Lutecium-177 je v klinické praxi etablovaný β-zářič (6,65 d). Emitované β-částice mají navíc nízkou energii a střední vzdálenost, kterou urazí v měkkých tkáních, se pohybuje okolo 670 µm, což je výhodné pro ozařování malých oblastí. Při přeměně jsou taktéž emitovány fotony o nízkých energiích například 113 keV a 208 keV, které lze využít k diagnostice. 50 Nanočástice magnetitu označené 177Lu tak představují multifunkční nástroj pro léčbu nádorových onemocnění jak pomocí ionizujícího záření, tak i pomocí hypertermie. Skupina Ognjanović et al. zkoumala značení nanočástic magnetitu obalených kyselinou citronovou, kyselinou polyakrylovou a PEG pomocí sorpce 177Lu na jejich povrh. Výtěžky značení se ve všech případech pohybovaly okolo 99 %. Nanočástice taktéž vykazovaly velmi dobrou stabilitu značení v prostředí fyziologického roztoku a krevního séra i po 96 hodinách, kdy bylo uvolněno méně než 5 % původní aktivity. Úspěšnost hypertermie byla poté ověřena na buněčné nádorové linii CT-26. 51
Zajímavé jsou rovněž studie s 166Ho (26,7 h). SPIONs se zesítěným dextranovým obalem mohou být použity jako negativní kontrastní činidla v MRI. Pro tyto účely byly modifikovány funkcionalizované částice pomocí chelátoru DTPA. Biodistribuce [166Ho]DTPA-SPIONs po intravenózním podání na zvířecím modelu Wistar vykazovala rychlé vychytávání v retikuloendotelovém systému (tj. více než 60 a 15 % aplikované dávky bylo v játrech a slezině 30 minut p. i.). Podobně jako u 153Sm, byla i zde potvrzena rychlá clearance aktivity z ostatních orgánů. Tyto výsledky naznačují, že [166Ho]DTPA -SPIONs by mohly být dobrým kandidátem pro teranostické účely u malignit jater a sleziny. 52
Závěr
Výzkum a vývoj v oblasti nanomateriálů během poslední dekády přináší velmi zajímavé a cenné poznatky, které nalézají široké uplatnění v materiálové chemii, separačních technologiích a biomedicínských aplikacích. Zatím nepřímý užitek z nanomateriálů plynul nukleární medicíně z radionuklidových generátorů a separačních postupů vybraných diagnostických a terapeutických radionuklidů, které využívají kompozitní nanomateriály pro získávání zájmových radionuklidů. Výzkumné směry a preklinický výzkum však naznačují, že pro uplatnění nanočástic v medicíně je tato cesta otevřená hledání nových řešení pro multimodální systémy, které by byly schopny zajistit jak diagnostickou informaci, tak i terapeutickou intervenci v nádorové tkáni pro různé skupiny radionuklidů. Zároveň by v případě magnetických materiálů mohlo být pro selektivní cílení využito externí magnetické pole nebo lze s výhodou v terapii využít hypertermie. Zároveň magnetické nanočástice již v minulosti byly využity v MRI pro výrazné zkrácení T2 relaxačního času a našly využití jako kontrastní látky v zobrazovacích metodách. Výzvou pro další preklinický výzkum však zůstává vyřešení otázky stability a prevence agregace připravených nanočástic s ohledem na jejich způsob přípravy, zachování fyzikálně-chemických parametrů, biokompatibility a možnosti systémové aplikace s výraznou retencí v cílové tkáni.
Poděkování:
Tato práce byla podpořena granty Českého vysokého učení technického v Praze č. SGS19/194/OHK4/3T/14 (V.V., M.Š., Z.S.), Technologické agentury ČR č. TJ01000334 (V.V., Z.S. a M.V.) a TO01000074 (M.Š, J. K. a M.V.), Agentury pro zdravotnický výzkum NV16-30544A (Z.S., M.V., V.V. a J.K.), Centra pokročilé fotovoltaiky CZ.02.1.01/0.0/0.0/15_003/00004 (J.K.) a Grantové agentury ministerstva vnitra, Bezpečnostní výzkum VI20172020106 (M.V. a J.K.)
Zdroje
- Psimadas D, Baldi G, Ravagli C, et al. Comparison of the magnetic, radiolabeling, hyperthermic and biodistribution properties of hybrid nanoparticles bearing CoFe2O4 and Fe3O4 metal cores. Nanotechnology. 2014; 25 : 025101
- Lu AH, Salabas EL, Schuth F. Magnetic Nanoparticles: Synthesis, Protection, Functionalization, and Application. Angew Chem Int Ed. 2007; 46 : 1222–1244
- Lima-Tenório MK, Pineda EA, Ahmad NM, et al. Magnetic nanoparticles: In vivo cancer diagnosis and therapy. Int J Pharm. 2015; 493 : 313–327
- Ramimoghadam D, Bagheri S, Hamid SBA. Progress in electrochemical synthesis of magnetic iron oxide nanoparticles. J Magn Magn Mater. 2014; 368 : 207–229
- Babes L, Denizot B, Tanguy G, et al. Synthesis of Iron Oxide Nanoparticles used as MRI contrast agents: A Parametric study. J Colloid Interface Sci. 1999; 212 : 474-482
- Mahdavi M, Ahmad MB, Haron MJ, et al. Synthesis, Surface Modification and Characterisation of Biocompatible Magnetic Iron Oxide Nanoparticles for Biomedical Applications. Molecules 2013; 18 : 7533-7548
- Laurent S, Forge D, Port M, et al. Magnetic iron oxide nanoparticles: Synthesis, stabilization, vectorization, physicochemical characterizations, and biological applications. Chem Rev. 2008; 108 : 2064-2110
- Wu W, He Q, Jiang C. Magnetic Iron Oxide Nanoparticles: Synthesis and Surface Functionalization Strategies. Nanoscale Res Lett. 2008; 3 : 397-415
- Jana NR, Chen Y, Peng X. Size-and Shape-Controlled Magnetic (Cr, Mn, Fe, Co, Ni) Oxide Nanocrystals via a Simple and General Approach. Chem Mater. 2004; 16 : 3931-3935
- Lassenberger A, Grünewald TA, van Oostrum PDJ, et al. Monodisperse Iron Oxide Nanoparticles by Thermal Decomposition: Elucidating Particle Formation by Second-Resolved in Situ Small-Angle X-ray Scattering. Chem Mater. 2017; 29 : 4511-4522
- Kohler N, Fryxell GE, Zhang M. A Bifunctional Poly(ethylenegylcol) Silane Immobilized on Metallic Oxide-Based Nanoparticles for Conjugation with Cell Targeting Agents. J Am Chem Soc. 2004; 126 : 7206-7211
- Lee Y, Lee J, Bae CJ, et al. Large-Scale Synthesis of Uniform and Crystalline Magnetite Nanoparticles Using Reverse Micelles as Nanoreactors under Reflux Conditions. Adv Funct Mater. 2005; 15 : 503-509
- Wu W, Wu Z, Yu T, et al. Recent progress on magnetic iron oxide nanoparticles: synthesis, surface functional strategies and biomedical applications. Sci Technol Adv Mater. 2015; 16 : 2
- Xiao L, Li J, Brougham DF, et al. Water-Soluble Superparamagnetic Magnetite Nanoparicles with Biocompatible Coating for Enhanced Magnetic Resonance Imagining. ACS Nano. 2011; 5 : 6315-6324
- Fernandéz-Barahona I, Muñoz-Hernando M, Herranz F. Microwave-Driven Synthesis of Iron-Oxide Nanoparticles for Molecular Imaging. Molecules. 2019; 24 : 1224
- Wang WW, Zhu YJ, Ruan ML. Microwave-assisted synthesis and magnetic property of magnetite and hematite nanoparticles. J Nanopart Res. 2007; 9 : 419-426
- Mahmoudi M, Sant S, Wang B, et al. Superparamagnetic iron oxide nanoparticles (SPIONs): Development, surface modification and applications in chemotherapy. Adv Drug Deliv Rev. 2011; 63 : 24–46
- Lewinsky N, Colvin V, Drezek R. Cytotoxicity of nanoparticles. Small 2008; 4 : 26-49
- Khalkhali M, Sadighian S, Rostamizadeh K, et al. Synthesis and characterization of dextran coated magnetite nanoparticles for diagnostics and therapy. Bioimpacts. 2015; 5 : 141-150
- Turcheniuk K, Tarasevich AV, Kukhar VP, et al. Recent advances in surface chemistry strategies for the fabrication of functional iron oxide based magnetic nanoparticles. Nanoscale. 2013; 5 : 10729-10752
- Veiseh O, Gunn JW, Zhang M. Design and fabrication of magnetic nanoparticles for targeted drug delivery and imaging. Adv Drug Deliv Rev. 2010; 62 : 284-304
- Deng YH, Wanch CC, Hu JH, et al. Investigation of formation of silica-coated magnetite nanoparticles via sol-gel approach. Colloids Surf A: Physiochem Eng Asp. 2005; 262 : 87-93
- Yoo D, Lee JH, Shin TH, Cheon J. Theranostic magnetic nanoparticles. Acc Chem Res. 2011; 44 : 863–874
- Yu MK, Park J, John S. Targeting strategies for multifunctional nanoparticles in cancer imaging and therapy. Theranostics. 2012; 2 : 3-44
- Unsoy G, Khodadust R, Yalcin S, et al. Synthesis of Doxorubicin loaded magnetic chitosan nanoparticles for pH responsive targeted drug delivery. Eur J Pharm Sci. 2014; 62 : 243-250
- Enochs WS, Schaffer B, Bhide PG, et al. MR Imaging of slow axonal transport in vivo. Exp Neurol 1993; 123 : 235-24
- Lin MM, Kim DK, Haj AJE, Dobson J. Development of Superparamagnetic Iron Oxide nanoparticles (SPIONs) for translation to clinical applications. IEEE Trans Nanobioscience. 2008; 7 : 298-305
- Santhosh PB, Ulrich NP. Multifunctional superparamagnetic iron oxide nanoparticles: Promising tools in cancer theranostics. Cancer Lett. 2013; 336 : 8-17
- Aghanejad A, Jalilian AR, Maus S, et al. Optimized production and quality control of 68Ga-DOTATATE. Iran J Nucl Med. 2016; 24 : 29-36
- Rosales RTM, Tavar R, Paul RL, et al. Synthesis of 64CuII–Bis(dithiocarbamatebisphosphonate) and Its Conjugation with Superparamagnetic Iron Oxide Nanoparticles: In Vivo Evaluation as Dual-Modality PET–MRI Agent. Angew Chem Int Ed. 2011;50 : 5509 –5513
- Choi JS, Park JC, Nah H, et al. A hybrid nanoparticle probe for dual-modality positron emission tomography and magnetic resonance imaging. Angew Chem Int Ed Engl. 2008; 47 : 6259-6262.
- Hong H, Zhang Y, Sun J, et al. Molecular imaging and therapy of cancer with radiolabeled nanoparticles. Nano Today. 2009; 4 : 399-413
- Lee HY, Li Z, Chen K, et al. PET/MRI dual-modality tumor imaging using arginine-glycine-aspartic (RGD)-conjugated radiolabeled iron oxide nanoparticles. J Nucl Med. 2008; 49 : 1371-1379
- Sun Z, Cheng K, Wu F, et al. Robust surface coating for a fast, facile fluorine-18 labeling of iron oxide nanoparticles for PET/MR dual-modality imaging. Nanoscale. 2016; 8 : 19644–19653
- Breeman WA, Jong de M, Blois de E, et al. Radiolabelling DOTA-peptides with 68Ga. Eur J Nucl Med Mol Imaging. 2005; 32 : 478-485
- Riss PJ, Kroll C, Nagel V, Rosch F. NODAPA-OH AND NODAPA-(NCS)n: synthesis, 68Ga-radiolabelling and in vitro characterisation of novel versatile bifunctional chelators for molecular imaging. Bioorg Med Chem Lett. 2008; 18 : 5364-5367
- Madru R, Tran TA, Axelsson J, et al. 68Ga-labeled superparamagnetic iron oxide nanoparticles (SPIONs) for multi-modality PET/MR/Cherenkov luminescence imaging of sentinel lymph nodes. Am J Nucl Med Mol Imaging. 2014; 4 : 60-69
- Barahona IF, Hernando MM, Pellico J, et al. Molecular Imaging with 68Ga Radio-Nanomaterials: Shedding Light on Nanoparticles. Appl Sci. 2018; 8 : 1098
- Fernandéz-Barahona I, Ruiz-Cabello J, Herranz F, Pellico J. Synthesis of 68Ga Core-doped Iron Oxide Nanoparticles for Dual Positron Emission Tomography /(T1)Magnetic Resonance Imaging. J Vis Exp. 2018; 141
- Same S, Aghanejad A, Nakhjavani SA, et al. Radiolabeled theranostics: magnetic and gold nanoparticles. Bioimpacts. 2016; 6 : 169-181
- Salvanou E, Bouziotis P, Tsoukalas C. Radiolabeled Nanoparticles in Nuclear Oncology. Adv Nan Res. 2018; 1 : 38-55
- Madru R, Kjellman P, Olsson F, et al. 99mTc-Labeled Superparamagnetic Iron Oxide Nanoparticles for Multimodality SPECT/MRI of Sentinel Lymph Nodes. J Nucl Med. 2012; 53 : 459–463
- Gholami A, Mousavie Anijdan SH. Development of 153Sm-DTPA-SPION as a theranostic dual contrast agents in SPECT/MRI. Iran J Basic Med Sci. 2016; 19 : 1056–1062
- Henriksen G, Breistol K, Bruland ØS, et al. Significant Antitumor Effect from Bone-seeking, α-Particle-emitting 223Ra Demonstrated in an Experimental Skeletal Metastases Model. Cancer Res. 2002; 62 : 3120
- Kozempel J. Vlk M. Nanoconstructs in Targeted Alpha-Therapy. Recent Pat Nanomed. 2014; 4 : 71-76
- Kozempel J, Mokhodoeva O, Vlk M. Progress in Targeted Alpha-Particle Therapy. What We Learned about Recoils Release from In Vivo Generators. Molecules. 2018; 23 : 581
- Mokhodoeva O, Vlk M, Málková E, et al. Study of 223Ra uptake mechanism by Fe3O4 nanoparticles: towards new prospective theranostic SPIONs. J Nanopart Res. 2016; 301 : 1-12
- Liang S, Wang Y, Yu J, et al. Surface modified superparamagnetic iron oxide nanoparticles: As a new carrier for biomagnetically targeted therapy. J Mater Sci Mater Med. 2007; 18 : 2297-2302
- Radovic M, Calatayud MP, Goya GF, et a. Preparation and in vivo evaluation of multifunctional 90Y-labeled magnetic nanoparticles designed for cancer therapy. J Biomed Mater Res A 2014; 103 : 126-134
- Dash A, Pillai MRA, Knapp FF. Productionof 177Lu for Targeted Radionuclide Therapy: Available Options. Nucl Med Mol Imaging. 2015; 49 : 85-107
- Ognjanović M, Radović M, Mirković M, et al. 99mTc-, 90Y-, and 177Lu-Labeled Iron Oxide Nanoflowers Designed for Potential Use in Dual Magnetic Hyperthermia/Radionuclide Cancer Therapy and Diagnosis. ACS Appl Mater Interfaces. 2019; 11 : 41109-41117
- Nosrati S, Shanehsazzadeh S, Yousefnia H. Biodistribution evaluation of 166Ho–DTPA–SPION in normal rats. J Radioanal Nucl Chem. 2015; 307 : 1559-1566
Štítky
Nukleární medicína Radiodiagnostika Radioterapie
Článek vyšel v časopiseNukleární medicína
Nejčtenější tento týden
2022 Číslo 2- Biochemoterapie agresivního karcinomu rekta – kazuistika z českého prostředí
- MDT Board: unikátní projekt pro lékaře pečující o pacienty s onemocněním plic a dalšími patologiemi v oblasti hrudníku
- Idiopatická plicní fibróza a refluxní choroba: silný vztah plný nejasností
- Intersticiální plicní procesy a jejich fibrotická progrese
- Konverzní léčba hraničně resekabilních jaterních metastáz kombinací mFOLFOX6 + panitumumab – kazuistika
-
Všechny články tohoto čísla
- Editorial
- Multimodální magnetické nanomateriály v diagnostice a terapii
- Lymfoscintigrafie dolních končetin u pacienta s cukrovkou – kazuistika
- Klinika nukleární medicíny 3. LF UK a FN Královské Vinohrady v Praze
- Historický kvíz
- Sonda do historie
- 10. Konference radiologické fyziky, Přerov
- Spolupráce na přípravě nejslibnějšího zářiče alfa pro léčbu nádorových onemocnění
- Slavnostní přednáška prof. Ing. Ondřeje Lebedy, Ph.D.
- Nukleární medicína
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Lymfoscintigrafie dolních končetin u pacienta s cukrovkou – kazuistika
- Klinika nukleární medicíny 3. LF UK a FN Královské Vinohrady v Praze
- Multimodální magnetické nanomateriály v diagnostice a terapii
- 10. Konference radiologické fyziky, Přerov
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



