-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Gastrointestinální toxicita systémové onkologické imunoterapie
Gastrointestinal toxicity of systemic oncology immunotherapy
Background: Systemic anti-cancer immunotherapy provides a substantial progress in options of current oncology treatment. Yet, this therapeutic approach is potentially associated with a significant gastrointestinal toxicity. Aim: The purpose of this paper is to provide a comprehensive review on pathogenesis, clinical features, dia gnostics and therapy of these toxicities. Review of current knowledge: Check-point inhibitors brought a major progress in anti-cancer immunotherapy and improved significantly prognosis of several malignancies (e. g. metastatic malignant melanoma, non-small-cell lung cancer, gastric and colorectal cancers in high-risk population associated with presence of pathogenic mutations, renal cell carcinoma, squamous cell carcinoma of the head and neck and urothelial carcinoma). They include monoclonal antibodies targeting cytotoxic T lymphocyte-associated antigen 4 (CTLA4; e. g. ipilimumab, tremelimumab), programmed death-1 receptor (PD-1; e. g. pembrolizumab, nivolumab) and its ligand PD-L1 (e. gatezolizumab, avelumab). Chimeric antigen receptor (CAR) T-cell therapy is another new option for haematological malignancies and metastatic colorectal cancer. Major symptoms of gastrointestinal toxicity caused by systemic immunotherapy include diarrhoea (20–50%), entero-colitis (1–10%) and laboratory or clinical signs of hepatopathy (~10%). Anti-cancer immunotherapy can be also complicated by infections (Clostridium difficile, Mycoplasma and/ or cytomegalovirus). There is no data on other possible complications so far. However, it can be assumed that these will also include bile acid malabsorption as well as small intestinal bacterial overgrowth syndrome. Treatment of gastrointestinal complications of immunotherapy should be graded according to their severity. It includes symptomatic medications (e. g. loperamide), systemic glucocorticoids and anti-TNF monoclonal antibodies (alone or together with mycofenolate mofetil or tacrolimus in the most severe cases). Conclusions: Awareness of possible complications of systemic anti-cancer immunotherapy is crucial for patients’ safety. It is mandatory to consider immune-related adverse events, complicating infections, bile acids malabsorption and small intestinal bacterial overgrowth syndrome. Prompt proper dia gnostics and immediate vigorous therapy infl uence the outcome of patients signifi cantly. A strictly individualized approach is indispensable.
Keywords:
bile acid malabsorption – gastrointestinal toxicity – anti-cancer immunotherapy – small intestinal bacterial overgrowth syndrome
Autoři: J. Bureš 1,2; D. Kohoutová 3; M. Zavoral 1,2
Působiště autorů: Ústav gastrointestinální onkologie, Ústřední vojenská nemocnice − Vojenská fakultní nemocnice, Praha 1; Interní klinika 1. LF UK a ÚVN, Ústřední vojenská nemocnice − Vojenská fakultní nemocnice, Praha 2; The Royal Marsden NHS Foundation Trust, London, UK 3
Vyšlo v časopise: Klin Onkol 2022; 35(5): 346-357
Kategorie: Přehled
doi: https://doi.org/10.48095/ccko2022346Souhrn
Východiska: Systémová protinádorová imunoterapie představuje zásadní pokrok v současné onkologické léčbě. Avšak tento terapeutický přístup je spojen s riziky nežádoucí gastrointestinální toxicity. Cíl: Tento článek přináší podrobný přehled patogeneze, klinického obrazu, diagnostiky a léčby těchto komplikací. Přehled současného stavu poznání: Inhibitory kontrolních bodů imunitní reakce – imunitních “checkpointů” (check-point inhibitors) zásadně zlepšily prognózu řady maligních onemocnění (mezi které patří např. maligní melanom, nemalobuněčný karcinom plic, rakovina žaludku a kolorektální karcinom osob s patogenními mutacemi, karcinom ledviny, spinocelulární karcinom hlavy a krku a uroteliální karcinom). Patří sem protilátky proti antigenu CTLA-4 (cytotoxický T-lymfocytární antigen 4; především ipilimumab a tremelimumab), dále protilátky proti receptoru programované smrti PD-1 (programmed cell death 1; především pembrolizumab a nivolumab) a proti jeho ligandu PD-L1 (např. atezolizumab a avelumab). V protinádorové imunoterapii se nově začíná využívat také adoptivní buněčná léčba (chimeric antigen receptor T cells – CAR-T cells), a to v léčbě hematologických malignit a metastazujícího kolorektálního karcinomu. Mezi hlavní projevy gastrointestinální toxicity způsobené systémovou protinádorovou imunoterapií patří průjmy (20–50 %), enterokolitida (1–10 %) a laboratorní nebo klinické známky hepatopatie (~10 %). Protinádorová imunoterapie může být komplikována také infekcemi (Clostridium difficile, Mycoplasma a/ nebo cytomegalovirus). I když zatím data o dalších komplikacích chybí, lze předpokládat, že imunoterapie může být komplikována také malabsorpcí žlučových kyselin a syndromem bakteriálního přerůstání v tenkém střevě. Terapie gastrointestinálních komplikací by měla být odstupňována podle tíže postižení. Zahrnuje symptomatickou léčbu (např. loperamid), systémové glukokortikoidy a anti-TNF-alfa monoklonální protilátky (samotné nebo v kombinaci s mykofenolátem mofetilem nebo takrolimem v nejtěžších případech). Závěry: Povědomí o možných komplikacích systémové protinádorové imunoterapie je zásadně důležité pro bezpečnost nemocných. Je třeba pomýšlet na možné imunopatologické nežádoucí vedlejší účinky, komplikující infekce, malabsorpci žlučových kyselin a syndrom bakteriálního přerůstání v tenkém střevě. Promptní náležitá dia gnostika a bezodkladná důrazná léčba zásadně ovlivňují prognózu pacientů. Přísně individualizovaný přístup je nezbytností.
Klíčová slova:
gastrointestinální toxicita – malabsorpce žlučových kyselin – protinádorová imunoterapie – syndrom bakteriálního přerůstání v tenkém střevě
Úvod
Moderní systémová onkologická léčba, především chemo - a imunoterapie, je spojena s rizikem nežádoucích vedlejších účinků na gastrointestinální trakt [1–11]. V současné době je k dispozici řada národních a mezinárodních doporučení pro prevenci, dia gnostiku a léčbu těchto komplikací [2,4,12–19]. Cílem této práce je přinést přehled gastrointestinální toxicity navozené systémovou protinádorovou imunoterapií. Práce si neklade za cíl detailní rozbor celé této rozsáhlé a komplexní problematiky, ale chce upozornit především na ně kte ré nové a/ nebo méně známé aspekty.
Historie a současné možnosti použití protinádorové imunoterapie
Historie protinádorové imunoterapie sahá až do druhé poloviny 19. století, začátky moderního pojetí této léčby se datují od osmdesátých let 20. století [20]. Milníky představují především adoptivní buněčná terapie (s tumor infi ltrujícími lymfocyty), rekombinantní cytokiny (např. rekombinantní interleukin 2, interferon alfa), monoklonální protilátky specifi cky namířené proti nádoru a vakcíny z dendritických buněk [20]. Pokrok v posledních 25 letech je dán především pochopením ně kte rých ze vztahů komplexní interakce mezi nádorem a imunitním systémem. To umožnilo do léčby zavést postupy zajišťující manipulaci s protinádorovou odpovědí. Mezi ně patří především inhibitory kontrolních bodů imunitní reakce – tzv. imunitních “checkpoints” (checkpoint inhibitors) [20–26].
Protinádorová léčba monoklonálními protilátkami proti kontrolním bodům imunitní reakce představuje v současné době zásadní pokrok v onkologické terapii [1,21,27–43]. Patří sem protilátky proti antigenu CTLA-4 (cytotoxický T-lymfocytární antigen 4; především ipilimumab, tremelimumab), dále protilátky proti receptoru programované smrti PD-1 (programmed cell death 1; především pembrolizumab, nivolumab, pidilizumab, cemiplimab, sintilimab) a proti jeho ligandu PD-L1 (atezolizumab, avelumab, durvalumab) [21,35,40]. Využívají se ve schválených indikacích FDA (Food and Drug Administration) a EMA (European Medicines Agency) především v terapii maligního melanomu (ipilimumab, nivolumab), karcinomu plic (ipilimumab, nivolumab, pembrolizumab, atezolimab), karcinomu žaludku, spinocelulárního karcinomu hlavy a krku (nivolumab), karcinomu ledviny (ipilimumab, nivolumab, pembrolizumab), karcinomu močového měchýře (nivolumab, pembrolizumab), a v léčbě Hodgkinovy choroby (nivolumab, pembrolizumab) [16,39,40]. V rámci klinických studií se používají i v dalších indikacích (karcinom jícnu, kolorektální karcinom, karcinom anu aj.) [21,23–25,39,43]. Kombinace anti-PD-1 a anti-CTLA-4 protilátek se ukázala být efektivnější než léčba pouze jednou nebo druhou protilátkou [21,33,35]. V říjnu 2015 schválila FDA první kombinovanou terapii anti - -CTLA4 (ipilimumab) a anti-PD1 (nivolumab) [37]. V České republice je již řada z výše uvedených léčiv registrována, jsou to např. ipilimumab, pembrolizumab, nivolumab, cemiplimab, atezolizumab, avelumab a durvalumab.
V protinádorové imunoterapii se nově začíná využívat také adoptivní buněčná léčba (CAR-T cells – chimeric antigen receptor T cells). CAR-T lymfocyty jsou autologní T lymfocyty, do kterých je pomocí virového vektoru vnesena genetická informace pro chimérický buněčný receptor. Tento chimérický protein je dalším peptidem (spacer) spojen prostřednictvím transmembránového úseku s nitrobuněčnými signálními doménami [44 – 46]. Od roku 2017 (po schválení FDA) vedle hemato-onkologických indikací se tato nová léčba začíná uplatňovat např. v imunoterapii metastazujícího kolorektálního karcinomu [44–47].
Nežádoucí vedlejší projevy imunoterapie
Závažným vedlejším účinkem protinádorové imunologické léčby je nežádoucí narušení imunologické tolerance vůči normálním tkáním organizmu, které je svými znaky podobné autoimunitnímu onemocnění (immune-related adverse events – irAEs) [27,36,47–50]. Mezi hlavní nežádoucí vedlejší účinky patří průjmy (20–50 %; většinou grade 1–2), enterokolitida nebo kolitida (1–10 %), hepatitida a laboratorní známky hepatopatie (~ 10 %), mukokutánní toxicita (pruritus, zánětlivé dermatózy, imunobulózní choroby, depigmentace, stomatitida, slizniční afty, xerostomie, lichen planus, pemfigoid, alopecie, postižení nehtů; v 70–90 %; zpravidla lehkého stupně – grade 1–2), a endokrinopatie, především, hypofyzitida (1–6 %; s dysfunkcí adenohypofýzy: panhypopituitarismus nebo primární nadledvinová insufi cience), tyreoidální dysfunkce (1–13 %; častěji hypotyreóza než hypertyreóza) a inzulinodependentní diabetes mellitus (~ 0,2 %) [27,28,36,48–53], a to s odlišným časovým průběhem (obr. 1) [16,31,38]. Podstatná část nemocných trpí nepřiměřenou únavou (16–24 % při monoterapii a až v 26 % při kombinované imunoterapii) [54,55]. Bolesti hlavy a periferní senzorická neuropatie se vyskytuje u 4–6 % pacientů [17]. Akutní systémová zánětlivá reakce z uvolnění cytokinů (cytokine release syndrome) s horečkami, bez multiorgánové dysfunkce vzácně komplikuje terapii nivolumabem nebo adoptivní buněčnou léčbu (CAR-T cells) [47,56]. Při protinádorové imunoterapii byly vzácněji popsány také Stevenův-Johnsonův syndrom (toxická epidermální nekrolýza), pneumonitida, kardiotoxicita (včetně myokarditidy) a akutní poškození ledvin (acute kidney injury). Méně často je v rámci gastrointestinální toxicity postižen jícen, žaludek a tenké střevo, vzácně vznikne akutní pankreatitida (asymptomatický vzestup sérové amylázy a lipázy je však častý, v 10–15 %) [18,27].
Obr. 1. Časový průběh imunologicky navozených nežádoucích vedlejších účinků léčby ipilimumabem (immune-related adverse events). Částečně zpracováno podle [16] a [31]. ![Časový průběh imunologicky navozených nežádoucích vedlejších účinků léčby ipilimumabem (immune-related adverse events). Částečně zpracováno podle [16] a [31].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/597e83967f19da9098b1f3c74180d15e.png)
Jak již bylo uvedeno výše, podstatná část pacientů trpí v průběhu protinádorové imunoterapie průjmy [2–4,27, 38,49,54]. Průjmy s případným rozvojem kolitidy se většinou objevují po třetím týdnu od začátku imunoterapie, s kulminací obtíží kolem osmého týdne [2,4,16,38]. Většina případů se upraví během 12 týdnů [31]. Průjmy se celkově vyskytují méně často při léčbě nivolumabem (~ 21 %) ve srovnání s terapií ipilimumabem (~ 34 %) a kombinované léčbě nivolumabem a ipilimumabem (~ 45 %) [2,3]. Také závažné průjmy (grade 3–4) jsou častější při léčbě ipilimumabem (~ 5–10 % pacientů s maligním melanomem) [29,30] ve srovnání s nivolumabem nebo pembrolizumabem (~ 1–2 %) [32,54]. Tíže střevního postižení je závislá na dávce imunoterapie [30]. Frekvence průjmů (stupeň, “grade CTCAE” – podle Common Terminology Criteria Adverse Events [19], viz obr. 6, nekoreluje s endoskopickým skóre dle Mayo [49,57], na rozdíl od nálezu krve ve stolici [2–4,49]. MD Anderson Cancer Center navrhuje členit tíži endoskopického nálezu do tří stupňů: první stupeň má nález normální; ve středním stupni je postižení omezeno na levý tračník, jsou nalezeny méně než 3 vředy a žádný z vředů není v průměru větší než 1 cm; ve třetím stupni je postižení závažnější (počet a velikost vředů) a/ nebo je postižen i pravý tračník a/ nebo je těžká zánětlivá reakce při histologickém vyšetření [4]. Závažnou vzácnou komplikací enterokolitidy jsou perforace střeva a život ohrožující krvácení [58,59]. Následuje-li anti-PD-1 léčba po předchozím podání anti-CTLA-4 protilátek (komplikovaném střevními obtížemi), průjmy se zpravidla neobjeví [27].
Obr. 2. Tíže gastrointestinální toxicity systémové protinádorové imunoterapie. Hodnocení a principy léčby. Částečně zpracováno podle [16]. ![Tíže gastrointestinální toxicity systémové protinádorové imunoterapie. Hodnocení a principy léčby. Částečně zpracováno
podle [16].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/a6beaf1bcb892fab3dacf6efc08ca20c.png)
CT – počítačová tomografi e, ICPi – inhibitory kontrolních bodů imunitní reakce (immune check-point inhibitors), MMF – mykofenolát mofetil, NYHA – stupeň kardiální kompenzace podle New York Heart Association, TBC – tuberkulóza, TPV – úplná parenterální výživa Také léčba FGFR inhibitory je komplikována průjmy, a to v 15–60 % případů. Zpravidla se jedná o lehčí nebo přechodné vedlejší účinky [44]. Adoptivní buněčná léčba (CAR-T cells) je spojena především s rizikem neurotoxicity a se syndromem uvolnění cytokinů (cytokine release syndrome). Terapie kolorektálního karcinomu (HER2-specifi c CAR-T) může být komplikována průjmy v důsledku kolitidy [46,52,60].
Mikrobiota
Imunoterapií indukované kolitidy mají ně kte ré shodné charakteristiky s idiopatickými střevními záněty, včetně nepochybné etiopatogenetické role střevních mikrobio t [61,62], léčebného využití glukokortikoidů a bio logické terapie anti-TNF-alfa [63]. Klíčovým poznatkem je skutečnost, že základní složení střevních mikrobio t může predikovat jak odpověď na protinádorovou imunoterapii, tak i toxicitu touto léčbou indukovanou [64–68]. Na základě sekvenování 16S rRNA, Dubin et al. [65] zjistili, že pacienti s vyšším zastoupením bakterií kmene Bacteroidetes ve střevních mikrobio tech měli menší riziko vzniku kolitidy (indukované ipilimumabem). Stejný závěr byl potvrzen i dalšími autory [66]. Naopak vyšší zastoupení rodu Faecalibacterium a dalších bakterií kmene Firmicutes je spojeno s příznivou klinickou odpovědí na terapii ipilimumabem (u pacientů s metastatickým maligním melanomem), ale i s vyšším rizikem vzniku kolitidy indukované touto léčbou [66]. Právě role bakterií rodu Faecalibacterium ukazuje složitost komplexní problematiky střevních mikrobiot. Faecalibacterium prausnitzii je bakterie s protizánětlivými účinky [69–71]. Je významným producentem butyrátu ve střevě s důležitým imunomodulačním efektem, s udržováním poměru Th17/ Treg lymfocytů a inhibicí HDAC1 (histone deacetylase 1) [70,72]. U Crohnovy choroby nižší zastoupení této bakterie ve střevě hraje důležitou roli v etiopatogeneze onemocnění [73–75] a je spojeno s vyšším rizikem pooperační rekurence Crohnovy choroby [69].
Interakci nádoru a imunitního systému makroorganismu modulují také ně kte ré bakteriální metabolity a mediátory mikrobio t přímo nebo nepřímo ovlivňované. Patří mezi ně např. žlučové kyseliny, mastné kyseliny s krátkým řetězcem nebo inosin a jeho metabolity [62]. Novým předmětem výzkumu jsou interakce viromu a fungomu s probíhající protinádorovou imunoterapií [62].
Diagnostika a diferenciální diagnostika
Na možnost kolitidy komplikující protinádorovou imunoterapii je třeba pomýšlet především, pokud se průjmy objeví za 3–6 týdnů po zahájení onkologické léčby [16]. Kromě nejlehčího stadia (grade 1), je v ostatních případech třeba vždy provést sigmoideoskopii s odběrem bio psií. Endoskopický obraz je značně variabilní, a to i při jednom použitém léčivu (obr. 2–5). Častěji bývají postižené rektum a levý tračník, proto sigmoideoskopie může být dostatečným vyšetřením. V endoskopickém obraze bývá vymizelá cévní kresba, eroze, afty, méně často jsou přítomné vředy [49]. Často je přítomná výrazně zvýšená produkce hlenu. Makroskopický nález však může být normální. Při histologickém vyšetření bio ptických vzorků může být neutrofi lní, lymfocytární nebo smíšený infi ltrát, častým nálezem jsou kryptové pseudoabscesy [49,76,77]. Histologický nález může předcházet jeden až tři týdny průjmy a endoskopický obraz kolitidy [49].
Obr. 3. Imunoterapií indukovaná kolitida (nivolumab pro maligní melanom) u 64letého pacienta. Koloskopie: sliznice colon descendens je edematózní, zarudlá, kryta hlenem. Jsou vymizelé haustrace i cévní kresba. Nemocný byl následně úspěšně léčen infl iximabem a mykofenolátem mofetilem. 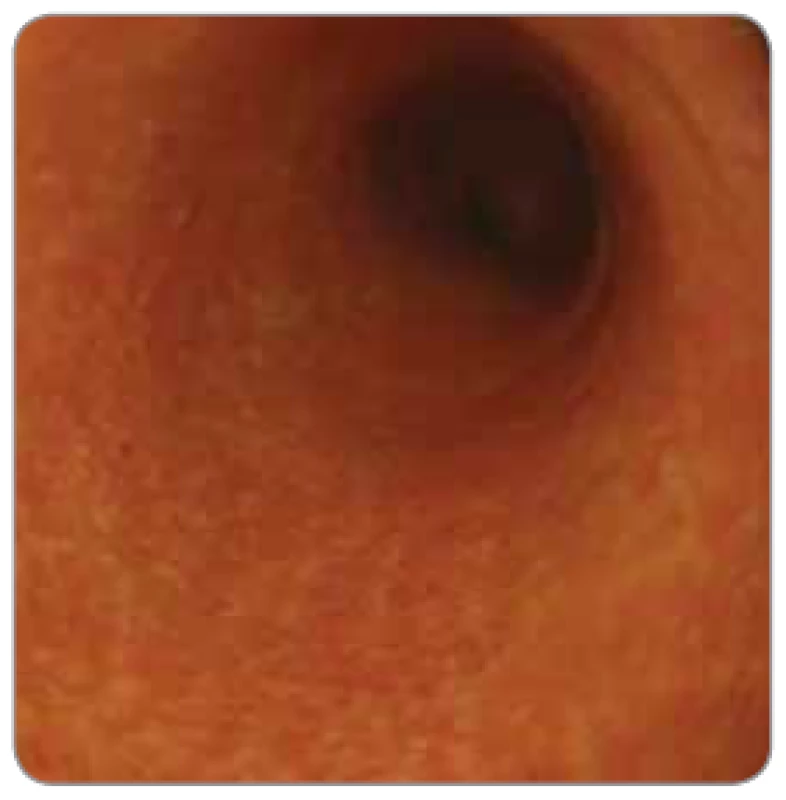
Obr. 4. Imunoterapií indukovaná kolitida (ipilimumab a nivolumab pro malobuněčný karcinom plic) u 52leté pacientky. Koloskopie: sliznice sigmatu je edematózní, zarudlá, s vymizelou cévní kresbou, kryta hnisem, místy je vyjádřen granulární reliéf. Nemocná byla následně úspěšně léčena infl iximabem a mykofenolátem mofetilem. 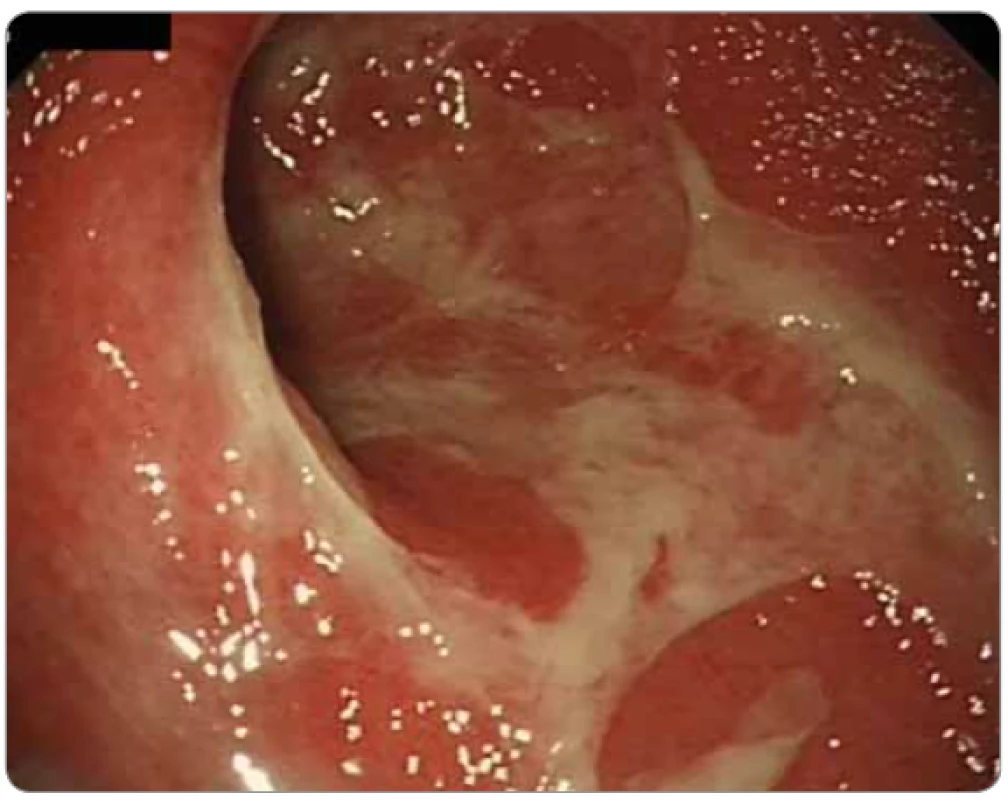
Obr. 5. Imunoterapií indukovaná kolitida (ipilimumab a nivolumab pro maligní melanom) u 62-letého pacienta. Koloskopie: ložiskově zarudlá sliznice transverza s vícečetnými afty. Nemocný byl následně úspěšně léčen infl iximabem. 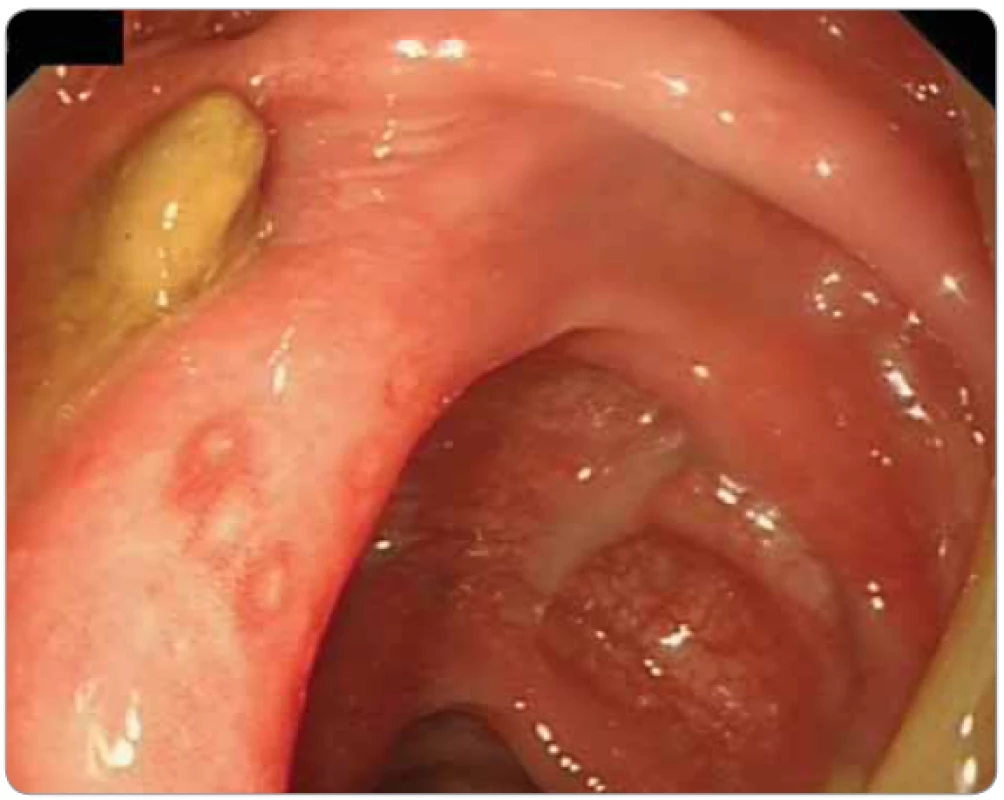
Obr. 6. Imunoterapií indukovaná kolitida (nivolumab pro maligní melanom) u 51letého pacienta. Koloskopie: sliznice sigmatu je edematózní, s vymizelou cévní kresbou, fragilní, spontánně krvácející, s naznačeným nodulárním reliéfem. Nemocný byl léčen vedolizumabem. Nelepšící se stav si vyžádal subtotální kolektomii. 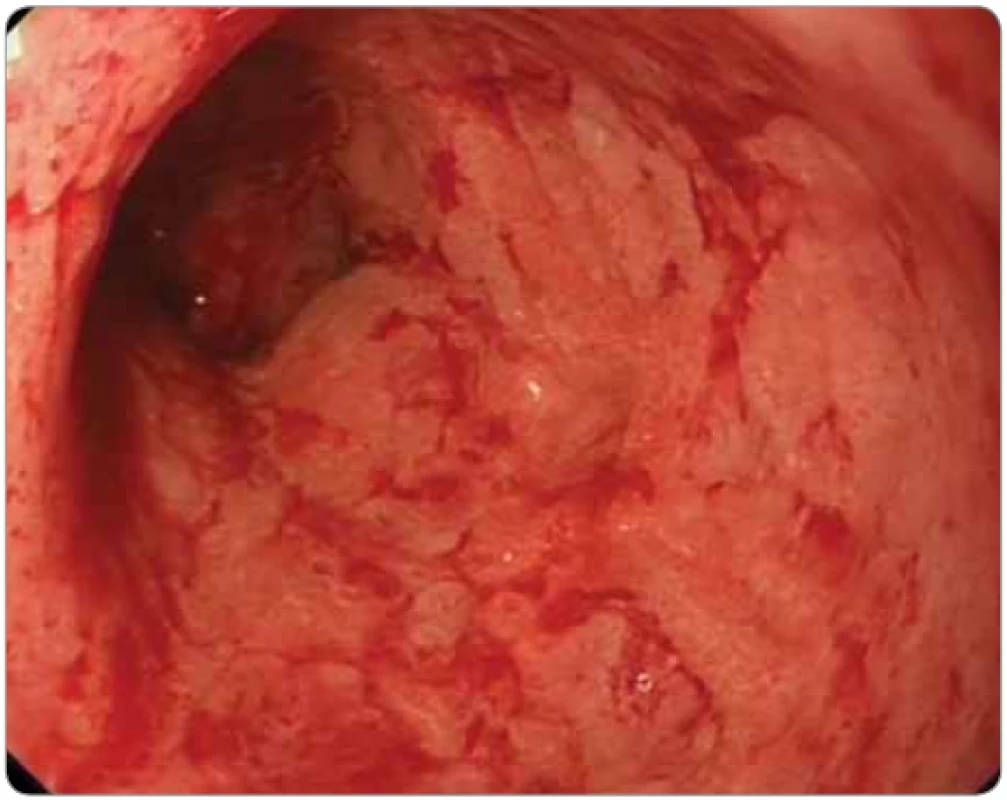
Hematologická, bio chemická a imunologická vyšetření jsou nespecifická a ke správné dia gnóze zpravidla nepřispějí. Kalprotektin ve stolici je vysoký [49]. Specifické bio markery jsou předmětem výzkumu [51]. Enterokolitida indukovaná ipilimumabem může nést ně kte ré znaky reakce štěpu proti hostiteli [49].
Diferenciálně dia gnosticky je třeba vyloučit infekce, především Clostridium difficile a cytomegalovirovou infekci (viz níže), malabsorpci žlučových kyselin (viz níže), koincidující až dosud latentní onemocnění v pozadí (např. celiakii, intoleranci laktózy), syndrom bakteriálního přerůstání v tenkém střevě (viz níže) a chemoterapií indukované kolitidy (při kombinované onkologické léčbě). Je třeba si uvědomit, že u jednoho pacienta může mít průjem více příčin současně [78–81].
Principy léčby
Léčbu kolitidy indukované protinádorovou imunoterapií je třeba přísně individualizovat. Vodítkem jsou stupně tíže postižení (obr. 6) s využitím mezinárodních doporučení [2,4,16,49]. Opatření je třeba realizovat bez prodlevy, ihned po objevení se průjmů. Vždy je třeba vyloučit komplikující infekci (viz níže). U stupně 1 postačí dostatečná hydratace spolu se symptomatickou léčbou (loperamid v denní dávce 2–16 mg). Protinádorovou imunoterapii u stupně 1 není třeba přerušovat. U stupně 2 je třeba neprodleně zahájit léčbu systémovými glukokortikoidy (prednison 0,5–1 mg/ kg/ den per os). V případě, že průjmy nejsou zjevně s krví, je možno jako alternativu zvážit budenosid (9 mg denně per os) [3,4,16]. Před zahájením glukokortikoterapie je třeba vyloučit infekci Clostridium diffi cile [49].
Vždy je třeba zvažovat možné nežádoucí vedlejší účinky systémových glukokortikoidů. Je-li nezbytná nutriční terapie, vždy je třeba preferovat enterální před parenterální výživou [2]. Profylaktické podání vitaminu D (do dosažení normálních hodnot) snižuje riziko vzniku kolitidy indukované protinádorovou imunoterapií [82].
Důležitá je současná symptomatická a rehydratační léčba. Imunoterapii je třeba přerušit. Léčba může probíhat ambulantně, s nemocným je třeba udržovat pravidelný telefonní kontakt. Již v této fázi doporučujeme provést sigmoideoskopii. Stupeň 3 a 4 vyžaduje hospitalizaci. Časná sigmoideoskopie je nezbytná. Ihned je třeba zahájit i.v. podání glukokortikoidů (metylprednisolon 1–2 mg/ kg/ den), rehydrataci krystaloidy, úpravu vnitřního prostředí a nutriční podporu (perorálními polymerními přípravky). Na indikaci totální parenterální výživy není jednotný názor, doporučené postupy Evropské společnosti pro klinickou onkologii (ESMO) ji uvádějí (obr. 6) [16], britské nepovažují její podání za indikované [2]. Imunoterapii je třeba přerušit. Důležité je podrobné laboratorní vyšetření (včetně posouzení stavu výživy). Zpravidla je třeba provést CT vyšetření břicha k vyloučení komplikací vyžadujících bezodkladnou chirurgickou intervenci [4,16]. Nedojde - -li během 72 hodin ke zlepšení stavu, je indikována i.v. infuzní bio logická léčba (infl iximab 5 mg/ kg nebo vedolizumab 300 mg). Po 2 týdnech následuje další infuze bio logické léčby [3,4,83]. Zhruba 60 % nemocných příznivě odpoví na léčbu systémovými glukokortikoidy a 80 % na podání infliximabu [2,3]. Při terapeutickém selhání glukokortikoidů je nezbytná koloskopie [84]. Zhruba 10 % pacientů má nález v colon ascendens, ne v levém tračníku, proto někdy sigmoideoskopie nestačí. Před rozhodnutím o bio logické léčbě musí být zvážena rizika anti-TNF-alfa terapie (včetně vyloučení latentní tuberkulózy, chronické virové hepatitidy B a kardiálního selhávání) [49].
Podle dosavadních výsledků se zdá, že vedolizumab (ve srovnání s infl iximabem) je spojen s menším rizikem snížení léčebného efektu imunoterapie a s menším rizikem nádorové progrese [49]. Terapii kolitidy indukované protinádorovou imunoterapií může posílit mykofenolát mofetil (1–1,5 g dvakrát denně) nebo takrolimus (0,1–0,3 mg/ kg/ den za kontrol cílové koncentrace takrolimu v plné krvi 5–15 ng/ ml) [2–4,16]. U refrakterních forem kolitidy se nově zkouší také ustekinumab nebo tofacitinib [2]. Při nelepšícím se stavu nebo komplikacích (perforace, toxické megakolon) je třeba neodkladně indikovat chirurgickou léčbu (subtotální kolektomie) [4,16,49].
V léčbě průjmů indukovaných imunoterapií FGFR inhibitory je doporučována symptomatická léčba loperamidem. Při závažnějším stupni (grade 3 nebo 4) je třeba imunoterapii přerušit [44]. V léčbě závažné gastrointestinální toxicity adoptivní buněčné terapie (CAR-T cells) se doporučují systémové glukokortikoidy a tocilizumab [45,52].
Na možný příznivý efekt probiotik v prevenci a léčbě kolitidy indukované protinádorovou imunoterapií není jednotný názor [61,62,83]. Z experimentálních prací je zřejmé, že modulační efekt probio tik trvá pouze po dobu jejich podávání [85]. Prozatím pouze v rámci klinických studií je u kolitid indukovaných protinádorovou imunoterapií zkoušena fekální bakterioterapie (fekální transplantace; faecal microbio ta transfer) [47,68,86]. Jedná se o snahu posílit protinádorovou účinnost imunoterapie a snížit nebo dokonce zabránit její gastrointestinální toxicitě [87]. Mezi “nenádorové indikace” v rámci komplexní onkologické péče patří fekální transplantace u recidivující a/ nebo refrakterní infekci Clostridium difficile [62,87].
Biologická léčba (infliximab, vedolizumab) enterokolitidy nebo kolitidy navozené protinádorovou imunoterapií je v České republice v současné době možná podle §16 (výjimečná úhrada jinak nehrazené zdravotní péče; Zákon o veřejném zdravotním pojištění č. 48/ 1997, paragraf 16).
Infekce komplikující systémovou protinádorovou imunoterapii
Protinádorová imunoterapie je spojena také s rizikem infekčních komplikací. Jedná se především o infekci Clostridium diffi cile, mykoplazmaty a o cytomegalovirovou infekci [88–91]. Vyšší riziko klostridiové infekce je u starších osob, léčených dlouhodobě inhibitory protonové pumpy, a u pacientů s dlouhodobou úplnou enterální výživou [92–98]. Riziko cytomegalovirové infekce je vyšší při kombinované imunosupresní léčbě / chemoterapii a protinádorové imunoterapii [89]. Byly popsány také případy tuberkulózy komplikující protinádorovou imunoterapii, a to i v neendemických oblastech [99].
Na možnost komplikující střevní infekce je třeba pamatovat, protože klinický i endoskopický obraz bývá značně nespecifi cký (obr. 7). Průjmy mohou mít vedle infekčních příčin současně i příčiny neinfekční. Léčba musí být přísně individualizována po stanovení infekčního agens.
Obr. 7. Cytomegalovirová kolitida krátce po chemoradioterapii pro karcinom rekta 67letého imunosuprimovaného pacienta. Koloskopie: sliznice sigmatu je edematózní, zarudlá, je vymizelá cévní kresba. Cytomegalovirus byl prokázán v biopsiích sigmatu i v séru (CMV PCR: 40 501 IU/ml). 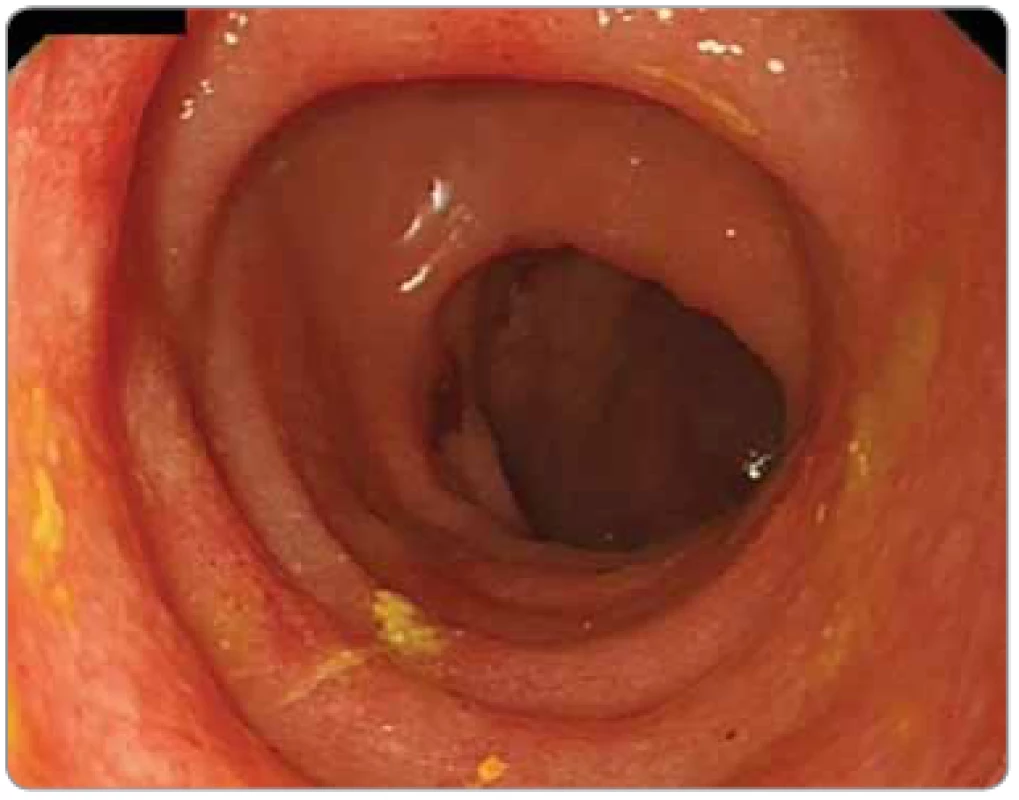
Malabsorpce žlučových kyselin u enterokolitid navozených protinádorovou onkologickou léčbou
Malabsorpce žlučových kyselin patří k nejvíce opomíjeným dia gnózám v gastroenterologii a onkologii. Dobře je doložena především u onkologických pacientů s chemo - a/ nebo radioterapií, kdy postihuje až polovinu nemocných [100–102]. Širší zkušenosti s malabsorpcí žlučových kyselin komplikující systémovou protinádorovou imunoterapii dosud chybí, lze ji očekávat především u komplikující enterokolitidy. Z patofyziologického hlediska se malabsorpce žlučových kyselin dělí do tří skupin: typ I (sekundární ve vazbě na dysfunkci ilea; stavy po resekcích ilea, terminální ileitida u Crohnovy choroby, stavy po radioterapii malé pánve), typ II (primární; až u třetiny nemocných s dráždivým tračníkem) a typ III (sekundární bez vazby na terminální ileum, např. stavy po cholecystektomii, chronická pankreatitida, celiakie, syndrom bakteriálního přerůstání v tenkém střevě aj.) [100,103,104].
Klinický obraz
V klinickém obraze malabsorpce žlučových kyselin dominují průjmy. V jejich patogenezi se uplatňují vícečetné mechanizmy, poruchy transportu / vstřebávání sodíku a vody, zvýšená střevní permeabilita, nedostatečná zpětnovazebná inhibice bio syntézy žlučových kyselin, zvýšená motilita tenkého i tlustého střeva se zkrácením tranzitního času, funkční nebo morfologické poškození sliznice tenkého a/ nebo tlustého střeva, zvýšená produkce hlenu a stimulace defekace [103–105]. Důležitá je interakce střevních mikrobio t se žlučovými kyselinami [105]. Syndrom bakteriálního přerůstání může být jak příčinou, tak i následkem malabsorpce žlučových kyselin.
Diagnostika a léčba
Zlatým standardem pro dia gnostiku malabsorpce žlučových kyselin je SeHCAT sken (75-Selenium HomoCholic Acid Taurine test) (obr. 8 a 9). Je jednoduchý k provedení, neinvazivní, s minimální radiační zátěží (370 kBq, tj. 10 μCi) [100,106,107]. Dia gnostický SeHCAT sken není dosud v České republice k dispozici, jeho zavedení je plánováno na podzim 2022. Při velmi důvodném podezření na malabsorpci žlučových kyselin je možno zahájit terapeutický test s cholestyraminem [100,102]. Sérové koncentrace C4 (7-hydroxy-4-cholesten-3-one) se v diagnostice malabsorpce žlučových kyselin využívají méně často [108–110]. Dechové testy (s 14C - nebo 13C-glykocholátem) a přímé stanovení žlučových kyselin ve stolici se v běžné klinické praxi neprovádějí.
Obr. 8. SeHCAT sken: malabsorpce žlučových kyselin neprokázána (retence radiofarmaka v den 7: 35 %). Převzato se svolením autorů [100]. ![SeHCAT sken: malabsorpce žlučových kyselin neprokázána (retence radiofarmaka v den 7: 35 %). Převzato se svolením autorů
[100].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/64364b083058f357c149701591a244c3.png)
Obr. 9. SeHCAT sken: malabsorpce žlučových kyselin prokázána (retence radiofarmaka v den 7: 2 %). Převzato se svolením autorů [100]. ![SeHCAT sken: malabsorpce žlučových kyselin prokázána (retence radiofarmaka v den 7: 2 %). Převzato se svolením
autorů [100].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/fcbfbd45432ca1cd48fc9bc937a22815.png)
Při laboratorním vyšetření mohou být zjištěny známky malasimilace (normocytární nebo makrocytární anemie; nízká sérová koncentrace vitaminu B12; nízký sérový prealbumin a defi cit vitaminu D) a minerálové dysbalance v důsledku chronických průjmů (hypovolemická hypotonická hyponatremie s tendencí k hypokalemii a metabolické alkalóze, pokud současně převládají ztráty kalia nad ztrátami bikarbonátů) [105].
Principy léčby zahrnují terapii základního onemocnění (je-li to možné) a léčbu gastrointestinální toxicity navozené imunoterapií a/ nebo chemoterapií (viz výše). Terapie malabsorpce žlučových kyselin zahrnuje dietní opatření (omezení příjmu tuků v potravě na 20 % denního energetického příjmu), symptomatickou léčbu (loperamid per os v denní dávce 2–16 mg), sekvestranty a substituci vitaminu D a vitaminu B12 [100,102,111–114]. Ze sekvestrantů je v České republice k dispozici cholestyramin. Je nutno ho podávat odděleně od dalších léčiv a zvyšovat postupně (až na cílovou dávku 12 g denně). Mezi časté vedlejší účinky patří zácpa (~ 10 %) a dále nadýmání, pyróza, nechutenství, nevolnost, zvracení a bolesti hlavy (1–10 %). V zahraničí se v terapii používá cholesevelam, který je obvykle lépe tolerován než cholestyramin [112,115]. Cholesevelam není v České republice dosud k dispozici. Léčba sekvestranty může interferovat s absorpcí vitaminů rozpustných v tucích, proto je vhodné tyto kontrolovat. Kontrolovat je třeba také jaterní testy a sérové koncentrace triacylglycerolů.
Syndrom bakteriálního přerůstání v tenkém střevě
Opomíjenou komplikací onkologické léčby je syndrom bakteriálního přerůstání v tenkém střevě [116,117], vyskytuje se až u poloviny nemocných [116–118]. Na vzniku se zpravidla podílí více faktorů. Může se jednat o komplikaci základního onemocnění, předchozí chirurgické léčby a/ nebo chemo - / imunoterapie [116,117]. Syndrom bakteriálního přerůstání je klinická porucha, kdy symptomy a/ nebo laboratorní abnormality jsou přičítány zvýšenému počtu bakterií a/ nebo abnormálnímu složení bakteriot v tenkém střevě. Symptomatologie může být nespecifi cká, připomínat dráždivý tračník nebo jiné funkční poruchy, méně často je plně vyjádřen malasimilační syndrom [116,118]. Při laboratorním vyšetření může být zdánlivě paradoxně snížená sérová koncentrace vitaminu B12 (bakteriemi konzumován) a normální nebo zvýšená koncentrace kyseliny listové (bakteriemi produkována) [116–118]. V minulosti byl pro dia gnózu požadován průkaz > 105 mikroorganismů/ ml aspirátu z proximálního jejuna. Jednalo se o náročné vyšetření jak pro odběr, vyžadující speciální odběrový systém (aspirační katétr s převlečnou trubicí a gumovým obturátorem k zabránění kontaminace z jiných částí trávicího ústrojí) [119], tak i pro následné mikrobiologické zpracování.
Americká gastroenterologická asociace (AGA) v roce 2020 navrhla zjednodušenou defi nici: průkaz > 103 CFU (colony-forming units, kolonie tvořící jednotky) koliformních bakterií v 1 ml čerstvého jejunálního aspirátu [118]. Toto vyšetření je snáze proveditelné. Arbitrární hranice byla stanovena na základě poznatku, že jen zřídka u zdravého dospělého člověka hodnota CFU přesáhne 102/ ml jejunálního aspirátu [118]. V běžné klinické praxi se využívají neinvazivní dechové testy, kdy se po perorálním podání glukózy nebo laktulózy měří vzestup koncentrace vodíku a/ nebo metanu ve vydechovaném vzduchu [116]. Britská Asociace gastrointestinálních fyziologů (AGIP) v roce 2020 navrhla standardní protokol [120]. Pro pozitivní hodnocení je rozhodující vzestup vodíku a/ nebo metanu o ≥ 20 ppm oproti bazální hodnotě kdykoliv v průběhu testu (obr. 10 a 11) [120].
Obr. 10. Vodíkový a metanový dechový test u 60leté pacientky, od roku 2020 léčené pro adenokarcinom pankreatu. Současně byla diagnostikována exokrinní pankreatická insuficience – elastáza 1 ve stolici: 104 μg E1 / g stolice (norma > 200 μg E1 / g stolice). Vzestup koncentrace vodíku je patologický (za 60 minut po perorálním podání 75 g glukózy), je diagnostický pro syndrom bakteriálního přerůstání v tenkém střevě (hydrogenní fenotyp). 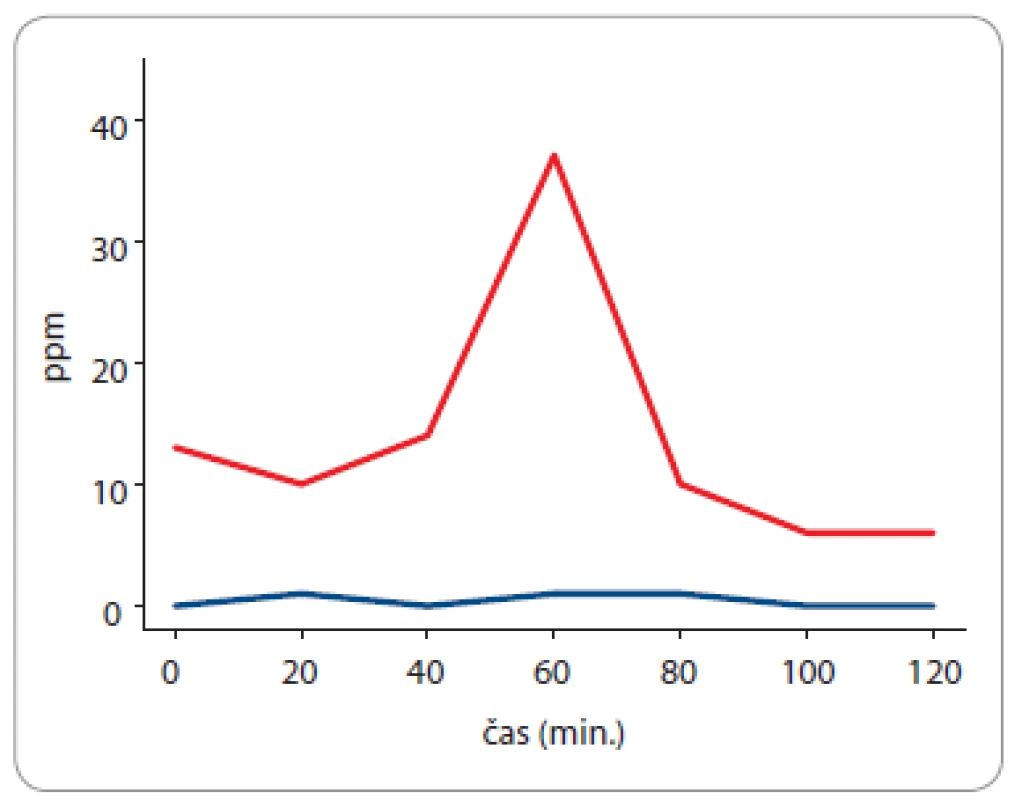
ppm (parts per milion) – počet částic na jeden milion (bezrozměrný zlomek); vodík červeně, metan modře. Obr. 11. Vodíkový a metanový dechový test u 60letého pacienta, od roku 2015 léčeného pro liposarkom malé pánve. Opakovaně došlo k recidivě bakteriálního přerůstání v tenkém střevě. Současně byla diagnostikována závažná malabsorpce žlučových kyselin (SeHCAT scan – retence radiofarmaka: 0 % v den 7; norma > 20 %). Vzestup koncentrace metanu ve vydechovaném vzduchu je patologický (za 20 minut po perorálním podání 75 g glukózy), je diagnostický pro syndrom bakteriálního přerůstání v tenkém střevě (metanogenní fenotyp). 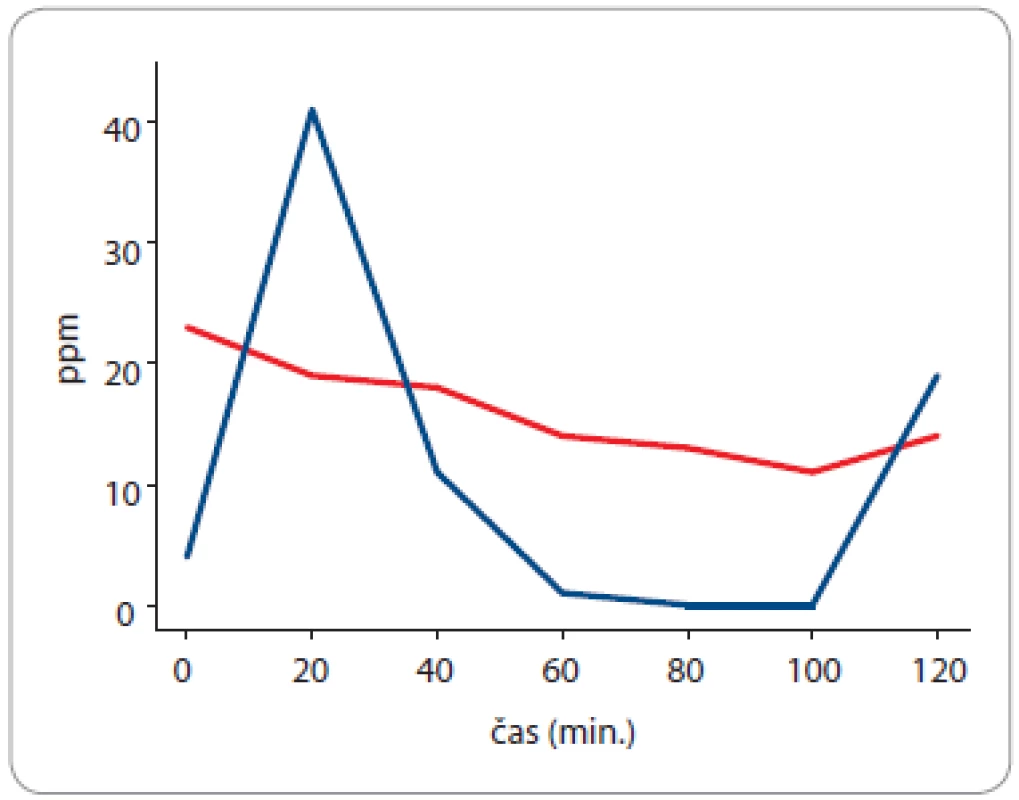
ppm (parts per milion) – počet částic na jeden milion (bezrozměrný zlomek); vodík červeně, metan modře. Východiskem léčby je ovlivnění základního onemocnění nebo stavu, který bakteriální přerůstání v tenkém střevě způsobil (je-li to možné). V terapii se používá především cyklické podávání rifaximinu a/ nebo metronidazolu a/ nebo vankomycinu [121–124]. Relativní novinkou v léčbě je coligenta (kolimycin s gentamycinem pro perorální podání). V zahraničí je již k dispozici komerční přípravek, jedna kapsle obsahuje 135 mg kolimycinu a 100 mg gentamycinu. Ve studii 150 pacientů desetidenní podávání léčiva (tří kapslí denně) vedlo ke zlepšení symptomů u 86 % nemocných a normalizaci vodíkového dechového testu ve 42 % [125].
Závěry
Systémová protinádorová imunoterapie představuje zásadní pokrok v současné onkologické léčbě. Je však spojena s riziky nežádoucích vedlejších účinků. Jedná se o imunopatologické reakce (podobné autoimunitním chorobám), infekční komplikace a velmi pravděpodobně také o malabsorpci žlučových kyselin a syndrom bakteriálního přerůstání v tenkém střevě. Na tato rizika je třeba pamatovat, včas komplikace diagnostikovat a bezodkladně léčit.
Dedikace
Práce byla podpořena z projektu DZRO MO1012 (institucionální podpora výzkumu ÚVN).
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
The authors declare that they have no potential conflicts of interest concerning drugs, products, or services used in the study.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.
prof. MUDr. Jan Bureš, CSc., FCMA
Ústav gastrointestinální onkologie
ÚVN Praha
U vojenské nemocnice 1200
169 02 Praha 6e-mail: bures.jan@uvn.cz
Obdrženo/Submitted: 2. 4. 2022
Přijato/Accepted: 20. 4. 2022
Zdroje
- Niederhuber JE, Armitage JO, Kastan MB et al (eds). Abeloff ’s clinical oncology. 6th Edition. Philadelphia: Elsevier Books 2020. ISBN 978-0-323-47674-4.
- Powell N, Ibraheim H, Raine T et al. British Society of Gastroenterology endorsed guidance for the management of immune checkpoint inhibitor-induced enterocolitis. Lancet Gastroenterol Hepatol 2020; 5(7): 679–697. doi: 10.1016/ S2468-1253(20)300 14-5.
- Ibraheim H, Baillie S, Samaan MA et al. Systematic review with meta-analysis: eff ectiveness of anti-infl ammatory therapy in immune checkpoint inhibitor-induced enterocolitis. Aliment Pharmacol Ther 2020; 52(9): 1432–1452. doi: 10.1111/ apt.15998.
- Dougan M, Wang Y, Rubio -Tapia A et al. AGA clinical practice update on dia gnosis and management of immune checkpoint inhibitor colitis and hepatitis: expert review. Gastroenterology 2021; 160(4): 1384–1393. doi: 10.1053/ j.gastro.2020.08.063.
- Petruželka L, Konopásek B. Klinická onkologie. Praha: Karolinum 2002.
- Adam Z, Krejčí M, Vorlíček J. Speciální onkologie. Praha: Galén 2010.
- Klener P. Základy klinické onkologie. Praha: Galén 2011.
- Petera J, Melichar B. Klinická onkologie. In: Bureš J, Horáček J, Malý J (eds). Vnitřní lékařství. Praha: Galén 2014 : 684–726.
- Kiss I, Matějovská Kubešová H. Geriatrická onkologie. Praha: Mladá fronta 2015.
- Krejsek J, Andrýs C, Krčmová I. Imunologie člověka. Hradec Králové: Garamon 2016.
- Hucl T, Petruželka L, Kiss I et al. Základy gastrointestinální onkologie. In: Zavoral M, Bureš J, Ryska M et al. (eds). Mařatkova gastroenterologie. Praha: Karolinum 2021.
- Society guideline links. Management of symptoms and toxicities of anticancer therapy. [online]. Dostupné z: www.uptodate.com.
- Society guideline links. Management of toxicities due to checkpoint inhibitor immunotherapy. Dostupné z: www.uptodate.com.
- Společnost pro gastrointestinální onkologii ČLS JEP. Vzdělávací webináře, 2020–2022 [online]. Dostupné z: www.sgo-cls.cz.
- Česká onkologická společnost ČLS JEP. Doporučené postupy, 2022. [online]. Dostupné z: www.linkos. cz/ tags/ doporucene-postupy/ .
- Haanen JBAG, Carbonnel F, Robert C et al. Management of toxicities from immunotherapy: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow - up. Ann Oncol 2017; 28(Suppl 4): iv119–iv142. doi: 10.1093/ annonc/ mdx225.
- Puzanov I, Diab A, Abdallah K et al. Managing toxicities associated with immune checkpoint inhibitors: consensus recommendations from the Society for Immunotherapy of Cancer (SITC) Toxicity Management Working Group. J Immunother Cancer 2017; 5(1): 95. doi: 10.1186/ s40425-017-0300-z.
- Hryniewicki AT, Wang C, Shatsky RA et al. Management of Immune Checkpoint Inhibitor Toxicities: A Review and Clinical Guideline for Emergency Physicians. J Emerg Med 2018; 55(4): 489–502. doi: 10.1016/ j.jemermed. 2018.07.005.
- Common Terminology Criteria for Adverse Events (CTCAE). Version 5.0. US Dept Health Human Services, 2017. [online]. Dostupné z: www.ctep.cancer.gov.
- Říhová B, Štastný M. History of immunotherapy – from Coley toxins to checkpoints of the immune reaction. Klin Onkol 2015; 28(Suppl 4): 8–14. doi: 10.14735/ amko20154S8.
- Shoushtari AN. Principles of cancer immunotherapy. [online]. Dostupné z: www.uptodate.com.
- Lakomý R, Poprach A. Side effects of modern immunotherapy and how to solve them in the clinics. Klin Onkol 2015; 28(Suppl 4): 103–114.
- Obermannová R. Checkpoint inhibitors in the treatment of upper gastrointestinal tract tumors. Klin Onkol 2017; 30 (Suppl 3): 50–54. doi: 10.14735/ amko20173S50.
- Tomášek J, Kiss I. Imunoterapie nádorů dolní části trávicí trubice. Klin Onkol 2017; 30 (Suppl 3): 62–65. doi: 10.14735/ amko20173S62.
- Fiala O, Šorejs O, Šustr J et al. Side effects and efficacy of immunotherapy. Klin Onkol 2020; 33(1): 8–10. doi: 10.14735/ amko20208
- Špaček J. Gastrointestinal toxicity of immunotherapy. Klin Onkol 2020; 33(1): 23–28. doi: 10.14735/ amko202023.
- Postow M. Toxicities associated with checkpoint inhibitor immunotherapy. [online]. Dostupné z: www.uptodate. com.
- Patel AB, Lacouture ME. Mucocutaneous toxicities associated with immune checkpoint inhibitors. [online]. Dostupné z: www.uptodate.com.
- Hodi FS, O’Day SJ, McDermott DF et al. Improved survival with ipilimumab in patients with metastatic melanoma. N Engl J Med 2010; 363(8): 711–723. doi: 10.1056/ NEJMoa1003466.
- Wolchok JD, Neyns B, Linette G et al. Ipilimumab monotherapy in patients with pretreated advanced melanoma: a randomised, double-blind, multicentre, phase 2, dose-ranging study. Lancet Oncol 2010; 11(2): 155 – 164. doi: 10.1016/ S1470-2045(09)70334-1.
- Weber JS, Kähler KC, Hauschild A. Management of immune-related adverse events and kinetics of response with ipilimumab. J Clin Oncol 2012; 30(21): 2691–2697. doi: 10.1200/ JCO.2012.41.6750.
- Topalian SL, Sznol M, McDermott DF et al. Survival, durable tumor remission, and long-term safety in patients with advanced melanoma receiving nivolumab. J Clin Oncol 2014; 32(10): 1020–1030. doi: 10.1200/ JCO.2013.53.0105.
- Snyder A, Makarov V, Merghoub T et al. Genetic basis for clinical response to CTLA-4 blockade in melanoma. N Engl J Med 2014; 371(23): 2189–2199. doi: 10.1056/ NEJM oa1406498.
- Larkin J, Chiarion-Sileni V, Gonzalez R et al. Combined nivolumab and ipilimumab or monotherapy in untreated melanoma. N Engl J Med 2015; 373(1): 23–34. doi: 10.1056/ NEJMoa1504030.
- Buchbinder EI, Desai A. CTLA-4 and PD-1 pathways: similarities, differences, and implications of their inhibition. Am J Clin Oncol 2016; 39(1): 98–106. doi: 10.1097/ COC.0000000000000239.
- Spain L, Diem S, Larkin J. Management of toxicities of immune checkpoint inhibitors. Cancer Treat Rev 2016; 44 : 51–60. doi: 10.1016/ j.ctrv.2016.02.001.
- Topalian SL, Taube JM, Anders RA et al. Mechanismdriven bio markers to guide immune checkpoint blockade in cancer therapy. Nat Rev Cancer 2016; 16(5): 275 – 287. doi: 10.1038/ nrc.2016.36.
- Weber JS, Hodi FS, Wolchok JD et al. Safety profi le of nivolumab monotherapy: a pooled analysis of patients with advanced melanoma. J Clin Oncol 2017; 35(7): 785 – 792. doi: 10.1200/ JCO.2015.66.1389.
- Flynn M, Young K, Cunningham D et al. The evolving immunotherapeutic landscape in advanced oesophagogastric cancer. Ther Adv Med Oncol 2018; 10 : 1758835918786228. doi: 10.1177/ 1758835918786 228.
- Motzer RJ, Penkov K, Haanen J et al. Avelumab plus axitinib versus sunitinib for advanced renal-cell carcinoma. N Engl J Med 2019; 380(12): 1103–1115. doi: 10.1056/ NEJMoa1816047.
- Larkin J, Chiarion-Sileni V, Gonzalez R et al. Five-year survival with combined nivolumab and ipilimumab in advanced melanoma. N Engl J Med 2019; 381(16): 1535–1546. doi: 10.1056/ NEJMoa1910836.
- Kohoutova D, Worku D, Aziz H et al. Malignant melanoma of the gastrointestinal tract: symptoms, diagnosis, and current treatment options. Cells 2021; 10(2): 327. doi: 10.3390/ cells10020327.
- Puhr HC, Preusser M, Ilhan-Mutlu A. Immunotherapy for esophageal cancers: what is practice changing in 2021? Cancers (Basel) 2021; 13(18): 4632. doi: 10.3390/ cancers13184632.
- Martinez M, Moon EK. CAR T cells for solid tumors: new strategies for finding, infiltrating, and surviving in the tumor microenvironment. Front Immunol 2019; 10 : 128. doi: 10.3389/ fi mmu.2019.00128.
- Brudno JN, Kochenderfer JN. Recent advances in CAR T-cell toxicity: mechanisms, manifestations and management. Blood Rev 2019; 34 : 45–55. doi: 10.1016/ j. blre.2018.11.002.
- Larson RC, Maus MV. Recent advances and discoveries in the mechanisms and functions of CAR T cells. Nat Rev Cancer 2021; 21(3): 145–161. doi: 10.1038/ s41568 - 020-00323-z.
- Kennedy LB, Salama AKS. A review of cancer immunotherapy toxicity. CA Cancer J Clin 2020; 70(2): 86–104. doi: 10.3322/ caac.21596.
- Malikova H, Holesta M, Fialova A et al. Hypophysitis and other autoimmune complications related to immune checkpoints inhibitors’ treatment: spectrum of imaging appearances. Neuro Endocrinol Lett 2018; 39(3): 196–204.
- Som A, Mandaliya R, Alsaadi D et al. Immune checkpoint inhibitor-induced colitis: a comprehensive review. World J Clin Cases 2019; 7(4): 405–418. doi: 10.12998/ wjcc.v7.i4.405.
- Ibraheim H, Perucha E, Powell N. Pathology of immune - mediated tissue lesions following treatment with immune checkpoint inhibitors. Rheumatology (Oxford) 2019; 58(Suppl 7): vii17–vii28. doi: 10.1093/ rheumatology/ kez465.
- Jia XH, Geng LY, Jiang PP et al. The bio markers related to immune related adverse events caused by immune checkpoint inhibitors. J Exp Clin Cancer Res 2020; 39(1): 284. doi: 10.1186/ s13046-020-01749-x.
- Dahiya DS, Wani F, Guidi JC et al. Gastrointestinal adverse eff ects of immunotherapeutic agents: a systematic review. Gastroenterology Res 2020; 13(6): 227–232. doi: 10.14740/ gr1340.
- Jamal S, Hudson M, Fifi -Mah A et al. Immune-related adverse events associated with cancer immunotherapy: a review for the practicing rheumatologist. J Rheumatol 2020; 47(2): 166–175. doi: 10.3899/ jrheum.190084.
- Naidoo J, Page DB, Li BT et al. Toxicities of the anti-PD-1 and anti-PD-L1 immune checkpoint antibodies. Ann Oncol 2016; 27(7): 1362. doi: 10.1093/ annonc/ mdw141.
- Zhou X, Yao Z, Bai H et al. Treatment-related adverse events of PD-1 and PD-L1 inhibitor-based combination therapies in clinical trials: a systematic review and meta-analysis. Lancet Oncol 2021; 22(9): 1265–1274. doi: 10.1016/ S1470-2045(21)00333-8.
- Zhao L, Yang Y, Li W et al. Nivolumab-induced cytokine - release syndrome in relapsed/ refractory Hodgkin’s lymphoma: a case report and literature review. Immunotherapy 2018; 10(11): 913–917. doi: 10.2217/ imt-2018-0025.
- Pabla BS, Schwartz DA. Assessing severity of disease in patients with ulcerative colitis. Gastroenterol Clin North Am 2020; 49(4): 671–688. doi: 10.1016/ j.gtc.2020.08.003.
- Kewan T, Covut F, Ahmed R et al. Clinically signifi cant bleeding with immune checkpoint inhibitors: a retrospective cohort study. Eur J Cancer 2020; 137 : 285–287. doi: 10.1016/ j.ejca.2020.07.005.
- Young K, Lin E, Chen E et al. Small bowel hemorrhage from check point inhibitor enteritis: a case report. BMC Gastroenterol 2021; 21(1): 345. doi: 10.1186/ s12876-021 - 01915-1.
- Tey SK. Adoptive T-cell therapy: adverse events and safety switches. Clin Transl Immunology 2014; 3(6): e17. doi: 10.1038/ cti.2014.11.
- Li J, Butcher J, Mack D et al. Functional impacts of the intestinal microbio me in the pathogenesis of infl ammatory bowel disease. Infl amm Bowel Dis 2015; 21(1): 139 – 153. doi: 10.1097/ MIB.0000000000000215.
- Jain T, Sharma P, Are AC et al. New insights into the cancer-microbio me-immune axis: decrypting a decade of discoveries. Front Immunol 2021; 12 : 622064. doi: 10.3389/ fi mmu.2021.622064.
- Marthey L, Mateus C, Mussini C et al. Cancer immunotherapy with Anti-CTLA-4 monoclonal antibodies induces an infl ammatory bowel disease. J Crohns Colitis 2016; 10(4): 395–401. doi: 10.1093/ ecco-jcc/ jjv227.
- Furusawa Y, Obata Y, Hase K. Commensal microbiota regulates T cell fate decision in the gut. Semin Immunopathol 2015; 37(1): 17–25. doi: 10.1007/ s00281-014 - 0455-3.
- Dubin K, Callahan MK, Ren B et al. Intestinal microbiome analyses identify melanoma patients at risk for checkpoint-blockade-induced colitis. Nat Commun 2016; 7 : 10391. doi: 10.1038/ ncomms10391.
- Chaput N, Lepage P, Coutzac C et al. Baseline gut microbiota predicts clinical response and colitis in metastatic melanoma patients treated with ipilimumab. Ann Oncol 2017; 28(6): 1368–1379. doi: 10.1093/ annonc/ mdx108.
- Rezasoltani S, Yadegar A, Asadzadeh Aghdaei H et al. Modulatory eff ects of gut microbio me in cancer immunotherapy: a novel paradigm for blockade of immune checkpoint inhibitors. Cancer Med 2021; 10(3): 1141–1154. doi: 10.1002/ cam4.3694.
- Yu ZK, Xie RL, You R et al. The role of the bacterial microbio me in the treatment of cancer. BMC Cancer 2021; 21(1): 934. doi: 10.1186/ s12885-021-08664-0.
- Sokol H, Pigneur B, Watterlot L et al. Faecalibacterium prausnitzii is an anti-inflammatory commensal bacterium identifi ed by gut microbio ta analysis of Crohn disease patients. Proc Natl Acad Sci U S A 2008; 105(43): 16731–16736. doi: 10.1073/ pnas.0804812105.
- Ferreira-Halder CV, Faria AVS, Andrade SS. Action and function of Faecalibacterium prausnitzii in health and disease. Best Pract Res Clin Gastroenterol 2017; 31(6): 643–648. doi: 10.1016/ j.bpg.2017.09.011.
- Quévrain E, Maubert MA, Michon C et al. Identifi - cation of an anti-inflammatory protein from Faecalibacterium prausnitzii, a commensal bacterium deficient in Crohn’s disease. Gut 2016; 65(3): 415–425. doi: 10.1136/ gutjnl-2014-307649
- Zhou L, Zhang M, Wang Y et al. Faecalibacterium prausnitzii produces butyrate to maintain Th17/Treg balance and to ameliorate colorectal colitis by inhibiting histone deacetylase 1. Infl amm Bowel Dis 2018; 24(9): 1926–1940. doi: 10.1093/ ibd/ izy182.
- Jia W, Whitehead RN, Griffi ths L et al. Is the abundance of Faecalibacterium prausnitzii relevant to Crohn’s disease? FEMS Microbio l Lett 2010; 310(2): 138–144. doi: 10.1111/ j.1574-6968.2010.02057.x.
- Fujimoto T, Imaeda H, Takahashi K et al. Decreased abundance of Faecalibacterium prausnitzii in the gut microbio ta of Crohn’s disease. J Gastroenterol Hepatol 2013; 28(4): 613–619. doi: 10.1111/ jgh.12073.
- Lopez-Siles M, Duncan SH, Garcia-Gil LJ et al. Faecalibacterium prausnitzii: from microbio logy to diagnostics and prognostics. ISME J 2017; 11(4): 841–852. doi: 10.1038/ ismej.2016.176.
- Darnell EP, Mooradian MJ, Baruch EN et al. Immunerelated adverse events (irAEs): dia gnosis, management, and clinical pearls. Curr Oncol Rep 2020; 22(4): 39. doi: 10.1007/ s11912-020-0897-9.
- Fountzilas E, Lampaki S, Koliou GA et al. Real-world safety and effi cacy data of immunotherapy in patients with cancer and autoimmune disease: the experience of the Hellenic Cooperative Oncology Group. Cancer Immunol Immunother 2022; 71(2): 327–337. doi: 10.1007/ s00262-021-02985-6.
- Muls AC, Klimova K, Andreyev HJN. Clinical decision - making in managing changes in gastrointestinal function following cancer therapies: is experience enough? Eur J Cancer Care (England) 2018; 27(1). doi: 10.1111/ ecc.12766.
- Larsen HM, Borre M, Christensen P et al. Clinical evaluation and treatment of chronic bowel symptoms following cancer in the colon and pelvic organs. Acta Oncol 2019; 58(5): 776–781. doi: 10.1080/ 0284186X.2018.1562211.
- Gadhok R, Paulon E, Tai C et al. Gastrointestinal consequences of cancer treatment: evaluation of 10 years’ experience at a tertiary UK centre. Frontline Gastroenterol 2020; 12(6): 471–477. doi: 10.1136/ flgastro - 2020-101430.
- Andreyev HJN, Lalji A, Mohammed K et al. The FOCCUS study: a prospective evaluation of the frequency, severity and treatable causes of gastrointestinal symptoms during and after chemotherapy. Support Care Cancer 2021; 29(3): 1443–1453. doi: 10.1007/ s00520-020 - 05610-x.
- Grover S, Dougan M, Tyan K et al. Vitamin D intake is associated with decreased risk of immune checkpoint inhibitor-induced colitis. Cancer 2020; 126(16): 3758–3767. doi: 10.1002/ cncr.32966.
- Lui RN, Chan SL. Management of gastrointestinal side effects of immune checkpoint inhibitors. Clin Gastroenterol Hepatol 2021; 19(11): 2262–2265. doi: 10.1016/ j.cgh.2021.06.038.
- Geukes Foppen MH, Rozeman EA, van Wilpe S et al. Immune checkpoint inhibition-related colitis: symptoms, endoscopic features, histology and response to management. ESMO Open 2018; 3(1): e000278. doi: 10.1136/ esmoopen-2017-000278.
- Bures J, Smajs D, Kvetina J et al. Bacteriocinogeny in experimental pigs treated with indomethacin and Escherichia coli Nissle. World J Gastroenterol 2011; 17(5): 609–617. doi: 10.3748/ wjg.v17.i5.609.
- Wang Y, Wiesnoski DH, Helmink BA et al. Fecal microbiota transplantation for refractory immune checkpoint inhibitor-associated colitis. Nat Med 2018; 24(12): 1804–1808. doi: 10.1038/ s41591-018-0238-9.
- McQuade JL, Ologun GO, Arora R et al. Gut microbiome modulation via fecal microbiota transplant to augment immunotherapy in patients with melanoma or other cancers. Curr Oncol Rep 2020; 22(7): 74. doi: 10.1007/ s11912-020-00913-y.
- Wanik J, Teevan C, Pepin L et al. Implementation of a bowel protocol to improve enteral nutrition and reduce clostridium diffi cile testing. Crit Care Nurse 2019; 39(6): e10–e18. doi: 10.4037/ ccn2019304.
- Badran O, Ouryvaev A, Baturov V et al. Cytomegalovirus pneumonia complicating immune checkpoint inhibitors-induced pneumonitis: a case report. Mol Clin Oncol 2021; 14(6): 120. doi: 10.3892/ mco.2021.2282.
- Bird D, Singh M. An unusual case of invasive pleuritis and miliary Mycoplasma pneumonia during check-point inhibitor therapy. Respirol Case Rep 2021; 9(9): e0813. doi: 10.1002/ rcr2.813.
- Sumiyoshi T, Uemura K, Aoki G et al. Increased clostridium difficile infection in the era of preoperative chemotherapy for pancreatic cancer. Pancreatology 2021; 22(2): 258–263. doi: 10.1016/ j.pan.2021.12. 009.
- Pitta MR, Campos FM, Monteiro AG et al. Tutorial on diarrhea and enteral nutrition: a comprehensive stepbystep approach. JPEN J Parenter Enteral Nutr 2019; 43(8): 1008–1019. doi: 10.1002/ jpen.1674.
- Wang D, Dong D, Wang C et al. Risk factors and intestinal microbiota: clostridioides difficile infection in patients receiving enteral nutrition at intensive care units. Crit Care 2020; 24(1): 426. doi: 10.1186/ s13054-020 - 03119-7.
- Kelly CR, Fischer M, Allegretti JR et al. ACG Clinical Guidelines: prevention, diagnosis, and treatment of clostridioides difficile infections. Am J Gastroenterol 2021; 116(6): 1124–1147. doi: 10.14309/ ajg.0000000000001278.
- Inghammar M, Svanström H, Voldstedlund M et al. Proton-pump inhibitor use and the risk of community associated clostridium difficile infection. Clin Infect Dis 2021; 72(12): e1084–e1089. doi: 10.1093/ cid/ciaa1 857.
- Lee P, Fike D, Yang H et al. Do the types and routes of proton pump inhibitor treatments affect clostridium difficile in ICU patients? A retrospective cohort study.Expert Rev Clin Pharmacol 2021; 14(3): 399–404. doi: 10.1080/ 17512433.2021.1890582.
- Obrová K, Grumaz S, Remely M et al. Presence of viremia during febrile neutropenic episodes in patients undergoing chemotherapy for malignant neoplasms. Am J Hematol 2021; 96(6): 719–726. doi:10.1002/ ajh.26177.
- Kitagawa K, Okada H, Miyazaki S et al. Cytomegalovirus reactivation in esophageal cancer patients receiving chemoradiotherapy: a retrospective analysis. Cancer Med 2021; 10(21): 7525–7533. doi: 10.1002/ cam4. 4269.
- Stroh GR, Peikert T, Escalante P. Active and latent tuberculosis infections in patients treated with immune checkpoint inhibitors in a non-endemic tuberculosis area. Cancer Immunol Immunother 2021; 70(11): 3105–3111. doi: 10.1007/ s00262-021-02905-8.
- Kohoutová D. Malabsorpce žlučových kyselin. In: Zavoral M, Bureš J, Ryska M et al. (eds). Mařatkova gastroenterologie. Praha: Karolinum 2021.
- Kohoutova D, Gee C, Fleuret C et al. Bile acid malabsorption as a consequence of cancer treatment: prevalence and management in the national leading centre. UEG J 2021; 9(8): 207
- Gee C, Fleuret C, Wilson A et al. Bile acid malabsorption as a consequence of cancer treatment: prevalence and management in the national leading centre. Cancers 2021; 13(24): 6213. doi: 10.3390/ cancers13246 213.
- Walters JR, Tasleem AM, Omer OS et al. A new mechanism for bile acid diarrhea: defective feedback inhibition of bile acid bio synthesis. Clin Gastroenterol Hepatol 2009; 7(11): 1189–1194. doi: 10.1016/ j.cgh.2009.04.024.
- Barkun AN, Love J, Gould M et al. Bile acid malabsorption in chronic diarrhea: pathophysiology and treatment. Can J Gastroenterol 2013; 27(11): 653–659. doi: 10.1155/ 2013/ 485631.
- Camilleri M. Bile acid diarrhea: prevalence, pathogenesis, and therapy. Gut Liver 2015; 9(3): 332–339. doi: 10.5009/ gnl14397.
- Fani B, Bertani L, Paglianiti I et al. Pros and cons of the SeHCAT test in bile acid diarrhea: a more appropriate use of an old nuclear medicine technique. Gastroenterol Res Pract 2018; 2018 : 2097359. doi: 10.1155/ 2018/ 2097359.
- Vijayvargiya P, Camilleri M. Update on bile acid malabsorption: fi nally ready for prime time? Curr Gastroenterol Rep 2018; 20(3): 10. doi: 10.1007/ s11894-018 - 0615-z.
- Lenicek M, Juklova M, Zelenka J et al. Improved HPLC analysis of serum 7alpha-hydroxycholest-4-en - 3-one, a marker of bile acid malabsorption. Clin Chem 2008; 54(6): 1087–1088. doi: 10.1373/ clinchem.2007.100 107.
- Lyutakov I, Ursini F, Penchev P et al. Methods for dia gnosing bile acid malabsorption: a systematic review. BMC Gastroenterol 2019; 19(1): 185. doi: 10.1186/ s12876-019-1102-1.
- Battat R, Duijvestein M, Vande Casteele N et al. Serum concentrations of 7-hydroxy-4-cholesten-3-one are associated with bile acid diarrhea in patients with Crohn’s disease. Clin Gastroenterol Hepatol 2019; 17(13): 2722–2730.e4. doi: 10.1016/ j.cgh.2018.11.012.
- Hofmann AF, Poley JR. Cholestyramine treatment of diarrhea associated with ileal resection. N Engl J Med 1969; 281(8): 397–402. doi: 10.1056/ NEJM1969082128 10801.
- Bays H, Dujovne C. Colesevelam HCl: a non-systemic lipid-altering drug. Expert Opin Pharmacother 2003; 4(5): 779–790. doi: 10.1517/ 14656566.4.5.779.
- Gupta A, Muls AC, Lalji A et al. Outcomes from treating bile acid malabsorption using a multidisciplinary approach. Support Care Cancer 2015; 23(10): 2881–2890. doi: 10.1007/ s00520-015-2653-5.
- Watson L, Lalji A, Bodla S et al. Management of bile acid malabsorption using low-fat dietary interventions: a useful strategy applicable to some patients with diarrhoea - predominant irritable bowel syndrome? Clin Med (London) 2015; 15(6): 536–540. doi: 10.7861/ clinmedicine. 15-6-536.
- Jackson A, Lalji A, Kabir M et al. The effi cacy of a lowfat diet to manage the symptoms of bile acid malabsorption – outcomes in patients previously treated for cancer. Clin Med (London) 2017; 17(5): 412–418. doi: 10.7861/ clinmedicine.17-5-412.
- Bures J, Cyrany J, Kohoutova D et al. Small intestinal bacterial overgrowth syndrome. World J Gastroenterol 2010; 16(24): 2978–2990. doi: 10.3748/ wjg.v16.i24.2978.
- Bushyhead D, Quigley EM. Small intestinal bacterial overgrowth. Gastroenterol Clin North Am 2021; 50(2): 463–474. doi: 10.1016/ j.gtc.2021.02.008.
- Quigley EMM, Murray JA, Pimentel M. AGA clinical practice update on small intestinal bacterial overgrowth: expert review. Gastroenterology 2020; 159(4): 1526–1532. doi: 10.1053/ j.gastro.2020.06.090.
- Ghoshal U, Ghoshal UC, Ranjan P et al. Spectrum and antibio tic sensitivity of bacteria contaminating the upper gut in patients with malabsorption syndrome from the tropics. BMC Gastroenterol 2003; 3 : 9. doi: 10.1186/ 1471-230X-3-9.
- British Society of Gastroenterology. Association of Gastrointestinal Physiologists (AGIP) standardised testing protocol for hydrogen/ methane breath testing to assess small intestinal bacterial overgrowth and carbohydrate malabsorption. [online]. Dostupné z: https:/ / www. bsg.org.uk/ wp-content/ uploads/ 2019/ AGIP-Best-Practice - Statement-for-HMBT.pdf.
- Shah SC, Day LW, Somsouk M et al. Meta-analysis: antibio tic therapy for small intestinal bacterial overgrowth. Aliment Pharmacol Ther 2013; 38(8): 925–934. doi: 10.1111/ apt.12479.
- Gatta L, Scarpignato C. Systematic review with metaanalysis: rifaximin is eff ective and safe for the treatment of small intestine bacterial overgrowth. Aliment Pharmacol Ther 2017; 45(5): 604–616. doi: 10.1111/ apt.13928.
- Ghoshal UC. Antibio tic treatment for small intestinal bacterial overgrowth: is a cocktail better than a single? United European Gastroenterol J 2021; 9(6): 643–644. doi: 10.1002/ ueg2.12075.
- Bureš J. Syndrom bakteriálního přerůstání v tenkém střevě. In: Zavoral M, Bureš J, Ryska M et al. (eds). Mařatkova gastroenterologie. Praha: Karolinum 2021.
- Bouchoucha M, Fysekidis M, Lekhal C et al. COLIGENTA treatment of small intestinal bacterial overgrowth. Results of an open study. Dig Liver Dis 2021; 53(1): 66–71. doi: 10.1016/j.dld.2020.10.032.
Štítky
Dětská onkologie Chirurgie všeobecná Onkologie
Článek SpolupachateléČlánek Aktuality z odborného tisku
Článek vyšel v časopiseKlinická onkologie
Nejčtenější tento týden
2022 Číslo 5- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Nejasný stín na plicích – kazuistika
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
-
Všechny články tohoto čísla
- Spolupachatelé
- Gastrointestinální toxicita systémové onkologické imunoterapie
- Přínos empatie lékaře pro jeho pacienty a výsledky začlenění rozvíjení schopnosti empatie do kurikul lékařských fakult
- Informace z České onkologické společnosti
- Expresia ligandu 1 programovanej smrti v nemalobunkovom karcinóme pľúc – mechanizmus regulácie, asociácia s ostatnými markermi a terapeutické využitie
- Zevní akcelerované ozáření lůžka časného karcinomu prsu s využitím stereotaktických technik – metodologie, technické aspekty a předběžné výsledky prospektivní randomizované studie
- Cvičení jako nástroj pro zlepšení kvality života pacientek po léčbě karcinomu prsu
- Bifenotypový sinonazálny sarkóm – opis prípadu
- Onkologické rány – doporučení péče vycházející z multioborové spolupráce
- Aktuality z odborného tisku
- Klinická onkologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Gastrointestinální toxicita systémové onkologické imunoterapie
- Onkologické rány – doporučení péče vycházející z multioborové spolupráce
- Přínos empatie lékaře pro jeho pacienty a výsledky začlenění rozvíjení schopnosti empatie do kurikul lékařských fakult
- Bifenotypový sinonazálny sarkóm – opis prípadu
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



