-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Zevní akcelerované ozáření lůžka časného karcinomu prsu s využitím stereotaktických technik – metodologie, technické aspekty a předběžné výsledky prospektivní randomizované studie
Adjuvant accelerated partial-breast irradiation of early-stage breast cancer using stereotactic approach – methodology, technical challenges and early results of prospective randomized trial
Background: The adjuvant radiotherapy (RT) of the early-stage breast cancer patients as local treatment aims to eliminate potential microscopic residual disease in the surgery bed or satellites in its neighborhood. Based on published studies, accelerated partial breast irradiation (APBI) is recommended for strictly selected patients. The aim of this single-institution prospective randomized study was to compare the targeted APBI delivered by stereotactic approach with the currently more commonly used accelerated whole breast irradiation with the boost to the tumor bed in terms of feasibility, safety, tolerance, and cosmetic effects. Materials and methods: Early-stage breast cancer patients after partial mastectomy were screened for eligibility. The inclusion criteria were age > 50 years, non-lobular carcinoma histology, size ≤ 2 cm, negative margins ≥ 2 mm, L0, ER-positive, BRCA negative. Enrolled patients were equally randomized into two arms according to radiotherapeutic regiment – external APBI (5× 6 Gy) and accelerated whole breast irradiation with the boost (15× 2,67 Gy + 5× 2 Gy). These preliminary results of the ongoing study evaluated the first 57 from 84 planned patients. Results: The median age was 65 years. The tumors were of grade 1 in 60 % of patients, the median size of 9 mm and 70 % were classified as invasive ductal carcinoma. Statistical significant differences between the groups in baseline characteristics were not observed. A total of 29 patients was enrolled in the APBI group by the end of 2020. All enrolled patients were evaluated one month after RT. A total of 40 (70,2 %) a 33 (58 %) had examinations 3 and 6 months after RT, respectively. Toxicity evaluation showed statistically significantly fewer acute adverse events in the APBI group in terms of skin erythema, desquamation, skin tenderness, dryness, edema, pigmentation, breast pain and fatigue. Late toxicity evaluated in 3 and 6 months after RT was significantly higher in the control group. The cosmetic effect (independently evaluated by a physician, nurse and patient) was more favorable to the APBI group. Conclusion: The technique using the principles of targeted radiotherapy turned out to be a less toxic and easier feasible approach for adjuvant radiation of early-stage breast cancer patients. Consequently, the presented study increases the level of evidence for RT-indicated patients to the establishment of external APBI into daily clinical practice.
Keywords:
breast cancer – stereotactic body radiotherapy – early stages – adjuvant radiotherapy – surgical bed – APBI
Autoři: P. Burkoň 1; I. Selingerová 2; M. Slavik 1; M. Holánek 3; M. Vrzal 1; T. Kazda 1,2; V. Hůlková 1; M. Blažková 1; K. Poláchová 1; P. Šlampa 1
Působiště autorů: Klinika radiační onkologie LF MU a MOÚ Brno 1; Výzkumné centrum aplikované molekulární onkologie (RECAMO), MOÚ Brno 2; Klinika komplexní onkologické péče LF MU a MOÚ Brno 3
Vyšlo v časopise: Klin Onkol 2022; 35(5): 379-391
Kategorie: Původní práce
doi: https://doi.org/10.48095/ccko2022379Souhrn
Východiska: Adjuvantní radioterapie (RT) pacientek s časným karcinomem prsu má jako lokální léčba za cíl eliminovat potenciální mikroskopické reziduální onemocnění v operačním poli nebo v jeho blízkém sousedství. Na základě publikovaných studií lze vybraným pacientkám doporučit v této indikaci akcelerované ozáření lůžka tumoru (accelerated partial-breast irradiation – APBI). Cílem této monocentrické prospektivní randomizované studie je porovnat cílenou APBI aplikovanou stereotaktickou technikou s nejčastěji používaným akcelerovaným ozářením celého prsu z hlediska proveditelnosti, bezpečnosti, tolerance a kosmetických efektů. Materiál a metody: Do studie byly zařazeny pacientky s časným karcinomem prsu po parciální mastektomii splňující tato kritéria: věk > 50 let, non-lobulární typ karcinomu, velikost ≤ 2 cm, negativní okraje ≥ 2 mm, L0, ER pozitivní, BRCA negativní. Zařazené pacientky byly randomizovány do dvou ramen podle režimu RT – zevní APBI (5× 6 Gy) nebo akcelerované ozáření celého prsu s boostem na oblast lůžka nádoru (15× 2,67 Gy + 5× 2 Gy). V této práci předkládáme výsledky po prvních 2 letech náboru (zařazeno 57 z 84 plánovaných pacientek). Výsledky: Medián věku pacientek byl 65 let. Karcinom grade 1 byl prokázán u 60 % pacientek, medián velikosti postižení v prsu byl 9 mm a nejčastějším histologickým typem (70 %) byl invazivní karcinom nespecifického typu (NST). Ve všech základních parametrech nebyly mezi skupinami shledány žádné statisticky významné rozdíly. Do APBI skupiny bylo do konce roku 2020 zařazeno celkem 29 pacientek. Jeden měsíc po RT byly zhodnoceny sledované parametry u všech pacientek, ve 3 a 6 měsících po ozáření byly zhodnoceny u 40 (70,2 %) a 33 (58 %) pacientek. Hodnocení toxicity ukázalo statisticky významně méně akutních nežádoucích účinků v APBI skupině ve smyslu kožního erytému, deskvamace, citlivosti kůže, suchosti, otoku, pigmentace, bolesti prsou a únavy. Pozdní toxicita hodnocená za 3 a 6 měsíců po RT byla významně vyšší v kontrolním rameni. Kosmetický efekt (nezávisle hodnocený lékařem, sestrou a pacientem) byl rovněž příznivější pro skupinu s APBI. Závěr: Technika APBI využívající principů cíleného stereotaktického ozáření se ukázala být méně toxickou a snadněji proveditelnou možností pro adjuvantní radioterapii pacientek s časným stadiem karcinomu prsu ve srovnání s ozářením celého prsu s následným boostem. V důsledku toho předložená studie zvyšuje úroveň důkazů pro zavedení tohoto přístupu do každodenní klinické praxe u pacientek splňujících indikační kritéria k APBI.
Klíčová slova:
adjuvantní radioterapie – karcinom prsu – časná stadia – cílená radioterapie – lůžko nádoru – APBI
Úvod
Jedním z nejvýznamnějších úspěchů preventivních onkologických programů v celosvětovém měřítku je významný nárůst incidence raného stadia karcinomu prsu na úkor lokálně pokročilého nebo diseminovaného onemocnění, čehož bylo dosaženo zejména díky zavedení screeningové mamografie. Vezmeme-li v úvahu i zvyšující se výskyt nádorových onemocnění obecně, zejména ve vyspělých zemích, dochází neustále ke zvyšování poptávky po léčbě těchto pacientek a tím vyšším nárokům na zdravotnický systém, onkologická centra a oddělení radiační onkologie.
Současným standardem léčby většiny pacientek s časným karcinomem je prs zachovávající výkon (breast conserving therapy – BCT) sestávající z parciální mastektomie a následného ozáření celého prsu (whole breast irradiation – WBI). Některé pacientky však z důvodu nutnosti absolvovat dlouhotrvající pooperační ozáření preferují provedení totální mastektomie bez nutnosti následné adjuvantní radioterapie, která standardně sestává z ozáření celého prsu v 3–5 týdnech s možností dalšího doplnění dávky do nádorového lůžka během následujících 1–2 týdnů (boost). Celkově tedy pacientky podstoupí 4–7 týdnů každodenního ozařování. Na základě výsledků randomizovaných studií je u pacientek s velmi příznivými charakteristikami tumoru možné ozářit pouze chirurgické lůžko s lemem, přičemž lokální kontrola (local control – LC) a celkové přežití (overall survival – OS) zůstanou na stejné úrovni jako při využití WBI [1–7]. Na základě těchto výsledků odborné společnosti American and European Society of Radiation Oncology (ASTRO) a European Society for Radiotherapy and Oncology (ESTRO) doporučují pacientkám s časným karcinomem prsu částečné ozáření (partial breast irradiation – PBI) namísto WBI [8–10]. Jednou z hlavních výhod PBI je zkrácení léčby na několik dní s využitím akcelerovaného režimu (accelerated partial breast irradiation – APBI). V dnešní době se optimalizace techniky APBI stává jednou z priorit současné radiační onkologie.
Pro PBI existuje několik technických možností – intersticiální nebo intrakavitární brachyterapie, intraoperační ozáření nebo zevní radioterapie. Brachyterapie je invazivní metodou a jako takovou ji pacientky často neakceptují [11]. Klinické studie prokázaly proveditelnost zevní APBI jak v adjuvantní indikaci po parciální mastektomii (30 Gy v pěti frakcích do lůžka nádoru), tak i v neoadjuvanci před plánovanou operací [12–15]. Klasická 3D konformní radioterapie (3D-CRT) však byla ve studiích spojena s vyšším rizikem kožních reakcí a horšími kosmetickými výsledky. Tento fakt byl dán zejména nutností zvětšit bezpečnostní lem ke kompenzaci nepřesností při ozáření včetně pohybů prsu při dýchání [16–18]. Řešením je využití všech dostupných technických novinek běžně používaných při cílené stereotaktické radioterapii také v této indikaci – obrazem řízená radioterapie cílená na klipy v lůžku tumoru využívající CT přístroje na platformě lineárního urychlovače (image guided radiotherapy – IGRT), zastavení pohybů prsu při dýchání a ozáření v hlubokém nádechu (deep inspiration breath hold – DIBH), rychlá a přesná aplikace dávky při tzv. ozáření kyvem (volumetric modulated arc therapy – VMAT), využití svazku bez homogenizačního filtru o vysokém dávkovém příkonu (flattening filter freen – FFF) či korekci polohy pacientky na ozařovacím stole se 6 stupni volnosti [19–24].
Cílem této prospektivní randomizované monocentrické studie bylo prokázat non-inferioritu APBI (celkem 5 frakcí) aplikované pomocí techniky cílené radioterapie u pacientek s časným stadiem karcinomu prsu oproti častěji používanému režimu akcelerovaného ozáření celého prsu s boostem (celkem 20 frakcí) [25]. Hlavním cílem bylo zhodnotit proveditelnost, bezpečnost, toleranci a kosmetické účinky APBI v pěti frakcích a zvýšit tak úroveň důkazů pro zavedení této metody u indikovaných pacientek do každodenní klinické praxe. V této práci uvádíme předběžné výsledky, metodologii a technické souvislosti. Studie byla schválena Etickou komisí Masarykova onkologického ústavu (schválení č. 2017/1889/MOU). Všechny pacientky podepsaly informovaný souhlas.
Materiál a metody
Pacientky
Účast v této klinické studii byla nabídnuta všem pacientkám s časným stadiem karcinomu prsu, které byly indikovány k provedení adjuvantní radioterapie na Klinice radiační onkologie Masarykova onkologického ústavu (MOU) a splňovaly vstupní kritéria studie, která jsou podrobně shrnuta v tab. 1. Po podpisu informovaného souhlasu s účastí v klinické studii byly zařazené pacientky randomizovány do dvou ramen podle režimu radioterapie (RT) – ozáření lůžka tumoru stereotaktickým přístupem (APBI, 5× 6 Gy, každý pracovní den) nebo klasické akcelerované ozáření celého prsu s boostem do lůžka tumoru (WBI, 15× 2,67 Gy + 5× 2 Gy, každý pracovní den). Jako optimální stratifikační faktory byly vybrány: 1) velikost operačního lůžka měřená nejdelší vzdáleností chirurgických klipů umístěných pro potřebu zacílení radioterapie (dichotomické dělení s cut off hodnotou ≥ 3 cm) a 2) dichotomické rozdělení na fototyp světlý (fototyp I – nápadně světlá pleť, rezavé vlasy, hodně pih, modré oči + fototyp II – světlá pleť i vlasy, jemné pihy, modré, zelené nebo šedé oči) a fototyp tmavý (fototyp III – světle hnědá pleť, vlasy tmavě blond nebo hnědé, hnědé oči + fototyp VI – tmavá pleť, velmi tmavé vlasy i oči). Jak velikost lůžka tumoru, tak fototyp mohou ovlivnit primární cíle studie, tj. vyhodnocení toxicity a kosmetických efektů léčby.
Tab. 1. Kritéria pro zařazení do výzkumného projektu. 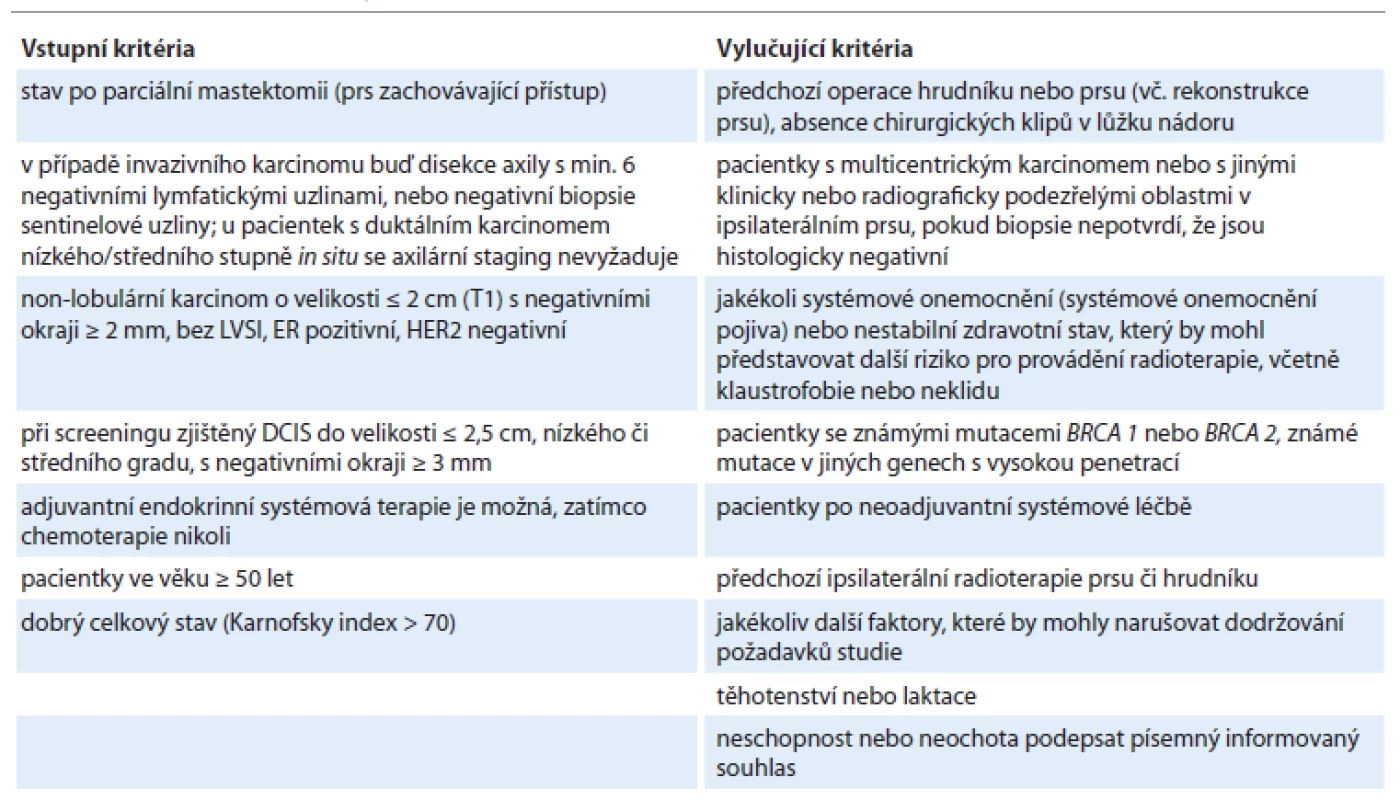
ER – estrogenový receptor, DCIS – duktální karcinom in situ, HER2 – receptor 2 pro lidský epidermální růstový faktor (HER2/neu), LVSI – lymfovaskulární invaze Plánování a aplikace radioterapie
Bezpečná aplikace vysokých dávek záření byla zajištěna přesnou a reprodukovatelnou imobilizací pacientek, plánováním léčby na bázi čtyřdimenzionální výpočetní tomografie (4D-CT) s využitím techniky DIBH, navigací na titanové klipy v chirurgickém lůžku během každé frakce pomocí výpočetní tomografie s konickým svazkem (cone beam computed tomography – CBCT) integrované do lineárního urychlovače a fyzikálních metod zajištění kvality léčby [26–31].
CT skeny o tloušťce 2 mm vč. dechové křivky byly z CT přístroje odeslány do plánovacího systému (Eclipse™) k přípravě ozařovacího plánu. Při ozáření celého prsu byl klinický cílový objem (clinical target volume – CTV) definován reziduálním parenchymem žlázy. Plánovací cílový objem (planning target volume – PTV) byl vytvořen automatickou expanzí CTV o 10 mm všemi směry. V případě ozáření lůžka tumoru zahrnoval CTV vlastní dutinu excize s okrajem 10 mm. K přesné definici operační dutiny byly použity titanové klipy umístěné do jejích okrajů, popř. byla poloha klipů korelována s předoperační obrazovou dokumentací. Při konturaci byl objem CTV redukován od povrchu kůže o 5 mm, hrudní stěna i prsní svaly do tohoto objemu zahrnuty nebyly. PTV byl při APBI vytvořen automatickou expanzí CTV o 3 mm ve všech směrech. PTV byl od povrchu těla rovněž redukován o 5 mm. Do tohoto finálního PTV byla naplánována předepsaná dávka záření.
Kontrolní skupina pacientek (rameno WBI) byla ozařována standardním akcelerovaným režimem trvajícím 20 pracovních dní. Celý prs byl ozářen dávkou 40,05 Gy v 15 frakcích, následovalo doplnění dávky do lůžka tumoru (boost) dávkou 10 Gy v 5 frakcích. Studijní skupina (rameno APBI) byla ozářena dávkou 30 Gy v 5 frakcích během 5 pracovních dní (obr. 1) [32]. Plány léčby byly vytvořeny pomocí plánovacího systému Eclipse v15.6 (Varian Medical Systems, Palo Alto CA). Dávková distribuce byla vypočtena algoritmem AAA v15.6 s výpočetní mřížkou 2,5 mm. Ozařovací plány byly dodány prostřednictvím lineárního urychlovače Varian TrueBeam STX v2.5 (Varian Medical Systems, Palo Alto CA). Byla použita technika VMAT (2–3 částečné kyvy) a svazek 6 MV bez homogenizačního filtru s vysokým dávkovým příkonem (FFF) [33–35]. Denní korekce polohy pacienta přímo na ozařovacím stole pomocí CBCT zajistila přesné zacílení svazků do cílového objemu [36]. Adekvátního pokrytí předepsanou dávkou bylo dosaženo v případě, kdy 95 % objemu PTV bylo pokryto předepsanou dávkou. Dávka v okolních rizikových tkáních byla vyhodnocena pomocí dávkově objemových histogramů [37]. Dávkové limity jednotlivých rizikových orgánů jsou uvedeny v tab. 2.
Obr. 1. Ilustrativní příklad dávkové distribuce v případě akcelerovaného ozáření lůžka tumoru. 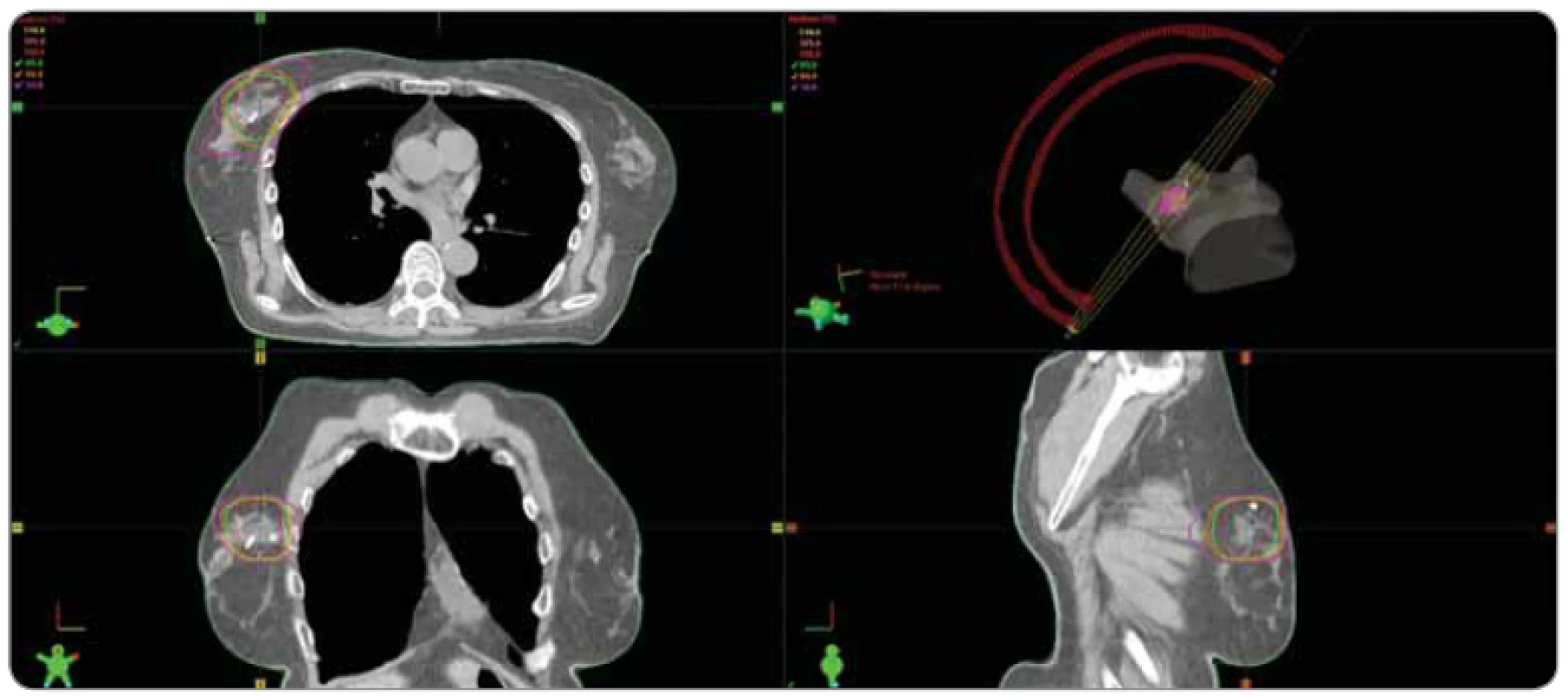
Tab. 2. Dávkové limity pro pacientky ve skupinách APBI a WBI. 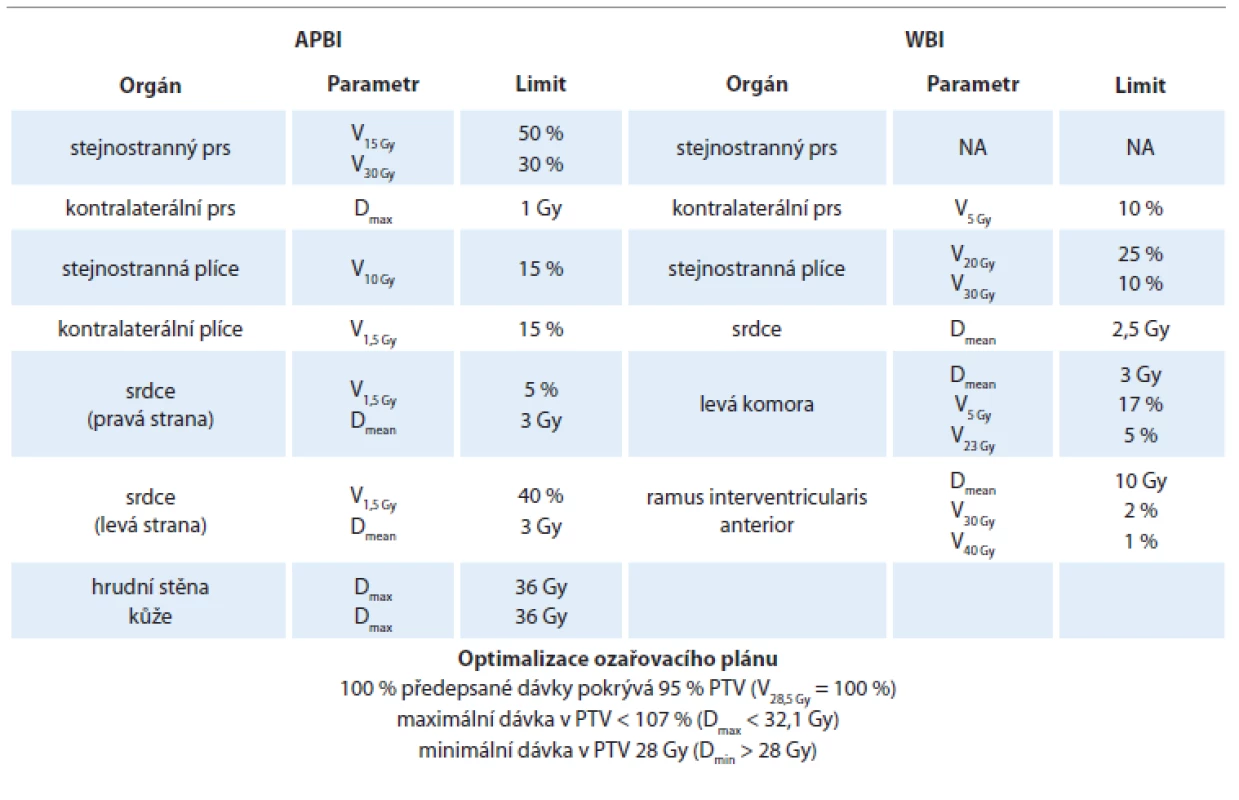
APBI – akcelerované ozáření lůžka tumoru, Dmean – medián dávky, Dmax – maximální dávka, Dmin – minimální dávka; Gy – Gray; NA – nestanoveno, PTV – plánovací cílový objem, Vx < y % – objem daného orgánu ozářený dávkou X Gy je menší než y %, WBI – ozáření celého prsu Sledování pacientek
Kontrolní návštěvy v prvním roce sledování byly předepsány po 3 měsících, v dalším roce po 4 a dále po 6 měsících. Po 5 letech pak byly prováděny 1× ročně. Po podepsání informovaného souhlasu byly provedeny základní laboratorní krevní testy (krevní obraz a základní biochemie). K hodnocení vedlejších účinků byla použita kritéria CTCAE v. 5.0 (Common Toxicity Criteria for Adverse Events National Cancer Institute). Akutní toxicita byla definována jako vedlejší účinky, ke kterým dochází do 90 dnů po ukončení ozařování. Vedlejší účinky zaznamenány po uplynutí 90 dní od ukončení radioterapie byly charakterizovány jako chronická toxicita. Kvalita života byla hodnocena oficiálním českým překladem EORTC QoL dotazníků (EORTC QLQ-C30) vč. speciálního modulu pro pacientky s karcinomem prsu (Breast QLQ-BR23) [38,39].
Kromě standardního klinického vyšetření a vyhodnocení akutních a pozdních nežádoucích účinků vyplňovali samostatně při každé návštěvě pacientka, lékař i sestra dotazník zaměřený na hodnocení vlivu ozáření na kosmetický efekt. Stupeň 1, kdy je kosmetický efekt léčby vynikající (léčený prs je po léčbě téměř stejný jako neléčený); stupeň 2, kdy je efekt velmi dobrý (změny na prsu jsou sice minimální, ale zjistitelné); stupeň 3, kdy je efekt uspokojivý (změny jsou snadno pozorovatelné) a stupeň 4, kdy je kosmetický efekt po léčbě špatný (účinkem léčby došlo k těžkým změnám) [40]. Před zařazením každé pacientky byla provedena fotografie hrudníku. Stejný snímek byl pořízen při každé follow-up kontrole k vyhodnocení vlivu záření na prsní tkáň, kůži a podkoží. Data hodnocení fotografií, ekonomické zátěže a kvality života nejsou zahrnuta v této publikaci a budou publikována po zařazení všech pacientek a po delším sledování.
Statistické metody
Studie byla designovaná jako randomizovaná monocentrická studie s paralelním uspořádáním. Primárním cílem bylo srovnání toxicity mezi oběma rameny. Při hladině významnosti 5 %, síle testu 90 %, hranici noninferiority 10 % a očekávanému rozdílu mezi pacienty po WBI a APBI 10 % bylo naplánováno zařazení 84 pacientek (42 v každém rameni). Pacientky byly randomizovány v poměru 1 : 1 za použití blokové randomizace (velikost bloku 4) a dvou stratifikačních faktorů.
Pro popis základních charakteristik pacientek byly použity běžné parametry popisné statistiky, tj. medián a rozpětí pro spojité proměnné a počty a procenta pro kategoriální proměnné. Rozdíly mezi rameny byly testovány pomocí Mannova-Whitneyho testu, Fisherova exaktního testu či chí-kvadrát testu dle charakteru dat. Pro všechny statistické testy byla uvažována hladina významnosti 5 % a použit statistický software R, verze 4.1.2.
Výsledky
Soubor pacientek
Do projektu bylo od září 2019 do prosince 2020 zařazeno 57 z 84 celkově plánovaných pacientek. Medián věku byl 65 let (rozmezí 51–78 let). Světlý typ kůže (fototyp I+II) mělo 27 (47 %) a tmavý (fototyp III+IV) 30 pacientek (53 %). Levostranný karcinom byl diagnostikován u 26 (46 %) pacientek. Podle TNM klasifikace bylo 7 % karcinomů velikosti pT1a, 53 % pT1b, 35 % pT1c a ve třech případech (3,5 %) se jednalo o drobný karcinom in situ. Medián velikosti ložisek byl 9 mm, medián velikosti negativního okraje byl 5 mm. 70 % invazivních karcinomů bylo histologicky klasifikováno jako invazivní karcinom nespecifického typu (NST), dříve označovaný jako duktální, k méně častějším typům patřily mucinózní, tubulární a solidně trabekulární karcinomy. U 60 % nádorů se jednalo o dobře diferencované nádory (grade 1), ostatní byly gradu 2. U všech pacientek byla provedena v rámci operačního výkonu biopsie sentinelové lymfatické uzliny. Nejčastěji byla vyšetřena jedna sentinelová uzlina (32 pacientek, 56 %), v dalších případech byly vyšetřeny dvě (13 pacientek, 23 %), tři (7 pacientek, 12 %) a čtyři uzliny (4 pacientky, 7 %). Ve většině případů se jednalo o luminální karcinomy s vysokou expresí steroidních receptorů a nízkou proliferací (medián množství estrogenních receptorů 100 %, progesteronových receptorů 72 %, medián hodnoty proliferační aktivity 14 %). Charakteristiky pacientek se mezi oběma sledovanými rameny statisticky významně nelišily (tab. 3).
Tab. 3. Základní charakteristiky souboru pacientek. 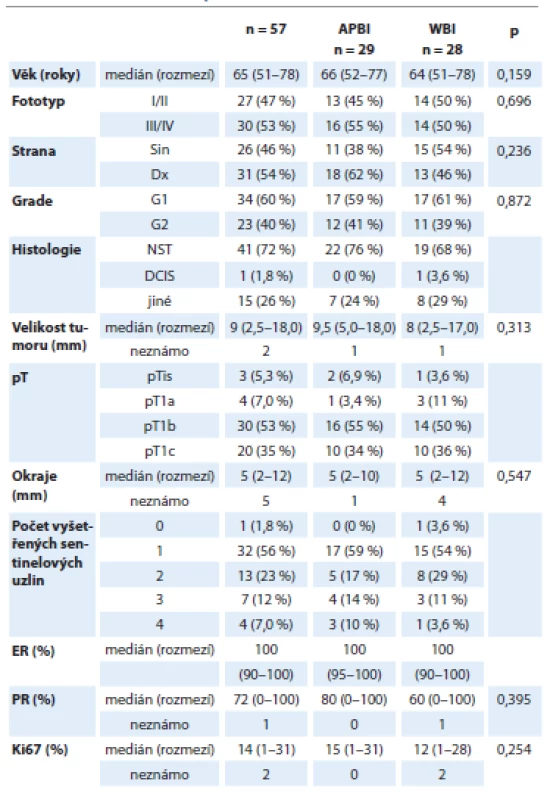
APBI – akcelerované ozáření lůžka tumoru, ER – estrogenový receptor, PR – progesteronový receptor, WBI – ozáření celého prsu Charakteristiky radioterapie
Předepsané dávky i doba aplikace radioterapie byly dodrženy jak pro pacientky ozařované pomocí WBI, tak pomocí APBI. Medián velikosti CTV pro APBI byl 57,8 cm3 (rozmezí 25,7–101 cm3). Tomu odpovídala velikost PTV, jejíž medián byl 83,4 cm3 (rozmezí 41,3–139,8 cm3). Do tohoto objemu byla předepsána dávka záření.
Toxicita
Všechny zařazené pacientky absolvovaly kontrolu a měly vyhodnocenou toxicitu léčby 1 měsíc po ukončení ozáření. Jednotlivé sledované parametry byly hodnoceny ošetřujícím lékařem. Kontrolu po 3 měsících mělo prozatím 40 pacientek (70 %), po 6 měsících 33 pacientek (58 %).
Časový průběh různých vedlejších účinků ozáření a jejich stupně podle typu radioterapie je zobrazen na obr. 2. Akutní vedlejší účinky se vyskytly statisticky významně častěji ve skupině WBI než ve skupině APBI. Při ukončení léčby byl v APBI skupině méně často oproti WBI skupině zaznamenán erytém 45 vs. 100 % (p < 0,001), deskvamace 0 vs. 36 % (p < 0,001), citlivost kůže 0 vs. 68 % (p < 0,001), edém kůže 10 vs. 43 % (p = 0,005), únava 10 vs. 54 % (p < 0,001), suchost kůže 0 vs. 43 % (p < 0,001), pigmentace 3,4 vs. 43 % (p < 0,001) a bolest prsu 0 vs. 39 % (p < 0,001). Po prvním měsíci sledování byla situace obdobná: erytém 8 vs. 62 % (p < 0,001), deskvamace 0 vs. 33 % (p = 0,002), citlivost kůže 4 vs. 46 % (p < 0,001), edém kůže 0 vs. 25 % (p = 0,010), suchost kůže 0 vs. 54 % (p < 0,001), pigmentace 8 vs. 79 % (p < 0,001) a bolest prsu 8 vs. 46 % (p < 0,001).
Obr. 2. Časový průběh toxicity radioterapie. 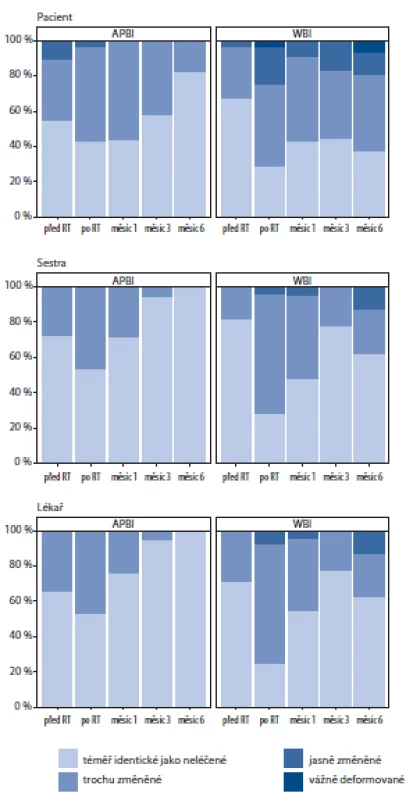
Ve 3 měsících po léčbě byla pozdní toxicita v kontrolní skupině opět sig - nifikantně horší: erytém 0 vs. 25 % (p = 0,047), citlivost kůže 5 vs. 40 % (p = 0,020), suchost kůže 5 vs. 40 % (p = 0,020), únava 0 vs. 30 % (p = 0,020), pigmentace 5 % vs. 60 % (p < 0,001) a bolest prsu 5 vs. 50 % (p < 0,001). Situace v jednotlivých parametrech byla půl roku po ozáření následující: citlivost kůže 0 vs. 50 % (p < 0,001), edém kůže 0 vs. 44 % (p = 0,003), suchost kůže 0 vs. 25 % (p = 0,044), pigmentace 0 vs. 62 % (p < 0,001), bolest prsu 0 vs. 38 % (p = 0,007).
Vyhodnocení kosmetického efektu
Kosmetický efekt (nezávisle hodnocený lékařem, sestrou a pacientem) byl rovněž příznivější ve skupině zevního APBI. Hodnocení probíhalo vyplněním dotazníku při každé kontrole pacientky. Časový průběh hodnocení je znázorněn na obr. 3. Zejména při ukončení radioterapie bylo hodnocení kosmetického efektu závažnější ve skupině WBI (pacientka p = 0,066, sestra p = 0,048, lékař p = 0,019). Při dalších kontrolách už rozdíl mezi skupinami nedosahoval statistické významnosti.
Diskuze
Cílem předložené práce bylo zhodnocení proveditelnosti, bezpečnosti, tolerance a porovnání kosmetických účinků APBI oproti standardnímu režimu adjuvantní radioterapie s ozářením celého prsu. Režim APBI zavedený v naší studii byl velmi dobře tolerovaný, snadno proveditelný a bezpečný. Hodnocení toxicity lékařem ukázalo statisticky významně méně akutních nežádoucích účinků v APBI skupině ve smyslu kožního erytému, deskvamace, citlivosti kůže, suchosti, otoku, pigmentace, bolesti prsů a únavy (na konci RT a 1 měsíc po RT). Pozdní toxicita hodnocená za 3 a 6 měsíců po RT byla oproti kontrolnímu rameni rovněž významně nižší při využití APBI.
Adjuvantní radioterapie jako lokální léčba po provedení primárního operačního výkonu má za cíl eliminaci potenciální mikroskopické reziduální choroby v operačním lůžku a/nebo satelitech v okolí [41,42]. Recidivy karcinomů se nejčastěji vyskytují právě v místě původního postižení [43,44]. Níže diskutované randomizované studie prokázaly, že u pacientek s velmi příznivými charakteristikami tumoru lze ozářit pouze chirurgické lůžko s lemem (PBI), přičemž lokální kontrola onemocnění a celkové přežití pacientek jsou stejné jako v případě ozáření celého prsu (WBI). Na základě výsledků těchto studií odborné společnosti ASTRO a ESTRO doporučují pacientkám s časným karcinomem prsu částečné ozáření (PBI) namísto WBI [45–47].
Existuje řada technických možností, jak PBI (APBI) provést – intersticiální brachyterapie (BRT), zevní radioterapie (zevní APBI), intraoperační radioterapie (intraoperative radiotherapy – IORT) či nové přístupy využívající magnetickou rezonancí řízenou radioterapii (MR-guided radiotherapy – MRgRT) [48–50]. Volba techniky často závisí na tom, jakou z nich má dané pracoviště k dispozici (jde nejen o přístrojové vybavení, ale také o erudici personálu). Nejvíce literárních dat s dlouhodobým sledováním pacientek lze v literatuře najít pro brachyterapii [51–59]. Invazivita a nutnost celkové anestezie může být pro některé pacientky v indikaci této metody omezující. V posledních letech se tedy objevuje stále více prací využívajících k APBI zevního ozáření. Kosmetický efekt v námi prezentované studii byl podobný výsledkům těchto publikací.
V prospektivní studii Rodríguez et al randomizovali 102 pacientek do skupiny WBI (48 Gy / 24 frakcí ± 10 Gy boost) nebo APBI (37,5 Gy / 10 frakcí, 2× denně) [60]. Po 5 letech sledování nedošlo k žádné recidivě ani žádným rozdílům v OS. Ve skupině APBI bylo signifikantně méně akutních nežádoucích účinků léčby, pozdní toxicita byla v obou skupinách stejná. U většiny pacientek v obou skupinách bylo dosaženo výborného kosmetického efektu.
Významná multicentrická studie fáze III IMPORT LOW randomizovala 2 016 pacientek do ramene WBI (n = 674, 40 Gy/ 15 frakcí), WBI se sníženou dávkou (n = 673, 36 Gy/ 15 frakcí na celý prs a 40 Gy kolem lůžka nádoru) a PBI (n = 669, 40 Gy/ 15 frakcí) [61]. Po střední době sledování 72 měsíců nebyl mezi skupinami v LC a OS žádný rozdíl. Z kosmetického hlediska (sledován vzhled a pevnost prsou) dosáhla skupina PBI výrazně nižší míry nežádoucích účinků.
Livi et al ve své práci neprokázali žádný signifikantní rozdíl v LC ani OS mezi zevní APBI (30 Gy/ 5 frakcí) oproti WBI (50 Gy/ 25 frakcí + 10 Gy/ 5 frakcí boost) [62,63]. APBI vykazovala výrazně lepší profil toxicity. Autoři rovněž porovnali funkční stav a kvalitu života pacientek pomocí dotazníků QLQ-C30 a BR-23 [64]. Porovnání po ukončení léčby a po 2 letech vyšlo lépe pro pacientky ve skupině APBI. Po 10 letech sledování nebyl mezi oběma skupinami v počtu ipsilaterálních recidiv, regionální kontrole spádových uzlin ani OS žádný významný rozdíl [65].
V kanadské studii RAPID fáze III bylo na 2 135 pacientkách porovnáno WBI (n = 1 065, 50 Gy / 25 frakcí nebo 42,5 Gy / 16 frakcí) oproti APBI (n = 1 070, 38,5 Gy / 10 frakcí, 2× denně) [66,67]. Studie prokázala non-inferioritu APBI v počtu ipsilaterálních recidiv a akutní toxicitě, nicméně pozdní toxicita vyšla v neprospěch APBI. V této skupině byl rovněž prokázán horší kosmetický efekt po 3, 5 a 7 letech sledování. Autoři došli k závěru, že šestihodinový interval mezi frakcemi je pro reparaci příliš krátký.
Podobná italská prospektivní studie IRMA randomizovala 983 pacientek do ramene WBI (50 Gy / 25 frakcí ± 10 Gy boost) a do ramene APBI (38,5 Gy / 10 frakcí, 2× denně) [68]. I když byla použita podobná frakcionace jako ve studii RAPID, nebyl v kosmetickém efektu po 5leté době sledování mezi skupinami žádný významný rozdíl. Ani akutní ani pozdní toxicita nebyla mezi těmito skupinami rozdílná.
Studie NSABP B-39/RTOG 0413 rozdělila 4 216 pacientek na WBI (n = 2 109, 50 Gy / 25 frakcí + 10 Gy boost) a APBI (n = 2 107, 34–38,5 Gy / 10 frakcí, 2× denně buď BRT nebo zevní RT) [69–71]. Mezi skupinami nebyly zjištěny žádné rozdíly v OS, přežití bez příznaků nemoci (disease free survival – DFS), akutní ani pozdní toxicitě. Po 10 letech sledování nebylo v počtu ipsilaterálních recidiv dosaženo kritérií pro non-inferioritu APBI režimu, i když absolutní rozdíl mezi oběma skupinami byl < 1 % (4,8 % pro APBI vs. 4,1 % pro WBI).
Na základě výše uvedených studií lze předpokládat, že onkologové specializující se na nádory prsu přijmou APBI jako rozumnou alternativu k WBI u vhodně vybraných pacientek. V dlouhodobém horizontu se rovněž jeví pravděpodobné, že tyto pacientky budou preferovat krátkodobý, neinvazivní a minimálně toxický režim aplikovaný zevní radioterapií. Naše práce má potenciál pomoci zavést takovou metodu do klinické praxe.
Všechny základní APBI studie zahrnovaly pacientky s velmi nízkým rizikem (> 40–50 let; invazivní karcinomy ≤ 2,5–3 cm s volnými okraji; hormonálně dependentní karcinomy bez postižení spádových lymfatických uzlin). Ačkoli bylo v některých studiích možné zařazovat také pacientky s uzlinovým postižením (pN1mic nebo pN1), bylo takových pacientek právě s výjimkou studie NSABP B-39 celkově zastoupeno velmi málo. I to mohlo výsledky této práce ovlivnit.
Běžně přijímaná frakcionační schémata zahrnují 34 Gy v 10 frakcích pro BRT, 38 Gy v 10 frakcích pro zevní APBI, popř. 20–21 Gy v jedné frakci pro IORT [72,73]. Většina studií aplikovala 10 frakcí v 5 dnech, tj. 2× denně. Údaje týkající se preferencí pacientek jsou omezené, nicméně pacientky i lékaři považují ozařování 2× denně za značně těžkopádné a ne zcela optimální [74,75]. Dávkové schéma použité v naší studii (30 Gy v 5 frakcích) je pro adjuvantní ozáření vyhovující. Qi et al popsali poměr a/b (základní radiobiologický parametr) nádorů prsu jako relativně nízký (a/b = 2,88), a proto může být právě vysokodávkovaná radioterapie velmi přínosná stejně jako např. u karcinomu prostaty [76]. Při použití lineárního kvadratického modelu (LQ model) a za předpokladu poměru a/b tři je předepsané dávkování použité v naší APBI studii ekvivalentní 54 Gy podaným standardní frakcionací po 2 Gy denně. Pokud by byl poměr a/b roven 2,5, ekvivalentní dávka při standardní frakcionaci by pak byla 56,7 Gy.
V současné době je tedy tento projekt první, který srovnává proveditelnost a vedlejší účinky běžně používaného WBI aplikovaného akcelerovanými frakcionačními režimy oproti technice cíleného ozáření lůžka tumoru využívajícího všech moderních technologií cílené stereotaktické radioterapie. Onkologickou bezpečnost tohoto postupu již prokázaly výše uvedené studie, náš projekt chce poukázat na hlavní výhody této techniky ve smyslu toxicity a kvality života. V první řadě lze díky přesnějšímu ozáření zmenšit plánovací cílový objem a tím snížit toxicitu a vylepšit kosmetický efekt léčby. Podstatné zkrácení celkové doby léčby při APBI vede také ke zlepšení kvality života pacientek, umožňuje zvýšení průchodnosti zařízení poskytovatele onkologické péče a ve finále je spojeno i s finanční úsporou pro plátce. Režim ozáření jedenkrát denně se zdá být optimální.
Je nutné zmínit i limity této studie. Prvním je relativně malý počet pacientek, i když k základní statistické analýze dostatečný. Delší doba sledování bude nutná pro analýzu dalších sledovaných parametrů. Ve statistické analýze nebyl v LC, DFS či OS žádný rozdíl. Za dobu sledování pacientek nedošlo k žádné recidivě, regionální či vzdálené diseminaci popř. smrti některé z pacientek.
Na základě současných doporučení se zdá, že námi aplikovaný boost (doplňkové ozáření lůžka tumoru po ozáření celého prsu) není ve světle současných poznatků nutný a znamená jisté nadléčení [77]. V době zahájení studie byl takový postup součástí léčebných protokolů na našem pracovišti. Rovněž všechny studie popsané výše toto doplňkové ozáření v kontrolních ramenech používaly. Dnes bychom u starších pacientek s dostatečnými resekčními okraji tento postup indikovat nemuseli. Boost ozáření mohlo u některých pacientek zhoršit sledované parametry toxicity a zvýraznit tak rozdíly mezi oběma skupinami. Jelikož ale měla naše studie za cíl potvrdit non-inferioritu APBI oproti WBI, nejsou signifikantní rozdíly ve prospěch APBI ramene k jejímu vyhodnocení nutné.
Faktem také je, že řada pacientek s nízkým rizikem relapsu onemocnění, které byly léčeny ve studiích s APBI, mohla být vhodnými kandidátkami pro úplné vynechání adjuvantní radioterapie. Prozatím je však tento postup volen hlavně u pacientek v horším klinickém stavu či s komorbiditami, kdy není výrazný benefit z redukce rizika ipsilaterální recidivy onemocnění pomocí radioterapie předpokládán.
Závěr
Technika zevního APBI využívající principů cílené radioterapie se ukázala být méně toxickou a snadněji proveditelnou možností adjuvantního ozáření nízkorizikových karcinomů prsu po parciálním chirurgickém výkonu než dosud běžně používané akcelerované režimy ozáření celého prsu. Stejná technologie je používána při stereotaktickém ozařování, které aplikuje vysoké dávky ionizujícího záření do cílového objemu s vysokou přesností s maximálním šetřením okolních tkání a orgánů [78–80].
Využití techniky zevního APBI v adjuvantní léčbě po provedení prs záchovné operace je v podmínkách zdravotnického systému ČR i přes dostupné důkazy potvrzující účinnost a proveditelnost této metody alespoň s využitím invazivní brachyterapie zatím velmi omezené.
V současné době dochází k dramatickému vývoji nových léčebných možností pacientů s nádorovými onemocněními. Moderní systémová léčba, jako např. imunoterapie nebo cílená léčba, je však ve většině případů enormně nákladná (finanční toxicita) a představuje významnou část finančních prostředků, které jsou na léčbu onkologických pacientů vynakládány, a to nejenom v ČR. Stejné obavy, co se finanční náročnosti týče, jsou spojeny také se zaváděním nejmodernějších radioterapeutických systémů. Využití standardního lineárního urychlovače (schopného pokrýt široké spektrum pacientů) umožňuje v každodenní praxi ozáření většího množství pacientů v blízkosti jejich domova. Konečným důsledkem je optimalizace léčby z pohledu pacienta (personalizovaná medicína) a optimalizace rozdělování finančních prostředků z pohledu vlády a zdravotních pojišťoven.
Dedikace
Tato práce vznikla za podpory Ministerstva zdravotnictví ČR – Koncepční rozvoj výzkumné organizace (MOU 00209805) a grantu Ministerstva zdravotnictví ČR AZV č. 19-00354.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
The authors declare that they have no potential conflicts of interest concerning drugs, products, or services used in the study.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.MUDr. Petr Burkoň, Ph.D.
Klinika radiační onkologie
Masarykův onkologický ústav
Žlutý kopec 7
656 53 Brnoe-mail: burkon@mou.cz
Obdrženo/Submitted: 25. 2. 2022
Přijato/Accepted: 13. 4. 2022
Zdroje
1. Livi L, Meattini I, Marrazzo L et al. Accelerated partial breast irradiation using intensity – modulated radiotherapy versus whole breast irradiation: 5-year survival analysis of a phase 3 randomised controlled trial. Eur J Cancer 2015; 51 (4): 451–463. doi: 10.1016/j.ejca.2014.12.013.
2. Meattini I, Saieva C, Marrazzo L et al. Accelerated partial breast irradiation using intensity-modulated radiotherapy technique compared to whole breast irradiation for patients aged 70 years or older: subgroup analysis from a randomized phase 3 trial. Breast Cancer Res Treat 2015; 153 (3): 539–547. doi: 10.1007/s10549-015-3565-2.
3. Rodriguez N, Sanz X, Dengra J et al. Five-year outcomes, cosmesis, and toxicity with 3 - dimensional conformal external beam radiation therapy to deliver accelerated partial breast irradiation. Int J Radiat Oncol Biol Phys 2013; 87 (5): 1051–1057. doi: 10.1016/j.ijrobp.2013.08.046.
4. Strnad V, Ott OJ, Hildebrandt G et al. 5-year results of accelerated partial breast irradiation using sole interstitial multicatheter brachytherapy versus whole-breast irradiation with boost after breast-conserving surgery for low-risk invasive and in-situ carcinoma of the female breast: a randomised, phase 3, non-inferiority trial. Lancet 2016; 387 (10015): 229–238. doi: 10.1016/S0140-6736 (15) 00 471-7.
5. Schäfer R, Strnad V, Polgar C et al. Quality-of-life results for accelerated partial breast irradiation with interstitial brachytherapy versus whole-breast irradiation in early breast cancer after breast-conserving surgery (GEC-ESTRO): 5-year results of a randomised, phase 3 trial. Lancet Oncol 2018; 19 (6): 834–844. doi: 10.1016/S1470-2045 (18) 30195-5.
6. Polgár C, Ott OJ, Hildebrandt G et al. Late side-effects and cosmetic results of accelerated partial breast irradiation with interstitial brachytherapy versus whole-breast irradiation after breast-conserving surgery for low-risk invasive and in-situ carcinoma of the female breast: 5-year results of a randomised, controlled, phase 3 trial. Lancet Oncol 2017; 18 (2): 259–268. doi: 10.1016/S1470-2045 (17) 30011-6.
7. Ott OJ, Strnad V, Hildebrandt G et al. GEC-ESTRO multicenter phase 3-trial: accelerated partial breast irradiation with interstitial multicatheter brachytherapy versus external beam whole breast irradiation: early toxicity and patient compliance. Radiother Oncol 2016; 120 (1): 119–123. doi: 10.1016/j.radonc.2016.06.019.
8. Correa C, Harris EE, Leonardi MC et al. Accelerated partial breast irradiation: executive summary for the update of an ASTRO evidence based consensus statement. Pract Radiat Oncol 2017; 7 (2): 73–79. doi: 10.1016/j.prro.2016.09.007.
9. Strnad V, Major T, Polgar C et al. ESTRO-ACROP guideline: interstitial multi-catheter breast brachytherapy as accelerated partial breast irradiation alone or as boost – GEC-ESTRO breast cancer working group practical recommendations. Radiother Oncol 2018; 128 (3): 411–420. doi: 10.1016/j.radonc.2018.04.009.
10. Strnad V, Krug D, Sedlmayer F et al. DEGRO practical guideline for partial-breast irradiation. Strahlenther Onkol 2020; 196 (9): 749–763. doi: 10.1007/s00066-020-01613-z.
11. Keisch M, Vicini F, Kuske R et al. Initial clinical experience with the MammoSite breast brachytherapy applicator in women with early stage breast cancer treated with breast-conserving therapy. Int J Radiat Oncol Biol Phys 2003; 55 (2): 289–293. doi: 10.1016/s0360-3016 (02) 04277-3.
12. Formenti S, Rosenstein B, Skinner K et al. T1 stage breast cancer: adjuvant hypofractionated conformal radiation therapy to tumor bed in selected postmenopausal breast cancer patients a pilot feasibility study. Radiology 2002; 222 (1): 171–178. doi: 10.1148/radiol.2221010769.
13. Livi L, Meattini I, Marrazzo L et al. Accelerated partial breast irradiation using intensity modulated radiotherapy versus whole breast irradiation: 5-year survival analysis of a phase 3 randomised controlled trial. Eur J Cancer 2015; 51 (4): 451–463. doi: 10.1016/j.ejca.2014.12.013.
14. Meattini I, Saieva C, Miccinesi G et al. Accelerated partial breast irradiation using intensity modulated radiotherapy versus whole breast irradiation: health-related quality of life final analysis from the Florence phase 3 trial. Eur J Cancer 2017; 76 : 17–26. doi: 10.1016/j.ejca.2017.01.023. Epub 2017 Mar 3.
15. Bondiau P, Bahadoran P, Lallement M et al. Robotic stereotactic radioablation concomitant with neo-adjuvant chemotherapy for breast tumors. Int J Radiat Oncol Biol Phys 2009; 75 (4): 1041–1047. doi: 10.1016/ j.ijrobp.2008.12.037.
16. Hepel J, Tokita M, MacAusland S et al. Toxicity of three-dimensional conformal radiotherapy for accelerated partial breast irradiation. Int J Radiat Oncol Biol Phys 2009; 75 (5): 1290–1296. doi: 10.1016/j.ijrobp.2009.01.009.
17. Jagsi R, Ben-David M, Moran J et al. Unacceptable cosmesis in a protocol investigating intensity-modulated radiotherapy with active breathing control for accelerated partial-breast irradiation. Int J Radiat Oncol Biol Phys 2009; 76 (1): 71–78. doi: 10.1016/j.ijrobp.2009.01.041.
18. Olivotto I, Whelan T, Parpia S et al. Interim cosmetic and toxicity results from RAPID: a randomized trial of accelerated partial breast irradiation using three-dimensional conformal external beam radiation therapy. J Clin Oncol 2013; 31 (32): 4038–4045. doi: 10.1200/JCO.2013.50.5511.
19. Šlampa P. Radiační onkologie. Maxdorf: Jessenius 2021.
20. Bergom C, Currey A, Desai N et al. Deep inspiration breath hold: techniques and advantages for cardiac sparing during breast cancer irradiation. Front Oncol 2018; 8 : 87. doi: 10.3389/fonc.2018.00087.
21. Latty D, Stuart KE, Wang W et al. Review of deep inspiration breath-hold techniques for the treatment of breast cancer. J Med Radiat Sci 2015; 62 (1): 74–81. doi: 10.1002/jmrs.96.
22. Otto K. Volumetric modulated arc therapy: IMRT in a single gantry arc. Med Phys 2008; 35 (1): 310–317. doi: 10.1118/1.2818738.
23. Yan Y, Yadav P, Bassetti M et al. Dosimetric differences in flattened and flattening filter-free beam treatment plans. J Med Phys 2016; 41 (2): 92–99. doi: 10.4103/0971-6203.181636.
24. Schmidhalter D, Fix MK, Wyss M et al. Evaluation of a new six degrees of freedom couch for radiation therapy. Med Phys 2013; 40 (11): 111710. doi: 10.1118/1.4823789.
25. Haviland JS, Hopwood P, Mills J et al. Do patient-reported outcome measures agree with clinical and photographic assessments of normal tissue effects after breast radiotherapy? The experience of the Standardisation of Breast Radiotherapy (START) trials in early breast cancer. Clin Oncol 2016; 28 (6): 345–353. doi: 10.1016/j.clon.2016.01.011.
26. Bergom C, Currey A, Desai N et al. Deep inspiration breath hold: techniques and advantages for cardiac sparing during breast cancer irradiation. Front Oncol 2018; 8 : 87. doi: 10.3389/fonc.2018.00087.
27. Latty D, Stuart KE, Wang W et al. Review of deep inspiration breath-hold techniques for the treatment of breast cancer. J Med Radiat Sci 2015; 62 (1): 74–81. doi: 10.1002/jmrs.96.
28. Burkon P, Slampa P, Kazda T et al. Stereotactic body radiation therapy for colorectal cancer liver metastases; early results. Klin Onkol 2012; 25 (Suppl 2): 2S93–2S97.
29. Burkon P, Kazda T, Pospisil P et al. Ablative dose stereotactic body radiation therapy for oligometastatic disease: a prospective single institution study. Neoplasma 2019; 66 (2): 315–325. doi: 10.4149/neo_2018_180731N558.
30. Burkon P, Selingerova I, Slavik M et al. Stereotactic body radiotherapy for lymph node oligometastases: real-world evidence from 90 consecutive patients. Front Oncol 2021; 10 : 616494. doi: 10.3389/fonc.2020.616494.
31. Burkoň P, Oberreiterová S, Kazda T et al. Stereotactic body radiotherapy of lymph node oligometastases. Klin Onkol 2020; 33 (2): 114–122. doi: 10.14735/amko2020 114.
32. Formenti S, Rosenstein B, Skinner K et al. T1 stage breast cancer: adjuvant hypofractionated conformal radiation therapy to tumor bed in selected postmenopausal breast cancer patients a pilot feasibility study. Radiology 2002; 222 (1): 171–178. doi: 10.1148/radiol.2221010769.
33. Otto K. Volumetric modulated arc therapy: IMRT in a single gantry arc. Med Phys 2008; 35 (1): 310–317. doi: 10.1118/1.2818738.
34. Ong CL, Verbakel WF, Cuijpers JP et al. Stereotactic radiotherapy for peripheral lung tumors: a comparison of volumetric modulated arc therapy with 3 other delivery techniques. Radiother Oncol 2010; 97 (3): 437–442. doi: 10.1016/j.radonc.2010.09.027.
35. Yan Y, Yadav P, Bassetti M et al. Dosimetric differences in flattened and flattening filter-free beam treatment plans. J Med Phys 2016; 41 (2): 92–99. doi: 10.4103/0971-6203.181636.
36. Purdie TG, Bissonnette JP, Franks K et al. Cone-beam computed tomography for on-line image guidance of lung stereotactic radiotherapy: localization, verification, and intrafraction tumor position. Int J Radiat Oncol Biol Phys 2007; 68 (1): 243–252. doi: 10.1016/j.ijrobp.2006.12.022.
37. Formenti S, Rosenstein B, Skinner K et al. T1 stage breast cancer: adjuvant hypofractionated conformal radiation therapy to tumor bed in selected postmenopausal breast cancer patients a pilot feasibility study. Radiology 2002; 222 (1): 171–178. doi: 10.1148/radiol.2221010769.
38. Aaronson NK, Ahmedzai S, Bergman B et al. The European Organization for Research and Treatment of Cancer QLQ-C30: a quality-of-life instrument for use in international clinical trials in oncology. J Natl Cancer Inst 1993; 85 (5): 365–376. doi: 10.1093/jnci/85.5.365.
39. Sprangers MA, Groenvold M, Arraras JI et al. The European Organization for Research and Treatment of Cancer breast cancer-specific quality-of-life questionnaire module: first results from a three-country field study. J Clin Oncol 1996; 14 (10): 2756–2768. doi: 10.1200/JCO.1996.14.10.2756.
40. Haloua MH, Krekel NMA, Jacobs GJA et al. Cosmetic outcome assessment following breast-conserving therapy: a comparison between BCCT.core software and panel evaluation. Int J Breast Cancer 2014; 2014 : 716860. doi: 10.1155/2014/716860.
41. Darby S, McGale P, Correa C et al. Effect of radiotherapy after breast-conserving surgery on 10-year recurrence and 15-year breast cancer death: meta-analysis of individual patient data for 10,801 women in 17 randomised trials. Lancet 2011; 378 (9804): 1707–1716. doi: 10.1016/S0140-6736 (11) 61629-2.
42. Bartelink H, Horiot J, Poortmans P et al. Recurrence rates after treatment of breast cancer with standard radiotherapy with or without additional radiation. N Engl J Med 2001; 345 (19): 1378–1387. doi: 10.1056/NEJMoa010874.
43. Fisher B, Anderson S, Bryant J et al. Twenty-year follow-up of a randomized trial comparing total mastectomy, lumpectomy, and lumpectomy plus irradiation for the treatment of invasive breast cancer. N Engl J Med 2002; 347 (16): 1233–1241. doi: 10.1056/NEJMoa022152.
44. Veronesi U, Marubini E, Mariani L et al. Radiotherapy after breast conserving surgery in small breast carcinoma: long-term results of a randomized trial. Ann Oncol 2001; 12 (7): 997–1003. doi: 10.1023/a: 1011136326943.
45. Correa C, Harris EE, Leonardi MC et al. Accelerated partial breast irradiation: executive summary for the update of an ASTRO evidence-based consensus statement. Pract Radiat Oncol 2017; 7 (2): 73–79. doi: 10.1016/j.prro.2016.09.007.
46. Strnad V, Major T, Polgar C et al. ESTRO-ACROP guideline: interstitial multi-catheter breast brachytherapy as accelerated partial breast irradiation alone or as boost – GEC-ESTRO breast cancer working group practical recommendations. Radiother Oncol 2018; 128 (3): 411–420. doi: 10.1016/j.radonc.2018.04.009.
47. Strnad V, Krug D, Sedlmayer F et al. DEGRO practical guideline for partial-breast irradiation. Strahlenther Onkol 2020; 196 (9): 749–763. doi: 10.1007/s00066-020-01 613-z.
48. Veronesi U, Orecchia R, Maisonneuve P et al. Intraoperative radiotherapy versus external radiotherapy for early breast cancer (ELIOT): a randomised controlled equivalence trial. Lancet Oncol 2013; 14 (13): 1269–1277. doi: 10.1016/S1470-2045 (13) 70497-2.
49. Vaidya JS, Wenz F, Bulsara M et al. TARGIT trialists’ group. Risk-adapted targeted intraoperative radiotherapy versus whole-breast radiotherapy for breast cancer: 5-year results for local control and overall survival from the TARGIT-A randomised trial. Lancet 2014; 383 (9917): 603–613. doi: 10.1016/S0140-6736 (13) 61950-9.
50. Nachbar M, Mönnich D, Boeke S et al. Partial breast irradiation with the 1.5 T MR-Linac: first patient treatment and analysis of electron return and stream effects. Radiother Oncol 2019; 145 : 30–35. doi: 10.1016/j.radonc.2019.11.025.
51. Bennion NR, Baine M, Granatowicz A et al. Accelerated partial breast radiotherapy: a review of the literature and future directions. Gland Surg 2018; 7 (6): 596–610. doi: 10.21037/gs.2018.11.05.
52. Strnad V, Ott OJ, Hildebrandt G et al. 5-year results of accelerated partial breast irradiation using sole interstitial multicatheter brachytherapy versus whole-breast irradiation with boost after breast-conserving surgery for low-risk invasive and in-situ carcinoma of the female breast: a randomised, phase 3, non-inferiority trial. Lancet 2016; 387 (10015): 229–238. doi: 10.1016/S0140-6736 (15) 00 471-7.
53. Polgár C, Fodor J, Major T et al. Breast-conserving therapy with partial or whole breast irradiation: ten-year results of the Budapest randomized trial. Radiother Oncol 2013; 108 (2): 197–202. doi: 10.1016/j.radonc.2013.05.008.
54. Ott OJ, Strnad V, Hildebrandt G et al. GEC-ESTRO multicenter phase 3-trial: accelerated partial breast irradiation with interstitial multicatheter brachytherapy versus external beam whole breast irradiation: early toxicity and patient compliance. Radiother Oncol 2016; 120 (1): 119–123. doi: 10.1016/j.radonc.2016.06.019.
55. Polgár C, Ott OJ, Hildebrandt G et al. Late side-effects and cosmetic results of accelerated partial breast irradiation with interstitial brachytherapy versus whole-breast irradiation after breast-conserving surgery for low-risk invasive and in-situ carcinoma of the female breast: 5-year results of a randomised, controlled, phase 3 trial. Lancet Oncol 2017; 18 (2): 259–268. doi: 10.1016/S1470-2045 (17) 30011-6.
56. White J, Winter K, Kuske RR et al. Long-term cancer outcomes from study NRG oncology/ RTOG 9517: a phase 2 study of accelerated partial breast irradiation with multicatheter brachytherapy after lumpectomy for early-stage breast cancer. Int J Radiat Oncol Biol Phys 2016; 95 (5): 1460–1465. doi: 10.1016/j.ijrobp.2016.03. 037.
57. Rabinovitch R, Winter K, Kuske R et al. RTOG 95-17, a phase II trial to evaluate brachytherapy as the sole method of radiation therapy for stage I and II breast carcinoma – year-5 toxicity and cosmesis. Brachytherapy 2014; 13 (1): 17–22. doi: 10.1016/j.brachy.2013.08.002.
58. Schäfer R, Strnad V, Polgar C et al. Quality-of-life results for accelerated partial breast irradiation with interstitial brachytherapy versus whole-breast irradiation in early breast cancer after breast-conserving surgery (GEC-ESTRO): 5-year results of a randomised, phase 3 trial. Lancet Oncol 2018; 19 (6): 834–844. doi: 10.1016/S1470-2045 (18) 30195-5.
59. Kamrava M, Kuske RR, Anderson B et al. Outcomes of breast cancer patients treated with accelerated partial breast irradiation via multicatheter interstitial brachytherapy: the pooled registry of multicatheter interstitial sites (PROMIS) experience. Ann Surg Oncol 2015; 22 (Suppl 3): S404–411. doi: 10.1245/s10434-015-4563-7.
60. Rodriguez N, Sanz X, Dengra J et al. Five-year outcomes, cosmesis, and toxicity with 3 - dimensional conformal external beam radiation therapy to deliver accelerated partial breast irradiation. Int J Radiat Oncol Biol Phys 2013; 87 (5): 1051–1057. doi: 10.1016/j.ijrobp.2013.08. 046.
61. Coles CE, Griffin CL, Kirby AM et al. Partial-breast radiotherapy after breast conservation surgery for patients with early breast cancer (UK IMPORT LOW trial): 5-year results from a multicentre, randomised, controlled, phase 3, non-inferiority trial. Lancet 2017; 390 (10099): 1048–1060. doi: 10.1016/S0140-6736 (17) 31145-5.
62. Livi L, Meattini I, Marrazzo L et al. Accelerated partial breast irradiation using intensity-modulated radiotherapy versus whole breast irradiation: 5-year survival analysis of a phase 3 randomised controlled trial. Eur J Cancer 2015; 51 (4): 451–463. doi: 10.1016/j.ejca.2014.12.013.
63. Meattini I, Saieva C, Marrazzo L et al. Accelerated partial breast irradiation using intensity-modulated radiotherapy technique compared to whole breast irradiation for patients aged 70 years or older: subgroup analysis from a randomized phase 3 trial. Breast Cancer Res Treat 2015; 153 (3): 539–547. doi: 10.1007/s10549-015-35 65-2.
64. Livi L, Meattini I, Marrazzo L et al. Accelerated partial breast irradiation using intensity-modulated radiotherapy versus whole breast irradiation: 5-year survival analysis of a phase 3 randomised controlled trial. Eur J Cancer 2015; 51 (4): 451–463. doi: 10.1016/j.ejca.2014.12.013.
65. Meattini I. Partial breast irradiation may be as effective as whole breast irradiation in preventing recurrence in patients with early breast cancer. In: San Antonio Breast Cancer Symposium. San Antonio, 12th December 2019.
66. Whelan TJ, Julian JA, Berrang TS et al. External beam accelerated partial breast irradiation versus whole breast irradiation after breast conserving surgery in women with ductal carcinoma in situ and node-negative breast cancer (RAPID): a randomised controlled trial. Lancet 2019; 394 (10215): 2165–2172. doi: 10.1016/S0140-6736 (19) 32515-2.
67. Olivotto IA, Whelan TJ, Parpia S et al. Interim cosmetic and toxicity results from RAPID: a randomized trial of accelerated partial breast irradiation using three-dimensional conformal external beam radiation therapy. J Clin Oncol 2013; 31 (32): 4038–4045. doi: 10.1200/JCO.2013.50.5 511.
68. Meduri B, Baldissera A, Galeandro M et al. OC-0568: accelerated PBI VS standard radiotherapy (IRMA trial): interim cosmetic and toxicity results. Radiother Oncol 2017; 123: S303. doi: 10.1016/S0167-8140 (17) 31008-3.
69. Vicini FA. Primary results of NSABP B-39/RTOG 0413 (NRG Oncology): a randomized phase III study of conventional whole breast irradiation (WBI) versus partial breast irradiation (PBI) for women with stage 0, I, or II breast cancer. Abstract GS4-04. In: San Antonio Breast Cancer Symposium. San Antonio, February 2019.
70. Vicini FA, Cecchini RS, White JR et al. Longterm primary results of accelerated partial breast irradiation after breast-conserving surgery for early-stage breast cancer: a randomised, phase 3, equivalence trial. Lancet 2019; 394 (10215): 2155–2164. doi: 10.1016/S0140-6736 (19) 32514-0.
71. NSABP B-39, RTOG 0413: A randomized phase III study of conventional whole breast irradiation versus partial breast irradiation for women with stage 0, I, or II breast cancer. Clin Adv Hematol Oncol 2006; 4 (10): 719–721.
72. Bennion NR, Baine M, Granatowicz A et al. Accelerated partial breast radiotherapy: a review of the literature and future directions. Gland Surg 2018; 7 (6): 596–610. doi: 10.21037/gs.2018.11.05.
73. Dutta SW, Showalter SL, Showalter TN et al. Intraoperative radiation therapy for breast cancer patients: current perspectives. Breast Cancer (Dove Med Press) 2017; 9 : 257–263. doi: 10.2147/BCTT.S112516.
74. Bonin K, McGuffin M, Presutti R et al. Breast cancer patients’ preferences for adjuvant radiotherapy post lumpectomy: whole breast irradiation vs. partial breast irradiation-single institutional study. J Cancer Educ 2018; 33 (1): 37–43. doi: 10.1007/s13187-016-1016-3.
75. Hoopes DJ, Kaziska D, Chapin P et al. Patient preferences and physician practice patterns regarding breast radiotherapy. Int J Radiat Oncol Biol Phys 2012; 82 (2): 674–681. doi: 10.1016/j.ijrobp.2010.11.077.
76. Qi X, White J, Li X. Is a/b for breast cancer really low? Radiother Oncol 2011; 100 (2): 282–288. doi: 10.1016/j.radonc.2011.01.010.
77. Bartelink H, Maingon P, Poortmans P et al. Whole-breast irradiation with or without a boost for patients treated with breast-conserving surgery for early breast cancer: 20-year follow-up of a randomised phase 3 trial. Lancet Oncol 2015; 16 (1): 47–56. doi: 10.1016/S1470-2045 (14) 71156-8.
78. Timmerman R, Paulus R, Galvin J et al. Stereotactic body radiation therapy for inoperable early stage lung cancer. JAMA 2010; 303 (11): 1070–1076. doi: 10.1001/jama.2010.261.
79. Rusthoven K, Kavanagh B, Cardenes H et al. Multi-institutional phase I/II trial of stereotactic body radiation therapy for liver metastases. J Clin Oncol 2009; 27 (10): 1572–1578. doi: 10.1200/JCO.2008.19.6329.
80. Burkoň P, Slávik M, Kazda T et al. Stereotactic body radiotherapy – current indications. Klin Onkol 2019; 32 (1): 10–24. doi: 10.14735/amko201910.
Štítky
Dětská onkologie Chirurgie všeobecná Onkologie
Článek SpolupachateléČlánek Aktuality z odborného tisku
Článek vyšel v časopiseKlinická onkologie
Nejčtenější tento týden
2022 Číslo 5- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejasný stín na plicích – kazuistika
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Jak souvisí postcovidový syndrom s poškozením mozku?
-
Všechny články tohoto čísla
- Spolupachatelé
- Gastrointestinální toxicita systémové onkologické imunoterapie
- Přínos empatie lékaře pro jeho pacienty a výsledky začlenění rozvíjení schopnosti empatie do kurikul lékařských fakult
- Informace z České onkologické společnosti
- Expresia ligandu 1 programovanej smrti v nemalobunkovom karcinóme pľúc – mechanizmus regulácie, asociácia s ostatnými markermi a terapeutické využitie
- Zevní akcelerované ozáření lůžka časného karcinomu prsu s využitím stereotaktických technik – metodologie, technické aspekty a předběžné výsledky prospektivní randomizované studie
- Cvičení jako nástroj pro zlepšení kvality života pacientek po léčbě karcinomu prsu
- Bifenotypový sinonazálny sarkóm – opis prípadu
- Onkologické rány – doporučení péče vycházející z multioborové spolupráce
- Aktuality z odborného tisku
- Klinická onkologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Gastrointestinální toxicita systémové onkologické imunoterapie
- Onkologické rány – doporučení péče vycházející z multioborové spolupráce
- Přínos empatie lékaře pro jeho pacienty a výsledky začlenění rozvíjení schopnosti empatie do kurikul lékařských fakult
- Bifenotypový sinonazálny sarkóm – opis prípadu
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání






