-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaPozvolný vzestup bilirubinu v průběhu léčby mnohočetného myelomu lenalidomidem, bortezomibem a dexametazonem (demaskování dříve nediagnostikovaného Gilbertova syndromu) a vymizení nekrobiotického xantogranulomu po dosažení kompletní remise myelomu
Slow increase of bilirubin concentration during administration of lenalidomide, bortezomib and dexamethasone for multiple myeloma (unmasking previously undiagnosed Gilbert syndrome) and disappearance of necrobiotic xanthogranuloma after complete remission of multiple myeloma
Background: Lenalidomid ranks among immunomodulatory drugs. There are a few of the more common side effects, like a higher risk of venous trombembolism or diarrhea. Other side effects are rare. The hyperbilirubinemia described in this article can be assigned to them. In our case, the increase of bilirubin was associated with unrecognized Gilbert syndrome. Case description: We report a patient with multiple myeloma and necrobiotic xanthogranuloma (NXG) of the skin and liver. After the treatment with bortezomib, lenalidomid and dexamethasone, complete remission was attained after 4 cycles with decrease of monoclonal immunoglobulin to an unmeasurable concentration. At the same time, the disappearance of cutaneous and hepatic lesions of NXG on FDG-PET/CT was evident. The administration of bortezomib was stopped after 8 cycles and only continued with lenalidomide as a maintenance therapy. However, after four cycles of this therapy, bilirubin increased above the upper limit and the increase continued till the 11th month of lenadomide administration, when bilirubin reached the highest concentration of 75 μmol/l (more than the three-fold of the upper limit, grade III toxicity). The patient had asymptomatic hyperbilirubinemia with no underlying liver disease or renal impairment while being on lenalidomide therapy. Genetic studies proved mutation; insertion in the promotor gene UGT1A1 typical for Gilbert syndrome. Hyperbilirubinemia may be attributed to the unmasking of previously undiagnosed Gilbert syndrome. Therefore, the therapy with lenalidomide was interrupted after 11 months. The bilirubin level decreased after the discontinuation of the drug. Conclusion: NXG disappeared after fulfilling complete remission of multiple myeloma with disappearance of monoclonal immunoglobulin. This observation supports the hypothesis that monoclonal immunoglobulin has a crucial role in the ethiopathogenesis of NXG and suggests the treatment of monoclonal gammopathy if present in a patient with NXG, hoping that this will result in xantogranuloma disappearance.
Keywords:
Multiple myeloma – necrobiotic xanthogranuloma – monoclonal Gilbert syndrome – hyperbilirubinemia
Autoři: Z. Adam 1; Z. Řehák 2; Z. Adamová 3; L. Pour 1; K. Dvořáková 4; B. Packová 5; R. Koukalová 2; Martin Krejčí 1*; Marta Krejčí 1**; M. Štork 1; V. Sandecká 1; I. Boichuk 1; Z. Král 1
Působiště autorů: Interní hematologická a onkologická klinika LF MU a FN Brno 1; Oddělení nukleární medicíny, MOU Brno 2; Chirurgické oddělení, Nemocnice ve Frýdku-Místku 3; Patologicko-anatomické oddělení, Nemocnice Jihlava 4; Interní gastroenterologická klinika LF MU a FN Brno 5
Vyšlo v časopise: Klin Onkol 2022; 35(4): 315-322
Kategorie: Kazuistika
doi: https://doi.org/10.48095/ccko2022315Souhrn
Východiska: Lenalidomid je lék ze skupiny imunomodulačních léčiv. Jeho nežádoucí účinky lze rozdělit na častější, kam patří zvýšené riziko trombembolizmu nebo průjem, a vzácné, k nimž lze přiřadit námi popsanou hyperbilirubinemii. V našem případě vzestup bilirubinu souvisel s dříve nerozpoznaným Gilbertovým syndromem. Popis případu: Popisujeme pacienta s mnohočetným myelomem a nekrobiotickým xantogranulomem (NXG) kůže a jater. Po léčbě bortezomibem, lenalidomidem a dexametazonem následoval rychlý pokles monoklonálního imunoglobulinu na neměřitelné hodnoty a již po 4. cyklu byla dosažena kompletní remise mnohočetného myelomu a současně vymizela kožní ložiska NXG, dříve velmi dobře zřetelná na FDG-PET/CT. Pacient dostal celkem osm cyklů této léčby a pak pokračovala pouze udržovací léčba lenalidomidem. Po čtyřech cyklech této léčby se však zvýšila koncentrace bilirubinu nad horní hranici normy a její zvyšování v dalších měsících léčby pokračovalo, až v 11. měsíci dosáhla koncentrace 78,5 μmol/l (vyšší než trojnásobek horní fyziologické hranice, toxicita stupně III). V průběhu léčby lenalidomidem se u pacienta rozvinula asymptomatická hyperbilirubinemie, aniž by bylo přítomno difuzní poškození jaterního parenchymu (všechny jaterní enzymy byly trvale v normě). Taktéž byla vyloučena hemolýza. Genetické vyšetření prokázalo mutaci promotoru genu UGT1A1, která je typická pro Gilbertův syndrom. Léčba lenalidomidem vedla k postupnému demaskování Gilbertova syndromu. Po přerušení léčby začal bilirubin klesat. Závěr: NXG vymizel po dosažení kompletní remise myelomu, což potvrzuje etiopatogenetickou souvislost NXG s monoklonálním imunoglobulinem. Proto je u osob se symptomatickým xantogranulomem, u nichž je prokázán monoklonální imunoglobulin, vhodné pokusit se léčbou zastavit tvorbu monoklonálního imunoglobulinu s nadějí, že to povede k vymizení xantogranulomu.
Klíčová slova:
mnohočetný myelom – Gilbertův syndrom – nekrobiotický xantogranulom – hyperbilirubinemie
Úvod
Lenalidomid používáme u našich pacientů již mnoho let. Jeho nežádoucí účinky mohou být častější, kam patří zvýšené riziko trombembolizmu a při dlouhodobějším užívání řidší stolice. Jiné nežádoucí účinky jsou vzácné, k nim lze přiřadit námi popsanou hyperbilirubinemii v průběhu léčby lenalidomidem. V případě, který popisujeme, souvisela hyperbilirubinemie s dříve nerozpoznaným Gilbertovým syndromem, který se vlivem léčby lenalidomidem manifestoval. Jde o vzácnou komplikaci a zatím jsme se s podobným případem nesetkali.
Nekrobiotický xantogranulom (NXG) je nozologickou jednotkou řadící se mezi histiocytární onemocnění. Jednou z hypotéz, které vysvětlují vznik NXG, je stimulace tvorby xantogranulomové tkáně monoklonálním imunoglobulinem. Tato hypotéza je založena na několika experimentálních pracích a dále pak na několika pozorováních, kdy se masy NXG po vymizení monoklonálního imunoglobulinu zcela vytratily. Vzhledem k vzácnosti NXG není počet těchto případů velký, proto jsme se rozhodli popsat našeho pacienta, u něhož došlo k vymizení NXG poté, co vymizel monoklonální imunoglobulin. Naše pozorování podporuje hypotézu, dle níž má monoklonální imunoglobulin klíčovou roli v etiopatogenezi NXG. Proto by u pacientů s NXG měl být vyšetřen monoklonální imunoglobulin. Pokud je přítomný, je vhodné se pokusit odstranit jeho tvorbu cílenou léčbou s nadějí, že vymizení tvorby monoklonálního imunoglobulinu povede k vymizení xantogranulomu.
Popis případu
Muž, narozený roku 1957, byl do naší ambulance odeslán v lednu 2019 pro vysokou hodnotu celkové bílkoviny (105 g/l; fyziologické rozmezí 64–83 g/l) a pro nález monoklonálního imunoglobulinu typu IgG-kappa (M-IgG) v séru v koncentraci 32 g/l. Celková koncentrace imunoglobulinů typu IgG byla 46 g/l (fyziologické rozmezí 7–16 g/l). V anamnéze neměl žádné závažné onemocnění a dlouhodobě neužíval žádné léky. Kostní dřeň byla vyšetřena metodou trepanobiopsie. V histologickém hodnocení válečku kostní dřeně popsal patolog přítomnost klonálních plazmocytů kappa (myelomových buněk). Jejich kvantita byla variabilní dle vyšetřovaného úseku, v rozmezí 2–20 %. Vstupní rentgenové vyšetření skeletu neprokázalo žádné osteolytické změny, typické pro mnohočetný myelom. Koncentrace hemoglobinu byla 141 g/l a hodnoty kreatininu a kalcia byly v normě. Diagnóza byla uzavřena jako asymptomatický myelom.
V rámci kompletnosti vyšetření bylo v červnu 2019 realizováno první FDG-PET/CT vyšetření, které se na první pohled jevilo být bez patologického nálezu. Byla popsána mírně zvýšená akumulace fluorodeoxyglukózy (FDG) v retromandibulární uzlině vpravo a zvýšená akumulace FDG v podkoží pravého stehna, průměr ložiska byl < 1 cm. Toto kožní ložisko jsme považovali za drobnou zánětlivou reakci a nijak jsme je nekontrolovali. Jak se ale při dalším vyšetření ukázalo, byl to zřejmě počínající NXG.
Zobrazená retromandibulární uzlina nebyla tak velká, aby byla dobře hmatná.
Druhé FDG-PET/CT vyšetření bylo provedeno skoro o rok později, tj. v květnu 2020, a toto vyšetření již přineslo překvapivý patologický nález několika ložisek zvýšené akumulace, ne však v kostech. Byla popsána zvětšená jugulární uzlina vpravo o velikosti 15 mm, zvýšeně akumulující FDG (maximální standardizovaná hodnota utilizace – SUVmax – byla 3,73). V nízkodávkovém CT vyšetření dále byla patrná zvětšená játra. Pravý lalok kraniokaudálně měřil 16 cm a měl nehomogenní strukturu. Slezina se oproti přechozímu vyšetření také zvětšila. Na skeletu byla zřetelná osteoporóza a prolomená horní krycí ploška těla obratle L2. V kůži a podkoží femorální oblasti vpravo laterálně byl již na nízkodávkovém CT zřetelný infiltrát o velikosti 24 × 24 × 12 mm. V PET obraze bylo překvapivě více ložisek s patologickou akumulací FDG v obou lalocích jater s maximem kaudálně (SUVmax do výše 6,5). Izolovaně aktivní ložisko povrchově laterálně na pravém stehně intenzivně akumulovalo FDG, takže hodnota SUVmax dosáhla 12,15. Biochemické vyšetření v té době dokumentovalo normální bilirubin, z jaterních enzymů pouze AST bylo zcela nepatrně vyšší – 1,01 µkat/l.
Histologické vyšetření tkáně z kožního ložiska prokázalo rozsáhlý granulomatózní zánět zasahující do tukové tkáně, s četnými velkými mnohojadernými histiocyty, se septy místy fibrotizujícími, místy se znakem nekrobiózy, ale bez pěnitých buněk. Plazmocyty byly jen místy a byly dle barvení kappa a lambda řetězců polyklonální. Histologický závěr: NXG bez pěnitých buněk. Odběr histologie z jater byl příliš rizikový, proto nebyl proveden.
V listopadu 2020 se pacient i přes všechny tyto nálezy cítil být stále zdráv, neměl pocit, že by byl svou nemocí nějak omezován, jedinou novinkou byly tlaky v pravém podžebří, když ležel v posteli – ty dříve nemíval.
Třetí FDG-PET/CT vyšetření, jehož cílem bylo dokumentovat dynamiku procesu vzhledem ke zcela nejasnému vývoji, bylo realizováno v listopadu 2020. Toto vyšetření zjistilo, že akumulace v jugulární uzlině na krku vpravo se zvýšila, hodnota SUVmax dosáhla hodnoty 7,72; při předchozím vyšetření pouze 3,73. V játrech se objevila nehomogenní struktura, byla progrese hypodenzních ložisek a velké ložisko v segmentu S6 mělo nyní i centrální nekrózu. Průměr ložiska v S6 segmentu byl 5 cm, přičemž u předchozího vyšetření mělo průměr jen 3,5 cm. Hepatosplenomegalie byla stacionární, pankreas a ledviny bez expanze. Na povrchu těla v kůži a podkoží byla nalezena vícečetná patologická ložiska ve shodě s PET zobrazením, největší na proximálním předloktí vpravo, laterálně na paži vpravo, dále v polovině levé paže a další ložisko na DKK laterálně na pravém stehně a v distální třetině pravého lýtka mediálně, všechna do průměru 1 cm. V PET obraze byla zřetelná splývající ložiska v játrech, největší v segmentu S6, toto ložisko bylo aktivní v povrchovém lemu a neaktivní centrálně (nejspíše šlo o nekrotizaci).
Při porovnání s předchozím vyšetřením v květnu 2020 se míra akumulace FDG zvyšuje v absolutních hodnotách SUVmax. Dále v játrech přibylo nehomogenity v rozložení farmaka, ale bez přesvědčivých ložisek. Povrchově v kůži a podkoží bylo popsáno pět hypermetabolických ložisek, na proximálním předloktí SUVmax 10,03, laterálně na paži vpravo SUVmax 20,64, v polovině levé paže SUVmax 15,7, dorzálně na hrudníku SUVmax 4,48 a další na dolních končetinách. Oproti květnu se tedy zvětšila četnost kožních a podkožních ložisek a zvýšila se akumulace FDG v nich. Tato zřetelná progrese již vyžadovala léčbu. I když byl patologický nález na FDG-PET/CT v játrech, bilirubin i jaterní enzymy byly překvapivě v mezích normy, taktéž cholesterol a triglyceridy.
Mezi NXG a monoklonální gamapatií je etiologická vazba. Proto jsme 26. 11. 2020 zahájili léčbu mnohočetného myelomu. Pro iniciální léčbu mnohočetného myelomu jsme zvolili kombinaci ve složení: lenalidomid, bortezomib a dexametazon. Bortezomib a dexametazon pacient dostával klasicky 1× týdně a lenalidomid dostával první čtyři cykly v dávce 25 mg a v dalších cyklech byla dávka snížena na 10 mg vždy 21 dní s následující týdenní pauzou. Pacient v červenci 2021 ukončil 8. měsícem (cyklem) léčbu bortezomibem a od srpna roku 2021 přešel na udržovací léčbu ve složení: lenalidomid v dávce 10 mg v klasickém schématu 1 tableta po dobu 21 dní, po kterých následuje týdenní pauza. K tomu užíval jen 1× týdně dexametazon 20 mg v tabletě.
Koncentrace monoklonálního imunoglobulinu byla v době zahájení léčby 32 g/l a při léčbě výrazně klesala; poslední měřitelná hodnota byla 5 g/l v březnu 2021 a od dubna 2021 již byla neměřitelná. Imunofixace byla negativní, viz graf 1. A stejně rychle jak klesala koncentrace monoklonálního imunoglobulinu, tak mizely morfy xantogranulomu, jak dokladují následující PET/CT popisy a obr. 1.
Graf 1. Vývoj monoklonálního imunoglobulinu. 
Obr. 1. Snímky FDG-PET/CT. 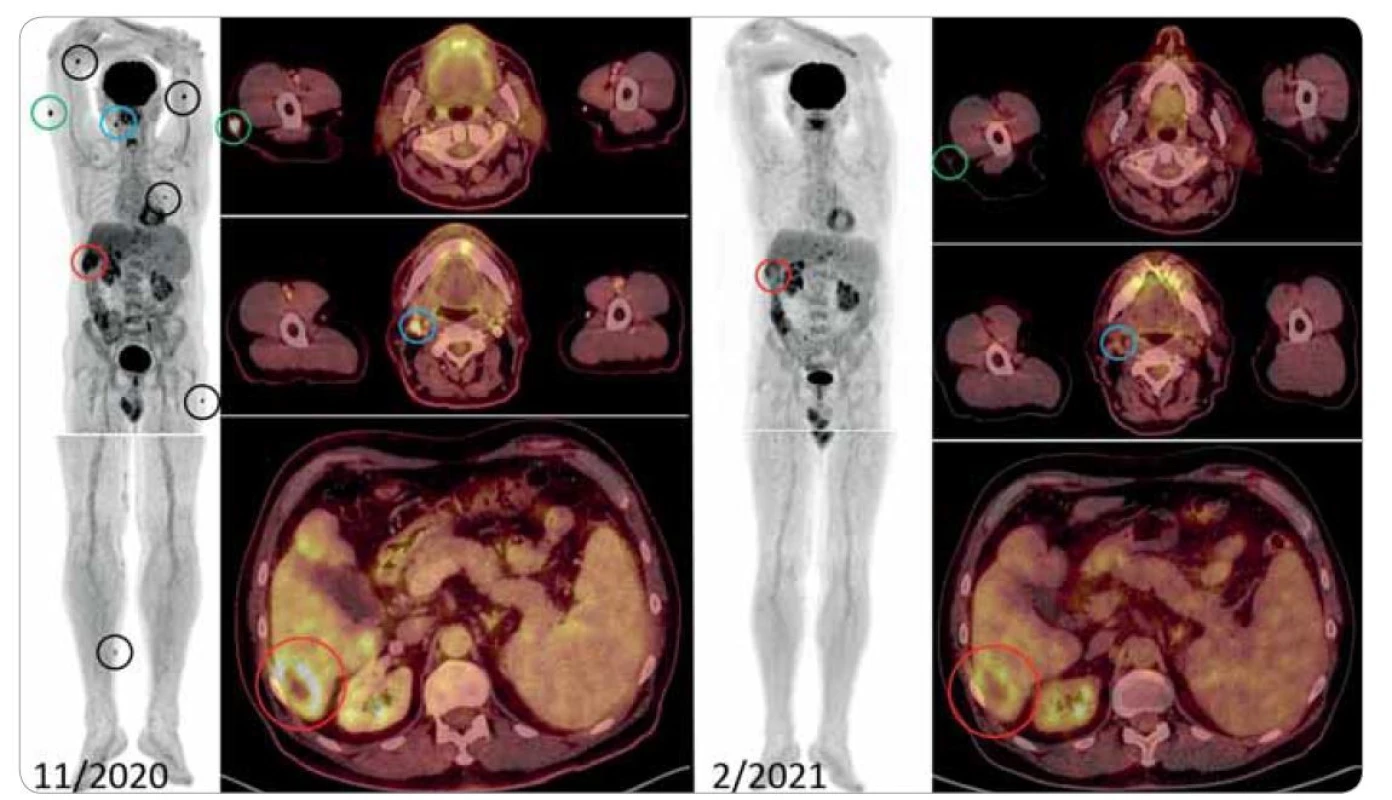
Vlevo: Vyšetření v 11/2020 (projekce maximální intenzity a fúzované axiální řezy). Metabolicky vysoce aktivní ložiska v podkoží pravé paže laterálně (zelené označení), metabolicky aktivní uzlina velikosti 11 mm v průměru na krku vpravo (modré označení) a hypodenzní, centrálně nekrotické ložisko v S6 jater, cca 6 cm v průměru (červené označení) jsou v detailech zobrazena i fúzovaně v axiálních řezech. Další černě označená ložiska jsou povrchově na pravém předloktí, levé paži, dorzálně na hrudníku vlevo, levém stehně a pravém lýtku. Vpravo: Vyšetření v 2/2021 (projekce maximální intenzity a fúzované axiální řezy) detekuje úplnou morfometabolickou regresi kožních ložisek, krční uzliny vpravo a parciální metabolickou regresi ložiska v S6 jater. Kontrolní FDG-PET/CT bylo provedeno v únoru počátkem 4. měsíce (cyklu) léčby. Při srovnání s vyšetřením z listopadu 2020 je vidět parciální regrese ložiska v játrech, prakticky úplná morfometabolická regrese minule aktivní jugulární uzliny a úplná morfometabolická regrese všech patologických infiltrátů kůže a podkoží. Šlo tedy o velmi rychlou léčebnou odpověď, podobně jako došlo k rychlému poklesu monoklonálního imunoglobulinu, jehož vývoj uvádí obrazová dokumentace.
Poslední PET/CT z listopadu 2021 uvádí, že sledované hypodenzní ložisko v játrech v S6 dále zmenšuje svoji velikost ve srovnání s předchozími vyšetřeními.
Dosažení kompletní remise mnohočetného myelomu s kompletním vymizením monoklonálního imunoglobulinu tedy bylo spojeno s vymizením ložisek xantogranulomu detekovatelného pomocí FDG-PET/CT jak na kůži, tak i v játrech, kde zůstaly dle PET/CT hodnocení již jen minimální změny.
Léčba byla pacientem excelentně tolerována, po celou dobu léčby neudával žádné nežádoucí účinky. Léčbu lenalidomidem jsme však v listopadu 2021 ukončili pro hyperbilirubinemii s maximem 78 μmol/l (norma 2–21 μmol/l); přímý bilirubin byl v té době 11,9 μmol/l (norma 0–5 μmol/l).
Pacient měl na našem pracovišti četné kontroly ještě před zahájením léčby, celkem 18 laboratorních vyšetření, vždy s normálními hodnotami bilirubinu. První zvýšená hodnota bilirubinu – 26 μmol/l – byla zjištěna v únoru 2021, tj. ve 4. měsíci (cyklu) léčby, ale pak opět poklesla a ještě počátkem dubna 2021 měl pacient znovu hodnotu bilirubinu ve fyziologickém rozmezí. Od konce dubna 2021 se však hodnoty bilirubinu začaly postupně zvyšovat, zatímco jaterní enzymy zůstávaly stále zcela v normě. Hodnoty bilirubinu ilustruje graf 2. V rámci diferenciální diagnostiky hyperbilirubinemie proběhla vyšetření na hepatitidy a hemolýzu s negativním výsledkem. V listopadu 2021 byla léčba pro izolovanou hyperbilirubinemii ukončena. Příčina hyperbilirubinemie byla stanovena metodou genetického vyšetření jako morbus Gilbert. Real-time PCR potvrdilo inzerci repetitivní sekvence TA v promotoru genu pro uridin-5‘-difosfo-glukuronyl-transferázu 1A1 (UGT 1A1). Tento Gilbertův syndrom byl doposud asymptomatický, nikdy dříve před léčbou lenalidomidem u pacienta nebyla detekována hyperbilirubinemie. Po ukončení podávání lenalidomidu dochází k postupnému poklesu bilirubinu.
V prosinci 2021 bylo provedeno kontrolní vyšetření kostní dřeně. Při cytologickém hodnocení kostní dřeně bylo konstatováno, že plazmocyty nejsou zmnoženy (0,2 %) a nejsou v nich přítomny morfologické odchylky, v kostní dřeni bylo více monocytů a makrofágů. Histologické hodnocení koagula kostní dřeně prokázalo do 5 % plazmocytů, které nebyly klonální. Flowcytometrické vyšetření kostní dřeně prokázalo 0,14 % plazmocytů, které byly normálního fenotypu. Vyšetření kostní dřeně potvrdilo trvání kompletní remise mnohočetného myelomu.
Diskuze
Souvislost NXG s monoklonálním imunoglobulinem
NXG je uveden v histologické klasifikaci krevních chorob ve skupině histiocytárních onemocnění. Kritéria této nemoci, uvedená v tab. 1, se v odborné literatuře poprvé objevila v roce 2020. Tento článek jen navazuje na předchozí publikace věnované NXG [2–6]. Jde o histiocytární onemocnění, které je ve většině případů diagnostikováno u pacientů s monoklonálním imunoglobulinem (M-Ig), z čehož plyne, že M-Ig zde má něco společného s etiologií a patofyziologií vzniku NXG. Etiopatogenezi zkoumal Raphael Szalat a své výzkumy zveřejnil ve dvou publikacích. Dospěl k závěru, že příčinou je tvorba imunokomplexů a interakce mezi M-Ig a lipoproteiny. Ve svých publikacích uvádí jako důkaz etiopatogenetické souvislosti NXG a monoklonální gamapatie ústup NXG při potlačení tvorby M-Ig [7,8].
Tab. 1. Diagnostická kritéria nekrobiotického xantogranulomu z roku 2020 [1]. ![Diagnostická kritéria nekrobiotického xantogranulomu z roku 2020 [1].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/1d3653b1e963ffb70caab13606efd837.jpg)
Souvislost NXG s monoklonální gamapatií potvrzuje i náš případ, protože když M-Ig vymizel, vymizela současně i ložiska NXG. Podobný, poměrně rychlý ústup kožní patologie u pacienta po vymizení M-Ig po léčbě jsme pozorovali u jiné kožní patologie související s M-Ig, u skleromyxedému. Vymizení M-Ig vedlo k vymizení skleromyxedému a recidiva gamapatie vedla k obnovení skleromyxedému. A stejně tak u pacientky s IgA-pemfigem a mnohočetným myelomem typu IgA vymizely kožní morfy po dosažení kompletní remise po léčbě a vrátily se v době recidivy. M-Ig může dle zaměření své antigenní determinanty indukovat různá kožní, ale i jiná onemocnění.
Léčba NXG nemá svá pravidla typu léčebných doporučení, k dispozici je pouze několik přehledových prací, které vyšly v posledních 5 letech [1,9–13]. V poslední přehledové publikaci z roku 2020, je analyzováno celkem 235 pacientů s NXG z několika velkých nemocnic v USA [1].
Z těchto 235 pacientů mělo 193 (82,1 %) monoklonální imunoglobulin, nejčastější byl IgG-kappa, u 117 pacientů (50 %) ale byly pozorovány i ostatní typy M-Ig. Není jasné, zda u pacientů bez monoklonálního imunoglobulinu byla prováděna imunoelektroforéza, protože tyto případy byly publikovány dermatology, kteří nemají praxi s monoklonálními gamapatiemi a jejich diagnostickými metodami.
Z celého souboru 235 pacientů mělo 59 (25,1 %) maligní onemocnění typu mnohočetného myelomu. Solidní tumory byly vzácné a vždy byly provázeny přítomností M-Ig. U některých pacientů s NTX byl pozorován postupný vývoj monoklonální gamapatie nejasného významu do mnohočetného myelomu. Morfy nabývaly různých forem. Důležité je zmínit lokalizaci. Nejčastější byly NXG morfy periorbitálně (u 60 %), v další části obličeje (22,8 %), na trupu (53 %) a na končetinách (56 %). Mezi výjimečné lokalizace pak patřil mozek, gastrointestinální trakt, srdce, játra, plíce, svaly a parotis [1].
V odborné literatuře za posledních 10 let jsme našli jen dva popisy lokalizace NTX v játrech [14,15]. Přehledová práce z roku 2020 cituje jen ty terapeutické postupy, které vedly k léčebné odpovědi alespoň u tří pacientů. Léčba pomocí intravenózních imunoglobulinů dosáhla léčebné odpovědi u 9 z 9 léčených osob, antimalarika u 4 z 5 pacientů (80 %), nitroložisková léčba triamcinolonem acetátem u 6 z 8 léčených (75 %), operace u 3 ze 4 operovaných (75 %), chemoterapie u 8 z 12 léčených (67 %) a imunomodulační léky lenalidomid a thalidomid u 5 z 8 léčených (63 %). V literatuře jsme nalezli ještě další práce popisující léčebný účinek imunomodulačních léků, a to jak léčbu starším thalidomidem, tak novějším lenalidomidem [16–20]. O něco více případů bylo léčeno nitrožilními imunoglobuliny [21–27]. Nelze ale říci, která léčba je účinnější. Domníváme se, že je zde analogie s léčbou skleromyxedému. U obou těchto chorob (NXG a skleromyxedému) je možné léčbu cílit na klonální plazmatické buňky s nadějí, že při senzitivitě monoklonální gamapatie poklesne koncentrace M-Ig, a tedy ustoupí projevy NXG nebo skleromyxedému, které monoklonální imunoglobulin vyvolává. Zda je tato léčba účinná, či není, záleží na senzitivitě plazmocelulární dyskrazie k léčbě. V případě, kdy nelze cílenou léčbou odstranit tvorbu M-Ig, pomáhá léčba pomocí nitrožilních imunoglobulinů. Tyto imunoglobuliny narušují vazbu M-Ig na cílové struktury, které nemoc spouští; v případě NXG tedy zřejmě vazbu M-Ig na lipoproteiny a tvorbu imunokomplexů [5–8]. I u NXG lze léčbu cílit oběma směry. Schéma léčby, které publikoval Haber v roce 2020 pro skleromyxedém, je vlastně shodné s léčebným schématem pro NXG, protože v obou případech je vyvolávající příčinou reakce monoklonálního imunoglobulinu s některými autoantigeny, viz schéma 1 [28]. Náš případ dokumentuje, že léčba úspěšně potlačující tvorbu M-Ig je spojena s regresí morf NTX, jak dokumentuje FDG-PET/CT, které je vhodné pro sledování této nemoci [29–31]. Je zde však i druhé vysvětlení, a sice že NXG byl potlačen lenalidomidem.
Schéma 1. Léčebné schéma. Na základě systematického přehledu literatury pro léčbu skleromyxedému je vlastně použitelné i pro léčbu nekrobiotického xantogranulomu, protože v obou případech jsou přítomny změny způsobené reakcí monoklonálního imunoglobulinu s autoantigeny; v jednom případně je důsledkem skleromyxedém a v druhém nekrobiotický xantogranulom [28]. ![Schéma 1. Léčebné schéma. Na základě systematického přehledu literatury pro léčbu
skleromyxedému je vlastně použitelné i pro léčbu nekrobiotického xantogranulomu,
protože v obou případech jsou přítomny změny způsobené reakcí monoklonálního
imunoglobulinu s autoantigeny; v jednom případně je důsledkem skleromyxedém
a v druhém nekrobiotický xantogranulom [28].](https://pl-master.mdcdn.cz/media/image_pdf/1060c0794b69c74f8b5149c031b1f2ae.jpg?version=1660665075)
Souvislost léčby lenalidomidem s hyperbilirubinemií
Léčba lenalidomidem má svá známá rizika, mezi něž patří trombembolické komplikace, příp. průjmy při dlouhodobějším podávání. Mezi velmi vzácné nežádoucí účinky lenalidomidu zřejmě patří i hyperbilirubinemie. Náš pacient zpočátku toleroval lenalidomid po 4 měsíce (cykly) dobře, bez vzestupu koncentrace bilirubinu, a až po 4 měsících podávání lenalidomidu došlo k rozvoji izolované asymptomatické hyperbilirubinemie. Vzhledem k absenci jakýchkoliv potíží z oblasti trávicího traktu a absenci jakékoliv elevace jaterních enzymů či průkazu hemolýzy nebo jaterní infekce jsme získali podezření, že lenalidomid mohl odmaskovat do té doby se neprojevující Gilbertův syndrom. Genetickým vyšetřením pak byl Gilbertům syndrom potvrzen. V literatuře jsou zatím jen ojedinělé popisy pacientů, u nichž lenalidomid vedl k odmaskování Gilbertova syndromu [32].
Mutace A (TA)7TAA promotoru uridin-5‘-difosfo-glukuronosyltransferázy (UDP-glukuronosyltransferáza – UGT) je považována za nejčastější příčinu tohoto syndromu, ačkoliv bylo identifikováno více než 100 odlišných mutací, které se podílejí na Gilbertově syndromu [33].
UGT je skupina enzymů, které jsou zodpovědné za glukuronidaci různých molekul a jejich vylučování z těla. UGT1A1 je enzym, který je zodpovědný za konjugaci kyseliny glukuronové s bilirubinem. Připojením kyseliny glukuronové vlivem enzymu UGT1A1 se bilirubin stane ve vodě rozpustným, což pomáhá jeho vylučování [34–38]. U Gilbertova syndromu bylo popsáno více než 100 různých mutací, ale nejčastější jsou homozygotní polymorfizmy dvou extra bází (TA) v promotoru genu UGT1A1. Tyto extra báze snižují ve svém důsledku expresi tohoto genu. To způsobuje 10–35% snížení aktivity enzymu UGT1A1.
Gilbertův syndrom se projevuje jen u homozygotů pro tuto mutaci, tedy tento syndrom je autozomálně recesivně dědičný. Genetické studie prokázaly, že 9–10 % populace v západních zemích je homozygotních s touto variantou promotoru a až 42 % populace je heterozygotních [38], takže Gilbertův syndrom není až tak vzácný. Dle jiné epidemiologické studie postihuje 2–10 % populace západního světa [39,40].
Pacient, kterého popisujeme, měl od 5. měsíce (cyklu) léčby lenalidomidem postupně narůstající hodnoty bilirubinu (graf 2), ačkoliv byl zcela asymptomatický, bez dalších známek hepatotoxicity. Tato asymptomatická hyperbilirubinemie se liší od dříve popsaných lenalidomidem indukovaných hepatotoxických projevů u pacientů s renálním selháním [41–45]. Náš pacient měl normální funkce ledvin po celou dobu léčby. Asymptomatická hyperbilirubinemie je velmi vzácná komplikace léčby lenalidomidem, ale je třeba ji mít na zřeteli, i když v databázi medicínské literatury MEDLINE PubMed jsou zatím jen ojedinělé popisy.
Námi popsaný případ dokumentuje, že lenalidomid může u těchto pacientů vést k hyperbilirubinemii, zřejmě však ne u všech, protože lenalidomid je podáván již léta velkému počtu pacientů a zpráv o manifestaci Gilbertova syndromu je málo.
Závěr
Námi popsaný případ je zajímavý ze dvou důvodů. Vymizení monoklonálního imunoglobulinu spojené s vymizením morf xantogranulomu lze interpretovat jako průkaz etiopatogenetické souvislosti NXG s monoklonálním imunoglobulinem nebo jako ústup po léčbě lenalidomidem. Pokud recidiva myelomu bude spojená s recidivou xantogranulomu, potvrdí se souvislost s monoklonálním imunoglobulinem.
Lenalidomid může u normobilirubinemických pacientů s mutacemi, které jsou podkladem pro Gilbertům syndrom, vést k manifestaci tohoto syndromu, a to buď ihned v průběhu 1. cyklu, jak popisuje literatura [32], nebo později, pozvolna v průběhu léčby. Proto je nutno při kontrolách pacientů užívajících tento lék sledovat mimo jiné i vývoj koncentrace bilirubinu.
Poděkování
Sepsáno za podpory MZ ČR – RVO (FNBr, 65269705).
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.MUDr. Zuzana Adamová, Ph.D.
Chirurgické oddělení
Nemocnice ve Frýdku-Místku
Elišky Krásnohorské 321
738 01 Frýdek-Místek
e-mail: adamova@nemfm.cz
Obdrženo/Submitted: 13. 2. 2022
Přijato/Accepted: 24. 3. 2022
Zdroje
1. Nelson CA, Zhong CS, Hashemi DA et al. A multicenter cross-sectional study and systematic review of necrobiotic xanthogranuloma with proposed diagnostic criteria. JAMA Dermatol 2020; 156 (3): 270–279. doi: 10.1001/jamadermatol.2019.4221.
2. Král Z, Krejčí M, Kynclová J et al. Nekrobiotický xantogranulom asociovaný s monoklonální gamapatií: popis případu a přehled léčebných možností. Transfuze Hematol dnes 2020; 26 (4): 310–319.
3. Zahradová L, Adam Z, Fait J et al. Nekrobiotický xantogranulom – vzácná kožní komplikace u nemocného s mnohočetným myelomem. Vnitr Lek 2010; 56 (Suppl 2): 179–182.
4. Sýkorová T. Histiocytózy z non-Langerhansových buněk. Klinická dermatovenerologie. Praha: Mladá fronta 2019 : 1027–1036.
5. Adam Z, Zahradová L, Krejčí M. Difuzní plošná normolipemická xantomatóza a nekrobiotický xantogranulom, asociované s monoklonální gamapatií – přínos PET-CT pro stanovení rozsahu nemoci a zkušenosti s léčbou. Popis dvou případů a přehled literatury. Vnitr Lek 2010; 56 (11): 1158–1159.
6. Adam Z, Veselý K, Motyčková I et al. Eyelids with yellow granulomas and cough – periocular xanthogranuloma associated with adult-onset asthma. A case study and an overview of clinical forms of juvenile xanthogranuloma and its therapy. Vnitr Lek 2012; 58 (5): 365–377.
7. Szalat R, Pirault J, Fermand JP et al. Physiopathology of necrobiotic xanthogranuloma with monoclonal gammopathy. J Intern Med 2014; 276 (3): 269–284. doi: 10.1111/joim.12195.
8. Szalat R, Arnulf B, Karlin L et al. Pathogenesis and treatment of xanthomatosis associated with monoclonal gammopathy. Blood 2011; 118 (14): 3777–3784. doi: 10.1182/blood-2011-05-356907.
9. Miguel D, Lukacs J, Illing T et al. Treatment of necrobiotic xanthogranuloma – a systematic review. J Eur Acad Dermatol Venereol 2017; 31 (2): 221–235. doi: 10.1111/jdv.13786.
10. Wick MR, Patterson JW. Cutaneous paraneoplastic syndromes. Semin Diagn Pathol 2019; 36 (4): 211–228. doi: 10.1053/j.semdp.2019.01.001.
11. Hilal T, DiCaudo DJ, Connolly SM et al. Necrobiotic xanthogranuloma: a 30-year single-center experience. Ann Hematol 2018; 97 (8): 1471–1479. doi: 10.1007/s00277-018-3301-1.
12. Khoschbin T, Löser C, Dippel E. Paraneoplastic skin diseases. Internist 2019; 60 (8): 775–782. doi: 10.1007/s00 108-019-0636-1.
13. Weidenthaler-Barth B. Clinical and histological spectrum of palisaded granulomatous dermatitides: granuloma annulare, necrobiosis lipoidica, rheumatoid nodules, and necrobiotic xanthogranuloma. Hautarzt 2017; 68 (7): 536–541. doi: 10.1007/s00105-017-39 95-3.
14. Nguyen BD. Hepatobiliary and pancreatic: hepatic necrobiotic xanthogranuloma. J Gastroenterol Hepatol 2017; 32 (10): 1667. doi: 10.1111/jgh.13858.
15. Santosaputri E, Ellis EJ, Nagiah S et al. A multisystem granulomatous disease: necrobiotic xanthogranuloma with hepatic involvement. Med J Aust 2014; 200 (8): 490–493. doi: 10.5694/mja13.11303.
16. Mello RB, Vale ECSD. Necrobiotic xanthogranuloma associated with smoldering multiple myeloma: satisfactory response to cyclophosphamide, dexamethasone, and thalidomide. An Bras Dermatol 2019; 94 (3): 337–340. doi: 10.1590/abd1806-4841.20198500.
17. Efebera Y, Blanchard E, Allam C et al. Complete response to thalidomide and dexamethasone in a patient with necrobiotic xanthogranuloma associated with monoclonal gammopathy: a case report and review of the literature. Clin Lymphoma Myeloma Leuk 2011; 11 (3): 298–302. doi: 10.1016/j.clml.2011.03.020.
18. Mahendran P, Wee J, Chong H et al. Necrobiotic xanthogranuloma treated with lenalidomide. Clin Exp Dermatol 2018; 43 (3): 345–347. doi: 10.1111/ced.13293.
19. Dholaria BR, Cappel M, Roy V. Necrobiotic xanthogranuloma associated with monoclonal gammopathy: successful treatment with lenalidomide and dexamethasone. Ann Hematol 2016; 95 (4): 671–672. doi: 10.1007/s00277-016-2604-3.
20. Ghani S, Al Ustwani O, Khalid B et al. Periorbital necrobiotic xanthogranuloma treated successfully with novel multiple myeloma therapy. Clin Adv Hematol Oncol 2013; 11 (10): 678–680.
21. Olson RM, Harrison AR, Maltry A et al. Periorbital necrobiotic xanthogranuloma successfully treated with intravenous immunoglobulin. Case Rep Ophthalmol 2018; 9 (1): 70–75. doi: 10.1159/000485 913.
22. Goyal A, O‘Leary D, Vercellotti G et al. Intravenous immunoglobulin for treatment of necrobiotic xanthogranuloma. Dermatol Ther 2019; 32 (1): e12744. doi: 10.1111/dth.12744.
23. Lukács J, Goetze S, Elsner P. Periocular necrobiotic xanthogranuloma successfully treated with intravenous immunoglobulin. Acta Derm Venereol 2017; 97 (6): 754–755. doi: 10.2340/00015555-2626.
24. Rubinstein A, Wolf DJ, Granstein RD. Successful treatment of necrobiotic xanthogranuloma with intravenous immunoglobulin. J Cutan Med Surg 2013; 17 (5): 347–350. doi: 10.2310/7750.2013.13012.
25. Liszewski W, Wisniewski JD, Safah H et al. Treatment of refraktory necrobiotic xanthogranulomas with extracorporeal photopheresis and intravenous immunoglobulin. Dermatol Ther 2014; 27 (5): 268–271. doi: 10.1111/dth.12135.
26. Nambudiri VE, McLaughlin C, Lo TC et al. Successful multimodality treatment of recalcitrant necrobiotic xanthogranuloma using electron beam radiation and intravenous immunoglobulin. Clin Exp Dermatol 2016; 41 (2): 179–182. doi: 10.1111/ced.12719.
27. Pedrosa AF, Ferreira O, Calistru A et al. Necrobiotic xanthogranuloma with giant cell hepatitis, successfully treated with intravenous immunoglobulins. Dermatol Ther 2015; 28 (2): 68–70. doi: 10.1111/dth.12211.
28. Haber R, Bachour J, Gemayel ME. Scleromyxedema treatment: systemic reviewand update. Intern J Dermatol 2020; 59 (10): 1191–1201. doi: 10.1111/ijd.14888.
29. Eltilib M, Fenner J, Saramago I et al. Necrobiotic xanthogranuloma on 18F-FDG PET/CT. Clin Nucl Med 2020; 45 (12): 967–969. doi: 10.1097/RLU.0000000000003 300.
30. Hou J, Long T, Hu S. Application of F-FDG-PET/CT in necrobiotic xanthogranuloma involving multiple organs. Eur J Nucl Med Mol Imaging 2021; 48 (1): 321–322. doi: 10.1007/s00259-020-04841-8.
31. Koukalová R, Selingerová I, Řehák Z a kol. FDG-PET/CT v diagnostice a hodnocení léčebné odpovědi Castlemanovy choroby – retrospektivní studie 29 případů z jednoho centra. Klin Onkol 2021; 34 (2): 120–127. doi: 10.48095/ccko2021120.
32. Azmy V, Neparidze N. Hyperbilirubinemia following lenalidomide administration. Clin Case Rep 2018; 6 (5): 875–877. doi: 10.1002/ccr3.1471.
33. Thoguluva Chandrasekar V, Faust TW, John S. Gilbert syndrome. Treasure Island: StatPearls Publishing 2022.
34. Jirsa M, Sticová E. Neonatal hyperbilirubinemia and molecular mechanisms of jaundice. Vnitr Lek 2013; 59 (7): 566–571.
35. Zmetáková I, Čierna I, Székyová D et al. Molekulová diagnostika dedičných nekonjugovaných hyperbilirubinémií na Slovensku. Čes-slov Pediat 2009; 64 (5): 223–229.
36. Vítek L. The role of bilirubin and UGT1A1 mutations in health and disease Prague medical report. Prague: Karolinum 2004–2008 : 122–124.
37. Fremuth J, Sýkora J, Boday A et al. Analýza UGT 1A1*28 polymorfismu v oblasti TATA-box promotoru genu pro UDP-glukuronyltransferázu u Gilbertova syndromu v dětském věku. Čes-slov Pediat 2005; 60 (1): 7–13.
38. King D, Armstrong MJ. Overview of Gilbert‘s syndrome. Drug Ther Bull 2019; 57 (2): 27–31. doi: 10.1136/dtb. 2018.000028.
39. Slachtova L, Seda O, Behunová J et al. Genetic and biochemical study of dual hereditary jaundice: Dubin-Johnson and Gilbert‘s syndromes. Haplotyping and founder effect of deletion in ABCC2. Eur J Hum Genet 2016; 24 (5): 704–709. doi: 10.1038/ejhg.2015.181.
40. Memon N, Weinberger BI, Hegyi T et al. Inherited disorders of bilirubin clearance. Pediatr Res 2016; 79 (3): 378–386. doi: 10.1038/pr.2015.247.
41. Zanella M, Rubia-Brandt L, Giostra E et al. A case of drug--induced hepatitis due to lenalidomide. Case Rep Gastroenterol 2011; 5 (1): 217–222. doi: 10.1159/000326935.
42. Nojkov B, Signori C, Konda A et al. Lenalidomide-associated hepatotoxicity – a case report and literature review. Anticancer Res 2012; 32 (9): 4117–4119.
43. Hussain S, Browne R, Chen J et al. Lenalidomide-induced severe hepatotoxicity. Blood 2007; 110 (10): 3814. doi: 10.1182/blood-2007-06-097758.
44. Zanella MC, Rubbia-Brandt L, Giostra E et al. A case of drug-induced hepatitis due to lenalidomide. Case Rep Gastroenterol 2011; 5 (1): 217–222. doi: 10.1159/ 000326935.
45. Jena RK, Swain TR, Kansurkar SS et al. Lenalidomide induced intrahepatic cholestasis in newly diagnosed patients of multiple myeloma. Eur J Clin Pharmacol 2012; 68 (5): 881–884. doi: 10.1007/s00228-011-1152-y.
Štítky
Dětská onkologie Chirurgie všeobecná Onkologie
Článek vyšel v časopiseKlinická onkologie
Nejčtenější tento týden
2022 Číslo 4- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejasný stín na plicích – kazuistika
- Hojení análních fisur urychlí čípky a gel
- Jak souvisí postcovidový syndrom s poškozením mozku?
- Cinitaprid – v Česku nová účinná látka nejen pro léčbu dysmotilitní dyspepsie
-
Všechny články tohoto čísla
- Onkologická léčba 21. století a Kaplan-Meierovy křivky
- Rosai-Dorfman-Destombesova choroba – histiocytární onemocnění se zánětlivými projevy
- Pacienti s karcinomy prezentujícími genovou fúzi neuregulinu 1 (NRG1) jsou kandidáty na teranostický přístup k výběru cílené léčby
- Olanzapin v onkologické paliativní péči
- Imunoterapia nádorových ochorení
- Jak únava ovlivňuje návrat do práce u pacientek s karcinomem prsu
- Informace z České onkologické společnosti
- Regulační síť kompetitivně interagujících RNA a účinnost radioterapie u nádorů rekta
- Současné podávání cisplatiny jednou týdně a radioterapie s modulovanou intenzitou svazku s využitím simultánního integrovaného boostu při léčbě pokročilého skvamocelulárního karcinomu hlavy a krku
- Pozvolný vzestup bilirubinu v průběhu léčby mnohočetného myelomu lenalidomidem, bortezomibem a dexametazonem (demaskování dříve nediagnostikovaného Gilbertova syndromu) a vymizení nekrobiotického xantogranulomu po dosažení kompletní remise myelomu
- Mikrovlnná ablace solitární jaterní metastázy kolorektálního karcinomu komplikované perforací žaludku a gastrokutánní píštělí – kazuistika
- Klinická onkologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Olanzapin v onkologické paliativní péči
- Imunoterapia nádorových ochorení
- Rosai-Dorfman-Destombesova choroba – histiocytární onemocnění se zánětlivými projevy
- Jak únava ovlivňuje návrat do práce u pacientek s karcinomem prsu
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání




