-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaPacienti s karcinomy prezentujícími genovou fúzi neuregulinu 1 (NRG1) jsou kandidáty na teranostický přístup k výběru cílené léčby
Patients with neuregulin 1 (NRG1) rearranged cancer are suitable for the theranostic approach and targeted therapy
Introduction: Neuregulin 1 (NRG1) gene fusion was detected in a wide range of carcinomas. It is most frequently present in lung adenocarcinomas, especially in KRAS and BRAF wild-type cases. Purpose: We present a newly described diverse group of NRG1 rearranged carcinomas. The paper explains basic molecular principles associated with this oncogenic driver. It consists of ERBB3 (HER3) and ERBB2 (HER2) receptor activation with downstream activation of PIK and MAPK canonical pathways. The experience with new therapeutic modalities is summarized. Conclusions: So far, the global results of cytotoxic, immune and targeted therapies were disappointing. Further research (including two studies in Europe) is underway, developing new therapeutic strategies and examining this cancer biology. In the meantime, it is possible to diagnose NRG1 rearranged carcinomas in the Czech Republic since mRNA next generation sequencing (NGS) analysis is readily available.
Keywords:
NRG 1 protein – neuregulin 1 – molecular targeted therapies – ERBB 2 protein – ERBB 3 protein – solid tumors
Autoři: O. Ondič 1,2; N. Ptáková 1,3; V. Janovský 4; J. Vančurová 4; M. Hósová 5; M. Michal 1; M. Pešek 6
Působiště autorů: Bioptická laboratoř s. r. o., Plzeň 1; Šiklův ústav patologie, LF UK a FN Plzeň 2; 2. LF UK, Praha 3; Onkologické oddělení, Nemocnice České Budějovice 4; Oddělení patologicko-anatomické, FN Bulovka, Praha 5; Klinika pneumologie a ftizeologie LF UK a FN Plzeň 6
Vyšlo v časopise: Klin Onkol 2022; 35(4): 271-275
Kategorie: Přehled
doi: https://doi.org/10.48095/ccko2022271Souhrn
Východiska: Fúze genu neuregulin 1 (NRG1) byla zjištěna u mnoha různých karcinomů. Nejčastěji u adenokarcinomů plic, a to zejména v těch bez mutace genů KRAS a BRAF. Cíl: Článek představuje nově popsanou různorodou skupinu karcinomů s fúzí genu NRG1. Vysvětluje základní molekulárně-genetické mechanizmy související s touto řídicí genovou alterací. Jde o aktivaci receptoru ERBB3 (HER3) a ERBB2 (HER2) s následnou iniciací kanonických onkogenních drah PIK a MAPK. Sumarizujeme dosavadní zkušenosti s novými léčebnými postupy. Závěr: Dosavadní celosvětové výsledky imunoterapie, cytotoxické a zatím zkoušené cílené léčby nejsou uspokojivé. Probíhají další léčebné studie (z toho dvě v Evropě) a výzkum biologie těchto karcinomů. NRG1 rearanžované karcinomy je možné diagnostikovat metodou mRNA sekvenace nové generace (NGS) i v podmínkách ČR.
Klíčová slova:
cílená léčba – NRG1 protein – neuregulin 1 – ERBB2 protein – ERBB3 protein – solidní nádory
Úvod
Onkogenní genové fúze, které zahrnují např. geny ALK, ROS1, RET a NTRK1, 2, 3, představují řídicí genové alterace (oncogenic drivers) a mohou vést k deregulované abnormální proliferaci buněk vlastního organizmu. Bývají detekovány v širokém spektru solidních nádorů. Proto jsou tyto genové fúze označovány i jako tumor agnostické markery. V současnosti existuje možnost ovlivnit je cílenou léčbou [1–12]. Nově se ve světě zaměřuje pozornost i na geny pro neuregulin (NRG) 1–4. Tyto čtyři proteiny jsou důležité pro embryonální vývoj nervové soustavy, srdce a dalších orgánů [13,14]. In vitro bylo prokázáno, že v onkogenezi nádorů se nejvíce uplatňuje protein NRG1 [15,16]. Jeho struktura obsahuje doménu podobnou epitelovému růstovému faktoru (epithelial growth factor – EGF), tzv. EGF-like doménu, kterou se váže na receptory ERBB – nejsnáze na receptor ERBB3 patřící do rodiny receptorů pro EGF, jejichž struktura byla recentně molekulárně-dynamicky modelována (obr. 1) [17,18]. Tento receptor následně v prostředí cytoplazmatické membrány buňky vytvoří dimer s druhým partnerským receptorem (nejčastěji ERBB2 nebo ERBB3). Tak nastane aktivace jejich cytoplazmatické složky vedoucí k aktivaci kanonických onkogenních cest PIK a MAPK (obr. 2).
Obr. 1. Molekulárně-dynamický model dimerizovaného receptoru z rodiny EGFR podle studie Arkhipova et al [17] a Tsai et al [18]. Červeně je vyznačena doména s vazebním místem pro ligand, kterým může být EGF-like doména neuregulinu. ![Molekulárně-dynamický model dimerizovaného receptoru z rodiny
EGFR podle studie Arkhipova et al [17] a Tsai et al [18]. Červeně je vyznačena doména
s vazebním místem pro ligand, kterým může být EGF-like doména neuregulinu.](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/7f5104169901bea04eb48f7d3ca6383e.jpg)
EGF – epidermální růstový faktor, POPC, POPS – modelová buněčná membrána sestávající z 1-palmitoyl-2-oleoyl-sn-glyc-ero-3-fosfocholinu a 1-palmitoyl-2-oleoyl-sn-glycero-3- -fosfoserinu. Obr. 2. Schematické znázornění aktivace kanonických onkogenních drah PIK, MAPK v buňce po aktivaci membránového receptoru ERBB3 neuregulinem 1 a následné dimerizaci s ERBB2. 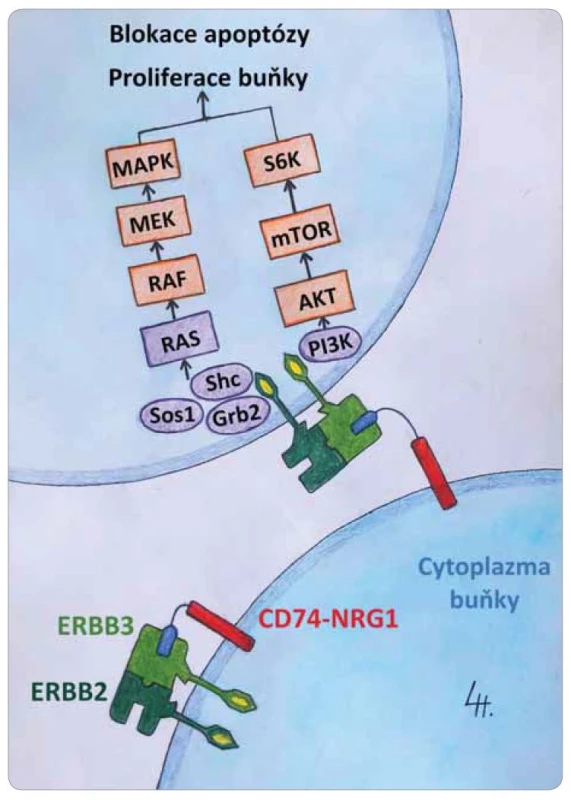
ERBB2, ERBB3 – receptory epidermálního růstového faktoru Incidence
Zdá se, že spektrum nádorů s funkční fúzí/rearanží genu NRG1 je vymezeno zejména karcinomy. Svědčí o tom publikované výsledky informačních analýz anonymizovaných dat sekvenace nádorů metodou sekvenace nové generace (next generation sequencing – NGS) z velkých center v USA i Evropě (tab. 1) [19–21]. Tyto nádory představovaly ≤ 0,2 % ze všech sekvenovaných nádorů s rovnoměrným zastoupením u mužů i žen. Publikované práce z Asie [22,23], Severní Ameriky [24,25] i Evropy [21,26] jednoznačně a shodně poukazují na fakt, že nejvyšší incidenci (7 %) nádorů s rearanží genu NRG1 prezentují invazivní adenokarcinomy plic. Přitom jejich specifická podskupina – karcinomy bez mutace genů BRAF a KRAS – obsahuje tuto genovou fúzi mnohem častěji.
Tab. 1. Spektrum orgánů s diagnostikovaným NRG1 rearanžovaným karcinomem dle publikovaných informačně-analytických studií velkých databází sekvenovaných nádorů. 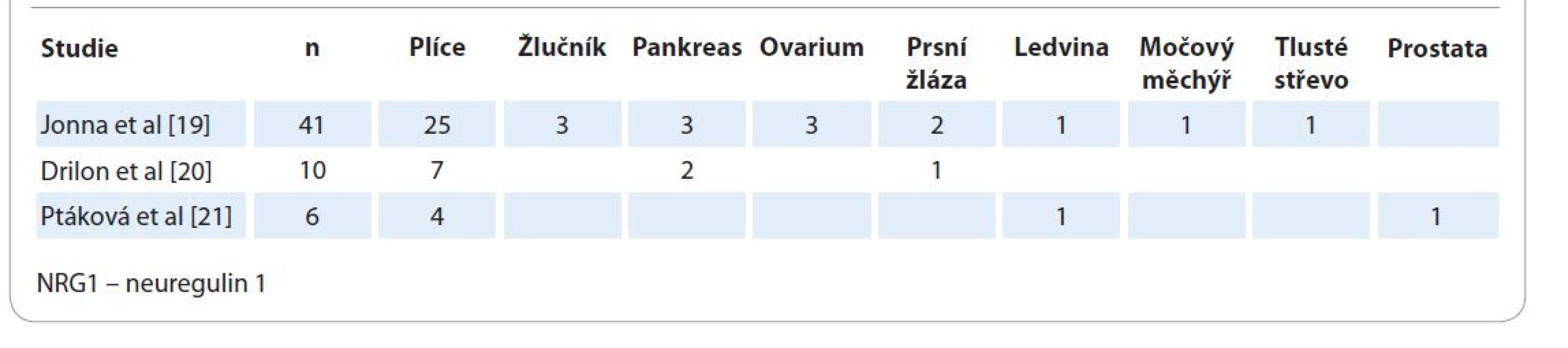
Studie dle Jonna et al navíc odhalila 1x sarkom bez udání lokality a 1x neuroendokrinní tumor nazofaryngu [19]. Článek autorů Dermawan et al je první prací, která popisuje minisérii 3 metastazujících vřetenobuněčných sarkomů s rearanží genu NRG1 u žen ve věku 32, 25 a 47 let vzniklých 2x na dolní končetině a 1×x v dutině děložní, s myoinvazí. Partnerskými geny byly PPHLN1, HMBOX1 a MTUS1 a s genem NRG1 tvořily funkční fúzní produkt [37]. Praktická diagnostika
V ČR jsme od roku 2018 k dnešnímu dni diagnostikovali 6 českých pacientů s NRG1 rearanžovaným karcinomem (tab. 2). Ve všech případech se jednalo o adenokarcinom, z toho pětkrát o invazivní mucinózní adenokarcinom plic. Čtyři pacienti byli diagnostikováni prospektivně. U jedné pacientky byl podán afatinib bez prokázaného efektu a následně zemřela [20]. Celkem zemřelo 5 pacientů a jeden žije se stabilizovaným onemocněním. Diagnostika NRG1 rearanžovaných karcinomů je založena na sekvenaci metodou NGS. Používá se DNA i RNA analýza. Zdá se, že mRNA NGS, kterou využívá i naše pracoviště, je pro tento účel senzitivnější, a tedy vhodnější metodou [25,27]. Dosavadní prezentované výsledky diagnostiky s využitím imunohistochemie a fluorescenční in situ hybridizace rozhodně nejsou přesvědčivé [21].
Tab. 2. Základní charakteristika českých pacientů s NRG1 rearanžovaným adenokarcinomem plic. 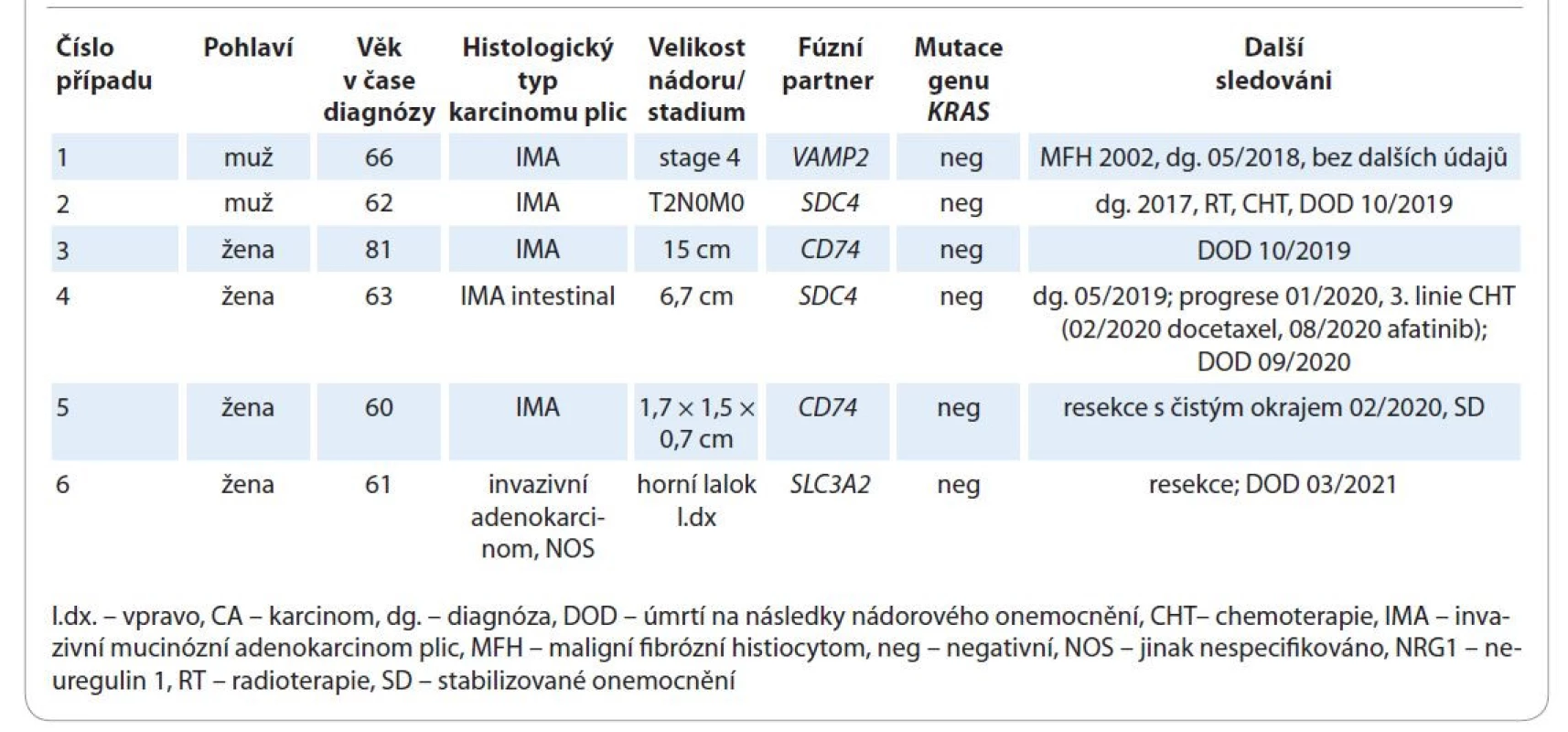
Terapie
V současnosti jsou připraveny desítky molekul cílících na různé domény receptorů ERBB2 (HER2), ERBB3 (HER3) [28–31]. Nejpokročilejší je klinické zkoušení afatinibu, který byl podán 20 pacientům [26,21] s NRG1 rearanžovaným karcinomem. Jednalo se o adenokarcinom plic (14×), karcinom pankreatobiliárního systému (4×), low-grade serózní karcinom ovaria (1×) a kolorektální karcinom (1×). Příznivá odpověď na léčbu byla zaznamenána u 14 pacientů, z toho parciální odpověď trvající 3–27 měsíců byla zaznamenána u 11 pacientů a stabilizace onemocnění (stable disease – SD) trvající 1,4–16 měsíců bylo dosaženo u 3 pacientů. Tyto výsledky nejsou uspokojivé. Povzbudivé nejsou ani pilotní výsledky imunoterapie podáváním checkpoint inhibitorů [27]. Podle práce Drilona et al se ukazuje, že mutační nálož (tumor mutational burden – TMB) a exprese PD-L1 u NRG1 rearanžovaných karcinomů jsou nízké. Hodnota TMB byla 0,9 (0–2,6; n = 11) mutací na megabázi – statisticky významně nižší ve srovnání se všemi nemalobuněčnými karcinomy plic (non-small cell lung cancer – NSCLC) i ve srovnání s NSCLC obsahujícími fúze genů ALK, ROS1, RET a NTRK [27]. Exprese PD-L1 byla negativní u 72 % (33/46), mírná exprese (1–49 %) u 24 % (11/46) a vysoká exprese (> 50 %) u 4 % (2/46) hodnocených karcinomů [27].
Výhled do budoucna
Přínos cílené léčby NRG1 rearanžovaných karcinomů s využitím molekul zaměřených na jiné receptory než pouze ERBB2 musí zhodnotit další prospektivní studie (tab. 3) [32–34]. Dále je v plánu (a v srpnu 2021 by měla začít) německá studie NCT04410653. Léčebný režim bude afatinib 40 mg denně až do progrese onemocnění či výrazných nežádoucích účinků. Do studie budou zváni pacienti s invazivním mucinózním karcinomem plic, adenokarcinomem pankreatu bez mutace genu KRAS a pacienti s jinými nádory [35]. Ukončení studie se plánuje na prosinec 2023. Obdobná studie NCT04814056 začala v červnu 2021 v Šanghaji v Číně [36]. Ve světle recentních poznatků bude zajímavé sledovat vývoj designu a výsledky všech naplánovaných studií. Do té doby však lze i v ČR pacienty prospektivně diagnostikovat. To jim do budoucna dá šanci dosáhnout na cílenou léčbu v souladu s aktuálním nastavením pravidel zdravotní péče, nebo možná i dříve v rámci výše zmíněných studií. Zejména bylo v osobní komunikaci prvního autora s garantem projektu (Alison Schram, M.D., z Memorial Sloan-Kettering Cancer Center) potvrzeno, že adekvátně diagnostikovaní pacienti za vhodných klinických okolností budou mít možnost využít cílené léčby přípravkem zenocutuzumab na některém ze 3 pracovišť (Salzburg, Hamburg, Heidelberg) v rámci studie NCT02912949 a na náklady této studie.
Tab. 3. Registrované prospektivní studie cílené léčby NRG1 rearanžovaných karcinomů. 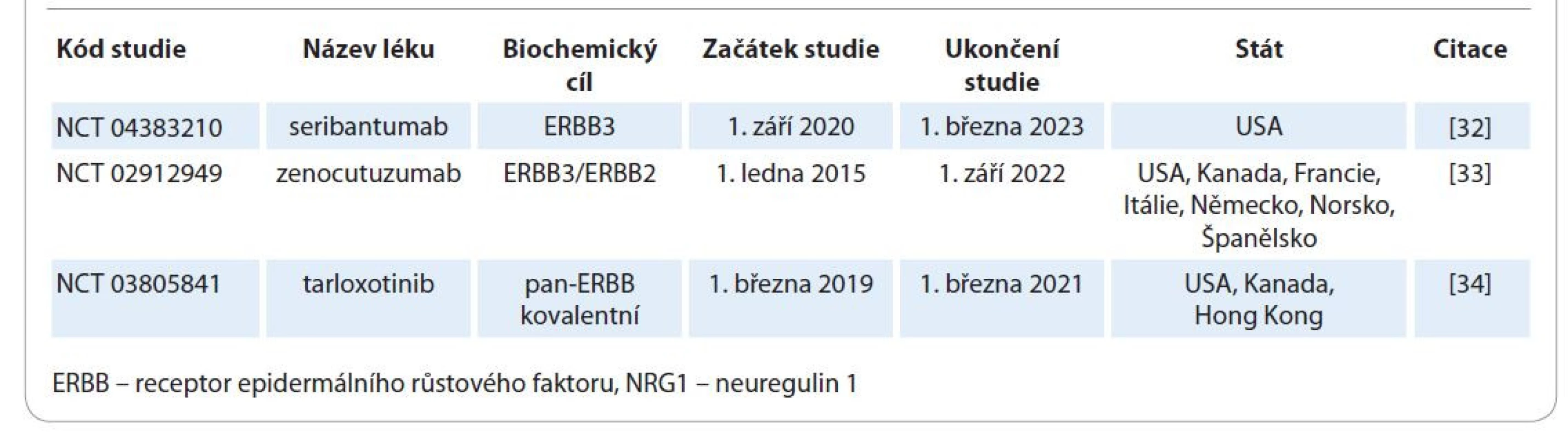
Lze doufat, že vyhlídky na přesnou diagnózu u pacientů s NRG1 rearanžovanými karcinomy v ČR i ve Slovenské republice jsou příznivé. Důvodem k optimizmu jsou propracované a celostátně dobře zavedené standardní postupy pro diagnostiku nemalobuněčných karcinomů plic. Dále pak přidání NRG1 genu mezi prediktivní markery, které lze vyšetřovat na žádost onkologa u pacientů s NSCLC a také u pacientů s méně častými nádory a nádory neznámého origa. Samozřejmě indikace vyšetření somatickým NGS panelem (NSCLC) by byla v kompetenci multidisciplinárního indikačního semináře komplexního onkologického centra. Testování metodou mRNA NGS by nejspíše bylo prováděno pouze u pacientů s adenokarcinomem plic, u kterých běžné reflexní testování neprokázalo přítomnost řídicí (driver) mutace genů KRAS (a BRAF).
To by mohlo vést k identifikaci NRG1 karcinomů s nejvyšší možnou efektivitou, jak bylo popsáno výše. Navíc by tyto zkušenosti dále mohly být inspirací pro zpřesnění diagnostiky dalších skupin doposud obtížně léčitelných malignit, např. (a zejména) karcinomů pankreatobiliárního systému.
Shrnutí
Práce popisuje novou geneticky definovanou skupinu karcinomů s fúzí genu NRG1. Vysvětluje základní molekulárně-genetické mechanizmy související s touto řídicí genovou alterací. Jde o aktivaci receptoru ERBB3 a ERBB2 s následnou iniciací kanonických onkogenních drah PIK a MAPK. Nejčastěji jde o adenokarcinomy plic. Dosavadní celosvětové výsledky imunoterapie, cytotoxické a zatím zkoušené cílené léčby, nejsou uspokojivé. Probíhají další léčebné studie zaměřené zejména na adenokarcinomy plic a duktální karcinomy pankreatu s fúzí NRG1. Dvě studie aktivní i v Evropě sledují účinek přípravků afatinib a zenocutuzumab. Rovněž se rozvíjí výzkum biologie těchto karcinomů. Již dnes lze NRG1 rearanžované karcinomy rutinně diagnostikovat metodou mRNA NGS i v podmínkách ČR. Za vhodných klinických okolností pak mohou důsledně diagnostikovaní pacienti reálně „dosáhnout“ na cílenou léčbu v rámci probíhajících klinických studií.
Poděkování
Autoři oceňují erudici a profesionalitu týmu molekulárních genetiků Bioptické laboratoře v Plzni. Děkujeme slečně Lucii Horské za provedení ilustrací.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.MUDr. Ondrej Ondič, Ph.D., FIAC
Šiklův ústav patologie
LF UK a FN Plzeň
Edvarda Beneše 1128/13
305 99 Plzeň-Bory
Obdrženo/Submitted: 21. 6. 2021
Přijato/Accepted: 24. 11. 2021
Zdroje
1. Schram AM, Chang MT, Jonsson P et al. Fusions in solid tumours: diagnostic strategies, targeted therapy, and acquired resistance. Nat Rev Clin Oncol 2017; 14 (12): 735–748. doi: 10.1038/nrclinonc.2017.127.
2. Rossi G, Jocolle G, Conti A et al. Detection of ROS1 rearrangement in non-small cell lung cancer: current and future perspectives. Lung Cancer 2017; 8 : 45–55. doi: 10.2147/LCTT.S120172.
3. Bronte G, Ulivi P, Verlicchi A et al. Targeting RET-rearranged non-small cell lung cancer: future prospects. Lung Cancer 2019; 10 : 27–36. doi: 10.2147/LCTT.S192830.
4. Subbiah V, Velcheti V, Tuch BB et al. Selective RET kinase inhibition for patients with RET-altered cancers. Ann Oncol 2018; 29 (8): 1869–1876. doi: 10.1093/annonc/mdy137.
5. Amatu A, Sartore-Bianchi A, Siena S. NTRK gene fusions as novel targets of cancer therapy across multiple tumour types. ESMO Open 2016; 1 (2): e000023. doi: 10.1136/esmoopen-2015-000023.
6. Hsiao SJ, Zehir A, Sireci AN et al. Detection of tumor NTRK gene fusions to identify patients who may benefit from tyrosine kinase (TRK) inhibitor therapy. J Mol Diagn 2019; 21 (4): 553–571. doi: 10.1016/j.jmoldx.2019.03.008.
7. Marcus L, Donoghue M, Aungst S et al. FDA approval summary: entrectinib for the treatment of NTRK gene fusion solid tumors. Clin Cancer Res 2021; 27 (4): 928–932. doi: 10.1158/1078-0432.CCR-20-2771.
8. Cocco E, Scaltriti M, Drilon A. NTRK fusion-positive cancers and TRK inhibitor therapy. Nat Rev Clin Oncol 2018; 15 (12): 731–747. doi: 10.1038/s41571-018-0113-0.
9. Hickman JA, Tannock IF, Meheus L et al. The European Union and personalised cancer medicine. Eur J Cancer 2021; 150 : 95–98. doi: 10.1016/j.ejca.2021.03.013.
10. Svaton M, Pešek M. Successful therapy of Czech patients with ROS1 translocation by crizotinib. Klin Onkol 2016; 29 (1): 63–65. doi: 10.14735/amko201663.
11. Bratova M, Karlinova B, Skrickova J et al. Non-small cell lung cancer as a chronic disease – a prospective study from the Czech TULUNG registry. In Vivo 2020; 34 (1): 369–379. doi: 10.21873/invivo.11783.
12. Brat K, Bratova M, Skrickova J et al. Real-life effectiveness of first-line anticancer treatments in stage IIIB/IV NSCLC patients: data from the Czech TULUNG registry. Thorac Cancer 2020; 11 (11): 3346–3356. doi: 10.1111/1759-7714.13679.
13. Meyer D, Yamaai T, Garratt A et al. Isoform-specific expression and function of neuregulin. Development 1997; 124 (18): 3575–3586. doi: 10.1242/dev.124.18.3575.
14. Falls DL. Neuregulins: functions, forms, and signaling strategies. Exp Cell Res 2003; 284 (1): 14–30. doi: 10.1016/s0014-4827 (02) 00102-7.
15. Hynes NE, MacDonald G. ErbB receptors and signaling pathways in cancer. Curr Opin Cell Biol 2009; 21 (2): 177–184. doi: 10.1016/j.ceb.2008.12.010.
16. Hobbs SS, Coffing SL, Le AT et al. Neuregulin isoforms exhibit distinct patterns of ErbB family receptor activation. Oncogene 2002; 21 (55): 8442–8452. doi: 10.1038/sj.onc.1205960.
17. Arkhipov A, Shan Y, Das R et al. Architecture and membrane interactions of the EGF receptor. Cell 2013; 152 (3): 557–569. doi: 10.1016/j.cell.2012.12.030.
18. Tsai CJ, Nussinov R. Emerging allosteric mechanism of EGFR activation in physiological and pathological contexts. Biophys J 2019; 117 (1): 5–13. doi: 10.1016/j.bpj.2019.05.021.
19. Jonna S, Feldman RA, Swensen J et al. Detection of NRG1 gene fusions in solid tumors. Clin Cancer Res 2019; 25 (16): 4966–4972. doi: 10.1158/1078-0432.CCR-19-0160.
20. Drilon A, Somwar R, Mangatt BP et al. Response to ERBB3-directed targeted therapy in NRG1-rearranged cancers. Cancer Discov 2018; 8 (6): 686–695. doi: 10.1158/2159-8290.CD-17-1004.
21. Ptáková N, Martínek P, Holubec L et al. Identification of tumors with NRG1 rearrangement, including a novel putative pathogenic UNC5D-NRG1 gene fusion in prostate cancer by data-drilling a de-identified tumor database. Genes Chromosomes Cancer 2021; 60 (7): 474–481. doi: 10.1002/gcc.22942.
22. Nakaoku T, Tsuta K, Ichikawa H et al. Druggable oncogene fusions in invasive mucinous lung adenocarcinoma. Clin Cancer Res 2014; 20 (12): 3087–3093. doi: 10.1158/1078-0432.CCR-14-0107.
23. Shim HS, Kenudson M, Zheng Z et al. Unique genetic and survival characteristics of ivasive mucinous adenocarcinoma of the lung. J Thorac Oncol 2015; 10 (8): 1156–1162. doi: 10.1097/JTO.0000000000000579.
24. Chang JC, Offin M, Falcon C et al. Comprehensive molecular and clinicopathologic analysis of 200 pulmonary invasive mucinous adenocarcinomas identifies distinct characteristics of molecular subtypes. Clin Cancer Res 2021; 27 (14): 4066–4076. doi: 10.1158/1078-0432.CCR-21-0423.
25. Laskin J, Liu SV, Tolba K et al. NRG1 fusion-driven tumors: biology, detection, and the therapeutic role of afatinib and other ErbB-targeting agents. Ann Oncol 2020; 31 (12): 1693–1703. doi: 10.1016/j.annonc.2020.08.2335.
26. Cadranel J, Liu SV, Duruisseaux M et al. Therapeutic potential of Afatinib in NRG1 fusion-driven solid tumors: a case series. Oncologist 2020; 26 (1): 7–16. doi: 10.1634/theoncologist.2020-0379.
27. Drilon A, Duruisseaux M, Han JY et al. Clinicopathologic features and response to therapy of NRG1 fusion-driven lung cancers: the eNRGy1 global multicenter registry. J Clin Oncol 2021; 39 (25): 2791–2802. doi: 10.1200/JCO.20.03307.
28. Gaborit N, Lindzen M, Yarden Y. Emerging anti-cancer antibodies and combination therapies targeting HER3/ERBB3. Hum Vaccin Immunother 2016; 12 (3): 576–592. doi: 10.1080/21645515.2015.1102809.
29. Mishra R, Patel H, Alanazi S et al. HER3 signaling and targeted therapy in cancer. Oncol Rev 2018; 12 (1): 355. doi: 10.4081/oncol.2018.355.
30. Schram AM, O’Reilly EM, Somwar R et al. Clinical proof of concept for MCLA-128, a bispecific HER2/3 antibody therapy, in NRG1 fusion-positive cancers. Mol Cancer Ther 2019; 18 (Suppl 12): PR02. doi: 10.1158/1535-7163.TARG-19-PR02.
31. Tirunagaru VG, Estrada-Bernal A, Yu H et al. Tarloxotinib exhibits potent activity in NRG1 fusion and rearranged cancers. Cancer Res 2019; 79 (Suppl 13): 2202a.
32. Study of seribantumab in adult patients with NRG1 gene fusion positive advanced solid tumors. [online]. Available from: https: //clinicaltrials.gov/ct2/show/NCT04383210?term=NCT04383210&draw=2&rank=1.
33. A study of zenocutuzumab (MCLA-128) in patients with solid tumors harboring an NRG1 fusion. [online]. Available from: https: //clinicaltrials.gov/ct2/show/NCT02912949?term=NCT02912949&draw=2&rank=1.
34. Study of tarloxotinib in Pts with NSCLC (EGFR exon 20 insertion, HER2-activating mutations) & other solid tumors with NRG1/ERBB gene fusions (RAIN). [online]. Available from: https: //clinicaltrials.gov/ct2/show/NCT03805841?term=NCT+03805841&draw=2&rank=131.
35. Afatinib in advanced NRG1-rearranged malignancies: the NCT/DKTK PMO-1604 phase-II trial. [online]. Availabe from: https: //clinicaltrials.gov/ct2/show/record/NCT04410653?view=record.
36. An open-labeled, single-arm clinical study to evaluate the efficacy of afatinib in treatment of locally advanced or metastatic non-small cell lung cancer with NRG1-fusion. [online]. Available from: https: //clinicaltrials.gov/ct2/show/record/NCT04814056.
37. Dermawan JK, Zou Y, Antonescu CR. Neuregulin 1 (NRG1) fusion-positive high-grade spindle cell sarcoma: a distinct group of soft tissue tumors with metastatic potential. Genes Chromosomes Cancer 2022; 61 (3): 123–130. doi: 10.1002/gcc.23008.
Štítky
Dětská onkologie Chirurgie všeobecná Onkologie
Článek vyšel v časopiseKlinická onkologie
Nejčtenější tento týden
2022 Číslo 4- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejasný stín na plicích – kazuistika
- Hojení análních fisur urychlí čípky a gel
- Jak souvisí postcovidový syndrom s poškozením mozku?
- Cinitaprid – v Česku nová účinná látka nejen pro léčbu dysmotilitní dyspepsie
-
Všechny články tohoto čísla
- Onkologická léčba 21. století a Kaplan-Meierovy křivky
- Rosai-Dorfman-Destombesova choroba – histiocytární onemocnění se zánětlivými projevy
- Pacienti s karcinomy prezentujícími genovou fúzi neuregulinu 1 (NRG1) jsou kandidáty na teranostický přístup k výběru cílené léčby
- Olanzapin v onkologické paliativní péči
- Imunoterapia nádorových ochorení
- Jak únava ovlivňuje návrat do práce u pacientek s karcinomem prsu
- Informace z České onkologické společnosti
- Regulační síť kompetitivně interagujících RNA a účinnost radioterapie u nádorů rekta
- Současné podávání cisplatiny jednou týdně a radioterapie s modulovanou intenzitou svazku s využitím simultánního integrovaného boostu při léčbě pokročilého skvamocelulárního karcinomu hlavy a krku
- Pozvolný vzestup bilirubinu v průběhu léčby mnohočetného myelomu lenalidomidem, bortezomibem a dexametazonem (demaskování dříve nediagnostikovaného Gilbertova syndromu) a vymizení nekrobiotického xantogranulomu po dosažení kompletní remise myelomu
- Mikrovlnná ablace solitární jaterní metastázy kolorektálního karcinomu komplikované perforací žaludku a gastrokutánní píštělí – kazuistika
- Klinická onkologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Olanzapin v onkologické paliativní péči
- Imunoterapia nádorových ochorení
- Rosai-Dorfman-Destombesova choroba – histiocytární onemocnění se zánětlivými projevy
- Jak únava ovlivňuje návrat do práce u pacientek s karcinomem prsu
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



