-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Olanzapin v onkologické paliativní péči
Olanzapine in oncology palliative care
Background: Olanzapine is an effective antipsychotic drug used in psychiatry to treat psychoses, especially schizophrenia and schizoaffective disorders. It belongs to the 2nd generation antipsychotics, its mechanism of action ranks among multireceptor antagonists (MARTA); it affects the dopamine, serotonin, adrenaline, histamine, and muscarinic systems. The broad pharmacodynamic profile of olanzapine provides for a broad indication spectrum with a better adverse effect profile compared to conventional antipsychotics. It can be used in a number of situations to benefit cancer patients in palliative care as well as in the terminal stages of the disease. Purpose: The review article presents possible indications for olanzapine in oncological palliative care. Apart from dealing with delirium and anxiety, indications for the use of antipsychotics in palliative medicine include the management of nausea, vomiting and loss of appetite. Olanzapine is an effective antiemetic in cancer patients with tumor-induced nausea and in antiemetic regimens for chemotherapy-induced nausea and vomiting. Olanzapine is an effective treatment for delirium, as effective as haloperidol, but with a lower toxicity profile. It increases appetite and can be used with advantage in patients with anorexia and weight loss. It is possible to use its anxiolytic and mood-stabilizing effects; in many situations, it can serve well as a co-analgesic, especially in the so-called total pain. It is proven to increase the quality of life of patients with advanced cancer. Conclusion: Due to its effect, simple dosage and a good safety profile, olanzapine is a useful drug for the routine clinical practice of an oncologist – a non-psychiatrist.
Keywords:
anxiety – delirium – palliative care – Nausea – sleep disorders – anorexia – olanzapine – total pain
Autoři: Z. Šoukalová
Působiště autorů: Onkologické oddělení, Nemocnice Jihlava
Vyšlo v časopise: Klin Onkol 2022; 35(4): 276-283
Kategorie: Přehled
doi: https://doi.org/10.48095/ccko2022276Souhrn
Východiska: Olanzapin je účinné antipsychotikum využívané v psychiatrii pro léčbu psychóz, zejména schizofrenie a schizoafektivních poruch. Patří mezi antipsychotika 2. generace, svým mechanizmem účinku se řadí mezi multireceptorové antagonisty (MARTA) a ovlivňuje jak dopaminový, tak serotoninový, adrenalinový, histaminový a muskarinový systém. Široký farmakodynamický profil olanzapinu je předpokladem pro široké indikační spektrum s lepším profilem nežádoucích účinků oproti klasickým antipsychotikům. S výhodou ho lze použít v řadě situací u onkologických pacientů v paliativní léčbě i v terminálních fázích nemoci. Cíl: Přehledový článek představuje možné indikace olanzapinu v onkologické paliativní péči. Indikace použití antipsychotik v paliativní medicíně zahrnují kromě řešení deliria a úzkosti i nevolnost, zvracení a nechutenství. Olanzapin je účinné antiemetikum u onkologických pacientů s nádorem indukovanou nevolností i v rámci antiemetických režimů při chemoterapií indukované nauzee a zvracení. Olanzapin je účinný prostředek v řešení delirantních stavů, stejně účinný jako haloperidol, ale s nižším profilem toxicity. Zvyšuje chuť k jídlu, lze jej tedy s výhodou využít u pacientů s anorexií a hubnutím. Lze využívat jeho anxiolytický a náladu stabilizující efekt a v řadě situací jej lze podávat i jako koanalgetikum, zejména u tzv. celkové bolesti („total pain“). Prokazatelně zvyšuje kvalitu života pacientů s pokročilým onkologickým onemocněním. Závěr: Díky svému účinku, jednoduchému dávkování a dobrému bezpečnostnímu profilu představuje olanzapin užitečný lék pro běžnou klinickou praxi onkologa – nepsychiatra.
Klíčová slova:
úzkost – paliativní péče – delirium – nespavost – nechutenství – olanzapin – nevolnost – celková bolest
Úvod
Paliativní péče u onkologického pacienta má za cíl zlepšovat, nebo aspoň udržet kvalitu života v období, kdy je nemoc inkurabilní. Onkologické onemocnění ve všech svých fázích může provázet řada potíží, jako je bolest, dušnost, nevolnost, nechutenství, úbytek na váze, únava a slabost, zvracení, průjem, zácpa apod. Onkologické onemocnění nepřináší jen potíže somatické, ale i psychické, jako jsou úzkost, deprese, poruchy spánku a v terminálních fázích onemocnění nejsou vzácné ani delirantní stavy. Úspěšná onkologická léčba není otázkou jen redukce nebo eradikace nádorové masy, ale i otázkou intenzivního řešení potíží, které onemocnění přináší. Onkolog je proto odborníkem nejenom na protinádorovou léčbu, ale i na zvládnutí symptomů nemoci, na tzv. podpůrnou léčbu. Psychofarmaka jsou skupina léčiv, ve kterých se obvykle onkologové necítí jisti, a z řady důvodů používají poměrně úzké spektrum léčiv. V následujícím přehledu je představen olanzapin, účinné psychofarmakum, které může onkolog využít v řadě „nepsychotických“ indikací u onkologického pacienta.
Antipsychotika – úvod pro nepsychiatra
Antipsychotika (dříve neuroleptika) patří mezi psychofarmaka primárně používaná v psychiatrii k léčbě psychóz, bipolárních afektivních poruch, jinak nezvladatelných úzkostí, depresí či k tlumení agitovanosti, agresivity a psychomotorického neklidu. Dále jsou využívána pro řešení delirantních stavů.
Efekt antipsychotik je daný působením na mediátorové systémy mozku, a to blokádou různých receptorů, zejména dopaminergních. Přesný mechanizmus antipsychotického účinku není dosud objasněn. Pro všechna antipsychotika je společné, že blokují dopaminové D2, příp. D3 receptory v mozku (v současnosti je popsáno 5 podtypů dopaminových receptorů D1–D5). Dopamin je důležitý neurotransmiter v mozku, při nadměrné stimulaci dopaminergního systému vzniká neklid, napětí, hostilita až agresivita. Dopamin hraje důležitou roli při činnostech důležitých pro zachování života a rodu: při příjmu potravy a tekutin a při sexualitě; díky dopaminu je toto chování spojeno s pocitem uspokojení. Zvýšení hladiny dopaminu v mozku u pacientů s psychózou je pravděpodobným podkladem narušeného zpracování informací, čímž dochází k odchylnému připsání významu nedůležitým podnětům. Hyperdopaminergní stav je způsobený zvýšenou syntézou dopaminu presynapticky a zároveň zvýšeným uvolněním dopaminu ze synapsí, což bylo opakovaně prokázáno pomocí PET a zvýšení vychytávání 18F-DOPA v bazálních gangliích [1]. V mozku jsou dopaminové D2 receptory umístěny v bazálních gangliích, hypofýze, limbickém systému, temporální kůře a v area postrema [2]. Jednotlivé oblasti zodpovídají za různé antipsychotické účinky. Předpokládá se, že blokáda D2 receptorů v bazálních gangliích se podílí na úpravě některých kognitivních funkcí, jako je např. motorické tempo a exekutivní funkce. V mezolimbickém systému snižuje blokáda D2 emoční naléhavost psychotické produkce a v mezokortikálních oblastech je spojena s úpravou poruch myšlení, vnímání a kognitivních funkcí. Area postrema ovlivňuje centrum zvracení. Blokáda D2 receptorů antipsychotiky nebo thiethylperazinem i metoklopramidem má v area postrema antiemetický účinek. Blokáda D2 receptorů je však zodpovědná i za nežádoucí antidopaminergní účinky, zejména extrapyramidový hypertonicky-hypokinetický syndrom a za hyperprolaktinemii.
Antipsychotika se dělí na tři skupiny: 1. generace neboli klasická antipsychotika, 2. generace neboli atypická antipsychotika a třetí je skupina dopaminergních stabilizátorů (tab. 1).
Tab. 1. Přehled antipsychotik. Upraveno podle [2]. ![Přehled antipsychotik. Upraveno podle [2].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/35bf273cb63cdeb0d54fd31175775627.jpg)
Klasická antipsychotika se vážou na D2 receptory silně a dlouhodobě. PET vyšetření ukázala, že minimální obsazenost D2 receptorů ve striatu musí k dosažení antipsychotického působení činit 40–60 %. Pokud však přesáhne 80 %, vzniknou extrapyramidové nežádoucí účinky [3].
Antipsychotika 2. generace, na rozdíl od klasických antipsychotik 1. generace, povětšinou blokují D2/D3 receptory selektivně extrastriatálně. Vazba na tyto dopaminové receptory je oproti antipsychotikům 1. generace volnější, s vyšší disociační konstantou a kratším poločasem. To zodpovídá za lepší toleranci, nižší výskyt extrapyramidových účinků, hyperprolaktinemie a vyšší efektivitu oproti preparátům z 1. generace. Dělí se dle receptorového profilu na 1) selektivní dopaminové antagonisty, 2) serotoninové a dopaminové antagonisty (SDA) a 3) mnohočetné receptorové antagonisty (MARTA).
Antipsychotika 2. generace patřící do skupiny MARTA jsou antagonisté více typů receptorů; kromě blokády D2 receptorů antagonizují i serotoninové, histaminové, muskarinové a adrenergní receptory. V tab. 2 je shrnutí účinků blokády jednotlivých podskupin receptorů – jak těch žádoucích, tak i nežádoucích. Blokáda dopaminových receptorů D2 zodpovídá za antipsychotický a antiemetický efekt, ale i za zmiňované extrapyramidové účinky, tarditivní dyskinézy, příp. hyperprolaktinemii. Ovlivnění serotoninového systému vysvětluje účinek na negativní příznaky schizofrenie, na kognitivní příznaky, zejména paměť, depresivní příznaky a zároveň vysvětluje menší výskyt extrapyramidových nežádoucích účinků. Blokáda alfa-adrenergních, muskarinových a histaminových receptorů je zodpovědná spíše za vedlejší účinky, jako jsou hypotenze s rizikem pádu, sucho v ústech, prodloužení QT intervalu, sedace a zvýšení hmotnosti.
Tab. 2. Předpokládané klinické efekty blokády receptorových systémů ovlivňovaných antipsychotiky. Převzato z [5]. ![Předpokládané klinické efekty blokády receptorových systémů ovlivňovaných antipsychotiky. Převzato z [5].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/11e46cf69ef61fe6831c9b317be0818b.jpg)
Olanzapin
Olanzapin je antipsychotikum 2. generace patřící do skupiny MARTA. V předklinických studiích vykazuje olanzapin širokou afinitu k řadě receptorů pro serotonin (5HT2A/2C, 5HT3, 5HT6) a dopamin (D1–D5); ovlivňuje cholinergní a muskarinové receptory (M1–M5), alfa1-adrenergní a histaminové H1 receptory. Olanzapin vykazoval in vitro větší afinitu k serotoninovým 5HT2 receptorům než k dopaminovým D2 receptorům a vyšší 5HT2 než D2 aktivitu na in vivo modelech [4]. Přehled míry blokace jednotlivých receptorů ukazuje tab. 3. Elektrofyziologické studie ukázaly, že olanzapin selektivně snižuje aktivitu mezolimbických dopaminergních neuronů bez výraznějšího účinku na striatální dráhy ovládající motoriku. Proto u něj nemusíme mít obavy z extrapyramidových příznaků. Vyšší afinita k serotoninovým receptorům nám umožňuje podávat olanzapin i při úzkostně-depresivních stavech a při poruchách spánku. Znalost receptorového profilu olanzapinu vysvětluje možnost jeho použití v širších indikacích mimo psychózy, a to s lepším profilem nežádoucích účinků. V tab. 4 můžeme vidět míru blokády jednotlivých receptorů ve srovnání s nejznámějšími antipsychotiky. Olanzapin nevyvolává obávané extrapyramidové příznaky ani hyperprolaktinemii a nemá vliv na prodloužení QT intervalu. Zato má větší sedativní účinky a zvyšuje hmotnost, čehož lze využít i s terapeutickým záměrem.
Tab. 3. Míra blokace jednotlivých receptorů. Upraveno podle [6]. ![Míra blokace jednotlivých receptorů. Upraveno podle [6].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/b6d1c97bda9dc5c8dc4fe5481c4cb6c7.jpg)
Tab. 4. Nežádoucí účinky olanzapinu. 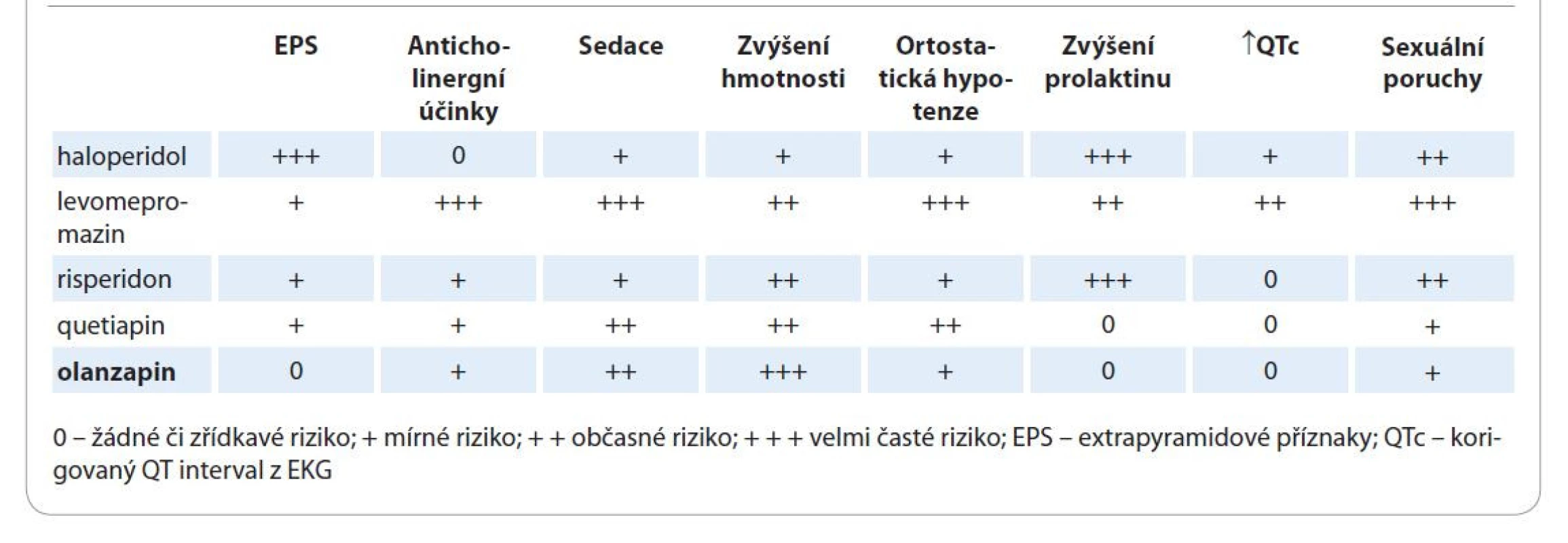
Indikace olanzapinu v onkologii a paliativní medicíně
Nauzea a zvracení po chemoterapii
Nejznámější použití olanzapinu v onkologii je v tzv. olanzapinovém antiemetickém režimu. Je účinný v akutní i opožděné nevolnosti při podání vysoce i středně emetogenní chemoterapie. Může se podávat v kombinaci s palonosetronem a kortikoidy. V profylaxi opožděné nevolnosti je dokonce účinnější než aprepitant [7]. Přidání olanzapinu ke standardní dvojkombinaci setron a kortikoid místo přidání aprepitantu je výhodné kromě ceny i v možnosti podání už během prvního cyklu chemoterapie.
V profylaxi akutního zvracení je čtyřkombinace palonosetron + NK1 inhibitor + dexametazon + olanzapin účinná až v 95 %. Dle posledních dat se tato čtyřkombinace může stát novým standardem v antiemetické terapii u vysoce emetogenní chemoterapie založené na cisplatině [8].
Nauzea a zvracení v paliativní péči
Nauzea a nechutenství jsou častými projevy samotného onkologického onemocnění bez ohledu na léčbu cytostatiky. Nevolnost u pokročilého onkologického onemocnění může být způsobená řadou příčin, od samotného postižení trávicího traktu přes různé metabolické příčiny při selhávání jater, ledvin, hyperkalcemii, acidóze apod. až po příčiny jako nedostatečně tlumená bolest, úzkost nebo i soor v dutině ústní či úporná zácpa.
Zvracení je koordinováno v prodloužené míše několika cestami: z periferie přes n. vagus a nn. splanchnici (vedoucí z nitrobřišních orgánů), přes vestibulární systém (H1 histaminové a M1 cholinergní receptory), centrálně z vyšších center mozku (např. při anticipačním zvracení při chemoterapii) a přes area postrema. Area postrema se nachází uvnitř dorzálního povrchu prodloužené míchy, na spodině čtvrté mozkové komory a obsahuje tzv. chemoreceptorovou spouštěcí zónu. Jedná se o bohatě cévně zásobenou oblast, která nemá hematoencefalickou bariéru a tím může být přístupná metabolitům z mozkomíšního moku i z krve, zatímco centrum pro zvracení je uloženo za hematoencefalickou bariérou. Stimulací řady receptorů (opioidní, 5HT3 a D2 dopaminové receptory), které se zde nacházejí, je zachycen signál z periferie, který je převeden dále do centra zvracení, které je odpovědné za vyvolání zvracení. Zde je místo působení olanzapinu jako antiemetika, zejména blokádou 5HT2 a 5HT3 receptorů, ale i D2, H1 a muskarinových receptorů.
Velká většina klinických studií je zaměřena na roli olanzapinu jako antiemetika během emetogenní onkologické léčby. Studií zkoumajících efekt olanzapinu v paliativní péči není mnoho. V roce 2019 byla publikována randomizovaná, dvojitě zaslepená, placebem kontrolovaná studie, která zkoumala bezpečnost a účinnost olanzapinu jako antiemetika u pacientů s pokročilým onkologickým onemocněním, kteří nebyli léčeni chemoterapií nebo radioterapií [9]. Studie se účastnilo 30 pacientů, kteří měli chronickou nevolnost hodnocenou v numerické škále 0–10; vstupním kritériem byla nutná intenzita nevolnosti > 3. Pacientům byl podáván olanzapin v dávce 5 mg/den po dobu 1 týdne nebo placebo. Po týdnu užívání byl v rameni s olanzapinem zaznamenán pokles nevolnosti o 8 bodů oproti skupině s placebem (95% CI 7–8; p < 0,001). Pacienti v rameni s olanzapinem hlásili nejenom menší nevolnost, nižší nutnost užívání jiných antiemetik a lepší chuť k jídlu, ale i menší sedaci a únavu a lepší celkovou pohodu. Žádný z pacientů, kteří dostávali olanzapin, nezaznamenal nadměrnou sedaci nebo jiné nežádoucí účinky.
Zvláštní situací, kde může být olanzapin použit, je opioidy navozená nevolnost. Zahájení léčby opioidy bývá relativně často spojené s výskytem nauzey a zvracení. Prevalence u nauzey je 8–35 % a u zvracení 14–40 % [10]. Tyto symptomy vznikají na podkladě přímé interakce morfinu s opioidními receptory v area postrema. Po 7–10 dnech se vůči nežádoucím účinkům opioidů vytváří tolerance. Při zahajování opioidní analgetické medikace je proto vhodné poskytnout pacientům k dispozici účinné antiemetikum. Nejčastěji se používají metoklopramid a setrony, a to i přesto, že neproběhly klinické studie, které by v této indikaci prokázaly jejich efekt. V jedné multicentrické, dvojitě zaslepené studii byl efekt metoklopramidu a ondasetronu na opioidy navozenou nevolnost stejně účinný jako placebo [11]. Naopak olanzapin a risperidon v malých studiích účinnost prokázaly [12].
Nechutenství v paliativní péči
Nechutenství s malnutricí provází až 80 % nemocných s pokročilým onkologickým onemocněním. Nádorová anorexie je patofyziologický syndrom multifaktoriální etiologie, jejímž podkladem je komplexní metabolická porucha [13]. Přítomnost malignity vyvolává přes aktivaci cytokinů až systémovou zánětlivou odpověď, kde aktivace centrálních cytokinových systémů vyvolává nechutenství. Vztah k jídlu a apetit jsou regulovány i histaminergním systémem v mozku. Ten moduluje kromě spánkového rytmu, bdělosti, učení a paměti i kontrolu nad chutí k jídlu [14]. Blokádou histaminového receptoru H1 olanzapinem dochází ke zvýšené chuti k jídlu. V psychiatrii se jedná o účinek nežádoucí, protože u pacientů dochází k poměrně výraznému a nechtěnému nárůstu hmotnosti. Tento efekt však lze využít záměrně terapeuticky. Olanzapin byl v několika studiích testován u pacientů s mentální anorexií, kde prokázal určitý benefit [15].
V roce 2019 byly publikovány výsledky japonské studie, která zkoumala efekt nízké dávky olanzapinu na zvýšení chuti k jídlu u pacientů s pokročilým onkologickým onemocněním. U všech 80 pacientů bylo dokumentováno zvýšení příjmu potravy na 149 ± 12,2 % jejich obvyklého průměru. Olanzapin prokázal efekt na zvýšení chuti k jídlu i u poloviny pacientů, kteří vstupně netrpěli nevolnostmi. Tohoto efektu bylo dosaženo podáváním olanzapinu v dávce 1,5 mg/den, vyšší dávka již efekt nezvyšovala [16].
Delirium
Delirium je definováno jako akutní stav zmatenosti, poruchy pozornosti, kolísavého stavu vědomí a kolísavého psychomotorického tempa, ke kterému dochází v důsledku somatické nebo psychické choroby nebo poruchy přesahující adaptační schopnosti mozku. Je to nejčastější neuropsychiatrický syndrom u terminálně nemocných onkologických pacientů. Delirium je přítomno min. u 25–50 % hospitalizovaných a u 80–90 % pacientů v závěru života [17]. Podle převažujícího charakteru psychomotorických projevů se dělí na hyperaktivní (agitované), hypoaktivní a smíšené. Příčiny deliria jsou velmi rozmanité: organické poruchy CNS (tumor, metastázy, krvácení, encefalopatie po radioterapii), metabolické příčiny (hypoxie různé etiologie, hyperkapnie, jaterní a ledvinné selhání, poruchy acidobazické rovnováhy, hyponatremie, hyperkalcemie, dekompenzovaný diabetes mellitus), infekce, febrilie, sepse, oběhové příčiny (dehydratace, hypovolemie, srdeční selhání, šokové stavy), anemie, malnutrice, abstinenční syndrom, a to i při náhlém vysazení léků (alkohol, nikotin, benzodiazepiny, opioidy, kortikoidy, antidepresiva). Delirium může být potencováno i užíváním některých léků (anticholinergika, antikonvulziva, antidepresiva, antiemetika, antihistaminika, antiparkinsonika, neuroleptika, kortikosteroidy, nesteroidní antiflogistika a řada jiných). Mezi další významné faktory, které mohou vést k nástupu nebo prohloubení deliria, patří úzkost, deprese, nekontrolovaná bolest, nedostatek kvalitního spánku, cizí a rušné prostředí. U pacientů v pokročilých stadiích nemoci nacházíme často současně několik možných příčin.
Je zřejmé, že terapeutický přístup k pacientovi v deliriu musí být rovněž komplexní. Kromě farmakoterapie je důležitá i samotná prevence, odstranění možných příčin a další nefarmakologické postupy. Antipsychotika jsou však základem farmakoterapie delirií. Zlatým standardem je haloperidol, který však přináší riziko extrapyramidového syndromu, např. u pacientů s Parkinsonovou nemocí je kontraindikován. Ve srovnání s haloperidolem má olanzapin prokazatelně stejnou účinnost [18], ale s lepším bezpečnostním profilem, což potvrdil i nedávno provedený systematický přehled a metaanalýza 15 randomizovaných klinických studií [19]. Olanzapin s dalšími antipsychotiky 2. generace vykazoval nižší riziko výskytu extrapyramidového syndromu. Efektivitu olanzapinu ve srovnání s haloperidolem řešila i recentní nizozemská studie, jejíž výsledky byly publikovány v roce 2020. Šlo o randomizovanou klinickou studii fáze III, kdy bylo srovnáváno použití olanzapinu vs. haloperidolu při deliriu u hospitalizovaného pacienta s pokročilým onkologickým onemocněním [20]. Olanzapin prokázal stejnou účinnost jako haloperidol, jen s vyšším podílem sedace, což může být při noční agitovanosti u hyperaktivního deliria žádoucí efekt. Efektivita olanzapinu však může být ovlivněna věkem. V jedné jihokorejské studii byla prokázána nižší účinnost olanzapinu ve skupině pacientů starších 75 let oproti pacientům mladším 75 let. Ve věkové skupině 75+ odpovědělo na léčbu olanzapinem 28,5 % pacientů, přičemž u ostatních antipsychotik byla zaznamenána odpověď u 46,8 % pacientů. U pacientů ve věku ≤ 75 let však byla účinnost olanzapinu vyšší než u ostatních antipsychotik (haloperidol, risperidon a quetiapin). Bezpečnost byla stejná ve všech věkových kategoriích [21]. V případě deliria nasedajícího na demenci u geriatrických pacientů je proto nutné očekávat nižší účinnost.
V případě hyperaktivního deliria je někdy nutná jiná cesta podání než perorální tablety. Olanzapin je k dispozici také v orodispergovatelné formě, kdy se podává rozpustná tableta do úst sublingválně nebo na bukální sliznici. Zde dochází k poměrně rychlému vstřebání i při horší spolupráci pacienta. V psychiatrii je využívána depotní parenterální forma olanzapinu. V prostředí paliativní péče v USA je olanzapin poměrně často podáván subkutánně. V jedné studii [22] onkologickým pacientům v agitovaném deliriu, kteří nereagovali na parenterálně podávaný haloperidol, podávali olanzapin v dávce 5–10 mg s.c. každých 8 hodin po dobu 3 dnů, pak pokračovali v podávání haloperidolu. V ČR je olanzapin pro parenterální podávání registrovaný, není ale v současnosti hrazen ze zdravotního pojištění. Byla také publikována data o intravenózním použití olanzapinu v emergentní situaci u agitovaného pacienta v kombinaci s midazolamem [23], tato forma však v současnosti v ČR není dostupná.
Úzkost
Úzkost je jedním ze symptomů, který provází pokročilé onkologické onemocnění a který v závěru života vystupuje mnohdy do popředí. Úzkost je emoční stav vyjadřující strach a obavy, zlou předtuchu, která může přerůst do úzkostné poruchy v momentě, kdy adaptační mechanizmy osobnosti, schopnost vypořádat se s problémy a strategie řešení selhávají. Jde o situaci, kdy se strach, přirozená obranná reakce na ohrožení, stává problémem sám o sobě. Umění úzkost rozeznat a dobře na ni reagovat je součástí dobré praxe v onkologii i paliativní medicíně. Základem je psychoterapeutický přístup, vč. dobré komunikace, který lze v případě potřeby rozšířit o přístup farmakologický. K seznámení se s jednoduchými principy základního psychoterapeutického přístupu k pacientovi s úzkostí odkazuji na Doporučení ČSPM k léčbě symptomů v paliativní péči [17]. Základem krátkodobé péče jsou benzodiazepiny, které však po 3–4 týdnech ztrácejí svou účinnost, zvyšuje se riziko závislosti a úzkostných stavů při jejich vysazování. Pro dlouhodobou léčbu jsou léky volby farmaka z řad antidepresiv a antipsychotik.
Anxiolytické účinky a potenciální zmírnění depresivních symptomů olanzapinu lze vysvětlit jeho blokádou zejména serotoninových receptorů 5HT2 a 5HT3. V psychiatrii je anxiolytický efekt olanzapinu známý. Několik randomizovaných studií v psychiatrii prokázalo efekt olanzapinu na generalizovanou úzkostnou poruchu vyskytující se paralelně u pacientů se schizofrenií [24]. Studie prokazující anxiolytický efekt v paliativní medicíně dosud chybí.
Deprese
Olanzapin se využívá v psychiatrii jako augmentace antidepresivní medikace u refrakterních depresivních stavů a je součástí léčby bipolární deprese. Využívá se jeho účinek na stabilizaci nálady, a proto je běžně předepisován i v situacích, kdy pacient netrpí psychotickými symptomy [25]. V paliativní indikaci lze olanzapin přidat k běžnému antidepresivu (např. SSRI) do kombinace, kdy kromě jiných účinků potencuje antidepresivní efekt.
Poruchy spánku
Velká část onkologických pacientů v paliativní péči přes únavu a slabost trpí nespavostí nebo poruchami spánkového rytmu. Terapie nespavosti vyžaduje komplexní přístup, kde kromě farmakoterapie jsou neméně důležitá režimová opatření a psychoterapeutický přístup. Olanzapin díky působení na histaminergní a muskarinové receptory vyvolává sedaci, která může být využívána při poruchách spánku. Olanzapin a antipsychotika vůbec nejsou při farmakoterapii lékem první volby; psychiatrická společnost dokonce ve svých doporučených postupech uvádí, že olanzapin a quetiapin můžou být v léčbě nespavosti vyzkoušeny jen ve zcela výjimečných případech, neboť jejich pozitivní účinek nebyl publikovanými studiemi prokázán a mohou mít závažné nežádoucí účinky. V opozici stojí doporučené postupy pro praktické lékaře, které užití antipsychotik (tiapridalu, olanzapinu a risperidonu) dokonce favorizují před benzodiazepiny (BZD) a benzodiazepinům podobnými hypnotiky – zolpidemem a zopiklonem (benzodiazepine receptor stimulating agents – BZRA), protože patří mezi synchronizátory biologických rytmů. Autoři tuto preferenci vysvětlují schopností BZD a BZRA ovlivnit nejen start a kontinuitu spánku, ale právě i synchronizaci biologických rytmů [26], co lze využít i v paliativní medicíně. Olanzapin lze použít v situacích, kdy se u pacienta kombinují potíže, ve kterých může být olanzapin účinný, jako je úzkost, nechutenství a počínající delirantní stavy, nebo když se chceme vyhnout benzodiazepinům a klasická hypnotika jsou bez efektu.
Bolest
Bolest často chápeme jen jako nepříjemný nociceptivní prožitek vyvolaný fyzickým poškozením tkání. Holistický přístup k bolesti definuje koncept tzv. celkové bolesti „total pain“, kdy popisuje celkové utrpení člověka vč. emocionálních, sociálních a duchovních zdrojů bolesti a utrpení. Je pochopitelné, že úzkost, beznaděj, deprese, samota, celková psychická nepohoda fyzickou bolest prohlubují. Někdy se pro pacienty fyzický popis bolesti stává jednoduchým symbolem jejich celkového utrpení a veškerá symptomatologie „se točí“ jen kolem bolesti. Podávání samotných analgetik však v této situaci obvykle není účinné. Pokud pacient udává intenzivní bolest refrakterní na standardní neopioidní a opioidní analgetika, je vhodné přehodnotit, zda se nejedná o komplexní syndrom celkové bolesti. V tom případě jsou vhodná koanalgetika ze skupiny psychofarmak, která fungují jako „psychoanalgetika“. Olanzapin je vhodný u pacientů, kde je bolest provázená neúměrným neklidem, úzkostí a nespavostí.
Olanzapin – praktické informace
Olanzapin je dostupný v perorální formě, jako potahovaná tableta nebo tableta dispergovatelná v ústech je vhodná pro pacienty s polykacími potížemi nebo s menší mírou spolupráce, např. při deliriu. V psychiatrii je ještě dostupná parenterální depotní forma. Startovací dávka je 5 mg, maximální dávka je 20 mg. Nejnižší dostupná síla je 2,5 mg, řada tablet má dělicí rýhu pro půlení tablety. Lék se díky delšímu poločasu podává 1× denně, obvykle ve večerní dávce. Olanzapin lze podávat bez ohledu na jídlo, protože absorpce není ovlivňována potravou. Další farmakokinetické informace jsou uvedeny v tab. 5.
Tab. 5. Základní klinické a farmakokinetické informace. Upraveno podle [27]. ![Základní klinické a farmakokinetické informace. Upraveno podle [27].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/b0fc1e65a735ae5966983131e65bbdbd.jpg)
Z nežádoucích účinků je nejčastější již zmiňovaná sedace – je závislá na dávce; řešením může být jen snížení dávky. Z méně častých nežádoucích účinků olanzapinu nutno zmínit ortostatickou hypotenzi s rizikem pádu, metabolické změny, jako je zvýšení hladiny cholesterolu, glukózy a triglyceridů, periferní edémy a mírné anticholinergní účinky vč. obstipace a pocitu suchosti v dutině ústní. Vzhledem k tomu, že dávky používané v paliativní medicíně jsou nižší než při použití z psychiatrických indikací, výskyt těchto nežádoucích účinků je zanedbatelný.
Největší překážkou v preskripci olanzapinu je při úhradě pojišťovnou vazba na odbornost psychiatra. Řešení je v tzv. delegování preskripce psychiatrem nebo předpis s úhradou pacienta. Cena balení se při dávce 10 mg/den pohybuje kolem 160 Kč/měsíc, při dávce 5 mg/den pak okolo 85 Kč/měsíc (údaje k červenci 2021).
Závěr
Olanzapin v rukou onkologa může vést ke zvýšení kvality života u pacientů s pokročilým onkologickým onemocněním. Olanzapin lze použít u pacientů s nevolností, zvracením, nechutenstvím, hubnutím, v delirantních stavech, v situacích psychického distresu, s vědomím jeho anxiolytického a sedativního účinku. V případě refrakterní bolesti lze zvážit jeho použití jako koanalgetika. Díky svému účinku, jednoduchému dávkování a dobrému bezpečnostnímu profilu představuje olanzapin užitečný lék pro běžnou klinickou praxi onkologa-nepsychiatra.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.MUDr. Zuzana Šoukalová
Onkologické oddělení
Nemocnice Jihlava
Vrchlického 59
586 01 Jihlava
e-mail: soukalovaz@nemji.cz
Obdrženo/Submitted: 3. 8. 2021
Přijato/Accepted: 24. 10. 2021
Zdroje
1. Fusar-Poli P, Meyer-Lindenberg A. Striatal presynaptic dopamine in schizophrenia, part II: meta-analysis of [ (18) F/ (11) C]-DOPA PET studies. Schizophr Bull 2013; 39 (1): 33–42. doi: 10.1093/schbul/sbr180.
2. Kopeček M. Aktualizované klinické a teoretické aspekty podávání antipsychotik. Klin Farmakol Farm 2012; 26 (1): 18–29.
3. Arakawa R, Takano A, Halldin C. PET technology for drug development in psychiatry. Neuropsychopharmacol Rep 2020; 40 (2): 114–121. doi: 10.1002/npr2.12084.
4. SPC Olanzapin Actavis. [online]. Dostupné z: https: // www.sukl.cz/download/spc/SPC2111.pdf.
5. Kopeček M. Klinické a teoretické aspekty podávání antipsychotik (neuroleptik). Remedia 2002; 12 : 447–465.
6. Leucht S, Corves C, Arbter D et al. Second-generation versus first-generation antipsychotic drugs for schizophrenia: a meta-analysis. Lancet 2009; 373 (9657): 31–41. doi: 10.1016/S0140-6736 (08) 61764-X.
7. Navari RM, Gray SE, Kerr AC. Olanzapine versus aprepitant for the prevention of chemotherapy-induced nausea and vomiting: a randomized phase III trial. J Support Oncol 2011; 9 (5): 188–195. doi: 10.1016/j.suponc.2011.05.002.
8. Hashimoto H, Abe M, Tokuyama O et al. Olanzapine 5 mg plus standard antiemetic therapy for the prevention of chemotherapy-induced nausea and vomiting (J-FORCE): a multicentre, randomised, double-blind, placebo-controlled, phase 3 trial. Lancet Oncol 2020; 21 (2): 242–249. doi: 10.1016/S1470-2045 (19) 30678-3.
9. Navari RM. A placebo controlled, randomized, double-blinded trial of olanzapine for the treatment of chronic nausea and/or vomiting, unrelated to chemotherapy/radiation. J Clin Oncol 2019; 37 (31 Suppl): 118.
10. Kozák J, Lejčko J, Vrba I. Opioidy. Praha: Mladá fronta 2018.
11. Hardy J, Daly S, McQuade B et al. A double-blind, randomised, parallel group, multinational, multicentre study comparing a single dose of ondansetron 24 mg p. o. with placebo and metoclopramide 10 mg t.d.s. p. o. in the treatment of opioid-induced nausea and emesis in cancer patients. Support Care Cancer 2002; 10 (3): 231–236. doi: 10.1007/s00520-001-0332-1.
12. Torigoe K, Nakahara K, Rahmadi M et al. Usefulness of olanzapine as an adjunct to opioid treatment and for the treatment of neuropathic pain. Anesthesiology 2012; 116 (1): 159–169. doi: 10.1097/ALN.0b013e31823c7 e56.
13. Sláma O, Kabelka L, Vorlíček J. Paliativní medicína pro praxi. Praha: Galén 2011.
14. Yanai K, Tashiro M. The physiological and pathophysiological roles of neuronal histamine: an insight from human positron emission tomography studies. Pharmacol Ther 2007; 113 (1): 1–15. doi: 10.1016/ j.pharmthera.2006.06.008.
15. Attia E, Steinglass JE, Walsh BT et al. Olanzapine versus placebo in adult outpatients with anorexia nervosa: a randomized clinical trial. Am J Psychiatry 2019; 176 (6): 449–456. doi: 10.1176/appi.ajp.2018.18101125.
16. Okamoto H, Shono K, Nozaki-Taguchi N. Low-dose of olanzapine has ameliorating effects on cancer-related anorexia. Cancer Manag Res 2019; 11 : 2233–2239. doi: 10.2147/CMAR.S191330.
17. Doporučení ČSPM k léčbě symptomů v paliativní péči Česká společnost paliativní medicíny České lékařské společnosti Jana Evangelisty Purkyně. [online]. Dostupné z: https: //docplayer.cz/198016335-Doporuceni-cspm-k-lecbe-symptomu-v-paliativni-peci-ceska-spolecnost-paliativni-mediciny-ceske-lekarske-spolecnosti-jana-evangelisty-purkyne.html.
18. Boettger S, Jenewein J, Breitbart W. Haloperidol, risperidone, olanzapine and aripiprazole in the management of delirium: a comparison of efficacy, safety, and side effects. Palliat Support Care 2015; 13 (4): 1079–1085. doi: 10.1017/S1478951514001059.
19. Kishi T, Hirota T, Matsunaga S et al. Antipsychotic medications for the treatment of delirium: a systematic review and meta-analysis of randomised controlled trials. J Neurol Neurosurg Psychiatry 2016; 87 (7): 767–774. doi: 10.1136/jnnp-2015-311049.
20. van der Vorst MJDL, Neefjes ECW, Boddaert MSA et al. Olanzapine versus haloperidol for treatment of delirium in patients with advanced cancer: a phase III randomized clinical trial. Oncologist 2020; 25 (3): e570–e577. doi: 10.1634/theoncologist.2019-0470.
21. Yoon HJ, Park KM, Choi WJ et al. Efficacy and safety of haloperidol versus atypical antipsychotic medications in the treatment of delirium. BMC Psychiatry 2013; 13 : 240. doi: 10.1186/1471-244X-13-240.
22. lsayem A, Bush SH, Munsell MF et al. Subcutaneous olanzapine for hyperactive or mixed delirium in patients with advanced cancer: a preliminary study. J Pain Symptom Manage 2010; 40 (5): 774–782. doi: 10.1016/j.jpainsymman.2010.02.017.
23. Chan EW, Taylor DM, Knott JC et al. Intravenous droperidol or olanzapine as an adjunct to midazolam for the acutely agitated patient: a multicenter, randomized, double-blind, placebo-controlled clinical trial. Ann Emerg Med 2013; 61 (1): 72–81. doi: 10.1016/j.annemergmed.2012.07.118.
24. Temmingh H, Stein DJ. Anxiety in patients with schizophrenia: epidemiology and management. CNS Drugs 2015; 29 (10): 819–832. doi: 10.1007/s40263-015-0282-7.
25. Bowden CL. Atypical antipsychotic augmentation of mood stabilizer therapy in bipolar disorder. J Clin Psychiatry 2005; 66 (Suppl 3): 12–19.
26. Kec D, Ludka O, Hamerníková V et al. Současné trendy v léčbě a diagnostice chronické nespavosti. Čes Slov Psychiat 2020; 116 (3): 139–149.
27. Basire S. Psychotropic drug directory. HealthComm UK Ltd.: Aberdeen 2010 : 202–203.
Štítky
Dětská onkologie Chirurgie všeobecná Onkologie
Článek vyšel v časopiseKlinická onkologie
Nejčtenější tento týden
2022 Číslo 4- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
-
Všechny články tohoto čísla
- Onkologická léčba 21. století a Kaplan-Meierovy křivky
- Rosai-Dorfman-Destombesova choroba – histiocytární onemocnění se zánětlivými projevy
- Pacienti s karcinomy prezentujícími genovou fúzi neuregulinu 1 (NRG1) jsou kandidáty na teranostický přístup k výběru cílené léčby
- Olanzapin v onkologické paliativní péči
- Imunoterapia nádorových ochorení
- Jak únava ovlivňuje návrat do práce u pacientek s karcinomem prsu
- Informace z České onkologické společnosti
- Regulační síť kompetitivně interagujících RNA a účinnost radioterapie u nádorů rekta
- Současné podávání cisplatiny jednou týdně a radioterapie s modulovanou intenzitou svazku s využitím simultánního integrovaného boostu při léčbě pokročilého skvamocelulárního karcinomu hlavy a krku
- Pozvolný vzestup bilirubinu v průběhu léčby mnohočetného myelomu lenalidomidem, bortezomibem a dexametazonem (demaskování dříve nediagnostikovaného Gilbertova syndromu) a vymizení nekrobiotického xantogranulomu po dosažení kompletní remise myelomu
- Mikrovlnná ablace solitární jaterní metastázy kolorektálního karcinomu komplikované perforací žaludku a gastrokutánní píštělí – kazuistika
- Klinická onkologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Olanzapin v onkologické paliativní péči
- Imunoterapia nádorových ochorení
- Rosai-Dorfman-Destombesova choroba – histiocytární onemocnění se zánětlivými projevy
- Jak únava ovlivňuje návrat do práce u pacientek s karcinomem prsu
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



