-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Následky hypoacidity navozené inhibitory protonové pumpy – tipy pro praxi
Consequences of Hypoacidity Induced by Proton Pump Inhibitors – a Practical Approach
Background:
Proton pump inhibitors (PPIs) are often a part of drug regimens for many patients, including cancer patients. These drugs are very effective suppressors of gastric acid secretion; a significant increase in the gastric pH is seen with chronic use. This affects absorption of drugs, vitamins, and minerals.
Purpose:
PPIs are associated with many adverse drug reactions; nevertheless, these adverse effects are often neglected in clinical practice. The main aim of this article is to emphasize some of the adverse effects and theoretical mechanisms underlying these adverse reactions, the expected length of therapy before their clinical manifestation, and potential ways of dealing with these adverse reactions. We will focus on hypergastrinemia and rebound hyperacidity, which occur in patients on long-term therapy with high dose PPIs. Next, we will focus on osteoporosis and hypomagnesemia, adverse effects for which the assumed mechanism is decreased absorption of particular ions from the gastrointestinal tract. Furthermore, clinically significant pharmacokinetic drug interactions at the level of absorption will be analyzed. Tyrosine kinase inhibitors (TKIs) are drugs with limited solubility; this solubility is pH-dependent. Some recommendations seek to ensure optimal absorption with minimal inter-day variability. Tables summarizing the optimal relationship between food and TKIs, and (sometimes) the optimal regimen of concomitant PPIs, are included.
Key words:
proton pump inhibitors – drug-related side effects and adverse reactions – drug interactions – tyrosine kinase inhibitors – hypochlorhydria
The author declares she has no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.
Submitted: 24. 8. 2018
Accepted: 17. 10. 2018
Autoři: J. Rychlíčková 1,2
Působiště autorů: Ústavní lékárna, Masarykův onkologický ústav, Brno 1; Farmakologický ústav, LF MU Brno 2
Vyšlo v časopise: Klin Onkol 2018; 31(6): 409-413
Kategorie: Přehled
doi: https://doi.org/10.14735/amko2018409Souhrn
Východiska:
Inhibitory protonové pumpy (proton pump inhibitors – PPIs) jsou velmi častou součástí medikačních režimů nejen onkologických pacientů. Jedná se o léčiva velmi silně tlumící sekreci kyseliny chlorovodíkové, jejich vlivem tedy dochází, především při chronickém podávání, k významné elevaci intragastrického pH. V důsledku tohoto posunu lze očekávat změny v absorpci jak léčiv, tak i vitamínů, minerálů apod.
Cíl:
PPIs jsou asociovány s celou řadou nežádoucích účinků, v běžné klinické praxi se na ně ale často zapomíná. Cílem tohoto sdělení je upozornit na některé z nich, a to z pohledu předpokládaného mechanizmu, z pohledu délky terapie potřebné k manifestaci nežádoucího účinku a také z pohledu možností jejich řešení. Konkrétně se zaměříme na hypergastrinemii a rebound hyperaciditu spojenou především s dlouhodobou terapií vysokými dávkami, dále na osteoporózu a na hypomagnezemii, u nichž je jednou z teorií předpoklad změny ionizace a absorpce příslušných iontů. A právě na klinicky významné farmakokinetické interakce na úrovni absorpce zapříčiněné změnou žaludečního pH se zaměříme v druhé části příspěvku. Tyrozinkinázové inhibitory (TKI) představují léčiva, u nichž je limitujícím krokem jejich absorpce právě rozpustnost, která je závislá na pH. U celé řady TKI je tedy doporučena konkrétní vazba na příjem stravy (nalačno, s jídlem, v odstupu od jídla), aby byly zajištěny optimální podmínky pro vstřebání těchto léčiv s minimálními mezidenními rozdíly. Součástí textu jsou i přehledové tabulky vazby TKI na souběžný příjem stravy, event. v některých případech optimálního režimu podání PPIs.
Klíčová slova:
inhibitory protonové pumpy – nežádoucí účinky léčiv – lékové interakce – tyrozinkinázové inhibitory – hypochlorhydrie
Úvod
Inhibitory protonové pumpy (proton pump inhibitors – PPIs) představují nejsilnější supresory sekrece žaludeční kyseliny v běžné klinické praxi. Prvním předpokladem jejich účinnosti je jejich kumulace v sekrečních kanalikulech, kde se pH pohybuje kolem 1 a disociační konstanta pKa1 PPIs je mezi 3,8 a 4,5. Druhým předpokladem je pak bioaktivace (druhá protonizace; aktivace tedy není závislá na enzymatické přeměně), aktivní metabolit je schopen kovalentně vázat H+/ K+ ATP-ázu (vodíko-draselnou pumpu) [1,2]. PPIs dokážou významně zvýšit hodnoty intragastrického pH, klinický význam nemá ani tak maximální dosažená hodnota pH, jako spíše doba nad určitým pH. Protonová pumpa je posledním článkem řetězce sekrece kyseliny chlorovodíkové, resp. vodíkových iontů nezávisle na způsobu aktivace [3]. Díky kovalentní vazbě přetrvává efekt PPIs delší dobu, než je jejich plazmatický poločas, uvádí se dokonce 3– 4 dny.
Některé nežádoucí účinky (NÚ) PPIs lze odvodit z mechanizmu účinku, jiné budou souviset se změnou absorpčních podmínek. Analogicky může docházet ke změnám absorpce konkomitantně podávaných léčiv. Cílem tohoto sdělení je sumarizovat NÚ této lékové skupiny spolu s předpokládanou délkou terapie do možné manifestace konkrétního NÚ a dále nastínit možná řešení těchto NÚ. Zaměříme se také na klinicky významné změny absorpce souběžně podávaných tyrozinkinázových inhibitorů (TKI) jako další riziko PPIs.
Hypergastrinemie, riziko maligního zvratu, rebound hyperacidita
Hypergastrinemie (plazmatické hladiny nad 100– 150 pg/ ml) může být důsledkem gastrinomu, obstrukce žaludečního odtoku apod. nebo hypo-/ anacidity u pacientů s atrofickou gastritidou, infekcí Helicobacter pylori, event. lékově navozené hypo-/ anacidity (sekrece gastrinu narůstá fyziologicky při neutrálním pH) [4,5]. Antisekreční terapie navozuje obvykle střední elevace gastrinemie (200– 400 pg/ ml) s vrcholem v prvních 4 měsících terapie a následnou plató fází, zatímco při destrukci parietálních buněk s achlorhydrií jsou hodnoty gastrinemie > 1 000 pg/ ml [5]. Gastrin stimuluje sekreci kyseliny dvěma mechanizmy: přímým působením na parietální buňky a nepřímo cestou enterochromafinních (enterochromaffin-cell-like – ECL) buněk a jimi uvolněného histaminu. Zvýšená stimulace parietálních buněk vyústí v hypertrofii a hyperplazii, dilatované žlázy mohou získat cystický charakter, event. až charakter polypu. Ovšem polypy jsou obvykle benigního charakteru, riziko maligního zvrhnutí při dlouhodobém podávání PPI se jeví jako minimální a po ukončení terapie typicky regredují [6]. Stejně jako u parietálních buněk dochází k hyperplazii i u ECL buněk, buněk duodenální sliznice a sliznice tlustého střeva. Prevalence žaludečních karcinoidů jako ECL tumorů asociovaných s PPIs (sekvence hyperplazie – dysplazie – neoplazie) se ale nejeví vyšší oproti éře před PPIs [5,6]. Na druhé straně Jianu et al uvádějí, že při obecně pomalé rychlosti růstu dobře diferencovaných neuroendokrinních tumorů je nutné opravdu dlouhodobé sledování pacientů (50 % průměrné délky života; řád desítek let u člověka) [4].
Jako prevenci NÚ navrhují Graham et al kontrolní stanovení gastrinemie v pravidelných intervalech (např. 5 let) [6]. Význam rutinního monitorování gastrinemie se jeví sporný s ohledem na nejasný klinický i ekonomický benefit při souběžné antisekreční terapii. Při jejím vysazení zase narůstá riziko hyperacidity [5].
Z výše uvedeného logicky vyplývá navýšení sekreční kapacity pro žaludeční kyselinu při déle trvající terapii PPIs. Po dobu trvání terapie PPIs k manifestaci nedojde, ovšem při náhlém ukončení/ přerušení déle trvající terapie (v rámci jednotek týdnů) lze očekávat rebound fenomén v podobě hyperacidity, a to opět v řádu jednotek týdnů s postupně klesající symptomatikou [7,8]. Jako možné terapeutické postupy ke snížení rebound hyperacidity se jeví použití H2 blokátorů nebo postupné snižování denních dávek PPIs. Výhodou H2 blokátorů je kratší a méně vyjádřený rebound fenomén (trvání v řádu dní), rizikem je zase neúčinnost v důsledku down-regulace H2 receptorů při zvýšené stimulaci ECL buněk gastrinem. S postupnou detrakcí PPIs jsou omezené klinické zkušenosti. V prvním kroku lze redukovat počet denních dávek, dále jednotlivou dávku, ve chvíli, kdy není dostupná nižší jednotlivá dávka, přistoupit k prodloužení intervalu mezi dávkami, a to v intervalech 2– 4 týdnů s velkou interindividuální variabilitou [9,10].
Osteoporóza
Ačkoli je negativní vliv PPIs na kostní metabolizmus a rizika fraktur do určité míry sporný, především díky velkému bias studií, nelze ho v kontextu cíle tohoto sdělení opomenout. Logickým předpokladem zvýšení frekvence fraktur kyčle, zápěstí a páteře u uživatelů PPIs je změna absorpce vápníku při zvýšení pH v gastrointestinálním traktu (GIT) (kyselé prostředí usnadňuje uvolnění ionizovaného vápníku z omezeně rozpustných kalciových solí) s následným navozením negativní bilance kalcia [11,12]. Byly ale vysloveny i další teorie – hyperparathyreóza následkem hypergastrinemie, přímý efekt na metabolizmus kosti jak ovlivněním osteoklastů, tak osteoblastů. Jak už bylo řečeno výše, PPIs se díky svým fyzikálně-chemickým vlastnostem kumulují v oblastech velmi nízkého pH, tedy i ve vezikulech osteoklastů, kde snižují jejich schopnost přestavovat kostní tkáň [11]. Osteoporóza je ale multifaktoriální onemocnění s významným vlivem pohybové aktivity, kouření, komorbidit a souběžné medikace (kortikoidy, diuretika, glitazony, …).
K manifestaci nedojde v řádu týdnů ani měsíců vzhledem k velmi nízkému fyziologickému obratu a úbytku kostní hmoty. Na rozdíl od hypergastrinemie se zde doba terapie do zvýšení rizika fraktur pohybuje v řádu let. Targownik et al udávají hranici 7 let pro všechny typy fraktur, 5 let konkrétně pro fraktury kyčle [13]. Co se týká substituce kalcia jako nástroje ke snížení rizika fraktur asociovaných s PPIs, chybí přesvědčivá data o účinnosti tohoto postupu. Na druhé straně víme, že substituce kalcia obecně přispívá ke zlepšení kvality kostní hmoty, resp. zpomaluje její odbourávání a snižuje riziko fraktur. I při vědomí možné změny absorpce vlivem lékové interakce se jeví možné benefity kalciové substituce jako převažující nad riziky v podobě NÚ. U pacientů vyžadujících léčbu PPIs lze také očekávat změny ve skladbě stravy a snížení dietního příjmu kalcia. Právě tito pacienti více profitují ze suplementace kalcia [14]. Mezi absorpcí jednotlivých solí kalcia nejsou za běžných podmínek klinicky významné rozdíly, v případě iatrogenně navozené hypo-/ achlorhydrie by měl být preferován citrát či citrát-malát [15]. Dalším postupem snižujícím riziko tohoto NÚ PPIs je přehodnocení indikace u rizikových skupin pacientů, ovšem např. při souběžné terapii kortikoidy je nezbytné pečlivé zhodnocení benefitů oproti rizikům, ač v tomto případě kumulativním.
Hypomagnezemie
Od roku 2006 bylo reportováno několik případů život ohrožujících hypomagnezemií asociovaných s PPIs. Podobně jako u kalcia prvotním předpokladem bylo snížení gastrointestinální absorpce magnezia. Přibližně 90 % perorálně přijatého magnezia je absorbováno pasivně paracelulárním transportem, transcelulární aktivní transport pak zajišťují kationtové kanály přechodného receptorového potenciálu melastaninového typu (transient receptor potential melastatin – TRPM) – především TRPM6 a TRPM7. Variabilita na úrovni TRPM6/ 7 může být jedním z mechanizmů PPIs navozené hypomagnezemie, další teorie pracují se změnou citlivosti kanálů při změně pH. Není jasné, zda se hypomagnezemie potenciálně týká všech uživatelů těchto léčiv, či zda jde o idiosynkrastické reakce [16]. S ohledem na kinetiku magnezia v těle by příčina hypomagnezemie mohla být i v renálních tubulech, to se ale zatím nepotvrdilo [17,18].
V publikovaných kazuistikách souběžná suplementace hořčíku (podávané dávky se pohybovaly v rozmezí 80– 480 mg ionizovaného magnezia) neměla příliš významný efekt, po vysazení PPIs došlo k promptní normalizaci magnezemie s možností vysazení substituce [17– 19]. Promptní v tomto případě znamená v řádu dní. Pro praxi je důležitá nejen znalost tohoto NÚ pro diferenciální diagnostiku, ale i znalost omezeného významu substituce. Monitoring magnezemie lze provést u rizikových pacientů – souběžná terapie diuretiky, laxativy, inhibitory receptoru pro epidermální růstový faktor (epidermal growth factor receptor – EGFR), nefrotoxickými léčivy, která narušují tubulární procesy (cisplatina, aminoglykosidy, pentamidin).
Lékové interakce na úrovni absorpce jako následek hypoacidity
Biologická dostupnost orálně podaného léčiva je výsledkem spolupůsobení fyziologických (anatomie a fyziologie GIT, tranzitní časy, pH jednotlivých částí GIT, množství žluči, složení bakteriální mikroflóry a funkce transportérů), fyzikálně-chemických (stupeň ionizace, molekulová hmotnost, lipofilita léčiva) a technologických faktorů (typ lékové formy, velikost částic, typ soli, vzájemné uspořádání molekul, komplexace léčiv) [20]. Každopádně to, co významně predikuje biologickou dostupnost léčiva, je rozpustnost (solubilita) a propustnost (permeabilita). Na základě těchto vlastností byl v 90. letech Amidonem et al definován tzv. biofarmaceutický klasifikační systém (Biopharmaceutical Classification System – BCS), který rozděluje léčiva do 4 tříd:
- třída I: vysoká permeabilita, vysoká solubilita;
- třída II: vysoká permeabilita, nízká solubilita;
- třída III: nízká permeabilita, vysoká solubilita;
- třída IV: nízká permeabilita, nízká solubilita [21].
V návaznosti na výše uvedený přehled faktorů ovlivňujících biologickou dostupnost a míru farmakodynamického efektu PPI je tedy zřejmé, že PPI navozené změny pH představují jeden z kritických faktorů ovlivňujících ionizaci léčiva, a následně tedy i míru a rychlost rozpustnosti a schopnost pasivního přechodu přes stěnu GIT. V rámci posuzování lékových interakcí je ale jednou z nejzásadnějších informace o její klinické významnosti, klinická významnost interakce stoupá se zužujícím se terapeutickým oknem souběžně podávaného léčiva. Typickým příkladem mohou být TKI. Zařazení TKI do jednotlivých BCS kategorií uvádí tab. 1. Na první pohled je zřejmé, že většina TKI spadá do II. třídy dle BCS, tedy skupiny s vysokou permeabilitou a nízkou solubilitou. V praxi to tedy znamená, že limitujícím faktorem absorpce je v tomto případě rozpustnost. TKI jsou obvykle slabě alkalické povahy, u celé řady těchto léčiv dochází k významným změnám rozpustnosti v pásmu pH, které jsme schopni ovlivnit PPI. A právě to je podstata lékové interakce PPI a TKI, jinými slovy při souběžném podání PPI, který dokáže významně elevovat hodnoty intragastrického pH, a konkrétního TKI, jehož rozpustnost významně klesá se stoupajícím pH, dojde k posunu rovnováhy k neionizované formě, tedy formě se sníženou rozpustností, klesá frakce dostupná pro absorpci v GIT a výsledkem je snížená biologická dostupnost TKI.
Tab. 1. TKI v současné době obchodované v ČR (k 16. 8. 2018) (seřazeny dle vztahu k jídlu). 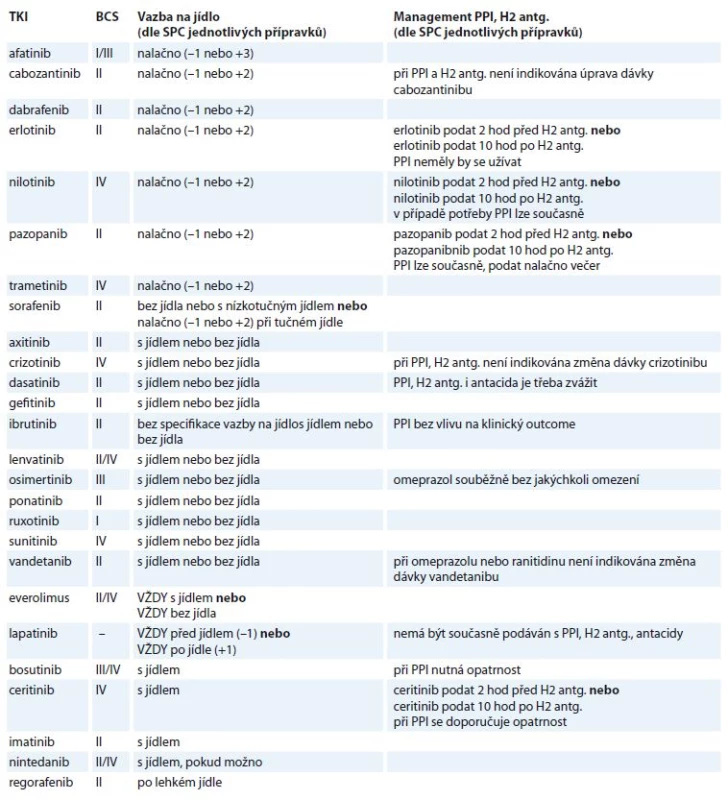
TKI – tyrozinkinázové inhibitory, BCS – biofarmaceutický klasifi kační systém, SPC – souhrn údajů o přípravku, PPI – inhibitory protonové pumpy, H2 antg. – antagonisté histaminových H2 receptorů, (–1) – 1 hod před jídlem, (+1)/(+2)/(+3) – 1/2/3 hod po jídle Pro kvantitativní odhad je nutná znalost pKa, tedy hodnoty pH, při které je v rovnováze ionizovaná a neionizovaná frakce léčiva. Čím nižší pKa, tím větší negativní vliv PPI na absorpci, resp. při pKa nižší než 4– 5 je vliv PPI výraznější, dochází k posunu TKI do neionizované, hůře rozpustné formy a snížení biologické dostupnosti a expozice. Praktickými příklady mohou být crizotinib, dasatinib, erlotinib, gefitinib, lapatinib a pazopanib [22]. Přestože u těchto léčiv je často zmínka o vlivu pH na jejich rozpustnost, jednotný postup v rámci managementu souběžné antisekreční terapie chybí a zcela jistě bude předmětem následného výzkumu, stejně jako ověření klinického dopadu interakce (vliv na celkové přežití a přežití bez progresu). Důležitým aspektem takové studie bude přesná informace o konkrétním užívaném PPI (odlišnosti jednotlivých PPIs v inhibici izoenzymů CYP450, P-glykoproteinu), celkové denní dávce, počtu denních dávek (při vícedenních dávkách či kontinuálním přívodu je kolísání pH minimalizováno, negativní dopad lékové interakce bude tedy výraznější), ale také režimu podávání TKI ve vztahu k PPI (možnost podat současně, tedy v době minimální plazmatické koncentrace PPI s využitím zpožděného nástupu účinku PPI, druhým režimem je podání TKI 2– 3 hodiny po PPI, tedy v době maximálního účinku PPI; obě strategie mají své výhody a nevýhody). Přestože hlavním zaměřením textu jsou PPI, do tab. 1 jsme pro úplnost zahrnuli i informaci o H2 antagonistech (ranitidin, famotidin). Díky krátkému biologickému poločasu H2 antagonistů je logické doporučení podávat TKI v době minimálního efektu, tedy před podáním H2 blokátoru a s odstupem několika hod po jeho podání.
V tomto kontextu je jistě zajímavá farmakokinetická studie Leeuwena et al zaměřená na míru antagonizace PPI navozené hypoacidity Coca-Colou Classic, a to na konkrétním příkladu erlotinibu. Pacienti konzumovali 250 ml Coca-Coly Classic (pH cca 2,5), kontrolní skupina pila vodu. Oproti kontrolní skupině došlo ke statisticky signifikantnímu vzestupu maximální plazmatické koncentrace erlotinibu při souběžném podávání esomeprazolu 40 mg, zatímco u pacientů bez esomeprazolu je rozdíl minimální [23].
Drobná poznámka k managementu lékové interakce u pazopanibu. Jak je uvedeno v tab. 1, měl by být pazopanib užit s PPI ve večerních hodinách. Za jistý nedostatek tohoto užití ale považujeme elevace intragastrického pH v supinační poloze vlivem duodenogastrického refluxu. Díky významné závislosti rozpustnosti pazopanibu na pH může toto být zdrojem suboptimální absorpce a pacient by na tuto skutečnost měl být upozorněn.
Na absorpci TKI nelze nahlížet pouze pohledem vlivu žaludečního pH, významný je v určitých případech i obsah tuku ve stravě (lapatinib, sorafenib) a nelze zapomenout na lékové interakce na úrovni střevního cytochromu CYP-3A4, P-glykoproteinu, zároveň je toto ale nad rámec tohoto textu.
Závěr
PPIs jsou velmi častou součástí medikací pacientů, o to víc pacientů onkologických. Naší snahou bylo upozornit na klinicky významnou lékovou interakci s vybranými TKI a na některé vybrané NÚ, a to v kontextu lékově navozené hypoacidity.
Autorka deklaruje, že v souvislosti s předmětem studie nemá žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do bi omedicínských časopisů.
PharmDr. Jitka Rychlíčková, Ph.D.
Masarykův onkologický ústav
Ústavní lékárna
Žlutý kopec 7
656 53 Brno
e-mail: jitka.rychlickova@gmail.com
Obdrženo: 24. 8. 2018
Přijato: 17. 10. 2018
Zdroje
1. Shin JM, Sachs G. Pharmacology of proton pump inhibitors. Curr Gastroenterol Rep 2008; 10(6): 528– 534.
2. Roche VF. The chemically elegant proton pump inhibitors. Am J Pharm Educ 2006; 70(5): 101.
3. Fellenius E, Berglindh T, Sachs G et al. Substituted benzimidazoles inhibit gastric acid secretion by blocking (H+ + K+)ATPase. Nature 1981; 290(5802): 159– 161.
4. Jianu CS, Fossmark R, Viset T et al. Gastric carcinoids after long-term use of a proton pump inhibitor. Aliment Pharmacol Ther 2012; 36(7): 644– 649. doi: 10.1111/ apt.12012.
5. Dacha S, Razvi M, Massaad J et al. Hypergastrinemia. Gastroenterol Rep (Oxf) 2015; 3(3): 201– 208. doi: 10.1093/ gastro/ gov004.
6. Graham DY, Genta RM. Long-term proton pump inhibitor use and gastrointestinal cancer. Curr Gastroenterol Rep 2008; 10(6): 543– 547.
7. Niklasson A, Lindström L, Simrén M et al. Dyspeptic symptom development after discontinuation of a proton pump inhibitor: a double-blind placebo-controlled trial. Am J Gastroenterol 2010; 105(7): 1531– 1537. doi: 10.1038/ ajg.2010.81.
8. Reimer C, Søndergaard B, Hilsted L et al. Proton-pump inhibitor therapy induces acid-related symptoms in healthy volunteers after withdrawal of therapy. Gastroenterology 2009; 137(1): 80– 87. doi: 10.1053/ j.gastro.2009.03.058.
9. Pandolfino J. Discontinuation of proton pump inhibitor therapy and the role of esophagel testing. Gastroenterol Hepatol (N Y) 2013; 9(11): 747– 764.
10. MacKenzie C, Nabila AS. Clinical indications for proton pump inhibitors and tapering information when indicated. [online]. Available from: https:/ / ahpnetwork.com/ wp-content/ uploads/ 2016/ 12/ Clinician-PPI-Flyer.Ahmed_.10.16.pdf.
11. Costa-Rodrigues J, Reis S, Teixeira S et al. Dose-dependent inhibitory effects of proton pump inhibitors on human osteoclastic and osteoblastic cell activity. FEBS J 2013; 280(20): 5052– 5064. doi: 10.1111/ febs.12478.
12. Ito T, Jensen RT. Association of long-term proton pump inhibitor therapy with bone fractures and effects on absorption of calcium, vitamin B12, iron, and magnesium. Curr Gastroenterol Rep 2010; 12(6): 448– 457. doi: 10.1007/ s11894-010-0141-0.
13. Targownik LE, Lix LM, Metge CJ et al. Use of proton pump inhibitors and risk of osteoporosis-related fractures. CMAJ 2008; 179(4): 319– 326. doi: 10.1503/ cmaj.071330.
14. Lamy O, Burckhardt P. Calcium revisited: part II calcium supplements and their effects. Bonekey Rep 2014; 3 : 579. doi: 10.1038/ bonekey.2014.74.
15. Reinwald S, Weaver CM, Kester JJ. The health benefits of calcium citrate malate: a review of the supporting science. Adv Food Nutr Res 2008; 54 : 219– 346. doi: 10.1016/ S1043-4526(07)00006-X.
16. Florentin M, Elisaf MS. Proton pump inhibitor-induced hypomagnesemia: a new challenge. World J Nephrol 2012; 1(6): 151– 154. doi: 10.5527/ wjn.v1.i6.151.
17. Shabajee N, Lamb EJ, Sturgess I et al. Omeprazole and refractory hypomagnesaemia. BMJ 2008; 337: a425. doi: 10.1136/ bmj.39505.738981.BE.
18. Epstein M, McGrath S, Law F. Proton-pump inhibitors and hypomagnesemic hypoparathyroidism. N Engl J Med 2006; 355(17): 1834– 1836. doi: 10.1056/ NEJMc066308.
19. Kuipers MT, Thang HD, Arntzenius AB. Hypomagnesaemia due to use of proton pump inhibitors – a review. Neth J Med 2009; 67(5): 169– 172.
20. El-Kattan A, Varma M. Oral absorption, intestinal metabolism and human oral bioavailability. In: Paxton J (ed). Topics on drug metabolism. Rijeka: InTech Europe 2012. [online]. Available from: https:/ / www.intechopen.com/ books/ topics-on-drug-metabolism/ oral-absorption-intestinal-metabolism-and-human-oral-bioavailability-.
21. Amidon GL, Lennernäs H, Shah VP et al. A theoretical basis for a biopharmaceutic drug classification: the correlation of in vitro drug product dissolution and in vivo bioavailability. Pharm Res 1995; 12(3): 413– 420.
22. van Leeuwen RW, van Gelder T, Mathijssen RH et al. Drug-drug interactions with tyrosine-kinase inhibitors: a clinical perspective. Lancet Oncol 2014; 15(8): e315– e326. doi: 10.1016/ S1470-2045(13)70579-5.
23. van Leeuwen RW, Peric R, Hussaarts KG et al. Influence of the acidic beverage cola on the absorption of erlotinib in patients with non-small-cell lung cancer. J Clin Oncol 2016; 34(12): 1309– 1314. doi: 10.1200/ JCO.2015.65.2560.
Štítky
Dětská onkologie Chirurgie všeobecná Onkologie
Článek vyšel v časopiseKlinická onkologie
Nejčtenější tento týden
2018 Číslo 6- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
- Nejasný stín na plicích – kazuistika
-
Všechny články tohoto čísla
- James P. Allison a Tasuku Honjo
- Dlouhé nekódující molekuly RNA u cervikálních nádorů
- Následky hypoacidity navozené inhibitory protonové pumpy – tipy pro praxi
- Vývodný močový systém a gynekologické malignity
- Infiltrace karcinomů prostaty CD204+ a CD3+ buňkami koreluje s expresí ERG a fúzí genu TMPRSS2-ERG
- Supernatanty Lactobacillus rhamnosus GG a Lactobacillus crispatus SJ-3C-US snižují expresi genů TSGA10, AURKC, OIP5 a AKAP4 v HeLa buňkách
- Použití metody Metal Deletion Technique pro odstraňování artefaktů při plánování radioterapie u pacientů s implantovanými kardiostimulátory
- Efekt a toxicita radioterapie ve vybraných paliativních indikacích
- Zriedkavý malígny PECom obličky – diagnostická výzva a neobvyklá terapeutická odpoveď
- Nediferencovaný karcinóm pankreasu – kazuistika
- Nemalobuněčný karcinom plic s expresí estrogenových receptorů a pozitivitou ALK
- Aktuality z odborného tisku
- Melanom animálního typu – velmi vzácná varianta lidského melanomu
- Význam gastrointestinální flóry v léčbě nádorů pomocí checkpoint inhibitorů
- Jaterní PECom (perivascular epitheloid cell tumor – nádor z perivaskulárních epiteloidních buněk) v diagnostických zobrazovacích metodách – kazuistika
- Klinická onkologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Jaterní PECom (perivascular epitheloid cell tumor – nádor z perivaskulárních epiteloidních buněk) v diagnostických zobrazovacích metodách – kazuistika
- Nediferencovaný karcinóm pankreasu – kazuistika
- Efekt a toxicita radioterapie ve vybraných paliativních indikacích
- James P. Allison a Tasuku Honjo
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



