-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Vývodný močový systém a gynekologické malignity
Urinary Tract and Gynecologic Malignancies
Background:
The close anatomical relationship of the urogenital system is a significant, and sometimes limiting, factor in oncogynecology. Reducing adverse effects (treatment-associated toxicity) is an integral part of cancer treatment. Radical surgery, as well as oncological therapy, which represent milestones in the treatment of such malignancies, may require tailoring the extension of the intervention in order to preserve other non-gynecological structures. Despite the progress in minimally invasive surgery, and evolution of radiotherapy and systemic therapy, treatment-related complications remain; indeed, their increasing prevalence in women raises questions about quality of life.
Aim:
Here, we highlight the modalities used to treat gynecological cancer and discuss the most common urological adverse effects related to these interventions. Knowledge of side effects, as well as methods of prevention, is fundamental if we are to preserve quality of life.
Conclusion:
reatment of gynecological cancer is based on cooperation between members of the multidisciplinary team. From this point-of-view, combination of two radical modalities (mainly surgery and radiotherapy) remains problematic. However, the patient’s prognosis, and plans for other possible oncological therapies, play an essential role in management of urological adverse effects related to cancer treatment.
Key words:
gynecologic neoplasms – complication – urinary tract – quality of life
This work was supported by project PROGES Q40.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.
Submitted: 27. 9. 2018
Accepted: 21. 10. 2018
Autoři: J. Špaček jr. 1; J. Petera 2; M. Broďák 1; I. Práznovec 3; J. Špaček 3
Působiště autorů: Urologická klinika LF UK a FN Hradec Králové 1; Klinika onkologie a radioterapie LF UK a FN Hradec Králové 2; Porodnická a gynekologická klinika LF UK a FN Hradec Králové 3
Vyšlo v časopise: Klin Onkol 2018; 31(6): 414-420
Kategorie: Přehled
doi: https://doi.org/10.14735/amko2018414Souhrn
Východiska:
Anatomická blízkost pohlavních orgánů a močového systému je v gynekologické onkologii významným a někdy také limitujícím faktorem. Nedílnou součástí onkogynekologické léčby je i snaha eliminovat vedlejší účinky (léčebnou toxicitu). Podstoupení radikální chirurgické, příp. onkologické léčby je pro pacientky s gynekologickými malignitami klíčovým krokem, který má vliv na celkovou dobu přežití, ale může také ovlivňovat kvalitu života. Samotný rozsah terapie by měl být veden s ohledem na okolní struktury a se snahou o zachování jejich funkce. Navzdory rozvoji minimálně invazivní chirurgie, pokrokům v radioterapii a v systémové léčbě komplikace protinádorové léčby nevymizely. Narůst prevalence pacientek, které byly léčeny pro gynekologické malignity, logicky klade důraz na otázky týkající se kvality života.
Cíl:
K současným možnostem léčby gynekologických malignit předkládáme v tomto článku přehled urologických komplikací. Znalost vedlejších účinků léčby a jejich prevence je zásadní pro udržení kvality života.
Závěr:
Léčba gynekologických malignit je v indikovaných případech otázkou multioborové spolupráce. Z hlediska potenciální urotoxicity může být velmi problematická např. kombinace radikální chirurgie a pooperační radioterapie. Elektivní spolupráce multioborového týmu onkogynekologa, onkologa, chirurga a urologa vč. spoluúčasti při indikacích a operačních výkonech je u vybraných případů velmi žádoucí. Z hlediska léčby komplikací je pro urologa zásadní znalost prognózy pacientky a plán případné další onkologické léčby.
Klíčová slova:
gynekologické nádory – komplikace – močový trakt – kvalita života
Úvod
Gynekologické malignity zahrnují zhoubná onemocnění zevního genitálu a pochvy, dále nádory dělohy (děložní čípek, děložní tělo) a konečně nádory vycházející z adnex (vejcovod, vaječník, popřípadě primární karcinom peritonea). Po stanovení diagnózy onkologického onemocnění vytváříme léčebný plán (víceoborové konzilium) a následuje zahájení terapie. Základním momentem je až na výjimky (špatný celkový stav pacienta) snaha o odstranění nádorového ložiska vč. „zdravého okraje“. Cílem je nulový reziduální tumor a v řadě případů bývá součástí výkonu i chirurgický staging (regionální lymfadenektomie, event. detekce sentinelové uzliny). Někdy se může jednat i o výkony s vyšším podílem radikality. Zatímco u nádorů vulvy, děložního těla, vejcovodů, vaječníků a primárního karcinomu peritonea platí koncept cytoreduktivní chirurgie, tak naopak u karcinomu děložního čípku případy s postižením parametrií, tedy stadia IIB a výše, se již neoperují, ale naopak primárně ozařují. Obdobná situace je i u nádorů pochvy, kde se operují zejména počáteční stadia onemocnění. Pooperační, adjuvantní léčba je indikována v případě potřeby (přítomnost negativních klinických a histopatologických prognostických faktorů). U gynekologických nádorů se jedná o radioterapii (vulva, pochva, děložní čípek, endometrium) nebo chemoterapii (endometrium, vejcovod, vaječník a primární karcinom peritonea). Zdaleka ne všechny případy jsou však vhodné k primární chirurgii a v případě pokročilejšího onemocnění je hlavní léčebnou modalitou nechirurgický způsob onkologické léčby. U nádorů pochvy a děložního čípku je to radioterapie (RT) a u nádorů vejcovodu, vaječníku a primárního karcinomu endometria chemoterapie (CHT). V poslední době přichází v úvahu v některých případech i využití biologické léčby.
Primární postižení urologického traktu při gynekologických malignitách souvisí zejména se stadiem onemocnění a v úvahu přicházejí i případy, které v rámci pokročilosti v době záchytu postihují současně i urologický trakt. Toto je možné u nádorů zevního genitálu: T2 – nádor jakékoliv velikosti s rozšířením do přilehlých perineálních struktur (dolní třetina uretry, dolní třetina pochvy, anus); T3 – nádor jakékoliv velikosti se šířením do následujících struktur (horní 2/ 3 pochvy, sliznice močového měchýře, sliznice rekta; nebo je nádor fixován ke kosti); u nádorů pochvy: T4 – nádor postihuje sliznici močového měchýře nebo rekta; u nádorů čípku: T3b – nádor se šíří ke stěně pánevní, způsobuje obstrukční nefropatii; T4 – nádor postihuje sliznici močového měchýře či rekta nebo se šíří mimo malou pánev, přičemž bulózní edém sliznice močového měchýře nepostačuje ke klasifikaci nádoru jako T4 a toto by mělo být biopticky ověřeno.
Se vznikem onkogynekologických center (min. 100 nových záchytů a min. 60 radikálních operací/rok) a možností onkogynekologické subspecializace došlo v ČR přibližně v posledních 10– 15 letech k zásadnímu kvalitativnímu vylepšení péče o pacientky s gynekologickými nádory. Snahou je zajistit a poskytnout péči, která je na nejvyšší úrovni. Tu by měli poskytovat specialisté, kteří mají náležité zkušenosti. Postupně se zvyšuje doba přežití a narůstající prevalence bude o to více klást důraz na otázky týkající se kvality života. S ohledem na intimní blízkost vývodných cest močových a vnitřních pohlavních orgánů bývá u těchto pacientek urologická kvalita života vnímána jako kruciální.
Rozdělení nežádoucích účinků (NÚ) postihujících urologický trakt vyplývá z toho, ve které fázi léčebného procesu vzniknou. Logické je tedy tyto komplikace rozdělovat na ty, jež souvisejí s operační nebo systémovou léčbou, případně s RT. Dolní močové cesty jsou navíc pod vlivem estrogenů a při výpadku jejich produkce dochází v této oblasti k nežádoucím projevům souvisejícím s jejich nedostatkem.
Současná klasifikace urotoxicity
Urologické komplikace v onkogynekologii je možné rozdělit z více pohledů.
- a) Rozdělení podle časového vztahu k ukončení léčby – akutní (do 90 dní) a pozdní komplikace (3 měsíce až desítky let po ukončení léčby);
- b) rozdělení podle charakteru postižení – anatomické komplikace, poruchy funkce (dysfunkce dolních močových cest);
- c) rozdělení podle typu použité primární léčby – chirurgické komplikace, komplikace po RT a komplikace související se systémovou léčbou (CHT, cílená léčba);
- d) specifické komplikace protinádorové léčby – postradiační cystitida, striktura močovodu s rozvojem obstrukční nefropatie, patologické komunikace (píštěl), sekundární malignity.
Chirurgická léčba a urologické komplikace – současný pohled
Primární chirurgická terapie je klíčovým krokem protinádorové léčby u většiny lokalizovaných gynekologických malignit. Kritickou oblastí z hlediska poranění močových cest je distální močovod a močový měchýř. U močovodu se jedná především o oblast jeho křížení s uterinní arterií a infundibulopelvickým ligamentem [1,2]. Pravděpodobnost poranění močových cest klesá se zvětšující se vzdáleností od místa nádorového postižení. Nicméně je třeba si uvědomit, že rozsah operačního zákroku dosahuje, v případě paraaortální lymfadenektomie, až k renálním cévám [2,3]. Gynekolog se tak dostává do míst, která byla donedávna vyhrazena urologovi. Laparoskopický a roboticky asistovaný přístup umožnil snížení operačního poranění, časnější rehabilitaci a pozitivně ovlivnil celkovou morbiditu [4,5]. Základní nevýhodou minimálně invazivní chirurgie je však nemožnost pohmatu, tedy absence taktilní zpětné vazby. Na straně druhé je možné využití barevného mapování klíčových anatomických struktur, jako jsou močovod a lymfatické uzliny, pomocí patentní modři nebo nově indocyaninovou zelení [6]. Primární účast urologa u těchto výkonů je však spíše výjimečná, urolog je volán ad hoc nejčastěji k peroperačnímu poranění močových cest. Těchto komplikací je více u onkogynekologických výkonů než u chirurgie benigních lézí [7]. Frekvence poranění distálního močovodu je nejvyšší u laparoskopické hysterektomie (0,2– 6,0 %) a u močového měchýře při robotické radikální hysterektomii (4,38– 4,59 %) [7–9]. V časném pooperačním období se můžeme u pacientek setkat s dysfunkcí močových cest spočívající ve snížení senzitivity a poruchy vyprazdňování močového měchýře až retence moče. V naprosté většině případů se jedná o přechodné změny, které jsou důsledkem poškození pánevních plexů autonomního nervového systému, přímého postižení a reparačních změn perivezikální tkáně [1].
Sekundární chirurgie, tedy operační léčba recidiv, v sobě zahrnuje chirurgii solitární recidivy (možnost exenterace a chirurgii generalizované nemoci řešící lokální problém). Indikace k těmto výkonům vzniká v rámci víceoborového konzilia a elektivní přítomnost urologa bývá mnohem častější. Z našeho pracoviště pochází např. společná práce týkající se oblasti retroperitonea a recidiv sarkomů dělohy [10]. Příkladem plánované přítomnosti urologa při onkogynekologickém výkonu je přední exenterace, při níž urolog provádí cystektomii a zpravidla derivuje moč do exkludované kličky terminálního ilea a vytváří ortotopickou nebo heterotopickou derivaci moči [11,12]. Gynekolog v některých případech žádá o přechodnou derivaci horních močových cest zavedením ureterální cévky nebo stentu. Tento krok může znamenat pro operatéra výhodu ve smyslu snazší identifikace močovodu [13]. Nicméně je třeba si uvědomit, že takový zákrok nesnižuje počet poranění ureteru, ale zvyšuje pravděpodobnost jeho případného peroperačního rozpoznání a primárního ošetření [14,15]. Ukazuje se, že tento postup je z hlediska urologa prozíravý, protože větší část poranění močovodů je rozpoznána s časovým odstupem od operace, kdy může být okamžitá reparace významně složitější a často je odkládána [16,17]. Základní rozdělení poranění horních a dolních močových cest a možnosti léčby jsou zmíněny v tab. 1. Specifickou problematikou je vznik píštělí, striktur močovodu, dysfunkce dolních močových cest a uroinfekce. Vzhledem k faktu, že tyto komplikace mohou být důsledkem více druhů léčebných metod, jsou zmíněny samostatně v tab. 2.
Tab. 1. Rozdělení a terapeutické možnosti poranění horních a dolních močových cest. 
Tab. 2. Základní přehled nejčastějších urologických komplikací souvisejících s léčbou gynekologických malignit. 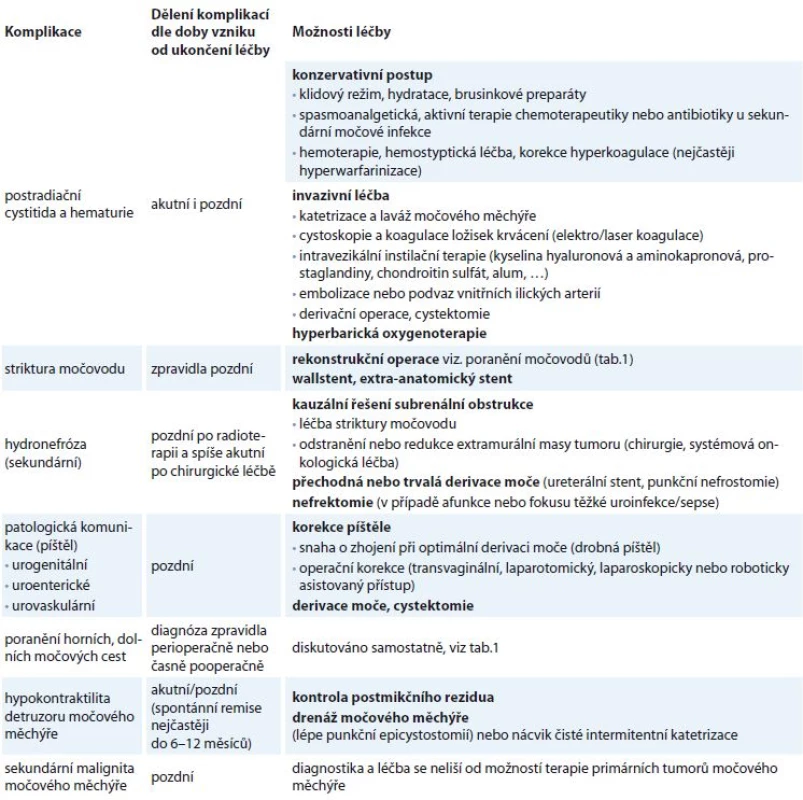
RT a urologické komplikace – současný pohled
Léčba zářením se u gynekologických malignit uplatňuje především u karcinomu děložního čípku a endometria. Také u vzácnějších nádorů vulvy a pochvy je RT velmi důležitou léčebnou modalitou. RT gynekologických malignit může vést ke vzniku komplikací na úrovni horních i dolních močových cest. Tyto NÚ jsou podmíněné velikostí dávky a typem zvoleného ozařování [18]. NÚ RT na horní a dolní močové cesty se dělí na akutní a pozdní, přičemž časová hranice akutních NÚ je do 90 dní. Pro zhodnocení změn po ozáření se nejčastěji využívá skórování akutních a chronických změn po ozáření Mezinárodní společnosti pro radiační onkologii, biologii a fyziku (Radiation Therapy Oncology Group – RTOG) (tab. 3) [19]. Existují ale i jiné skórovací systémy, jako např. CTCA (Common Terminology Criteria for Adverse Events), jehož výhodou je přesnější specifikace sledované komplikace [20]. Za obecně akceptovatelnou je považována urotoxicita do stupně 2 dle klasifikace RTOG/ EORTC (European Organisation for Research and Treatment of Cancer), těžší obtíže jsou hodnoceny jako velmi závažné komplikace a měly by být řešeny po dohodě s příslušným specialistou. Časné NÚ RT se mohou projevit již během léčby a jsou důsledkem přímého působení záření na rychle se dělící tkáně sliznice močových cest a konečníku. Pozdní (chronické) nežádoucí změny jsou důsledkem porušení cév a vaziva. Následná fibrotická přestavba má za následek změnu základních vlastností močových cest [21]. V kontextu dalšího vlivu RT se zmiňuje vznik nebo akcelerace neuropatie autonomního nervového systému s přímým důsledkem na funkci dolních močových cest. Podobné spektrum NÚ řeší také onkolog a urolog v péči o pacienta po RT pro karcinom prostaty. U obou těchto diagnóz se vyskytují zmiňované rizikové faktory, které souvisejí s mírou urotoxicity. Jedná se především o samotné parametry RT (kumulativní radiační dávka, cílový objem a typ ozařování – zevní RT, brachyterapie nebo jejich kombinace) [18,22]. Specifickou problematikou je otázka vzniku sekundárních malignit. Chaturvedi et al prokázali v mezinárodní studii pacientek po RT pro karcinom čípku a těla děložního nárůst incidence pánevních malignit vč. močového měchýře o 12 % oproti skupině bez RT [23]. To je jistě fakt, který musí zohlednit nejen urolog při péči o takového pacienta.
Tab. 3. Hodnocení nežádoucích účinků po radioterapii dle RTOG/EORTC [19]. ![Hodnocení nežádoucích účinků po radioterapii dle RTOG/EORTC [19].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/26a72778db80f06da467675b530ec09b.jpeg)
RTOG – Radiation Therapy Oncology Group, EORTC – European Organisation for Research and Treatment of Cancer Primární RT
RT nebo konkomitantní chemoradioterapie (CHRT) je indikovaná zejména u karcinomů čípku od stadia IIB včetně. Zde je relativně vyšší incidence (17– 40 %) akutních komplikací nižšího stupně (stupeň 1 a 2) [18,24]. Často je též používána jako primární léčba u nádorů pochvy. Radiotolerance proximální části pochvy je 140 Gy, dávka na celou vagínu by neměla přesáhnout 80 Gy. Zadní stěna pochvy je více radiovulnerabilní než přední a laterální stěny. Riziko komplikací je vyšší při použití brachyterapie než při zevním ozařování [25].
Adjuvantní RT
Zásadně bychom se měli snažit vyhýbat kombinaci radikální chirurgie (zejména radikální přístup v oblasti retroperitonea) s následnou radikální RT, kdy hrozí vyšší pravděpodobnost rozvoje fibrotických změn s postižením ureterů a následným rozvojem hydronefrózy. Z hlediska vzniku závažných komplikací je nejméně žádoucí kombinovat 2 nebo 3 radikální léčebné metody a musíme mít stále na mysli, že úspěšnost naší léčby se odvíjí zejména od kvality života po ukončené léčbě. Ze strany pacientek jsou velmi úzkostlivě vnímány právě obtíže související se symptomy dolních močových cest. Studie PORTEC 2 (The Postoperative Radiation Theraphy in Endometrial Cancer) mimo jiné prokázala vyšší incidenci frekventního močení a urgencí u brachyterapie oproti zevní RT (vzestup o 6 vs. 1 % nad bazální úroveň) [26].
Konkomitantní CHRT
Potenciačního efektu CHT podávané současně s RT se dosahuje vyšší úspěšnosti onkologické léčby. Její využití v onkogynekologii je zaměřeno především na vysoce rizikový karcinom čípku a endometria. Dle recentních výsledků studie PORTEC 3, která porovnávala mimo jiné také míru toxicity, byla zaznamenána vyšší míra akutní urotoxicity (stupeň 2) právě v rameni s CHRT oproti rameni se samotnou RT (7 vs. 3 %). Nicméně u vyššího stupně toxicity u akutních komplikací a pozdních komplikací bez ohledu na jejich závažnost byly obě tyto metody stran urologických komplikací rovnocenné [27].
Paliativní RT
Je indikována u nemocných ve špatném celkovém stavu, při diseminaci onemocnění nebo při inoperabilní recidivě. Dle Nguyenga et al byl u pacientek s inoperabilním karcinomem endometria, které podstoupily brachyterapii s vysokým dávkovým příkonem (high dose rate brachyterapie), nález komplikací vyššího stupně až 16 % [28].
Systémová léčba a urologické komplikace – současný pohled
Spolupráce onkologa a urologa spočívá mimo jiné v péči o ledvinné funkce pacientky. Jejich zachování je podmínkou prevence vzniku nebo zhoršení renální insuficience a stává se tak důležitým aspektem plánování a podání CHT, která je v onkogynekologii založená na využití platinových derivátů a taxanů. Samotný nefrotoxický efekt podané cisplatiny může renální insuficienci značně prohloubit. Cisplatina s cyklofosfamidem je považována za více nefrotoxickou kombinaci než cisplatina s paklitaxelem [29]. V některých případech obstrukční nefropatie s progresí azotemie je nezbytným krokem derivace moči pomocí zavedení ureterálního stentu nebo punkční nefrostomie [30]. Tento postup sice vede ke zlepšení renálních parametrů, ale zhoršuje kvalitu života pacientky. Dalším a často opomíjeným aspektem je vyšší riziko vzniku nebo recidivy uroinfekce související se zavedeným cizím tělesem [31,32]. Důležitým faktorem je riziko imunosuprese pacientky související se základním onkologickým onemocněním, protinádorovou léčbou a případnou malnutricí. Výskyt hemoragické cystitidy jako komplikace podání cyklofosfamidu a ifosfamidu zmiňujeme jen na okraj, protože se vyskytuje častěji u vysokodávkované CHT před transplantací hematopoetických buněk [33]. Biologická terapie přinesla významný pokrok pro pacientky s pokročilým nebo metastatickým karcinomem vaječníku a recidivou karcinomu děložního čípku. Urologické komplikace jsou spíše okrajové. Výzkum terapeutických, ale i možných NÚ nadále pokračuje.
Vývodný močový systém a deficit estrogenů
Často opomíjeným prvkem bývá u léčby gynekologických malignit hypoestrogenizmus, který ovlivňuje kvalitu života ženy na několika úrovních. Významný pokles plazmatické koncentrace estrogenů má za následek rozvoj somatických, funkčních a psychických změn. Část z nich je vyvolána jednoznačně nedostatkem estrogenů, u dalších je obtížné odlišit podíl stárnutí. Z hlediska rychlosti nástupu rozdělujeme tyto projevy na časné a pozdní. Chirurgické léčba, RT a CHT pánevních malignit se významně podílejí na vzniku a prohloubení hypoestrogenizmu. Nově se klinicko-patologické jednotky související s deficitem estrogenů v oblasti močopohlavního systému (atrofická vaginitida, urogenitální atrofie aj.) shrnují pod společné označení „urogenitální syndrom v menopauze/ klimakteriu“ [34]. Vzhledem ke stejnému embryonálnímu původu močové trubice, trigona močového měchýře a pochvy se jako logická jeví úvaha o společné estrogenní dependenci této oblasti [35,36]. Zvýšení poševního pH v důsledku redukce laktobacilů vede k poševní dysmikrobii s vyšším rizikem vzniku a recidivy uroinfekce. Základní urologické znaky související s deficitem estrogenů jsou zmíněny v tab. 4.
Tab. 4. Možné projevy deficitu estrogenů v oblasti vývodného močového systému. 
Shrnutí nejčastějších urologických komplikací
Výše uvedeným výčtem léčebných modalit onkogynekologie a jejím případným vztahem k močovým cestám se snažíme o přehled současné problematiky. Bližší specifikace jednotlivých patologií, vč. výčtu možností jejich terapie, je nad rámec tohoto sdělení. Z důvodu přehlednosti uvádíme nejčastější komplikace v tab. 2.
Závěr
Vztah ženských pohlavních orgánů a vývodných cest močových je velmi těsný. Vše začíná již ve chvíli primárního záchytu onemocnění, kdy musíme myslet i na nejbližší okolí tumoru, vč. jeho vztahu k močové trubici, močovému měchýři a močovodům. Zejména déle trvající urologická symptomatologie může pacientku devastovat zásadním způsobem. V tomto ohledu je např. velmi problematická kombinace radikální chirurgie retroperitonea s preparací ureterů a posléze radikální pooperační RT. Elektivní víceoborová spolupráce vč. spolupřítomnosti při indikacích a operačních výkonech je pro pacientky velmi žádoucí. Z hlediska řešení komplikací je zásadní otázka prognózy pacientky a případně další plánovaná léčba. V současné době chápeme spoluúčast urologa v managementu gynekologických malignit v rámci primární léčby spíše jako mimořádnou. O to více je však pravděpodobnější v rámci léčby recidiv a samozřejmě i při řešení komplikací, které mohou nastat i v dnešní době.
Tato práce byla podpořena projektem PROGES Q40.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do bi omedicínských časopisů.
Obdrženo: 27. 9. 2018
Přijato: 21. 10. 2018
MUDr. Jiří Špaček
Urologická klinika
LF UK a FN Hradec Králové
Sokolská 581
500 05 Hradec Králové
e-mail: jiri.spacek@fnhk.cz
Zdroje
1. Záleský M, Zachoval R, Vik V et al. Urologické konsekvence gynekologických operací. Urol List 2008; 6(1): 78– 84.
2. Feranec R, Mouková L, Chovanec J. Prekancerózy v gynekologii – endometrium. Klin Onkol 2013; 26(Suppl.): S52– S53.
3. Ouldamer L, Fichet-Djavadian S, Marret H et al. Upper margin of para-aortic lymphadenectomy in cervical cancer. Acta Obstet Gynecol Scand 2012; 91(8): 893– 900. doi: 10.1111/ j.1600-0412.2012.01443.x.
4. Cibula D, Petruželka L et al. Onkogynekologie. Praha: Grada 2009.
5. Fader AN, Weise RM, Sinno AK et al. Utilization of minimally invasive surgery in endometrial cancer care: a quality and cost disparity. Obstet Gynecol 2016; 127(1): 91– 100. doi: 10.1097/ AOG.0000000000001180.
6. Casarin J, Multinu F, Ubl DS et al. Adoption of minimally invasive surgery and decrease in surgical morbidity for endometrial cancer treatment in the United States. Obstet Gynecol 2018; 131(2): 304– 311. doi: 10.1097/ AOG.0000000000002428.
7. Mendivil AA, Abaid LN, Brown JV 3rd et al. The safety and feasibility of minimally invasive sentinel lymph node staging using indocyanine green in the management of endometrial cancer. Eur J Obstet Gynecol Reprod Biol 2018; 224 : 29– 32. doi: 10.1016/ j.ejogrb.2018.02.027.
8. Wu HH, Yang PY, Yeh GP et al. The detection of ureteral injuries after hysterectomy. J Minim Invasive Gynecol 2006; 13(5): 403– 408. doi: 10.1016/ j.jmig.2006.04.018.
9. El Abd AS, El-Abd SA, El-Enen MA et al. Immediate and late management of iatrogenic ureteric injuries: 28 years of experience. Arab J Urol 2015; 13(4): 250– 257. doi: 10.1016/ j.aju.2015.07.004.
10. Brodak M, Spacek J, Pacovsky J et al. Multidisciplinary approach as the optimum for surgical treatment of retroperitoneal sarcomas in women. Eur J Gynaecol Oncol 2013; 34(3): 234– 237.
11. Jarabák J, Zachoval R, Visokai V et al. Výskyt a řešení urologických komplikací po totální pánevní exenteraci provedené pro pokročilé nádory malé pánve. Ces Urol 2016; 20(1): 39– 47.
12. Loran OB, Veliev EL, Seregin AV et al. Quality of life in women after anterior pelvic exenteration. Urologiia 2016(2): 58– 62.
13. Speicher PJ, Goldsmith ZG, Nussbaum DP et al. Ureteral stenting in laparoscopic colorectal surgery. J Surg Res 2014; 190(1): 98– 103. doi: 10.1016/ j.jss.2014.02.025.
14. Brandes S, Coburn M, Armenakas N et al. Diagnosis and management of ureteric injury: an evidence-based analysis. BJU Int 2004; 94(3): 277– 289. doi: 10.1111/ j.1464-410X.2004.04978.x.
15. Chou MT, Wang CJ, Lien RC. Prophylactic ureteral catheterization in gynecologic surgery: a 12-year randomized trial in a community hospital. Int Urogynecol J Pelvic Floor Dysfunct 2009; 20(6): 689– 693. doi: 10.1007/ s00192-008-0788-3.
16. Parpala-Spårman T, Paananen I, Santala M et al. Increasing numbers of ureteric injuries after the introduction of laparoscopic surgery. Scand J Urol Nephrol 2008; 42(5): 422– 427. doi: 10.1080/ 00365590802025857.
17. Visco AG, Taber KH, Weidner AC et al. Cost-effectiveness of universal cystoscopy to identify ureteral injury at hysterectomy. Obstet Gynecol 2001; 97(5 Pt 1): 685– 692.
18. Viswanathan AN, Lee LJ, Eswara JR et al. Complications of pelvic radiation in patients treated for gynecologic malignancies. Cancer 2014; 120(24): 3870– 3883. doi: 10.1002/ cncr.28849.
19. Cox JD, Stetz J, Pajak TF. Toxicity criteria of the radiation therapy oncology group (RTOG) and the European organization for research and treatment of cancer (EORTC). Int J Radiat Oncol Biol Phys 1995; 31(5): 1341– 1346. doi: 10.1016/ 0360-3016(95)00060-C.
20. Cancer Therapy Evaluation Program. Bethesda: National Cancer Institute. [online]. Available from: https:/ / ctep.cancer.gov/ .
21. Čoupková I, Čoupek P, Krupa P. Komplikace spojené s radioterapií karcinomu prostaty, jejich prevence a léčba. Urol praxi 2011; 12(5): 292– 294.
22. Kubeš J, Vítek P, Dědečková K et al. Velmi pozdní následky radioterapie – limitující faktor současných radioterapeutických technik. Klin Onkol 2014; 27(3): 161–165. doi: 10.14735/amko2014161.
23. Chaturvedi AK, Engels EA, Gilbert ES et al. Second cancers among 104,760 survivors of cervical cancer: evaluation of long-term risk. J Natl Cancer Inst 2007; 99(21): 1634– 1643. doi: 10.1093/ jnci/ djm201.
24. Gay HA, Barthold HJ, O’Meara E et al. Pelvic normal tissue contouring guidelines for radiation therapy: a radiation therapy oncology group consensus panel atlas. Int J Radiat Oncol Biol Phys 2012; 83(3): e353– e362. doi: 10.1016/ j.ijrobp.2012.01.023.
25. Šlampa P et al. Radiační onkologie v praxi. 3. vyd. Brno: Masarykův onkologický ústav 2011.
26. Nout RA, Putter H, Jürgenliemk-Schulz IM et al. Five-year quality of life of endometrial cancer patients treated in the randomised Post Operative Radiation Therapy in Endometrial Cancer (PORTEC-2) trial and comparison with norm data. Eur J Cancer 2012; 48(11): 1638– 1648. doi: 10.1016/ j.ejca.2011.11.014.
27. de Boer SM, Powell ME, Mileshkin L et al. Adjuvant chemoradiotherapy versus radiotherapy alone for women with high-risk endometrial cancer (PORTEC-3): final results of an international, open-label, multicentre, randomised, phase 3 trial. Lancet Oncol 2018; 19(3): 295– 309. doi: 10.1016/ S1470-2045(18)30079-2.
28. Nguyen TV, Petereit DG. High-dose-rate brachytherapy for medically inoperable stage I endometrial cancer. Gynecol Oncol 1998; 71(2): 196– 203. doi: 10.1006/ gyno.1998.5148.
29. McGuire WP, Hoskins WJ, Brady MF et al. Cyclophosphamide and cisplatin compared with paclitaxel and cisplatin in patients with stage III and stage IV ovarian cancer. N Engl J Med 1996; 334(1): 1– 6. doi: 10.1056/ NEJM199601043340101.
30. Song Y, Fei X, Song Y. Percutaneous nephrostomy versus indwelling ureteral stent in the management of gynecological malignancies. Int J Gynecol Cancer 2012; 22(4): 697– 702. doi: 10.1097/ IGC.0b013e318243b475.
31. Heyns CF. Urinary tract infection associated with conditions causing urinary tract obstruction and stasis, excluding urolithiasis and neuropathic bladder. World J Urol 2012; 30(1): 77– 83. doi: 10.1007/ s00345-011-0725-9.
32. Emmert C, Rassler J, Köhler U. Survival and quality of life after percutaneous nephrostomy for malignant ureteric obstruction in patients with terminal cervical cancer. Arch Gynecol Obstet 1997; 259(3): 147– 151.
33. Ilhan O, Koç H, Akan H et al. Hemorrhagic cystitis as a complication of bone marrow transplantation. J Chemother 1997; 9(1): 56–61. doi: 10.1179/joc.1997.9.1.56.
34. Gandhi J, Chen A, Dagur G et al. Genitourinary syndrome of menopause: an overview of clinical manifestations, pathophysiology, etiology, evaluation, and management. Am J Obstet Gynecol 2016; 215(6): 704– 711. doi: 10.1016/ j.ajog.2016.07.045.
35. Donát J. Klinické aspekty klimaktéria a postmenopauzy. Praha: Avicenum 1987.
36. Goldstein I, Alexander JL. Practical aspects in the management of vaginal atrophy and sexual dysfunction in perimenopausal and postmenopausal women. J Sex Med 2005; 2 (Suppl. 3): 154– 165. doi: 10.1111/ j.1743-6109.2005.00131.x.
Štítky
Dětská onkologie Chirurgie všeobecná Onkologie
Článek vyšel v časopiseKlinická onkologie
Nejčtenější tento týden
2018 Číslo 6- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Neodolpasse je bezpečný přípravek v krátkodobé léčbě bolesti
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
-
Všechny články tohoto čísla
- James P. Allison a Tasuku Honjo
- Dlouhé nekódující molekuly RNA u cervikálních nádorů
- Následky hypoacidity navozené inhibitory protonové pumpy – tipy pro praxi
- Vývodný močový systém a gynekologické malignity
- Infiltrace karcinomů prostaty CD204+ a CD3+ buňkami koreluje s expresí ERG a fúzí genu TMPRSS2-ERG
- Supernatanty Lactobacillus rhamnosus GG a Lactobacillus crispatus SJ-3C-US snižují expresi genů TSGA10, AURKC, OIP5 a AKAP4 v HeLa buňkách
- Použití metody Metal Deletion Technique pro odstraňování artefaktů při plánování radioterapie u pacientů s implantovanými kardiostimulátory
- Efekt a toxicita radioterapie ve vybraných paliativních indikacích
- Zriedkavý malígny PECom obličky – diagnostická výzva a neobvyklá terapeutická odpoveď
- Nediferencovaný karcinóm pankreasu – kazuistika
- Nemalobuněčný karcinom plic s expresí estrogenových receptorů a pozitivitou ALK
- Aktuality z odborného tisku
- Melanom animálního typu – velmi vzácná varianta lidského melanomu
- Význam gastrointestinální flóry v léčbě nádorů pomocí checkpoint inhibitorů
- Jaterní PECom (perivascular epitheloid cell tumor – nádor z perivaskulárních epiteloidních buněk) v diagnostických zobrazovacích metodách – kazuistika
- Klinická onkologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Jaterní PECom (perivascular epitheloid cell tumor – nádor z perivaskulárních epiteloidních buněk) v diagnostických zobrazovacích metodách – kazuistika
- Nediferencovaný karcinóm pankreasu – kazuistika
- Efekt a toxicita radioterapie ve vybraných paliativních indikacích
- James P. Allison a Tasuku Honjo
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



