-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Současné možnosti predikce odpovědi na cílenou anti-EGFR léčbu metastatického kolorektálního karcinomu
Current Possibilities for Predicting Responses to EGFR Blockade in Metastatic Colorectal Cancer
Background:
The combination of modern systemic chemotherapy and anti-EGFR monoclonal antibodies improves overall survival and quality of life for patients with metastatic colorecal cancer. By contrast, the addition of anti-EGFR therapy to the treatment regime of resistant patients may lead to worse progression-free survival and overall survival. Therefore, identifying sensitive and resistant patients prior to targeted therapy of metastatic colorecal cancer is a key point during the initial decision making process. Previous research shows that primary resistance to EGFR blockade is in most cases caused by constitutive activation of signaling pathways downstream of EGFR. Of all relevant factors (mutation of KRAS, NRAS, BRAF, and PIK3CA oncogenes, inactivation of tumor suppressors PTEN and TP53, amplification of EGFR and HER2, and expression of epiregulin and amphiregulin, mikroRNA miR-31-3p, and miR-31-5p), only evaluation of KRAS and NRAS mutations has entered routine clinical practice. The role of the other markers still needs to be validated. The ongoing benefit of anti-EGFR therapy could be indicated by specific clinical parameters measured after the initiation of targeted therapy, including early tumor shrinkage, the deepness of the response, or hypomagnesemia. The accuracy of predictive diagnostic tools could be also increased by examining a combination of predictive markers using next generation sequencing methods. However, unjustified investigation of many molecular markers should be resisted as this may complicate interpretation of the results, particularly in terms of their specific clinical relevance.Aim:
The aim of this review is to describe current possibilities with respect to predicting responses to EGFR blockade in the context of the EGFR pathway, and the utilization of such results in routine clinical practice.Key words:
colorectal cancer – cetuximab – panitumumab – EGFR – KRAS – BRAF
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.Submitted:
20. 3. 2016Accepted:
19. 4. 2016
Autoři: R. Němeček 1
; M. Svoboda 1,2
; O. Slabý 1,3
Působiště autorů: Klinika komplexní onkologické péče LF MU a Masarykův onkologický ústav, Brno 1; Oddělení epidemiologie a genetiky nádorů, Masarykův onkologický ústav, Brno 2; CEITEC – Středoevropský technologický institut, MU, Brno 3
Vyšlo v časopise: Klin Onkol 2016; 29(3): 187-195
Kategorie: Přehledy
doi: https://doi.org/10.14735/amko2016187Souhrn
Východiska:
Kombinace moderní chemoterapie s cílenou anti-EGFR léčbou vede u senzitivních pacientů s metastatickým kolorektálním karcinomem k prodloužení života a zlepšení jeho kvality. U rezistentních pacientů může však přidání monoklonálních protilátek proti EGFR vést naopak ke zhoršení parametrů přežití. Z tohoto důvodu se identifikace senzitivních a rezistentních pacientů stala klíčovou záležitostí při iniciální rozvaze před zahájením cílené léčby metastatického kolorektálního karcinomu. Četné klinické studie vedly ke zjištění, že rezistence k anti-EGFR terapii je v naprosté většině případů spojena s trvalou aktivací signálních drah distálně od EGFR. Z mnoha studovaných faktorů (mutace onkogenů KRAS, NRAS, BRAF a PIK3CA, inaktivace nádorového supresoru PTEN a TP53, amplifikace EGFR a HER2, zvýšená hladina ligandů epiregulinu a amphiregulinu, mikroRNA miR-31-3p a miR-31-5p a další) se do rutinní klinické praxe dostaly pouze KRAS a NRAS. U ostatních faktorů je třeba dalších studií k verifikaci zjištěných závěrů. Na pokračující efektivitu anti-EGFR terapie mohou ukazovat i některé klinické parametry zjištěné až po zahájení cílené léčby, jako např. časná regrese nádoru, hloubka nádorové odpovědi či míra poklesu plazmatické hladiny hořčíku. Přesnost prediktivní diagnostiky lze zvýšit rovněž kombinací vyšetřovaných biomarkerů např. pomocí metod založených na sekvenování nové generace. Je však třeba varovat před nekritickým vyšetřováním řady molekulárních markerů, které může vést k problémům s interpretací získaných výsledků, především jejich klinické relevance.Cíl:
Cílem tohoto přehledu je popsat současné možnosti predikce odpovědi na anti-EGFR terapii v kontextu EGFR signální dráhy a návaznosti na běžnou klinickou praxi.Klíčová slova:
kolorektální karcinom – cetuximab – panitumumab – EGFR – KRAS – BRAFÚvod
Kolorektální karcinom (colorectal cancer – CRC) je jedním z nejčastějších zhoubných nádorových onemocnění [1]. Každoročně je diagnostikován u více než 1 360 000 lidí na celém světě, přibližně 694 000 nemocných v důsledku CRC každým rokem umírá. Ve vyspělých zemích je CRC druhou nejčastější příčinou úmrtí na nádorové onemocnění. ČR je pátou zemí s nejvyšší incidencí CRC [2]. Metastázy jsou zachyceny u cca 25 % pacientů již v době diagnózy, u dalších 25 – 40 % pacientů se vyvinou až s odstupem po primární chirurgické a onkologické léčbě [3]. Nejčastěji jsou postižena játra a plíce. Šanci na dlouhodobé přežití nabízí radikální metastasektomie, která je proveditelná u méně než 20 % pacientů. Většina nemocných je léčena systémovou paliativní terapií založenou na aplikaci kombinace cytostatik (5-fluorouracil a oxaliplatina nebo irinotekan) a monoklonálních protilátek (cetuximab nebo panitumumab a bevacizumab, aflibercept nebo ramucirumab). První dvě z uvedených protilátek blokují receptor pro epidermální růstový faktor (epidermal growth factor receptor – EGFR), další tři protilátky inhibují různé formy vaskulárního endotelového růstového faktoru (vascular endothelial growth factor – VEGF). Všechny uvedené léčebné modality zlepšují celkové přežití (overall survival – OS) [4]. V kombinaci s chemoterapií dosahuje anti-EGFR terapie (v porovnání s léčbou cílenou na VEGF) vyššího procenta léčebných odpovědí a výraznější regrese objemu nádorové tkáně, a proto se využívá k pokusu o konverzi hraničně resekabilního nebo neresekabilního onemocnění na onemocnění resekabilní [5]. Efektivita obou skupin cílených léčiv je však při samostatném podání poměrně nízká. U anti-EGFR monoterapie se uvádí četnost léčebných odpovědí (response rate – RR) v rozmezí 10 – 20 %, monoklonální protilátky proti VEGF se v monoterapii nepoužívají vůbec. V kombinaci s chemoterapií dochází u obou skupin k navýšení RR na 55 – 65 % [4,5]. Přibližně 35 – 45 % pacientů však na kombinaci chemoterapie s cílenou léčbou neodpoví, u některých pacientů může dokonce anti-EGFR terapie vést ke zhoršení času bez progrese onemocnění (progression-free survival – PFS) a OS [6,7]. Ve snaze o aplikaci cílené léčby pouze pacientům s nejvyšší pravděpodobností léčebné odpovědi probíhá intezivní výzkum molekulárních faktorů predikujících odpověď nebo rezistenci k této nákladné terapii ještě před jejím zahájením.
V případě terapie zaměřené na VEGF jsou možnosti predikce léčebné odpovědi prozatím velmi omezené [8,9]. Testují se prediktivní modely zahrnující symptomatologii onemocnění, lokalizaci a typ nádoru, iniciální odpověď na chemoterapii a další. Klinická data potvrzující jejich využití jsou však insuficientní a chybí verifikace výsledků v prospektivních studiích. V případě monoklonálních protilátek proti EGFR je situace zcela odlišná. Objevení souvislosti mezi aktivační mutací onkogenu KRAS a rezistencí CRC k anti-EGFR terapii bylo jedním z nejvýznamnějších milníků v oblasti prediktivní diagnostiky solidních nádorů [10,11]. Vyloučení mutace KRAS se stalo nezbytnou podmínkou úhrady cetuximabu a panitumumabu vyžadovanou regulačními autoritami. Řada dalších studií vedla ke zjištění, že rezistence k anti-EGFR terapi je u metastatického CRC (mCRC) v naprosté většině případů spojena s konstitutivní aktivací signálních drah spojujících EGFR s jádrem nádorové buňky [12].
Cílem tohoto review je popsat patofyziologii EGFR signální dráhy a současné možnosti predikce odpovědi na anti-EGFR terapii v návaznosti na běžnou klinickou praxi.
Struktura EGFR signální dráhy
Receptor pro EGFR je abnormálně aktivován u velké části nádorových onemocnění [13]. U CRC je overexprese EGFR detekovatelná u cca 50 % pacientů a je asociována s progresí nádoru, horší prognózou a sníženou senzitivitou k chemoterapii [14]. EGFR gen (avian erythroblastosis oncogene B1/ ErbB1/ HER1), uložený na chromozomu 7p12-13, kóduje transmembránový receptor s tyrozinkinázovou aktivitou patřící do ErbB (HER) rodiny receptorů. Tato rodina zahrnuje rovněž receptory HER2/ neu (ErbB2), HER 3 (ErbB3) a HER4 (ErbB4). S výjimkou receptoru HER2, který postrádá schopnost navázat ligand, vážou HER-receptory s variabilní afinitou různé ligandy vč. EGF, TGF-α (transforming growth factor α), epiregulinu, betacellulinu, HB-EGF (heparin binding EGF-like growth factor), amphiregulinu, epigenu, heregulinu a neuregulinů 1 – 4 [15]. Dle afinity k EGFR rozlišujeme ligandy vysokoafinitní (EGF, TGF-α, betacellulin a HB-EGF) a nízkoafinitní (epiregulin, amphiregulin a epigen) [16]. Navázání ligandu indukuje homodimerizaci nebo heterodimerizaci jednotlivých receptorů ErbB rodiny a následnou autofosforylaci tyrozinových zbytků v cytoplazmatické části receptoru. Výjimkou je receptor HER3, který vlastní kinázovou aktivitu postrádá, ale může vytvořit heterodimery s ostatními receptory z ErbB rodiny a ty stimulovat. K fosforylovaným tyrozinovým zbytkům jsou přitahovány tzv. adaptorové proteiny, které aktivují downstreamové signální transdukční kaskády (schéma 1).
Schéma 1. Struktura EGFR signální dráhy. 
Nejčastěji je prostřednictvím EGFR aktivována MAP kinázová signální dráha (mitogen-activated protein kinase pathway), kde prvním z klíčových proteinů je protein RAS (rat sarcoma viral oncogene homolog). Jsou popisovány tři rozdílné RAS proteiny: KRAS, NRAS (neuroblastoma RAS viral oncogene homolog) a HRAS (harvey RAS viral oncogene homolog). Aktivovaný protein KRAS lze identifikovat podle vazby na GTP (guanosintrifosfát). Díky vlastní defosforylační (GTPázové) aktivitě však dochází ke konverzi GTP na GDP (guanosindifosfát), a tím ke spontánní inaktivaci proteinu KRAS. Následné uvolnění GDP z proteinu KRAS je katalyzováno pomocí GEF (guanine nukleotide exchange factor), který usnadňuje reaktivaci KRAS navázáním nové molekuly GTP. Aktivovaný protein KRAS fosforyluje serin-threoninovou kinázu RAF (rapidly accelerated fibrosarcoma), která následně aktivuje MEK (mitogen-activated protein kinase). Aktivní kináza MEK fosforyluje ERK (extracellular signal-regulated kinase), nazývanou též MAPK (mitogen-activated protein kinase), a ta aktivuje v jádře nádorové buňky faktory stimulující transkripci genů zodpovědných za buněčnou proliferaci [17].
Bylo popsáno několik mutací postihujících signální dráhu RAS/ RAF/ MEK/ ERK, které způsobují její trvalou aktivaci a následnou buněčnou proliferaci nezávislou na růstových faktorech. Mutace KRAS v kodonech 12 a 13 (v exonu 2) jsou přítomné u přibližně 40 % pacientů s CRC [18]. Dalších cca 5 % pacientů s CRC má mutaci KRAS v exonech 3 nebo 4 (obvykle v kodonech 61 nebo 146) a dalších 5 % je nositelem mutace NRAS v exonech 2, 3 nebo 4. Přibližně 10 % pacientů má mutaci BRAF (v-raf murine sarcoma viral oncogene homolog B1) v kodonu 600 [18].
Ačkoliv je RAS/ RAF/ MEK nejčastější signální dráhou aktivovanou skrze EGFR, existují další signální dráhy, které prostřednictvím aktivace receptorů ErbB ovlivňují buněčnou proliferaci a přežití nádorových buněk a které se s RAS/ RAF/ MEK dráhou navzájem kříží. Aktivace PI3K (phosphatidylinositol 3-kinase) je přímo napojena na receptory ErbB3 a ErbB4 a nepřímo napojena na receptory ErbB1 a ErbB2. Aktivovaná PI3K následně fosforyluje AKT (AKT8 virus oncogene cellular homolog) a kinázu S6 (small subunit ribosomal protein S6). Přibližně u 50 % CRC byly popsány alterace v signální dráze PI3K. Nejčastější je aktivační mutace PIK3CA (phosphatidylinositol-4, 5-biphosphate 3-kinase, catalytic subunit alpha), která se vyskytuje u 15 % nehypermutovaných a 37 % hypermutovaných CRC [18]. Další dráhy aktivované prostřednictvím receptorů ErbB rodiny zahrnují fosfolipázu Cγ, proteinkinázu C a dráhu Jak/ Stat (Janus-family tyrosine kinase/ Signal transducer and activator of transcription). Aktivace těchto signálních drah patří mezi kompenzační mechanizmy, kterými nádorové buňky reagují na nově vzniklou blokádu EGFR a které mohou být příčinou vzniku získané (sekundární) rezistence k anti-EGFR terapii [12].
Faktory predikující rezistenci k anti-EGFR terapii
RAS (KRAS, NRAS)
Důsledkem mutace onkogenu KRAS (mKRAS) je zablokování GTPázové aktivity proteinu a jeho trvalá aktivace. Aktivovaný protein KRAS pak vysílá stimulační signál směrem k jádru nádorové buňky bez ohledu na stimulaci EGFR ligandem nebo jeho zablokování monoklonální protilátkou (monoclonal antibody – moAb). Důkazy o tom, že mKRAS způsobuje rezistenci k anti-EGFR terapii, byly publikovány již dva roky po uvedení cetuximabu do klinické praxe [10]. Následné retrospektivní analýzy velkých klinických studií fáze III hodnotících efektivitu cetuximabu či panitumumabu v kombinaci s chemoterapií v 1. linii léčby mCRC toto zjištění potvrdily a vyloučení mutace KRAS se stalo nezbytnou podmínkou zahájení anti-EGFR terapie [11,19 – 20]. K dalšímu zpřesnění prediktivní diagnostiky mCRC došlo v roce 2013. Retrospektivní analýza studie PRIME hodnotící u nemutovaných KRAS (wtKRAS) pacientů s mCRC efektivitu kombinace FOLFOX (oxaliplatina ++ 5-fluorouracil + leukovorin)/ panitumumab oproti chemoterapii FOLFOX samotné prokázala, že kromě běžně vyšetřovaných mutací KRAS v exonu 2 (v kodonech 12 a 13) jsou za rezistenci k panitumumabu zodpovědné i mutace onkogenu KRAS v exonu 3 (kodon 59 a 61) a 4 (kodon 117 a 146) a také mutace onkogenu NRAS ve stejných exonech (2, 3 a 4) [6,21]. Navíc bylo zjištěno, že podání panitumumabu pacientům s jakoukoliv mutací KRAS či NRAS má detrimentální efekt ve smyslu zhoršení PFS a OS oproti léčbě chemoterapií samotnou (OS 15,6 vs. 19,2 měsíce, HR 1,21; p = 0,04) [21]. Podobné výsledky byly získány při retrospektivních analýzách studií CRYSTAL a OPUS hodnotících vliv přidání cetuximabu k režimům FOLFIRI (irinotekan + 5-fluorouracil + leukovorin) a FOLFOX v 1. linii léčby mCRC. Pacienti s mutací RAS (mRAS) z přidání cetuximabu nebenefitovali [22], nebo jím byli podobně jako ve studii PRIME dokonce poškozeni [23]. Naopak u pacientů s wild-type RAS (wtRAS) ve všech vyšetřovaných exonech (2, 3 a 4) byl benefit přidání anti-EGFR moAb k chemoterapii samotné mnohem výraznější než při původním hodnocení skupiny pacientů s wtKRAS v exonu 2 (tab. 1).
Tab. 1. Porovnání OS u wtKRAS, wtRAS a mRAS pacientů v 1. linii anti-EGFR léčby mCRC. 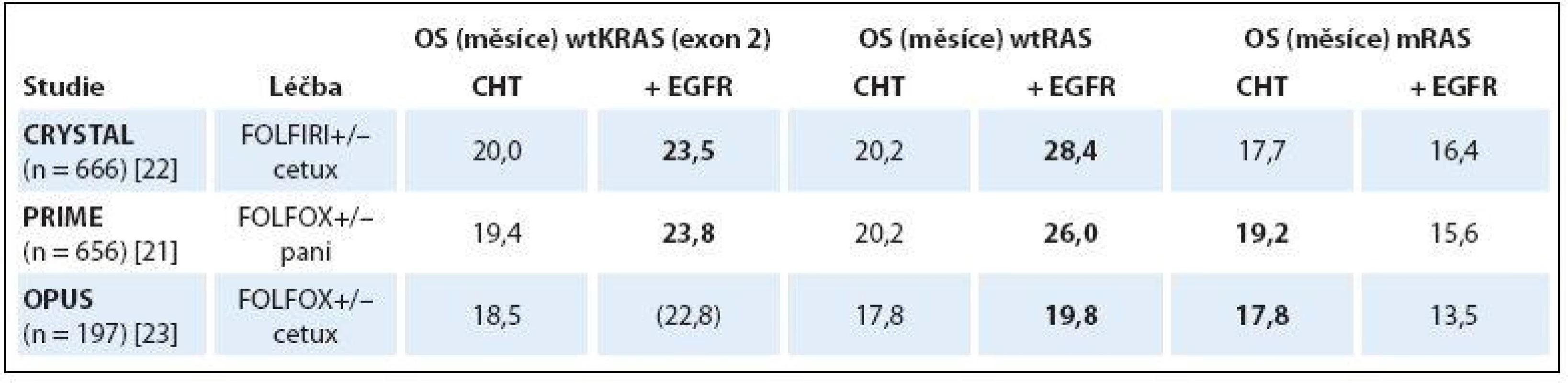
wtKRAS – wild-type KRAS (v exonech 2 a 3), wtRAS – wild-type RAS (KRAS a NRAS v exonech 2, 3 a 4), mRAS – mutovaný RAS, CHT – chemoterapie, EGFR – cílená léčba proti receptoru pro epidermální růstový faktor, FOLFIRI – irinotekan + 5-fl uorouracil + leukovorin, FOLFOX – oxaliplatina + 5-fl uorouracil + leukovorin, cetux – cetuximab, pani – panitumumab, OS – celkové přežití Superioritu anti-EGFR nad anti-VEGF terapií u podskupiny pacientů s wtRAS v 1. linii léčby mCRC měly prokázat dvě přímé head-to-head studie fáze III, v jejichž původním designu bylo hodnocení pouze pacientů s wtKRAS (exon 2) nádory. Německá studie FIRE-3 hodnotící efektivitu kombinace FOLFIRI/ cetuximab oproti kombinaci FOLFIRI/ bevacizumab sice svůj primární cíl zlepšení RR u skupiny pacientů s wtKRAS nesplnila, nicméně při subanalýze zaměřené pouze na pacienty s wtRAS již byly rozdíly v RR evidentní (72 vs. 56,1 %; p = 0,003) [7,24]. Naopak rozsáhlá americká akademická studie CALGB 80405 porovnávající přidání cetuximabu nebo bevacizumabu k režimům FOLFOX nebo FOLFIRI (dle volby lékaře) výraznější rozdíly mezi anti-EGFR a anti-VEGF terapií ani při analýze podskupiny pacientů s wtRAS neprokázala [25]. Plné znění studie dosud publikováno nebylo a je s napětím očekáváno. Recentní metaanalýza hodnotící data z devíti studií definitivně potvrdila, že podání anti-EGFR terapie pacientům s jakoukoliv mutací RAS nepřináší těmto pacientům žádný terapeutický benefit [26]. Souhrnně lze tedy říci, že analýzou mutací onkogenu RAS v exonech 2, 3 a 4 jsme v současné době schopni odfiltrovat cca 50 % pacientů s mCRC, kteří jsou k léčbě cetuximabem či panitumumabem evidentně refrakterní.
BRAF
BRAF je protoonkogen lokalizovaný na chromozomu 7 (7q34), který patří do rodiny RAF genů (ARAF, BRAF a CRAF). Kóduje serin-threoninovou proteinkinázu, která navazuje na RAS v signální dráze RAS – RAF – MEK – ERK. Mutace onkogenu BRAF (mBRAF) se vyskytuje u cca 40 – 60 % melanomů, 45 % papilárních karcinomů štítné žlázy, 35 % serózních karcinomů ovaria a u 5 – 15 % mCRC [27]. Nejčastěji se jedná o mutaci V600E v aktivační doméně kinázy BRAF na exonu 15. Záměnou valinu za glutamát v kodonu 600 dojde ke konstitutivní aktivaci RAF kinázy a tím i celé RAS/ RAF signální dráhy bez ohledu na stav EGFR [28]. Mutace BRAF je vzájemně exkluzivní s mutací RAS, neboť koexistence obou mutací brání proliferaci a vytváří negativní selekční tlak [29]. Z hlediska výskytu je mBRAF častější u proximálních (pravostranných) CRC, u starších pacientů (zejména žen), u nádorů nízce diferencovaných, s mucinózní histologií a s mikrosatelitní instabilitou (MSI-H) [30]. U pacientů s mCRC je mBRAF jednoznačně prokázaným negativně prognostickým faktorem nezávisle na podané léčbě [31]. Negativně prediktivní potenciál této mutace ve vztahu k anti-EGFR terapii zůstává nadále nejasný. Ačkoliv dvě recentní metaanalýzy negativně prediktivní potenciál mBRAF potvrdily [32,33], horší výsledky u wtRAS/ mBRAF pacientů byly prokázány především u předléčených pacientů ve 2. a dalších liniích léčby [34,35]. V 1. linii léčby mCRC jsou výsledky studií kontroverzní. Některé retrospektivní studie rezistenci k anti-EGFR terapii potvrzují [36,37], jiné ne [38]. Sdružená analýza studií CRYSTAL a OPUS hodnotící přidání cetuximabu k režimu FOLFIRI nebo FOLFOX prokázala jednoznačné zlepšení PFS i OS u pacientů s wtRAS/ wtBRAF [39]. V podskupině 70 pacientů s wtRAS/ mBRAF bylo sice zlepšení PFS i OS rovněž pozorováno, ale kvůli nízkému počtu pacientů již rozdíly nebyly statisticky signifikantní. Svoji roli zde jistě sehrál i negativně prognostický vliv mBRAF, neboť při porovnání pacientů léčených pouze chemoterapií dosahovali pacienti s mBRAF evidentně horších výsledků než pacienti s wtBRAF. Rovněž analýza pacientů s mBRAF ve studiích PRIME a FIRE-3 negativně prediktivní efekt mBRAF ve vztahu k anti-EGFR terapii nepotvrdila [6]. Recentní prospektivní studie hodnotící prediktivní význam mBRAF u wtRAS mCRC pacientů ukázala, že pacienti s mBRAF mají oproti pacientům s wtBRAF horší PFS i OS, ovšem statisticky signifikantní je tento rozdíl opět pouze ve 2. a dalších liniích léčby, nikoliv v 1. linii [40]. V současné době by tedy zjištění mBRAF nemělo být důvodem k nepodání anti-EGFR terapie v 1. linii léčby mCRC. Existuje však rostoucí evidence o mBRAF jako jednom z mechanizmů sekundární (získané) rezistence vznikající v průběhu léčby cetuximabem či panitumumabem [41,42].
PIK3CA
Fostatidyl-inositol-3-kináza (PI3K) patří do rodiny lipidových kináz, které konvertují fosfatidyl-inositol-2-fosfát (PIP2) na fosfatidyl-inositol-3-fosfát (PIP3), fosforylují AKT a aktivují dráhu PI3K/ AKT/ mTOR ovlivňující buněčnou proliferaci a přežití buněk [43]. Pro CRC je důležitá PI3K třídy IA, která je významným efektorem receptorů ErbB1–4. Jedná se o heterodimer složený z regulační podjednoty (p85), kotvící kinázu k vazebným místům EGFR, a katalytické podjednotky (p110), zodpovědné za fosforylaci a přenos signálu na AKT. Ze somatických mutací se u nádorových onemocnění vyskytují především aktivační mutace onkogenu PIK3CA, který kóduje katalytickou podjednotku p110 [44]. Tyto mutace jsou popisovány u cca 15 – 20 % CRC a mohou koexistovat současně s mutacemi RAS nebo BRAF [45]. Většina mutací PIK3CA (mPIK3CA) je lokalizovaných v exonu 9 (60 – 65 % mutací) a v exonu 20 (20 – 25 % mutací) a vede ke konstitutivní aktivaci celé downstream dráhy AKT/ mTOR nezávisle na blokádě EGFR.
Potenciální vliv mPIK3CA na rezistenci k anti-EGFR terapii mCRC byl studován v několika retrospektivních studiích, jejichž výsledky jsou rozporuplné [46,47]. Vysvětlení přinesla rozsáhlá retrospektivní analýza konsorcia evropských studií zahrnující 708 chemorefrakterních pacientů s mCRC léčených cetuximabem, která ukázala, že pouze mutace PIK3CA v exonu 20, nikoliv v exonu 9, jsou signifikantně spojeny s horším RR, PFS i OS při porovnání s pacienty bez této mutace [35]. Prediktivní význam mutací v exonu 20 posiluje i fakt, že tato mutace je vzájemně exkluzivní s mutací KRAS. Naopak mutace v exonu 9 byla často detekována právě u pacientů KRAS mutovaných. Rozdílné zastoupení mutací exonu 9 a exonu 20 v předchozích studiích vysvětluje jejich konfliktní výsledky. Mutace PIK3CA v exonu 20 tedy mohou hrát roli v rezistenci k anti-EGFR terapii zejména u pacientů s wtKRAS mCRC, což potvrdily dvě recentní metaanalýzy [33,48]. K tomu, aby však mohly tyto nízce frekventní mutace ovlivnit selekci pacientů k anti-EGFR terapii v běžné klinické praxi, je nutná jejich validace v dalších prospektivních klinických studiích.
Ztráta PTEN
PTEN (phosphatase and tensin homolog) je tumor supresorový gen lokalizovaný na chromozomu 10, který kóduje protein (fosfatázu) brzdící PI3K/ AKT/ mTOR signalizaci. U cca 20 – 40 % mCRC dochází na podkladě genetických i epigenetických mechanizmů k inaktivaci PTEN [49], což vede k navýšení koncentrace PIP3, konstitutivní hyperaktivaci signální dráhy PI3K/ AKT/ mTOR a v konečném důsledku ke zvýšení proliferace a přežívání nádorových buněk [50]. Retrospektivní studie zkoumající podíl ztráty PTEN na rezistenci k anti-EGFR terapii přinesly nekonkluzivní výsledky. Podobně jako u karcinomu prsu v nich byla inaktivace PTEN definována ztrátou imunohistochemické (IHC) exprese. Ve studii Loupakise et al byla ztráta exprese PTEN u 102 chemorefrakterních pacientů s mCRC léčených cetuximabem a irinotekanem spojena s horší odpovědí na léčbu. Rozdíl v RR byl však signifikantní pouze při hodnocení výsledků analýzy PTEN z metastatických lézí, nikoliv ze vzorků primárních nádorů, což ukazuje na možnost změny exprese PTEN v průběhu nádorového onemocnění (např. v důsledku klonální selekce) [51]. PFS byl u PTEN-pozitivních pacientů rovněž delší, signifikatní prodloužení OS však bylo potvrzeno pouze u pacientů s vyloučenou mutací onkogenu RAS. Retrospektivní francouzská studie sice na souboru chemorefrakterních pacientů s wtRAS mCRC žádné rozdíly v RR či PFS ve vztahu k PTEN neprokázala, pacienti PTEN-negativní však vykazovali signifikantně horší OS [36]. I když recentní metaanalýza prokázala, že ztráta exprese PTEN je signifikantně spojena s nedostatečným benefitem anti-EGFR terapie u wtRAS mCRC, autoři uzavírají, že prediktivní vliv mutací BRAF a PIK3CA je významnější než vliv ztráty PTEN [33]. Podobně jako u mPIK3CA jsou pro použití v běžné klinické praxi nutné rozsáhlejší prospektivní klinické studie a především standardizace metody detekce PTEN exprese. V současné době tedy není možno považovat PTEN za validní prediktivní nebo prognostický marker mCRC.
EGFR-ligandy epiregulin a amphiregulin
Vysoká exprese EGFR-ligandů epiregulinu a amphiregulinu je jedním ze znaků autokrinní aktivace EGFR-signální dráhy a označuje nádor senzitivní k anti-EGFR terapii [52]. Prof. Jacobs v roce 2009 publikoval práci, ve které na souboru 220 pacientů s mCRC léčených kombinací irinotekan + cetuximab zjišťoval vliv mRNA exprese epiregulinu a amphiregulinu na OS, RR i PFS. Vyšetření prováděl na parafinových bločcích nádorové tkáně, samozřejmostí bylo vyšetření stavu KRAS. Kromě potvrzení negativně prediktivního vlivu mKRAS tým autorů dále zjistil, že pomocí stanovení hladiny ligandů EGFR lze pacienty s wtKRAS rozdělit do dvou evidentně odlišných skupin. Zatímco pacienti s wtKRAS a vysokou hladinou epiregulinu vykazovali nejlepší léčebné výsledky (medián OS 65 týdnů), pacienti s wtKRAS a nízkou hladinou epiregulinu na léčbu spíše neodpovídali a svými klinickými charakteristikami se přibližovali skupině pacientů s mKRAS (medián OS 31 týdnů). Stanovení hladiny exprese epiregulinu tedy pomohlo vyčlenit ze skupiny pacientů s wtKRAS podskupinu velmi pravděpodobných respondérů. Rovněž analýza exprese hladiny epiregulinu a amphiregulinu ve studii PICCOLO (irinotekan vs. irinotekan + panitumumab u 323 předléčených pacientů s wtRAS mCRC) [53] potvrdila, že vysoká exprese ligandů predikuje benefit panitumumabu u pacientů s wtRAS mCRC, naopak pacienti s nízkou hladinou ligandů z aplikace panitumumabu nebenefitovali. Prognostický význam hladiny epiregulinu a amhiregulinu potvrzen nebyl [54]. Uvedená data ukazují, že stanovení hladiny exprese EGFR ligandů může být slibnou cestou k cílenější selekci wtRAS pacientů léčených anti-EGFR terapií. Aby se však tato hypotéza mohla stát součástí běžné klinické praxe, je zapotřebí její verifikace v dalších klinických studiích.
HER2 amplifikace
HER2 je receptor postrádající schopnost navázat ligand, který je odkázán na heterodimerizaci s ostatními ErbB receptory, zejména EGFR a HER3. Amplifikace HER2 se, v závislosti na své intenzitě, může podílet na rezistenci k anti-EGFR terapii [55,56]. Recentní retrospektivní studie analyzující pomocí FISH (fluorescenční in situ hybridizace) HER2 status u 170 wtKRAS mCRC pacientů léčených cetuximabem nebo panitumumabem rozdělila pacienty do tří podskupin: 1. s minimální či žádnou amplifikací HER2 (35 % pacientů); 2. s HER2 amplifikací u minoritních klonů, případně se zvýšeným počtem kopií genu pro HER2 v důsledku polyzomie (61 %); 3. s HER2 amplifikací ve všech buňkách (4 %) [57]. Nejhorší léčebné výsledky byly pozorovány u skupiny 3, kde v důsledku hyperaktivace HER2 dochází pravděpodobně k bypassu EGFR blokády a vzniku rezistence k anti-EGFR terapii. U této malé skupiny pacientů (jen 4 %) by bylo na místě zvážení blokády HER2. Naopak nejlepší výsledky vykazovali pacienti s HER2 amplifikací u minoritních klonů nebo s polyzomií. Souvislost hladiny mRNA pro HER2 s PFS a OS byla pozorována i u pacientů léčených cetuximabem a chemoterapií v 1. linii léčby mCRC v rámci studie CALGB 80203 [58]. Přestože ke stanovení definitivních závěrů je třeba dalších prospektivních studií, je prediktivní potenciál HER2 overexprese v souvislosti s anti-EGFR terapií velmi pravděpodobný.
Exprese EGFR na povrchu nádorové buňky
Pilotní klinické studie ověřující efektivitu cetuximabu u mCRC hodnotily zejména pacienty s imunohistochemicky ověřenou overexpresí EGFR [59,60]. Analogicky jako u karcinomu prsu, kde overexprese HER2 představuje nutnou podmínku efektivity trastuzumabu, se totiž předpokládalo, že bez overexprese EGFR nemůže protilátka proti tomuto receptoru fungovat. Relativně záhy byl však potvrzen efekt cetuximabu i u pacientů s negativní expresí EGFR [61]. Přesto trvalo poměrně dlouhou dobu, než regulační autority přestaly vyžadovat potvrzení EGFR exprese před zahájením cílené anti-EGFR léčby. Mezi hlavní důvody nulové prediktivní hodnoty EGFR exprese bývá uváděna omezená senzitivita IHC, chybějící standardizace, neschopnost rozlišit tzv. vysokoafinitní EGFR (kterých je sice jen 5 %, ale tvoří hlavní biologicky aktivní formu receptoru) a nízkoafinitní EGFR (95 % všech EGFR s nízkou biologickou aktivitou), riziko znehodnocení vzorků nádoru při dlouhém skladování a problém rozdílnosti epitopů EGFR pro monoklonální protilátku a pro IHC detekci [61].
Amplifikace genu pro EGFR
V četných retrospektivních klinických studiích bylo prokázáno, že již malé zvýšení počtu kopií genu pro EGFR (gene copy numer – GCN – nad 2,5 kopií genu na jádro buňky), stanovené metodou FISH nebo PCR koreluje s vyšší četností léčebných odpovědí i PFS při terapii cetuximabem [36,62 – 64]. Naopak pacienti s EGFR GCN pod uvedenou hranicí na anti-EGFR léčbu odpovídali hůře nebo vůbec. Tento stupeň amplifikace (vyvolaný většinou polyzomií než skutečnou amplifikací genu) je popisován u cca 30 % pacientů s mCRC. Ověření prediktivního potenciálu EGFR GCN v prospektivních klinických studiích však komplikuje řada faktorů, především problematická technická reproducibilita a vysoká interlaboratorní variabilita vyšetření a rozdílná hodnota cutoff používaná jednotlivými výzkumnými skupinami [65]. Z těchto důvodů se využití EGFR GCN v reálné klinické praxi prozatím neočekává.
Kombinace biomarkerů
Současným stanovením několika uvedených faktorů lze zvýšit celkovou prediktivní hodnotu testu. Retrospektivní analýza mutací PIK3CA, KRAS, BRAF a PTEN v souboru 132 pacientů s mCRC léčených anti-EGFR terapií vedla k odhalení až 70 % non-respondérů [66]. Pravděpodobnost léčebné odpovědi vyloučením jednotlivých mutací postupně narůstala (RR 0 % u pacientů s alterací ve dvou a více vyšetřovaných genech, 4 % u pacientů s alterací v jednom genu a 51 % u tzv. quadruple negativních pacientů s absencí alterace ve všech čtyřech uvedených genech). Naopak hodnoty PFS a OS s narůstajícím počtem alterací progresivně klesaly. Podobné výsledky byly publikovány při analýze mutací KRAS, BRAF a PTEN a EGFR GCN [36]. S nastupující érou sekvenování nové generace (next generation sequencing – NGS) se možnosti multigenní detekce výrazně zjednodušují a do prováděných analýz je již v současné době možné zařadit stále více genů se známou prediktivní nebo prognostickou hodnotou [67]. Problematické ovšem zůstává racionální vyhodnocení získaných výsledků a jejich klinických konsekvencí.
Klinické faktory ovlivňující odpověď na anti-EGFR terapii
Specifickou skupinou jsou faktory klinické, které předpovídají pokračující odpověď na anti-EGFR léčbu až po určité době jejího trvání, nikoliv před jejím zahájením. Vycházejí buď ze specifických nežádoucích účinků podávané léčby (akneiformní rash, hypomagnezemie), nebo z intenzity léčebné odpovědi při prvním přešetření (časná regrese nádoru).
Akneiformní exantém (rash)
Receptor EGFR se kromě nádorové tkáně vyskytuje ve zvýšené míře i v kůži a v kožních adnexách, proto je akneiformní exantém typickým vedlejším účinkem léčby cetuximabem a panitumumabem. Prevalence exantému je 80 – 100 % a jeho intenzita koreluje s vyšším RR i OS [59,68 – 70]. Předpokládalo se, že exantém může ukazovat na lokální saturaci EGFR v nádorové tkáni. Z tohoto důvodu byly prováděny studie s navýšením dávky cetuximabu u pacientů bez exantému ve snaze o zlepšení efektivity léčby [71]. Zdvojnásobením obvyklé týdenní dávky cetuximabu bylo dosaženo navýšení RR (30 vs. 16 %), ale nikoliv zlepšení OS. Navýšení RR bylo navíc pozorováno pouze u pacientů s wtKRAS. Argumentů proti prediktivnímu využití akneiformního exantému je však celá řada: 1. rash se objevuje i u pacientů bez odpovědi na anti-EGFR léčbu a naopak – neobjevuje se u všech pacientů s odpovědí [72]; 2. rash ukazuje na lokální saturaci EGFR v kůži a nikoliv v nádoru [71]; 3. reakce kůže na podávanou léčbu může být individuální [73]. Je tedy třeba vyčkat výsledků dalších prospektivních studií k objasnění prediktivní a prognostické hodnoty kožní toxicity anti-EGFR terapie [74].
Hypomagnezemie
EGFR je výrazně exprimován ve vzestupném raménku Henleovy kličky, kde ovlivňuje iontový kanál zodpovědný za zpětnou reabsorbci magnezia (Mg) z glomerulárního filtrátu. Blokáda EGFR tedy vede k hypomagnezemii. Dle publikované metaanalýzy 14 randomizovaných klinických studií byla hypomagnezemie potvrzena u 17 % pacientů léčených cetuximabem či panitumumabem [75]. Přidání anti-EGFR terapie zvýšilo relativní riziko vzniku hypomagnezemie oproti pacientům léčeným pouze chemoterapií na 3,87 u cetuximabu (resp. 12,55 u panitumumabu), relativní riziko závažné hypomagnezemie bylo zvýšeno na 7,48 u cetuximabu (resp. 10 u panitumumabu). Byla popsána korelace mezi hypomagnezemií a klinickou odpovědí na anti-EGFR terapii [76 – 78]. Ve studii Vincenziho et al byl u pacientů s poklesem Mg o více než 20 % oproti baseline hodnotám pozorován při terapii cetuximabem a irinotekanem signifikantně vyšší RR (66 vs. 25,6 %; p = 0,004), PFS (6 vs. 3,9 měsíce; p < 0,0001) i OS (10,7 vs. 8,9 měsíce; p = 0,021) [76]. Podobné výsledky publikovali stejní autoři o tři roky později [77]. V kontrastu s uvedeným jsou však výsledky studie NCI-CTG CO.17, ve které byl pokles hladiny Mg o více než 20 % oproti baseline (stanovený po 1. měsíci léčby) spojen se zhoršením OS [78]. Přestože prediktivní potenciál hypomagnezemie zůstává nejasný, je doporučeno pravidelně kontrolovat plazmatickou hladinu hořčíku v průběhu anti-EGFR léčby a případný deficit substituovat.
Časná regrese nádoru
Iniciální změna objemu nádorové tkáně při systémové léčbě mCRC predikuje dlouhodobou úspěšnost léčby a ovlivňuje i OS [79]. Byly definovány pojmy „hloubka nádorové odpovědi“ (deepness of response – DOR) a „časná regrese nádoru“ (early tumor shrinkage – ETS). DOR označuje procento zmenšení objemu nádoru při nadiru oproti stavu při zahájení léčby [80]. ETS ukazuje na stupeň regrese nádorového postižení při prvním hodnocení efektu léčby. Většinou bývá uváděna objemová regrese nádoru o ≥ 20 % v 8. týdnu léčby, která je již významná z hlediska ovlivnění OS [81]. Otázkou je, zda se u pacientů, kteří tohoto stupně regrese nádoru po určité době léčby nedosáhli, promítne další pokračování v cílené léčbě do významného prodloužení OS, či nikoliv.
Další potenciální prediktivní faktory
V souvislosti s efektivitou anti-EGFR terapie jsou uváděny některé další faktory, např. mutace nádorového supresoru TP53 [82] nebo alterace dalšího z tumor supresorových genů FBXW7 (F-box/ WD repeat-containing protein 7), který kóduje protein uplatňující se v procesu ubikvitinace Cyclinu E, Notch a řady proteinových produktů významných protoonkogenů (MYC, JUN) [83]. Rovněž zde hrají důležitou roli epigenetické mechanizmy. MikroRNA (miRNA) jsou krátké, 18 – 25 nukleotidů dlouhé nekódující jednořetězcové RNA, které regulují expresi cílového genu na posttranskripční úrovni. Většinou tlumí translaci nebo zvyšují degradaci cílové mRNA, mohou však fungovat i jako aktivátory translace. Každá miRNA může regulovat řádově stovky cílových mRNA a v závislosti na buněčném kontextu může jedna miRNA vykonávat jak funkci onkogenu, tak nádorového supresoru. Bylo zjištěno, že EGFR signalizace je přímo regulována prostřednictvím miRNA [84] a recentní práce dokonce ukazují na vztah mezi miRNA a senzitivitou k anti-EGFR terapii [85]. U pacientů s wtRAS mCRC léčených cetuximabem byla prokázána signifikantní korelace mezi PFS a miR-31-3p a miR-31-5p. V naší práci jsme na retrospektivním souboru 69 pacientů s wtRAS mCRC léčených cetuximabem prokázali až 3,2násobně delší PFS u skupiny pacientů s nízkou hladinou miR-31-3p a miR-31-5p oproti skupině pacientů s vysokou hladinou miR-31-3p a miR-31-5p [86].
Závěr
Kombinace moderní chemoterapie s cílenou anti-EGFR léčbou vede u senzitivních pacientů s mCRC k výraznému prodloužení života a zlepšení jeho kvality. U rezistentních pacientů může naopak přidání monoklonálních protilátek proti EGFR vést ke zhoršení PFS i OS, a tím pacienty poškodit. Z tohoto důvodu se identifikace senzitivních a rezistentních pacientů stala klíčovou záležitostí při iniciální rozvaze před zahájením cílené léčby mCRC. Četné klinické studie vedly ke zjištění, že rezistence k anti-EGFR terapii je v naprosté většině případů spojena s konstitutivní aktivací signálních drah distálně od EGFR. Ze studovaných faktorů (mutace onkogenů KRAS, NRAS, BRAF a PIK3CA, inaktivace nádorového supresoru PTEN a TP53, amplifikace EGFR a HER2, zvýšená hladina ligandů epiregulinu a amphiregulinu, mikroRNA miR-31-3p a miR-31-5p a další) se do rutinní klinické praxe probojovaly pouze KRAS a NRAS. U ostatních faktorů není dosavadní klinická evidence dostatečná a je zapotřebí dalších studií k verifikaci zjištěných závěrů. Na efektivitu anti-EGFR terapie mohou ukazovat i některé klinické parametry zjištěné až po zahájení cílené léčby, jako např. DOR, ETS, hypomagnezemie a další. Přesnost prediktivní diagnostiky lze zvýšit rovněž kombinací vyšetřovaných biomarkerů např. pomocí metod založených na NGS. Je však třeba varovat před nekritickým vyšetřováním řady molekulárních markerů, které může vést k problémům s interpretací získaných výsledků, především jejich klinické relevance.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
doc. MUDr. Marek Svoboda, Ph.D.
Klinika komplexní onkologické péče a Oddělení epidemiologie a genetiky nádorů
Masarykův onkologický ústav
Žlutý kopec 7
656 53 Brno
e-mail: msvoboda@mou.cz
Obdrženo: 20. 3. 2016
Přijato: 19. 4. 2016
Zdroje
1. Ferlay J, Soerjomataram I, Dikshit R et al. Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012. Int J Cancer 2015; 136(5): E359 – E386. doi: 10.1002/ ijc.29210.
2. Český národní webový portál epidemiologie nádorů. Masarykova univerzita, Česká republika 2006. [online]. Dostupný z: www.svod.cz.
3. Van Cutsem E, Cervantes A, Nordlinger B et al. Metastatic colorectal cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2014; 25 (Suppl 3): 1 – 9. doi: 10.1093/ annonc/ mdu260.
4. Tay RY, Wong R, Hawkes EA. Treatment of metastatic colorectal cancer: focus on panitumumab. Cancer Manag Res 2015; 24(7): 189 – 198. doi: 10.2147/ CMAR.S71821.
5. Khattak MA, Martin H, Davidson A et al. Role of first-line anti-epidermal growth factor receptor therapy compared with anti-vascular endothelial growth factor therapy in advanced colorectal cancer: a meta-analysis of randomized clinical trials. Clin Colorectal Cancer 2015; 14(2): 81 – 90. doi: 10.1016/ j.clcc.2014.12.011.
6. Douillard JY, Oliner KS, Siena S et al. Panitumumab-FOLFOX4 treatment and RAS mutations in colorectal cancer. N Engl J Med 2013; 369(11): 1023 – 1034. doi: 10.1056/ NEJMoa1305275.
7. Heinemann V, von Weikersthal LF, Decker T et al. FOLFIRI plus cetuximab versus FOLFIRI plus bevacizumab as first-line treatment for patients with metastatic colorectal cancer (FIRE-3): a randomised, open-label, phase 3 trial. Lancet Oncol 2014; 15(10): 1065 – 1075. doi: 10.1016/ S1470-2045(14)70330-4.
8. Custodio A, Barriuso J, de Castro J et al. Molecular markers to predict outcome to antiangiogenic therapies in colorectal cancer: current evidence and future perspectives. Cancer Treat Rev 2013; 39(8): 908 – 924. doi: 10.1016/ j.ctrv.2013.02.004.
9. Mirone G, Shukla A, Marfe G. Signaling mechanisms of resistance to EGFR-and Anti-Angiogenic Inhibitors cancer. Crit Rev Oncol Hematol 2016; 97 : 85 – 95. doi: 10.1016/ j.critrevonc.2015.08.012.
10. Lievre A, Bachet JB, Le Corre D et al. KRAS station status is predictive of response to cetuximab therapy in colorectal cancer. Cancer Res 2006; 66(8): 3992 – 3995.
11. Karapetis CS, Khambata-Ford S, Jonker DJ et al. K-ras mutations and benefit from cetuximab in advanced colorectal cancer. N Engl J Med 2008; 359(17): 1757 – 1765. doi: 10.1056/ NEJMoa0804385.
12. Misale S, Di Nicolantonio F, Sartore-Bianchi A et al. Resistance to anti-EGFR therapy in colorectal cancer: from heterogeneity to convergent evolution. Cancer Discov 2014; 4(11): 1269 – 1280. doi: 10.1158/ 2159-8290.CD-14-0462.
13. Normanno N, De Luca A, Bianco C et al. Epidermal growth factor receptor (EGFR) signaling in cancer. Gene 2006; 366(1): 2 – 16.
14. Luo HY, Xu RH. Predictive and prognostic biomarkers with therapeutictargets in advanced colorectal cancer. World J Gastroenterol 2014; 20(14): 3858 – 3874. doi: 10.3748/ wjg.v20.i14.3858.
15. Yarden Y, Sliwkowski MX. Untangling the ErbB signalling network. Nat Rev Mol Cell Biol 2001; 2(2): 127 – 137.
16. Jones JT, Akita RW, Sliwkowski MX. Binding specificities and affinities of EGF domains for ErbB receptors. FEBS Lett 1999; 447(2 – 3): 227 – 231.
17. Normanno N, Tejpar S, Morgillo F et al. Implications for KRAS status and EGFR-targeted therapies in metastatic CRC. Nat Rev Clin Oncol 2009; 6(9): 519 – 527. doi: 10.1038/ nrclinonc.2009.111.
18. Cancer Genome Atlas Network. Comprehensive molecular characterization of human colon and rectal cancer. Nature 2012; 487(7407): 330 – 337. doi: 10.1038/ nature11252.
19. Van Cutsem E, Kohne CH, Hitre E et al. Cetuximab and chemotherapy as initial treatment for metastatic colorectal cancer. N Engl J Med 2009; 360 : 1408 – 1417. doi: 10.1056/ NEJMoa0805019.
20. Amado RG, Wolf M, Peeters M et al. Wild-type KRAS is required for panitumumab efficacy in patients with metastatic colorectal cancer. J Clin Oncol 2008; 26(10): 1626 – 1634. doi: 10.1200/ JCO.2007.14.7116.
21. Douillard JY, Siena S, Cassidy J et al. Final results from PRIME: randomized phase III study of panitumumab with FOLFOX4 for first-line treatment of metastatic colorectal cancer. Ann Oncol 2014; 25(7): 1346 – 1355. doi: 10.1093/ annonc/ mdu141.
22. Ciardiello F, Lenz HJ, Kohne CH et al. Treatment outcome according to tumor RAS mutation status in CRYSTAL study patients with metastatic colorectal cancer (mCRC) randomized to FOLFIRI with/ without cetuximab. J Clin Oncol 2014; 32 (Suppl 5): abstr. 3506.
23. Bokemeyer C, Kohne CH, Ciardiello F et al. Treatment outcome according to tumor RAS mutation status in OPUS study patients with metastatic colorectal cancer (mCRC) randomized to FOLFOX4 with/ without cetuximab. J Clin Oncol 2014; 32 (Suppl 5): abstr. 3505.
24. Stintzing S, Modest DP, von Weikersthal LF et al. Independent radiological evaluation of objective response, early tumor shrinkage, and depth of response in FIRE-3 (AIO KRK-0306) in the final RAS evaluable population. Ann Oncol 2014; 25 : 1 – 41: abstr. LBA11.
25. Venook AP, Niedzwiecki D, Lenz HJ et al. CALGB/ SWOG 80405: phase III trial of irinotecan/ 5-FU/ leucovorin (FOLFIRI) or oxaliplatin/ 5-FU/ leucovorin (mFOLFOX6) with bevacizumab (BV) or cetuximab (CET) for patients (pts) with KRAS wild-type (wt) untreated metastatic adenocarcinoma of the colon or rectum (MCRC). J Clin Oncol 2014; 32 (Suppl 5): abstr. LBA3.
26. Sorich MJ, Wiese MD, Rowland A et al. Extended RAS mutations and anti-EGFR monoclonal antibody survival benefit in metastatic colorectal cancer: a meta-analysis of randomized, controlled trials. Ann Oncol 2015; 26(1): 13 – 21. doi: 10.1093/ annonc/ mdu378.
27. Pakneshan S, Salajegheh A, Smith RA et al. Clinicopathological relevance of BRAF mutations in human cancer. Pathology 2013; 45(4): 346 – 356. doi: 10.1097/ PAT.0b013e328360b61d.
28. Ikenoue T, Hikiba Y, Kanai F et al. Functional analysis of mutations within the kinase activation segment of B-Raf in human colorectal tumors. Cancer Res 2003; 63(23): 8132 – 8137.
29. Bosnan F, Yan P. Molecular pathology of colorectal cancer. Pol J Pathol 2014; 65(4): 257 – 266.
30. Thiel A, Riskimaki A. Toward a molecular classification of colorectal cancer: the role of BRAF. Front Oncol 2013; 3 : 281. doi: 10.3389/ fonc.2013.00281.
31. Tol J, Nagtegaal ID, Punt CJ. BRAF mutation in metastatic colorectal cancer. N Engl J Med 2009; 361(1): 98 – 99. doi: 10.1056/ NEJMc0904160.
32. Therkildsen C, Bergmann TK, Henrichsen-Schnack Tet al. The predictive value of KRAS, NRAS, BRAF, PIK3CA and PTEN for anti-EGFR treatment in metastatic colorectal cancer: a systematic review and meta-analysis. Acta Oncol 2014; 53(7): 852 – 864. doi: 10.3109/ 0284186X.2014.895036.
33. Yang ZY, Wu XY, Huang YF et al. Promising biomarkers for predicting the outcomes of patients with KRAS wild-type metastatic colorectal cancer treated with anti-epidermal growth factor receptor monoclonal antibodies: a systematic review with meta-analysis. Int J Cancer 2013; 133(8): 1914 – 1925. doi: 10.1002/ ijc.28153.
34. Di Nicolantonio F, Martini M, Molinari F et al. Wild-type BRAF is required for response to panitumumab or cetuximab in metastatic colorectal cancer. J Clin Oncol 2008; 26(35): 5705 – 5712. doi: 10.1200/ JCO.2008.18.0786.
35. De Roock W, Claes B, Bernasconi D et al. Effects of KRAS, BRAF, NRAS, and PIK3CA mutations on the efficacy of cetuximab plus chemotherapy in chemotherapy-refractory metastatic colorectal cancer: a retrospective consortium analysis. Lancet Oncol 2010; 11(8): 753 – 762. doi: 10.1016/ S1470-2045(10)70130-3.
36. Laurent-Puig P, Cayre A, Manceau G et al. Analysis of PTEN, BRAF, and EGFR status in determining benefit from cetuximab therapy in wild-type KRAS metastatic colon cancer. J Clin Oncol 2009; 27(35): 5924 – 5930. doi: 10.1200/ JCO.2008.21.6796.
37. Modest DP, Jung A, Moosmann N et al. The influence of KRAS and BRAF mutations on the efficacy of cetuximab-based first-line therapy of metastatic colorectal cancer: an analysis of the AIO KRK-0104-trial. Int J Cancer 2012; 131(4): 980 – 986. doi: 10.1002/ ijc.26467.
38. Smith CG, Fisher D, Claes B et al. Somatic profiling of the epidermal growth factor receptor pathway in tumors from patients with advanced colorectal cancer treated with chemotherapy ± cetuximab. Clin Cancer Res 2013; 19(15): 4104 – 4113. doi: 10.1158/ 1078-0432.CCR-12-2581.
39. Bokemeyer C, Van Cutsem E, Rougier P et al. Addition of cetuximab to chemotherapy as first-line treatment for KRAS wild-type metastatic colorectal cancer: pooled analysis of the CRYSTAL and OPUS randomised clinical trials. Eur J Cancer 2012; 48(10): 1466 – 1475. doi: 10.1016/ j.ejca.2012.02.057.
40. Saridaki Z, Tzardi M, Sfakianaki M et al. BRAFV600E mutation analysis in patients with metastatic colorectal cancer (mCRC) in daily clinical practice: correlations with clinical characteristics, and its impact on patients’ outcome. PLoS One 2013; 8(12): e84604. doi: 10.1371/ journal.pone.0084604.
41. Montagut C, Bellosillo B, Gonzalez I et al. Evolution of heterogeneous mechanisms of acquired resistance to cetuximab-based therapy in colorectal cancer. J Clin Oncol 2014; 32 (Suppl 5): abstr. 3526.
42. Misale S, Arena S, Lamba S et al. Blockade of EGFR and MEK intercepts heterogeneous mechanisms of acquired resistance to anti-EGFR therapies in colorectal cancer. Sci Transl Med 2014; 6(224): 224 – 226. doi: 10.1126/ scitranslmed.3007947.
43. Vivanco I, Sawyers CL. The phosphatidylinositol 3-kinase AKT pathway in human cancer. Nat Rev Cancer 2002; 2(7): 489 – 501.
44. Vanhaesebroeck B, Guillermet-Guibert J, Graupera M et al. The emerging mechanisms of isoform-specific PI3K signalling. Nat Rev Mol Cell Biol 2010; 11(5): 329 – 341. doi: 10.1038/ nrm2882.
45. De Roock W, Claes B, Bernasconi D et al. Effects of KRAS, BRAF, NRAS, and PIK3CA mutations on the efficacy of cetuximab plus chemotherapy in chemotherapy-refractory metastatic colorectal cancer: a retrospective consortium analysis. Lancet Oncol 2010; 11(8): 753 – 762. doi: 10.1016/ S1470-2045(10)70130-3.
46. Sartore-Bianchi A, Martini M, Molinari F et al. PIK3CA mutations in colorectal cancer are associated with clinical resistance to EGFRmonoclonal antibodies. Cancer Res 2009; 69(5): 1851 – 1857. doi: 10.1158/ 0008-5472.CAN-08-2466.
47. Prenen H, De Schutter J, Jacobs B et al. PIK3CA mutations are not a major determinant of resistence to the epidermal growth factor receptor inhibitor cetuximab in metastatic colorectal cancer. Clin Cancer Res 2009; 15(9): 3184 – 3188. doi: 10.1158/ 1078-0432.CCR-08-2961.
48. Huang L, Liu Z, Deng D et al. Anti-epidermal growth factor receptor monoclonal antibody-based therapy for metastatic colorectal cancer: a meta-analysis of the effect of PIK3CA mutations in KRAS wild-type patients. Arch Med Sci 2014; 10(1): 1 – 9. doi: 10.5114/ aoms.2014.40728.
49. Siena S, Sartore-Bianchi A, Di Nicolantonio F et al. Biomarkers predicting clinical outcome of epidermal growth factor receptor-targeted therapy in metastatic colorectal cancer. J Natl Cancer Inst 2009; 101(19): 1308 – 1324. doi: 10.1093/ jnci/ djp280.
50. Cully M, You H, Levine AJ et al. Beyond PTEN mutations: the PI3K pathway as an integrator of multiple inputs during tumorigenesis. Nat Rev Cancer 2006; 6(3): 184 – 192.
51. Loupakis F, Pollina L, Stasi I et al. PTEN expression and KRAS mutations on primary tumors and metastases in the prediction of benefit from cetuximab plus irinotecan for patients with metastatic colorectal cancer. J Clin Oncol 2009; 27(16): 2622 – 2629. doi: 10.1200/ JCO.2008.20.2796.
52. Jacobs B, De Roock W, Piessevaux H et al. Amphiregulin and epiregulin mRNA expression in primary tumors predicts outcome in metastatic colorectal cancer treated with cetuximab. J Clin Oncol 2009; 27(30): 5068 – 5074. doi: 10.1200/ JCO.2008.21.3744.
53. Seymour MT, Brown SR, Middleton G et al. Panitumumab and irinotecan versus irinotecan alone for patients with KRAS wild-type, fluorouracil-resistant advanced colorectal cancer (PICCOLO): a prospectively stratified randomised trial. Lancet Oncol 2013; 14(8): 749 – 759. doi: 10.1016/ S1470-2045(13)70163-3.
54. Seligmann JF, Elliott F, Richman SD et al. Combined epiregulin (EGFR) and amphiregulin (AREG) expression levels as a biomarker of prognosis and panitumumab benefit in RAS-wt advanced colorectal cancer (aCRC). J Clin Oncol 2014; 32 (Suppl 5): abstr. 3520.
55. Bertotti A, Migliardi G, Galimi F et al. A molecularly annotated platform of patient-derived xenografts (“xenopatients”) identifies HER2 as an effective therapeutic target in cetuximab-resistant colorectal cancer. Cancer Discov 2011; 1(6): 508 – 523. doi: 10.1158/ 2159-8290.CD-11-0109.
56. Yonesaka K, Zejnullahu K, Okamoto I et al. Activation of ERBB2 signaling causes resistance to the EGFR-directed therapeutic antibody cetuximab. Sci Transl Med 2011; 3(99): 99ra86. doi: 10.1126/ scitranslmed.3002442.
57. Martin V, Landi L, Molinari F et al. HER2 gene copy number status may influence clinical efficacy to anti-EGFR monoclonal antibodies in metastatic colorectal cancer patiens. Br J Cancer 2013; 108(3): 668 – 675. doi: 10.1038/ bjc.2013.4.
58. Cushman SM, Jiang C, Hatch AJ et al. Gene expression markers of efficacy and resistance to cetuximab treatment in metastatic colorectal cancer: Results from CALGB 80203 (Alliance). Clin Cancer Res 2015; 21(5): 1078 – 1086. doi: 10.1158/ 1078-0432.CCR-14-2313.
59. Cunningham D, Hublet Y, Siena S et al. Cetuximab monotherapy and cetuximab plus irinotecan in irinotecan-refractory metastatic colorectal cancer. N Engl J Med 2004; 351(4): 337 – 345.
60. Saltz LB, Meropol NJ, Loehrer PJ Sr et al. Phase II trial of cetuximab in patients with refractory colorectal cancer that expresses the epidermal growth factor receptor. J Clin Oncol 2004; 22(7): 1201 – 1208.
61. Chung KY, Shia J, Kemeny NE et al: Cetuximab shows aktivity in colorectal cancer patients with tumor that do not express the epidermal growth factor receptor by imunohistochemistry. J Clin Oncol 2005; 23(9): 1803 – 1810.
62. Moroni M, Veronese S, Benvenuti S et al. Gene copy number for epidermal growth factor erceptor (EGFR) and clinical response to anti-EGFR treatment in colorectal cancer: a cohort study. Lancet Oncology 2005; 6(5): 279 – 286.
63. Capuzzo F, Finochiaro G, Rossi E et al. EGFR FISH assay predicts for response to cetuximab in chemotherapy refraktory colorectal cancer patients. Ann Oncol 2008; 19(4): 717 – 723.
64. Sartore-Bianchi A, Moroni M, Veronese S et al. Epidermal growth factor receptor gene number and clinical outcome of metastatic colorectal cancer treated with panitumumab. J Clin Oncol 2007; 25(22): 3238 – 3245.
65. Sartore-Bianchi A, Fieuws S, Veronese S et al. Standardization of EGFR FISH in colorectal cancer: Results of an international, interlaboratory reproducibility ring study. J Clin Pathol 2012; 65(3): 218 – 223. doi: 10.1136/ jclinpath-2011-200353.
66. Sartore-Bianchi A, Di Nicolantonio F, Nichelatti M et al. Multideterminants analysis of molecular alterations for predicting clinical benefit to EGFR-targeted monoclonal antibodies in colorectal cancer. PLoS One 2009; 4(10): 7287. doi: 10.1371/ journal.pone.0007287.
67. Oliner K, Peeters M, Siena S et al. Evaluation of the gene mutations beyond KRAS as predictive biomarkers or response to panitumumab in a randomized, phase III monotherapy study of metastatic colorectal cancer (mCRC). J Clin Oncol 2011; 29 (Suppl): abstr. 3530.
68. Bewrlin J, Van Cutsem E, Peeters M et al. Predictive value of skin toxicity severity for response to panitumumab in patients with metastatic colorectal cancer (mCRC): a pooled analysis of five clinical trials. J Clin Oncol 2007; 25 (Suppl): abstr. 4134.
69. Peeters M, Siena S, Van Cutsem E et al. Association of progression-free survival, overal survival, and patient-reported outcomes by skin toxicity and KRAS status in patients receiving panitumumab monotherapy. Cancer 2009; 115(7): 1544 – 1554. doi: 10.1002/ cncr.24088.
70. O’Callaghan CJ, Tu D, Karapetis CS et al. The relationship between the development of rash and clinical and health-related quality of life outcomes by KRAS mutation status in patients with colorectal cancer treated with cetuximab in NCI CTG CO.17. J Clin Oncol 2011; 29 (Suppl): abstr. 3588.
71. Van Cutsem E, Tejpar S, Vanbeckevoort D et al. Intrapatient cetuximab dose escalation in metastatic colorectal cancer according to the grade of early skin reactions: the randomized EVEREST study. J Clin Oncol 2012; 30(23): 2861 – 2868. doi: 10.1200/ JCO.2011.40.9243.
72. Pérez-Soler R, Saltz L. Cutaneous adverse effects with HER1/ EGFR targeted agents: is there a silver lining? J Clin Oncol 2005; 23(22): 5235 – 5246.
73. Personeni N, Hendlisz A, Gallez J et al. Correlation between the response to cetuximab alone or in combination with irinotecan and the activated/ phosphorylated epidermal growth factor receptor in metastatic colorectal cancer. Semin Oncol 2005; 32 (Suppl 9): 59 – 62.
74. Stinzing S, Kapaun C, Laubender RP et al. Prognostic value of cetuximab-related skin toxicity in metastatic colorectal cancer patients and its correlation with parameters of the epidermal growth factor receptor signal transduction pathway: results from a randomized trial of the GERMAN AIO CRC Study Group. Int J Cancer 2013; 132(1): 236 – 245. doi: 10.1002/ ijc.27654.
75. Petrelli F, Borgonovo K, Cabiddu M et al. Risk of anti-EGFR monoclonal antibody-related hypomagnesemia: systematic reviewand pooled analysis of randomized studies. Expert Opin Drug Saf 2012; 11 (Suppl 1): S9 – S19. doi: 10.1517/ 14740338.2011.606213.
76. Vincenzi B, Santini D, Galluzzo S et al. Early magnesium reduction in advanced colorectal cancer patients treated with cetuximab plus irinotecan as predictive factor of efficacy and outcome. Clin Cancer Res 2008; 14(13): 4219 – 4224. doi: 10.1158/ 1078-0432.CCR-08-0077.
77. Vincenzi B, Galluzzo S, Santini S et al. Early magnesium modifications as a surrogate marker of efficacy of cetuximab-based anticancer treatment in KRAS wild-type advanced colorectal cancer patients. Ann Oncol 2011; 22(5): 1141 – 1146. doi: 10.1093/ annonc/ mdq550.
78. Vickers MM, Karapetis CS, Tu D et al. The influence of hypomagnesemia (hMg) on overall survival (OS) in a phase III randomized study of cetuximab (CET) plus best supportive care (BSC) versus BSC: NCIC CTG/ AGITG CO.17. J Clin Oncol 2011; 29 (Suppl): abstr. 3601.
79. Holubec L, Liška V, Fínek J et al. The importance of early tumor shrinkage and deepness of response in assessing the efficacy of systemic anticancer treatment with metastatic colorectal cancer. Klin Onkol 2015; 28(2): 89 – 93. doi: 10.14735/ amko201589.
80. Nishino M, Jagannathan JP, Krajewski KM et al. Personalized tumor response assessment in the era of molecular medicine: cancer-specific and therapy-specific response criteria to complement pitfalls of RECIST. Am J Roentgenol 2012; 198(4): 737 – 745. doi: 10.2214/ AJR.11.7483.
81. Piessevaux H, Van Cutsem E, Bokemeyer C et al. Early tumor shrikage and long-term outcome in metastatic colorectal cancer (mCRC): assessment of predictive utility across treatment arms in the CRYSTAL and OPUS studies. J Clin Oncol 2011; 29 (Suppl): abstr. 3572.
82. Oden-Gangloff A, Di Fiore F, Bibeau F et al. TP53 mutations predict disease control in metastatic colorectal cancer treated with cetuximabbased chemotherapy. Br J Cancer 2009; 100(8): 1330 – 1335. doi: 10.1038/ sj.bjc.6605008.
83. Lupini L, Bassi C, Mlcochova J et al. Prediction of response to anti-EGFR antibody-based therapies by multigene sequencing in colorectal cancer patients. BMC Cancer 2015; 15 : 808. doi: 10.1186/ s12885-015-1752-5.
84. Mlcochova J, Faltejskova P, Nemecek R et al. Micro-RNAs targeting EGFR signalling pathway in colorectal cancer. J Cancer Res Clin Oncol 2013; 139(10): 1615 – 1624. doi: 10.1007/ s00432-013-1470-9.
85. Mosakhani N, Lahti L, Borze I et al. MicroRNA profiling predicts survival in anti-EGFR treated chemorefractory metastatic colorectal cancer patients with wild-type KRAS and BRAF. Cancer Genet 2012; 205(11): 545 – 551. doi: 10.1016/ j.cancergen.2012.08.003.
86. Mlčochová J, Vychytilová P, Ferracin M et al. MicroRNA expression profiling identifies miR-31-5p/ 3p as associated with time to progression in wild-type RAS metastatic colorectal cancer treated with cetuximab. Oncotarget 2015; 6(36): 38695 – 38704. doi: 10.18632/ oncotarget.5735.
Štítky
Dětská onkologie Chirurgie všeobecná Onkologie
Článek vyšel v časopiseKlinická onkologie
Nejčtenější tento týden
2016 Číslo 3- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Nejasný stín na plicích – kazuistika
- Jak souvisí postcovidový syndrom s poškozením mozku?
-
Všechny články tohoto čísla
- Editorial
- História onkológie na Slovensku
- Diagnóza Lynchova syndromu od patologa
- Současné možnosti predikce odpovědi na cílenou anti-EGFR léčbu metastatického kolorektálního karcinomu
- Vyhodnocení výživových zvyklostí ve studii karcinomu pankreatu
- Vliv předoperační radiochemoterapie na hustotu CD8+ tumor infiltrujících lymfocytů adenokarcinomu rekta
- Mapování psychologického distresu po 4,5 letech u pacientek s diagnózou karcinomu prsu v porovnání se zdravou populací
- Ložisková amyloidóza v dutině nosní
- Karcinoid z pohárkových buněk apendixu metastazovaný do orbity – klinická kazuistika a přehled literatury
-
Průvodce mladého onkologa infuzní terapií a výživou
Díl 3 – Hypomagnezemie a hypofosfatemie. Realimentace. Kazuistika 3 - SOUTĚŽ NA PODPORU AUTORSKÝCH TÝMŮ PUBLIKUJÍCÍCH V ZAHRANIČNÍCH ODBORNÝCH TITULECH
- SOUTĚŽ O NEJLEPŠÍ PRÁCI
- Aktuality z odborného tisku
- MUDr. Eva Siracká, DrSc. – prvá dáma rádioterapie na Slovensku jubiluje
- Doc. MUDr. Juraj Kaušitz, CSc. – 70-ročný
-
Onkologie v obrazech
Karcinom prsu s aktivní imunoeditací a aktivací imunitní kontrolní dráhy PD-L1/ PD-1 - Informace z České onkologické společnosti
- Klinická onkologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle-
Průvodce mladého onkologa infuzní terapií a výživou
Díl 3 – Hypomagnezemie a hypofosfatemie. Realimentace. Kazuistika 3 - História onkológie na Slovensku
- Diagnóza Lynchova syndromu od patologa
- Doc. MUDr. Juraj Kaušitz, CSc. – 70-ročný
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



