-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Karcinoid z pohárkových buněk apendixu metastazovaný do orbity – klinická kazuistika a přehled literatury
Carcinoid of the Appendix Goblet Cells Metastasize to the Orbit – a Clinical Case Report and Review of the Literature
Goblet cell carcinoid (GCC) of the appendix is extremely rare, representing approximately 5% of all primary appendiceal neoplasms. Histologically there are three groups of GCC: group A (typical GCC), adenocarcinoma ex GCC signet ring cell type (group B), and adenocarcinoma ex GCC poorly differentiated carcinoma type (group C), which is the most aggressive. GCC metastasizes in 15–60% of cases, mainly to the ovaries, pelvis, abdominal cavity, ribs, vertebrae, and lymph nodes. Hematogenous metastasis to the liver or other parenchymal organs can occur, but this is very rare. The different organs metastases haven’t been described yet. The primary mode of treatment is radical surgical resection or debulking, followed by chemotherapy; however, patients with unresectable or recurrent GCC are candidates for systemic therapy. Here, we report a case of very aggressive GCC of the appendix, which had metastazed to the liver at the time of diagnosis and subsequently metastasized to the orbit.
Key words:
carcinoid tumor – goblet cells – metastatic – appendix – orbit
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.Submitted:
2. 2. 2016Accepted:
25. 4. 2016
Autoři: V. M. Matějka 1; P. Mukenšnabl 2; R. Tupý 3; O. Fiala 1; J. Fínek 1
Působiště autorů: Onkologická a radioterapeutická klinika LF UK a FN Plzeň 1; Šiklův ústav patologie, LF UK a FN Plzeň 2; Klinika zobrazovacích metod LF UK a FN Plz 3
Vyšlo v časopise: Klin Onkol 2016; 29(3): 220-223
Kategorie: Kazuistiky
doi: https://doi.org/10.14735/amko2016220Souhrn
Karcinoid z pohárkových buněk (goblet cell carcinoid – GCC) apendixu je velmi vzácné nádorové onemocnění. V literatuře se udává, že se jedná asi o 5 % ze všech primárních malignit apendixu. Histologicky jsou definovány tři skupiny – skupina A (typický GCC), adenokarcinom ex GCC buněk tvaru pečetního prstenu (skupina B) a nejvíce agresivně se chovající skupina C, adenokarcinom ex GCC špatně diferencovaný typ. GCC metastazuje v 15 – 60 %, nejčastěji do ovarií, pánve, břišní dutiny, kostí a lymfatických uzlin. Velmi vzácně se objevuje i metastatické postižení jater a jiných parenchymatózních orgánů. Jiná místa metastatického šíření nebyla popsána. Primární léčbou tohoto onemocnění je chirurgické odstranění nebo alespoň cytoredukční operace následována systémovou léčbou. V případě neresekability nebo vzdálené diseminace onemocnění je indikována chemoterapie. V této kazuistice prezentujeme případ velmi agresivně rostoucího GCC se synchronním metastatickým postižením jater, s velmi netypickým místem dalšího metastatického šíření – orbitou.
Klíčová slova:
karcinoid – pohárková buňka – metastatický – apendix – orbitaÚvod
Karcinoid z pohárkových buněk (goblet cell carcinoid – GCC) apendixu je velmi vzácné onemocnění, které tvoří necelých 5 % všech primárních nádorů tohoto orgánu. Nejčastěji se objevuje v páté a šesté dekádě věku, ale z popsaných případů vyplývá, že se může manifestovat v rozsahu 20 – 89 [1,2]. Nejvýznamnějším prognostickým faktorem onemocnění je jeho stadium v době diagnózy. Pětileté celkové přežití (overall survival – OS) pro jednotlivá stadia: 100 % pro stadium I,76 % pro stadium II, 22 % pro stadium IIIa 14 % pro stadium IV. Medián OS je pro grade 1 – 119 měsíců, pro grade 2 – 43 měsíců a pro grade 3 – 31 měsíců [3]. GCC metastazuje v 15 – 60 % případů, častěji pak ve skupině starších pacientů. Místem šíření jsou pak nejčastěji ovaria, pánev, břišní dutina, kosti a lymfatické uzliny. Víceméně vzácně je popisováno metastatické postižení jater a jiných parenchymatických orgánů [4]. Základem léčby je chirurgické odstranění tumoru, event. následované systémovou léčbou. V případě neresekovatelného či recidivujícího onemocnění je pak jedinou možností systémová cytostatická léčba. Výběr chemoterapeutického schématu vychází z místa lokalizace primárního tumoru. Standardně se používají schémata založená na 5-fluorouracilu (5-FU) a leukovorinu (FOLFOX (oxaliplatina + 5-FU + + leukovorin)/FOLFIRI (irinotekan + 5-FU ++ leukovorin)). V 2. linii je pak možno použít v monoterapii či kombinaci např. etopozid, cisplatinu, streptozotocin či interferon α [3,4]. V našem sdělení prezentujeme případ velmi agresivního karcinoidu z pohárkových buněk apendixu se synchronním metastatickým postižením jater, který se dále šířil do orbity.
Kazuistika
V lednu 2013 byla tehdy 50letá žena hospitalizována na gynekologickém oddělení pro bolesti břicha. CT břicha odhalilo tumorózní útvar, jehož původ imponoval v levém ovariu, a čtyři jaterní metastázy. Pacientka podstoupila laparotomii, při které byla provedena hysterektomie, oboustranná adnexektomie, omentektomie a resekce céka s end-to-end ileocékalní anastomózou. Provedení resekce jaterních ložisek bylo naplánováno v druhé době.
Histologicky se jednalo o GCC, grade 2.V místech s největší mitotickou aktivitou bylo dosaženo až 50 % (MiB), v žádné z odebraných lymfatických uzlin nebyla nalezena metastáza onemocnění. Jednalo se tedy o stadium IV, T4 N0 M1. Nádorové buňky vykazovaly pozitivitu AE 1 – 3, chromogranin A a synaptophyzin. Ostatní testované markery byly negativní (vimentin, S100, inhibin, SAL 4) (obr. 1).
Obr. 1. HE (hematoxin-eozin) barvený vzorek GCC – pohárkové buňky s nálezem buněk tvaru pečetního prstenu a extracelulárními ostrůvky mucinu. 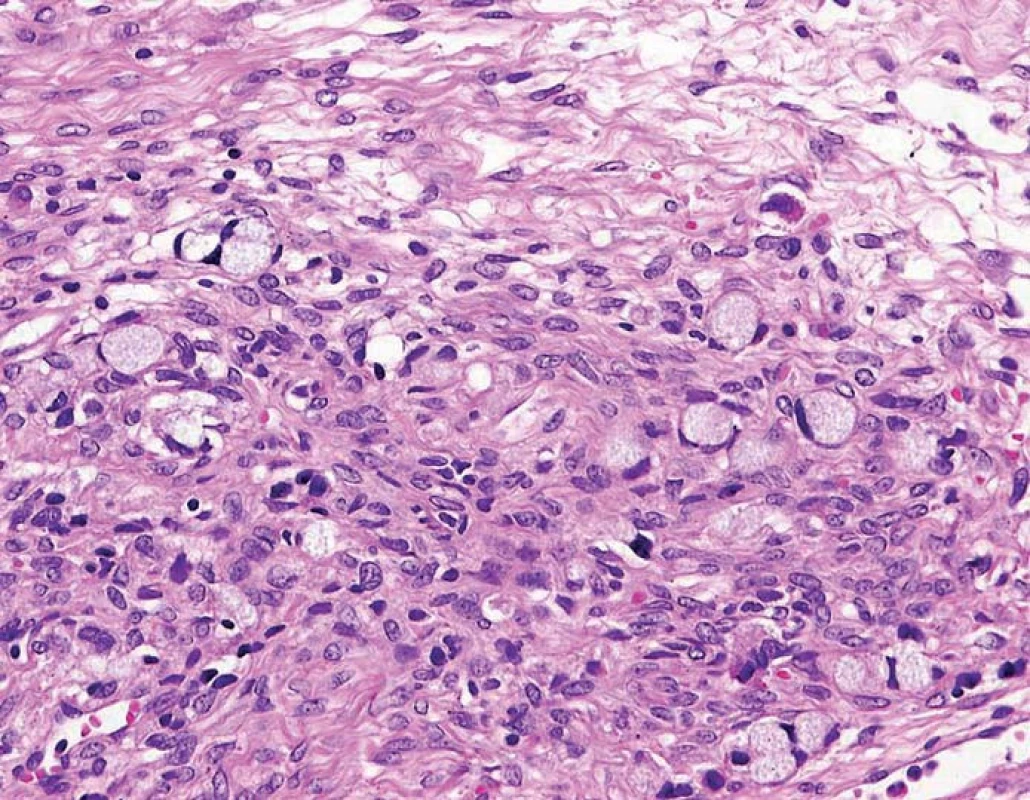
V únoru 2013 byla provedena operace jaterních metastáz, která zahrnovala pravostrannou hepatektomii s cholecystektomií. Všechna čtyři nalezená ložiska byla metastázami se stejným imunohistochemickým profilem jako nádor primární.
Začátkem dubna 2013 bylo v plánu zahájení adjuvantní systémové léčby, ale kontrolní CT odhalilo pravostranný megaureter. Následné potvrzení nefunkčnosti pravé ledviny vedlo k odložení chemoterapie a přípravě k pravostranné nefrektomii. V květnu téhož roku si však pacientka začala stěžovat na zhoršený vizus, diplopii a exoftalmus. Bylo provedeno kontrolní CT, které popsalo nejen mnohočetné postižení dutiny břišní (resekční plocha jater, vzestupný tračník a retroperitoneální lymfatické uzliny), ale i metastatické postižení levé orbity způsobující popsané potíže (obr. 2).
Obr. 2. CT hlavy s nálezem metastázy orbity způsobující exoftalmus, která destruuje kostní ohraničení orbity. 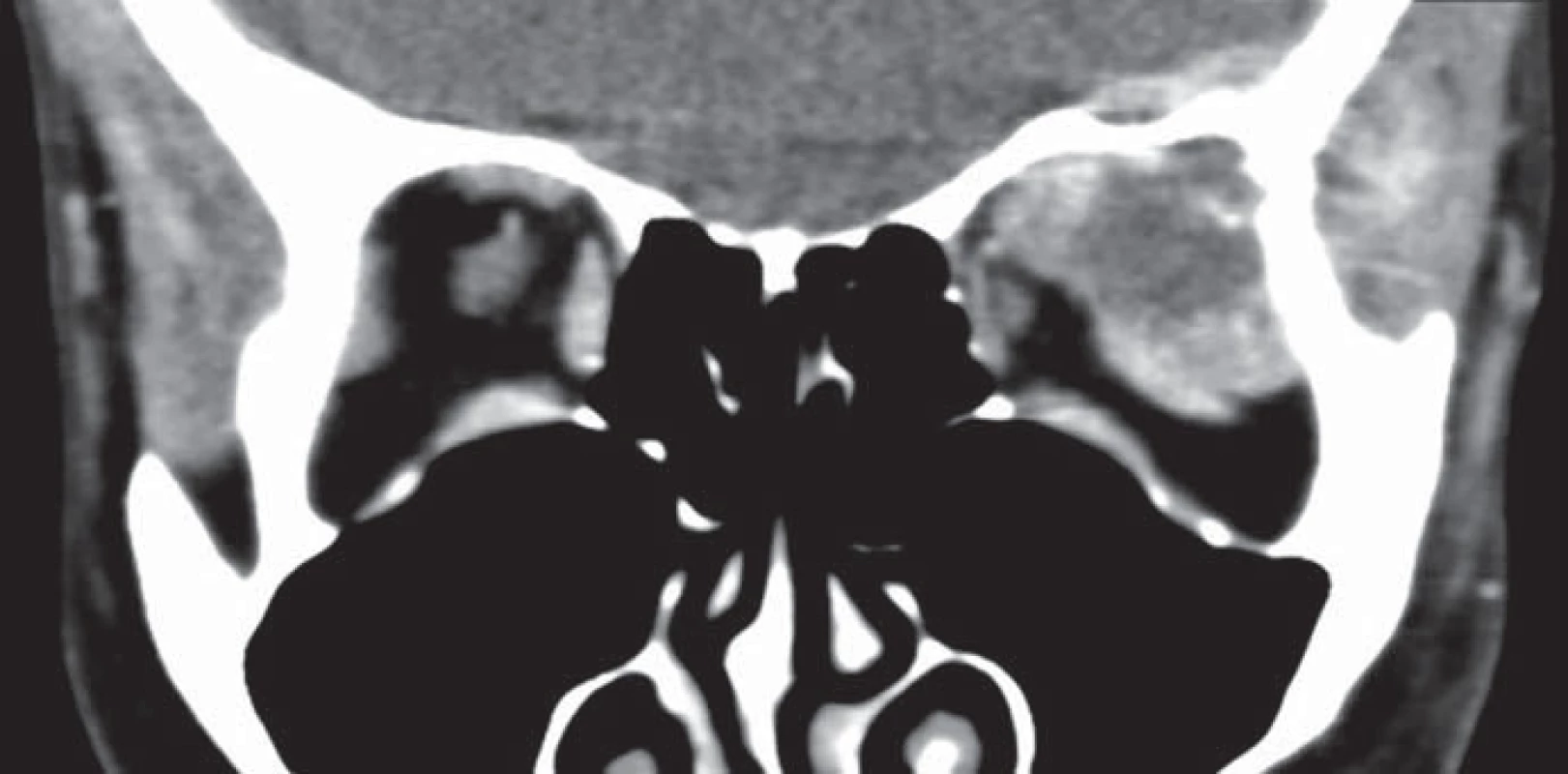
Z důvodu inoperability nálezu byla indikována systémová cytotoxická léčba. Pacientka podstoupila dva cykly monoterapie – kapecitabine (850 mg/ m2 2krát denně, 1. – 14. den, 21denní cyklus). Analog somatulinu byl nasazen pro opakované flushe (somatuline, 60 mg, 28denní cyklus). Jelikož největší tíha obtíží byla způsobena metastázou v orbitě, byla provedena paliativní radioterapie ložiska brzdným zářením 2,5 Gy/frakci do totální referenční dávky 25 Gy. (obr. 3). Systémová léčba byla ukončena v červenci 2013, kdy byla potvrzena progrese onemocnění. Symptomatická terapie byla doplněna pravidelnou aplikací somatulinu, a to až do smrti nemocné, která nastala 13. srpna 2013.
Obr. 3. CT hlavy s nálezem progrese metastázy orbity přes systémovou léčbu kapecitabinem a lokální paliativní radioterapii ložiska. 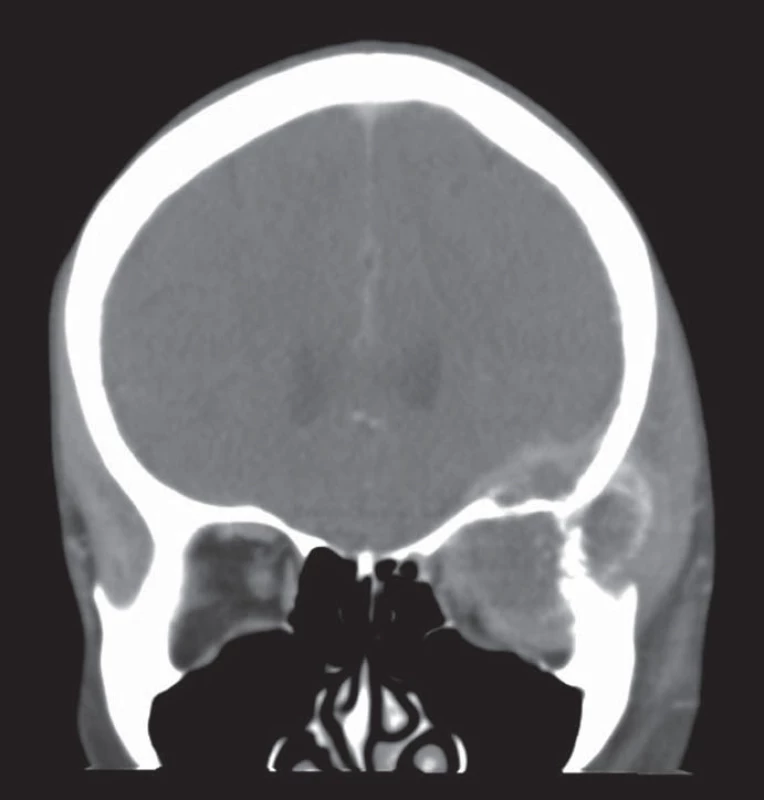
Diskuze
Primární nádory apendixu jsou vzácným onemocněním, kdy se udává, že v každém třístém preparátu po apendektomii je zachycen karcinoid. GCC je patologickou jednotkou odlišnou od adenokarcinomu a karcinoidu. V dostupné literatuře se udává méně než 5% zastoupení ze všech primárních neoplazií tohoto orgánu [1]. Průměrný věk při záchytu je 58,5 roku věku, s velmi širokým rozsahem od 20 do 89 let. To je ve velkém kontrastu s průměrným věkem prezentace karcinoidů (38 let), méně již pak adenokarcinomů (60 let). Vyšší incidence byla popsána v bílé rase, se stejným zastoupením u obou pohlaví [2]. Věk námi popisované pacientky byl 50 let, což je nižší než v literatuře udávaný průměr.
U naší pacientky byla prvním symptomem bolest břicha, která imponovala jako gynekologický problém. Nespecifické potíže jsou typické pro GCC, stejně jako pro jiná nádorová onemocnění. Nejčastěji se jedná o bolest břicha imponující jako projevy apendicitidy, žaludečních či gynekologických obtíží. První symptomy mohou být ale i jiného charakteru, např. zažívací obtíže, chronická bolest břicha, hmatatelná rezistence či potíže urogenitálního traktu. V případě, že nádorové buňky produkují aktivní molekuly, může být prvním příznakem i nějaká forma karcinoidového syndromu. Není ale vzácností zcela asymptomatický pacient, u něhož je patologická jednotka zjištěna až histologickým vyšetřením apendixu odebraného z jiné indikace [2,3].
Finální diagnóza je vždy v rukou patologa, a to na základě histologického vyšetření. Tang et al definovali tři základní skupiny GCC – skupina A, také nazývána typický GCC, je definována pohárkovými buňkami tvořícími shluky nebo dlouhé provazce, bez známek desmoplazie, s minimálními buněčnými atypiemi a absencí porušení architektoniky stěny apendixu. V případě adenokarcinomu ex GCC s buňkami tvaru pečetního prstenu (skupina B) jsou pohárkové buňky uspořádány v nepravidelných velkých shlucích. Dále je pro tuto skupinu typická infiltrace okolí jednotlivými buňkami s desmoplazií, buněčnými atypiemi a destrukcí stěny apendixu. V případě skupiny C (adenokarcinom ex GCC špatně diferencovaný) nacházíme ohniska pohárkových buněk v prostředí buněk špatně diferencovaných, které mohou vykazovat znaky buněk tvaru pečetního prstenu [4 – 6].
Histogeneticky se nyní předpokládá, že se GCC vyvíjí z typického karcinoidu. Pohárkové buňky se vyvíjejí z pluripotentní kmenové buňky APUD sytému (intestinal amine precursor uptake and decarboxylase system) z endodermu. Tyto nádory vykazují silnou pozitivitu pro cytokeratin 20 (CK20), CK 7, neuron-specifickou enolázu (NSE), chromogranin A, serotonin, lysozym a vimentin. Neuroendokrinní granula jsou také pozitivní na NSE, chromogranin A, synaptophysin, serotonin, substanci P a S-100 protein [4,6,7]. V případě naší pacientky byl tumor pozitivní na AE 1–3, chromogranin A a synaptophysin.
Stancu et al popsali v GCC ztrátu alel 11q, 16q a 18q (11 %, 11 % a 39 %). Tyto výsledky jsou velmi shodné s nálezy ve střevních karcinoidech (27 %, 37 % a 56 %), ale ne v karcinomech apendixu. Testovaly se i mutace KRAS, Smad4 a β-cateninu, které jsou častým nálezem v adenokarcinomu tlustého střeva, ale v GCC nebyly prokázány [8].
Hlavním prognostickým faktorem onemocnění je jeho stadium. Pětileté OS pro jednotlivá stadia: 100 % pro staduim I, 76 % pro stadium II, 22 % pro stadium III a 14 % pro stadium IV. Medián OS je pro grade 1 – 119 měsíců, pro grade 2 – 43 měsíců a pro grade 3 – 31 měsíců [3]. GCC je méně agresivního biologického chování než adenokarcinom, ale více než klasický karcinoid. Onemocnění metastazuje v 15 – 60 % případů, a to více u pacientů staršího věku (karcinoid jen 2 – 5 %) [4,7]. Nejčastěji se onemocnění šíří do ovarií, pánve, břišní dutiny, kostí a lymfatických uzlin. Hematogenní metastázy do jater a jiných parenchymatických orgánů jsou velmi vzácné [7]. Tento fakt je v ostrém kontrastu s naším případem, kde bylo metastatické postižení jater přítomno již v době diagnózy. Metachronní metastázy byly navíc diagnostikovány v břišní dutině, lymfatických uzlinách retroperitonea, jater a orbity již dva měsíce po primární operaci. Takto agresivní chování je pro tento druh onemocnění velmi netypické, a to i při nepříznivém histologickém nálezu.
Základem léčby GCC je dostatečně radikální chirurgická resekce. Při vzácnosti onemocnění a z toho vyplývajících omezených klinických zkušenostech jsou léčebná doporučení prakticky shodná s těmi pro adenokarcinomy dané oblasti. Stadium I a II GCC jsou léčeny samotnou chirurgickou operací. V případě stadia III je pak doporučeno podání adjuvantní chemoterapie na bázi 5-FU (FuFa/ FOLFOX). V případě diseminovaného či inoperabilního onemocnění je pak hlavní modalitou systémová léčba opět na bázi 5-FU (FOLFOX, FOLFIRI) [7,9]. V případě jejího selhání je možné v 2. linii použít monoterapii či kombinaci vybraných cytostatik. Určitý, byť velmi omezený efekt prokázala cytostatika: streptozotocin, cisplatina, etopozid a interferon α[7,9,10]. V našem případě jsme se pokusili ovlivnit onemocnění podáním kapecitabinu, který však selhal již po druhém cyklu.
V prezentované kazuistice popisujeme případ velmi agresivně se chovajícího GCC apendixu metastazujícího do jater a orbity, s velmi špatnou odpovědí na systémovou léčbu.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Vít M. Matějka
Onkologická a radioterapeutická klinika LF UK a FN Plzeň
alej Svobody 80
304 60 Plzeň
e-mail: matejkavm@fnplzen.cz
Obdrženo: 2. 2. 2016
Přijato: 25. 4. 2016
Zdroje
1. McGory ML, Maggard MA, Kang H et al. Malignancies of the appendix: beyond case series reports. Dis Colon Rectum 2005; 48(12): 2264 – 2271.
2. McCusaker ME, Coté TR, Clegg LX et al. Primary malignant neoplasms of the appendic: a population-based study from the surveillance, epidemiology and end results program 1973 – 1998. Cancer 2002; 94(12): 3307 – 3312.
3. Anderson NH, Somerville JE, Johnston CF et al. Appendiceal goblet cell carcinoids: a clinicopathological and immunohistochemical study. Histopathology 1991; 18(1): 61 – 65.
4. Tang LH, Shia J, Soslow RA et al. Pathologic classification and clinical behavior of the spectrum of goblet cell carcinoid tumors of the appendix. Am J Surg Pathol 2008; 32(10): 1429 – 1443.
5. Toumpanakis C, Standish RA, Baishnab E et al. Goblet cell carcinoid tumors (adenocarcinoid) of the appendix. Dis Colon Rectum 2007; 50(3): 315 – 322.
6. Mitra B, Pal M, Paul B et al. Goblet cell carcinoid of appendix: a rare case with literature review. Int J Surg Case Rep 2013; 4(3): 334 – 337. doi: 10.1016/ j.ijscr.2013.01.007.
7. Roy P, Chetty R. Goblet cell carcinoid tumors of the appendix: an overview. World J Gastrointest Oncol 2010; 2(6): 251 – 258. doi: 10.4251/ wjgo.v2.i6.251.
8. Stancu M, Wu TT, Wallace C et al. Genetic alterations in goblet cell carcinoids of the vermiform appendix and comparison with gastrointestinal carcinoid tumors. Mod Pathol 2003; 16(12): 1189 – 1198.
9. Pham TH, Wolff B, Abraham SC et al. Surgical and chemotherapy treatment outcomes of goblet cell carcinoid: a tertiary cancer center experience. Ann Surg Oncol 2006; 13(3): 370 – 376.
10. Butler JA, Houshiar A, Lin F et al. Goblet cell carcinoid of the appendix. Am J Surg 1994; 168(6): 685 – 687.
Štítky
Dětská onkologie Chirurgie všeobecná Onkologie
Článek vyšel v časopiseKlinická onkologie
Nejčtenější tento týden
2016 Číslo 3- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Nejasný stín na plicích – kazuistika
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
-
Všechny články tohoto čísla
- Editorial
- História onkológie na Slovensku
- Diagnóza Lynchova syndromu od patologa
- Současné možnosti predikce odpovědi na cílenou anti-EGFR léčbu metastatického kolorektálního karcinomu
- Vyhodnocení výživových zvyklostí ve studii karcinomu pankreatu
- Vliv předoperační radiochemoterapie na hustotu CD8+ tumor infiltrujících lymfocytů adenokarcinomu rekta
- Mapování psychologického distresu po 4,5 letech u pacientek s diagnózou karcinomu prsu v porovnání se zdravou populací
- Ložisková amyloidóza v dutině nosní
- Karcinoid z pohárkových buněk apendixu metastazovaný do orbity – klinická kazuistika a přehled literatury
-
Průvodce mladého onkologa infuzní terapií a výživou
Díl 3 – Hypomagnezemie a hypofosfatemie. Realimentace. Kazuistika 3 - SOUTĚŽ NA PODPORU AUTORSKÝCH TÝMŮ PUBLIKUJÍCÍCH V ZAHRANIČNÍCH ODBORNÝCH TITULECH
- SOUTĚŽ O NEJLEPŠÍ PRÁCI
- Aktuality z odborného tisku
- MUDr. Eva Siracká, DrSc. – prvá dáma rádioterapie na Slovensku jubiluje
- Doc. MUDr. Juraj Kaušitz, CSc. – 70-ročný
-
Onkologie v obrazech
Karcinom prsu s aktivní imunoeditací a aktivací imunitní kontrolní dráhy PD-L1/ PD-1 - Informace z České onkologické společnosti
- Klinická onkologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle-
Průvodce mladého onkologa infuzní terapií a výživou
Díl 3 – Hypomagnezemie a hypofosfatemie. Realimentace. Kazuistika 3 - História onkológie na Slovensku
- Diagnóza Lynchova syndromu od patologa
- Doc. MUDr. Juraj Kaušitz, CSc. – 70-ročný
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



