-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Moderní nanomedicína v léčbě karcinomů plic
Modern Nanomedicine in Treatment of Lung Carcinomas
Backgrounds:
Despite the fast development of new effective cytostatics and targeted therapy, the treatment efficiency of lung cancer is still insufficient. The systemic administration of drugs results in a decrease in drug concentrations in tumor site, particularly due to specific extracellular environment in lungs. Nanotransporters could serve as a platform, protecting a drug against these undesired effects, which may enhance its therapeutic index and reduce side effects of a drug. Moreover, nanotechnologies possess the potential to improve the diagnostics of lung cancer, and thus increase a survival rate of oncologic patients.Aim:
The presented study is aimed to demonstrate the possibilities provided by nanotechnologies in the field of treatment and diagnostic of lung cancers and discuss the obstacles, which complicate a translation into clinical practice.Key words:
targeted delivery – liposomes – nanoparticles – non‑small cell lung cancer – small cell lung cancer
The study was supported by League Against Cancer Prague (project 18257/2014-981) and by the Czech Ministry of Health – RVO, FN v Motole 00064203.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.Submitted:
21. 3. 2015Accepted:
11. 5. 2015
Autoři: Z. Heger 1; T. Eckschlager 2; M. Stiborová 3; V. Adam 1; O. Zítka 1; R. Kizek 1
Působiště autorů: Laboratoř metalomiky a nanotechnologií, Ústav chemie a biochemie, Mendelova univerzita v Brně 1; Klinika dětské hematologie a onkologie 2. LF UK a FN v Motole, Praha3 Katedra biochemie, Přírodovědecká fakulta, UK v Praze 2
Vyšlo v časopise: Klin Onkol 2015; 28(4): 245-250
Kategorie: Přehled
doi: https://doi.org/10.14735/amko2015245Souhrn
Východiska:
I přes rychlý vývoj nových, efektivnějších cytostatik a cílené terapie není úspěšnost léčby karcinomů plic stále dostačující. Systémově aplikované léčivo je k nádorovým buňkám často dopraveno v neefektivních koncentracích, a to především kvůli specifickému extracelulárnímu prostředí plic. Nanotransportéry mohou ochránit léčivo před těmito nežádoucími vlivy, zvýšit jeho účinnost a snížit jeho nežádoucí účinky. Nanotechnologie mají navíc potenciál zvýšit diagnostickou úspěšnost nádorů plic, a tím přispět ke zlepšení přežití onkologických pacientů.Cíl:
Cílem této práce je ilustrovat možnosti, které nanotechnologie nabízejí na poli léčby a diagnostiky nádorů plic, a diskutovat překážky, které brání jejich zavedení do klinické praxe.Klíčová slova:
cílený transport – lipozomy – nanočástice – nemalobuněčný karcinom plic – malobuněčný karcinom plicÚvod
Karcinom plic je celosvětově nejčastější příčinou smrti spojené s nádorovým onemocněním u mužů a druhou nejčastější u žen. Ročně je tomuto onemocnění přičítáno přes 1,38 milionu úmrtí [1]. Léčebné postupy dvou základních typů nádorů plic – malobuněčný (small‑cell lung cancer – SCLC) a nemalobuněčný (non‑small‑cell lung cancer – NSCLC) – se podstatně liší [2].
I přes značné pokroky ve vývoji cytostatik jsou současné léčebné možnosti nedostatečné (u NSCLC je pětileté přežití ve stadiu IA a IB < 50 %; avšak s pokročilostí stadia nádoru míra přežití výrazně klesá, kdy ve stadiu IV je míra pětiletého přežití < 1 %) [3]. Systémová aplikace léčiv je často neúspěšná kvůli nízkým koncentracím léčiv v místě primárního nádoru a/ nebo metastáz a zvyšování dávek je spojeno s nežádoucími účinky [4]. Mimo to jsou léčiva vystavena intracelulární enzymové degradaci či endozomální translokaci. Cílený transport léčiv pomocí nanotransportérů přímo k nádorovým buňkám proto může výrazně zvýšit efektivitu léčby a míru přežití pacientů s karcinomem plic. Nanotransportéry mohou využívat jak aktivního cílení, kdy jsou využívány cílící molekuly, jako jsou např. protilátky, peptidy či aptamery [5], tak cílení pasivního díky efektu zvýšené permeability a retence (permeability and retention – EPR) [6], který je výsledkem patologické novotvořené vaskulatury v nádorech [7].
Efekt zvýšené permeability a retence a pasivní cílení
EPR efekt poprvé popsala skupina dr. Hiroshiho Maedy v roce 1984 [8]. Základní podstatou patofyziologie tohoto jevu je zvýšená permeabilita nádorové vaskulatury, což umožňuje lepší průnik relativně velkých částic (10 – 300 nm) [9], jako jsou lipozomy, nanočástice, micely či proteiny, do intersticiálního prostoru nádoru (schematicky znázorněno na obr. 1). V kombinaci s alterovanou lymfodrenáží se v nádoru mění dynamika transportu molekul a tekutin, což snižuje schopnost přítomné nanočástice odstranit [10,11]. Ačkoliv je EPR odvozený od rychlého tempa růstu nádoru a kolapsu cévní a lymfatické tkáně v místě jeho růstu, je tento jev v některých případech značně zjednodušován, a stal se tak pro mnohé „zlatou bránou“ pasivního vstupu léčiva do locus in quo v nádorové tkáni. Bližší pohled na dostupná data ale odhaluje, že příjem léčiva je komplikován vysokým intersticiálním tlakem v mikroprostředí nádoru a také nepravidelnou distribucí cév [12]. Ačkoliv bylo navrženo mnoho léčiv využívajících EPR efektu, jen velmi málo z nich je nyní užíváno v klinické praxi (např. MyocetTM, Daunoxom®, Abraxan®) [13]. I přesto je ale jisté, že EPR efekt je důležitým fenoménem u řady solidních tumorů, včetně karcinomů plic. Klinické využití léčebných postupů založených na tomto efektu musí být nicméně vždy zvažováno dle konkrétní situace.
Obr. 1. Schématické znázornění kumulace nanočástic v nádorové tkání vlivem EPR efektu, který je důsledkem hyperpermeability cév. 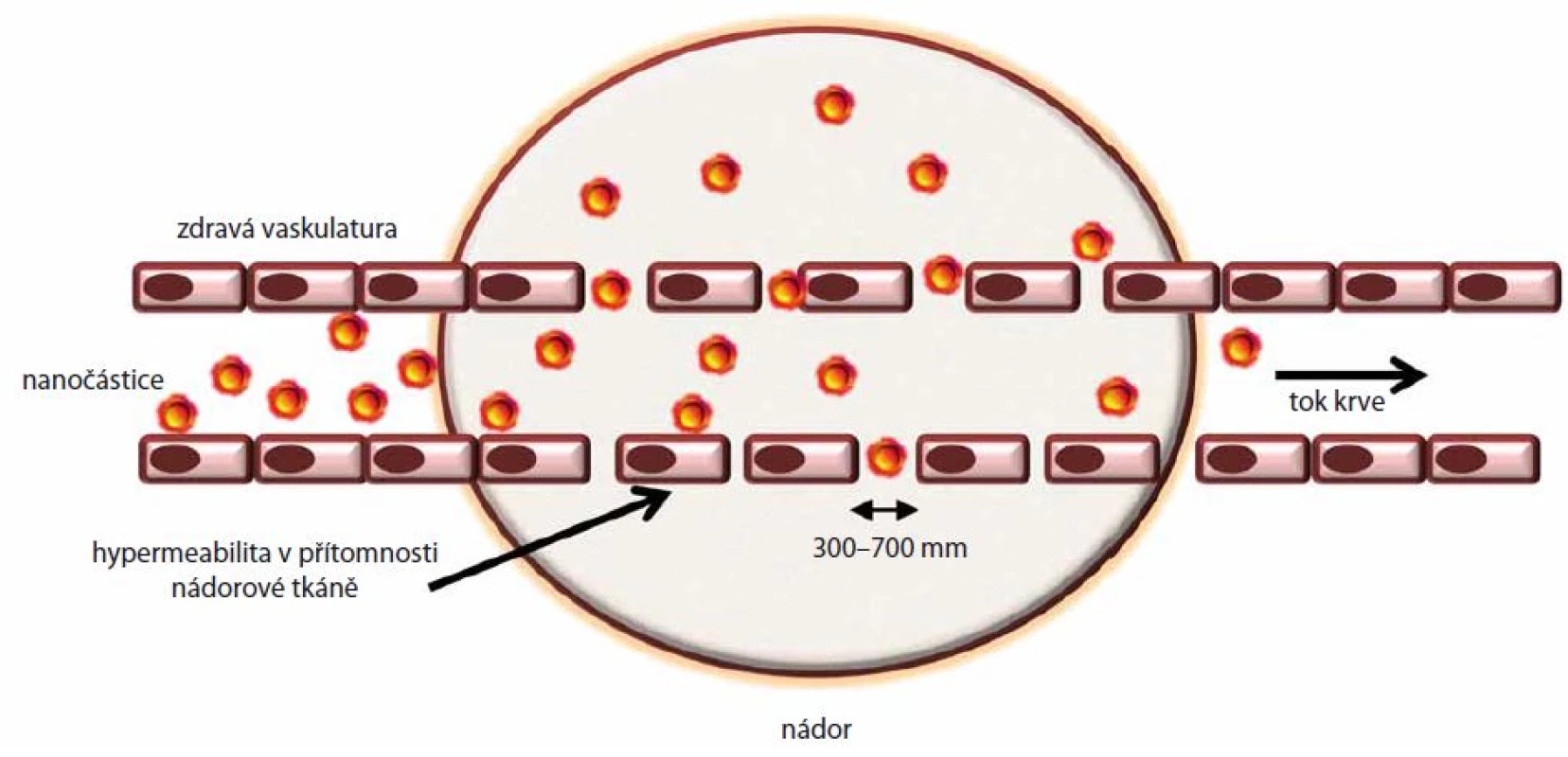
Využití nanotechnologií v medicíně karcinomů plic
Jak již bylo zmíněno výše, nanotechnologie nabízejí široké spektrum aplikací nejen v léčbě či cíleném zobrazování přítomnosti nádorových tkání in vivo, ale i v diagnostice využívající širokého spektra biomarkerů pro včasnou detekci nádorových onemocnění [14 – 16]. Ačkoliv je vývoj zařízení pro diagnostiku „bed ‑ side“ velmi důležitý a perspektivní, přičemž nanotechnologie umožňují zvýšit jejich efektivitu, v další části textu budou diskutovány pouze aplikace rozličných typů nanometrických struktur pro cílený transport cytostatických léčiv a imaging in vivo. Cílem práce je představit a diskutovat možnosti, které nanotechnologie nabízejí na poli léčby a diagnostiky karcinomů plic.
Nanočástice na bázi kovů
Nanočástice kovů fascinují vědeckou komunitu již více než 100 let. Obecně jsou pro nanomedicínské aplikace využívány nanočástice kovů o velikosti 10 – 500 nm [17], což je výhodné pro jejich internalizaci prostřednictvím EPR efektu. Další výhodou kovových nanočástic je možnost modifikace povrchu aktivně cílící strukturou, což zvyšuje nejen specifitu, ale i jejich stabilitu a biokompatibilitu. Nanočástice kovů lze využít nejen pro transport léčiv, fotosenzitizérů či nukleových kyselin, ale i jako kontrastní agens pro zobrazovací techniky, jako jsou MRI, CT či PET [18 – 21]. Další perspektivní možností je rovněž kombinace s jinými nanomateriály a využití v teranostice, která je definována jako kombinace diagnostických a terapeutických funkcí nanotransportérů (obr. 2) [22]. Takovým způsobem mohou být superparamagnetické oxidy železa (magnetit, maghemit) konjugovány s léčivem, přičemž další modifikací cílícím ligandem vzniká struktura schopná cíleného transportu, ale i zobrazování, jak bylo demonstrováno in vitro na příkladu micel s doxorubicinem, superparamagnetickým oxidem železa a LCP (lung cancer ‑ targeting peptid afinitní k integrinu αvβ6, jehož exprese je často zvýšená v NSCLC) [23].
Obr. 2. Znázornění využití teranostických nástrojů pro cílené zobrazování a terapii nádoru plic. 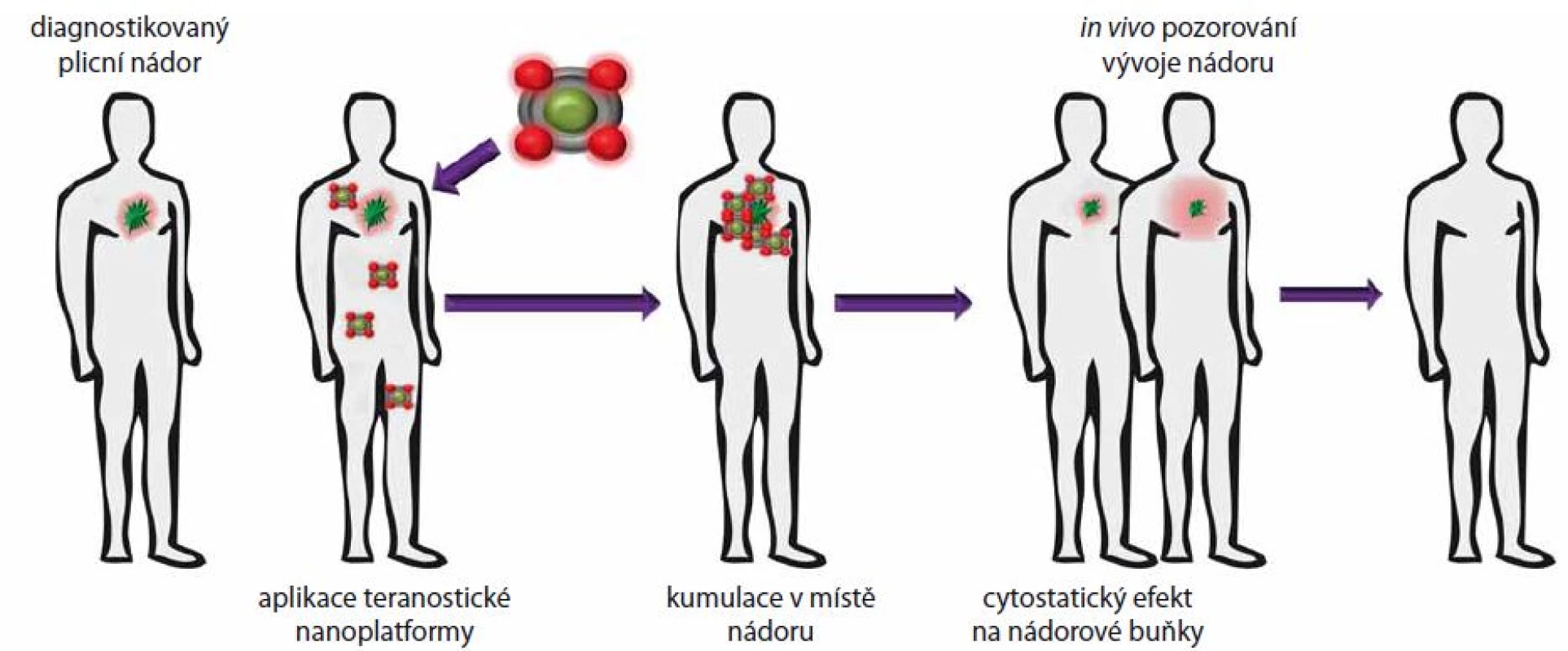
Z kovových nanočástic jsou ve vývoji nových terapeutických agens pro nanomedicínu nádorů plic nejčastěji používány zlaté nanočástice (AuNPs). AuNPs lze využít nejen pro cílený transport léčiv [24], ale i pro fotodynamickou terapii nádorů. Ta využívá fotosenzitizérů, které po expozici laserem produkují volné kyslíkové radikály efektivně ničící okolní tkáň [25]. Tento postup se stále více využívá především v paliativní léčbě NSCLC, které nejsou diseminovány mimo plicní tkáň. Osvícení ložisek se provádí bronchoskopicky laserem. Konjugace AuNPs s cetuximabem významně zvýšila účinek této protilátky u EGFR pozitivních nádorů plic v experimentu na zvířatech [26]. Díky své univerzálnosti, zahrnující široký modifikační potenciál, jednoduchou syntézu, biokompatibilitu a možnost fotosenzitivizace jsou tak AuNPs jedny z nejslibnějších nástrojů teranostiky nádorů plic, což dokazuje i množství publikací, které se této problematice věnují [27 – 29]. Ačkoliv bylo na tomto poli experimentálně dosaženo mnoha výjimečných výsledků, je využití AuNPs stále ještě v počátcích a bude zapotřebí další pečlivé práce, která povede k posouzení imunogenity, závislosti tvaru AuNPs na jejich toxicitě či k optimalizaci dávkování.
Kovů, které mohou být využity pro syntézu dalších typů nanočástic, je celá řada. Využití většiny z nich ale naráží na překážky, jako je nízká biokompatibilita, genotoxicita či vysoká produkční cena. Velmi slibnými se zdají být nanočástice ruthenia (Ru), které se in vitro ukazují být efektivnější proti různým nádorům, včetně NSCLC v porovnání s konvenčními platinovými cytostatiky [30]. I z toho důvodu jsou již některá léčiva na bázi nanočástic Ru ve fázi klinických studií.
Uhlíkové nanomateriály
Uhlíkové nanomateriály vynikají především vysokou aktivní internalizační schopností závislou na různých mechanizmech (receptorem zprostředkovanou endocytózou, kaveolární endocytózou, pinocytózou) [31]. Velkou výhodou je také velká celková plocha nanočástic a jednoduchá modifikace povrchu nanomateriálů léčivem či kontrastní látkou. Zajímavou ukázkou teranostiky nádoru plic s využitím uhlíkových nanočástic je jejich modifikace metotrexátem (MTX), asparaginázou a fluorescein isothiokyanátem (FITC). Výsledný konjugát využívá specifity analogu kyseliny listové – MTX vůči folátovým receptorům „over‑exprimovaným“ v buňkách nádorů plic, takže slouží současně jako směrující struktura i jako cytostatikum a cytostatické aktivity asparaginázy a FITC umožňující jeho fluorescenční sledování. Tento konjugát vykazuje dobrou hemo ‑ a biokompatibilitu in vitro [32].
Kromě špatné rozpustnosti je největší překážkou uhlíkových nanomateriálů potenciální toxicita při dlouhodobé expozici, která však může být eliminována vhodnou modifikací povrchu, což bylo ověřeno na experimentálním modelu hlodavců [33 – 35]. Vhodná data na fyziologicky bližším modelu ale aktuálně nejsou k dispozici.
Polymerní nanočástice
Biodegradabilita a biokompatibilita jsou základní podmínkou pro klinickou použitelnost každého nanotransportéru. V terapii nádorů plic využívající polymerní nanomateriály je tato problematika obzvlášť zkoumána, protože degradované polymery interagují s povrchově aktivními látkami v alveolech, což vyvolává nežádoucí účinky, které mohou končit závažnými dýchacími potížemi, a dokonce až smrtí. Dnes je již vyvinuta poměrně pestrá škála polymerů (polymer kyseliny mléčné, kopolymer kyseliny mléčné s kyselinou glykolovou, chitosan, polyalkylkyanoakryláty, polyethylenglykol (PEG) či želatina), které umožňují řízené a prodloužené uvolňování léčiva a jsou biokompatibilní (struktury některých těchto polymerů jsou znázorněné na obr. 3A – E).
Obr. 3. Strukturní vzorce biokompatibilních polymerů vhodných pro nanotechnologické aplikace nádorů plic. 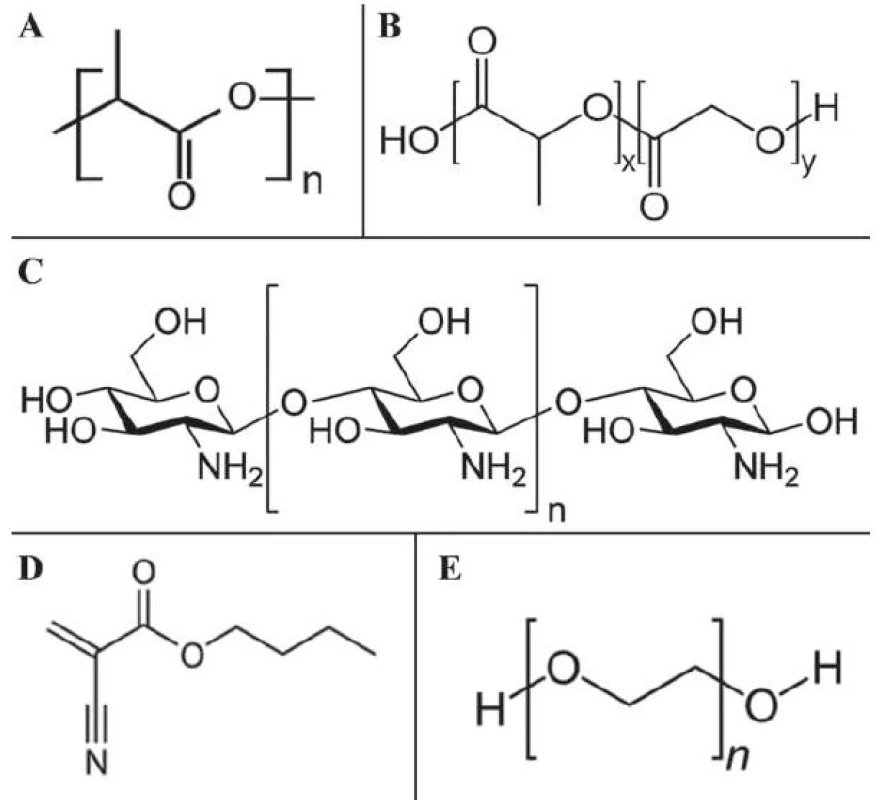
A. monomer polymeru kyseliny mléčné; B. monomer kopolymeru kyseliny mléčné s kyselinou glykolovou; C. chitosan; D. monomer butylkyanoakrylátu; E. monomer polyethylenglykolu. Kopolymer kyseliny mléčné s kyselinou glykolovou (poly(lactic-co-glycolic) acid – PLGA) je schválen pro vývoj přípravy inhalačních léků na bázi polymerních nanotransportérů a může sloužit pro transport nejen konvenčních léčiv, ale také RNA, DNA nebo terapeutických peptidů [36]. Jednoduchou konjugací PLGA s doxorubicinem a enkapsulací fosfolipidem s combretastatinem byl připraven nanotransportér s cytotoxickými a antiangiogenními vlastnostmi, který byl úspěšně testován in vivo u NSCLC [37]. Využití PLGA je limitováno rychlou „clearance“ z oběhového systému, což lze řešit jejich modifikací PEG za vzniku kopolymerního systému PLGA ‑ PEG. Stejný problém se týká i ostatních polymerních látek a vyplývá především z požadavků na vysokou biokompatibilitu. Nové poznatky nicméně ukazují, že kopolymerací s jinými látkami lze splnit všechny požadavky pro ideální nanotransportér, a proto lze předpokládat, že polymerní nanočástice budou mít velký potenciál pro využití v klinické praxi.
Dendrimery jsou samostatnou skupinou polymerních nanočástic, vyznačujících se velkým vnitřním prostorem a velkým počtem funkčních skupin na povrchu, což umožňuje navázání léčiva do vnitřní kavity nanočástice a cílícího ligandu či kontrastní látky na povrchu struktury [38]. Využití dendrimerů je komplikováno poměrně složitou výrobou a polykationickým charakterem, čímž se dendrimery stávají toxickými pro negativně nabité buněčné membrány.
Bio‑ nanočástice – proteinové a lipidové nanočástice
S cílem překonat toxicitu a nízkou biologickou kompatibilitu některých kovových nanotransportérů je pozornost zaměřena také na biologické materiály. Lipozomy jsou dvouvrstvé fosfolipidové nosiče běžně využívané k transportu hydrofobních i hydrofilních léčiv, a to buď jejich začleněním do lipidové dvojvrstvy, či enkapsulací ve vnitřní dutině [39,40]. Za posledních 10 let zažil výzkum na poli lipozomálních nanočástic rozmach, který vedl ke schválení několika přípravků na bázi lipozomů, nicméně žádný z nich nebyl zatím registrován pro využití v léčbě nádorů plic.
V roce 2004 byla vyvinuta lipozomální cisplatina (Lipoplatina) s nižší toxicitou včetně nefrotoxicity, které často použití cisplatiny limitují [41]. Lipoplatina byla v kombinaci s gemcitabinem testována u pacientů s pokročilými (IIIB/ IV), inoperabilními NSCLC v rámci klinické studie fáze II. Výsledky ukazují snížení nežádoucí toxicity (především nefrotoxicity) a zvýšení účinnosti léčiva [42]. Nedávné preklinické studie využívající xenotransplantátů chemosenzitivních i chemorezistentních buněk plicního adenokarcinomu ukázaly, že lipozomální forma paclitaxelu může být snadno modifikována pro aktivní cílení buněk nádorů plic, čímž lze překonat rezistenci buněk vůči léčivu [43].
Lipozomy byly také testovány pro transport antigenu MUC1, asociovaného s nádory plic, přičemž studie terapeutické lipozomální vakcíny BLP25 ukazují nadějné výsledky v léčbě pokročilých NSCLC [44]. Tato vakcína nyní prochází fází III. klinického testování [45].
V neposlední řadě je také nutné zmínit možnost využití lipozomálních nosičů v genové terapii karcinomů plic. Ačkoliv je možnost využití genové terapie v léčbě nádorů plic stále čistě experimentální, bylo již dosaženo několika unikátních výsledků. Lipozomy mohou nést geny kódující tumor supresorové proteiny a jak bylo již demonstrováno v klinické studii s nanopartikulemi obsahujícími plasmid nesoucí tumor supresorový gen TUSC2/ FUS1 (TUSC2), jehož produkt je redukován u plicních karcinomů, na rozdíl od zdravé bronchiální a alveolární tkáně [46], lze jeho aplikací u některých pacientů s NSCLC prodloužit přežití [47]. Výsledky z klinických studií navíc ukazují, že intravenózní aplikace jsou velmi dobře tolerovány, bez pozorované toxicity.
Pomocí lipozomů mohou být do buňky rovněž vkládány malé interferující RNA (siRNA), které jsou schopny selektivně inhibovat expresi nežádoucího proteinu interakcí s mRNA jejich kódujících genů [48]. Mezi takové proteiny lze zařadit i Cyklin D1, jehož inhibicí in vitro lze v buňkách NSCLC a mezoteliomu docílit rapidního poklesu proliferační aktivity a indukce apoptózy [49].
Nativní transportní proteiny tvoří další skupinu bio ‑ nanotransportérů, která se vyznačuje vhodným „bezpečnostním profilem“, další výhodou je také jejich uniformní velikost. Albuminové nanočástice umožňují díky svému náboji vazbu jak negativně, tak pozitivně nabitých molekul a také pozvolnější uvolňování léčiva než lipozomy [50]. V roce 2012 rozšířila FDA povolení k použití albuminových nanočástic s vázaným paclitaxelem (Abraxan®) pro léčbu některých nádorů včetně NSCLC. Vzhledem k ochotě albuminu vytvářet konjugáty i po navázání paclitaxelu lze i tento přístup využít pro teranostické účely, a to jejich další modifikací zobrazovacími látkami [51].
Neméně zajímavým proteinem je transportér železa apoferitin. Díky jeho přirozené vlastnosti – rozkladu na podjednotky – lze vlivem prostředí docílit efektivní enkapsulace cytostatik [52]. Apoferitin vyniká svou stabilitou a přirozenou afinitou k transferinovým receptorům (TfR1), jejichž množství je u většiny nádorů plic zvýšené [53]. Do proteinové „klece“ mohou být enkapsulovány také kontrastní látky či fotosenzitizéry (sumarizováno v [54]). Ačkoliv bylo s použitím apoferitinu experimentálně dosaženo mnoha zajímavých výsledků, vzhledem k nedostatku údajů z klinických testování nelze posoudit, zdali je jeho aplikace v humánní medicíně skutečně relevantní.
Výhledy do budoucnosti
Navzdory rozvoji širokého spektra léčebných strategií a vývoji nových typů léčiv zůstávají karcinomy plic stále nejčastější příčinou úmrtí spojených s nádorovým onemocněním. Přístupy využívající nanočástice mají potenciál řešit některé problémy konvenčních cytostatik, jako je jejich malá specifita, nízký terapeutický index, nežádoucí účinky či vznik sekundární chemorezistence. Obecně lze říci, že nanotransportéry umožňují velkou konstrukční flexibilitu, čímž lze řešit špatnou rozpustnost léčiv ve vodě či jejich sníženou schopnost překonávat biologické bariéry a selektivně cílit do konkrétního místa.
I přes tyto výhody je zde stále velké množství překážek, které je potřeba překonat před širším klinickým zavedením nanomateriálů v léčbě a diagnostice karcinomů plic. Je známo, že farmakokinetika nanomateriálů úzce vychází z jejich trojrozměrného uspořádání [55], a tak i malé změny v procesu syntézy mohou mít za následek fyzikálně‑chemické změny, které mohou v organizmu způsobovat různé komplikace. Další složitou otázkou je vylučování nanomateriálů z těla. Je nutné detailně porozumět chování nanotransportérů a biologické odezvě organizmu na jejich přítomnost. Jen tak lze zajistit reprodukovatelnost v průběhu léčby a minimalizovat farmakologické a imunologické komplikace. Snadnější uchopení této problematiky může vést k rychlejšímu převodu do klinické praxe a zvýšení efektivity léčby nádorů plic.
Práce byla podpořena Ligou proti rakovině Praha (projekt 18257/2014-981) a MZ ČR – RVO, FN v Motole 00064203.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Obdrženo: 21. 3. 2015
Přijato: 11. 5. 2015
prof. Ing. René Kizek, Ph.D.
Laboratoř metalomiky a nanotechnologií
Ústav chemie a biochemie
Mendelova univerzita v Brně
Zemědělská 1
613 00 Brno
e-mail: kizek@sci.muni.cz
Zdroje
1. Ferlay J, Shin HR, Bray F et al. Estimates of worldwide burden of cancer in 2008: Globocan 2008. Int J Cancer 2010; 127(12): 2893 – 2917. doi: 10.1002/ ijc.25516.
2. Modrá kniha České onkologické společnosti. 18. vyd. Brno: Masarykův onkologický ústav 2014.
3. Mountain CF. The international system for staging lung cancer. Semin Surg Oncol 2000; 18(2): 106 – 115.
4. Zhang J, Zhan Y, Ouyang M et al. Fatal interstitial lung disease associated with icotinib. J Thorac Dis 2014; 6(12): E267 – E271. doi: 10.3978/ j.issn.2072 ‑ 1439.2014.10.24.
5. Heger Z, Gumulec J, Cernei N et al. 17beta‑estradiol ‑ containing liposomes as a novel delivery system for the antisense therapy of ER ‑ positive breast cancer: an in vitro study on the MCF ‑ 7 cell line. Oncol Rep 2015; 33(2): 921 – 929. doi: 10.3892/ or.2014.3627.
6. Nichols JW, Bae YH. Evidence and fallacy. J Control Release 2014; 190 : 451 – 464. doi: 10.1016/ j.jconrel.2014.03.057.
7. Maeda H. Macromolecular therapeutics in cancer treatment: the EPR effect and beyond. J Control Release 2012; 164(2): 138 – 144. doi: 10.1016/ j.jconrel.2012.04.038.
8. Konno T, Maeda H, Iwai K et al. Selective targeting of anti‑cancer drug and simultneous image ‑ enhancement in solid tumors by arterially administred lipid contrast ‑ medium. Cancer 1984; 54(11): 2367 – 2374.
9. Kobayashi H, Watanabe R, Choyke PL. Improving conventional enhanced permeability and retention (EPR) effects; what is the appropriate target? Theranostics 2013; 4(1): 81 – 89. doi: 10.7150/ thno.7193.
10. Dreher MR, Liu W, Michelich CR et al. Tumor vascular permeability, accumulation, and penetration of macromolecular drug carriers. J Natl Cancer Inst 2006; 98(5): 335 – 344.
11. Leu AJ, Berk DA, Lymboussaki AL et al. Absence of functional lymphatics within a murine sarcoma: a molecular and functional evaluation. Cancer Res 2000; 60(16): 4324 – 4327.
12. Jain RK. Vascular and interstitial barriers to delivery of therapeutic agents in tumors. Cancer Metastasis Rev 1990; 9(3): 253 – 266.
13. Stirland DL, Nichols JW, Miura S et al. Mind the gap: a survey of how cancer drug carriers are susceptible to the gap between research and practice. J Control Release 2013; 172(3): 1045 – 1064. doi: 10.1016/ j.jconrel.2013.09.026.
14. Zitka O, Cernei N, Heger Z et al. Microfluidic chip coupled with modified paramagnetic particles for sarcosine isolation in urine. Electrophoresis 2013; 34(18): 2639 – 2647.
15. Fabrik I, Adam V, Křížková S et al. Určení hladiny termostabilních thiolů u pacientů se zhoubným nádorem. Klin Onkol 2007; 20(6): 384 – 389.
16. Petrlová J, Blaštík O, Průša R et al. Analýza obsahu metalothioneinu u pacientů se zhoubným nádorem prsu, tlustého střeva a nebo melanomem. Klin Onkol 2006; 19(2): 138 – 142.
17. Mody VV, Siwale R, Singh A et al. Introduction to metallic nanoparticles. J Pharm Bioallied Sci 2010; 2(4): 282 – 289. doi: 10.4103/ 0975 ‑ 7406.72127.
18. Dobson J. Gene therapy progress and prospects: magnetic nanoparticle‑based gene delivery. Gene Therapy 2006; 13(4): 283 – 287.
19. Rudge S, Peterson C, Vessely C et al. Adsorption and desorption of chemotherapeutic drugs from a magnetically targeted carrier (MTC). J Control Release 2001; 74(1 – 3): 335 – 340.
20. Corber SR et al. Cisplatin‑based metal organic framework nanoparticles for targeted drug delivery and tumor imaging. Abstracts of Papers of the American Chemical Society, 2014: sv. 247.
21. Blažková I, Vaculovičová M, Křížková S et al. Moderní zobrazovací techniky pro antracyklinová cytostatika – literární přehled. Klin Onkol 2013; 26(4): 239 – 244. doi: 0.14735/ amko2013239.
22. Xie J, Lee S, Chen X. Nanoparticle‑based theranostic agents. Adv Drug Deliv Rev 2010; 62(11): 1064 – 1079. doi: 10.1016/ j.addr.2010.07.009.
23. Guthi JS, Yang SG, Huang G et al. MRI ‑ visible micellar nanomedicine for targeted drug delivery to lung cancer cells. Mol Pharm 2010; 7(1): 32 – 40. doi: 10.1021/ mp9001393.
24. Chen YH, Tsai CY, Huang PY et al. Methotrexate conjugated to gold nanoparticles inhibits tumor growth in a syngeneic lung tumor model. Mol Pharm 2007; 4(5): 713 – 722.
25. Simone CB 2nd, Friedberg JS, Glatstein E et al. Photodynamic therapy for the treatment of non‑small cell lung cancer. J Thorac Dis 2012; 4(1): 63 – 75. doi: 10.3978/ j.issn.2072 ‑ 1439.2011.11.05.
26. Qian Y, Qiu M, Wu Q et al. Enhanced cytotoxic activity of cetuximab in EGFR ‑ positive lung cancer by conjugating with gold nanoparticles. Sci Rep 2014; 4 : 7490. doi: 10.1038/ srep07490.
27. Kao HW, Lin YY, Chen CC et al. Evaluation of EGFR ‑ targeted radioimmuno ‑ gold ‑ nanoparticles as a theranostic agent in a tumor animal model. Bioorg Med Chem Lett 2013; 23(11): 3180 – 3185. doi: 10.1016/ j.bmcl.2013.04.002.
28. Dufort S, Bianchi A, Henry M et al. Nebulized gadolinium‑based nanoparticles: a theranostic approach for lung tumor imaging and radiosensitization. Small 2015; 11(2): 215 – 221. doi: 10.1002/ smll.201401284.
29. Shi H, Ye X, He X et al. Au@Ag/ Au nanoparticles assembled with activatable aptamer probes as smart „nano ‑ doctors“ for image ‑ guided cancer thermotherapy. Nanoscale 2014; 6(15): 8754 – 8761. doi: 10.1039/ c4nr01927j.
30. Vajpayee V, Yang YJ, Kang SC et al. Hexanuclear self ‑ assembled arene ‑ ruthenium nano ‑ prismatic cages: potential anticancer agents. Chem Commun (Camb.) 2011; 47(18): 5184 – 5186. doi: 10.1039/ c1cc10167f.
31. Zhang S, Li J, Lykotrafitis G et al. Size ‑ dependent endocytosis of nanoparticles. Adv Mater 2009; 21 : 419 – 424.
32. Muthukumar T, Chamundeeswari M, Prabhavathi Set al. Carbon nanoparticle from a natural source fabricated for folate receptor targeting, imaging and drug delivery application in A549 lung cancer cells. Eur J Pharm Biopharm 2014; 88(3): 730 – 736. doi: 10.1016/ j.ejpb.2014.09.011.
33. Yang K, Zhang S, Zhang G et al. Graphene in mice: ultrahigh in vivo tumor uptake and efficient photothermal therapy. Nano Lett 2010; 10(9): 3318 – 3323. doi: 10.1021/ nl100996u.
34. Liu Z, Davis C, Cai W et al. Circulation and long‑term fate of functionalized, biocompatible single‑walled carbon nanotubes in mice probed by Raman spectroscopy. Proc Natl Acad Sci U S A 2008; 105(5): 1410 – 1415. doi: 10.1073/ pnas.0707654105.
35. Schipper ML, Nakayama‑Ratchford N, Davis CR et al. A pilot toxicology study of single‑walled carbon nanotubes in a small sample of mice. Nat Nanotechnol 2008; 3(4): 216 – 221. doi: 10.1038/ nnano.2008.68.
36. Ungaro F, d‘Angelo I, Miro A et al. Engineered PLGA nano ‑ and micro‑carriers for pulmonary delivery: challenges and promises. J Pharm Pharmacol 2012; 64(9): 1217 – 1235. doi: 10.1111/ j.2042 ‑ 7158.2012.01486.x.
37. Sengupta S, Eavarone D, Capila I et al. Temporal targeting of tumour cells and neovasculature with a nanoscale delivery system. Nature 2005; 436(7050): 568 – 572.
38. Bharali DJ, Khalil M, Gurbuz M et al. Nanoparticles and cancer therapy: a concise review with emphasis on dendrimers. Int J Nanomedicine 2009; 4(1): 1 – 7.
39. Komínková M, Guráň R, Merlos R et al. Study of functional qualities of different types of tailored liposomes with encapsulated doxorubicin using electrochemical and optical methods. Int J Electrochem Sci 2014; 9(6): 2993 – 3007.
40. Poprach A, Petráková K, Vyskočil J et al. Kardiotoxicita léků používaných v onkologii. Klin Onkol 2008; 21(5): 288 – 293.
41. Devarajan P, Tarabishi R, Mishra J et al. Low renal toxicity of lipoplatin compared to cisplatin in animals. Anticancer Res 2004; 24(4): 2193 – 2200.
42. Mylonakis N, Athanasiou A, Ziras N et al. Phase II study of liposomal cisplatin (Lipoplatin (TM)) plus gemcitabine versus cisplatin plus gemcitabine as first line treatment in inoperable (stage IIIB/ IV) non‑small cell lung cancer. Lung Cancer 2010; 68(2): 240 – 247. doi: 10.1016/ j.lungcan.2009.06.017.
43. Zhou J, Zhao WY, Ma X et al. The anticancer efficacy of paclitaxel liposomes modified with mitochondrial targeting conjugate in resistant lung cancer. Biomaterials 2013; 34(14): 3626 – 3638. doi: 10.1016/ j.biomaterials.2013.01.078.
44. North S, Butts C. Vaccination with BLP25 lipsome vaccine to treat non‑small cell lung and prostate cancers. Expert Rev Vaccines 2005; 4(3): 249 – 257.
45. Wu YL, Park K, Soo RA et al. INSPIRE: a phase III study of the BLP25 liposome vaccine (L ‑ BLP25) in Asian patients with unresectable stage III non‑small cell lung cancer. BMC Cancer 2011; 11 : 430. doi: 10.1186/ 1471 ‑ 2407 ‑ 11 ‑ 430.
46. Prudkin L, Behrens C, Liu DD et al. Loss and reduction of Fus1 protein expression is a frequent phenomenon in the pathogenesis of lung cancer. Clin Cancer Res 2008; 14(1): 41 – 47. doi: 10.1158/ 1078 ‑ 0432.CCR ‑ 07 ‑ 1252.
47. Lu C, Stewart DJ, Lee JJ et al. Phase I clinical trial of systemically administered TUSC2(FUS1) ‑ nanoparticles mediating functional gene transfer in humans. PLoS One 2012; 7(4): e34833. doi: 10.1371/ journal.pone.0034833.
48. Li SD, Huang L. Targeted delivery of antisense oligodeoxynucleotide and small interference RNA into lung cancer cells. Mol Pharm 2006; 3(5): 579 – 588.
49. Saini SS, Klein MA. Targeting cyclin D1 in non‑small cell lung cancer and mesothelioma cells by antisense oligonucleotides. Anticancer Res 2011; 31(11): 3683 – 3690.
50. Elzoghby AO, Samy WM, Elgindy NA. Albumin‑based nanoparticles as potential controlled release drug delivery systems. J Control Release 2012; 157(2): 168 – 182. doi: 10.1016/ j.jconrel.2011.07.031.
51. Chen Q, Liang C, Wang C et al. An imagable and photothermal „Abraxane‑like“ nanodrug for combination cancer therapy to treat subcutaneous and metastatic breast tumors. Adv Mater 2015; 27(5): 903 – 910. doi: 10.1002/ adma.201404308.
52. Şimşek E, Kiliç MA. Magic ferritin: a novel chemotherapeutic encapsulation bullet. Journal of Magnetism and Magnetic Materials 2005; 293(1): 509 – 513.
53. Carbognani P, Rusca M, Romani A et al. Transferrin receptor expression in nonsmall cell lung cancer: histopathologic and clinical correlates. Cancer 1996; 78(1): 178 – 179.
54. Heger Z, Skalickova S, Zitka O et al. Apoferritin applications in nanomedicine. Nanomedicine (Lond) 2014; 9(14): 2233 – 2245. doi: 10.2217/ nnm.14.119.
55. Moghimi SM, Hunter AC, Murray JC. Long-circulating and target - specific nanoparticles: theory to practice. Pharmacol Rev 2001; 53(2): 283 – 318.
Štítky
Dětská onkologie Chirurgie všeobecná Onkologie
Článek vyšel v časopiseKlinická onkologie
Nejčtenější tento týden
2015 Číslo 4- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Nejasný stín na plicích – kazuistika
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
-
Všechny články tohoto čísla
- Editorial
- Moderní nanomedicína v léčbě karcinomů plic
- Potenciál volné cirkulující DNA v diagnostice nádorových onemocnění
- Možnosti inhibice receptoru pro epidermální růstový faktor u karcinomu anu
- Analýza nákladové efektivity porovnávající panitumumab plus mFOLFOX6 a bevacizumab plus mFOLFOX6 v první linii metastatického kolorektálního karcinomu s expresí nemutovaného typu onkogenu RAS – adaptace modelu na podmínky České republiky
- Odhadovaná glomerulární filtrace u onkologických pacientů před chemoterapií cisplatinou
- Incidencia a prognostický význam známych genetických aberácií u pacientov s diagnózou akútnej myeloblastovej leukémie – dvojročná štúdia
- Extraoseální Ewingův sarkom, primární postižení děložního čípku – kazuistika
- Embryonálne tumory s mnohovrstvovými rozetami – vzácne tumory centrálneho nervového systému v detskom veku
- Antikoagulační léčba a trombembolizmus při léčbě bevacizumabem – opatrnost, či obavy?
- SOUTĚŽ O NEJLEPŠÍ PRÁCI
- Domácí parenterální výživa v onkologii
- Aktuality z odborného tisku
- Plicní fibróza po oxaliplatině
- SOUTĚŽ NA PODPORU AUTORSKÝCH TÝMŮ PUBLIKUJÍCÍCH V ZAHRANIČNÍCH ODBORNÝCH TITULECH
- Klinická onkologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Extraoseální Ewingův sarkom, primární postižení děložního čípku – kazuistika
- Domácí parenterální výživa v onkologii
- Embryonálne tumory s mnohovrstvovými rozetami – vzácne tumory centrálneho nervového systému v detskom veku
- Potenciál volné cirkulující DNA v diagnostice nádorových onemocnění
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



