-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Hodnocení jaterní funkce v onkologické praxi
Liver Function Assessment in Oncology Practice
The overall condition and prognosis of a patient can be affected by impaired liver function. It applies to anticancer pharmacotherapy, liver surgery and radiological interventions. The liver condition is usually assessed by common laboratory tests and clinical examination in daily practice. Liver tests consist of aminotransferases – alanine transaminase, aspartate transaminase, bilirubin, alkaline phosphatase, gamma glutamyl transpeptidase, lactate dehydrogenase, albumin and prothrombin time, less frequently prealbumin and cholinesterase. The alkaline phosphatase and aspartate transaminase are markers of a liver damage, the alkaline phosphatase and gamma glutamyl transpeptidase are most useful as markers for cholestatic liver injury. Albumin, prealbumin, cholinesterase and prothrombin time are the markers of synthetic liver function. Bilirubin and bile acids are related to the liver transport and excretory capacity. The Child-Pugh score is used to assess prognosis of chronic liver disease, mainly cirrhosis. The examination of liver function using indocyanine green helps to determinate the extent of possible liver resection. A mathematical analysis of dynamic cholescintigraphy and a calculation of hepatic extraction fraction enables quantification of liver function. Other liver function tests are of little use in oncology.
Key words:
liver function tests – drug induced liver injury – indocyanine green – nuclear medicine
Autoři: J. Tomášek 1
; J. Prášek 2; I. Kiss 1
; L. Husová 3; J. Podhorec 1
Působiště autorů: Klinika komplexní onkologické péče, Masarykův onkologický ústav, Brno 1; Klinika Nukleární mediciny FN Brno 2; Centrum kardiovaskulární a transplantační chirurgie FN u sv. Anny v Brně 3
Vyšlo v časopise: Klin Onkol 2012; 25(6): 427-433
Kategorie: Přehledy
Práce byla podpořena grantem GA ČR č. NT/11128-4/2010, „Endoluminální radiofrekvenční ablace tumorů postihujících žlučové cesty“.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do bi omedicínských časopisů.
Souhrn
Snížená funkce jater může negativně ovlivnit celkový stav a prognózu každého jedince, je často limitujícím faktorem pro terapii nádorových onemocnění. Týká se to jak protinádorové farmakoterapie, tak chirurgie jaterních nádorů a použití intervenčních radiologických metod v terapii jaterních nádorů. V běžné praxi je funkce jater hodnocena základním klinickým vyšetřením pacienta a běžnými laboratorními testy, které zahrnují alaninaminotransferázu, aspartátaminotransferázu, bilirubin, alkalickou fosfatázu, gamaglutamyltransferázu, laktátdehydrogenázu, albumin, protrombinový čas, méně často prealbumin a cholinesterázu. Transaminázy alaninaminotransferáza a aspartátaminotransferáza vyjadřují míru poškození jaterních buněk, alkalická fosfatáza a gamaglutamyltransferáza jsou cholestatické markery. Vlastní syntetickou funkci jater vyjadřuje albumin, prealbumin, cholinesteráza a protrombinový čas. Bilirubin a žlučové kyseliny vypovídají o transportní a exkreční kapacitě jater. Základním skórovacím systémem pro hodnocení funkčního stavu jater u pacientů s jaterní cirhózou je Child-Pughova klasifikace. V chirurgii jater se často používá ke stanovení možného rozsahu resekce vyšetření jaterní funkce pomocí indocyaninové zeleně. Jaterní funkci dobře popisuje hepatální extrakční frakce vypočítaná při dynamické cholescintigrafii. Další testy jaterní funkce v onkologické praxi větší využití nemají.
Klíčová slova:
játra – funkční testy – lékové postižení jater – inocyaninová zeleň – nukleární lékařstvíFunkce jater
Hmotnost jater představuje u dospělého člověka přibližně 3 % hmotnosti těla, u dospělého muže to je mezi 1 500–1 800 g, u žen 1 200–1 500 g. Cévní zásobení jater je tvořeno portálním a arteriálním systémem. Portální systém tvoří vlastní funkční oběh jater. Portální žilou je přiváděna krev z oblasti střev, sleziny, žlučníku a pankreatu. V portální krvi jsou koncentrovány živiny vstřebané z trávicího traktu, ale i potenciálně škodlivé látky, jako jsou toxiny a xenobiotika, ke kterým patří také léčiva. Vzhledem k anatomické lokalizaci portální žíly v hloubce dutiny břišní je její diagnostika obtížná, komplikovaná je také lokální léčba. Portální žilou do jater přitéká 70–75 % krve, arteriální tepnou zbylých 25–30 %. Krev přitékající jaterní tepnou zajišťuje oxygenaci a vlastní nutrici jaterního parenchymu i stromatu jater. Odtok žilní krve z jater je společný pro atreriální i portální řečiště. Propojení těchto systémů se děje v jaterních lalůčcích, resp. v jaterních sinusoidách. V jaterních lalůčcích také začíná biliární systém. Játra jsou orgán s mimořádným metabolickým obratem. Játry proteče 28 % celkového průtoku krve a využijí 20 % celkové spotřeby kyslíku v organizmu.
Jaterní funkce jsou velmi komplexní, odehrává se v nich zásadní část energetického a intermediárního metabolizmu organizmu. Probíhá v nich tvorba a vylučování žluči, která je důležitá jednak pro trávení tuků, jednak jsou žlučí vylučované látky, které nejsou z těla odstraňovány ledvinami. V játrech je metabolizována většina látek přicházejících portální krví z trávicího traktu, ale i látky přicházející arteriální krví z celého těla. Jsou to jednak látky vznikající v těle (hormony, bilirubin, žlučové kyseliny), jednak jsou to látky exogenní, cizorodé látky (např. toxiny, léčiva). Jaterní parenchym má zásadní význam v metabolizmu sacharidů, podílí se na udržování přiměřené hladiny glukózy v krvi. Řídí metabolizmus aminokyselin a udržuje jejich stálou hladinu v krvi. S tím pak souvisí syntéza plazmatických proteinů, které jsou většinově syntetizovány v játrech. Také metabolizmus lipidů se odehrává velkou měrou v jaterním parenchymu, a tím je dán také vztah jater k přeměně lipofilních vitaminů. Důležitá je funkce při metabolizmu mědi a železa. Významný je podíl jater na imunitních funkcích organizmu [1]. Buňky imunitního systému představují asi 10 % ze všech jaterních buněk. Jsou to mimo jiné Kupfferovy a dendritické buňky, endotelové buňky jaterních sinusoid a krevní buňky imunitního systému, které do jater vstupují a zase vystupují (lymfocyty, granulocyty) [2].
Laboratorní diagnostika
Existuje několik set laboratorních testů zaměřených na diagnostiku hepatopatií. Kromě biochemických vyšetření to jsou testy sérologické, hematologické, imunologické a molekulárně genetické. Při hodnocení laboratorních parametrů musíme brát v úvahu, že játra mají velkou funkční rezervu a regenerační schopnost, poškození pouze části jaterního parenchymu se nemusí laboratorně nijak projevit. Velká část biochemických vyšetření je nespecifická a patologické hodnoty mohou mít příčinu také mimo jaterní oblast. Je nutné mít na zřeteli, že jednotlivé vyšetření přináší informaci o aktuálním stavu jater, který se podle dynamiky nemoci nebo i regenerace po inzultu může rychle zhoršovat, nebo měnit k lepšímu. K přesné diagnostice jaterního poškození je obvykle nutno kombinovat výsledky několika laboratorních parametrů, které hodnotí různé jaterní funkce, a většinou je nutné znát i dynamiku těchto hodnot v čase. Stručně zmíníme základní běžně používaná a dostupná laboratorní vyšetření.
Míru poškození hepatocytů vyjadřují hodnoty aspartátaminotransferázy (AST) a alaninaminotransferázy (ALT). Enzym ALT je lokalizován v játrech a je specifický pro jaterní poškození, izoenzymy AST jsou přítomny také v jiných tkáních, jako je srdeční sval, kosterní svaly, mozek, ledviny, játra, slinivka břišní a erytrocyty. AST se vyskytuje v cytosolu a v mitochondriích, ALT pouze v cytosolu. Elevace AST je prognosticky závažnější, ukazuje na nekrózu hepatocytů. Aktivitu ALT i AST ovlivňuje řada faktorů a jejich hodnoty mohou kolísat až o 30 % u zdravých jedinců i při hepatopatii. K největšímu zvýšení obou transamináz dochází při akutních virových hepatitidách, toxickém poškození jater, u akutní ischemie a při šokovém stavu s poruchou cirkulace. Hodnota elevace je závislá na rozsahu jaterního poškození, ale není prognostickým faktorem. Pokles hodnot obvykle signalizuje ústup hepatopatie, ale může také znamenat masivní nekrózu. K přechodnému vzestupu ALT a AST dochází po intervenčních zákrocích v játrech (např. chemoembolizace, radiofrekvenční ablace).
Ukazatelem cholestázy nebo poškození žlučových cest je alkalická fosfatáza (ALP), gamaglutamyltransferáza (GGT) a přímý bilirubin. Nejvyšší hodnoty ALP a také GGT vyvolávají cholestatická onemocnění, v onkologii daná obvykle obstrukcí žlučovodů při nádorové infiltraci. Kostní izoenzym je příčinou elevace ALP při většině kostních chorob včetně metastatické diseminace do skeletu. Stanovení izoenzymů se rutinně neprovádí, je vždy nutná korelace s klinickým stavem.
GGT se vyskytuje v různých tkáních s exkreční a absorpční funkcí, především v játrech, ledvinách, pankreatu, slezině, srdci a v mozku. Při jaterních onemocněních stoupá hodnota GGT v korelaci s ALP, GGT je však citlivější. Při cholestáze se pohybuje hodnota GGT průměrně kolem dvanáctinásobku normy, ALP dosahuje trojnásobku. Vzestup mikrosomálního izoenzymu je lehce vyvolán některými exogenními látkami. Jde především o alkohol, ale i řadu léčiv (např. cimetidin, estrogeny, fenobarbilatl, heparin, furosemid) [3]. Zvýšení GGT lze zaznamenat u kuřáků, při revmatoidní artritidě, diabetu mellitu, chronické nemoci bronchopulmonální nebo hypertyreóze. GGT je velmi často označována zkratkou GMT, to je ale oficiální zkratka jiného enzymu – glycin-sarkosin N-metyltransferázy.
Bilirubin vzniká dominantně degradací hemoglobinu. Jeho hladina v séru vyjadřuje schopnost hepatocytů vychytávat bilirubin z plazmy a po konjugaci s kyselinou glukuronovou jej vylučovat do žluče, jedná se tedy o transportní a exkreční kapacitu jater. Za normálních okolností se konjugovaný bilirubin vyskytuje v séru jen stopově. Ke zvýšení sérové hladiny dochází při jeho regurgitaci z hepatocytů zpět do plazmy, což provází intrahepatální i extrahepatální cholestázu. Cholestáza provází pokročilá nádorová onemocnění často, intrahepatální cholestázu lze ale vyvolat i farmakologicky. K hyperbilirubinemii dochází až po překročení značné rezervní kapacity jater, zvýšená hladina bilirubinu je indikátorem snížené jaterní funkce. Se zvýšenou koncentrací nekonjugovaného bilirubinu se setkáváme při hemolýze nebo při vrozené poruše jeho konjugace.
Syntetickou kapacitu jater lze odhadnout podle hladiny některých proteinů, které se v játrech syntetizují. Kvantitativně nejvíce zastoupeným sérovým proteinem jaterní syntézy je albumin. Poločas albuminu je 19–21 dnů, a proto není vhodný ke sledování akutních stavů. Jaterní rezerva pro syntézu albuminu je vysoká. Kromě syntézy ovlivňuje hladinu albuminu stav nutrice, osmotický tlak, distribuční prostor a jeho katabolizmus. Pokles albuminu provází dekompenzovanou jaterní cirhózu nebo rozsáhlé nádorové infiltrace jater, při ascitu albumin uniká do peritoneální dutiny. Pokles albuminu je negativním prognostickým parametrem při benigních hepatopatiích i při nádorovém onemocnění. Pro hodnocení proteosyntézy u akutních jaterních lézí je vhodný prealbumin, který má poločas 1,9 dne. Játra jsou místem syntézy mnoha koagulačních faktorů, jedním z nich je protrombin. Koagulační poruchy také odrážejí jaterní funkci. Běžně se používá stanovení protrombinového času, který zachycuje aktivitu zevní cesty koagulační kaskády. Obvykle je vyjadřován jako INR (international normalized ratio). Prodloužení protrombinového času při hepatopatii má prognostický význam, ale INR může být pochopitelně ovlivněn řadou jiných faktorů (např. deficit vitaminu K, antikoagulační terapie nebo konsumpční koagulopatie).
Amoniak vzniká metabolizmem dusíkatých látek, především aminokyselin. V játrech z něj vzniká urea. K vzestupu dochází u jaterní insuficience, ale zvýšené hodnoty mohou mít řadu nehepatálních příčin (např. krvácení do GIT, vysoce proteinová dieta, krevní transfuze, větší fyzická zátěž, kouření, tvorba amoniaku působením H. pylori v žaludku). Jednotlivé vyšetření je obtížně interpretovatelné, větší váhu má série několika hodnot v několikadenních intervalech a kolerace je lepší při odběru arteriální než venózní krve.
Zvýšení biochemických testů jaterní funkce u onkologického pacienta nemusí být v souvislosti s nádorovým onemocněním, ani jeho léčbou. Vybrané obvyklé možné příčiny jsou shrnuty v tab. 5.
Tab. 1. Vybrané nenádorové příčiny zvýšení jaterních biochemických testů. 
Klinická relevance laboratorních vyšetření ve vztahu k protinádorové léčbě
Podle kritérií toxicity NCI CTCAE (Common Terminology Criteria for Adverse Events) verze 4.0 je hodnocen nežádoucí účinek jako těžký (stupeň 3) v případě, že dochází k vzestupu ALT, AST, ALP na 5–20násobek horní hranice normy, bilirubinu na 3–10násobek [4]. Nad těmito hodnotami pak jde již o 4. stupeň, který je popisován jako život ohrožující. K vzestupu těchto laboratorních parametrů a jejich následnému poklesu ale může dojít i u asymptomatických pacientů. Typickým příkladem je vzestup enzymů jaterního souboru v hodinách následujících po chemoembolizaci nádorového ložiska v játrech. Zachycení vrcholů aktivity enzymů velmi závisí na čase, kdy je vyšetření po výkonu nebo aplikaci léčiva provedeno. Prognózovat poškození jater na základě těchto maximálních hodnot je velmi sporné a tyto hodnoty neodrážejí funkční stav a kapacitu jater. Vyšetření enzymů jaterního souboru před zahájením a mezi cykly chemoterapie je obvyklou praxí, na základě těchto vyšetření je odhadována metabolická kapacita jater a upravováno dávkování chemoterapie, případně je konstatována její kontraindikace. Toto vyšetření popisuje jednak stav jater před zahájením léčby, jednak vývoj v jejím průběhu. Je nutné si ale uvědomit, že normální hodnoty jaterních enzymů nevylučují jaterní onemocnění. Např. nemocní s chronickou hepatitidou B, C nebo steatózou jater mohou mít normální hodnoty.
Skórovací systémy jaterní funkce
V praxi se běžně používá několik skórovacích systémů, které umožňují hodnotit jaterní funkci kombinací několika laboratorních a klinických parametrů. Child-Pughova klasifikace jaterní funkce (Child-Turcotte-Pugh skóre) dobře hodnotí stav jater u pacientů s jaterní cirhózou a zařazuje pacienty do funkční třídy A, B nebo C (tab. 1). Tento model (Child-Turcotte) byl původně vyvinut pro stanovení rizika pacientů léčených portosystémovou anastomózou [5] pro krvácení, později byla klasifikace modifikována, v Pughově modifikaci bylo vynecháno hodnocení nutrice a nahrazeno protrombinovým časem. K predikci přežití pacientů s dekompenzovanou jaterní cirhózou se v transplantologii používá skórovací model MELD (model for end-stage liver disease), který vychází z hodnoty kreatininu a bilirubinu v séru a hodnoty INR [6]. Na rozdíl od Child-Pughovy klasifikace je v tomto modelu zahrnuta i funkce ledvin [7]. Model určuje pravděpodobnost 3měsíčního přežití pacientů čekajících na transplantaci jater a je používán např. organizacemi Eurotransplant a UNOS (United Network for Organ Sharing). Vzorec má různé modifikace, online výpočet lze najít na webových stránkách UNOS [8]:
MELD skóre = 0,957 × Loge (kreatinin mg/dL) + 0,378 × Loge (bilirubin mg/dL) + 1,120 × Loge (INR) + 0,6431.
Tab. 2. Child-Pughova klasifikace funkčního hodnocení jater u pacientů s cirhózou. 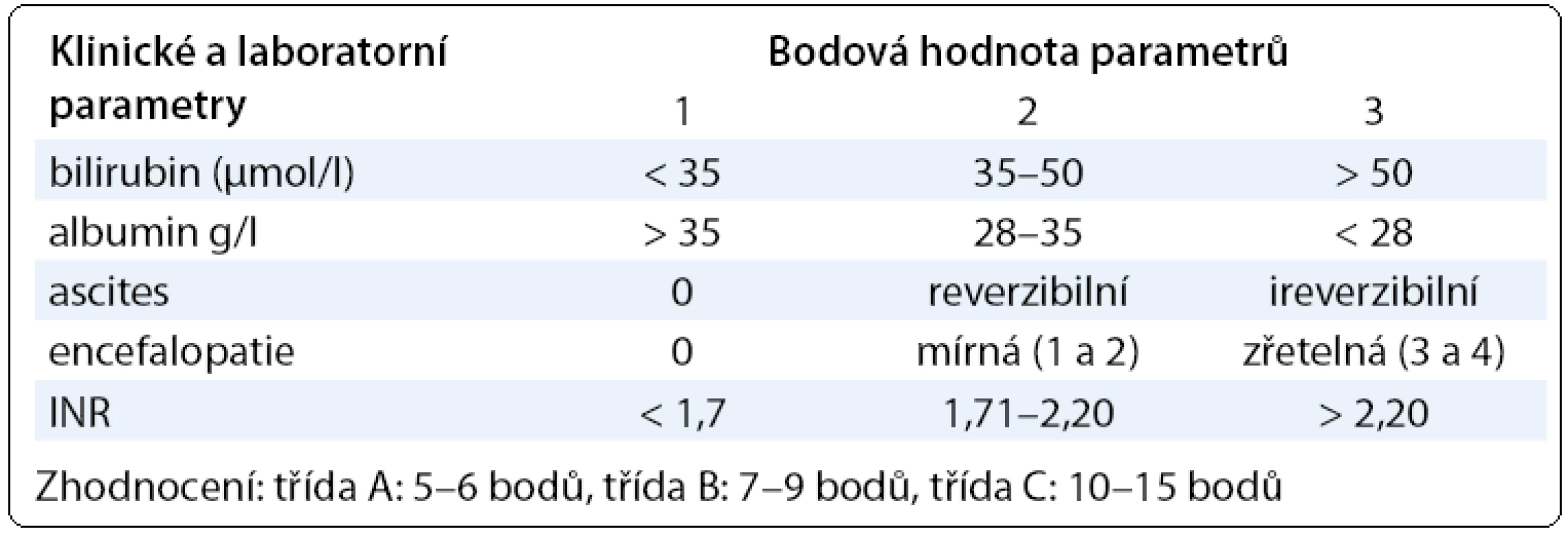
Pro pediatrické pacienty vznikl obdobný model PELD [9]. Kromě faktorů užívaných pro dospělé jsou do výpočtu PELD zahrnuty údaje o sérové koncentraci albuminu a o růstu.
Mezi další metody vyšetření jaterní funkce řadíme chromoexkreční zkoušky, clearance kofeinu, galaktózový eliminační test, dechové testy.
Chromoexkreční zkoušky
K chromoexkrečním zkouškám jaterní funkce se používají látky, které jsou po nitrožilním podání vychytávány játry a vylučovány do žluče. Koncentrace příslušné látky se stanoví v séru testované osoby obvykle kolorimetricky krátce po promísení a další nejméně jeden vzorek krve se odebírá po určité době. Poměr obou koncentrací vyjadřuje tzv. retenci látky v určitém čase. K chromoexkrečním zkouškám se užíval bromsulfoftalein (BSP), v současné době nejčastěji indocyaninová zeleň (ICG).
Retence indocyaninové zeleně
Indocyaninová zeleň je barvivo rozpustné ve vodě, které se po intravenózním podání váže na albumin a beta-lipoproteiny a je selektivně vychytáváno játry a nezměněné vylučováno žlučí. Není žádná mimojaterní cesta metabolizmu nebo vylučování ICG [10]. Eliminace ICG z krevního oběhu je závislá na perfuzi jater, vychytávání jaterním parenchymem a exkreci do žluče. Není ale ovlivněna enterohepatálním oběhem [11]. ICG je látka velmi dobře tolerovaná, netoxická, v literatuře je jen minimum zpráv o nežádoucích účincích; také paravenózní aplikace je dobře tolerována. Nejsou popsány žádné významné interakce s jinými léčivými přípravky nebo jiné interakce. ICG byla zavedena do praxe na začátku 60. let. Vlastní vyšetření probíhalo v minulosti obvykle podáním ICG ve formě bolusu a pak opakovanými odběry žilní krve z druhé paže. Koncentrace ICG v krvi pak byla stanovována pomocí spektrální fotometrie [12,13]. Takto prováděné vyšetření bylo časově a organizačně náročné. Velkým krokem vpřed proto bylo zavedení neinvazivní transkutánní monitorace ICG v krvi. Tato technika je velmi blízká pulzní oxymetrii. Vyšetření lze opakovaně provádět jednoduše přímo u lůžka pacienta, výsledky jsou známy okamžitě. V několika studiích byla potvrzena rovnocennost invazivního a neinvazivního stanovení ICG v krvi [14,15]. Základní parametry, které lze při vyšetřování jaterní funkce pomocí ICG sledovat, jsou míra eliminace ICG z plazmy (Plasma Disappearance Rate, PDR) a míra retence ICG po 15 minutách (R15), viz tab. 2.
Tab. 3. Parametry vyšetření jaterní funkce pomocí ICG. 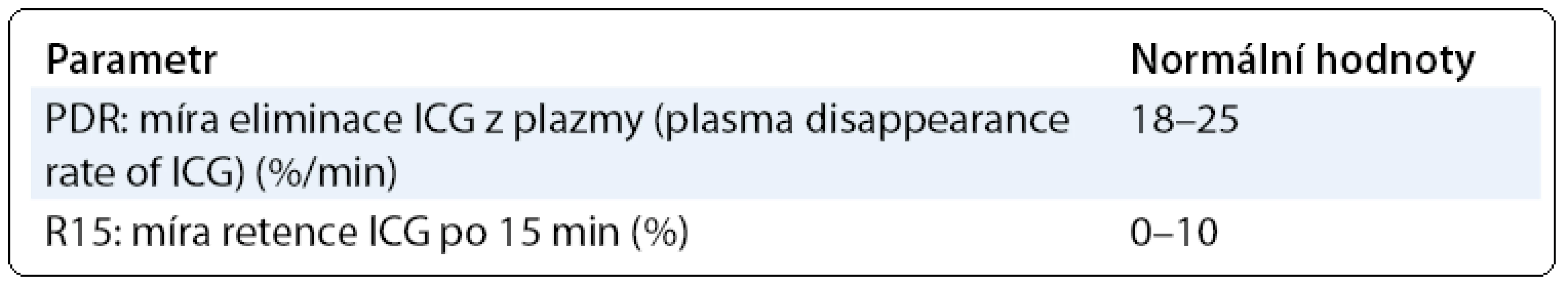
Vyšetření clearance ICG se používá jako parametr jaterní funkce u kriticky nemocných pacientů, kdy dobře koreluje s přežitím [16]. V chirurgii jater pomůže určení funkční rezervy jaterního parenchymu pomocí ICG ke stanovení bezpečného rozsahu resekčního výkonu tak, aby po resekci byla funkce zbytkového parenchymu jater dostatečná. Existuje několik kritérií, podle kterých je volen maximální rozsah resekce. Leypold et al [17] se opírají pouze o hodnotu retence ICG (tab. 3), Miyagawův algoritmus je komplexnější, zahrnuje také stav ascitu a hladinu bilirubinu (tab. 4) [18]. V případě rozsáhlých resekcí jaterního parenchymu je důležitá znalost objemu zbytkového jaterního parenchymu po resekci, toto objasní CT volumetrie jater [19]. Nejrizikovější jsou k velkým jaterním resekcím pacienti vysokého věku, se sníženou jaterní funkcí po dlouhé neoadjuvantní chemoterapii, a pokud dochází k cirhotické přestavbě jater [20].
Tab. 4. (upraveno podle Leypolda). 
Tab. 5. Kritéria bezpečné jaterní resekce (upraveno podle Miyagawy et al 1995 a Kysely 2006). 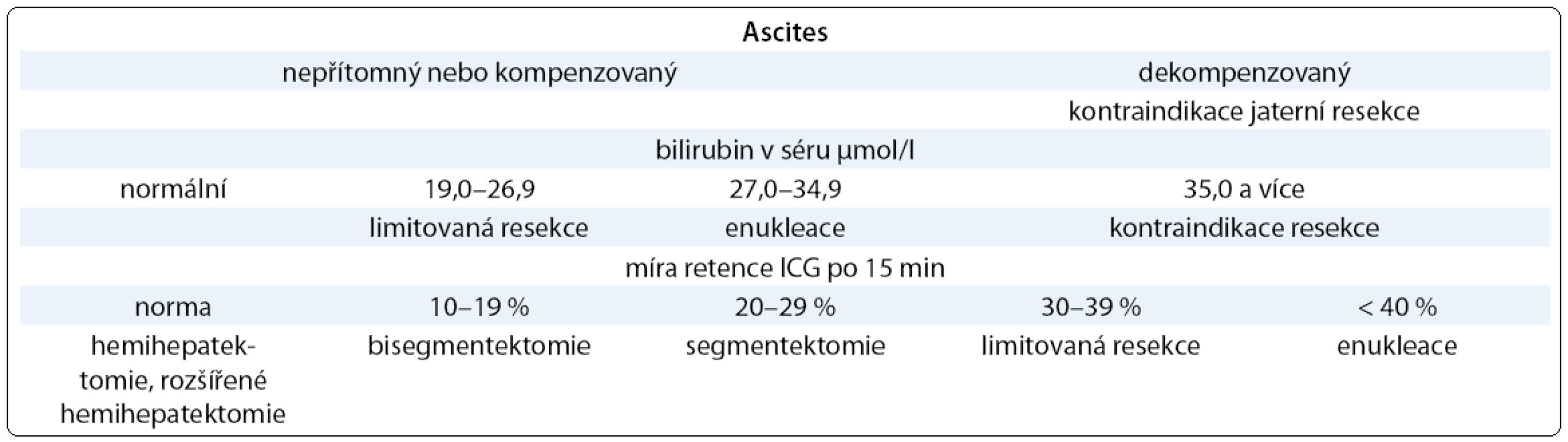
Radionuklidová diagnostika funkčních poruch hepatobiliárního systému
Funkční schopnost jater a také kinetiku žlučových cest můžeme hodnotit pomocí dynamické cholescintigrafie. Toto vyšetření má také morfologické aspekty. K vyšetření jsou používána radiofarmaka založená na bázi kyseliny iminodioctové (IDA), která jsou značena 99mTechneciem. HIDA je firemní označení iminodioctové kyseliny. HIDA má rychlou hepatobiliární kinetiku. Po intravenózní aplikaci je HIDA vychytávána hepatocyty a vylučována do žlučových kanálků a žlučových cest, hromadí se pak ve žlučníku, odkud se evakuuje po evakuačním podnětu. Evakuačním podnětem může být 50 g čokolády nebo i. v. podaný cholecystokinin. Průchod radiofarmaka játry a jeho pasáž žlučovými cestami až do duodena a tenkého střeva je při vyšetření sledován scintilační kamerou v krátkých intervalech. Rychlost transportu radiofarmaka játry může být ovlivněna hypoalbuminemií a hyperbilirubinemií, které vylučování zpomalují [21]. Rychlost vychytávání je závislá na množství hepatocytů v játrech a jejich funkčním stavu. Jaterní clearance 99mTc-HIDA je dána funkčním stavem hepatocytů a průchodností žlučových cest. Prodloužení clearance je tedy dáno nižší funkcí hepatocytů, zpomalením transportu žlučovými cestami nebo kombinací obou faktorů [22]. Jaterní funkci nelze stanovit např. pouze na základě hodnocení maxima aktivity nad játry. Musíme brát v úvahu rychlost transportu radiofarmaka do jater nebo možnost zpomalení transportu ve žlučových cestách. Možným řešením je použití dekonvoluční analýzy [23,24]. Dekonvoluční analýza je matematická metoda, při které jsou složitější křivky rozloženy na křivky jednodušší. Schopnost jater metabolizovat HIDA lze využít ke kvantifikaci jaterní funkce výpočtem hepatální extrakční frakce (HEF). Do dekonvoluční analýzy je jako vstupní křivka zadáván průběh aktivity v čase nad srdcem, která je obrazem měnící se koncentrace radiofarmaka v krevním oběhu a má vliv na jeho vychytávání hepatocyty a následný metabolizmus. Druhou zadávanou křivkou je křivka průběhu aktivity v čase nad jaterním parenchymem. Výsledná křivka po dekonvoluci je hypotetická křivka, která by vznikla záznamem nad játry, pokud bychom aplikovali jednotkový bolus radiofarmaka přímo do jaterní tepny. Při normální funkci jater je téměř 100 % HIDA při prvním průtoku játry vychytáno hepatocyty, metabolizováno a transportováno do žlučových cest. Při snížení jaterní funkce část radiofarmaka zůstává v krevním oběhu delší dobu. Hepatální extrakční frakce vyjadřuje, jak velká část HIDA je při jednom průchodu játry vychytána. Je udávána v procentech, normální hodnoty jsou 90–100 %, při těžkém snížení jaterní funkce jsou hodnoty kolem 10 % [22].
Ostatní zkoušky k vyšetření funkce jater uplatnění v onkologii nemají. Jde o jaterní funkční zátěžové testy, kdy jsou podána xenobiotika a je sledována jejich prostá jaterní exkrece nebo jednoduchá biotransformace probíhající v játrech [25]. Měří se pak clearance dané látky (galaktózový eliminační test, již zmíněná indocyaninová zeleň) nebo koncentrace metabolitu dané látky (aminopyrinový dechový test) [26].
V praxi se již nepoužívá galaktózový eliminační test. Galaktóza je zčásti metabolizována na CO2, zčásti je vylučována močí. Při zhoršeném jaterním metabolizmu galaktózy se zvyšovala její koncentrace v moči. Test clearance 13C značeného kofeinu využívá metabolizmu kofeinu cytochromem P450. Metabolity je možno měřit ve vydechovaném vzduchu (13CO2) nebo v periferní krvi (methylxantiny) [27]. V minulosti se používaly dechové testy s aminopyrinem nebo antipyrinem, které byly značeny 14C. Tyto látky jsou metabolizovány v játrech až na CO2, který je vydechován. Při testu je měřena aktivita 14CO2 ve vydechovaném vzduchu [28]. Test byl nahrazen dechovými testy s 13C, což je neradioaktivní stabilní izotop uhlíku, který se vyskytuje v přírodě. Pro testování jaterní funkce se obvykle používá metacetin značený 13C. Metacetin je pomocí cytochromu P450 metabolizován na CO2 a acetaminofen. Test s 13C značeným metacetinem měří jaterní demetylaci a oxidaci. Při vyšetření vydechuje testovaná osoba v intervalech do speciálních sáčků, v kterých je pak stanovován poměr 13CO2 a 12CO2. Jde o neinvazivní test dobře korelující s Child-Pughovou klasifikací. Prognostický význam testu v onkologii ani význam pro jaterní resekce zatím přesně popsán nebyl [29].
Hepatotoxické působení léčiv
Hepatotoxické látky lze rozdělit na skutečné hepatotoxiny (pravé, přímé, obligátní) a potenciální hepatotoxiny (netypické, senzitivující, nepřímé). Pravé hepatotoxiny poškozují játra u každého jedince, pokud jsou podány v dostatečné dávce. Mají konstantní latentní období. Obvykle jde o látky chemického průmyslu, méně často jde o přírodní látky, vzácně o léky (např. paracetamol, merkaptopurin). Potenciální hepatotoxiny poškodí játra jen u některých jedinců, není jasná závislost na dávce.
U více než 1 000 léčivých přípravků je popsáno možné hepatotoxické působení, u většiny se riziko poškození pohybuje mezi 1/10 000–1/100 000. Vysoký stupeň hepatotoxicity brání zavedení přípravku do praxe. Hepatotoxické látky mohou způsobit řadu typů jaterních lézí. K nejčastějším patří hepatocelulární nekróza, cholestáza, toxická alergická reakce, venookluzivní poškození, steatóza, jaterní fibróza, cirhóza a také nádory jater. Mechanizmus hepatotoxického účinku xenobiotik, a tedy i léků, může být různý. Molekulární léze může být vyvolána kovalentní vazbou toxické látky na proteiny, což může vyvolat nekrózu jaterních buněk, vazba na nukleové kyseliny může mít mutagenní účinek. Narušení transportních systémů v jaterní buňce může být důvodem cholestázy. Léky mohou vyvolat protilátkami zprostředkovanou hepatotoxicitu, indukovat apoptózu nebo poškodit mitochondriální funkce. Výsledné jaterní poškození je často kombinací několika účinků [30].
V průběhu onkologické léčby může dojít k lékovému poškození jater po podání antibiotik, analgetik, antiemetik, parenterální nutrice, ale i léčiv z jiných lékových skupin a především při vlastní protinádorové medikaci. Musíme brát v úvahu, že řada pacientů užívá volně prodejná léčiva, doplňkové podpůrné preparáty a potravinové doplňky.
Vyšší riziko jaterního poškození je u dětí a starších pacientů, u žen, u pacientů ve špatném nutričním stavu, při změnách v průtoku krve játry (srdeční selhání, poruchy gastrointestinálního traktu), při renálním poškození, při endokrinopatiích (diabetes mellitus, hypertyreóza).
Hepatotoxické účinky vybraných protinádorových léků
Doxorubicin
Podávání doxorubicinu je ojediněle spojeno s přechodnou elevací aminotransferáz [31].
Etoposid
V případě vysokodávkované chemoterapie v transplantačních režimech může vyvolat venookluzivní chorobu. Tento stav je život ohrožující. Při běžném dávkování je hepatotoxicita vzácná, bývá hepatocelulárního typu [32,33].
Cisplatina
Cisplatina může indukovat zvýšení transamináz, obvykle jen přechodně, vzácněji steatózu a cholestázu [34].
Dakarbazin
Podávání je vzácně komplikováno hypersenzitivní hepatitidou, dobře reagující na přerušení léčby a podání kortikoidů, kazuisticky může dojít k fulminantnímu jaternímu selhání [35].
Fluorouracil
Může vyvolávat steatózu, ale bez zvýšené morbidity nebo mortality [36,37].
Gemcitabin
Gemcitabin může zvyšovat hladinu aminotransferáz, obvykle přechodně [38].
Irinotekan
Po léčbě irinotekanem často (ve 25–50 %) vzniká steatóza a steatohepatitida, která může při následné resekci jaterních metastáz zvyšovat mortalitu. Po podávání irinotekanu dochází až u 25 % jedinců k většinou reverzibilní elevaci bilirubinu a aminotransferáz [39].
Kapecitabin
Až u čtvrtiny pacientů můžeme zachytit reverzibilní zvýšení bilirubinu, obvykle bez elevace obstrukčních enzymů [40,41].
Melfalan, busulfan
Při vysokodávkovém podávání riziko venookluzivní choroby [32,42].
Metotrexát
Při vyšším dávkování běžně dochází k přechodné elevaci ALT, AST. Dlouhodobé podávání (revmatologické indikace, imunosupresní léčba) a kumulativní dávka nad 2 g mohou být provázeny steatózou, atrofií jater, nekrózou, periportální fibrózou, cirhózou [43].
Oxaliplatina
Oxaliplatina může vyvolat vaskulární změny jaterního parenchymu na úrovni sinusoidů. Tento účinek je častý, je popisován ve 20–80 % případů po neoadjuvantní léčbě po resekci jaterních metastáz. Tímto se zvyšuje morbidita, ale ne mortalita [44,45].
Paklitaxel
Ve vyšším dávkování paklitaxel obvykle reverzibilně zvyšuje hladinu AST, ALT, ALP [46].
Topotekan
Topotekan může zvyšovat hladinu ALT a ALP při vyšším dávkování, stav je reverzibilní [47].
Interferon
Zvýšení hladin aminotransferáz se po vysazení obvykle vrací do normy [48].
Lanreotid, oktreotid
Při dlouhodobé léčbě je zvýšené riziko tvorby žlučových kamenů, často asymptomatické, vhodná laboratorní monitorace enzymů jaterního souboru [49].
Gefitinib
Mírné zvýšení aminotransferáz, klinicky málo významné [50].
Imatinib
Zvýšení hladiny bilirubinu a aminotransferáz, méně často až 4. stupně, vzácně jaterní nekróza, selhání [51,52].
Pazopanib
Zvýšení hladiny bilirubinu, aminotransferáz, zhoršení jaterní funkce. Během léčby je nutné laboratorně stav jater sledovat a případně přerušit nebo redukovat dávku [53,54].
Sorafenib
Vzácněji se může objevit vzestup bilirubinu a léky indukovaná hepatitida [55].
Sunitinib
Hepatotoxicita je vzácná, monitorace základních laboratorních parametrů jaterního souboru při léčbě je nutná.
Trastuzumab
Vzácněji bylo popsáno hepatocelulární poškození.
Závěr
Základní laboratorní vyšetření a klinické vyšetření nám ve většině případů dá dostatečnou informaci o funkčním stavu jater. Na našem pracovišti běžně používáme před rozsáhlejšími resekčními výkony na játrech vyšetření jaterní funkce pomocí ICG. Toto vyšetření provádíme také při plánování intervenční léčby nádorů jater, především v případě rozsáhlého postižení jater v terénu hepatopatie. Alternativně rutinně používáme stanovení HEF. Obě vyšetření spolu dobře korelují, výsledky našeho souboru s porovnáním obou metod budou publikovány v jiném sdělení.
MUDr. Jiří Tomášek
Klinika komplexní onkologické péče
Masarykův onkologický ústav
Žlutý kopec 7
656 53 Brno
e-mail: tomasek@mou.cz
Obdrženo: 10. 6. 2012
Přijato: 9. 7. 2012
Zdroje
1. Racanelli V, Rehermann B. The liver as an immunological organ. Hepatology 2006; 43 (2 Suppl 1): S54–S62.
2. Červinková Z. Funkce jater. In: Ehrmann J, Hůlek P (eds). Hepatologie. Praha: Grada 2010 : 25–36.
3. Vítek L. Laboratorní vyšetřovací metody. In: Ehrmann J, Hůlek P (eds). Hepatologie. Praha: Grada 2010 : 42–52.
4. CTCAE verze 4.0. National Cancer Institute. Available from: http://ctep.cancer.gov/protocolDevelopment//electronic_applications/ctc.htm#ctc_40.
5. Child CG, Turcotte JG. Surgery and portal hypertension. In: Child CG (ed). The liver and portal hypertension. Philadelphia: Saunders 1964 : 50–62.
6. Kamath PS, Wiesner RH, Malinchoc M et al. A model to predict survival in patients with end-stage liver disease. Hepatology 2001; 33(2): 464–470.
7. Carithers RL Jr. Liver transplantation. American Association for the Study of Liver Diseases. Liver Transpl 2000; 6(1): 122–135.
8. United Network For Organ Sharing, Richmond, USA, MELD, PELD kalkulator. Available from: http://www.unos.org/docs/MELD_PELD_Calculator_Documentation.pdf.
9. Wiesner RH, McDiarmid SV, Kamath PS et al. MELD and PELD: application of survival models to liver allocation. Liver Transpl 2001; 7(7): 567–580.
10. Stremmel W, Wojdat R, Groteguth R et al. Liver function tests in a clinical comparison. Z Gastroenterol 1992; 30(11): 784–790.
11. Sakka SG, Reinhart K, Meier-Hellmann A. Prognostic value of the indocyanine green plasma disappearance rate in critically ill patients. Chest 2002; 122(5): 1715–1720.
12. Tsubono T, Todo S, Jabbour N et al. Indocyanine green elimination test in orthotopic liver recipients. Hepatology 1996; 24(5): 1165–1171.
13. Plevris JN, Jalan R, Bzeizi KI et al. Indocyanine green clearance reflects reperfusion injury following liver transplantation and is an early predictor of graft function. J Hepatol 1999; 30(1): 142–148.
14. Faybik P, Krenn CG, Baker A et al. Comparison of invasive and noninvasive measurement of plasma disappearance rate of indocyanine green in patients undergoing liver transplantation: a prospective investigator-blinded study. Liver Transpl 2004; 10(8): 1060–1064.
15. Purcell R, Kruger P, Jones M. Indocyanine green elimination: a comparison of the LiMON and serial blood sampling methods. ANZ J Surg 2006; 76(1–2): 75–77.
16. Sakka SG. Assessing liver function. Curr Opin Crit Care 2007; 13(2): 207–214.
17. Leypold J, Kriz Z, Privara M et al. Vyšetření funkční zdatnosti jaterního parenchymu s pomocí indocyaninové zeleně před resekcí jater. Bratisl Lek Listy 2001; 102(2): 115–116.
18. Miyagawa S, Makuuchi M, Kawasaki S et al. Criteria for safe hepatic resection. Am J Surg 1995; 169(6): 589–594.
19. Lee SG, Hwang S. How I do it: assessment of hepatic reserve for indication of hepatic resection. J Hepatobiliary Pancreat Surg 2005; 12(1): 38–43.
20. Lodge JP. Assessment of hepatic reserve for the indication of hepatic resection: how I do it. J Hepatobiliary Pancreat Surg 2005; 12(1): 4–9.
21. Krishnamurthy S, Krishnamurthy GT. Quantitative assessment of hepatobiliary diseases with Tc99m-IDA scintigraphy. In: Freeman LM (ed). Nuclear medicine annual. New York: Raven Press 1988 : 309–330.
22. Prášek J. Atlas of dynamic cholescintigraphy. Praha: Lacomed 2004.
23. Tagge EP, Campbell DA Jr, Reichle R et al. Quantitative scintigraphy with deconvolutional analysis for the dynamic measurement of hepatic function. J Surg Res 1987; 42(6): 605–612.
24. Prasek J, Hep A, Dite P et al. The influence of dicetel on the mean transit time of 99mTc Trimethyl HIDA. Hepatogastroenterology 1994; 41(3): 302.
25. Jalan R, Hayes PC. Review article: quantitative tests of liver function. Aliment Pharmacol Ther 1995; 9(3): 263–270.
26. Reichen J. Assessment of hepatic function with xenobiotics. Semin Liver Dis 1995; 15(3): 189–201.
27. Kysela P. Způsoby vyšetření funkčních rezerv jaterního parenchymu. In: Válek V, Kala Z, Kiss I (eds). Maligní ložiskové procesy jater, diagnostika a léčba včetně minimálně invazivních metod. Praha: Grada 2006 : 244–247.
28. Urbain D, Muls V, Thys O et al. Aminopyrine breath test improves long-term prognostic evaluation in patients with alcoholic cirrhosis Child classes A and B. J Hepatol 1995; 22(2): 179–183.
29. Horák J. Kvantifikace jaterních funkcí. In: Ehrmann J, Hůlek P (eds). Hepatologie. Praha: Grada 2010 : 52–56.
30. Červinková Z, Šoerl J. Toxické poškození jater. In: Ehrmann J, Hůlek P (eds). Hepatologie. Praha: Grada 2010 : 365–371.
31. Avilés A, Herrera J, Ramos E et al. Hepatic injury during doxorubicin therapy. Arch Pathol Lab Med 1984; 108(11): 912–913.
32. Carreras E. Veno-occlusive disease of the liver after hemopoietic cell transplantation. Eur J Haematol 2000; 64(5): 281–291.
33. Tran A, Housset C, Boboc B et al. Etoposide (VP 16-213) induced hepatitis. Report of three cases following standard-dose treatments. J Hepatol 1991; 12(1): 36–39.
34. Hill JM, Loeb E, MacLellan A et al. Clinical studies of platinum coordination compounds in the treatment of various malignant diseases. Cancer Chemother Rep 1975; 59(3): 647–659.
35. Asbury RF, Rosenthal SN, Descalzi ME et al. Hepatic veno-occlusive disease due to DTIC. Cancer 1980; 45(10): 2670–2674.
36. Moertel CG, Fleming TR, Macdonald JS et al. Hepatic toxicity associated with fluorouracil plus levamisole adjutant therapy. J Clin Oncol 1993; 11(12): 2386–2390.
37. Peppercorn PD, Reznek RH, Wilson P et al. Demonstration of hepatic steatosis by computerized tomography in patients receiving 5-fluorouracil-based therapy for advanced colorectal cancer. Br J Cancer 1998; 77(11): 2008–2011.
38. Saif MW, Shahrokni A, Cornfeld D. Gemcitabine-induced liver fibrosis in a patient with pancreatic cancer. JOP 2007; 8(4): 460–467.
39. Morris-Stiff G, Tan YM, Vauthey JN. Hepatic complications following preoperative chemotherapy with oxaliplatin or irinotecan for hepatic colorectal metastases. Eur J Surg Oncol 2008; 34(6): 609–614.
40. Scheithauer W, McKendrick J, Begbie S et al. Oral capecitabine as an alternative to i.v. 5-fluorouracil-based adjuvant therapy for colon cancer: safety results of a randomized, phase III trial. Ann Oncol 2003; 14(12): 1735–1743.
41. Van Cutsem E, Twelves C, Cassidy J et al. Oral capecitabin compared with intravenous fluorouracil plus leucovorin in patients with metastatic colorectal cancer: results of a large phase III study. J Clin Oncol 2001; 19(21): 4097–4106.
42. Lazarus HM, Herzig RH, Graham-Pole J et al. Intensive melphalan chemotherapy and cryopreserved autologous bone marrow transplantation for the treatment of refractory cancer. J Clin Oncol 1983; 1(6): 359–367.
43. Hoekstra M, van Ede AE, Haagsma C et al. Factors associated with toxicity, final dose, and efficacy of methotrexate in patients with rheumatoid arthritis. Ann Rheum Dis 2003; 62(5): 423–426.
44. Vauthey JN, Pawlik TM, Ribero D et al. Chemotherapy regimen predicts steatohepatitis and an increase in 90-day mortality after surgery for hepatic colorectal metastases. J Clin Oncol 2006; 24(13): 2065–2072.
45. Morris-Stiff G, Tan YM, Vauthey JN. Hepatic complications following preoperative chemotherapy with oxaliplatin or irinotecan for hepatic colorectal metastases. Eur J Surg Oncol 2008; 34(6): 609–614.
46. Huizing MT, Misser VH, Pieters RC et al. Taxanes: a new class of antitumor agents. Cancer Invest 1995; 13(4): 381–404.
47. Creemers GJ, Lund B, Verweij J. Topoisomerase I inhibitors: topotecan and irinotecan. Cancer Treat Rev 1994; 20(1): 73–96.
48. Quesada JR, Talpaz M, Rios A et al. Clinical toxicity of interferons in cancer patients: a review. J Clin Oncol 1986; 4(2): 234–243.
49. Scarpignato C, Pelosini I. Somatostatin analogs for cancer treatment and diagnosis: an overview. Chemotherapy 2001; 47 (Suppl 2): 1–29.
50. Ho C, Davis J, Anderson F et al. Side effects related to cancer treatment: case 1. Hepatitis following treatment with gefitinib. J Clin Oncol 2005; 23(33): 8531–8533.
51. Ridruejo E, Cacchione R, Villamil AG et al. Imatinib-induced fatal acute liver failure. World J Gastroenterol 2007; 13(48): 6608–6611.
52. Schiff ER, Mindikoglu AL, Regev A et al. Imatinib mesylate (gleevec) hepatotoxicity. Dig Dis Sci 2007; 52(2): 598–601.
53. Keisner SV, Shah SR. Pazopanib: the newest tyrosine kinase inhibitor for the treatment of advanced or metastatic renal cell carcinoma. Drugs 2011; 71(4): 443–454.
54. Hutson TE, Davis ID, Machiels JP et al. Efficacy and safety of pazopanib in patients with metastatic renal cell carcinoma. J Clin Oncol 2010; 28(3): 475–480.
55. SPC Nexavar. Dostupné na: http://www.ema.europa.eu/.
Štítky
Dětská onkologie Chirurgie všeobecná Onkologie
Článek Klinický registr CORECT
Článek vyšel v časopiseKlinická onkologie
Nejčtenější tento týden
2012 Číslo 6- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Nejasný stín na plicích – kazuistika
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
-
Všechny články tohoto čísla
- Klinická onkologie slaví 25. výročí
- Molekulární podstata Waldenströmovy makroglobulinemie
- Prečo sú mitochondrie vhodné ciele pre liečbu rakoviny
- Hodnocení jaterní funkce v onkologické praxi
- EML4-ALK fúzní gen u pacientů s plicním karcinomem: biologie, diagnostika a cílená terapie
- Porovnání nákladů u režimů XELOX a FOLFOX-4 v léčbě kolorektálního karcinomu
- Výsledky léčby mozkových tumorů stereotaktickou radioterapií a radiochirurgií
- Profil pacientů s nádory léčených na pohotovosti referenčního střediska nádorové péče v jižní Brazílii
- Proteiny rezistence a chemorezistence u pacientek s karcinomem ovaria
- Kazuistika: Podpůrná léčba u pacientky s rozsáhlým tumorem ovaria
- Bílé subkapsulární jaterní uzly objevené náhodně během laparoskopické operace: žlučové hamartomy a peribiliární žlázový hamartom
- Paraneoplastický neurologický syndrom u 64letého pacienta s malobuněčným karcinomem plic – kazuistika
- Vzpomínka na MUDr. Vladimíra Spurného, CSc.
- Prof. MUDr. Rostislav Vyzula, CSc., již a teprve šedesátiletý
- Klinický registr CORECT
- Možnosti překonání rezistence k hormonální léčbě u pacientek s hormonálně dependentním metastatickým karcinomem prsu
- Aprepitant a pruritus – komentář k článku
- Informace z České onkologické společnosti
- Klinická onkologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Hodnocení jaterní funkce v onkologické praxi
- Porovnání nákladů u režimů XELOX a FOLFOX-4 v léčbě kolorektálního karcinomu
- Bílé subkapsulární jaterní uzly objevené náhodně během laparoskopické operace: žlučové hamartomy a peribiliární žlázový hamartom
- Kazuistika: Podpůrná léčba u pacientky s rozsáhlým tumorem ovaria
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



