-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Paraneoplastický neurologický syndrom u 64letého pacienta s malobuněčným karcinomem plic – kazuistika
Paraneoplastic Neurological Syndrome in 64-year-old Patient in Association with a Small Cell Lung Carcinoma
Background:
Paraneoplastic neurological syndromes are rare conditions manifest as psychiatric/neurological symptoms. They are caused by autoimmunne cross-reaction leading to destruction of the central nervous system.Case:
We present the case of a 64-year-old patient hospitalized for 6 months at the Department of Psychiatry for persisting depression. During that time he progressed to delirium. A diagnosis of diffuse encephalopathy was made, but further examination revealed a small cell lung cancer with generalisation. A paraneoplastic syndrome was finally diagnosed after autoptic and histologic examination.Conclusion:
Paraneoplastic neurological syndomes can be early signs of malignancy and may considerably precede oncologic diagnosis.Key words:
paraneoplastic syndromes – Hu antigens – small cell lung carcinoma – cross reactions – paraneoplastic eucephalomyelitis
Autoři: Z. Prouzová; S. Brychtová
Působiště autorů: Ústav klinické a molekulární patologie LF UP a FN Olomouc
Vyšlo v časopise: Klin Onkol 2012; 25(6): 471-475
Kategorie: Kazuistiky
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do bi omedicínských časopisů.
Obdrženo: 26. 6. 2012
Přijato: 3. 8. 2012Souhrn
Východiska:
Paraneoplastické neurologické syndromy jsou poměrně raritní poruchy s dominujícími neurologickými či psychiatrickými symptomy, jejichž podstatou bývá autoimunitní zkřížená reakce vedoucí k poškození struktur nervového systému.Případ:
V naší práci prezentujeme případ 64letého muže, který byl hospitalizován na psychiatrické klinice pro půl roku trvající depresivní syndrom s progresí do delirantního stavu s diagnózou difuzní encefalopatie. Teprve následná vyšetření prokázala generalizovaný malobuněčný karcinom plic. Paraneoplastický syndrom s projevy encefalitidy a ložisky demyelinizace byl diagnostikován až po provedení patologicko-anatomické pitvy.Závěr:
Paraneoplastické neurologické syndromy mohou být prvními projevy maligního onemocnění, přičemž mohou předcházet onkologické diagnóze i s větším časovým předstihem.Klíčová slova:
paraneoplastický syndrom – antigeny-Hu – malobuněčný karcinom plic – reakce zkřížené – paraneoplastická ancefalomyelitidaÚvod
Paraneoplastické neurologické syndromy (PNS) jsou poměrně vzácné poruchy nervové soustavy vyskytující se pouze asi u 0,01 % nádorových onemocnění, a klinicky jsou tak často opomíjené. I když tyto syndromy mohou provázet více typů maligních nádorů, jako jsou karcinomy prsu, ovaria a žaludku, jejich typický výskyt bývá spojován s malobuněčným karcinomem plic. Literární údaje se v záchytu četnosti paraneoplastických syndromů značně liší, nejčastěji se hovoří o polovině pacientů s malobuněčným karcinomem plic [1], ale některé práce uvádějí až 92 % pacientů. K nejčastěji zařazeným jednotkám PNS patří paraneoplastická encefalomyelitida a paraneoplastická senzorická neuropatie, dále pak paraneoplastická limbická encefalitida, Lambert-Eatonův myastenický syndrom, cerebelární degenerace, retinopatie a autonomní neuropatie. PNS nejsou vyvolány přímým působením samotných nádorových buněk a/nebo účinkem léčby, ale vznikají na podkladě zkřížené autoimunitní reakce, která následně vede k poškození struktur nervového systému. Klinické projevy jsou různé, nejčastěji jde o váhový úbytek při normálním příjmu potravy, impotenci, senzorické a motorické změny, poruchy paměti a změny chování jako deprese, demence, zmatenost, záchvatovité stavy, halucinace apod. Vznik symptomů je většinou náhlý, s rychlou progresí, postupně během týdnů až měsíců se projevy stabilizují. Symptomy paraneoplastických syndromů se u velké části pacientů dostaví i s větším časovým předstihem před průkazem maligního onemocnění. Vzhledem k rozmanitosti příznaků je definitivní diagnóza často potvrzena až autopticky.
Klinické údaje
V naší kazuistice prezentujeme případ 64letého muže, kuřáka, který byl přijat na psychiatrickou kliniku Vojenské nemocnice Olomouc pro přibližně 6 měsíců trvající depresivní syndrom. Během hospitalizace se objevily náhlé změny psychiky, epizody delirantních stavů s kvalitativní poruchou vědomí a progresí nechutenství. Pacient byl následně přeložen na interní oddělení k došetření somatického podkladu potíží, kde při přijetí progredoval těžký psychomotorický neklid s nutností mechanického omezení a farmakologického tlumení, postupně s přechodem do letargie. Vyšetření CT mozku popisovalo pouze postischemické hypodenzity periventrikulárně, avšak elektroencefalografické vyšetření (EEG) bylo hrubě abnormální, s diagnostickým závěrem svědčícím pro difuzní encefalopatii, neurologická infekce byla klinicky vyloučena. Během hospitalizace byl zjištěn generalizovaný maligní proces s ložisky v plicích, obou nadledvinách a lymfatických uzlinách (subtracheální, mediastinální, jaterní hilové, paraaortální). Provedené bioptické vyšetření prokázalo malobuněčný karcinom plic. Vzhledem k celkovému stavu byla zvolena pouze symptomatická léčba, pacient zemřel 2 týdny po stanovení diagnózy.
Materiál a metody
Bylo provedeno standardní autoptické vyšetření, získaný histologický materiál byl 24 hod fixován v 10% formalínu a zpracován obvyklým postupem se zalitím do parafínu a obarvením řezů hematoxylinem-eozinem. Z mozku bylo odebráno celkem 15 vzorků: 5 z frontálního laloku vpravo, po 2 z temporoparietální oblasti, okcipitálního laloku a hemisfér mozečku, 3 z bazálních ganglií, 1 z parietálního laloku vlevo. Dva vzorky (z frontálního laloku vpravo a bazálních ganglií) byly vyšetřeny použitím speciálních metod: Kongo červeň k vyloučení amyloidózy, Van Gieson elastica pro ozřejmení cévní stěny, metylenová modř na zobrazení množství a distribuce myelinu. Dále bylo u těchto vzorků použito imunohistochemické vyšetření s použitím protilátek CD3, CD4, CD8, CD20 pro bližší diagnostiku lymfocytů, protilátky granzyme B, TIA a CD57 ke stanovení molekul s cytotoxickým a cytolytickým potenciálem a protilátka MBP ke stanovení množství myelinu.
Výsledky
Pitvou a histologickým vyšetřením byl u výrazně kachektického pacienta zjištěn v levé plíci malobuněčný karcinom s primárním ložiskem velikosti 15 × 10 mm, rozsáhle generalizovaný do druhostranné plíce, nadledvin a lymfatických uzlin (subtracheálních, paratracheálních, mediastinálních, jaterních hilových, paraaortálních), které tvořily pakety. Rozsah onemocnění byl stanoven dle TNM na základě UICC (2009) na pT2, N3, M1b. Mozek byl makroskopicky bez patologických změn, vážil 1 350 g, na řezu byl přiměřené konzistence. Mozkové konusy přítomny nebyly. Ostatní orgány vykazovaly pouze obvyklé změny spojené s věkem. Jako bezprostřední příčina úmrtí byla stanovena generalizace nádoru.
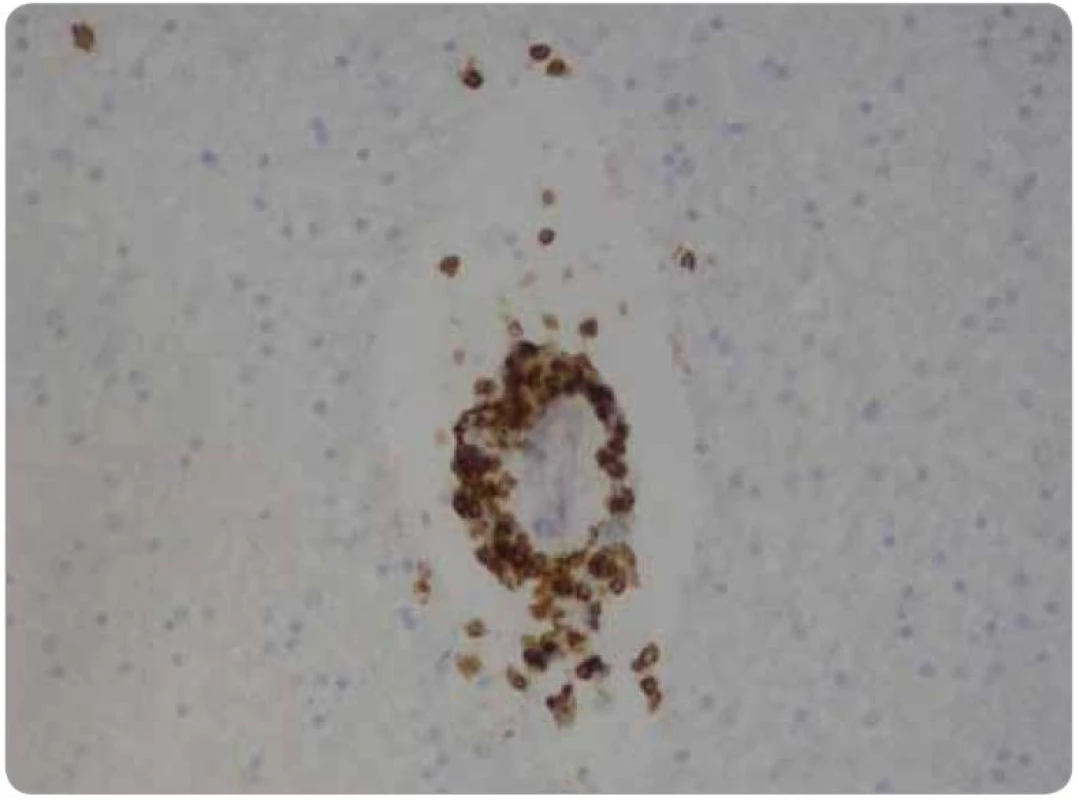
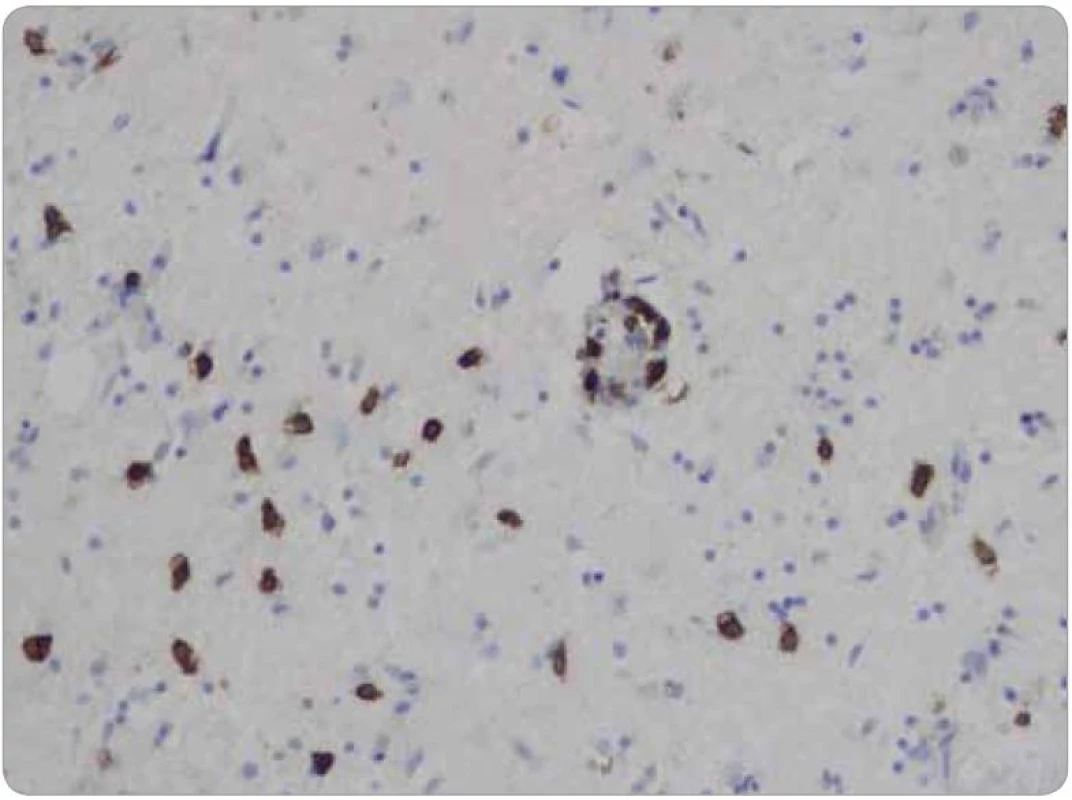
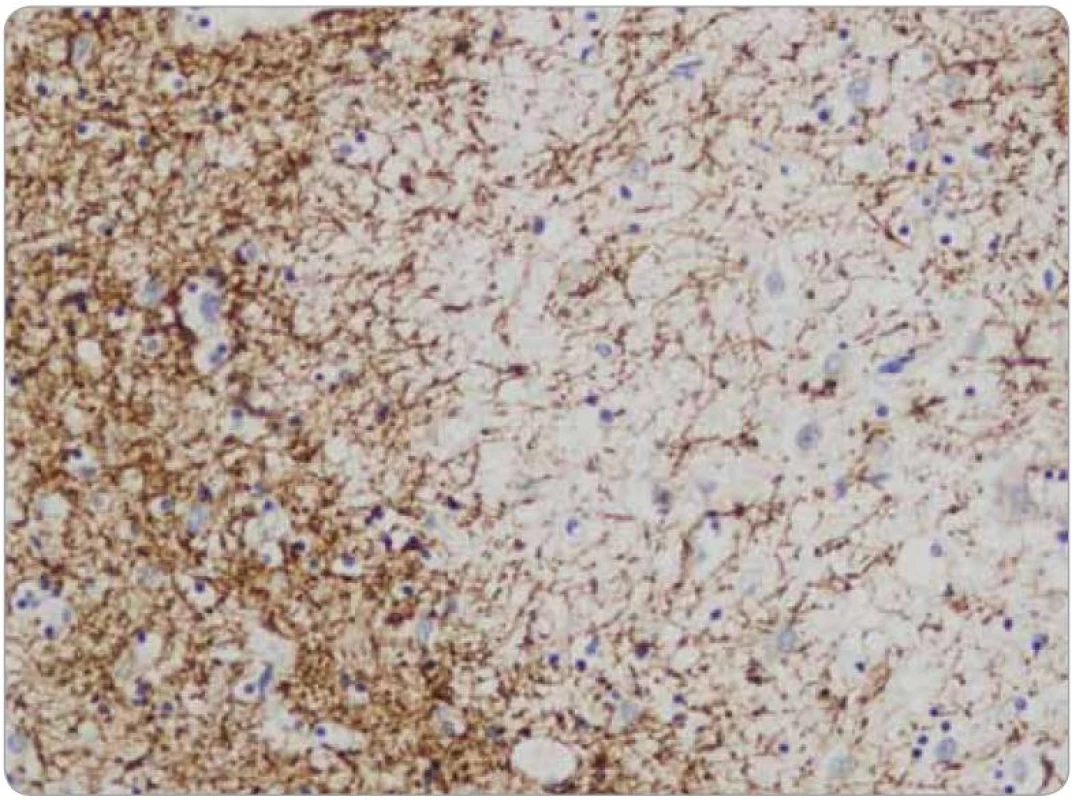
Histologicky tkáň mozku vykazovala ve všech 15 vzorcích fokální pericelulární a perivaskulární projasnění, ložiskově až vzhledu spongiformního edému. Dále byla fokálně patrná glióza bílé hmoty. Ve vzorcích z pravého frontálního laloku a bazálních ganglií byly přítomny perivaskulární shluky lymfocytů (obr. 1), které v imunohistochemickém vyšetření vykazovaly převážně CD3 pozitivitu T lymfocytů (obr. 2), s minimálním množstvím CD20 pozitivních B lymfocytů. Jednotlivé T lymfocytární subtypy, CD8 a CD4 pozitivní buňky byly zastoupeny v poměru 2–3/1. CD8 pozitivní lymfocyty byly zároveň přítomny disperzně v mozkové tkáni (obr. 3). Pozitivita cytotoxických, resp. cytolytických molekul (TIA, granzyme B, CD57), byla fokální. Speciální barvení vzorků dále prokázalo rozsáhlejší, místy splývající okrsky demyelinizace bílé hmoty potvrzené rovněž v imunohistochemii (MBP), viz obr. 4. Nebyla prokázána depozita amyloidu, senilní plaky či klubka (tangles). Cévy vykazovaly mírné aterosklerotické změny. Nález byl uzavřen jako paraneoplastická encefalitida a ložisková demyelinizace.
Obr. 1. Základní barvení hematoxylin-eozin, zvětšení 200×. 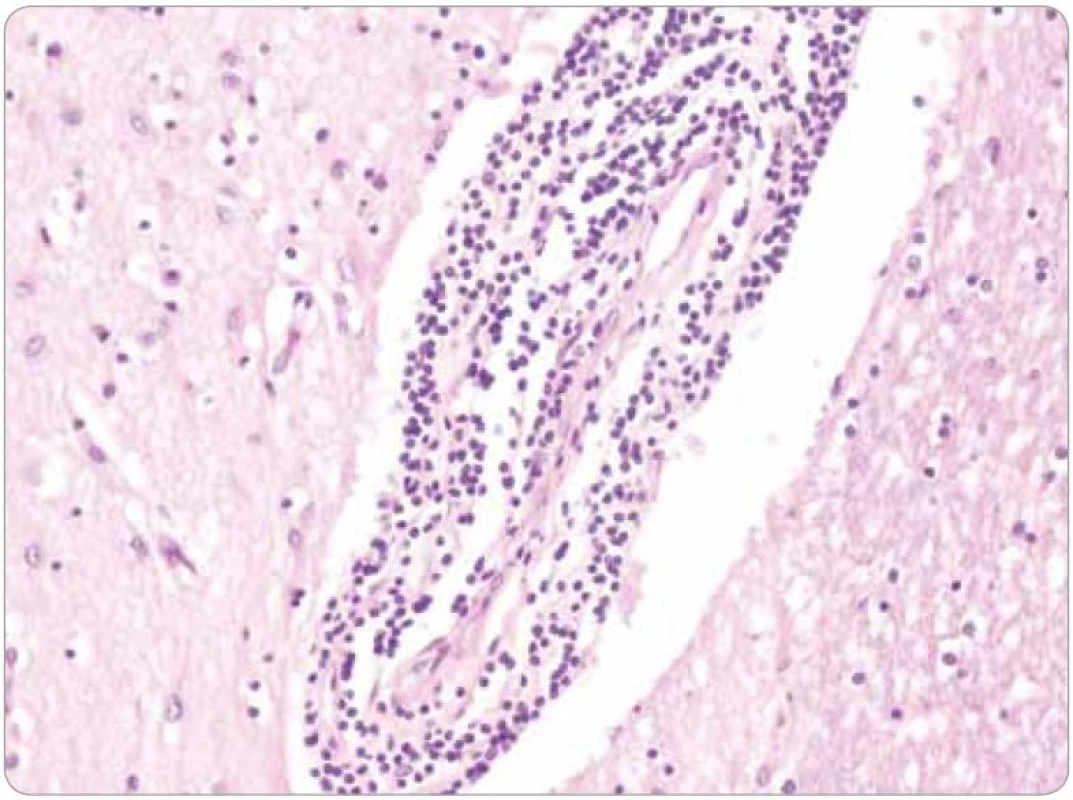
Diskuze
První odborné práce popisující neurologické, resp. psychiatrické změny v souvislosti s maligním nádorem, pocházejí z roku 1948 [2]. O 17 let později již bylo paraneoplastickým syndromům dokonce věnováno celé číslo časopisu Brain, kde Henson poprvé použil termín „s karcinomem asociovaná encefalomyelitida“ a u pacientů s nádorovým onemocněním popsal dysfunkci různých částí nervového systému s autopticky prokázanou zánětlivou infiltrací mozkové tkáně (především v perivaskulárních oblastech) [3]. Výrazný pokrok ve výzkumu PNS s řadou nových poznatků přinesl až rozvoj molekulárně biologických technik; za nejdůležitější se pokládá objev antineuronálních autoprotilátek. Tyto protilátky se vyskytují u pacientů v přímé souvislosti s některými typy tumorů, nejčastěji s malobuněčným karcinomem plic, dále s karcinomy ovaria, prsu, thymomy a některými lymfomy. Na základě objevu autoprotilátek byla formulována hypotéza o autoimunitní podstatě PNS. Předpokládá se, že některé antigeny produkované ve zvýšené míře nádorovými buňkami mají blízkou strukturní příbuznost s fyziologickými antigeny buněk normálních tkání, včetně CNS. Dochází tak k tvorbě autoprotilátek, které se někdy označují také jako onkoneurální autoprotilátky. Tyto se podle lokalizace cílového antigenu dělí do dvou základních skupin [4]. Do I. skupiny patří protilátky reagující s antigeny uloženými intracelulárně, sem patří v literatuře nejvíce diskutované protilátky anti-Hu (ANNA1) asociované s malobuněčným karcinomem plic (SCLC), kterým se budeme věnovat níže. Ve II. skupině najdeme protilátky namířené proti povrchovým antigenům neuronů. Obě skupiny jsou dále rozděleny na podskupiny podle jejich diagnostické hodnoty a souvislosti s CNS syndromy.
Přesná role anti-Hu autoprotilátek ve vzniku PNS není dodnes objasněna, stejně tak jako nejsou vysvětleny probíhající imunitní reakce. Je známo, že tyto protilátky samy o sobě primárně patogenní nejsou a nevedou k přímému poškození neuronů. Předpokládá se, že pravděpodobně představují humorální komponentu komplexní imunitní odpovědi zprostředkovanou CD8 pozitivními lymfocyty. Zkoumá se i vliv exprese MHC molekul I. třídy nádorovými buňkami; je prokázáno, že u karcinomů s paraneoplastickými syndromy bývá exprese těchto molekul častější než u karcinomů bez PNS. MHC molekuly I. třídy se podílejí na prezentaci nádorových antigenů cytotoxickým T lymfocytům, je tedy pravděpodobné, že právě současná exprese těchto molekul spolu s Hu antigeny vyvolává cytotoxickou reakci zprostředkovanou T lymfocyty. Přítomnost těchto specifických lymfocytů byla prokázána v séru, likvoru i postižených oblastech CNS, stejně tak i přítomnost anti-Hu protilátek. Jelikož titr anti-Hu autoprotilátek v mozkomíšním moku bývá výrazně vyšší než v séru, předpokládá se, a některé studie to dokazují, že k jejich syntéze dochází přímo intratékálně [5]. Přítomnost anti-Hu protilátek se pohybuje okolo 85 % PNS, protilátky však byly v 16–25 % detekovány i bez paraneoplastické symptomatiky [6]. Zajímavou otázkou je význam tvorby onkoneurálních protilátek a jejich interakce s antigeny exprimovanými tumorem. Některými klinickými i experimentálními studiemi bylo prokázáno, že imunitní odpověď namířená proti nádorovým antigenům zpomaluje růst nádoru a pacienti s vyššími titry anti-Hu protilátek mají limitovanější stadium nemoci a prokazatelně delší přežití, přičemž není zcela jasné, jak velkou roli zde hraje časnější stanovení diagnózy. Pro histologický obraz mozkové tkáně bývá charakteristická zejména vaskulitida malých cév nebo encefalomyelitida, změny však mohou být co do rozsahu často velice diskrétní; dále je popisovaná destrukce neuronů a pozitivita specifických protilátek v postižených oblastech. Podobně jako v našem případě bývají často přítomna i ložiska demyelinizace bílé hmoty. Podstatě procesu demyelinizace v asociaci s PNS se však žádná studie blíže nevěnuje. Můžeme pouze spekulovat, že se jedná o podobné procesy jako u jiných demyelinizačních onemocnění, jejichž spouštěcí faktory i přes intenzivní výzkum v této oblasti zůstávají nepoznány. Nejčastější teorie se přiklánějí buď k přítomnosti dosud neznámého infekčního agens, nebo ke zkřížené imunitní reakci mezi „tělu vlastními“ a „cizími“ antigeny zvané „molekulární mimikry“. Neznámý spouštěcí faktor vede k indukci řetězce vrozených i získaných imunitních mechanizmů, které mají za následek aktivaci makrofágů, CD8 pozitivních lymfocytů a imunoglobulinů, jejichž výsledkem je poškození a degradace myelinu, případně i oligodendrocytů.
Co se týká diferenciální diagnostiky, pro správnou diagnózu je nutné korelovat histologický nález s klinickými projevy onemocnění a neuropsychiatrickým vyšetřením. Obdobný histologický obraz může být pozorován při encefalitidě jiné etiologie (zejména virové subakutní infekce), dále při demyelinizačních onemocněních (časná fáze roztroušené sklerózy) či onemocněních spadajících pod ADEM (akutní diseminovaná encefalomyelitida), kam patří postinfekční encefalomyelitida, postvakcinační encefalomyelitida a jiné.
Závěr
Prezentovaný případ je ukázkovým příkladem paraneoplastických neurologických projevů, kdy psychiatrické syndromy s výrazným časovým odstupem předcházely diagnóze základního onemocnění a vedly k hospitalizaci k vyloučení zejména Creutzfeldtovy-Jakobovy choroby a Alzheimerovy demence. Definitivní diagnóza PNS byla stanovena až post mortem.
MUDr. Zuzana Prouzová
Ústav klinické a molekulární patologie LF UP a FN Olomouc
Hněvotínská 3
775 15 Olomouc
e-mail: zuzana.prouzova@fnol.cz
Obdrženo: 26. 6. 2012
Přijato: 3. 8. 2012
Zdroje
1. Posner JB. Paraneoplastic syndromes: a brief review. Ann N Y Acad Sci 1997; 835 : 83–90.
2. Denny-Brown D. Primary sensory neuropathy with muscular changes associated with carcinoma. J Neurol Neurosurg Psychiatry 1948; 11(2): 73–87.
3. Henson RA, Hoffman HL, Urich H. Encephalomyelitis with carcinoma. Brain 1965; 88(3): 449–464.
4. Graus F, Saiz A, Dalmau JO. Antibodies and neuronal autoimmune disorders of the CNS. J Neurol 2010; 257(4): 509–517.
5. Dalmau J, Graus F, Cheung NK et al. Major histocompatibility proteins, anti-Hu antibodies, and paraneoplastic encephalomyelitis in neuroblastoma and small cell lung cancer. Cancer 1995; 75(1): 99–109.
6. Kazarian M, Laird-Offringa IA. Small-cell lung cancer-associated autoantibodies: potential applications to cancer diagnosis, early detection, and therapy. Mol Cancer 2011; 10 : 33.
7. Antoine J, Mosnier J, Honnorat J et al. Paraneoplastic demyelinating neuropathy, subacute sensory neuropathy, and anti-Hu antibodies: clinicopathological study of an autory case. Muscle Nerve 1998; 21(7): 850–857.
8. Bernal F, Graus F, Pifarré A et al. Immunohistochemical analysis of anti-Hu-associated paraneoplastic encephalomyelitis. Acta Neuropathol 2002; 103(5): 509–515.
9. Croxford AL, Kurschus FC, Waisman A. Mouse models for multiple sclerosis: histological facts and future implications. Biochim Biophys Acta 2011; 1812(2): 177–183.
10. Dalmau J, Posner JB. Paraneoplastic syndromes. Arch Neurol 1999; 56(4): 405–408.
11. Eggers C, Hagel C, Pfeiffer G. Anti-Hu-associated paraneoplastic sensory neuropathy with peripheral nerve demyelination and microvasculitis. J Neurol Sci 1998; 155(2): 178–181.
12. Fahim A, Butt M, McGivern DV. A case of limbic encephalitis presenting as a paraneoplastic manifestation of limited stage small cell lung cancer: a case report. J Med Case Rep 2010; 4 : 408.
13. Graus F, Keime-Guibert F, Reñe R et al. Anti-Hu-associated paraneoplastic encephalomyelitis: analysis of 200 patients. Brain 2001; 124(Pt 6): 1138–1148.
14. Hiasa Y, Kunishige M, Mitsui T et al. Complicated paraneoplastic neurological syndromes: a report of two patients with small cell or non-small cell lung cancer. Clin Neurol Neurosurg 2003; 106(1): 47–49.
15. Jaster JH. Antibodies to Zic4 in paraneoplastic neurologic disorders and small-cell lung cancer. Neurology 2004; 63(7): 1339.
16. Kodousek R, Tichy T. Pathology of paraneoplastic syndromes. Cesk Patol 2000; 36(3): 116–122.
17. Lassmann H, van Horssen J. The molecular basis of neurodegeneration in multiple sclerosis. FEBS Lett 2011; 585(23): 3715–3723.
18. Love S, Louis DN, Ellison DW. Greenfield’s Neuropathology. 8th ed. London: Edward Arnold 2008 : 1525–1543.
19. McGuigan C, Bigham S, Johnston D et al. Encephalopathy in a patient with previous malignancy but normal brain imaging. Neurology 2005; 65(1): 165.
20. Oh SJ, Gürtekin Y, Dropcho EJ et al. Anti-Hu antibody neuropathy: a clinical, electrophysioloical, and pathological study. Clin Neurophysiol 2005; 116(1): 28–34.
21. Posner JB. Immunology of paraneoplastic syndromes: overview. Ann N Y Acad Sci 2003; 998 : 178–186.
22. Roberts WK, Deluca IJ, Thomas A et al. Patients with lung cancer and paraneoplastic Hu syndrome Harbor HuD-specific type 2 CD8+ T cells. J Clin Invest 2009; 119(7): 2042–2051.
23. Schneider R, Mohebiany AN, Ifergan I et al. B cell-derived IL-15 enhances CD8 T cell cytotoxicity and is increased in multiple sclerosis patients. J Immunol 2011; 187(8): 4119–4128.
24. Tanaka K, Tanaka M, Inuzuka T et al. Cytotoxic T lymfocyte-mediated cell death in paraneoplastic sensory neuronopathy with anti-Hu antibody. J Neurol Sci 1999; 163(2): 156–162.
25. Tofaris GK, Farmer SF. Focal Paraneoplastic Syndrome associated with small cell carcinoma of the lung. J Neurol 2008; 255(1): 123–124.
26. White D, Beringer T. Paraneoplastic limbic encephalitis in an elderly patient with small cell lung carcinoma. Ulster Med J 2010; 79(1): 22–24.
27. Wootla B, Denic A, Keegan B et al. Evidence for the role of B Cells and immunoglobulins in the pathogenesis of multiple sclerosis. Neurol Res Int 2011; 2011 : 780712.
Štítky
Dětská onkologie Chirurgie všeobecná Onkologie
Článek Klinický registr CORECT
Článek vyšel v časopiseKlinická onkologie
Nejčtenější tento týden
2012 Číslo 6- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Nejasný stín na plicích – kazuistika
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
-
Všechny články tohoto čísla
- Klinická onkologie slaví 25. výročí
- Molekulární podstata Waldenströmovy makroglobulinemie
- Prečo sú mitochondrie vhodné ciele pre liečbu rakoviny
- Hodnocení jaterní funkce v onkologické praxi
- EML4-ALK fúzní gen u pacientů s plicním karcinomem: biologie, diagnostika a cílená terapie
- Porovnání nákladů u režimů XELOX a FOLFOX-4 v léčbě kolorektálního karcinomu
- Výsledky léčby mozkových tumorů stereotaktickou radioterapií a radiochirurgií
- Profil pacientů s nádory léčených na pohotovosti referenčního střediska nádorové péče v jižní Brazílii
- Proteiny rezistence a chemorezistence u pacientek s karcinomem ovaria
- Kazuistika: Podpůrná léčba u pacientky s rozsáhlým tumorem ovaria
- Bílé subkapsulární jaterní uzly objevené náhodně během laparoskopické operace: žlučové hamartomy a peribiliární žlázový hamartom
- Paraneoplastický neurologický syndrom u 64letého pacienta s malobuněčným karcinomem plic – kazuistika
- Vzpomínka na MUDr. Vladimíra Spurného, CSc.
- Prof. MUDr. Rostislav Vyzula, CSc., již a teprve šedesátiletý
- Klinický registr CORECT
- Možnosti překonání rezistence k hormonální léčbě u pacientek s hormonálně dependentním metastatickým karcinomem prsu
- Aprepitant a pruritus – komentář k článku
- Informace z České onkologické společnosti
- Klinická onkologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Hodnocení jaterní funkce v onkologické praxi
- Porovnání nákladů u režimů XELOX a FOLFOX-4 v léčbě kolorektálního karcinomu
- Bílé subkapsulární jaterní uzly objevené náhodně během laparoskopické operace: žlučové hamartomy a peribiliární žlázový hamartom
- Kazuistika: Podpůrná léčba u pacientky s rozsáhlým tumorem ovaria
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání