-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Implementace Doporučení pro diagnostiku a léčbu srdečního selhání 2016 do klinické praxe – úloha ivabradinu
Implementation of Guidelines for Diagnosis and Treatment of Heart Failure 2016 in clinical practice – the role of ivabradine
We present two clinical cases documenting an application of the current Guidelines for Diagnosis and Treatment of Heart Failure issued by the European Society of Cardiology. The treatment algorithm recommends gradual use of disease modifying drug with dose titration to maximal tolerated doses. These drugs include angiotensin converting enzyme inhibitors or angiotensin receptor blockers, betablockers, mineralocorticoid antagonists, which are used together with diuretics to eliminate the symptoms of congestion. In case of persisting symptoms, ivabradin is one of possible further steps.
Keywords:
heart failure with reduced ejection fraction – ivabradine
Autoři: F. Málek
Působiště autorů: Kardiocentrum, Nemocnice Na Homolce, Praha
Vyšlo v časopise: Kardiol Rev Int Med 2017, 19(2): 123-127
Souhrn
Uvádíme dva příklady z klinické praxe, které dokumentují možnost využití aktuálních Doporučení pro diagnostiku a léčbu srdečního selhání Evropské kardiologické společnosti 2016. Algoritmus léčby doporučuje stupňovité podávání léků, které modifikují průběh onemocnění s titrací dávek do maximálních tolerovaných. Jedná se o inhibitory enzymu konvertujícího angiotenzin, případně blokátory receptoru angiotenzinu, betablokátory a antagonisty mineralokortikoidních receptorů, které jsou podávány souběžně s diuretiky k odstranění symptomů kongesce. Při přetrvávající symptomatologii je dalším možným krokem přidání ivabradinu.
Klíčová slova:
srdeční selhání se sníženou ejekční frakcí – ivabradinÚvod
Klasifikace Doporučení pro diagnostiku a léčbu srdečního selhání (SS) Evropské kardiologické společnosti 2016 (dále jen Doporučení ESC 2016) rozlišuje SS se sníženou ejekční frakcí(EF LK < 40 %) (heart failure with preserved ejection fraction – HFrEF), s mírně sníženou ejekční frakcí s EF LK 40 – 49 % (heart failure with mildly reduced ejection fraction – HFmrEF) a SS se zachovalou ejekční frakcí (EF LK > 50 %) (heart failure with preserved ejection fraction – HFpEF) [1].
Léčba SS je vždy komplexní a zohledňuje příčinu srdeční dysfunkce. Léčba zahrnuje dietní a režimová opatření, farmakoterapii, přístrojovou nechirurgickou léčbu a chirurgickou léčbu vč. implantace mechanické srdeční podpory a transplantace srdce.
Základem je vždy léčba farmakologická. V případě HFrEF je farmakoterapie společná bez ohledu na etiologii. Farmakoterapie vychází z vědeckých důkazů, které prokázaly v placebem kontrolovaných studiích snížení mortality a morbidity.
Základem farmakoterapie HFrEF jsou betablokátory, inhibitory renin-angiotenzinového systému (RAAS) a antagonisté mineralokortikoidních receptorů (MRA), které příznivě ovlivňují morbiditu a mortalitu pacientů s chronickým SS (CHSS). Jak uvádějí Doporučení ESC 2016, v případě pokračujících symptomů je u pacientů s HFrEF a zvýšenou tepovou frekvencí se sinusovým rytmem doporučeno zahájit léčbu ivabradinem (obr. 1). Ivabradin je selektivní inhibitor If kanálu v sinusovém uzlu, tím zpomaluje srdeční frekvenci.
Obr. 1. Algoritmus léčby HFrEF. 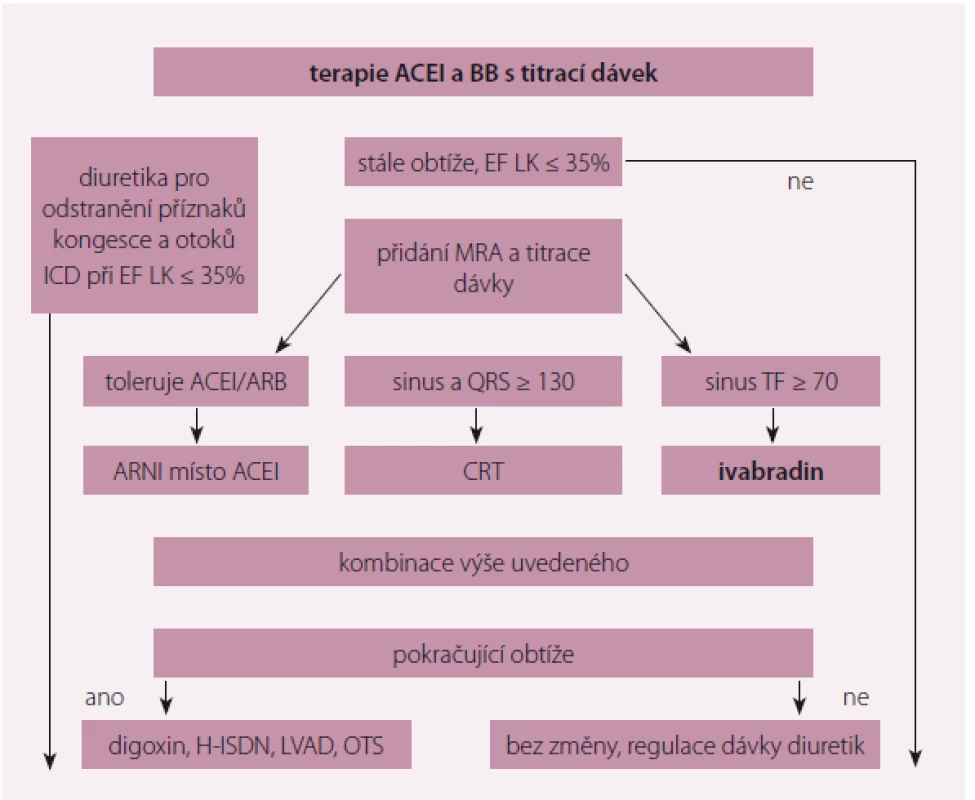
HFrEF – srdeční selhání se sníženou ejekční frakcí, ACEI – inhibitor angiotenzin-konvertujícího enzymu, BB – betablokátory, MRA – antagonista mineralokortikoidních receptorů, EF – ejekční frakce, ARNI – inhibitor neutrální endopeptidázy neprilysinu, QRS komplex – stah komorové svaloviny srdce, SF – srdeční frekvence, CRT – srdeční resynchronizační léčba, LVAD – levostranná srdeční podpora, ICD – implantabilní kardioverter-defibrilátor, VT/VF – arytmie Studie SHIFT byla randomizovaná, placebem kontrolovaná studie, která prokázala pozitivní vliv ivabradinu na přežívání a morbiditu pacientů s CHSS. Do studie bylo zařazeno 6 558 pacientů s EF LK ≤ 35 % se sinusovým rytmem a tepovou frekvencí ≥ 70/ min a alespoň jednou hospitalizací pro SS v posledním roce. Léčba ivabradinem byla u pacientů se systolickým CHSS a sinusovým rytmem spojena s poklesem tepové frekvence a snížením rizika kombinovaného výsledku úmrtí z kardiovaskulárních (KV) příčin a rizika hospitalizace pro SS (HR 0,82; p < 0,0001) [2].
Na základě výsledků studie SHIFT se ivabradin dostal do elitní skupiny léků, které u pacientů s HFrEF modifikují průběh onemocnění (tab. 1).
Tab. 1. Léky modifikující průběh onemocnění u HFrEF. 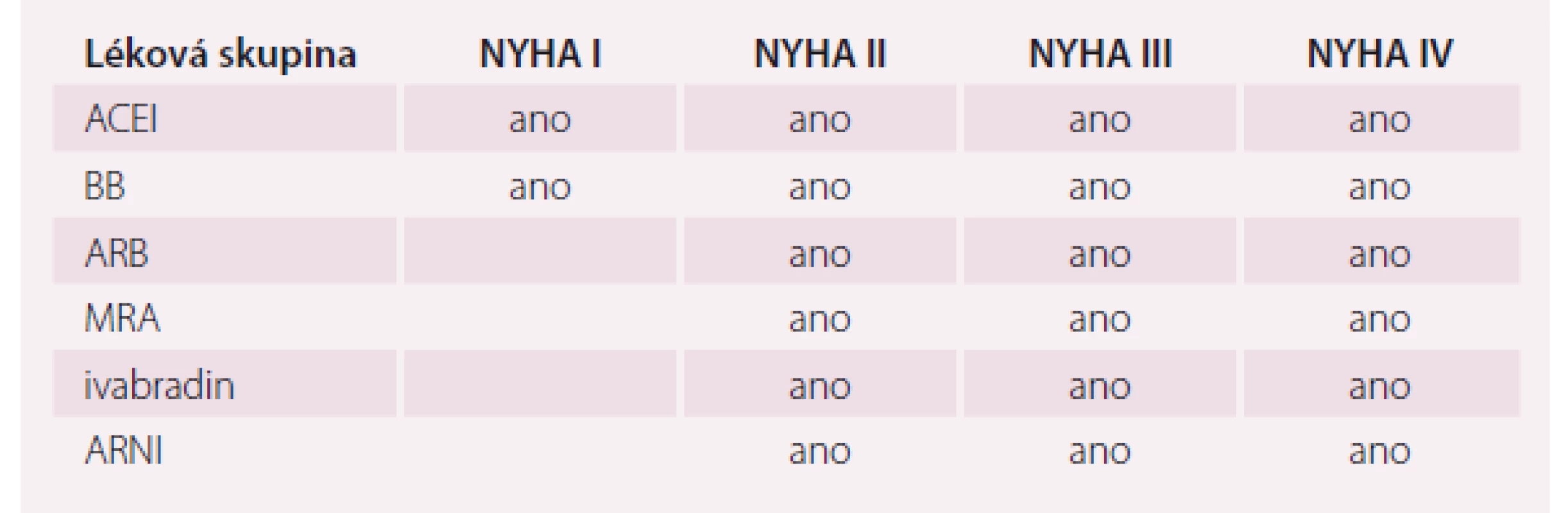
HFrEF – srdeční selhaní se sníženou ejekční frakcí, ARB – antagonisté AT1 receptrou angiotenzinu II, BB – betablokátory, ACEI – inhibitor angiotenzin-konvertujícího enzymu, MRA – antagonista mineralokortikoidních receptorů, ARNI – inhibitor neutralní endopeptidázy neprilysinu Podívejme se na možnost využití efektu ivabradinu ve dvou případech z klinické praxe.
Kazuistika 1
Pacient (56 let) se SS neischemické etiologie, narozený v roce 1961, byl do ledna 2013 bez zásadních zdravotních obtíží. Je pravdou, že tento pacient nechodil pravidelně k lékaři a poslední preventivní zdravotní prohlídku absolvoval 5 let před vznikem náhlého onemocnění. V lednu 2013 se u něj objevila z plného zdraví velmi rychle námahová a později i klidová a noční dušnost. Pacient byl hospitalizován na interním oddělení k objasnění příčiny dušnosti. Velmi rychle bylo na základě fyzikálního vyšetření a RTG hrudníku vysloveno podezření na SS, doplněná echokardiografie zjistila dilatace všech srdečních oddílů a dysfunkci LK s EF 25 %, pacient byl odeslán ke koronarografii s normálním nálezem na koronárních tepnách. Během hospitalizace byl dále zjištěn diabetes mellitus již komplikovaný polyneuropatií dolních končetin, snížená funkce ledvin, hyperurikemie a syndrom obstrukční spánkové apnoe (OSA).
Pacient byl odeslán na naše pracoviště s pracovní diagnózou dilatační kardiomyopatie. U nás provedená nukleární magnetická rezonance diagnózu potvrdila vyloučením myokarditidy.
U nemocného byla již během první hospitalizace zahájena farmakoterapie SS zahrnující karvedilol, ramipril, spironolakton a furosemid. Současně byl pacient léčen inzulinoterapií a alopurinolem. Dávka karvedilolu a ramiprilu byla zvýšena podle tolerance, pro rozvoj gynekomastie po spironolaktonu byla tato léčba změněna na eplerenon.
Při první kontrole v naší ambulanci udával pacient limitující obtíže, dušnost při jakékoli aktivitě odpovídající třídě NYHA III, TK 105/ 64, TF 84/ min při sinusovém rytmu, fyzikálně bez známek kongesce, BMI 33,8 kg/ m2, koncentrace kreatininu byla 165 µmol/ l, odhad glomerulární filtrace 40 ml/ min. Koncentrace NT-proBNP byla při první ambulantní kontrole 240 pmol/ l (2 000 pg/ ml). Byla provedena spiroergometrie s prognosticky příznivým výsledkem: maximální spotřeba kyslíku VO2max byla 19 ml/ kg/ min. Farmakoterapie zahrnovala léky modifikující průběh SS, inzulinoterapii, alopurinol a atorvastatin. Pacient toleroval maximální dávku karvedilolu 2 × 25 mg denně, vyšší dávka byla spojena s rozvojem symptomatické hypotenze. Tepová frekvence byla v klidu 84/ min při sinusovém rytmu (obr. 2).
Obr. 2. Kazuistika 1 – karvedilol 2 × 25 mg, kontrola 2. 4. 2016. 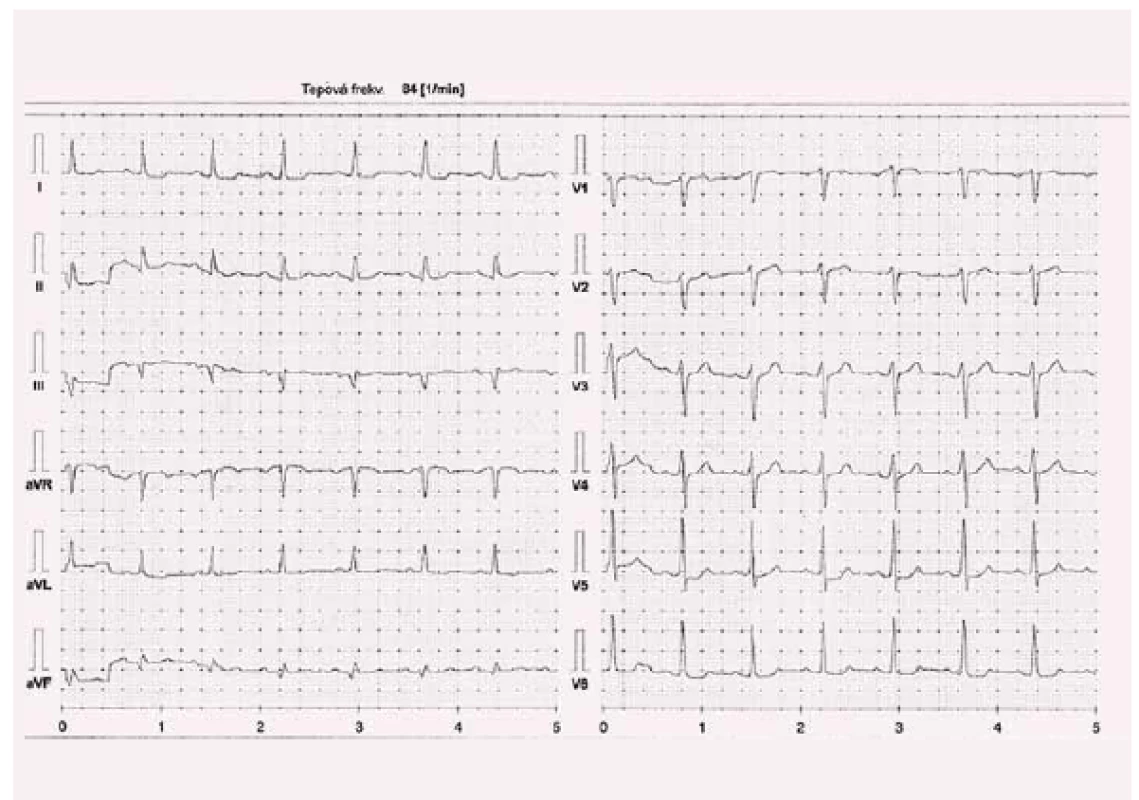
Na základě Doporučení ESC 2016 jsme se rozhodli zahájit terapii ivabradinem s úvodní dávkou 5 mg 2× denně a zvýšením dávky na 7,5 mg 2× denně. Přidání ivabradinu bylo spojeno s poklesem tepové frekvence na 57/ min v klidu (obr. 3). Kromě toho udával pacient postupné symptomatické zlepšení, jeho obtíže se začaly objevovat až při větší fyzické zátěži, chůzi do kopce nebo do schodů. Efekt terapie jsme ověřili vyšetřením NT-proBNP, kde došlo k poklesu na hodnotu 70 pmol/ l (600 pg/ ml), a provedením kontrolní spiroergometrie, kde došlo ke zvýšení maximální spotřeby kyslíku VO2max na 24 ml/ kg/ min.
Obr. 3. Kazuistika 1 – Procoralan 2 × 7,5 mg, kontrola 21. 3. 2017. 
Kazuistika 2
Pacient (70 let) se SS a ischemickou chorobou srdeční, narozený v roce 1947, bývalý kuřák s bohatou anamnézou vaskulárních komplikací, byl na naše pracoviště odeslán pro pokročilé symptomy SS. Jeho anamnéza zahrnovala absolvování čtyřnásobného aortokoronárního bypassu v roce 2004 a HFrEF s dlouhodobou symptomatologií ve funkční třídě NYHA II (tab. 2). V roce 2010 podstoupil pacient implantaci ICD (defibrilátoru) v primární prevenci náhlé srdeční smrti. Pro progresi symptomů v roce 2015 do NYHA III a nově i vzniku anginy pectoris byla u nemocného indikována rekoronarografie. Toto vyšetření prokázalo funkční bypass na RIA, RMS, ACD a nevýznamné zúžení sekvenčního bypassu na RIM, byl tedy doporučen konzervativní postup s posílením farmakoterapie. Chronická medikace pacienta zahrnovala nižší dávku karvedilolu, jakýkoli pokus o zvýšení dávky byl spojen s rozvojem symptomatické hypotenze. Pacient byl dlouhodobě léčen fixní kombinací perindopril/ amlodipin, která byla vzhledem k přítomnosti ischemické choroby s anginou pectoris a SS ponechána. Již dříve byl pokus o vynechání amlodipinu z kombinace spojen se zhoršením anginózních obtíží. Léčba byla proto po katetrizačním vyšetření doplněna o izosorbiddinitrát v úvodní dávce 2 × 20 mg se zvýšením na 2 × 40 mg (tab. 3). Tato terapie vedla k omezení příznaků anginy pectoris, nicméně pokročilé symptomy SS přetrvávaly.
Tab. 2. Anamnéza pacienta s CHSS a ICHS. 
CHSS – chronické srdeční selhání, ICHS – ischemickáý choroba srdeční, CABG – aortokoronární bypass, RIA – ramus interventricularis anterior, LIMA – arteria mammaria l. sin, RIM – ramus intermedius, RMS – ramus marginalis, ACD – arteria coronaria dextra, EF LK – ejekční frakce levé komory, EAE – endarterektomie, ACI – arteria carotis interna, CMP – cévní mozková příhoda, TIA – transitorní ischemická ataka Tab. 3. Kazuistika 2, pacient ročník 1947. Farmakoterapie. 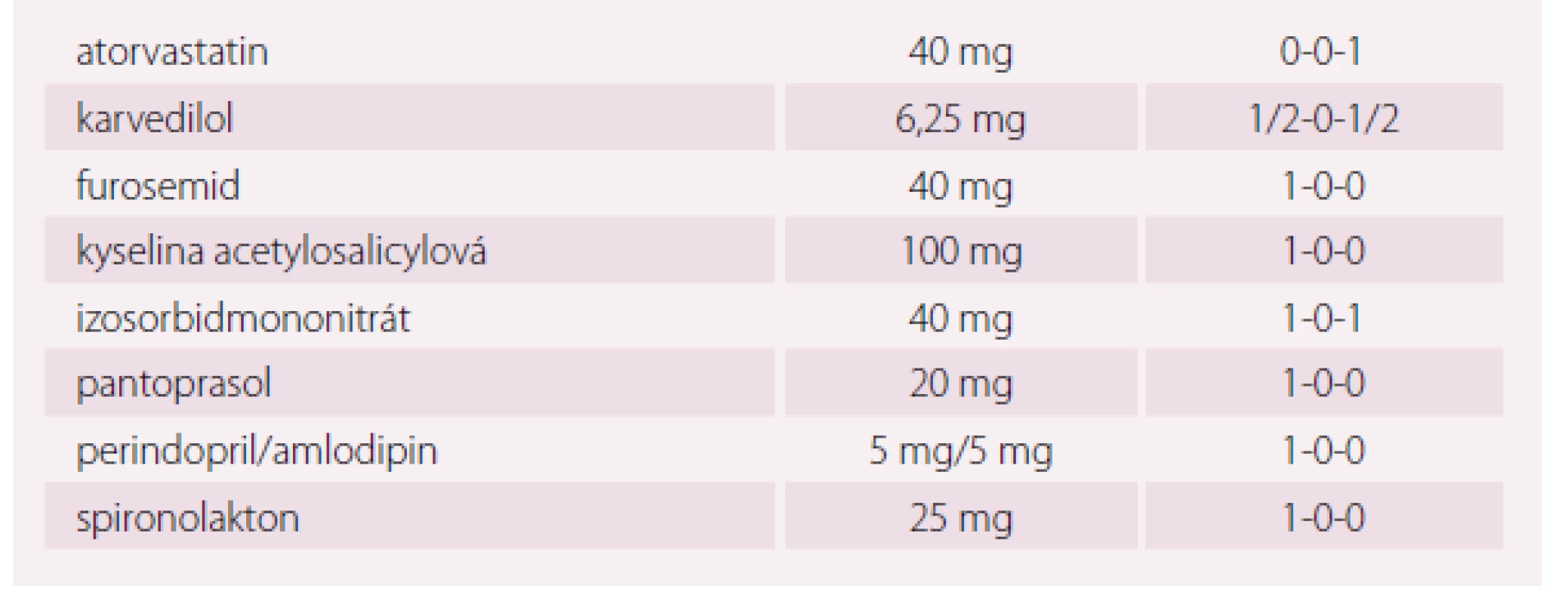
Při první ambulantní kontrole po rekoronarografii pacient udával dušnost, únavnost při jakékoli i běžné denní činnosti a nízkou toleranci zátěže, neměl klidové obtíže, typická bolest na hrudi se objevovala sporadicky ráno, zejména v chladném počasí, ale již bez nutnosti aplikace nitroglycerinu sublinguálně. V objektivním nálezu nebyly známky kongesce, krevní tlak byl 113/ 71, tepová frekvence 78/ min, BMI 23,88 kg/ m2. Klidová tepová frekvence byla 78/ min, vyšší dávka betablokátoru nebyla tolerována (obr. 4). Koncentrace NT-proBNP byla 144 pmol/ l (1 200 pg/ ml). U pacienta jsme při plné medikaci provedli zátěžové testy: šestiminutový test chůze s dosaženou vzdáleností 440 m a spiroergometrii s prognosticky příznivým výsledkem VO2max 19,5 ml/ kg/ min s dosažením respiračního poměru RER 1,05.
Obr. 4. Kazuistika 2 – při dávce karvedilolu 2 × 3,125 mg, kontrola 19. 11. 2016. 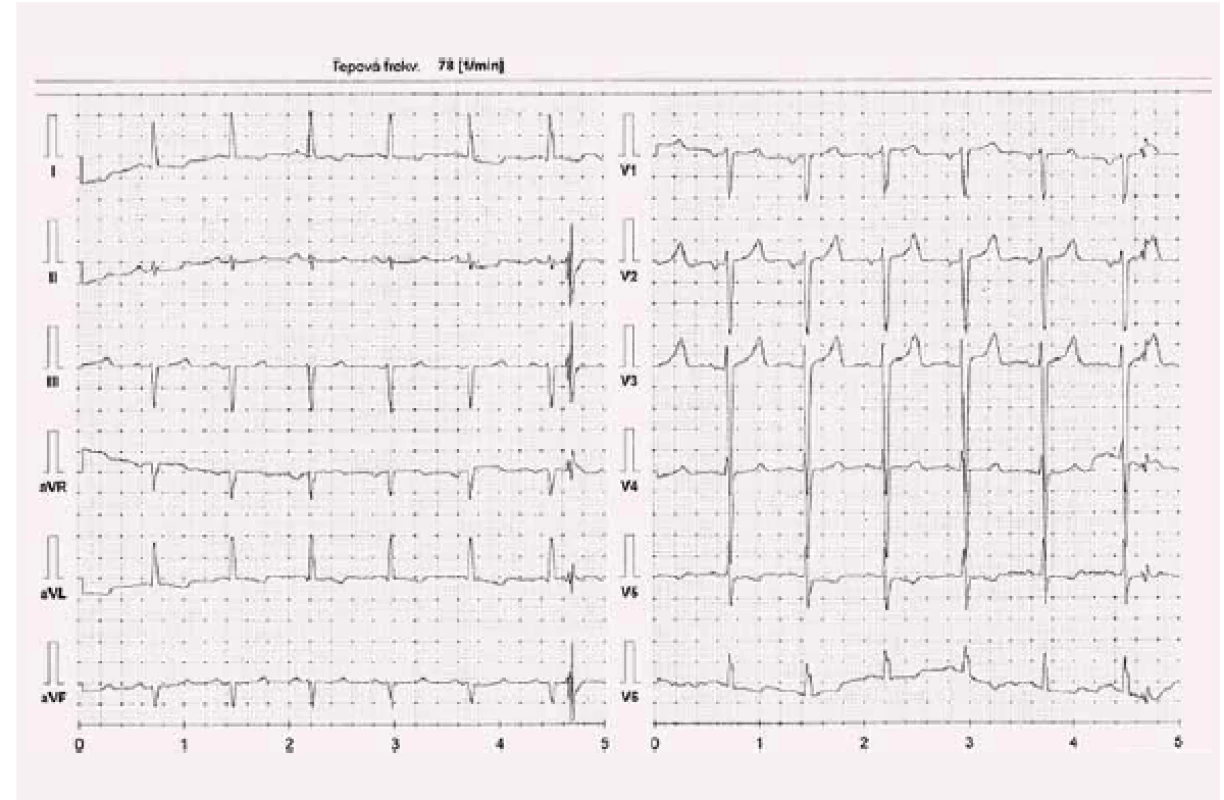
Vzhledem k pokročilým limitujícím symptomům jsme do terapie doplnili ivabradin ve vzestupné dávce od 2 × 5 mg do 2 × 7,5 mg. Tato terapie byla spojena s poklesem tepové frekvence (obr. 5) a se symptomatickým zlepšením o jednu třídu do NYHA II. Efekt jsme ověřili zátěžovým testem se vzestupem VO2max na 22 ml/ kg/ min a poklesem koncentrace NT-proBNP na 81 pmol/ l (680 pg/ ml).
Obr. 5. Kazuistika 2 – Procoralan 7,5 mg 1-0-1, kontrola 22. 3. 2017. 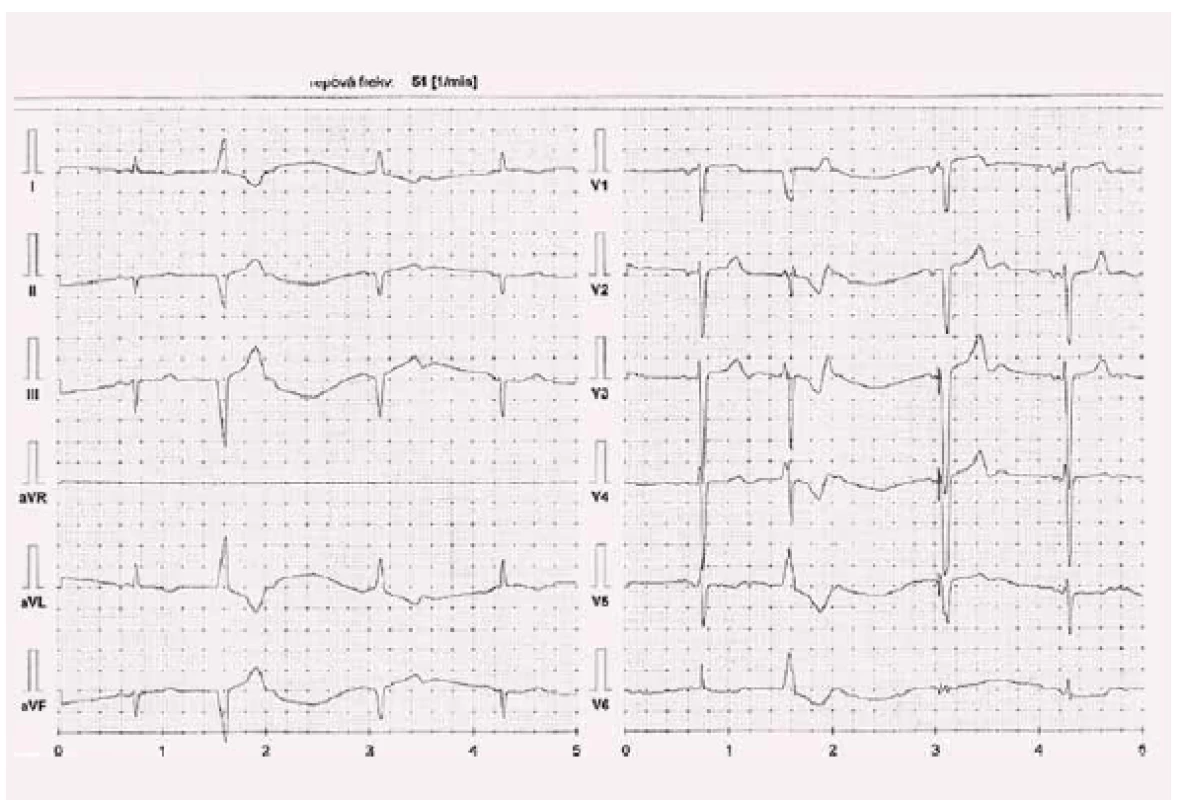
Diskuze
Příklady ze současné klinické praxe ukazují možnost využití algoritmu farmakologické léčby HFrEF podle Doporučení ESC 2016. Naše kazuistiky ukazují možnost využití příznivých účinků ivabradinu u pacientů se SS jak neischemické, tak ischemické etiologie srdeční dysfunkce. I přes prognosticky příznivý výsledek zátěžového testu – spiroergometrie bylo v obou případech přidání ivabradinu do farmakoterapie spojeno nejen s poklesem tepové frekvence, ale i se zlepšením symptomů a zvýšením tolerance zátěže s dalším vzestupem VO2max a s poklesem koncentrace NT-proBNP.
Poznatky o příznivém efektu ivabradinu vycházejí z výsledků studie SHIFT. Léčba ivabradinem byla u pacientů se systolickým CHSS a sinusovým rytmem spojena s poklesem tepové frekvence a snížením rizika kombinovaného výsledku úmrtí z KV příčin a rizika hospitalizace pro SS. Největší dopad měl ivabradin na snížení rizika hospitalizace pro zhoršení SS (HR 0,74; p < 0,0001) a úmrtí na SS (HR 0,74; p = 0,014) [3].
Léčba ivabradinem byla ve studii SHIFT a dalších klinických studiích dobře tolerována [4].
Máme další důkazy pro to, že jak terapie ivabradinem, tak kombinační léčba ivabradinu s betablokátorem je u pacientů s CHSS a optimalizovanou farmakoterapií dobře tolerována a je spojena se zlepšením tolerance zátěže a kvality života [5].
Závěr
Vždy musíme myslet na možnost přidání ivabradinu do farmakologické léčby pacientů s HFrEF levé komory. Máme dostatek důkazů pro to, že přidání ivabradinu do terapie je spojeno se snížením rizika úmrtí, hospitalizace pro SS, se zlepšením symptomů a zvýšením tolerance zátěže. K použití ivabradinu nám může velmi dobře posloužit algoritmus léčby HFrEF podle Doporučení ESC 2016.
Podpořeno MZ ČR – RVO (Nemocnice Na Homolce – NNH, 00023884), IG160502.
Doručeno do redakce: 10. 5. 2017
Přijato po recenzi: 20. 5. 2017
doc. MUDr. Filip Málek, Ph.D., MBA
www.homolka.cz
filip.malek@homolka.cz
Zdroje
1. Špinar J, Hradec J, Špinarová L et al. Souhrn doporučených postupů ESC pro diagnostiku a léčbu akutního a chronického srdečního selhání z roku 2016. Cor Vasa 2016; 58(5): e530 – e568.
2. Swedberg K, Komajda M, Bohm M et al. Ivabradin and outcomes in chronic heart failure (SHIFT): a randomised placebo – controlled trial. Lancet 2010; 376(9744): 875 – 885. doi: 10.1016/ S0140-6736(10)61198-1.
3. Borer JS, Böhm M, Ford I et al. Effect of ivabradine on recurrent hospitalization for worsening heart failure in patients with chronic systolic heart silure: the SHIFT Study. Eur Heart J 2012; 33(2): 2813 – 2820. doi: 10.1093/ eurheartj/ ehs259.
4. Tavazzi L, Swedberg K, Komajda M et al. Efficacy and safety of ivabradine in chronic heart failure across the age spectrum: Insights from the SHIFT study. Eur J Heart Fail 2013; 15(11): 1296 – 1303. doi: 10.1093/ eurjhf/ hft102.
5. Volterrani M, Cice G, Caminiti G et al. Effect of Carvedilol, Ivabradine or their combination on exercise capacity in patients with Heart Failure (the CARVIVA HF trial). Int J Cardiol 2011; 151(2): 218 – 224. doi: 10.1016/ j.ijcard.2011.06.098.
Štítky
Dětská kardiologie Interní lékařství Kardiochirurgie Kardiologie
Článek Léčba hypertenze ve stáříČlánek Endokrinní hypertenzeČlánek Hypertenze v klinické praxiČlánek Hypertenze a srdeční selhání
Článek vyšel v časopiseKardiologická revue – Interní medicína
Nejčtenější tento týden
2017 Číslo 2- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Léčba hypertenze ve stáří
- Kontrola krevního tlaku v primární a sekundární prevenci cévní mozkové příhody
- Endokrinní hypertenze
- Vztah mezi krevním tlakem a bolestí – co už víme?
- Vybrané poznámky ke studii FOURIER
- Implementace Doporučení pro diagnostiku a léčbu srdečního selhání 2016 do klinické praxe – úloha ivabradinu
- Farmakologická léčba srdečního selhání se zachovalou ejekční frakcí
- Elektrokardiogram a kardiostimulace
-
Intervence kardiovaskulárního rizika –
proč vítězíme a selháváme? - Hypertenze v klinické praxi
- Jaké jsou cílové hodnoty krevního tlaku u srdečního selhání?
- Nové fixní kombinace antihypertenziv
- Hypertenze a srdeční selhání
- Hypertenze a ischemická choroba srdeční – dva nebezpeční sourozenci
- Kardiologická revue – Interní medicína
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Jaké jsou cílové hodnoty krevního tlaku u srdečního selhání?
- Nové fixní kombinace antihypertenziv
- Elektrokardiogram a kardiostimulace
- Farmakologická léčba srdečního selhání se zachovalou ejekční frakcí
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



