-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Evropský konsenzus k otázkám aterogenní dyslipidemie a kombinační léčbě statinem a fibrátem
European consensus in questions about atherogenic dyslipidemia and combination of statine and obrate
Atherogenic dyslipidemia (AD), characterized by increased triglycerides in the context of the reduction in HDL-cholesterol (HDL-c), has been in the center of our attention for quite some time. Epidemiological trends, new knowledge about the importance of AD as well as the possibilities of its management led to the formulation of a consensus of European experts on this issue. AD regularly accompanies conditions associated with insulin resistance. Non-HDL-cholesterol and apolipoprotein B concentrations appear to be suitable markers of cardiovascular risk in patients with AD and, also, therapeutic targets. The question of remnant lipoproteins and their role in determining cardiovascular risk, especially in patients with AD, has gained special attention. Treatment is based on a rigorous diet and lifestyle modification. Pharmacological therapy is based on statins. In patients with hypertriglyceridemia and persistent unsatisfactory control of non-HDL-C a combination with fenofibrate should be considered. In this situation this combination further reduces the risk of macrovascular and microvascular complications.
Keywords:
consensus – atherogenic dyslipidemia – non-HDL cholesterol – remnant lipoproteins – statins – fenofibrate
Autoři: M. Vráblík
Působiště autorů: Centrum preventivní kardiologie, III. interní klinika 1. LF UK a VFN v Praze
Vyšlo v časopise: Kardiol Rev Int Med 2016, 18(1): 61-66
Kategorie: Kardiologická revue
Souhrn
Aterogenní dyslipidemii (AD), která je charakterizována jako zvýšení hladin triglyceridů v kontextu snížení koncentrací HDL cholesterolu (HDL-c), je věnována pozornost delší dobu. Epidemiologický vývoj, nové poznatky o významu AD i o možnostech jejího ovlivnění vedla k formulaci konsenzu evropských expertů k této otázce. AD pravidelně provází stavy spojené s inzulinovou rezistencí. Jako vhodný marker kardiovaskulárního rizika u nemocných s AD i léčebný cíl se jeví nonHDL cholesterol či koncentrace apolipoproteinu B. Zvláštní pozornost tak získává v poslední době otázka remnantních lipoproteinů a jejich význam pro určení kardiovaskulárního rizika zejména u pacientů s AD. Léčba je založena na důsledné úpravě diety a režimu. Farmakologická terapie je založena na statinech. U pacientů s trvající hypertriglyceridemií a neuspokojivou kontrolou nonHDL-c by měla být zvážena kombinace s fenofibrátem. Ten v této situaci přináší další snížení rizika makrovaskulárních i mikrovaskulárních komplikací.
Klíčová slova:
konsenzus – aterogenní dyslipidemie – nonHDL cholesterol – remnantní lipoproteiny – statiny – fenofibrátCo je aterogenní dyslipidemie?
Pojem aterogenní dyslipidemie (DLP) možná není zcela šťastný – používá se pro jasně definovanou poruchu metabolizmu plazmatických lipoproteinů a naznačuje, že ostatní DLP nejsou aterogenní. Na druhé straně se široce vžil a dostal se i do použití v praktické medicíně. Pojmem aterogenní DLP rozumíme komplexní kvalitativně kvantitativní změnu metabolizmu charakterizovanou odlišnou kvalitou i kvantitou sérových lipoproteinů. Ta se rozvíjí spolu s inzulinovou rezistencí a prohlubuje se spolu se snižováním inzulinové senzitivity a nárůstem inzulinové deficience. Z hlediska metabolizmu lipoproteinových částic se jako nejvýznamnější jeví porušení správné funkce inzulinu na úrovni jaterní buňky a enterocytu, tedy v místech rozhodujících o vzniku a degradaci lipoproteinových částic. Kromě těchto dvou hlavních tkáňových úrovní se na negativním vývoji lipidového metabolizmu podílí změny ve svalové a tukové tkáni. Kvalitativní změny lipoproteinů jsou dnes považovány za stejně důležité (ne-li důležitější) jako změny koncentrací jednotlivých lipidových součástí krevní plazmy [1]. O významu DLP nepřímo svědčí i fakt, že ve všech v současnosti používaných definicích metabolického syndromu najdeme dvě „lipidová“ kritéria – zvýšení triglyceridů (TG) a pokles koncentrací HDL cholesterolu (HDL-c) [2,3]. Narušení metabolické přeměny lipoproteinů hraje velmi důležitou roli při vzniku a udržování inzulinové rezistence a představuje jeden z hlavních mechanizmů vzniku cévních komplikací inzulinové rezistence/ diabetu 2. typu
Proč se věnovat aterogenní dyslipidemii?
V roce 2015 byl publikován přehledný závěr formulovaný skupinou evropských expertů věnovaný aktuálním poznatkům o významu a léčbě aterogenní DLP [4]. Zdá se tedy, že tato otázka nepřestává být aktuální, ačkoli se o ní diskutuje již řadu let, a ani komentovaná léčba nepatří mezi „začátečníky“. Přesto najdeme důvodů hned několik.
První dobrý důvod naznačí pohled do zdravotnických statistik. Počet osob s inzulinovou rezistencí stoupá, stejně jako přibývá diabetiků 2. typu. Prevalence diabetes mellitus dosahuje v Česku už téměř 9 % a bohužel musíme počítat s dalším zvyšováním tohoto čísla [5].
Další důvod hledejme ve výsledcích posledních výzkumů. Aterogenní DLP charakterizuje zmnožení remnantních lipoproteinů a na triglyceridy (TG) bohatých částic (viz níže). Ty mohou být zásadním dodavatelem cholesterolu pro vznik a růst aterosklerotické cévní léze, dokonce ještě důležitějším než samotné částice LDL. Rizikovost zmnožení remnantních lipoproteinů demonstrovali v poslední době např. dánští výzkumníci. Zpracování dat z obrovských kodaňských studií ukázalo, že vzestup hodnot koncentrací cholesterolu neseného remnantními částicemi predikuje nejen koronární a kardiovaskulární (KV), ale dokonce i celkovou mortalitu [6].
Třetím dobrým důvodem pro vznik konsenzu k danému tématu je fakt, že nám stále chybí jednoznačná a silná dokumentace postavení kombinační hypolipidemické léčby statin + fibrát v algoritmu léčby. Provedené studie vesměs trpěly nedokonalostmi designu a přinesly výsledky, které musíme dobře sledovat a interpretovat, protože při letmém pohledu ztrácíme důležitou část výpovědní hodnoty.
Poznámky k patogenezi aterogenní DLP
Dyslipidemie v kontextu inzulinové rezistence vzniká na základě genetického základu. Ten se nachází v blízkosti genetické podstaty samotné inzulinové rezistence a dědí se nejčastěji společně. Kromě vlivů zevního prostředí tedy počítejme při hodnocení individuálního lipoproteinového fenotypu s genetickými faktory (těžší postižení mají nositelé několika genetických odchylek v jedné metabolické cestě).
Výzkum genetické predispozice je obtížný, protože již dnes známe více než 100 genů, jejichž varianty jsou spojeny s poklesem inzulinové senzitivity a vznikem metabolického syndromu [7]. Centrální úlohu v patogenezi aterogenní DLP hrají buňky jaterní a buňky kartáčového lemu enterocytu. Zvýšená koncentrace volných mastných kyselin v portální krvi je signálem (i substrátem) pro zvýšení produkce na TG bohatých lipoproteinových částic VLDL v hepatocytu. Ty dávají následně kaskádou reakcí v krevním proudu vzniknout malým denzním LDL s výrazně větším aterogenním potenciálem. Částice HDL se intravaskulárně působením cholesterol-ester-transferázového proteinu (CETP) zmenšují a jsou z cirkulace odstraňovány ledvinami. Koncentrace HDL-c se snižuje [8,9].
Současně s těmito změnami působí inzulinová rezistence zvýšení absorpce lipidů ze střevního lumina i syntézu chylomikronů v buňce střevní sliznice.
Zásadní je ale u diabetika porucha postprandiálního lipidového metabolizmu. Ta má pravděpodobně větší význam pro vznik a rozvoj aterosklerózy než obdobné změny detekované nalačno. Hlavní změnou postprandiálního lipoproteinového metabolizmu je kumulace tzv. remnantních lipoproteinů. Jedná se o „zbytky“ velkých, na TG bohatých částic (jaterních VLDL a intestinálních chylomikronů), které již nejsou substrátem lipoproteinové lipázy. Je prokázáno, že jejich postprandiální akumulace porušuje vazodilatační schopnost endotelu, vede k produkci zánětlivých cytokinů, aktivaci monocytů a zvýšení náchylnosti aterosklerotického plátu k ruptuře [10,11]. Přitom za aterogenicitu remnantních částic neodpovídají TG, ale množství cholesterolu, které transportují. Přitom tyto lipoproteinové populace nepostihuje dobře žádný z běžně měřených parametrů lipidogramu a mohou unikat naší pozornosti (obr. 1). Máme ale možnosti, jak aterogenní DLP uspokojivě charakterizovat.
Obr. 1. Spektrum lipoproteinů plazmy podle aterogenního potenciálu. 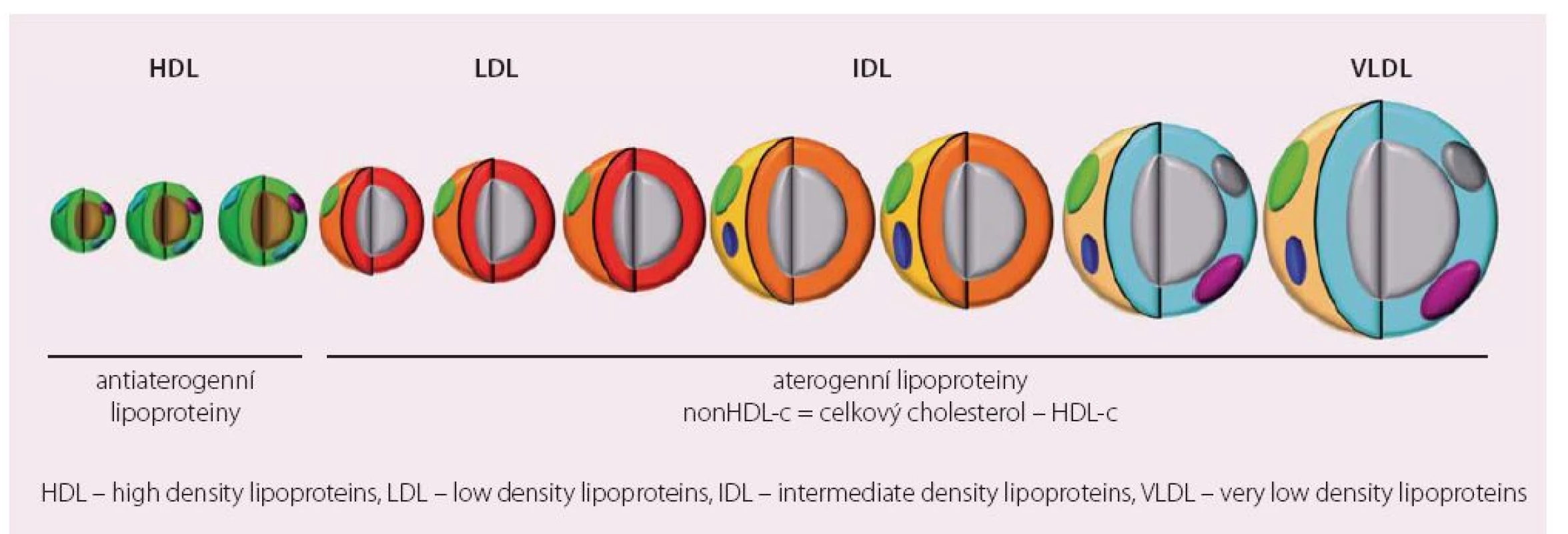
HDL – high density lipoproteins, LDL – low density lipoproteins, IDL – intermediate density lipoproteins, VLDL – very low density lipoproteins Hodnocení aterogenní DLP
Nezbytné je stanovení celkového cholesterolu a HDL-c, hladiny triglyceridů, LDL-c výpočtem dle Friedwaldovy rovnice při respektování obecných podmínek testování (odběr nalačno, odstup od akutního onemocnění alespoň čtyři týdny, uspokojivá kompenzace diabetu atd.). Možnosti hodnocení LDL-c podle zmíněné rovnice limituje nepřesnost při stoupajících TG – je-li triglyceridemie vyšší než 4,5 mmol/ l, nelze Friedwaldovu rovnici použít vůbec. Za hranice normálního rozmezí plazmatických lipidů lze považovat cílové hodnoty tak, jak byly stanoveny poslední revizí doporučení pro diagnostiku a léčbu DLP v dospělosti publikovaných evropskými odbornými společnostmi v roce 2011 (tab. 1) [12]. V tab. 1 nalezneme i cílové hladiny apoproteinu B a nonHDL-c (sekundární léčebné cíle), které jsou pro odhad rizika aterogenní DLP a monitoraci úspěchu léčby velmi důležité.
Tab. 1. Cílové a optimální hodnoty plazmatických lipidů a apoproteinů podle doporučení evropských společností z roku 2011. 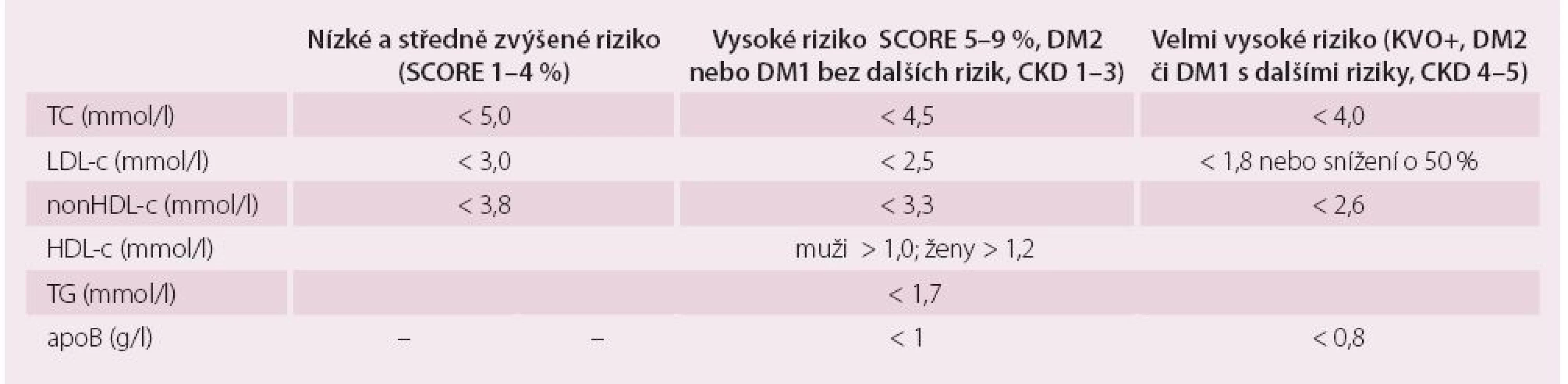
TC – celkový cholesterol, LDL-c – low density lipoprotein cholesterol, nonHDL-c – nonHDL cholesterol, apoB – apoprotein B, HDL-c – high density lipoprotein cholesterol, TG – triglyceridy, DM2 – diabetes mellitus 2. typu, DM1 – diabetes mellitus 1. typu, KVO+ – přítomnost manifestního KV onemocnění, CKD – chronické onemocnění ledvin Dalšími ukazateli, které můžeme (a měli bychom) klinicky využít pro hodnocení aterogenní DLP, jsou:
- nonHDL cholesterol = TC (celkový cholesterol) – HDL-c: u všech osob se zvýšenou hladinou TG reflektuje tento jednoduchý ukazatel celkové množství cholesterolu v plazmě neseného aterogenními lipoproteinovými částicemi. Výhoda tohoto markeru je, že není třeba dalšího laboratorního stanovení a nerostou náklady. NonHDL-c je přesnějším ukazatelem rizika u osob se smíšenou DLP než ostatní parametry základního lipidogramu [13].
- remnantní cholesterol (RLP-c): množství cholesterolu neseného v krevním proudu remnantními částicemi. Laboratorní stanovení tohoto parametru je náročné a není mezinárodně standardizováno. Proto byl v poslední době navržen odhad RLP-c výpočtem. Odečtením hodnot HDL-c a (přímou metodou stanoveného) LDL-c od koncentrace celkového cholesterolu získáme představu o množství cholesterolu neseného právě heterogenní subpopulací remnantních částic. Při výpočtu LDL-c pomocí Friedwaldovy rovnice je množství RLP-c rovno hladině TG dělené koeficientem 2,2 (v mmol/ l).
- apolipoprotein B (apoB): je nejpřesnějším z nových ukazatelů rizika u aterogenní DLP. Jeho koncentrace odpovídá počtu aterogenních lipoproteinových částic a informuje nás tak nejen o kvantitě, ale také o složení a velikosti lipoproteinů. Zvýšení hladiny apoB při normální nebo lehce zvýšené koncentraci LDL-c značí zmnožení malých denzních LDL částic s extrémním aterogenním potenciálem. ApoB je také nejpřesnějším ukazatelem rizika nemocných již léčených hypolipidemickou léčbou [13].
Význam aterogenní DLP
Aterogenní DLP je nejen zásadním ukazatelem přítomnosti inzulinové rezistence, ale především nositelem zásadně zvýšeného KV rizika. Autoři evropského konsenzu připomínají, že toto riziko sice léčba statinem k dosažení cílové hodnoty LDL-c snižuje významně, ale nedostatečně – hovoříme o tzv. reziduálním riziku. Zvláště statinové studie u diabetiků tento koncept ilustrovaly velmi dobře – přibližně 2/ 3 KV příhod proběhnou i u diabetiků dosahujících při léčbě statinem cílové hodnoty LDL-c (obr. 2) [14]. Proto musíme hledat další možnosti léčby a komentovaný konsenzus se zaměřil na kombinační léčbu statinem a fenofibrátem.
Obr. 2. Vysoké reziduální KV riziko u diabetiků ve statinových studiích. 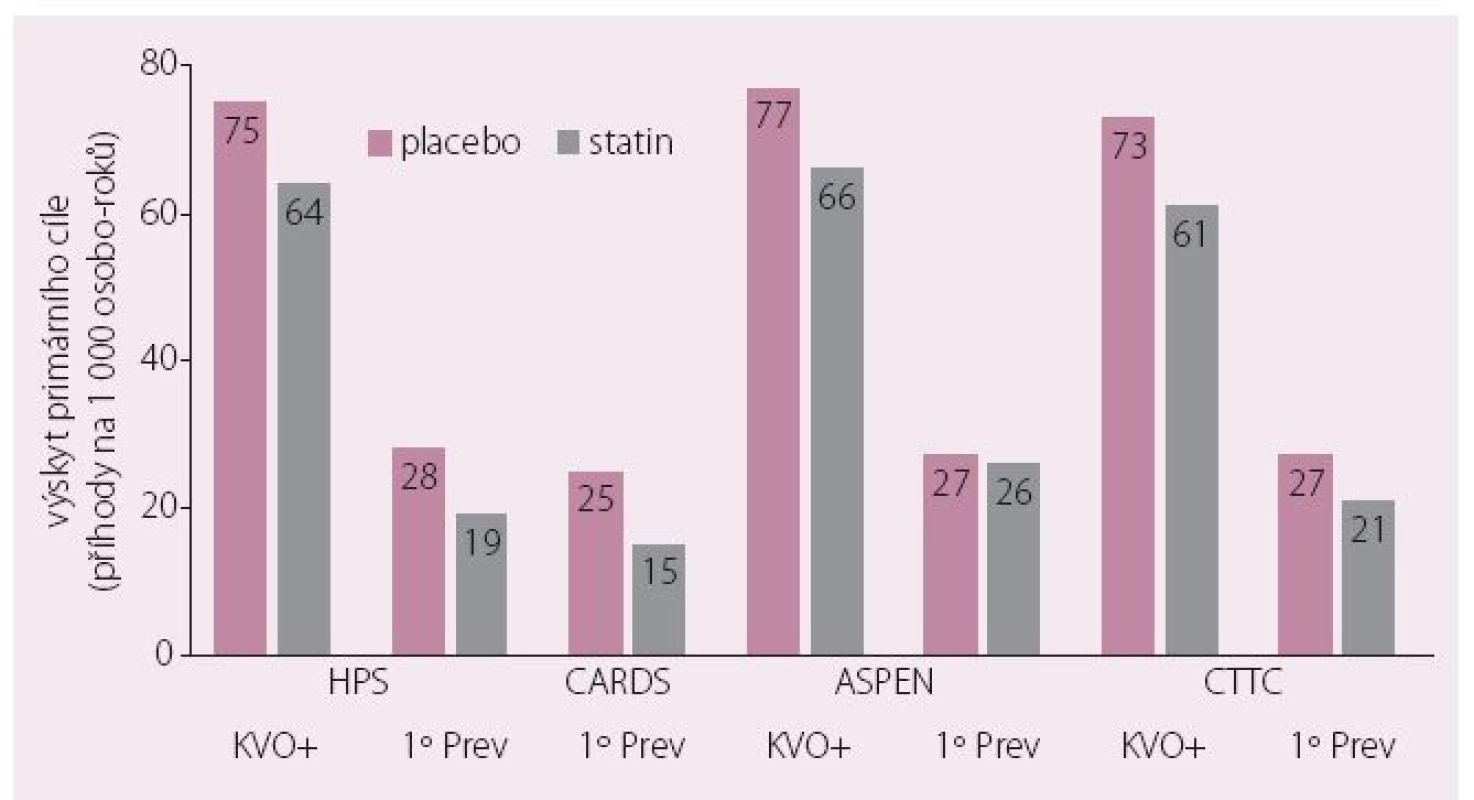
Statin a fenofibrát v léčbě aterogenní DLP – co víme a co bychom ještě vědět potřebovali?
Jako vždy (a v kontextu úvah o aterogenní DLP zvláště) využíváme veškerých možností ke změně diety a zvýšení pohybové aktivity. U nemocného s aterogenní DLP je efekt dobře prováděných režimových opatření většinou významný. Navíc u diabetiků zahrnuje snaha o kontrolu DLP i úsilí o kompenzaci diabetu, která sama o sobě přispěje ke snížení koncentrací (a postprandiální akumulace) aterogenních remnantů. Připomeňme si, že léčbou DLP neusilujeme pouze o dosažení cílových hodnot, ale o snížení rizika vzniku makro - i mikrovaskulárních komplikací. U většiny pacientů s aterogenní DLP (a diabetem/ inzulinovou rezistencí/ metabolickým syndromem) se účinné snížení KV rizika neobejde bez hypolipidemické farmakologické léčby a úkolem ošetřujícího lékaře je zejména vybrat vhodný postup léčby hypolipidemiky. Následující odstavce shrnují možnosti lipidy modifikující léčby nemocného s aterogenní DLP podle pořadí důležitosti ovlivnění jednotlivých lipidových ukazatelů.
Dosažení cílové hodnoty LDL-c
Evropský panel expertů se shoduje v tom, že i u pacientů s aterogenní DLP představuje první linii farmakologické intervence indikace statinu. Ta má být vedena tak, aby nemocní dosáhli cílové hodnoty LDL-c. Kromě snížení hladiny celkového LDL a zejména LDL-c v plazmě snižují statiny také TG a zvyšují mírně hladinu HDL-c, ovlivňují složení, a tím aterogenicitu lipoproteinů. Navíc disponují škálou tzv. pleiotropních účinků. Všechny tyto mechanizmy účinku se promítají do výsledného efektu výrazného snížení relativního rizika u diabetiků léčených statinem, které bylo odhadnuto na přibližně 30 % [14].
Na tomto doporučení nic nemění ani dnes již potvrzený negativní vliv statinů na glukózovou homeostázu. Při podávání statinů se riziko vzniku diabetu 2. typu zvyšuje o průměrně 9 % [15]. Důležité je, že toto riziko narůstá o více než 25 % u nositelů rizikových faktorů pro diabetes definovaných jako přítomnost metabolického syndromu, BMI > 30 kg/ m2, zvýšení lačné glykemie a/ nebo glykovaný hemoglobin > 44 mmol/ mol. Naopak osoby léčené statinem bez vyjmenovaných rizik měly srovnatelnou incidenci nově vzniklého diabetu s placebovou skupinou [16]. I přesto u rizikových osob s aterogenní DLP terapii statinem indikujeme, neboť benefit v podobě snížení rizika cévních komplikací jistě převyšuje rizika spojená s manifestací diabetu. Navíc fakticky nedochází k manifestaci diabetu u jinak zdravých osob, ale k urychlení přechodu prediabetu do stadia diabetu. Přitom lze tomuto riziku zabránit důsledným prosazováním režimových opatření vedoucích k poklesu hmotnosti. Prakticky z toho vyplývá, že osoby s aterogenní DLP zasluhují zvláštní pozornost cílenou k hodnocení parametrů glukózového metabolizmu a včasné intervenci směrem k jejich zlepšení (např. vč. indikace metforminu).
Kombinace statinů s dalšími léčivy prohlubujícími LDL-c snižující efekt statinů má smysl v případech, kdy monoterapie statinem nevede k dosažení cílové hodnoty LDL-c. Mají i další potenciálně zajímavé efekty (např. v poslední době dokumentovaný přesvědčivý efekt kombinace statin + ezetimib na makrovaskulární riziko diabetiků ve studii IMPROVE-IT nebo známý účinek pryskyřic na zlepšení glukózové homeostázy), ale rozbor těchto možností přesahuje zaměření konsenzu.
Dosažení cílové hodnoty nonHDL-c a optimální hodnoty triglyceridů
Hypertriglyceridemie zásadním způsobem zvyšuje aterogenicitu ostatních lipoproteinových částic a je spojena s poklesem koncentrací HDL-c. Hlavním opatřením a nejefektivnějším způsobem léčby vysoké triglyceridemie je dietní a pohybový režim. Často je ale nutná terapie farmakologická. K ovlivnění triglyceridemie a dosažení cílové hodnoty nonHDL-cv případě neuspokojivého efektu monoterapie statinem používáme fibráty v kombinaci se statiny.
Fibráty jsou agonisté nitrojaderných receptorů PPARalfa, a proto mají komplexní působení. Zvyšují lipolýzu prostřednictvím aktivace lipoproteinové lipázy, snižují produkci na triglyceridy bohatých částic v hepatocytu, indukují betaoxidaci mastných kyselin a jejich zvýšenou utilizaci v jaterní buňce, zvýšení syntézy apoproteinů AI a AII. Těmito mechanizmy je vysvětlitelná fibráty navozená změna v kvantitě, ale i kvalitě lipoproteinových částic krevní plazmy [17].
Dnes je nejrozšířenějším fenofibrát, který byl jako jediný zástupce této lékové třídy schválen pro použití v kombinaci se statiny. Jak dokumentovaly provedené studie, podávání fenofibrátu je spojeno s významným poklesem rizika KV onemocnění u osob s aterogenní DLP. Léčba fibrátem je efektivní právě u osob, které mají hypertriglyceridemii (a většinou také sníženou hladinu HDL-c), jak doložila i metaanalýza fibrátových studií (obr. 3) [18]. Fenofibrát prošel i dosud jedinou klinickou studií hodnotící kombinaci statin a fibrát (ACCORD Lipid). Diabetici 2. typu v ní byli randomizováni ke kombinaci statin + placebo nebo statin + fenofibrát. Kombinační léčba snižovala riziko makrovaskulárních komplikací opět výhradně u osob s aterogenní DLP (vysoké TG a nízká hladina HDL-c) (obr. 4). Byl potvrzen příznivý vliv fenofibrátu na vznik a rozvoj mikrovaskulárních komplikací. Studie ACCORD Lipid také prokázala, že bezpečnost kombinace statinu s fenofibrátem byla srovnatelná s monoterapií statinem a léčba byla provázena minimem nežádoucích účinků [19].
Obr. 3. Metaanalýza účinku fibrátů na KV riziko podle přítmnosti hyperTG/snížení HDL-c. 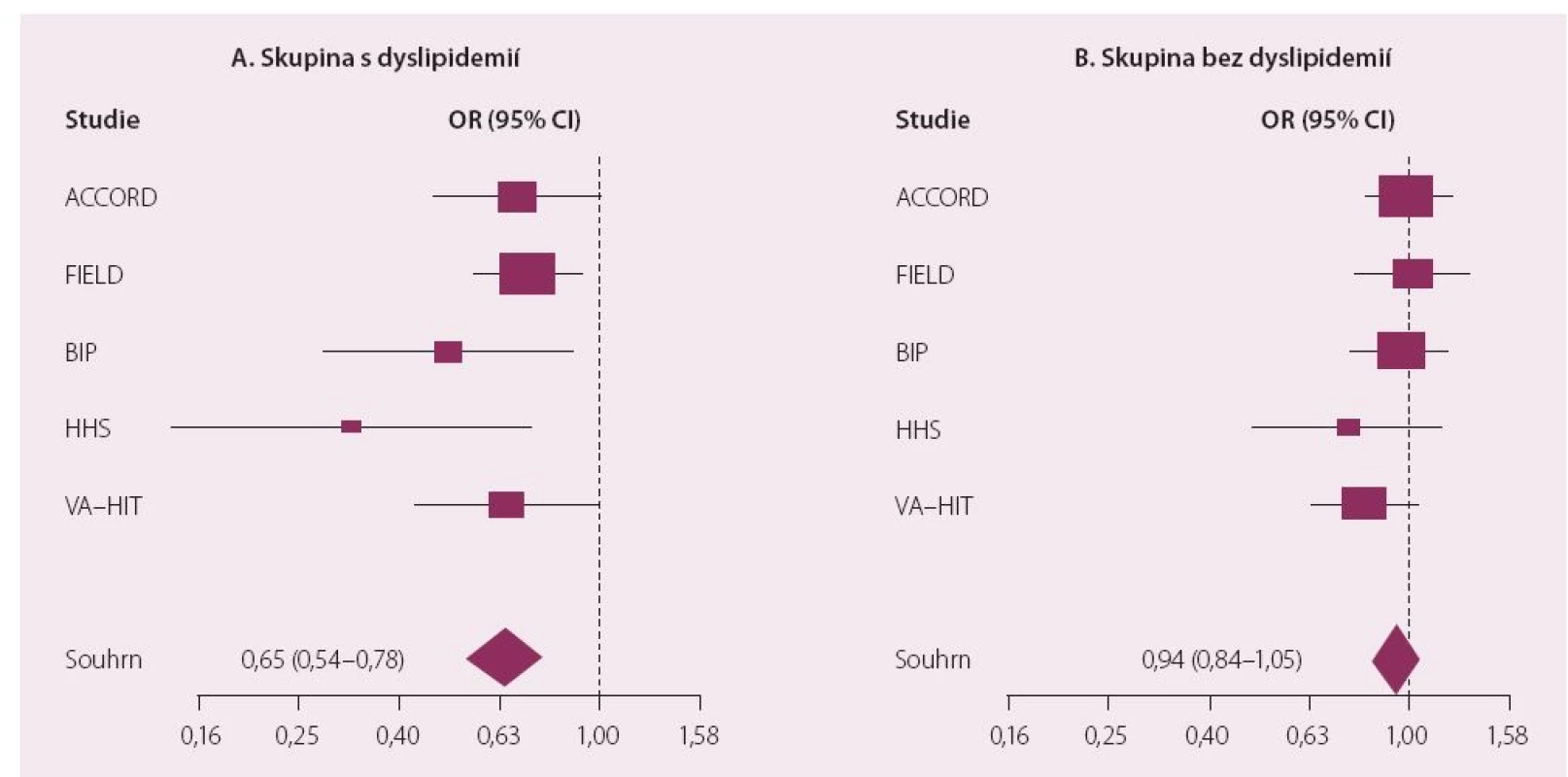
Obr. 4. ACCORD-LIPID: léčba aterogenní DLP simvastatinem a fenofibrátem snižuje relativní KV riziko o 29 %. 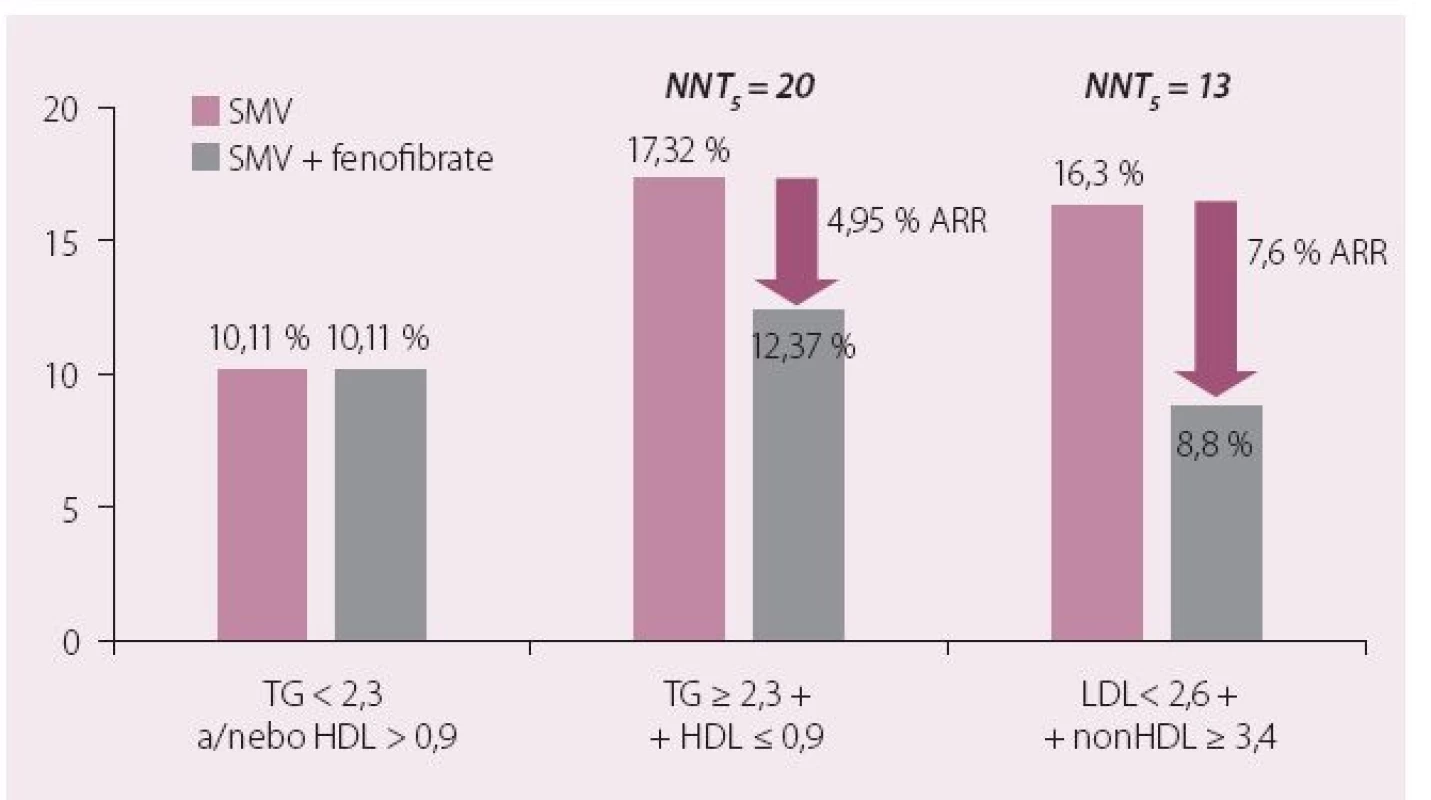
NNT – number needed to treat (nutný počet léčených k zabránění výskytu 1 sledované příhody), ARR – absolute risk reduction (redukce absolutního rizika); TG –triglyceridy Fenofibrát je indikován jako iniciální terapie u všech pacientů s opakovaně zjištěnou významnou hypertriglyceridemií (nad 4 – 5 mmol/ l nalačno). Většinou se však uplatní v kombinaci se statinem nebo ezetimibem při snaze o ovlivnění všech složek aterogenní DLP a dosažení potřebné koncentrace sekundárního léčebného cíle nonHDL-c. U těchto nemocných navíc přidání fenofibrátu ke statinu prohloubí LDL-c snižující účinek o 10 – 15 %, což je nesporně dalším významným „pro“ časného zahájení kombinační léčby. V souladu s výsledky klinických studií a na jejich základě formulovaných doporučení odborných společností přidáme k zavedené terapii statinem fenofibrát u těch nemocných, u nichž přetrvává zvýšení hladin TG > 2,3 mmol/ l i při dobře kontrolované hladině LDL-c.
Navíc fenofibrát má jednoznačně dokumentovaný příznivý efekt na vznik a průběh mikrovaskulárních komplikací diabetu. Jak připomíná konsenzus panelu expertů, tyto vlivy nezprostředkovávají změny lipoproteinového metabolizmu, ale přímý zásah do genové exprese několika genových oblastí (nejvýznamnější jsou pravděpodobně geny zodpovědné za iniciaci a průběh neoangiogeneze) [20]. Samostatná indikace fenofibrátu k prevenci a léčbě diabetických mikrovaskulárních komplikací dosud nebyla regulačními autoritami v Evropě schválena, ale důkazy z fenofibrátových studií můžeme považovat za průkazné [21,22].
Závěr
Intervence aterogenní DLP představuje jednu z hlavních možností ovlivnění prognózy svých nositelů. Závěry a nejdůležitější informace konsenzu shrnuje tab. 2.
Tab. 2. Souhrn nejdůležitějších informací z konsenzu evropských expertů k problematice aterogenní dyslipidemie a postavení kombinační léčby statin + fenofibrát v roce 2015. 
KV – kardiovaskulární, TG – triglyceridy, HDL-c – high density lipoproteins cholesterol, LDL-c – low density lipoproteins cholesterol Podpořeno grantem AZV MZČR: 15-28876A.
doc. MU Dr. Michal Vrablík, Ph.D.
www.vfn.cz
vrablikm@seznam.cz
Doručeno do redakce: 22. 2. 2016
Přijato po recenzi: 4. 3. 2016
www.kardiologickarevue.cz
Zdroje
1. Češka R. Cholesterol a ateroskleróza, léčba dyslipidémií. Praha: Triton 2005.
2. Alberti KG, Zimmet P, Shaw J. The metabolic syndrome – new worldwide definition. Lancet 2005; 366 : 1059 – 1062.
3. Grundy SM, Cleeman JI, Merz CN et al. Coordinating Committee of the National Cholesterol Education Program. Implications of recent clinical trials for the National Cholesterol Education Program Adult Treatment Panel III guidelines. Arterioscler Thromb Vasc Biol 2004; 24 : 149 – 161.
4. Lusis AJ, Mar R, Pajukanta P. Genetics of atherosclerosis. Annu Rev Genomics Hum Genet 2004; 5 : 189 – 218.
5. Soška V. Léčba dyslipidemie u diabetiků. Interní Med 2007; 4 : 163 – 166.
6. Adiels M, Olofsson SO, Taskinen MR et al. Overproduction of very low-density lipoproteins is the hallmark of the dyslipidemia in the metabolic syndrome. Atheroscler Thromb Vasc Biol 2008; 28 : 1225 – 1236. doi: 10.1161/ ATVBAHA.107.160192.
7. Hsieh J, Hayashi AA, Webb J et al. Postprandial dyslipidemia in insulin resistence: Mechanisms and role of intestinal insulin sensitivity. Atheroscler Suppl 2008; 9 : 7 – 13. doi:10.1016/ j.atherosclerosissup.2008.05.011.
8. Rivellese AA, De Natale C, Di Marino L et al. Exogenous and endogenous postprandial lipid abnormalities in type 2 diabetic patiens with optimal blood glucose control and optimal fasting triglyceride levels. J Clin Endocrinol Metab 2004; 89 : 2153 – 2159.
9. Catapano AL, Reiner Z, De Backer G et al. ESC/ EAS Guidelines for the management of dyslipidaemias of the European Society of Cardiology (ESC) and the European Atherosclerosis Society (EAS). Atherosclerosis 2011; 217 : 3 – 46.
10. Di Angelantonio E, Sarwar N, Perry P et al. The Emerging Risk Factors Collaboration. Major lipids, apolipoproteins, and risk of vascular disease. JAMA 2009; 302 : 1993 – 2000. doi: 10.1001/ jama.2009.1619.
11. Perk J, Backer GD, Gohlke H et al. European Guidelines on cardiovascular disease prevention in clinical practice (version 2012). The fifth joint task force of the european society of cardiology and other societies on cardiovascular disease prevention in clinical practice. Eur J Prev Cardiol 2012;19 : 585 – 667. doi: 10.1177/ 2047487312450228.
12. Wuelffelé MG, Kooy A, de Zeeuw D et al. The effect of metformin on blood pressure, plasma cholesterol and triglycerides in type 2 diabetes mellitus: a systematic review. J Intern Med 2004; 256 : 1 – 14.
13. Eleftheriadou I, Grigoropoulou P, Katsilambros Net al. Effect of medications used for the management of diabetes and obesity on postprandial lipid metabolism. Curr Diab Rev 2008; 4 : 340 – 356.
14. Kearney PM, Blackwell L, Collins R et al. Cholesterol treatment trialists. Efficacy of cholesterol-lowering therapy in 18 686 people with diabetes in 14 randomised trials of statins: a meta-analysis. Lancet 2008, 371 : 117 – 125. doi: 10.1016/ S0140-6736(08)60104-X.
15. Armitage J, Bowman L, Wallendszus K et al. Study of the Effectiveness of Additional Reductions in Cholesterol and Homocysteine (SEARCH) Collaborative Group. Intensive lowering of LDL cholesterol with 80 mg versus 20 mg simvastatin daily in 12,064 survivors of myocardial infarction: a double-blind randomised trial. Lancet 2010; 376 : 1658 – 1669.
16. Bruckert E, Hayem G, Dejager S et al. Mild to moderate muscular symptoms with high-dosage statin therapy in hyperlipidemic patients-the PRIMO study. Cardiovasc Drugs Ther 2005; 19 : 403 – 414.
17. Rajpathak SN, Kumbhani DJ, Crandall J et al. Statin therapy and risk of developing type 2 diabetes: a meta-analysis. Diabetes Care 2009; 32 : 1924 – 1929. doi: 10.2337/ dc09-0738.
18. Preiss D, Sattar N. Statins and the risk of new-onset diabetes: a review of recent evidence. Curr Opin Lipido 2011; 22 : 460 – 466. doi: 10.1097/ MOL.0b013e32834b4994.
19. Baigent C, Landray MJ, Reith C et al. SHARP Investigators. The effects of lowering LDL cholesterol with simvastatin plus ezetimibe in patients with chronic kidney disease (Study of Heart and Renal Protection): a randomised placebo-controlled trial. Lancet 2011; 377 : 2181 – 2192. doi: 10.1016/ S0140-6736(11)60739-3.
20. Takase H, Dohi Y, Okado T et al. Effects of ezetimibe on visceral fat in the metabolic syndrome: a randomised controlled study. Eur J Clin Invest 2012; 42 : 1287 – 1294. doi: 10.1111/ eci.12000.
21. Handelsman Y. Role of bile acid sequestrants in the treatment of type 2 diabetes. Diab Care 2011; 34 (Suppl 2): S244 – S250. doi: 10.2337/ dc11-s237.
22. Ginsberg HN, Elam MB, Lovato LC et al. ACCORD Study Group. Effects of combination lipid therapy in type 2 diabetes mellitus. N Engl J Med 2010; 362 : 1563 – 1574. doi: 10.1056/ NEJMoa1001282.
23. Wright AD, Dodson PM. Medical management of diabetic retinopathy: fenofibrate and ACCORD Eye studies. Eye (Lond) 2011; 25 : 843 – 849. doi: 10.1038/ eye.2011.62.
24. Davidson MH, Ballantyne CM, Kerzner B et al. Efficacy and safety of ezetimibe coadministered with statins: randomised, placebo-controlled, blinded experience in 2382 patients with primary hypercholesterolemia. Int J Clin Pract 2004; 58 : 746 – 755.
Štítky
Dětská kardiologie Interní lékařství Kardiochirurgie Kardiologie
Článek vyšel v časopiseKardiologická revue – Interní medicína
Nejčtenější tento týden
2016 Číslo 1- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Jak nejlépe blokovat renin-angiotenzinový systém u nemocných s hypertenzí a diabetes mellitus?
- Infekční komplikace u pacientů s akutním srdečním selháním – přehled
- Přidružená onemocnění a jejich význam pro prognózu akutního srdečního selhání – AHEAD score
- Kardiálna kachexia
- Tělesný trénink a rehabilitace u srdečního selhání
- Kvalita života pacientů s akutní dekompenzací chronického systolického srdečního selhání hodnocená pomocí standardizovaných dotazníků
- Hyperurikémia, kardiovaskulárne choroby a srdcové zlyhávanie
- Antikoagulace, antiagregace nebo obojí u pacientů s ischemickou chorobou srdeční a fibrilací síní
- Místo sitagliptinu v léčbě pacientů s diabetem 2. typu po studii TECOS
- Na jaké hodnoty snižovat systolický krevní tlak? Studie SPRINT
- prof. MUDr. Jiří Vítovec, CSc., FESC (*25. 2. 1951)
- Evropský konsenzus k otázkám aterogenní dyslipidemie a kombinační léčbě statinem a fibrátem
- Inhibitory protonové pumpy – nové molekuly, nové poznatky
- Nové pohledy na patofyziologii, diagnostiku a léčbu srdečního selhání se zachovanou ejekční frakcí
- Kardiologická revue – Interní medicína
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Inhibitory protonové pumpy – nové molekuly, nové poznatky
- Antikoagulace, antiagregace nebo obojí u pacientů s ischemickou chorobou srdeční a fibrilací síní
- Kardiálna kachexia
- Hyperurikémia, kardiovaskulárne choroby a srdcové zlyhávanie
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



