-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Antikoagulace, antiagregace nebo obojí u pacientů s ischemickou chorobou srdeční a fibrilací síní
What to use in patients with ischaemic heart disease and atrial fibrillation – anticoagulation, antiaggregation or both?
A combination of atrial fibrillation and ischaemic heart disease is quite common and antiaggregation or anticoagulation treatment should improve the prognosis of the patients. However, clear evidence is missing and recommendations contained in official guidelines sometimes differ. There are no clinical trials comparing warfarin and new anticoagulants (NOAC) in patients after coronary intervention, and there are also no data about the combination of NOAC with new antiaggregation drugs such as ticagrelor or prasugrel. The combination of antiaggregation (mono or dual) with NOAC or warfarin significantly increases the risk of bleeding, and therefore the intensity and the duration of treatment should be individualised and scoring systems such as CHA2DS2-VASc or HAS-BLED should be used. Anticoagulation alone (preferably NOAC) should be given to patients with chronic ischaemic heart disease (> 1 year) and atrial fibrillation.
Keywords:
atrial fibrillation – ischaemic heart disease – anticoagulation – antiagregation
Autoři: R. Lábrová; J. Špinar
Působiště autorů: Interní kardiologická klinika LF MU a FN Brno
Vyšlo v časopise: Kardiol Rev Int Med 2016, 18(1): 47-51
Kategorie: Kardiologická revue
Souhrn
Kombinace fibrilace síní s ischemickou chorobou srdeční je poměrně častá a antiagregační či antikoagulační léčba by měla vést především ke zlepšení prognózy nemocných. Bohužel chybí jasná data, jak léčit tyto pacienty, a doporučení se mohou dokonce v různých dokumentech mírně lišit. Neexistuje jediná klinická studie, která by porovnala pacienty s warfarinem oproti novým antikoagulanciím (NOAK), kteří podstoupili intervenční léčbu. Stejně tak neexistují data pro kombinaci NOAK s novými antiagregačními preparáty jako tikagrelor a prasugrel. Kombinace mono i duální antiagregace s NOAK i s warfarinem výrazně zvyšuje riziko krvácení. Délka a intenzita antiagregační i antikoagulační léčby by proto měla být individualizována se zvažováním prospěchu a neprospěchu pro pacienta. Používání skórovacích systémů jako CHA2DS2-VASc či HAS-BLED je doporučeno. U pacientů s chronickou ischemickou chorobou srdeční (> 1 rok) a současnou fibrilací síní by měla být upřednostněna samotná antikoagulační léčba s preferencí NOAK.
Klíčová slova:
fibrilace – ischemická choroba – antikoagulace – antiagregace
V roce 2015 vyšla inovovaná Evropská doporučení pro používání antikoagulancií – nonvitamin K antagonistů – u pacientů s nonvalvulární fibrilací siní (FS), která přinášejí především jasné pokyny, jak podávat tuto léčbu u pacientů s ischemickou chorobou srdeční (ICHS), především jak doporučit či nedoporučit současné podávání antikoagulační a antiagregační léčby u pacientů s FS a ICHS [1].
Kombinace FS s ICHS je poměrně častá a antiagregační či antikoagulační léčba by měla vést především ke zlepšení prognózy nemocných [2 – 4]. Bohužel chybí jasná data, jak léčit tyto pacienty, a doporučení se mohou dokonce v různých dokumentech mírně lišit [5 – 7]. Bohužel neexistuje jediná klinická studie, která by porovnala pacienty s warfarinem oproti novým antikoagulanciím (NOAK), kteří podstoupili intervenční léčbu pro akutní koronární syndrom nebo chronickou ICHS (případně měli indikovanou duální antiagregační léčbu). Stejně tak neexistují data pro kombinaci NOAK s novými antiagregačními preparáty jako tikagrelor a prasugrel.
Jaká máme základní data o používání NOAK u nemocných s akutním koronárním syndromem a/ nebo po koronární intervenci pro stabilní ICHS a současně s FS:
- FS komplikující akutní koronární syndrom (AKS) je poměrně častá, je spojena s vysokou mortalitou a častými krvácejícími i ischemickými komplikacemi [2,3,6,7].
- Metodou, jak snížit riziko krvácení, je používat nízkou dávku kyseliny acetylsalicylové (ASA) (75 – 100 mg), zvláště v kombinaci s P2Y12 inhibitory (tikagrelor, klopidogrel). Používat novou generaci pokrývaných stentů nebo kovové stenty, aby délka duální antiagregace byla co nejkratší, a používat radiální přístup katetrizace.
- Warfarin má prokázaný protektivní účinek po akutním koronárním syndromu v kombinaci s ASA (SAPT) oproti ASA samotné. Ve studii WARIS-2 měl samotný warfarin protektivní efekt a ve srovnání s kombinací warfarin + aspirin měl méně krvácení [8].
- Antikoagulace s nedostatečnou kontrolou INR (< 2,0) je neúčinná [9 – 11].
- U nemocných se stabilní ICHS léčených antikoagulací pro FS je přidání antiagregace zbytečné [12]. V rozsáhlém dánském registru tato strategie nevedla ke zlepšení prognózy [13].
- Většina registrů popisuje zvýšené krvácení při užívání triple terapie (DAPT) [14,15]. Studie WOEST randomizovala nemocné na chronické antikoagulaci podstupující angioplastiku k triple terapii nebo jen k dvojkombinaci (antikoagulace + aspirin nebo antikoagulace + klopidogrel) a prokázala zdvojnásobení rizika krvácení při triple terapii [16]. Překvapivě ale tato studie (která byla relativně malá) ukazovala trend k nižší mortalitě při kombinaci antikoagulace + klopidogrel. Studie ISAR-TRIPLE randomizovala nemocné na trojkombinaci po dobu šesti týdnů nebo šesti měsíců a opět prokázala, že během léčby je zvýšené riziko krvácení [17]. V registru AFCAS byla triple terapie spojena se statisticky nevýznamným zvýšením rizika krvácení bez ovlivnění ischemických příhod. Můžeme tedy shrnout, že triple terapie by měla být po co nejkratší dobu, tedy přibližně šest týdnů [1].
- Triple terapie s NOAK zvyšuje riziko krvácení přibližně dvakrát [18,19]. V současné době probíhají minimálně tři velké klinické studie s touto problematikou – PIONEER AF PCI s rivaroxabanem, RE-DUAL PCI s dabigatranem a AGUSTUS s apixabanem.
- Z již ukončených klinických studií s NOAK u FS není známo, zda NOAK vs. warfarin mají zvýšené riziko krvácení, nebo naopak snížené riziko trombotických příhod při SAPT či DAPT.
- Některé klinické studie s novými antiagregancii ukazují jejich výhodnost oproti klasickým, zda toto ale platí i pro kombinaci s warfarinem a/ nebo s NOAK, však není známo ani pro riziko krvácení ani pro účinnost [20,21].
- Některé klinické studie testovaly dlouhodobou strategii duální antiagregační strategie jako např. studie PEGASUS-TIMI 54. Pacienti s nutností dlouhodobé antikoagulace jsou ale z těchto studií vyloučeni [22].
- NOAK nebyly testovány u pacientů s akutním koronárním syndromem. V metaanalýze dabigatran vs. warfarin však bylo mnohem méně akutních koronárních příhod na dabigatranu (p = 0,03) [23].
- FDA registr se 134 000 nemocnými neukazuje rozdíl ve výskytu koronárních příhod mezi warfarinem a dabigatranem [24].
- Velmi malá dávka rivaroxabanu (2 × 2,5 mg) přidaná k DAPT signifikantně snížila ischemické příhody u pacientů po AKS [25].
- U warfarinu se doporučuje při provádění angioplastiky příprava a periproceduální podání heparinu. Zda toto platí i pro NOAK, nebylo dosud testováno.
Nemocné si můžeme rozdělit do tří základních skupin:
- koronární intervence u nemocných léčených NOAK pro FS;
- pacient, který prodělal akutní koronární syndrom v nedávné době (< 1 rok) a dostane FS;
- pacient se stabilní ICHS (> 1 rok po akutní příhodě) a dostane FS.
Koronární intervence u nemocných léčených NOAK pro FS
U warfarinu je doporučeno nepřerušovat léčbu při elektivní angioplastice nebo při angioplastice u akutního koronárního syndromu. Naopak u NOAK je doporučeno přerušení před elektivní angioplastikou i u akutního koronárního syndromu, protože takto to bylo doporučeno v klinických studiích fáze III u FS. Tento rozdíl v doporučení je dán tím, že u NOAK neumíme měřit účinnost, proto ani nedokážeme správně odhadnout adherenci nemocného k užívání léků a nevíme, jaká je současná úroveň antikoagulace. Malá studie fáze II s dabigatranem nepřinesla dostatek důkazů o účinnosti antikoagulace u elektivní perkutánní transluminální koronární angioplastika (PTCA) [26]. Dočasné přerušení krátkodobě působících NOAK umožňuje bezpečné zahájení antiagregační léčby.
Současné doporučení ESC ale zní nepoužívat nová antiagregancia (tikagrelor, prasugrel) v kombinaci s ASA a NOAK pro nedostatek zkušeností.
Současné doporučení shrnuje obr. 1.
Obr. 1. Doporučení pro antiagregační léčbu nemocných léčených NOAK. 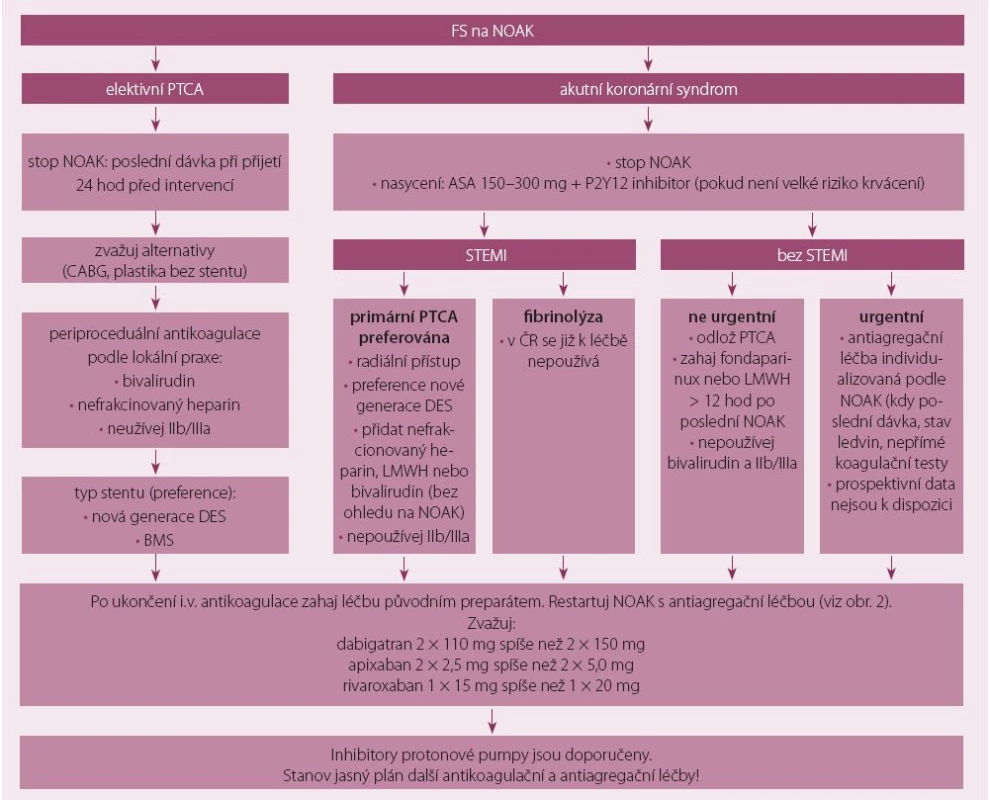
Elektivní PTCA u stabilní ICHS
U elektivní PTCA se doporučuje používání nové generace koronárních stentů uvolňujících farmaka (DES – drug eluting stents) nebo kovových stentů (BMS) s cílem zkrácení nutné duální antiagregace s NOAK. Není doporučeno měnit léčbu NOAK na warfarin z důvodů kolísání antikoagulační léčby. NOAK se doporučuje vysadit tak, aby byl předpokládaný konec účinnosti před převozem na angiolinku (většinou 24 hod). Nefrakcionovaný heparin, resp. bivaluridin je preferován před enoxaparinem [27].
ST elevace infarkt myokardu
Vzhledem k nedostatku dat u všech nemocných s AKS léčených NOAK se doporučuje podání 150 – 300 mg ASA a P2Y12inhibitorů [28]. U fragilních pacientů s velkým rizikem krvácení se doporučuje samotná ASA. Rutinní podávání IIb/ IIIa se nedoporučuje.
Non-ST elevace infarkt myokardu
Doporučení pro non-ST elevace infarktu myokardu (IM) se v zásadě neliší od ST elevací IM.
Postproceduální nasazení NOAK
U stabilních pacientů nasazujeme NOAK po ukončení intravenózní antikoagulační léčby. Nejsou žádná data pro přechod na warfarin.
U pacientů léčených dabigatranem se doporučuje souběh alespoň s jedním antiagregačním preparátem (většinou ASA) a je doporučena redukovaná dávka dabigatranu (2 × 110 mg), rivaroxabanu (1 × 15 mg) či apixabanu (2 × 2,5 mg).
Pacienti by při propuštění měli mí jasný plán snižování antiagregační či antikoagulační léčby, vhodné je přidání inhibitorů protonové pumpy.
Chronické podávání u nemocných více než jeden rok po AKS
Kombinace mono i duální antiagregace s NOAK i s warfarinem výrazně zvyšuje riziko krvácení [13,25,29]. Délka a intenzita antiagregační i antikoagulační léčby by proto měla být individualizována se zvažováním prospěchu a neprospěchu pro pacienta [30]. Je doporučeno používání skórovacích systémů jako CHA2DS2-VASc či HAS-BLED [31 – 33]. Jako návod individuální terapie slouží obr. 2.
U pacientů s elektivní PTCA je doporučena plná triple terapie jeden měsíc za použití BMS stentu nebo moderních BMS stentů s následným snižováním antikoagulace či antiagregace. K co nejkratší době triple terapie by měl být indikován především labilní pacient s rizikem krvácení nebo naopak s rizikem trombotické ischemické příhody.
Po jednom roce je doporučeno pokračovat pouze v monoterapii NOAK a riziko krvácení může tuto dobu zkrátit i na 3 – 6 měsíců.
U pacientů s velmi nízkým CHA2DS2-VASc [1 – 2] je možno podávat pouze duální antiagregaci bez antikoagulace, a to přesto, že ve studii ACTIVE W bylo méně IM na warfarinu než na duální antiagregaci [34].
U pacientů s první generací DES je doporučena triple terapie více než 3 – 6 měsíců.
U pacientů s velkým rizikem trombotické příhody a malým rizikem krvácení je taktéž doporučena triple terapie > 6 měsíců.
U pacientů po AKS je doporučena triple terapie > 6 měsíců, avšak u nemocných s velkým rizikem krvácení může být zkrácena až na 1 měsíc. Naopak prodloužení na 12 měsíců je doporučeno u nemocných s první generací DES stentů nebo u nemocných s vysokým trombotickým rizikem. Podobně o prodloužení můžeme uvažovat u nemocných s velmi nízkým rizikem krvácení (HAS-BLED 0-1).
Obecně u všech nemocných s ICHS a FS by po jednom roce souběhu antiagregační a antikoagulační léčby měla pokračovat pouze léčba antikoagulační, s výjimkou velmi rizikových nemocných.
Nemocní po akutní koronární intervenci (< 1 rok), kteří dostanou novou FS
Guidelines pro AKS doporučují duální antiagregaci po dobu jednoho roku, pokud nejsou nemocní léčeni antikoagulací [22]. Pokud nemocní v této době dostanou FS a je indikace k antikoagulační léčbě, nastává otázka, jak zahájit tuto léčbu a zda preferovat warfarin nebo NOAK. Randomizované klinické studie na tuto problematiku neexistují a řídit bychom se měli schématem zobrazeným na obr. 2, tedy v prvních šesti měsících spíše triple terapie a od 6. do 12. měsíce kombinace antikoagulace s aspirinem nebo klopidogrelem. NOAK jsou minimálně rovnocennou alternativou warfarinu.
Obr. 2. Doporučené schéma antikoagulační a antiagregační léčby. 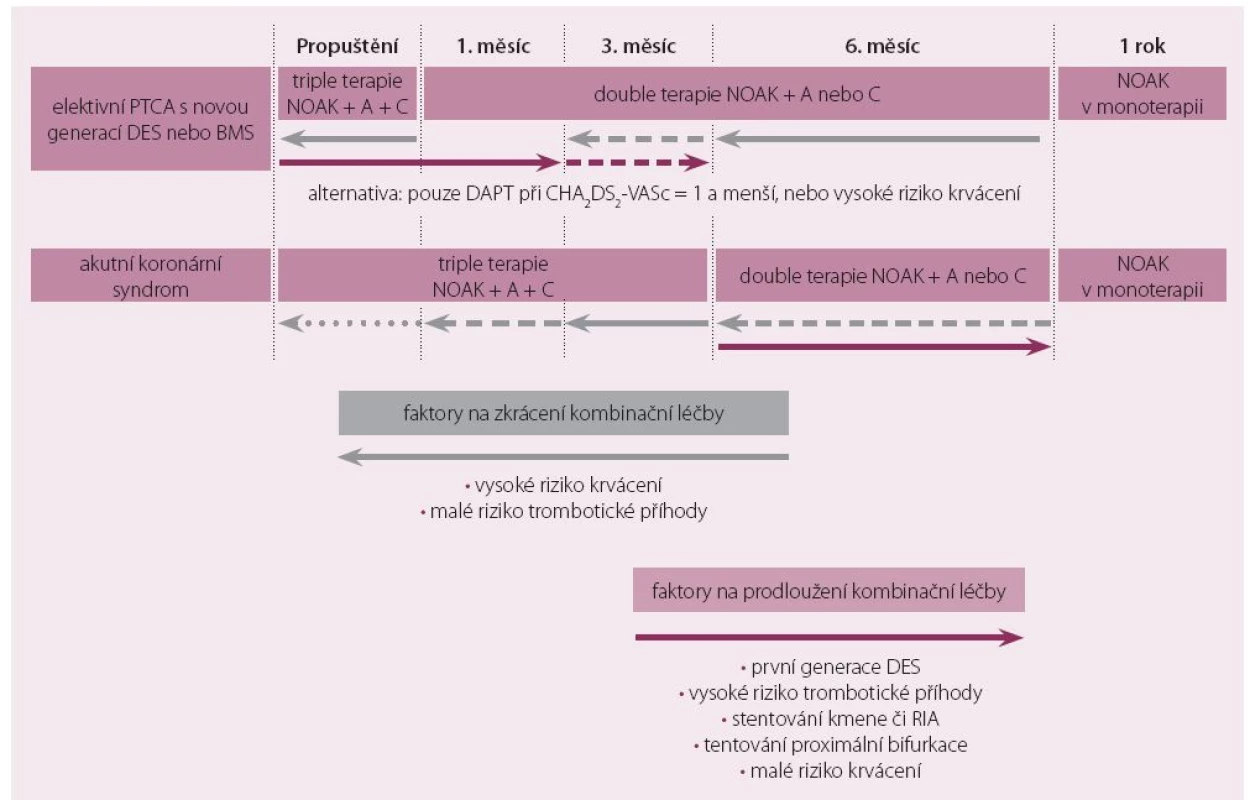
A – ASA 100 mg 1× denně, C – clopidogrel 75 mg 1× denně. Rivaroxaban v malé dávce (2 × 2,5 mg) má důkaz pro snížení trombotických příhod ve stentu u nemocných léčených duální antiagregací (ale se zvýšeným krvácením) [25,35]. Jeho efekt na předcházení ischemické cévní mozkové příhody u nemocných s FS však není znám.
Pacient se stabilní ICHS (> 1 rok po akutní příhodě), který dostane FS
Pacient se stabilní ICHS, který dostane FS, má dostávat antikoagulační léčbu podle guidelines pro FS, tedy při CHA2DS2-VASc ≥ 1 (obr. 3). Většina klinických studií jasně prokazuje superioritu warfarinu nad aspirinem a kombinace warfarin + aspirin je spojena se zvýšeným rizikem krvácení. Proto je u těchto nemocných indikována samotná antikoagulace bez antiagregace [5,14,36].
Obr. 3. Doporučení antikoagulační léčby podle CHA2DS2-VASc. 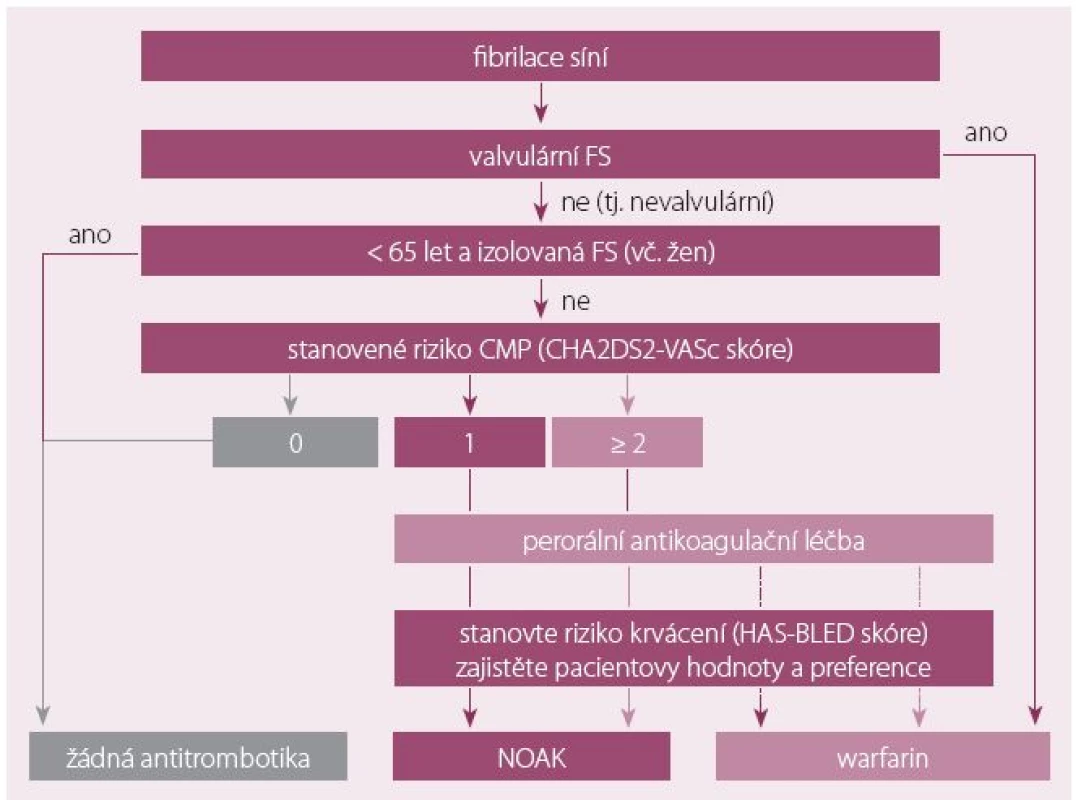
Otázka, zda jsou NOAK bezpečné preparáty, byla v tomto případě částečně zodpovězena v klinických studiích fáze III u FS, kde 15 – 20 % nemocných bylo po IM. Nebyla však provedena subanalýza, kolik těchto nemocných mělo současně ponechanou antiagregační léčbu. Zdá se ale, že výhody NOAK oproti warfarinu jsou zachovány i u těchto nemocných, a proto by měly být preferovány. Velký registr s dabigatranem (134 000 nemocných) tuto teorii plně podporuje [37]. Jestli je některý NOAK lepší než jiný, prozatím není známo, a ani nepřímá data toto srovnání neumožňují.
Práce byla podpořena projektem (Ministerstva zdravotnictví) koncepčního rozvoje výzkumné organizace 65269705 (FN Brno).
prof. MU Dr. Jindřich Špinar, CSc., FESC
www.fnbrno.cz
jspinar@fnbrno.cz
Doručeno do redakce: 12. 1. 2016
Přijato po recenzi: 25. 1. 2016
Zdroje
1. Heidbuchel H, Verhamme P, Alings M et al. Updated European Heart Rhythm Association Practical Guide on the use of non-vitamin K antagonist anticoagulants in patients with non-valvular atrial fibrillation. Europace 2015; 17 : 1467 – 1507. doi: 10.1093/ europace/ euv309.
2. Lopes RD, Pieper KS, Horton JR et al. Short - and long-term outcomes following atrial fibrillation in patients with acute coronarysyndromes with or without ST-segment elevation. Heart 2008; 94 : 867 – 873. doi: 10.1136/ hrt.2007.134486.
3. Rubboli A, Schlitt A, Kiviniemi T et al. One-year outcome of patients with atrial fibrillation undergoing coronary artery stenting: an analysis of the AFCAS registry. Clin Cardiol 2014; 37 : 357 – 364. doi: 10.1002/ clc.22254.
4. Rene AG, Genereux P, Ezekowitz M et al. Impact of atrial fibrillation in patients with ST-elevation myocardial infarction treated with percutaneous coronary intervention (from the HORIZONS-AMI [Harmonizing Outcomes With Revascularization and Stents in Acute Myocardial Infarction] trial). Am J Cardiol 2014; 113 : 236 – 242. doi: 10.1016/ j.amjcard.2013.09.016.
5. Windecker S, Kolh P, Alfonso F et al. 2014 ESC/ EACTS Guidelines on myocardial revascularization: The task force on myocardial revascularization of the European Society of Cardiology (ESC) and the European Association for Cardio-Thoracic Surgery (EACTS) Developed with the special contribution of the European Association of Percutaneous Cardiovascular Interventions (EAPCI). Eur Heart J 2014; 35 : 2541 – 2619. doi: 10.1093/ eurheartj/ ehu278.
6. Lip GY, Windecker S, Huber K et al. Management of antithrombotic therapy in atrial fibrillation patients presenting with acute coronary syndrome and/ or undergoing percutaneous coronary or valve interventions: a joint consensus document of the European Society of CardiologyWorking Group on Thrombosis, European Heart Rhythm Association (EHRA), European Association of Percutaneous Cardiovascular Interventions (EAPCI) and European Association of Acute Cardiac Care (ACCA) endorsed by the Heart RhythmSociety (HRS) and Asia-Pacific Heart Rhythm Society (APHRS). Eur Heart J 2014; 35 : 3155 – 3179. doi: 10.1093/ eurheartj/ ehu298.
7. Gorenek B, Blomstrom Lundqvist C, Brugada Terradellas J et al. Cardiac arrhythmias in acute coronary syndromes: position paper from the joint EHRA, ACCA, and EAPCI task force. Europace 2014; 16 : 1655 – 1673. doi: 10.1093/ europace/ euu208.
8. Hurlen M, Abdelnoor M, Smith P et al. Warfarin, aspirin, or both after myocardial infarction. N Engl J Med 2002; 347 : 969 – 974.
9. Fiore LD, Ezekowitz MD, Brophy MT et al. Department of veterans affairs cooperative studies program clinical trial comparing combined warfarin and aspirin with aspirin alone in survivors of acute myocardial infarction: primary results of the CHAMP study. Circulation 2002; 105 : 557 – 563.
10. The Organization to Assess Strategies for Ischemic Syndromes (OASIS) Investigators. Effects of long-term, moderate-intensity oral anticoagulation in addition to aspirin in unstable angina. J Am Coll Cardiol 2001; 37 : 475 – 484.
11. Coumadin Aspirin Reinfarction Study (CARS) Investigators. Randomised double-blind trial of fixed low-dose warfarin with aspirin after myocardial infarction. Lancet 1997; 350 : 389 – 396.
12. Lip GY. Don’t add aspirin for associated stable vascular disease in a patient with atrial fibrillation receiving anticoagulation. BMJ 2008; 336 : 614 – 615. doi: 10.1136/ bmj.39351.706586.AD.
13. Lamberts M, Gislason GH, Lip GY et al. Antiplatelet therapy for stable coronary artery disease in atrial fibrillation patients taking an oral anticoagulant: a nationwide cohort study. Circulation 2014; 129 : 1577 – 1585. doi: 10.1161/ CIRCULATIONAHA.113.004834.
14. Sorensen R, Hansen ML, Abildstrom SZ et al. Risk of bleeding in patients with acute myocardial infarction treated with different combinations of aspirin, clopidogrel, and vitamin K antagonists in Denmark: a retrospective analysis of nationwide registry data. Lancet 2009; 374 : 1967 – 1974. doi: 10.1016/ S0140-6736(09)61751-7.
15. Lamberts M, Olesen JB, Ruwald MH et al. Bleed-ing after initiation of multiple antithrombotic drugs, including triple therapy, in atrial fibrillation patients following myocardial infarction and coronary intervention: a nationwide cohort study. Circulation 2012; 126 : 1185 – 1193. doi: 10.1161/ CIRCULATIONAHA.112.114967.
16. Dewilde WJ, Oirbans T, Verheugt FW et al. Use of clopidogrel with or without aspirin in patients taking oral anticoagulant therapy and undergoing percutaneous coronary intervention: an open-label, randomised, controlled trial. Lancet 2013; 381 : 1107 – 1115. doi: 10.1016/ S0140-6736(12)62177-1.
17. Fiedler KA, Byrne RA, Schulz S et al. Rationale and design of The Intracoronary Stenting and Antithrombotic Regimen-Testing of a six-week versus a six-month clopidogrel treatment Regimen In Patients with concomitant aspirin and oraL anticoagulant therapy following drug-eluting stenting (ISAR-TRIPLE) study. Am Heart J 2014; 167 : 459 – 465. doi: 10.1016/ j.ahj.2014.01.005.
18. Oldgren J, Budaj A, Granger CB et al. Dabigatran vs. placebo in patients with acute coronary syndromes on dual antiplatelet therapy: a randomized, double-blind, phase II trial. Eur Heart J 2011; 32 : 2781 – 2789. doi: 10.1093/ eurheartj/ ehr113.
19. Oldgren J, Wallentin L, Alexander JH et al. New oral anticoagulants in addition to single or dual antiplatelet therapy after an acute coronary syndrome: a systematic review and meta-analysis. Eur Heart J 2013; 34 : 1670 – 1680. doi: 10.1093/ eurheartj/ eht049.
20. Wallentin L, Becker RC, Budaj A et al. Ticagrelor versus clopidogrel in patients with acute coronary syndromes. N Engl J Med 2009; 361 : 1045 – 1057. doi: 10.1056/ NEJMoa0904327.
21. Wiviott SD, Braunwald E, McCabe CH et al. Prasugrel versus clopidogrel in patients with acute coronary syndromes. N Engl J Med 2007; 357 : 2001 – 2015.
22. Bonaca MP, Bhatt DL, Cohen M et al. Long-term use of ticagrelor in patients with prior myocardial infarction. N Engl J Med 2015; 372 : 1791 – 1800. doi: 10.1056/ NEJMoa1500857.
23. Uchino K, Hernandez AV. Dabigatran association with higher risk of acute coronary events: meta-analysis of noninferiority randomized controlled trials. Arch Intern Med 2012; 172 : 397 – 402. doi: 10.1001/ archinternmed.2011.1666.
24. US Food and Drug Administration DSC. FDA Drug Safety Communication: FDA study of Medicare patients finds risks lower for stroke and death but higher for gastrointestinal bleeding with Pradaxa (dabigatran) compared to warfarin. Available from: http:/ /www.fda.gov/ Drugs/DrugSafety/ ucm396470.htm.
25. Mega JL, Braunwald E, Wiviott SD et al. Rivaroxaban in patients with a recent acute coronary syndrome. N Engl J Med 2012; 366 : 9 – 19. doi: 10.1056/ NEJMoa1112277.
26. Vranckx P, Verheugt FW, de Maat MP et al. A randomised study of dabigatran in elective percutaneous coronary intervention in stable coronary artery disease patients. EuroIntervention 2013; 8 : 1052 – 1060. doi: 10.4244/ EIJV8I9A162.
27. Ferguson JJ, Califf RM, Antman EM et al. Enoxaparin vs unfractionated heparin in high-risk patients with non-ST-segment elevation acute coronary syndromes managed with an intended early invasive strategy: primary results of the SYNERGY randomized trial. JAMA 2004; 292 : 45 – 54.
28. Alexopoulos D, Xanthopoulou I, Gkizas Vet al. Randomized assessment of ticagrelor versus prasugrel antiplatelet effects in patients with ST-segment-elevation myocardial infarction. Circ Cardiovasc Interv 2012; 5 : 797 – 804. doi: 10.1161/ CIRCINTERVENTIONS.112.972323.
29. Alexander JH, Lopes RD, Thomas L et al. Apixaban vs. warfarin with concomitant aspirin in patients with atrial fibrillation: insights from the ARISTOTLE trial. Eur Heart J 2014; 35 : 224 – 232. doi: 10.1093/ eurheartj/ eht445.
30. De Caterina R, Husted S, Wallentin L et al. New oral anticoagulants in atrial fibrillation and acute coronary syndromes: ESC working group on thrombosis-task force on anticoagulants in heart disease position paper. J Am Coll Cardiol 2012; 59 : 1413 – 1425. doi: 10.1016/ j.jacc.2012.02.008.
31. Fox KA, Dabbous OH, Goldberg RJ et al. Prediction of risk of death and myocardial infarction in the six months after presentation with acute coronary syndrome: prospective multinational observational study (GRACE). BMJ 2006; 333 : 1091.
32. Camm AJ, Kirchhof P, Lip GY et al. Guidelines for the management of atrial fibrillation: the task force for the management of atrial fibrillation of the European Society of Cardiology (ESC). Europace 2010; 12 : 1360 – 1420. doi: 10.1093/ europace/ euq350.
33. Camm AJ, Lip GY, De Caterina R et al. 2012 focused update of the ESC Guidelines for the management of atrial fibrillation: an update of the 2010 ESC Guidelines for the management of atrial fibrillation. Developed with the special contribution of the European Heart Rhythm Association. Europace 2012; 14 : 1385 – 1413.
34. Connolly S, Pogue J, Hart R et al. Clopidogrel plus aspirin versus oral anticoagulation for atrial fibrillation in the Atrial fibrillation Clopidogrel Trial with Irbesartan for prevention of Vascular Events (ACTIVE W): a randomised controlled trial. Lancet 2006; 367 : 1903 – 1912.
35. Gibson CM, Chakrabarti AK, Mega J et al. Reduction of stent thrombosis in patients with acute coronary syndromes treated with rivaroxaban in ATLAS-ACS 2 TIMI 51. J Am Coll Cardiol 2013; 62 : 286 – 290. doi: 10.1016/ j.jacc.2013.03.041.
36. Čihák R, Haman L, Heinc P. Summary of the 2012 focused upadate of the ESC Guidelines for management of AF. Prepared by the Czech Society of Cardiology. Cor Vasa 2012; 54: e341 – e351.
37. Graham DJ, Reichman ME, Wernecke M et al. Cardiovascular, bleeding, and mortality risks in elderly Medicare patiens treated with dabigatran or warfarin for nonvalvular atrial fibrillation. Circulation 2015; 131 : 157 – 164. doi: 10.1161/ CIRCULATIONAHA.114.012061.
Štítky
Dětská kardiologie Interní lékařství Kardiochirurgie Kardiologie
Článek vyšel v časopiseKardiologická revue – Interní medicína
Nejčtenější tento týden
2016 Číslo 1- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Jak nejlépe blokovat renin-angiotenzinový systém u nemocných s hypertenzí a diabetes mellitus?
- Infekční komplikace u pacientů s akutním srdečním selháním – přehled
- Přidružená onemocnění a jejich význam pro prognózu akutního srdečního selhání – AHEAD score
- Kardiálna kachexia
- Tělesný trénink a rehabilitace u srdečního selhání
- Kvalita života pacientů s akutní dekompenzací chronického systolického srdečního selhání hodnocená pomocí standardizovaných dotazníků
- Hyperurikémia, kardiovaskulárne choroby a srdcové zlyhávanie
- Antikoagulace, antiagregace nebo obojí u pacientů s ischemickou chorobou srdeční a fibrilací síní
- Místo sitagliptinu v léčbě pacientů s diabetem 2. typu po studii TECOS
- Na jaké hodnoty snižovat systolický krevní tlak? Studie SPRINT
- prof. MUDr. Jiří Vítovec, CSc., FESC (*25. 2. 1951)
- Evropský konsenzus k otázkám aterogenní dyslipidemie a kombinační léčbě statinem a fibrátem
- Inhibitory protonové pumpy – nové molekuly, nové poznatky
- Nové pohledy na patofyziologii, diagnostiku a léčbu srdečního selhání se zachovanou ejekční frakcí
- Kardiologická revue – Interní medicína
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Inhibitory protonové pumpy – nové molekuly, nové poznatky
- Antikoagulace, antiagregace nebo obojí u pacientů s ischemickou chorobou srdeční a fibrilací síní
- Kardiálna kachexia
- Hyperurikémia, kardiovaskulárne choroby a srdcové zlyhávanie
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



