-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Specifika klinických hodnocení léčiv časných fází I a II
Specifika klinických hodnocení léčiv časných fází I a II
Drug research and development is a challenging and highly regulated process carried out according to Good Clinical Practice. The effectiveness of new drugs or new therapeutic combinations, including the safety data, has to be demonstrated in large controlled trials before registration. All these trials must be conducted in accordance with globally recognized standards for the conduct of clinical trials. Early stage clinical trials phase I and II follow the preclinical experiments and have their own specifics. Phase I clinical trials usually enroll healthy volunteers; patients are enrolled only in exceptional cases. The primary endpoint of these studies is to establish the recommended dose for subsequent phase II trials. Dose escalation takes into account also the results of preclinical testing and is planned based on the principle of minimizing risks for the study subjects. Important parts of the early phases of clinical trials are also pharmacokinetic and/ or pharmacogenetic studies as well as the evaluation of adverse drug reactions.
Key words:
clinical trials – drug development – pharmacokinetics – phase I and II
Autoři: R. Demlová 1,2; H. Kostková 1; L. Součková 1
Působiště autorů: Farmakologický ústav, LF MU, Brno2 Masarykův onkologický ústav, Brno 1
Vyšlo v časopise: Kardiol Rev Int Med 2015, 17(1): 87-91
Kategorie: Interní medicína
Souhrn
Výzkum a vývoj nových léčiv představuje náročný a vysoce regulovaný proces, který probíhá dle zásad Správné klinické praxe. Účinnost nového léčiva nebo nové léčebné kombinace, a to samozřejmě včetně průkazu bezpečnosti, musí být před svou registrací a uvedením do reálné klinické praxe prokázána v rozsáhlých kontrolovaných studiích, které jsou naplánovány a prováděny v souladu se všemi celosvětově uznávanými pravidly pro provádění klinických hodnocení. Klinická hodnocení časných fází I a II navazují na preklinické experimenty a mají svá specifika. Do klinických hodnocení fází I jsou obvykle zařazováni zdraví dobrovolníci, pouze ve výjimečných případech pacienti. Primárním cílem těchto studií je stanovení doporučené dávky pro následné studie fáze II. Postupná eskalace dávky vychází i z preklinického testování a je plánována na principu minimalizace rizika pro subjekty hodnocení. Součástí časných fází klinických hodnocení je i studium farmakokinetiky, případně farmakogenetiky, a stanovení nežádoucích účinků léčiva.
Klíčová slova:
klinické hodnocení – vývoj léčiv – farmakokinetika – fáze I a IIHistorie regulace klinických hodnocení léčivých přípravků
Klinická hodnocení jsou zcela neodmyslitelně spojena s výzkumem a vývojem nových, zejména inovativních léčiv a jejich zaváděním do reálné klinické praxe. Pojem „inovace“ se objevil již na začátku 20. století, kdy jej poprvé použil ekonom Josef Alois Schumpeter [1]. Tento pojem se stal základem pro pojmenování farmaceutického průmyslu, jenž má svou základnu postavenou na vývoji přípravků obsahujících buď zcela novou účinnou látku, nebo novou kombinaci účinných látek. Inovativní mohou být také pomocné látky k již dříve objevené účinné látce, které zvyšují účinnost a bezpečnost léku. Inovace léku může spočívat i v nové lékové formě, která může zlepšit farmakokinetický profil léčiva a snížit jeho nežádoucí účinky.
S rozvojem farmaceutického průmyslu a novými léčivými přípravky přicházejícími na trh začaly samozřejmě vyvstávat i otázky etické. Nové přípravky měly nejen pozitivní, ale mnohdy i negativní efekt na zdraví lidí. To rychle vedlo k situaci, kdy, stejně jako v ostatních oblastech činnosti, začala být vládami stanovována pravidla, jež měla dát této citlivé oblasti větší řád a omezit negativní dopady. Po druhé světové válce vytvořil v Evropě příchod systémů zdravotní péče mnohem více strukturovaný systém, a to i pro předepisování léků a jejich úhrady. Rok 1957 přinesl ve Velké Británii první stanovení cen, což v podstatě umožnilo přiměřenou návratnost investic pro výrobce léků a přineslo motivaci investovat do léků nových. Tato větší role státu v oblasti zdravotnictví byla paralelní na obou stranách Atlantiku a projevila se rostoucí vládní regulací farmaceutického průmyslu. V roce 1961 došlo k velkému bezpečnostnímu skandálu, a to po užívání přípravku Contergan (thalidomid). Thalidomid byl používán od roku 1956 jako lék na ranní nevolnost u těhotných žen. V roce 1961 se objevily první zprávy o výskytu těžkých malformací (chybění celých končetin nebo jejich částí, malformace ucha a vnitřností) u mnohých novorozenců, jejichž matky užívaly thalidomid během těhotenství. USA zůstaly ušetřeny, protože FDA používání thalidomidu nepovolila. Na základě thalidomidové tragédie vydal kongres Spojených států amerických nařízení vztahující se k testování léčivých přípravků v průběhu těhotenství. Regulační autorita pro léčiva a potraviny Spojených států amerických (FDA – Food and Drug Administration) zareagovala v roce 1962 přijetím Kefauver ‑ Harrisova dodatku k Zákonu o potravinách, léčivech a kosmetice (FFDCA – Federal Food, Drug, and Cosmetic Act) z roku 1938. V tomto dodatku poprvé nacházíme legislativní požadavek na použití informovaného souhlasu, hlášení nežádoucích účinků a prokazování účinnosti přípravku. Vydáním tohoto dodatku došlo ke zpřísnění ohodnocení předkládané dokumentace ve smyslu nejen bezpečnosti, ale také účinnosti. Evropské státy zareagovaly na aktuální celosvětovou situaci, která byla ovlivněna thalidomidovou tragédií, vytvořením dokumentu Helsinské deklarace (1964). Od 60. let minulého století se tak regulace v oblasti výzkumu a vývoje léčiv poměrně intenzivně rozvíjí až do své dnešní podoby. Současný trend vývoje nových léčiv je charakterizován zejména posunem od „jednodušších, chemicky definovaných molekul“ až k dnešní cílené léčbě a léčivým přípravkům pro moderní terapie, jako jsou somatobuněčná a genová terapie nebo produkty tkáňového inženýrství. Tím se mění pohled na regulaci léčivých přípravků jako takový. Biotechnologická léčiva a jejich biosimilars a léčivé přípravky pro moderní terapie jsou i v současnosti velkou výzvou a další posun v této oblasti jistě přinese řadu nových otázek i pro oblast klinických hodnocení.
Výzkum a vývoj léčivých přípravků
Současné standardy léčby a doporučené farmakoterapeutické postupy se v dnešní době „medicíny založené na důkazech“ opírají o výsledky randomizovaných klinických studií a stejně tak opačně platí, že pozitivní výsledky správně naplánovaných, kontrolovaných multicentrických studií mohou změnit standardy v dosavadní léčbě.
Současně platí, že každý léčivý přípravek podléhá před uvedením na trh registraci. V rámci registračního procesu se posuzuje dokumentace, ve které budoucí držitel registračního rozhodnutí prokazuje bezpečnost, účinnost a kvalitu přípravku. Posuzují se také indikace, kontraindikace, dávkování přípravku, klasifikace pro výdej, ale i příbalová informace pro pacienta a návrh textů na obal léčivého přípravku. Součástí rozhodnutí o registraci je souhrn údajů o přípravku (SPC), který slouží lékařům a zdravotnickým odborníkům jako klíčový zdroj informací o léčivém přípravku.
Z výše uvedeného vyplývá, že účinnost nového léčiva nebo nové léčebné kombinace, a to samozřejmě včetně průkazu bezpečnosti, musí být před svou registrací a uvedením do reálné klinické praxe prokázána v rozsáhlých kontrolovaných studiích, které jsou naplánovány a prováděny v souladu se všemi celosvětově uznávanými pravidly pro provádění klinických hodnocení. Výsledkem takto naplánovaných studií by pak mělo být jednoznačné definování cílové skupiny pacientů, pro kterou má nová léčba největší přínos, zhodnocení bezpečnostního profilu včetně uvedení očekávaných nežádoucích účinků léčiva a vyhodnocení poměru přínosu a rizik při použití nového léčiva v širší klinické praxi.
Konkrétní klinické hodnocení je pak prováděno v souladu s protokolem dané studie, kde je definován primární cíl studie (s vhodnými cílovými parametry), kritéria pro zařazení vhodných pacientů (neboli subjektů klinického hodnocení, použijeme‑li správnou terminologii), detailně je definován léčebný plán, který obsahuje mnoho dalších kapitol, jejichž výčet je dán platnou legislativou a mezinárodně harmonizovanými pravidly Správné klinické praxe (Good Clinical Practice) [2]. Neméně podstatná je také struktura a obsah statistické části protokolu klinického hodnocení, který rovněž vychází z platné legislativy a mezinárodně pojatých pravidel Správné statistické praxe [3].
Fáze vývoje nového léčiva
Pro klasifikaci jednotlivých etap vývoje léčiva do základních skupin odlišujících se významně svým uspořádáním je možné použít různé pohledy a metodické přístupy, přičemž tím zcela nejzákladnějším je dělení podle pozice daného experimentu. Tento vývoj můžeme standardně dělit na dvě základní fáze, a to na fázi preklinickou a fázi klinickou.
V preklinické fázi, tedy vývoji léčiv až do fáze prvního podání lidskému subjektu, se využívají nejčastěji experimenty na zvířecích modelech, ať již na celém zvířeti nebo na izolovaných orgánech. Preklinické zkoušky by měly poskytnout zejména údaje vztahující se k akutní, subakutní, subchronické a chronické toxicitě, toxokinetice a bezpečnostní farmakologii léčiva. Současně mohou být na základě pilotních výsledků předcházejících studií nebo typu léčiva požadovány další specifické testy testující například reprodukční a vývojovou toxicitu, genotoxicitu, karcinogenitu nebo lokální toxicitu, fototoxicitu či imunotoxicitu. Kromě výše uvedených testů je třeba doplnit ještě další údaje, jako jsou maximální tolerovaná dávka (= maximální dávka bez specifikovaného toxického účinku), minimální letální dávka (= nejmenší dávka, která způsobí letální účinek; tato hodnota může být nahrazena hodnotou LD05, tj. dávka, která usmrtí 5 % pokusných zvířat) apod. K provedení všech zkoušek a analýz je navíc zapotřebí 2 – 5 let. Tak jako v případě Správné klinické praxe i Správné statistické praxe existují dokumenty ICH S 1 – 9 a ICH M 3 (The International Conference on Harmonisation of Technical Requirements for Registration of Pharmaceuticals for Human Use) [4], které se zabývají obecnými principy preklinického testování včetně hodnocení bezpečnosti. Definují i požadavky na časovou posloupnost a vyhodnocení preklinických testů před zahájením jednotlivých fází klinických hodnocení.
Celý proces klinického hodnocení (klinických studií) je pak tradičně dělen na čtyři fáze, přičemž fáze I – III předcházejí následné případné registraci léčiva (tab. 1). Z hlediska informačního lze studie méně tradičně rozdělit na studie explorační a studie konfirmační.
Tab. 1. Tradiční dělení jednotlivých fází klinických hodnocení. 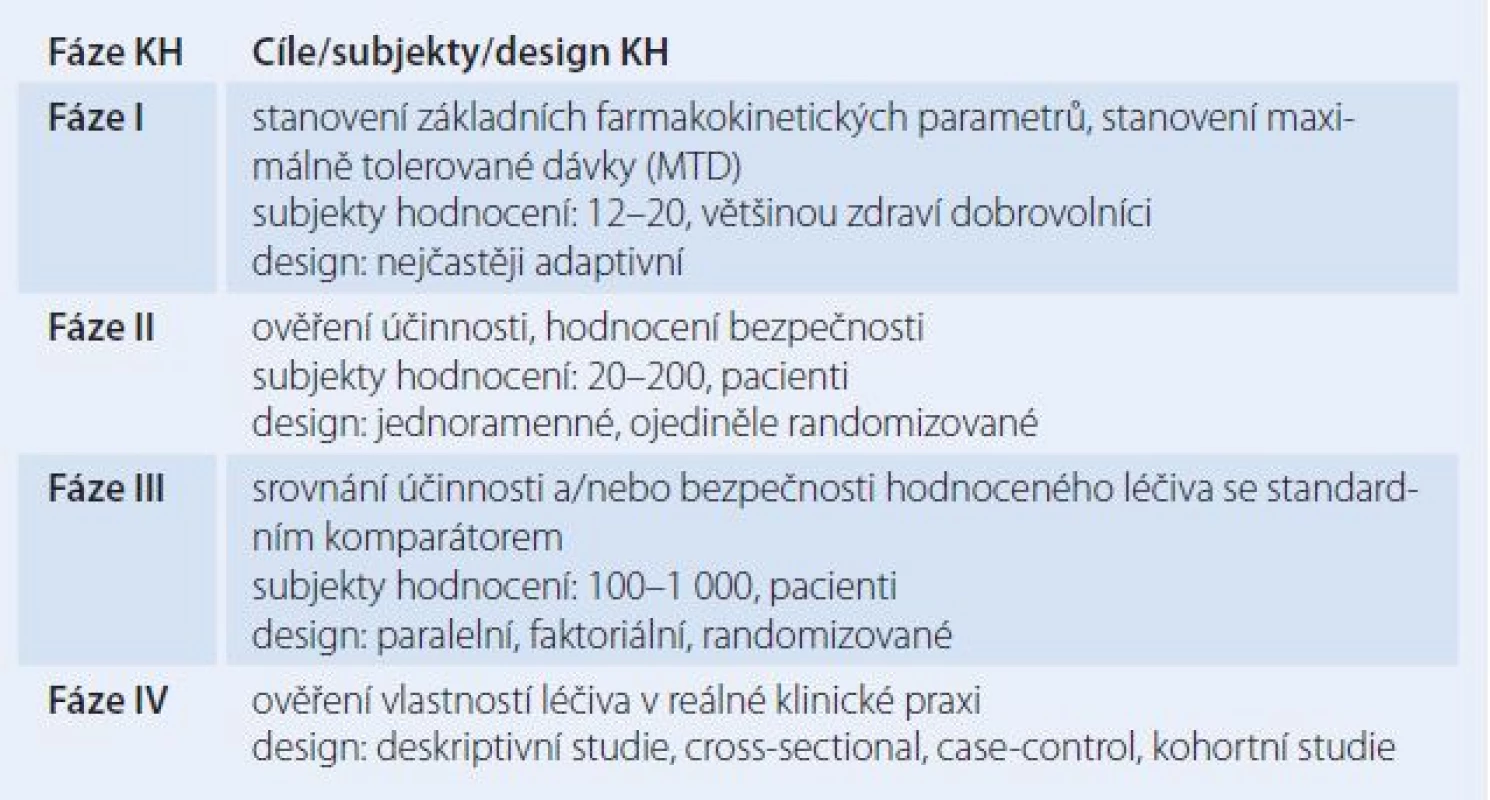
Explorační studie nemusí vycházet z testované hypotézy, mohou být vedeny retrospektivně nebo prospektivně, mohou, ale nemusí srovnávat dvě nebo více skupin. Informace získané z těchto exploračních fází klinického výzkumu pak mohou přispět a často i výrazně napomoci zhodnocení efektu i bezpečnosti nového léčiva. Toto se ukazuje velmi přínosné zejména v posledních letech, tedy v době zavádění nových cílených molekul neboli tzv. biologické léčby, kdy se zvyšuje potřeba odhalit „vhodné“ prediktivní markery pro účinek takto působících léčiv.
Faktem zůstává, že průkazné závěry lze pak učinit až na základě optimalizovaných randomizovaných konfirmačních studií, které jsou také uznávány všemi regulatorními orgány při závěrečném posuzování nového léčiva. Konfirmační studie představují kontrolovaný optimalizovaný systém založený na srovnání různých léčebných postupů, většinou současného standardního a experimentálního ramene léčby.
Pokud bychom se vrátili k tradičnímu dělení, pak celý proces klinického hodnocení dělíme na fázi I – IV. V našem článku se chceme podrobněji věnovat zejména specifikům tzv. časných fází klinických hodnocení, dle tradičního dělení tedy fázím I a II.
Fáze I a II klinických hodnocení a jejich specifika
Klinická hodnocení fáze I navazují bezprostředně na preklinické experimenty. Jedná se tedy o studie, ve kterých je nově vyvíjený léčivý přípravek poprvé podán lidským subjektům, nejčastěji zdravým dobrovolníkům. V případě, že by podání hodnoceného léčiva nebylo pro zdravé dobrovolníky bezpečné, respektive pokud lze očekávat závažnou toxicitu (například v případě cytostatik), jsou subjekty hodnocení i v rámci fází I pacienti [5].
Klinické studie fáze I jsou designovány s cílem prokázat farmakologické působení u lidských subjektů, hodnotit nežádoucí účinky spojené se zvyšující se dávkou podávaného léčiva a v případě zapojení pacientů může být sekundárním hodnoceným parametrem i pilotní průkaz účinnosti. Ten však není primárním cílem studií fáze I a jeho hodnocení je zařazeno do fází II a III. Počty zařazovaných subjektů jsou nízké (desítky subjektů). V této fázi bývá také nejčastějším hodnoceným primárním cílem stanovení tzv. maximální tolerovatelné dávky (MTD), kterou je možné definovat jako takovou dávku přípravku, při které jsou projevy toxicity ještě akceptovatelné, případně zvládnutelné ošetřujícím personálem. Taková dávka přípravku, která již způsobuje nepřípustné a nezvládnutelné projevy toxicity, se označuje jako tzv. dávku limitující toxicita (DLT – dose limiting toxicity).
Na základě exaktně stanovené MTD v projektech fáze I se stanovují optimální dávkovací režimy hodnoceného přípravku pro testování v následných fázích klinického hodnocení zaměřených již především na analýzu účinnosti (fáze II – III). Pro správnou interpretaci a pochopení významu MTD je důležité si uvědomit relativnost tohoto pojmu především v závislosti na předpokládané indikaci hodnoceného přípravku. Je evidentní, že pro dosažení požadované účinnosti, např. u cytostatik v onkologii, bude akceptována významně vyšší míra přípustné toxicity než při léčbě méně závažných onemocnění. V těchto případech je nutné při použití přípravku v účinné koncentraci počítat s aktivní kontrolou projevů toxicity. Dále je nutné si uvědomit, že stanovení MTD v rámci klinického hodnocení fáze I je determinováno populací subjektů hodnocení (zdravých dobrovolníků nebo pacientů), na kterých byla studie provedena. Pro většinu studií fáze I s cytostatiky platí, že jsou z důvodu charakteru podávaného hodnoceného léčiva prováděny za účasti pacientů, což klade významné nároky na provádění studie nejen z hlediska odborného a organizačního, ale také z hlediska etického.
Zásadní informací ve vztahu k zařazovaným subjektům hodnocení je skutečnost, že do těchto experimentů nemohou být zařazovány tzv. vulnerabilní osoby definované jako subjekty, u kterých účast v klinickém hodnocení nemusí být dána pouze projevem jejich svobodné vůle, ale může být vynucena jinou autoritou (např. vojáci, lidé v nápravných zařízeních apod.).
Z hlediska studia farmakologie hodnoceného léčiva jsou součástí klinických studií fáze Istudie hodnotící farmakokinetiku léčiva, tzv. PK ‑ studie, ať již jako substudie dané fáze Inebo jako samostatně vedené studie farmakokinetiky. Farmakokinetika se zabývá studiem osudu léčiv v organizmu v čase po jejich podání. K vyvolání účinku léčiva je nezbytné, aby se jeho aktivní forma dostala na místo účinku. Po podání léčiva do organizmu následuje řada dějů, které ve svých důsledcích ovlivňují, jak velké množství látky interaguje se specifickými receptory a je takto dostupné pro následné vlastní farmakodynamické působení. Mezi tyto děje řadíme její absorpci, distribuci, metabolickou přeměnu a vylučování. Všechny tyto farmakokinetické procesy také známe pod akronymem ADME (absorption, distribution, metabolism, excretion).
Z pohledu farmakokinetiky je zcela zásadní, jakou volíme cestu podání léčiva do organizmu. Léčivo lze podat přímo do krevního oběhu, a to nejčastěji intravenózní cestou, lze využít i intraarteriální aplikaci. Při podání jinými cestami se léčivo musí absorbovat z místa podání. Farmakokinetický parametr, který tento děj charakterizuje a který je rovněž klinicky významný, se nazývá biologická dostupnost (bioavailability). Udává rozsah, ve kterém léčivo dosáhne systémové cirkulace a následně pak místa svého účinku. Biologická dostupnost (F) je určována z poměru AUC (plocha pod křivkou – area under curve) pro perorální a AUC pro intravenózní podání stejné dávky (F = AUCp.o./ AUCi.v.).
Krví je léčivo transportováno z části ve volné formě a z části navázané na plazmatické proteiny či krevní elementy. Distribuce do cílových orgánů a tkání zahrnuje transport léčiva krví, prostup volné formy léčiva z intravaskulárního prostoru a vazbu léčiva v tkáních. V tkáních je léčivo přítomno opět ve volné formě (rozpuštěno v extracelulární nebo intracelulární tekutině) nebo ve formě vázané. Určitou představu o rozsahu distribuce můžeme získat pomocí distribučního objemu získaného jako poměr celkového množství léčiva v organizmu a jeho koncentrace v krvi (kterou změřit můžeme). Tím je distribuční objem (Vd). Jeho rozměrem je jednotka objemu obvykle vztažená na jednotku tělesné hmotnosti, tj. l/ kg.
Biotransformací rozumíme proces chemické přeměny látek v organizmu vedoucí k ukončení či změně biologické aktivity léčiva. Produktem biotransformace je metabolit, který může být inaktivní nebo naopak aktivnější než původní mateřská látka. Některá léčiva jsou podávána ve formě bez farmakodynamického účinku a teprve v procesu biotransformace se mění na účinný metabolit. Tyto látky se označují jako tzv. proléčiva (prodrug).
Hlavním orgánem biotransformace jsou játra, ale biotransformace samozřejmě probíhá i v dalších orgánech jako např. v trávicím traktu (např. peniciliny metabolizované v žaludku), v plicích, kůži či ledvinách. V játrech probíhá biotransformace uvnitř hepatocytů a jsou za ni zodpovědné jak volné, tak především mikrozomální enzymy (specifické enzymy umístěné na endoplazmatickém retikulu). Obecně lze rozdělit biotransformační procesy na dvě fáze:
Ve fázi I dochází k přeměně léčiva na polárnější metabolit připojením či odebráním funkčních skupin ( - OH, - NH2, -SH, - COOH). Jestliže je metabolit I. fáze dostatečně polární, může být snadno vyloučen ledvinami. Některé (málo polární) produkty I. fáze vstupují do fáze II, kde se konjugují s kyselinou glukuronovou, sírovou, octovou nebo s aminokyselinami glycinem či glutaminem za vzniku vysoce polárního metabolitu, který se již z organizmu vyloučí. Existují i látky, které vstupují přímo do II. fáze (obsahují funkční skupiny schopné přímé konjugace s výše uvedenými složkami) a teprve poté se stávají substrátem pro fázi I.
Mezi faktory, které mohou zásadně ovlivnit biotransformaci léčiv, patří faktory genetické. Existují značné interindividuální rozdíly v aktivitách například N ‑ acetyltransferázy nebo hydrolázy a z toho vyplývajícího dělení na tzv. pomalé a rychlé metabolizátory. Interindividuální rozdíly ve výskytu enzymů cytochromu P450 jsou zdrojem jevu nazvaného genetický polymorfizmus. Kromě genetických faktorů jsou významné také interakce při souběžném podávání dvou a více léčiv, které mohou být současně induktory nebo inhibitory mikrozomálních enzymů. Induktory zvyšují aktivitu mikrozomálních enzymů, zatímco inhibitory ji snižují. Při zvýšení aktivity se aplikovaná látka rychleji biotransformuje. Pokud je metabolit neúčinný či méně účinný, je při současném podání induktoru nutné podat i vyšší koncentraci látky k dosažení stejného účinku. Při podání inhibitoru naopak méně látky vyvolá stejný účinek. K dalším faktorů pak patří věk, pohlaví, stav výživy nebo souběžná onemocnění například jater nebo srdce. I tyto specifické farmakogenetické studie nebo studie hodnotící potenciální interakce mohou být součástí fází I klinických studií, vždy záleží na konkrétním léčivu.
Poslední fází je pak exkrece léčiv. Odstranění substance z vnitřního prostředí organizmu se odehrává hlavně v játrech a ledvinách, méně významně v plicích, střevě, slinných a potních žlázách atd. Exkreci látek do moči zprostředkují a modifikují tři základní děje – glomerulární filtrace, tubulární sekrece a tubulární reabsorpce. Exkrece léčiv z hepatocytů do žluče probíhá výlučně aktivním transportem proti výraznému koncentračnímu gradientu na kanalikulární membráně (žlučový pól hepatocytu) za účasti několika transportních proteinů. Vazba je substrátově specifická, proto může docházet při současném podání více léčiv k lékovým interakcím.
Uspořádání klinických hodnocení fáze I a výběr iniciální dávky
Uspořádání klinických hodnocení fáze I z hlediska náběru subjektů hodnocení vychází z nutnosti respektovat výše uvedené etické principy, tedy především minimalizaci celkového počtu zařazených subjektů. To znamená, že experiment je vždy zahájen s podáním takové dávky přípravku, o které víme (na základě provedených studií na zvířecích modelech), že je nižší než MTD, a teprve v případě, že po podání této dávky není u subjektů hodnocení toxicita zjištěna, dávku můžeme postupně zvyšovat podle předem stanoveného postupu (dávkovací stupnice). Výchozí dávka bývá nejčastěji exaktně odvozena z preklinických studií (studií na zvířecích modelech) a je to vždy taková dávka, kterou považujeme pro podání člověku za bezpečnou. V anglické terminologii je označována zkratkou MRSD (maximum recommended starting dose). Výše této dávky je odvozena z dávky podané v animálním experimentu u nejvhodnějšího species, která nezpůsobila žádné pozorované nežádoucí účinky (NOAELs – no ‑ observed adverse effect levels). Následná konverze na vstupní dávku do klinického hodnocení (HED – human equivalent dose) se pak provádí dle doporučených přepočtů. Například pro systémově podávané léčivo se vychází z rovnice, která zohledňuje povrch těla: HED = animal NOEL x (Wanimal/ Whuman)(1– b), kde W je váha v kg a b odpovídá hodnotě 0,67 jako korekčnímu faktoru mezi mg/ kg a mg/ m2 [6].
Následné dávky jsou nejčastěji kalkulovány tak, že se postupně snižuje nárůst vlastní dávky (vztah tedy není lineární), např. podle následujícího schématu:
první dávka a1, dále a2 = 2a1, a3 = 1,67a2, a4 = 1,5a3, a5 = 1,4a4, dále pak ak + 1 = 1,33ak. Tato posloupnost dávek bývá někdy označována jako modifikovaná Fibonacciho stupnice. V některých případech se pro odstupňování dávky používá logaritmické škály (vstupní dávka a1, a2 = 10a1, a3 = 100a1...). Pro klinická hodnocení fáze I se nejčastěji používají tzv. jednostupňové up‑ and‑ down designy, mezi kterými je možné rozlišit tři základní typy, a to tzv. design A, B a D.
Fáze II klinických hodnocení
Jestliže primárním cílem klinického hodnocení fáze I je stanovení MTD, a tedy stanovení optimálního dávkovacího režimu pro další testování hodnoceného léčiva, ve studiích fáze IIje naším cílem zhodnocení účinnosti. Výsledky těchto experimentů jsou významným rozhodovacím bodem žadatele o registraci léčivého přípravku pro jeho testování v dalších fázích. Každý krok testování je značně finančně a organizačně náročný, a je proto nutné testovat jen přípravky se skutečně velmi nadějnými vlastnostmi. Hlavním cílem této fáze testování je tedy neukončit je v případě slibné účinnosti, a naopak ukončit je v případě průkazu účinnosti nedostatečné. V rámci studií fáze II se tedy hodnocené léčivo podává v dané indikaci určitému počtu vybraných, protokolem přesně definovaných nemocných (desítky až stovky). Ověřují se léčebné účinky na lidský organizmus, primárním cílem bývá hodnocení účinnosti, shromažďují se samozřejmě i data o bezpečnosti. Z hlediska hodnocení účinnosti je primární hodnocený parametr volen s ohledem na diagnózu, ve které je léčivo zkoušeno.
Subjekty hodnocení ve fázích II. Vzhledem k tomu, že v experimentech fáze II nám jde především o zhodnocení účinnosti v cílové skupině pacientů, zařazované subjekty již nejsou zdraví dobrovolníci, ale pacienti splňující vstupní kritéria daná protokolem. Počet subjektů zde bývá vyšší než v experimentech fáze I, zpravidla jsou to stovky subjektů a nábor probíhá po skupinách.
Uspořádání klinických hodnocení fáze II
V experimentech fáze II se používají dva základní typy uspořádání, a to experimenty jednoramenné a dvouramenné.
- a) Jednoramenné uspořádání – v souladu s optimálním dvoustupňovým designem je experiment uspořádán tak, že je zařazena vstupní skupina subjektů (n1), u které je vyhodnocen podíl respondentů na léčbu, a pokud je tento podíl nižší než předpokládaný (r1), experiment je ukončen. V opačném případě je do experimentu zařazena skupina dalších subjektů (n2) a celková účinnost je následně vyhodnocena na celkovém souboru pacientů definována jako N = n1 + n2. V této fázi experimentů se používají i např. trojstupňové designy, filozofie provedení je však zřejmá z výše uvedeného příkladu experimentu dvoustupňového.
- b) Víceramenné randomizované uspořádání – v některých klinických hodnoceních se používá randomizace i v experimentech fáze II. Tento krok je relativně neobvyklý, zvláště když si uvědomíme, že hlavním smyslem těchto testů je pouze výběr přípravku s nadějnou účinností pro jeho testování v dalších fázích klinického výzkumu. Naproti tomu v experimentech fáze III, kde se randomizace běžně používá, nám jde především o srovnání účinnosti a bezpečnosti s kontrolní skupinou. Při použití randomizace v experimentech fáze II se tedy postupuje tak, že se zvolí více přípravků s nadějnou účinností a do další fáze testování se postoupí pouze ten, který má nejvyšší účinnost ve srovnání se všemi ostatními hodnocenými.
Etické principy a závěr
Klinický výzkum stejně jako preklinický experiment je nenahraditelnou součástí pokroku v medicíně. Pro všechny typy klinického výzkumu platí fakt, že se jej účastní člověk, tzv. subjekt hodnocení, ať již zdravý dobrovolník při provádění fází I klinických hodnocení nebo častěji pacient v rámci klinických hodnocení fáze II – IV.
Z etického pohledu musí být jednoznačně dodrženo to, že riziko, kterému je subjekt hodnocení vystaven, nesmí být vysoké a nesmí rozhodně převýšit jeho prospěch. Vzhledem k tomu, že etická stránka klinických hodnocení je nesmírně složitá, bylo třeba stanovit jasná pravidla, při kterých jsou dodržována základní lidská práva, při kterých se neopakují „experimenty“ na lidech a při kterých jsou subjekty hodnocení rovnoprávnými účastníky celého procesu.
Na druhé straně je třeba si uvědomit, že žádný kodex není schopen zajistit bezpečnost pro všechny. To, co jednomu prospívá, může jinému škodit. Co je v zájmu společnosti, ještě nemusí být v zájmu jednotlivce, zejména pokud se má stát výzkumným subjektem. Proto také není možno vytvořit absolutně platný, do detailů rozpracovaný návod na etické posuzování klinického výzkumu, ale je třeba mít stále na mysli samotnou podstatu lékařského povolání a apelovat na morální chování klinických výzkumníků. Etické principy klinického hodnocení léčiv tedy vychází z respektování základních lidských práv. Při etických úvahách o klinickém experimentu je třeba respektovat lidskou důstojnost, psychickou i fyzickou integritu a míru prospěšnosti pro danou osobu. Zájmy jedince je třeba upřednostňovat nad zájmy vědeckými a společenskými, a to platí i pro časné fáze klinických hodnocení fáze I a II.
Tato práce byla podpořena projektem RECAMO CZ.1.05/2.1.00/03.0101 a projekty velkých infrastruktur Lékařské fakulty Masarykovy univerzity ACIU LM 2011017 a CZECRIN LM2013034.
Doručeno do redakce: 11. 1. 2015
Přijato po recenzi: 21. 1. 2015
MUDr. Regina Demlová, Ph.D.
www.med.muni.cz
demlova@med.muni.cz
Zdroje
1. Sojka M. Dějiny ekonomických teorií. Praha: VŠE 1991.
2. ICH GCP Guidelines. Adopted by CPMP, July 1996, issued as CPMP/ICH/135/95/Step5, Explanatory Note and Comments to the above, issued as CPMP/768/97.
3. Redmond CK, Stephenson J, Colton T. Biostatistics in Clinical Trials. Chichester: Wiley: 2001.
4. The International Conference on Harmonisation of Technical Requirements for Registration of Pharmaceuticals for Human Use – ICH S 1-9 a ICH M 3. [online] Available from: http://www.ich.org/products/guidelines.html.
5. Demlová R, Obermannová R, Valík D et al. Phase Itrial in oncology – theory and practice. Klin Onkol 2012; 25 (Suppl 2): S98–S101.
6. Estimating the safe starting dose in clinical trials for therapeutics in adult healthy volunteers. Draft guidance. U.S. Department of Health and Human Services. Food and Drug Administration. Center for Druf Evaluation nad Research (CDER). Center for Biologics Evaluation and Research (CBER). December 2002. Pharmacology and Toxikology. [online] Available from: http://www.fda.gov/Drugs/DevelopmentApprovalProcess/default.htm.
Štítky
Dětská kardiologie Interní lékařství Kardiochirurgie Kardiologie
Článek Genetika kardiomyopatií
Článek vyšel v časopiseKardiologická revue – Interní medicína
Nejčtenější tento týden
2015 Číslo 1- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Vyšetření cerebrovaskulární rezervy u asymptomatických pacientů s významnou stenózou vnitřní karotické tepny
- Genetika kardiomyopatií
- Katetrizační léčba chronické stabilní ischemické choroby srdeční v současnosti
- Katetrizační uzávěr foramen ovale patens u potápěčů
- Katetrizační léčba fibrilace síní
- Srdeční resynchronizační terapie – kdy a u koho ji v současnosti indikovat?
- Není perikarditida jako perikarditida – kazuistika
- Studie Pegasus – duální antiagregace (ASA + ticagrelor) dlouhodobě po infarktu myokardu
- Nové studie dávají naději na zlepšení terapie aterosklerózy
-
Hlavolamy 2015
Propojení kardiologie a diabetologie - Vyhlášení výsledků autorské soutěže O nejlepší kazuistiku v roce 2014
- Vývoj a úkoly klinické farmakologie ve zdravotnické péči v ČR
- TDM antibiotik v klinické praxi
- prof. MUDr. Josef Veselka, CSc., FESC, FSCAI, FICA (*23. 3. 1965)
- TDM digoxinu v klinické praxi
- Patofyziologie a diagnóza obstrukce u hypertrofické kardiomyopatie
- Lékové interakce a současná klinická praxe
- Přímá perorální antikoagulancia – perspektivy terapeutického monitorování
- Klinická farmakologie antirevmatik
- Specifika klinických hodnocení léčiv časných fází I a II
- Význam TDM metotrexátu při terapii psoriázy
- Kardiologická revue – Interní medicína
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- TDM digoxinu v klinické praxi
- Lékové interakce a současná klinická praxe
- Srdeční resynchronizační terapie – kdy a u koho ji v současnosti indikovat?
- TDM antibiotik v klinické praxi
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



