-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Katetrizační léčba chronické stabilní ischemické choroby srdeční v současnosti
Current view on percutaneous treatment of chronic stable coronary artery disease
Current results of meta‑analyses and randomized trials have not brought any proof of superiority of PCI or medical therapy in reduction of nonfatal MI or all‑cause or cardiovascular mortality in patients with chronic stable oligosymptomatic coronary artery disease. Therefore, it is necessary to consider several sources of information in the therapeutic decision ‑ making process, such as individual clinical presentation, extent of ischemia or atherosclerosis. The evaluation of individual lesion or patient risk using modern invasive imaging methods and introduction of bioresorbable technologies may play a significant role in this field in the near future. The role of an interventional cardiologist in situations where randomized data are lacking is critical and is based on a responsible choice of appropriate diagnostic and therapeutic strategy considering the best risk/ benefit ratio for the patient.
Keywords:
coronary artery disease – percutaneous coronary intervention
Autoři: P. Hájek
Působiště autorů: Kardiologická klinika 2. LF UK a FN v Motole, Praha
Vyšlo v časopise: Kardiol Rev Int Med 2015, 17(1): 20-24
Kategorie: Kardiologická revue
Souhrn
Současné výsledky metaanalýz a randomizovaných studií neposkytují důkazy pro nadřazenost perkutánní koronární intervence či optimální farmakoterapie ve smyslu redukce mortality či rizika vzniku infarktu myokardu při léčbě chronické stabilní oligosymptomatické ischemické choroby srdeční. Při rozhodování o způsobu léčby je nezbytné zvážit další kritéria, kterými mohou být individuální klinická prezentace, rozsah ischemie či aterosklerotického postižení. Stanovení individuálního rizika léze, a tedy i pacienta pomocí moderních invazivních zobrazovacích metod a užití biodegradabilních technologií mohou v blízké budoucnosti sehrát na tomto poli významnou úlohu. Úloha intervenčního kardiologa současnosti v léčbě chronické stabilní ischemické choroby srdeční je při absenci definitivních randomizovaných dat zcela nezastupitelná a spočívá v uvážlivém a odpovědném výběru přiměřeného diagnostického a terapeutického postupu s nejlepším poměrem riziko vs prospěch pro pacienta.
Klíčová slova:
ischemická choroba srdeční – perkutánní koronární intervenceÚvod
Perkutánní koronární intervence (PCI) je dnes standardní a účinnou léčbou ischemické choroby srdeční (ICHS). Stala se základní metodou léčby akutního koronárního syndromu (AKS) a variantou kardiochirurgické revaskularizace při léčbě chronické stabilní ICHS. Katetrizační léčba ICHS prošla v posledních dekádách dynamickým rozvojem, řada otázek byla úspěšně odpovězena, řada problémů, zejména v léčbě chronické ICHS se symptomy dobře kontrolovanými optimální medikamentózní terapií (optimal medical treatment – OMT), však stále na své řešení čeká.
K významnému pokroku došlo v invazivní diagnostice a hodnocení koronárního postižení. Invazivní kardiolog současnosti si je vědom limitací koronární angiografie v hodnocení hemodynamické významnosti zúžení věnčitých tepen. V moderní katetrizační laboratoři je rutinně využívána metoda měření frakční průtokové rezervy (fractional flow reserve – FFR), která u pacientů se stabilní ICHS umožňuje rozhodnout selektivně pro každou větev koronární tepny o přítomnosti či absenci ischemie v daném povodí. Vezmeme‑li v úvahu, že chronická ICHS je ve většině případů pomalu progredujícím onemocněním s ročním rizikem úmrtí 1 – 2 % a že stent uložený do hemodynamicky nevýznamného zúžení přináší nemocnému nikoli prospěch [1], ale riziko spojené s invazivním výkonem, riziko trombózy ve stentu a riziko vyplývající z dlouhodobé antiagregační léčby, měli bychom akceptovat fakt, že by u stabilních pacientů žádný stent neměl být implantován bez průkazu ischemie alespoň neinvazivním, lépe však invazivním způsobem.
Výše zmíněná pomalá progrese koronární aterosklerózy neplatí bez výjimky. Ročně u méně než 7 % pacientů [2] dochází k rychlým změnám aterosklerotické léze, které se projevují buď rozvojem AKS, nebo významným zhoršením anginy pectoris. Příčinou je ruptura vulnerabilního aterosklerotického plátu, různá míra nasedající trombózy a následné hojení ruptury a organizace trombu. Toto zjištění je významným pokrokem v poznání patofyziologických dějů probíhajících na aterosklerotickém plátu. Byla určena patologicko‑anatomická podoba vulnerabilního plátu, jsou vyvíjeny metody detekující vulnerabilní plát in vivo a byl také podán důkaz o příčinné souvislosti vulnerabilního plátu a vzniku AKS.
Zásadní inovací v katetrizační léčbě se mohou stát biodegradabilní stenty či výztuže (bioresorbable vascular scaffold – BVS), které poté, co splní svůj úkol mechanického zprůchodnění tepny, vymizí z organizmu a teoreticky umožní obnovení fyziologického chování tepenné stěny, která byla nejdříve imobilizována aterosklerotickým procesem a pak kovovou „klecí“ stentu.
Funkční hodnocení významnosti koronárních stenóz, moderní způsoby detekce vulnerabilního plátu a zhodnocení účinnosti a bezpečnosti biodegradabilních stentů jsou klíčové úkoly moderního způsobu katetrizační léčby ICHS. Nejen individuální evaluace těchto nových technologií, ale posléze zejména vytváření nových algoritmů diagnostiky a léčby na základě jejich vzájemné integrace může být skutečnou revoluční změnou v přístupu k pacientům, jejichž onemocnění stále tvoří hlavní příčinu morbidity a mortality naší dospělé populace.
Perkutánní koronární intervence u pacientů se stabilní ICHS
V léčbě AKS byla prokázána jednoznačně účinnost PCI v redukci úmrtí i recidivy infarktu myokardu (IM) [3]. Také u pacientů s významnou symptomatologií navzdory OMT je PCI plně indikována [4]. V léčbě chronické, stabilní, farmakologicky dobře kontrolované ICHS stále stojíme před otázkou, zda PCI v této skupině pacientů vede k ovlivnění mortality či incidence IM, a pokud ne, zda jsme oprávněni vystavit stabilního pacienta byť i minimálnímu riziku spojenému s PCI. Význam tohoto problému podtrhuje fakt, že tito pacienti tvoří většinu vyšetření v katetrizačních laboratořích.
Výsledky tří recentních metaanalýz a detailní analýza tří často citovaných randomizovaných studií (COURAGE, FAME 2, BARI 2D) neprokázaly rozdíl v mortalitě (kardiovaskulární i celkové) či výskytu nefatálního IM při léčbě stabilní ICHS pomocí PCI vs OMT [5]. Tyto studie jsou zatíženy některými limitacemi, které brání tomu, aby mohly být brány jako definitivní důkaz identického významu PCI a OMT pro prognózu pacienta. Po provedení koronární angiografie bylo do studie COURAGE zařazeno méně než 10 % vyšetřených pacientů [6]. Pouze třetina pacientů zařazených do dílčí analýzy studující změnu ischemie během sledování pomocí perfuzní scintigrafie měla vstupně ischemii ≥ 10 % [7]. Šlo tedy o selektovanou, méně rizikovou skupinu nemocných. Hypotézu, zda je vůbec nezbytná u pacientů se střední až závažnou ischemií koronární angiografie ke stanovení další léčebné strategie, bude testovat studie ISCHEMIA (NCT01471522), která randomizuje tyto pacienty buď k provedení invazivního vyšetření, nebo k OMT.
Význam průkazu ischemie pro stanovení prognózy hodnotila studie FAME 2 [8]. Nemocní se stabilní ICHS a s FFR ≤ 0,80 (tzn. s hemodynamicky významnou stenózou) byli randomizováni k PCI + OMT nebo pouze k OMT. Osud pacientů s FFR > 0,80 (bez průkazu ischemie) byl sledován v registru. Nábor do studie byl předčasně ukončen po dosažení poloviny plánovaného počtu nemocných. Důvodem byl významně vyšší výskyt primárního kombinovaného cílového ukazatele (úmrtí, IM, urgentní revaskularizace) ve skupině OMT, zejména pro významně vyšší nutnost urgentní revaskularizace. V úmrtí či ve výskytu IM nebyl rozdíl ani mezi oběma skupinami ani mezi oběma skupinami a nemocnými zařazenými do registru.
Studie FAME 2 tak sice prokázala rozdíl v primárním cílovém ukazateli, avšak jen díky vyššímu výskytu revaskularizace ve skupině léčené OMT. Předčasné zastavení náboru snížilo pravděpodobnost prokázat prognostický význam PCI ve smyslu redukce mortality či IM. Navíc vyšší výskyt urgentní revaskularizace v konzervativně léčené skupině mohl být ovlivněn znalostí informace lékaře i pacienta o přítomnosti hemodynamicky významné stenózy (více než polovina urgentních revaskularizací byla indikována pouze na základě symptomatologie, bez EKG známek ischemie či pozitivity kardiospecifických enzymů).
Protože však studie FAME 2 potvrdila testovanou hypotézu (tzn. že PCI hemodynamicky významných stenóz vede k redukci kombinovaného ukazatele – úmrtí, IM, revaskularizace), můžeme říci, že PCI je u této skupiny pacientů indikováno. Pohled na konzervativně léčenou skupinu pacientů s významnou stenózou a stabilní symptomatologií však nabízí i alternativní strategii – u téměř 90 % nemocných se stabilní ICHS lze odložit PCI bez rizika zvýšení úmrtí či IM do doby, než dojde k progresi obtíží. V neposlední řadě studie FAME 2 ukázala, že během jednoho roku pouze 3 % hemodynamicky významných lézí v kontrolní skupině vedla ke vzniku ruptury plátu (úmrtí/ IM), tedy že drtivá většina hemodynamicky významných lézí není spojena s významným rizikem vzniku AKS. Tyto výsledky by naznačovaly, že funkční významnost není dobrým prediktorem ruptury plátu, a tedy vzniku AKS [5].
Vulnerabilní plát
Již před čtvrtstoletím byla formulována hypotéza vulnerabilního plátu, tedy plátu náchylného k ruptuře a trombóze [9]. Vulnerabilní plát je předchůdcem vzniku akutního koronárního syndromu, a z klinických i preventivních důvodů je proto klíčová včasná identifikace vulnerabilního plátu. Patologicko‑anatomickým obrazem vulnerabilního plátu je nejčastěji tzv. thin‑cap fibroatheroma (TCFA), který je charakterizován velkým nekrotickým lipidovým jádrem a tenkou fibrotickou čepičkou (< 65 µm) [10]. Vulnerabilní pláty nejsou přítomny difuzně, ale zaujímají přibližně 4 % délky koronárních arterií, zejména v proximálních segmentech. To znamená, že riziko destabilizace a ruptury aterosklerotického plátu je fokální, a tedy potenciálně lokalizovatelné a přístupné terapeutické intervenci.
V posledních 20 letech byla testována řada invazivních i neinvazivních metod k určení vulnerabilního plátu in vivo podle jeho morfologických, chemických a fyzikálních vlastností. V klinické praxi se nejčastěji užívají intravaskulární ultrazvuk s radiofrekvenční analýzou ultrazvukového signálu (radiofrequency intravascular ultrasound – RF ‑ IVUS), optická koherenční tomografie (OCT) a intravaskulární spektroskopie (NIRS – near ‑ infrared spectroscopy). Intravaskulátní ultrazvuk umožňuje přesné zhodnocení velikosti cévy, plátu a přítomnost kalcifikací, OCT je ideální pro průkaz ruptury čepičky a přítomnosti trombu, NIRS byl vyvinut k detekci lipidového jádra vulnerabilního plátu.
Přímým ověřením vztahu vulnerabilního plátu a budoucí koronární příhody byla prospektivní, multicentrická studie PROSPECT [2], která v rámci PCI pro AKS prováděla RF ‑ IVUS všech tří tepen a zkoumala angiografické a ultrazvukové charakteristiky lézí, které během sledování vedly ke vzniku závažných kardiovaskulárních příhod (major adverse cardiovascular events – MACE). Během tříletého sledování došlo ke vzniku MACE u 20,4 % pacientů, téměř v polovině případů na lézích, které nebyly iniciálně léčeny PCI pro AKS. Většina lézí odpovědných za pozdější MACE byla původně angiograficky nevýznamná (< 50 %); průměrný diametr stenózy vzrostl z 32 na 65 %.
Na rozdíl od angiografických charakteristik, z nichž žádná nebyla asociována se vznikem MACE během sledování, z výsledků RF ‑ IVUS byly identifikovány nezávislé prediktory pozdějších MACE (velikost plátu ≥ 70 %; průkaz TCFA dle RF ‑ IVUS; minimální plocha lumen tepny ≤ 4,0 mm2). Přítomnost dvou, resp. tří z těchto charakteristik identifikovaly léze zodpovědné za pozdější MACE s 10%, resp. 18% pravděpodobností [2]. Specificita záchytu vulnerabilních plátů dle RF ‑ IVUS je však bohužel nízká, neboť pouze u necelých 5 % TCFA došlo během sledování k rozvoji AKS. Pouhý obraz TCFA pomocí RF ‑ IVUS nestačí k predikci AKS, a je tedy zřejmá potřeba přesnější identifikace vulnerabilního plátu či jeho hrozící ruptury.
Jednou z nových možností detekce vulnerabilního plátu je NIRS, intravaskulární metoda určená k identifikaci a kvantifikaci lipidového jádra, jedné z charakteristik vulnerabilního aterosklerotického plátu [11]. Spektroskopie je metoda používaná již desetiletí v analytické chemii pro identifikaci organických molekul ve směsích. Využívá rozptylu, absorpce a odrazu elektromagnetického záření o různých vlnových délkách, přičemž vlnové délky odražených paprsků jsou specifické pro dané molekuly ve směsi. Při použití vlnové délky emitovaného záření 800 – 2 500 nm, tedy v pásmu blízkém infračervenému záření, a algoritmu detekce odraženého záření vlnových délek specifických pro cholesterol a jeho estery lze tyto detekovat v aterosklerotickém plátu.
Spektroskopie neposkytuje žádné strukturální informace o lumen a stěně cévy. Tuto limitaci odstraňuje použití katetru, který kombinuje jak NIRS, tak intravaskulární ultrazvukovou sondu. Lze tak během jediného vyšetření získat informace o morfologii plátu a přítomnosti lipidů v něm. Ačkoli jde o metodu relativně novou, řada klinických dat osvědčuje její možnosti v detekci vulnerabilního plátu [12]. V současné době probíhají dvě velké prospektivní klinické studie (PROSPECT 2, NCT02171065; Lipid Rich Plaque Study, NCT02033694), které by měly významným způsobem ověřit schopnost identifikace vulnerabilního plátu touto metodou (obr. 1).
Obr. 1. Analýza aterosklerotického plátu pomocí NIRS-IVUS. 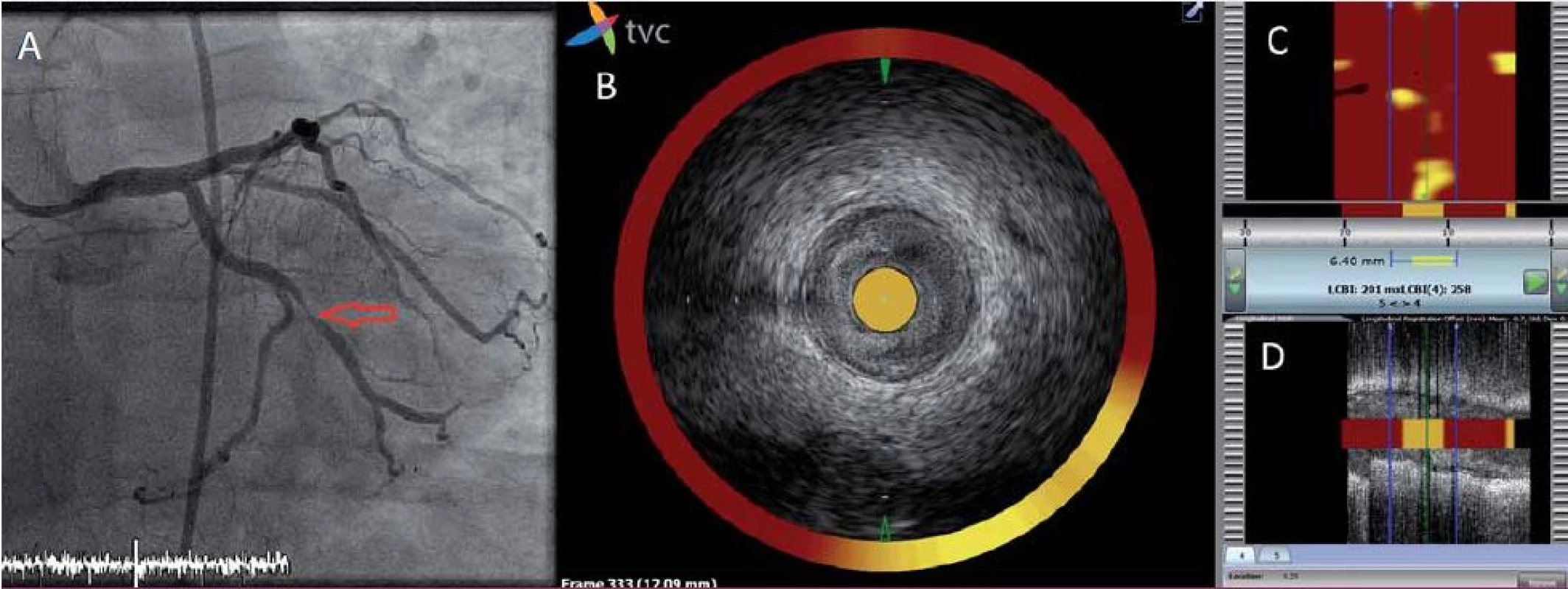
A – koronarogram levé věnčité tepny znázorňující kritickou stenózu ramus marginalis (červená šipka). B, C, D – zobrazení stenózy pomocí NIRS-IVUS: B – simultánní obraz intrakoronárního ultrazvuku a spektroskopie tepny v místě stenózy v příčném řezu. Katetr je zcela obklopen aterotrombotickými hmotami, žlutá barva na obvodě mezi č. 4 a 6 odpovídá lokalizaci lipidového jádra; C – chemogram: na ose x je délka vyšetřené tepny a na ose y obvod tepny ve stupních. Chemogram je dvourozměrná mapa, představuje podélně rozříznutou cévu. Detekce lipidů má pravděpodobnostní charakter, každému měření je přiřazen 1 pixel na chemogramu dle intenzity signálu lipidů, na obrazovce je tato hodnota kódována barvou od červené (nízká intenzita lipidového signálu) po žlutou (vysoká intenzita lipidového signálu); D – simultánní obraz intrakoronárního ultrazvuku a spektroskopie tepny v podélném řezu. Biodegradabilní výztuže
Prostá balonková angioplastika, poprvé provedená v roce 1977, byla spojena zejména s rizikem akutní okluze na podkladě kombinace elastického recoilu, intimo ‑ mediální disekce či intraparietálního hematomu a v prvních měsících po výkonu také s restenózou v důsledku neointimální proliferace a konstriktivního remodelingu. Metalické stenty používané od roku 1986 vyřešily problém akutní okluze na podkladě disekce, ovlivněním recoilu a konstriktivního remodelingu snížily výskyt restenózy. Metalický implantát však s sebou přinesl riziko akutních a subakutních trombotických komplikací (které bylo posléze významně sníženo duální antiagregační léčbou) a zejména nové, iatrogenní onemocnění na podkladě neointimální proliferace – in stent restenózu. Lékové stenty, které jsou dostupné od roku 1999, zásadním způsobem redukovaly neointimální proliferaci, a tím i restenózu ve stentu. Oddálením hojivých procesů ve stěně tepny, negativním ovlivněním reendotelizace a rizikem vzniku perzistující nebo získané malapozice stentu vzniklo nové ohrožení pacientů – pozdní a velmi pozdní trombóza [13]. Naštěstí se ukázalo, že zejména současná generace lékových stentů s biokompatibilními či biodegradabilními nosiči antiproliferativních léků, kterými jsou nástupci historicky prvního sirolimu (zejména everolimus, zotarolimus a biolimus), má riziko pozdní a velmi pozdní trombózy při adekvátní antiagregační léčbě akceptovatelně nízké [14].
Přesto existují další teoretické i praktické problémy spojené s přítomností „kovové klece“, které vytvářejí prostor pro další inovace. Objem neointimální tkáně indukovaný permanentní přítomností metalického implantátu je po uložení stentu vyšší než po prosté balonkové angioplastice. Mechanické sevření tepny rigidním pletivem stentu znemožňuje průběh fyziologických a farmakologických dějů cévní stěny, jakými jsou restaurace vazomotorického tonu cévní stěny, příznivý účinek adaptačního shear stresu, možnost pozdního rozšíření lumina tepny a pozdní expanzivní remodelace [13].
Podmínkou fyziologické funkčnosti cévní stěny je převod mechanických stimulů působících na stěnu tepny na chemické signály (mechanotransdukce), což má ateroprotektivní a tromborezistentní účinky. Porušení této souhry vede naopak k progresi aterosklerotického postižení a k jeho destabilizaci. Tato cévní signalizace je narušena ve stentovaných segmentech, kde je cévní distenzibilita eliminována kovovou kostrou stentu [13].
Slibnou kombinaci mechanického zprůchodnění cévy a pozdějšího vymizení cizorodého materiálu z cévní stěny v době, kdy již této podpory není třeba, nabízí biodegradabilní stenty či výztuže (bioresorbable vascular scaffold – BVS). První zkušenosti s novou generací BVS vytvořeného z polylaktátu potvrdily kompletní resorpci BVS během dvou let (hydrolýza esterových vazeb polylaktátu vede k rozložení výztuže na vodu a oxid uhličitý). Navíc ukázaly, že mezi šestým měsícem a dvěma lety od implantace došlo k pozdnímu rozšíření lumen (o 10,9 %) a k signifikantní redukci velikosti plochy, kterou zabírá plát a tunica media (12,7 %). Zatím není jisté, zda jde o skutečnou regresi plátu se změnou složení stěny cévy a plátu nebo o pseudoregresi v důsledku bioresorpce BVS [13]. Mechanizmus skutečné regrese není dosud jasný (obr. 2).
Obr. 2. PCI s uložením BVS. 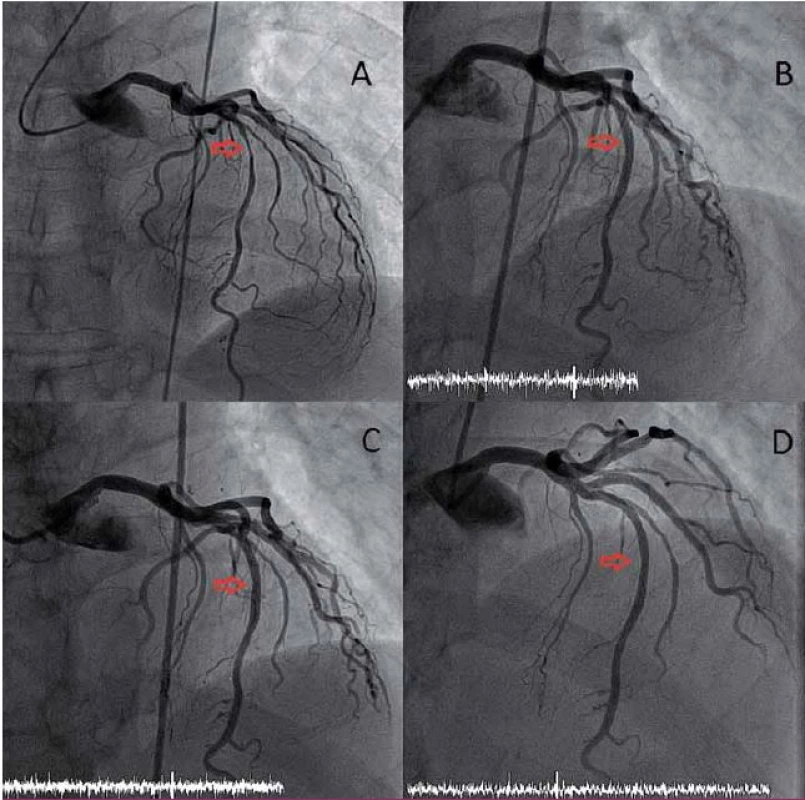
A – koronarogram levé věnčité tepny s významnou stenózou ve středním úseku ramus interventricularis anterior (RIA; červená šipka). B – koronarogram levé věnčité tepny po uložení BVS do RIA. C, D – koronarogram levé věnčité tepny 6, resp. 24 měsíců po uložení BVS do RIA. Nález prokazuje nevýznamnou restenózu v místě původně uloženého BVS. Po 24 měsících se předpokládá kompletní resorpce BVS. Tyto nadějné výsledky musí být potvrzeny randomizovanou klinickou studií, žádná dosud nebyla dokončena, přestože je povoleno v zemích Evropské unie užití BVS v klinické praxi. V letošním roce byly publikovány jednoroční výsledky randomizované studie ABSORB 2 porovnávající BVS s lékovým stentem, který uvolňuje stejný antiproliferativní lék [15]. I když se v prvním roce ještě nemohly projevit potenciální výhody BVS (proces degradace sice začíná již ve chvíli implantace, ale své mechanické vlastnosti ztrácí BVS až po roce), pozitivním výsledkem je příznivý bezpečnostní profil stentu, překvapivým, i když obtížně vysvětlitelným efektem je významná redukce spotřeby nitroglycerinu v šestém i dvanáctém měsíci od implantace ve skupině BVS. Konečné výsledky studie budou prezentovány v roce 2016.
Závěr
Současné výsledky metaanalýz či randomizovaných studií neposkytují důkazy pro nadřazenost PCI či OMT ve smyslu redukce mortality či rizika vzniku IM při léčbě chronické stabilní oligosymptomatické ICHS. Při rozhodování o způsobu léčby je nezbytné zvážit další kritéria, kterými mohou být individuální klinická prezentace, rozsah ischemie či aterosklerotického postižení. Stanovení individuálního rizika léze, a tedy i pacienta pomocí moderních invazivních zobrazovacích metod, a užití biodegradabilních technologií mohou v blízké budoucnosti sehrát na tomto poli významnou úlohu. Úloha intervenčního kardiologa současnosti v léčbě chronické stabilní ICHS je při absenci definitivních randomizovaných dat zcela nezastupitelná a spočívá v uvážlivém a odpovědném výběru přiměřeného diagnostického a terapeutického postupu s nejlepším poměrem riziko vs prospěch pro pacienta.
Podpořeno projektem Institucionální podpory č. 00064203 MZ České republiky.
Doručeno do redakce: 9. 1. 2015
Přijato po recenzi: 22. 1. 2015
doc. MUDr. Petr Hájek, Ph.D.
www.fnmotol.cz
petr.hajek@fnmotol.cz
Zdroje
1. Pijls NH, van Schaardenburgh P, Manoharan G et al. Percutaneous coronary intervention of functionally nonsignificant stenosis: 5‑year follow‑up of the DEFER Study. J Am Coll Cardiol 2007; 49 : 2105 – 2111.
2. Stone GW, Maehara A, Lansky AJ et al. PROSPECT Investigators. A prospective natural ‑ history study of coronary atherosclerosis. N Engl J Med 2011; 364 : 226 – 235. doi: 10.1056/ NEJMoa1002358.
3. Mehta SR, Cannon CP, Fox KA et al. Routine vs selective invasive strategies in patients with acute coronary syndromes: a collaborative meta‑analysis of randomized trials. JAMA 2005; 293 : 2908 – 2917.
4. Hachamovitch R, Hayes SW, Friedman JD et al. Comparison of the short‑term survival benefit associated with revascularization compared with medical therapy in patients with no prior coronary artery disease undergoing stress myocardial perfusion single photon emission computed tomography. Circulation 2003; 107 : 2900 – 2907.
5. Epstein SE, Waksman R, Pichard AD et al. Percutaneous coronary intervention versus medical therapy in stable coronary artery disease: the unresolved conundrum. JACC Cardiovasc Interv 2013; 6 : 993 – 998. doi: 10.1016/ j.jcin.2013.07.003.
6. Boden WE, O'Rourke RA, Teo KK et al. COURAGE Trial Research Group. Optimal medical therapy with or without PCI for stable coronary disease. N Engl J Med 2007; 356 : 1503 – 1516.
7. Shaw LJ, Berman DS, Maron DJ et al. COURAGE Investigators. Optimal medical therapy with or without percutaneous coronary intervention to reduce ischemic burden: results from the Clinical Outcomes Utilizing Revascularization and Aggressive Drug Evaluation (COURAGE) trial nuclear substudy. Circulation 2008; 117 : 1283 – 1291. doi: 10.1161/ CIRCULATIONAHA.107.743963.
8. De Bruyne B, Pijls NH, Kalesan B et al. FAME 2 Trial Investigators. Fractional flow reserve ‑ guided PCI versus medical therapy in stable coronary disease. N Engl J Med 2012; 367 : 991 – 1001. doi: 10.1056/ NEJMoa1205361.
9. Muller JE, Tofler GH, Stone PH. Circadian variation and triggers of onset of acute cardiovascular disease. Circulation 1989; 79 : 733 – 743.
10. Virmani R, Burke AP, Farb A et al. Pathology of the vulnerable plaque. J Am Coll Cardiol 2006; 47 (Suppl 8): C13 – C18.
11. Gardner CM, Tan H, Hull EL et al. Detection of lipid core coronary plaques in autopsy specimens with a novel catheter‑based near ‑ infrared spectroscopy system. JACC Cardiovasc Imaging 2008; 1 : 638 – 648. doi: 10.1016/ j.jcmg.2008.06.001.
12. Waxman S, Dixon SR, L'Allier P et al. In vivo validation of a catheter‑based near ‑ infrared spectroscopy system for detection of lipid core coronary plaques: initial results of the SPECTACL study. JACC Cardiovasc Imaging 2009; 2 : 858 – 868. doi: 10.1016/ j.jcmg.2009.05.001.
13. Serruys PW, Garcia ‑ Garcia HM, Onuma Y. From metallic cages to transient bioresorbable scaffolds: change in paradigm of coronary revascularization in the upcoming decade? Eur Heart J 2012 ; 33 : 16 – 25. doi: 10.1093/ eurheartj/ ehr384.
14. Kang SH, Park KW, Kang DY et al. Biodegradable ‑ polymer drug‑eluting stents vs. bare metal stents vs. durable ‑ polymer drug‑eluting stents: a systematic review and Bayesian approach network meta‑analysis. Eur Heart J 2014; 35 : 1147 – 1158. doi: 10.1093/ eurheartj/ eht570.
15. Serruys PW, Chevalier B, Dudek D et al. A bioresorbable everolimus‑eluting scaffold versus a metallic everolimus‑eluting stent for ischaemic heart disease caused by de ‑ novo native coronary artery lesions (ABSORB II): an interim 1‑year analysis of clinical and procedural secondary outcomes from a randomised controlled trial. Lancet 2015; 385 : 43 – 45. doi: 10.1016/ S0140 ‑ 6736(14)61455 ‑ 0.
Štítky
Dětská kardiologie Interní lékařství Kardiochirurgie Kardiologie
Článek Genetika kardiomyopatií
Článek vyšel v časopiseKardiologická revue – Interní medicína
Nejčtenější tento týden
2015 Číslo 1- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Vyšetření cerebrovaskulární rezervy u asymptomatických pacientů s významnou stenózou vnitřní karotické tepny
- Genetika kardiomyopatií
- Katetrizační léčba chronické stabilní ischemické choroby srdeční v současnosti
- Katetrizační uzávěr foramen ovale patens u potápěčů
- Katetrizační léčba fibrilace síní
- Srdeční resynchronizační terapie – kdy a u koho ji v současnosti indikovat?
- Není perikarditida jako perikarditida – kazuistika
- Studie Pegasus – duální antiagregace (ASA + ticagrelor) dlouhodobě po infarktu myokardu
- Nové studie dávají naději na zlepšení terapie aterosklerózy
-
Hlavolamy 2015
Propojení kardiologie a diabetologie - Vyhlášení výsledků autorské soutěže O nejlepší kazuistiku v roce 2014
- Vývoj a úkoly klinické farmakologie ve zdravotnické péči v ČR
- TDM antibiotik v klinické praxi
- prof. MUDr. Josef Veselka, CSc., FESC, FSCAI, FICA (*23. 3. 1965)
- TDM digoxinu v klinické praxi
- Patofyziologie a diagnóza obstrukce u hypertrofické kardiomyopatie
- Lékové interakce a současná klinická praxe
- Přímá perorální antikoagulancia – perspektivy terapeutického monitorování
- Klinická farmakologie antirevmatik
- Specifika klinických hodnocení léčiv časných fází I a II
- Význam TDM metotrexátu při terapii psoriázy
- Kardiologická revue – Interní medicína
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- TDM digoxinu v klinické praxi
- Lékové interakce a současná klinická praxe
- Srdeční resynchronizační terapie – kdy a u koho ji v současnosti indikovat?
- TDM antibiotik v klinické praxi
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



