-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Současné pohledy na patofyziologii, diagnostiku a léčbu imunitní trombocytopenie v dětském věku
Current views on the pathophysiology, diagnosis and treatment of immune thrombocytopenia in children
The review summarizes the most recent knowledge of the epidemiology, pathophysiology, current diagnostic aproach and treatment strategies in immune thrombocytopenia in children.
Keywords:
splenectomy – Quality of life – Molecular mimicry – immune thrombocytopenia – antiplatelet antibodies – T-cell mediated platelet destruction – platelet desialylation – immunosupressive treatment – TPO mimetics
Autoři: D. Pospíšilová 1; P. Smíšek 2
Působiště autorů: Dětská klinika Fakultní nemocnice a Lékařské fakulty Univerzity Palackého, Olomouc 1; Klinika dětské hematologie a onkologie 2. LF UK a FN Motol, Praha 2
Vyšlo v časopise: Čes-slov Pediat 2021; 76 (8): 460-473.
Kategorie: Přehledový článek
Souhrn
Článek shrnuje nejnovější poznatky o epidemiologii, patofyziologii, současném diagnostickém přístupu a možnostech léčby u imunitní trombocytopenie v dětském věku.
Klíčová slova:
kvalita života – splenektomie – imunosupresivní léčba – imunitní trombocytopenie – molekulární mimikry – protilátky proti trombocytům – T-lymfocyty indukovaná destrukce trombocytů – desialylace trombocytů – TPO mimetika
ÚVOD
Imunitní trombocytopenie (dříve idiopatická trombocytopenická purpura, ITP) je získané autoimunitní onemocnění charakterizované izolovanou trombocytopenií v periferní krvi a různě vyjádřenými krvácivými projevy. Vzniká v důsledku nepřiměřené imunitní reakce organismu proti vlastním trombocytům a megakaryocytům. Vyskytuje se u dětí i dospělých. Je nejčastějším typem trombocytopenie v dětském věku a nejčastějším autoimunitním onemocněním postihujícím krevní elementy. Incidence ITP u dětí je udávána v rozmezí 1,9–6,3 nových případů na 100 000 dětí za rok [1–4].
V posledních 20 letech byla doplněna celá řada poznatků o patofyziologii onemocnění, které přispěly k upřesnění diagnostiky a rozšíření léčebných možností. Byly vyvinuty nové léky, které se postupně na podkladě „evidence-based“ principu staly součástí léčebných postupů.
NÁZVOSLOVÍ
V roce 2009 bylo v rámci konsenzu mezinárodní skupiny expertů [5] změněno názvosloví ITP. Úprava názvu nemoci se stala nezbytným předpokladem pro sjednocení pojmů a jednotné srovnávání výsledků klinického výzkumu a efektu nových způsobů léčby. Protože byl jednoznačně prokázán imunitní podklad onemocnění, byl pojem „idiopatická“ nahrazen názvem „imunitní“. Vzhledem k tomu, že ne u všech pacientů je přítomna typická „purpura“, byl výraz „trombocytopenická purpura“ nahrazen slovem „trombocytopenie“. Je doporučeno používat název Imunitní trombocytopenie, zkratka pro označení onemocnění zůstává stejná: ITP. Doporučení mezinárodní skupiny expertů byla publikována v roce 2010 a 2011 [6, 7], po 9 letech byla nově revidována [8, 9].
DEFINICE A DĚLENÍ ITP
Imunitní trombocytopenie u dětí je charakterizována izolovanou trombocytopenií bez dalších změn v krevním obrazu včetně diferenciálního rozpočtu leukocytů a různě vyjádřenými krvácivými projevy bez další alterace celkového stavu.
Podle příčiny vzniku dělíme Imunitní trombocytopenii na dvě základní skupiny:
• Primární ITP
Jako primární ITP je označována trombocytopenie bez známé vyvolávající příčiny.
• Sekundární ITP
Pokud Imunitní trombocytopenie vzniká na podkladě jakéhokoli vrozeného nebo získaného predisponujícího onemocnění, například definovaných infekcí (EBV, CMV, varicella, hepatitida B, Parvovirus B19, HIV, Helicobacter pylori), autoimunitních onemocnění (Lupus erythematodes, Autoimunitní thyreoiditida aj.), imunodeficitů (Smíšený variabilní imunodeficit – CVID, hypogamaglobulinemie aj.), lymfoproliferací (autoimunitní lymfoproliferativní syndrom – ALPS aj.) nebo podaných léků, je označována jako sekundární ITP.
Podle délky trvání onemocnění navrhla Skupina expertů v roce 2009 nové dělení ITP a doporučila používat následující pojmy:
• Nově diagnostikovaná ITP (první 3 měsíce od diagnózy) – od názvu akutní ITP se již upouští.
• Perzistující ITP (3–12 měsíců od diagnózy) – označení reflektuje vysoký potenciál postupného zlepšení v průběhu prvního roku od diagnózy.
• Chronická ITP (po 12 měsících trvání).
Primární ITP nelze prokázat specifickými laboratorními testy, je tedy typickou diagnózou per exclusionem. Diagnóza sekundární ITP je podmíněna nálezem definované vyvolávající příčiny onemocnění, která se může manifestovat až s odstupem od diagnózy trombocytopenie. Diferenciálně diagnostické rozvahy jsou proto nezbytné v průběhu celého diagnostického procesu i u perzistující a chronické ITP.
EPIDEMIOLOGIE
ITP se může vyskytovat ve všech věkových skupinách. Maximum výskytu je popisováno ve věku mezi 2 a 8 lety, v této věkové kategorii je vyšší incidence u chlapců. Pouze 10 % pacientů s ITP tvoří kojenci a 20 % děti starší 10 let. Dívky a chlapci jsou ve věkové kategorii nad 10 let postiženi stejně, u dospělých pacientů převažují ženy [5].
U dětí s ITP ve věku 2–8 let jsou v předchorobí často uváděny nespecifické infekce dýchacích cest nebo gastroenteritidy, v malém procentu případů očkování. Mezi věkovými skupinami jsou patrné rozdíly v klinickém průběhu, etiologii, komorbiditách a dopadu na kvalitu života. Rozdílná maxima výskytu rovněž podporují teorii o odlišné patofyziologii onemocnění v různých věkových skupinách.
PATOFYZIOLOGIE
V patofyziologii onemocnění se uplatňuje celá řada faktorů. Znalost patofyziologie je důležitá pro porozumění podstatě a průběhu nemoci a stanovení adekvátního léčebného postupu.
Na vzniku Imunitní trombocytopenie se mohou podílet různé imunitní mechanismy:
• produkce autoprotilátek proti antigenům trombocytů (GPIIb/IIIa, GPIb/IX) s následným vychytáváním komplexů trombocyt-protilátka ve slezině cestou vazby na Fc receptory;
• destrukce trombocytů indukovaná CD8+ T-supresorovými lymfocyty;
• deregulace kompartmentu Bregs – subpopulace B lymfocytů produkujících IL-10, které hrají důležitou roli při vzniku autoimunních chorob;
• na Fc receptoru nezávislé vychytávání desialylovaných trombocytů v játrech (tzv. desialylace trombocytů);
• komplement-dependentní cytotoxicita;
• snížení produkce jaterního trombopoetinu;
• porucha funkce megakaryocytů.
Vyvolávající mechanismus vzniku ITP u dětí a dospělých se liší. Nejčastějším mechanismem vzniku trombocytopenie u dětí v předškolním a časném školním věku je systém tzv. „molekulárních mimiker“. Za spouštěče produkce protilátek jsou u dětí v tomto věku považovány virové infekce, jejichž nárůst je typický právě pro předškolní a časný školní věk. Podobnost epitopů na povrchu virů/bakterií a trombocytů může vést rovněž ke zkřížené reakci protilátek proti virům/bakteriím a povrchu trombocytů s následnou destrukcí patogenů i trombocytů [10–12].
Vzácně se ITP může vyvinout po očkování, byla popsána po aplikaci MMR vakcíny a velmi ojediněle u jiných vakcín. Příčinou je zkřížená imunitní reakce proti antigenům vakcín nebo proti jednotlivým složkám vakcíny (nosné proteiny, adjuvancia) [13, 14]. Je diskutován možný vliv infekce Helicobacter pylori na vznik ITP, výsledky studií se však rozcházejí [15, 16].
U 60–70 % pacientů jsou prokazatelné autoprotilátky proti povrchovým antigenům trombocytů, převážně ve třídě IgG, vzácněji IgM a IgA [17, 18]. 60–70 % pacientů má autoprotilátky proti hlavním funkčně důležitým povrchovým glykoproteinům (GP) trombocytů: GPIIbIIIa (integrin αIIbβ3), méně často proti GPIb-IX. Pouze malá část pacientů má autoprotilátky proti oběma uvedeným GP nebo i dalším povrchovým antigenům (GPIa-IIa a V). Protilátky se vážou na povrch trombocytů, ale i megakaryocytů [19]. Trombocyty s navázanými protilátkami jsou postupně rozpoznány Fc-receptory (FcRs) fagocytujících buněk. Po vazbě Fc části imunoglobulinu navázaného na povrch trombocytů na FcγRIIa tkáňových makrofágů v monocyto-makrofágovém systému dochází ke zvýšené fagocytóze komplexů trombocytů s navázanou protilátkou, a to primárně ve slezině. V souladu s touto teorií některé léky první linie jako intravenózně podané Ig (IVIG) a anti-Rh(D) globulin působí právě ovlivněním těchto mechanismů dependentních na Fc - a FcγR.
U 30–40 % pacientů však protilátky nejsou prokazatelné. Je tedy zřejmé, že existují ještě jiné mechanismy, které vedou ke vzniku onemocnění. Nepřítomnost protilátek může být částečně způsobena nedostatečnou citlivostí použitých vyšetřovacích metod a/nebo působením jiných patofyziologických vlivů. Byl prokázán přímý cytotoxický efekt CD8+ T lymfocytů na trombocyty. V cirkulaci části pacientů s ITP byly prokázány cytotoxické CD8+ T lymfocyty, které jsou schopny indukovat přímou lýzu trombocytů in vitro a rovněž akumulovat v kostní dřeni, kde mohou negativně ovlivňovat trombopoézu [20]. Byla prokázána i dysbalance splenických subpopulací lymfocytů, Th17 a regulačních T lymfocytů (Treg) a rozdíly hladin cytokinů [21, 22]. Na destrukci trombocytů se může podílet i C3 složka komplementu a NK buňky.
Autoprotilátky, které se vážou na povrchové antigeny megakaryocytů, mohou inhibovat jejich vyzrávání [23]. Byla prokázána i porucha funkce megakaryocytů, ve kterých dochází k vakuolizaci a jiným apoptotickým změnám ultrastruktury. Počet megakaryocytů v kostní dřeni může být normální nebo zvýšený.
Nejnověji popsaným mechanismem uplatňujícím se při vzniku trombocytopenie patří tzv desialylace trombocytů a jejich destrukce v játrech. Bylo prokázáno, že protilátky anti-GPIbα, nikoliv však anti-GPIIbIIIa, indukují aktivaci trombocytů nezávislou na Fc receptoru, a to translokací sialidázy (neuraminidázy1) a desialylací. Ta vede k vychytávání trombocytů v játrech po vazbě na Ashwelovy-Morellovy receptory. Tento mechanismus je zásadně odlišný od klasické Fc-FcγR-dependentní fagocytózy v makrofázích. Na myších modelech ITP bylo prokázáno, že inhibitory sialidázy vedou ke zmírnění trombocytopenie mediované anti-GPIbα protilátkou [24, 25].
Důsledkem imunopatologických procesů uplatňujících se v patofyziologii ITP je zkrácené přežívání trombocytů z původních 8–10 dnů na méně než 1 den, často pouze na několik hodin. Opsonizace trombocytů protilátkami může vést i k poruše jejich funkce. Pokles trombocytů stimuluje jejich zvýšenou produkci v kostní dřeni, která však většinou není schopna kompenzovat urychlenou destrukci. Výsledkem je trombocytopenie různého stupně. Mladé trombocyty mají větší objem a jsou vysoce efektivní ve své hemostatické funkci.
KLINICKÝ OBRAZ
Začátek nově diagnostikované ITP je obvykle náhlý. Většina dětí má v době záchytu onemocnění akutně vzniklé projevy krvácení do kůže ve formě petechií a sufuzí. Výraznější kožní a slizniční krvácení, které může vyžadovat intervenci, se vyskytuje u 30–56 % nově diagnostikovaných dětí s ITP (epistaxe, metroragie a hematurie) [26–28]. Pouze u 0–4 % dětských pacientů s ITP je popisováno závažné krvácení, které vyžaduje akutní intervenci (protrahované epistaxe, krvácení do spojivky, meléna, makroskopická hematurie, závažná metroragie).
Výskyt intrakraniálního krvácení u dětí s ITP je vzácný: byl popsán u 0,5–1 % pacientů s ITP [29, 30]. Může se objevit jak na počátku nemoci, tak kdykoli později při poklesu počtu trombocytů. Rizikovými faktory jsou těžká trombocytopenie, trauma hlavy a rizikové fyzické aktivity. Častější výskyt intrakraniálního krvácení je uváděn u dospělých, u dětí jsou naopak popisována jiná závažnější krvácení [27], a to v celém průběhu onemocnění. Informace o intrakraniálním krvácení jsou získány z registrů a retrospektivních dat, ze kterých mimo jiné vyplývá, že je spojeno s poklesem trombocytů pod 20 x 109/l v 90 % případů a pod 10 x 109/l v 75 % případů.
Pozvolný nástup krvácivých projevů je typický spíše pro starší děti a dospělé. Je často asociován s rozvojem chronické formy ITP. K určení stupně krvácení je doporučeno používat nově upravené škály krvácení (tab. 1).
Tab. 1. Aktualizovaná škála krvácení pro dětské pacienty s ITP (Provan 2019). 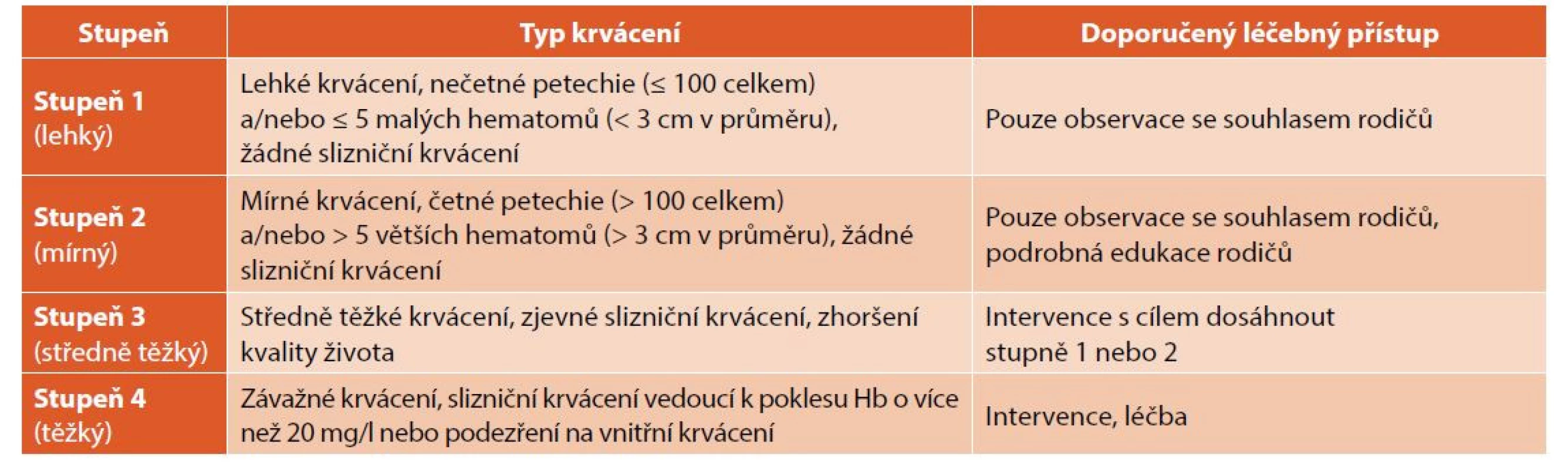
Škála krvácení je založena na původní škále vytvořené pro předchozí konsenzus z roku 2009. Update dle zkušeností autorů (Hb: hemoglobin) [8]. U 70–80 % dětí se počet trombocytů upraví do normálního rozmezí během 3–6 měsíců od diagnózy. Remise dosahuje 30–40 % dětí s ITP mezi 28 dny a 6 měsíci trvání nemoci, 15–20 % mezi 6–12 měsíci trvání a 20–30 % dětí mezi 12–24 měsíci trvání. Přechod do chronické ITP se u dětí udává v rozmezí 10–20 % [8]. Spontánní remise jsou u dětí popisovány i po 24–36 měsících od diagnózy, vzácně i později. V publikovaných registrech je uváděn rozvoj chronické formy ITP u 20–30 % dětí s ITP [8]. Pacientů s chronickou ITP s významnějšími klinickými symptomy je však výrazně méně, většinou kolem 10 % dětí.
V poslední době se jako častý příznak provázející chronickou ITP u dětí uvádí zvýšená únavnost [31, 32]. 85 % pacientů nebo jejich rodičů udává snížení energie a vitality, 77 % snížení schopnosti fyzických aktivit a 75 % limitaci schopnosti vykonávat denní povinnosti. Únava obvykle odeznívá s úpravou počtu trombocytů. 80 % lékařů uvádí snížení kvality života udávané pacienty a 66 % uvádí, že právě únava je faktorem, který se na kvalitě života podílí podstatnou měrou. Chronická ITP má také významný negativní dopad na kvalitu života dětí, což je nutno velmi pečlivě zohlednit při výběru léčebné strategie. Zachování dobré kvality života patří k jednomu ze základních cílů léčby.
DIAGNOSTICKÝ PŘÍSTUP K DĚTSKÝM PACIENTŮM S ITP
U dětských pacientů s typickou anamnézou a klinickým obrazem je základem ke stanovení diagnózy ITP detailní vyšetření krevního obrazu. Je nutno provést kompletní analýzu krevního obrazu včetně pečlivého mikroskopického zhodnocení nátěru periferní krve: morfologie leukocytů, velikosti a tvaru erytrocytů a trombocytů. Při vyšetření krevního obrazu nacházíme u ITP izolované snížení počtu trombocytů, u více než poloviny pacientů k hodnotám pod 20 x 109/l, často i pod 10 x 109/l. Některé trombocyty v nátěru jsou velké, jedná se většinou o mladé trombocyty. Výrazně velké trombocyty mohou být přítomny u vrozených trombocytopenií [33]. Při hodnocení počtu trombocytů v automatickém analyzátoru krevních elementů mohou být výrazně velké trombocyty zaměněny za erytrocyty a výsledný počet trombocytů z analyzátoru je potom falešně nízký (obr. 1). Proto je i z těchto důvodů nutné ověřit skutečný počet trombocytů vyšetřením nátěru periferní krve. Současné analyzátory krevního obrazu umožňují stanovení tzv. „frakce nezralých trombocytů (IPF)“, jejichž přítomnost potvrzuje akceleraci produkce trombocytů v kostní dřeni při jejich poklesu. Jde však pouze o pomocné vyšetření [34].
Obr. 1. Velké trombocyty dosahující velikosti erytrocytů – tyto velké trombocyty jsou v analyzátoru krevních elementů chybně počítány jako erytrocyty, což má za následek falešně nízký počet trombocytů (kojenec s May-Hegglinovou anomálií).
Fig. 1. Large platelets are equal to an erythrocyte size – these large platelets are miscounted as erythrocytes by a hematology analyzer, which results in a false low platelet count (here, an infant with May-Hegglin anomaly).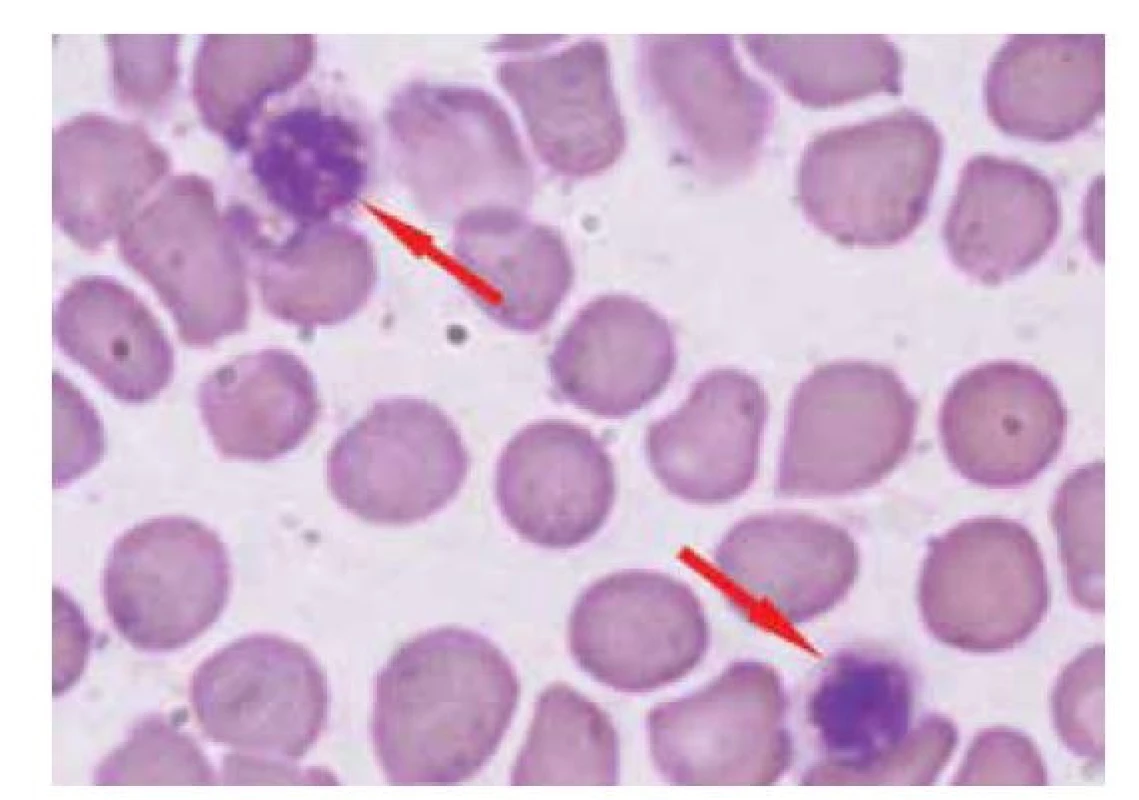
Pečlivá anamnéza, důkladné klinické vyšetření a výsledky detailní analýzy krevního obrazu jsou potom důležitým podkladem pro další diagnostický postup.
DOPORUČENÁ LABORATORNÍ VYŠETŘENÍ U DĚTÍ S NOVĚ DIAGNOSTIKOVANOU ITP
U pacientů s ITP může být při diagnostice onemocnění v krevním obraze přítomna relativní nebo absolutní lymfocytóza nebo eozinofilie, případně lehká mikrocytární anémie. Při dalších patologických nálezech (jiné typy anémie, leukocytóza, leukopenie, známky hemolýzy, retikulocytóza, změny morfologie krevních elementů) je však nutno pátrat po jiné příčině trombocytopenie a rozšířit panel vyšetření podle typu patologických nálezů (tab. 2).
Tab. 2. Doporučená vyšetření při diagnóze ITP. 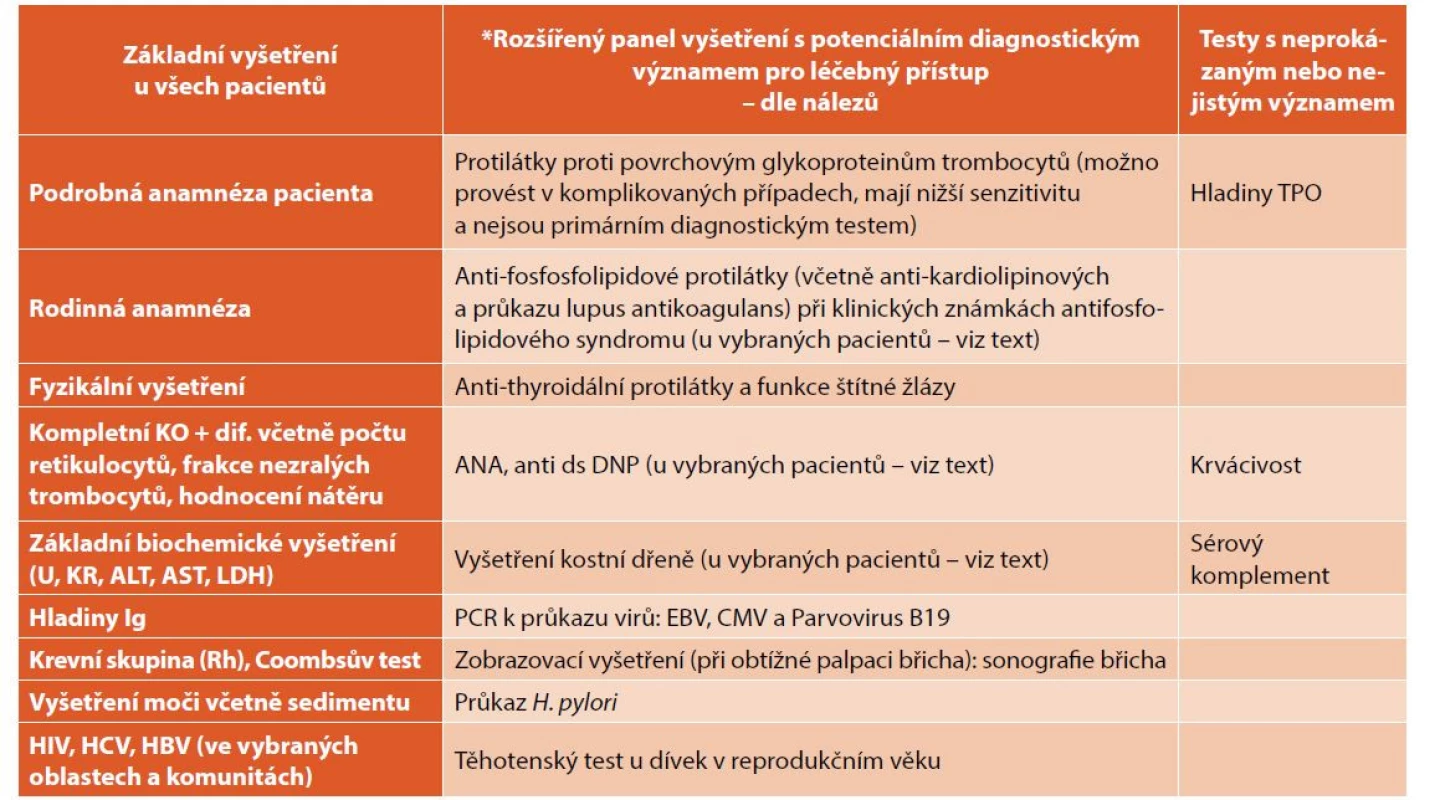
PCR – polymerázová řetězová rekce; PTT – parciální tromboplastinový čas; Rh – rhesus; TPO – trombopoietin
*Doplňující testy v dif. dg. ITP, nutné pro odlišení od jiných typů trombocytopenií.Vyšetření kostní dřeně není v typických a nekomplikovaných případech pro diagnózu ITP nezbytně nutné. Jeho provedení je však indikováno při jakýchkoli pochybnostech vyplývajících z hodnocení klinického nálezu nebo krevního obrazu. Cílem je vyloučení jiného onemocnění, jako je leukémie, aplastická anémie, myelodysplastický syndrom, Fanconiho anémie, případně dalších patologických procesů v kostní dřeni. Vyšetření kostní dřeně je prováděno vždy při špatné odpovědi na léčbu a při atypickém průběhu onemocnění. Je doporučováno rovněž u všech pacientů při přechodu do chronicity. Současné doporučené postupy již nepodmiňují zahájení léčby kortikoidy při jednoznačné diagnóze ITP vyšetřením kostní dřeně [8].
V kostní dřeni pacientů s ITP obvykle nalézáme zvýšený počet megakaryocytů s převahou mladých forem, v některých případech i špatné odštěpování trombocytů. Erytrocytární a granulocytární řada jsou bez odchylek.
U malých dětí, které mají v anamnéze klinické příznaky infekce nebo kontakt s infekčním onemocněním, je nutné vyloučit infekce doprovázené typicky poklesem trombocytů: EBV, CMV, HIV, hepatitis B, Parvovirus B19, ev. Helicobacter pylori, aktuálně i infekci virem SARS – COVID-19. Tyto infekce mohou mít v některých případech atypický klinický obraz. Podle skupiny expertů je u nově diagnostikovaných pacientů s ITP doporučeno provést vždy vyšetření moči včetně sedimentu, vyšetření krevní skupiny, přímý antiglobulinový (Coombsův) test a hladiny imunoglobulinů [8] (tab. 2). Coombsův test a hladiny imunoglobulinů je nutno vyšetřit před podáním anti-D globulin, IVIG.
U pacientů s perzistující ITP po 3 měsících od diagnózy je doporučeno vyšetřit (pokud nebylo vyšetřeno dříve):
• antinukleární, antifosfolipidové, antikardiolipinové a antithyreoidální protilátky, anti ds-DNP – především u adolescentních dívek;
• pokud pacient nesplňuje základní definici ITP (tedy podmínku izolované trombocytopenie bez dalších změn v krevním obrazu), nebo jsou při klinickém vyšetření zjištěny další patologické nálezy (například zvětšení mízních uzlin nebo organomegalie), je vyšetření nutno rozšířit podle typu patologického nálezu k objasnění vyvolávající příčiny (tab. 3).
Tab. 3. Diferenciální diagnóza trombocytopenií u dětí. 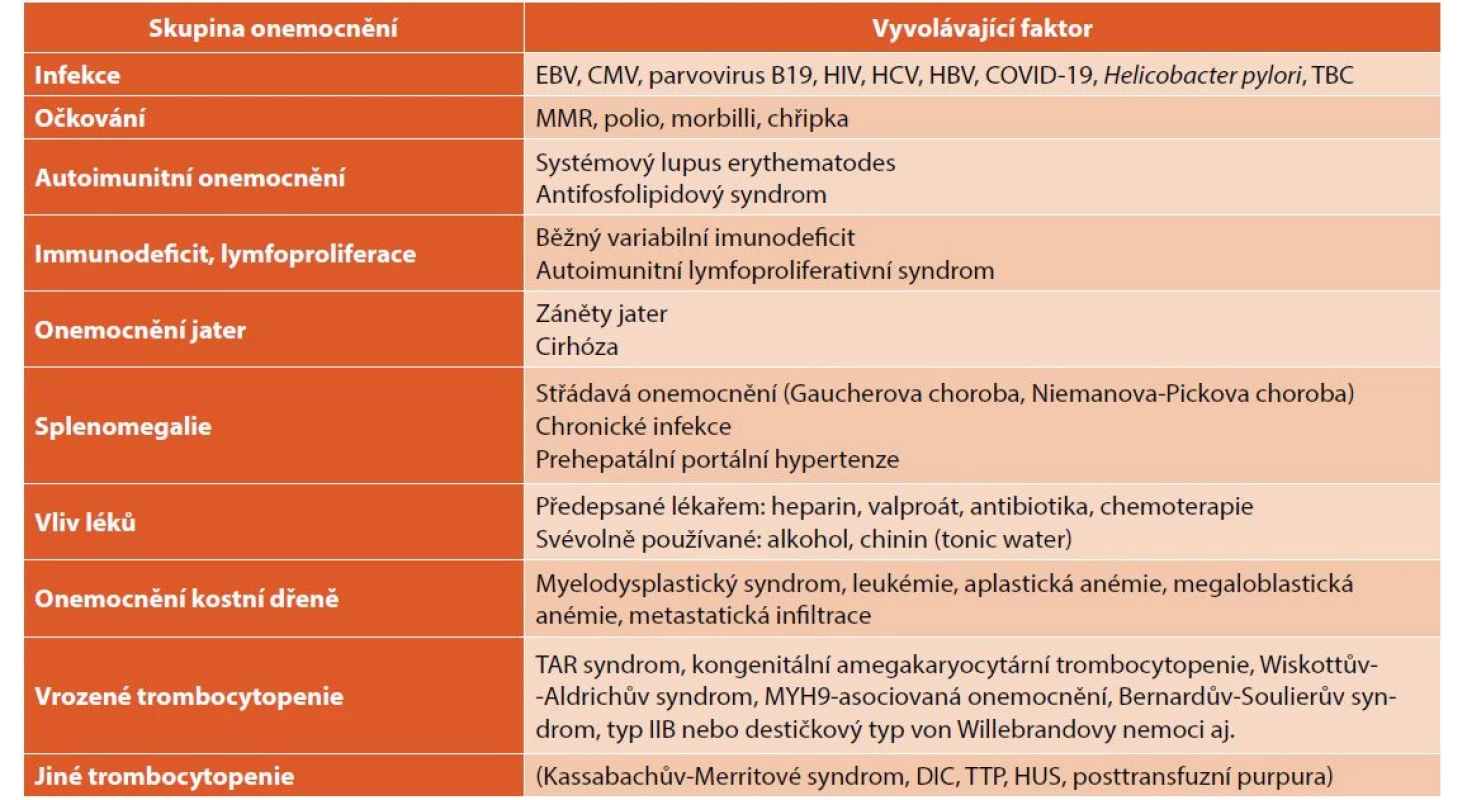
TAR – trombocytopenie s chyběním radia; MYH9 – myosin heavy chain 9; DIC – diseminovaná intravaskulární koagulace; TTP – trombotická trombocytopenická purpura; HUS – hemolyticko-uremický syndrom Vyšetření trombocytárních protilátek u akutní ITP není rutinně prováděno a není pro diagnózu nezbytné. Poslední doporučené postupy uvádějí „renesanci“ průkazu trombocytárních protilátek. Pozitivní průkaz protilátek proti povrchovým antigenům trombocytů svědčí spíše pro diagnózu imunitní (protilátkami indukované) trombocytopenie, negativní nález však onemocnění nevylučuje. Trombocytární protilátky se nevyskytují výhradně u ITP, ale i u jiných onemocnění provázených trombocytopenií (HIV infekce, SLE, Hodgkinův lymfom, Evansův syndrom). Je možno vyšetřovat protilátky volně přítomné v séru nebo vázané na destičky.
Další vyšetření jsou indikována pouze při podezření na jiné vyvolávající onemocnění.
DIFERENCIÁLNÍ DIAGNÓZA
Trombocytopenie může být prvním nebo doprovázejícím příznakem celé řady onemocnění. Pokud je nízký počet trombocytů při vyšetření krevního obrazu v kontrastu se zcela negativním klinickým nálezem, je vždy nutno vyloučit tzv. pseudotrombocytopenii, která vzniká shlukováním trombocytů působením kyseliny ethylendiamintetraoctové (EDTA). Tu vyloučíme vyšetřením počtu trombocytů z venózní krve odebrané do citrátu sodného a vyšetřením nátěru periferní krve.
Při anamnestických údajích o příznacích infekce je nutno vyloučit virové infekce, jako je EBV, CMV, Parvovirus B19, hepatitida C, HIV. Pečlivě odebraná anamnéza může odhalit vliv některých léků (antibiotika, antiepileptika, heparin) nebo předcházejícího očkování. U kojenců a batolat je třeba pomýšlet na vrozené trombocytopenie, jejichž první projevy se objevují většinou již v kojeneckém věku. K nejzávažnějším patří amegakaryocytární trombocytopenie, Wiskottův-Aldrichův syndrom, Mayova-Hegglinova anomálie. Vodítkem může být v některých případech velikost trombocytů. Po vrozených trombocytopeniích je třeba pátrat i u starších dětí s chronickou trombocytopenií, zejména při špatné odpovědi na léčbu kortikoidy a imunoglobuliny. Je nutno myslet i na vzácné vrozené imunodeficience, u kterých se trombocytopenie může jevit jako jeden z prvních příznaků (např. CVID). Pro definitivní diagnózu vrozené trombocytopenie jsou nutná specializovaná hematologická vyšetření v centrech dětské hematologie. V dnešní době je indikováno i molekulárně-genetické vyšetření k přesnému zařazení typu vrozené trombocytopenie. V souvislosti s vrozenou trombocytopenií bylo již popsáno více než 75 kandidátních genů [35].
U malých dětí je při izolované trombocytopenii nutno pomýšlet rovněž na Kassabachův-Merritové syndrom s velkými hemangiomy, které mohou být lokalizovány i v diagnosticky hůře dostupných lokalizacích (retroperitoneum, horní hrudní apertura) a mohou tak dlouho unikat pozornosti.
U starších dětí, především u adolescentních dívek, u kterých je většinou pozvolnější rozvoj trombocytopenie, je nutno vyloučit onemocnění pojiva, především systémový lupus erythematodes, u kterého může ITP předcházet i několik let plné manifestaci onemocnění. Závažné stavy se zvýšenou konzumpcí trombocytů (hemolyticko-uremický syndrom, trombotická trombocytopenická purpura, syndrom diseminované intravaskulární koagulace) lze většinou snadno odlišit podle závažného klinického průběhu i typických laboratorních výsledků. Výjimečně se mohou akutně vzniklou izolovanou trombocytopenií manifestovat některé druhy leukémií, lymfomů nebo nádorů s infiltrací kostní dřeně, aplastická anémie, Fanconiho anémie a myelodysplastický syndrom, které obvykle vyloučíme při detailním vyšetření krevního obrazu, biochemických analýzách a vyšetření kostní dřeně. Při splenomegalii je nutné vyloučit hypersplenismus se zvýšeným vychytáváním trombocytů ve zvětšené slezině. Příčinou splenomegalie mohou být střádavá onemocnění, metabolické choroby, hepatitidy nebo prehepatální portální hypertenze.
U chronické ITP je nutno vyloučit rovněž vrozené poruchy imunity: běžný variabilní imunodeficit (CVID), autoimunitní lymfoproliferativní syndrom (ALPS), případně jiné imunitní cytopenie s dominující trombocytopenií, které se s ITP často sdružují a mají dnes již známý genetický podklad. Vzácně může být trombocytopenie u malých dětí prvním příznakem vrozené formy trombotické trombocytopenické purpury (vrozený deficit ADAMTS13).
Prediktory vývoje do chronické formy ITP jsou následující: ženské pohlaví, starší věk při diagnóze, pozvolný nástup trombocytopenie [36].
LÉČBA DĚTSKÝCH PACIENTŮ S ITP
Cílem léčby u dětí s ITP je:
• předejít život ohrožujícímu krvácení;
• stabilizovat a redukovat stávající krvácení;
• zachovat dobrou kvalitu života dítěte a minimalizovat nežádoucí účinky podávané terapie.
1. Indikace k léčbě dětí s ITP
Současný konsenzus vychází nově z premisy, že u dětí má zhodnocení klinického obrazu a symptomů větší rozhodovací význam pro určení léčebného postupu než počet trombocytů [8].
Podle dostupné literatury z registrů pacientů s ITP, jak bylo výše uvedeno, vyplynula následující data:
• 0–4 % dětí s ITP má stupeň krvácení 4 (tab. 1);
• krvácení vyžadující léčbu jsou uváděna u 30–56 % nově diagnostikovaných pacientů;
• incidence ICH je 0–1 % [8].
Současný konsenzus zohledňuje při indikaci léčby několik základních faktorů:
• krvácivé projevy;
• počet trombocytů;
• aktuální trauma, především v oblasti hlavy;
• bolest hlavy;
• konkomitantní medikace, komorbidity;
• psychosociální otázky a životní styl pacienta, spolupráci s rodinou;
• vzdálenost a dostupnost zdravotnického zařízení, ekonomické otázky.
Podle nových doporučení je podstatné zhodnotit závažnost krvácivých projevů (viz škála krvácení (tab. 1).
Tendence ke krvácivým projevům nekoreluje vždy s počtem trombocytů, obecně však platí, že závažná krvácení jsou popisována většinou při hodnotě trombocytů pod 20 x 109/l. Při rozhodování o léčebném postupu je tedy důležité pečlivě zhodnotit klinický obraz, laboratorní výsledky, možnosti spolupráce s rodinou a rovněž dopad léčby na kvalitu života dítěte. Rozhodnutí je vždy individuální.
Jasné indikace hospitalizace jsou následující:
• progrese krvácivých projevů a/nebo komorbidity;
• riziko ICH v případě rizikových faktorů: léčba NSAID, vrozené koagulopatie (např. von Willebrandova nemoc), A-V malformace, nevysvětlitelná bolest hlavy, trauma hlavy – zde je nejprve nutné urgentně indikovat léčbu zaměřenou na úpravu koagulace a zástavu krvácení;
• změna chování dítěte, depresivní ladění;
• obava rodičů z krvácení a nejistota, zda je možné dodržet všechna opatření a důsledně kontrolovat aktivitu dítěte;
• psychosociální situace a styl života v rodině (např. batolecí věk, pubertální děti, nespolupracující rodiče);
• nedostatečná/komplikovaná dosažitelnost zdravotnického zařízení.
2. Péče o děti s nově diagnostikovanou Imunitní trombocytopenií
Děti s nově diagnostikovanou ITP a žádným nebo lehkým kožním krvácením (stupeň krvácení 1, 2, v některých případech stupeň 3) není potřeba léčit, nutná je však pečlivá observace v ambulantním režimu s pravidelnými kontrolami 2–3x týdně (wait and see). Je nutno zdůraznit, že nerozhoduje pouze počet trombocytů, ale i klinický obraz. Nezbytné je poučení rodičů o nutných režimových opatřeních, především o nutnosti omezení fyzických aktivit dítěte, které by mohly způsobit trauma v oblasti hlavy a břicha (kontaktní sporty s možnou agresí spoluhráče nebo údery míče, jízda na kole, na kolečkových bruslích, skateboardu, gymnastika, lyžování, skoky). Je nutno vyloučit používání léků, které interferují s funkcí trombocytů, jako jsou léky obsahující kyselinu acetylsalicylovou a nesteroidní antiflogistika, především ibuprofen. Pro malé děti je doporučeno používat helmu pro ochranu hlavy a provést opatření k prevenci pádu z postele. Po úrazech, zejména traumatu hlavy nebo břicha, by dítě s ITP s nízkým počtem trombocytů mělo být neprodleně vyšetřeno lékařem s cílem vyloučit krvácení do CNS a břicha [8].
Observace pacienta bez léčby – nová kritéria
Podle literatury 19–35 % dětí s nově diagnostikovanou ITP může být pouze sledováno bez léčby a bez zvýšeného rizika závažného krvácení [5, 8]. Důvody k zahájení léčby jsou spojeny se zvýšenou závažností aktuálního krvácení a rizikovými faktory ICH (15 % dětí se stupněm 3 a 2 % bez stupně 3 bylo hospitalizováno pro progresi krvácení. Je pozorován trend zvýšeného rizika závažného krvácení při mnohočetných ložiscích krvácení.
Děti s krvácením odpovídajícím škále 1–3 mohou být léčeny ambulantně bez ohledu na počet trombocytů, při stupni 3 je však již vyšší pravděpodobnost nutnosti hospitalizace podle aktuálního nálezu [8].
Zásady
• hospitalizace pacienta je doporučena u části pacientů se stupněm 3 a vždy u stupně 4 podle aktuálního stavu a spolupráce s rodinou;
• rodiče musí být podrobně informováni o riziku závažného krvácení bez léčby a s léčbou a o možných vedlejších rizicích léčby;
• je nutno provést podrobný rozbor kvality života;
• pokud dítě není léčeno, rodiče musí bedlivě sledovat možné projevy krvácení a neprodleně kontaktovat ošetřujícího hematologa, který musí být dostupný kdykoliv!
Absolutní indikace k hospitalizaci
U dětských pacientů s klinicky významným krvácením (rozsáhlejší mukokutánní krvácení – tzv. vlhká purpura, déletrvající závažná epistaxe, krvácení do spojivky, gastrointestinálního traktu, hematurie, závažná metroragie) je vždy nutná léčba za hospitalizace v rámci první linie léčby nově diagnostikované ITP [8].
Léčbu je podle konsenzu expertů vhodné zvážit v následujících situacích:
• u výrazného kožního krvácení při trombocytech pod 10 x 109/l;
• při současné léčbě nesteroidními antiflogistiky nebo antikoagulační léčbě, kterou nelze přerušit, nebo přítomnosti jakéhokoli dalšího onemocnění predisponujícího ke krvácení;
• v případech, kdy není možné intenzivní sledování pacienta, například špatná dosažitelnost zdravotnického zařízení, nespolupráce rodiny;
• v rizikových situacích, které mohou vést u pacienta s trombocytopenií ke krvácení: trauma hlavy, nutnost invazivních výkonů, velmi aktivní způsob života s rizikem traumat;
• při symptomech významně snižujících kvalitu života (únavnost, úzkostné stavy s obavami z krvácení, omezení možností aktivit aj.).
Léčba 1. linie
Výběr léčebných modalit 1. linie léčby je dán, nedochází k žádné změně doporučení:
• kortikoidy (plná dávka nejdéle 14 dní),
• vysoké dávky intravenózních imunoglobulinů (HDIVIG),
• observace pacienta bez léčby,
• anti-D globulin (pouze v zemích s platnou registrací: USA, Kanada, v zemích EU již není používán).
Při srovnání efektu kortikoidů a IVIG nebyl prokázán rozdíl mezi procentem dosažených remisí, po podání IVIG byl popsán kratší interval k normalizaci počtu trombocytů a kratší doba hospitalizace. Při podání IVIG jsou vyšší finanční náklady na hospitalizaci [37].
a) Kortikoidy
Používají se v různých základních režimech, preferuje se podávání vysokých dávek krátkou dobu se snahou co nejdříve přejít na obdenní podávání malých dávek.
Jsou používány následující režimy:
• prednison 1–2 mg/kg denně per os po dobu 2 týdnů s následným postupným snižováním během 7 dnů;
• prednison 4 mg/kg denně per os po dobu 3–4 dnů; methyprednisolon 30 mg/kg/den i. v. po dobu 3–5 dnů;
• dexamethason 24 mg/m2 4 dny.
Po podání vysokých dávek kortikoidů dochází k rychlejšímu vzestupu počtu trombocytů. Není dostatek důkazů o tom, že některá z uvedených alternativ má signifikantně lepší efekt na dobu dosažení remise nebo prognózu onemocnění. V posledních letech je některými hematology preferována aplikace vysokých dávek kortikoidů v krátkém časovém intervalu. Při krátkodobém použití vysokých dávek kortikoidů dochází k rychlejšímu vzestupu počtu trombocytů a jsou minimalizovány jejich četné vedlejší účinky na dětský organismus patrné při dlouhotrvající aplikaci, především ovlivnění růstu. Bylo prokázáno, že dexamethason vede k rychlejšímu vzestupu počtu trombocytů ve srovnání s prednisonem, nikoli však k dosažení vyššího procenta remisí.
Přibližně u 50 % pacientů dojde po vysazení úvodní dávky kortikoidů k poklesu počtu trombocytů, který nemusí dosahovat původních hodnot v době diagnózy. Většina těchto pacientů nevyžaduje další léčbu. Odpověď na léčbu uvedenými dávkami prednisonu lze očekávat v 75 % v intervalu 2–7 dnů.
b) Vysoké dávky imunoglobulinů (HDIVIG)
Podání HDIVIG:
• vede k nejrychlejšímu vzestupu počtu trombocytů;
• je spojeno s rizikem vedlejších účinků (teploty, bolesti hlavy, neutropenie, hemolýza, aseptická meningitida);
• většinou dostačuje dávka 0,8 g/kg;
• nevýhodou je většinou nutnost hospitalizace;
• trvá riziko: výrobek z lidské plazmy.
HDIVIG se u dětí s ITP podávají obvykle v dávce doporučené panelem expertů: 0,8–1 g/kg [8]. Podání 2. dávky je doporučeno až po 72 hodinách v případě nedostatečné odpovědi. Na podání IVIG odpoví 80 % pacientů v období 1–2 dnů. Metaanalýza studií srovnávajících efekt kortikoidů a intravenózních imunoglobulinů konstatuje rychlejší efekt na zvýšení počtu trombocytů a kratší dobu hospitalizace při podání IVIG [37].
Při srovnání IVIG a observace pacienta se perzistující ITP vyvinula u 18,6 % pacientů s IVIg a 28,9 % pacientů ve skupině s pouhou observací. Počet trombocytů pod 100 x 109/L za 12 měsíců byl pozorován u 10 % dětí po podání IVIg a 12 % u pacientů s observací. Kompletní odpověď v prvních 3 měsících byla signifikantně vyšší ve skupině s IVIg [38].
c) Anti-D globulin
Je stále používán v některých zemích (USA, Kanada) jako lék 1. linie, a to v dávce 50–75 μg/kg jednorázově. V evropských zemích v současné době není z rozhodnutí evropské lékové asociace (EMEA) indikován pro léčbu ITP. Je vyhrazen pouze pro RhD pozitivní a nesplenektomované pacienty. Samotná aplikace trvá kratší dobu a nevyžaduje hospitalizaci, vždy je doprovázena poklesem hemoglobinu.
Metaanalýza srovnání efektu IVIG a anti-D globulinu prokázala lepší efekt podaných IVIG – ve srovnání s anti-D vedly IVIG k rychlejšímu nárůstu počtu trombocytů a měly by být preferovány jako lék první linie u dětí s akutními projevy krvácení [39].
Léčba život ohrožujícího krvácení
V případech závažného život ohrožujícího krvácení je nutno podat:
• transfuzi trombocytů (3x vyšší dávka obvykle podávaných trombocytů);
• intravenózní imunoglobuliny (1 g/kg);
• intravenózní methylprednisolon (30 mg/kg);
• při nedostatečném efektu přidat antifibrinolytika;
• podání TPO-RA může přispět k rychlejšímu nárůstu počtu trombocytů, pokud je iniciální doporučená terapie nedostatečná.
Léčebný postup je při nedostatečném efektu doporučeno opakovat za 24 hodin. Při život ohrožujícím krvácení je možno zvážit podání rekombinantního faktoru VIIa, případně v kombinaci s fibrinogenem [4].
V případě intrakraniálního krvácení může být výjimečně indikováno akutní provedení splenektomie nebo cílený neurochirurgický zákrok po předchozím podání trombocytů a další zvolené léčby k cílenému zvýšení trombocytů.
3. Léčba dětí s perzistující a chronickou ITP
– zásady přístupu k pacientům
a) Perzistující ITP
V období mezi 6.–12. měsícem trvání onemocnění je stále poměrně vysoká šance na dosažení remise. Jako prediktory remise do 12 měsíců jsou označovány: nižší věk, větší závažnost krvácení a léčba kortikoidy + imunoglobuliny [40].
Při nutnosti léčby je možno použít některý z léků první linie nebo sáhnout k léčebným modalitám 2. linie. Stejný postup je možno použít i při léčbě chronické formy onemocnění. Pokud to klinický stav a riziko krvácení dovolí, přichází v léčbě ITP v úvahu také pouhá observace s příslušnými režimovými opatřeními, případně periodické podávání kortikoidů nebo IVIG.
Názory na indikace podání léků 2. linie u dětí se dynamicky mění s rozvojem nových poznatků a vývojem nových léčiv. Dosud neexistuje jasný konsenzus jednotného léčebného postupu. Situace odráží i vzácný výskyt chronické ITP u dětí a často chybění studií s dostatečnou silou důkazu. Léčba dětí s ITP, u kterých není dosaženo remise po aplikaci léčby první linie, by měla být vedena zkušeným dětským hematologem.
Léčba 2. linie
Je indikována u dětí s perzistující nebo chronickou ITP.
Při přetrvávání trombocytopenie a před zahájením léčby je doporučeno dodržovat níže uvedené zásady:
• Po 3 měsících trvání trombocytopenie je nutno opakovat detailní analýzu anamnézy, podrobné klinické vyšetření, podrobné vyšetření KO včetně expertní analýzy nátěrů periferní krve s cílem vyloučení dosud skryté vyvolávající příčiny.
• Pokud není mezi 3 až 6 měsíci trvání tendence ke vzestupu trombocytů a není žádná odpověď na léčbu, je indikováno vyšetření kostní dřeně a cytogenetické vyšetření.
• Vyšetření kostní dřeně není indikováno před další léčbou, ani před nasazením TPO agonistů, pokud je diagnóza ITP jednoznačná.
• V odůvodněných případech je vhodné provést genetické vyšetření (WES nebo cílené sekvenování) k detekci vrozené trombocytopenie, syndromů selhání kostní dřeně, ev. vrozené poruchy imunity.
• Další vyšetření doporučovaná k objasnění diagnózy sekundární ITP jsou indikována podle vývoje příznaků onemocnění (tab. 3), především:
- vyloučení chronických infekcí (hepatitis, cytomegalovirus, HIV, a/nebo H. pylori u rizikových populací nebo pokud není jasná diagnóza),
- vyšetření markerů autoimunitních chorob k vyloučení onemocnění, která mohou vyžadovat specifickou léčbu (APLAs, ANAs, anti-kardiolipinové protilátky, lupus anticoagulans, opakované hladiny Ig),
- vyloučení komplexní imunodeficience,
- ostatní onemocnění uvedená v tabulce 3 dle aktuálního nálezu.
Metaanalýza studií možných prediktivních faktorů přechodu do chronicity uvádí následující prediktory rizika rozvoje chronické ITP u dětí: ženské pohlaví, vyšší věk v době manifestace, negativní anamnéza předchozí infekce nebo vakcinace, pozvolný začátek, vyšší počet trombocytů při diagnóze [40].
b) Chronická ITP
Při léčbě chronické ITP je vzhledem k dlouhému trvání onemocnění důležité především minimalizovat vedlejší účinky léčby, redukovat potřebu rescue a konkomitantní medikace, zajistit dostatečný počet trombocytů před chirurgickou intervencí a předejít krvácení při komorbiditách. Je nutné pečlivé sledování vývoje nemoci hematologem s vyloučením dosud skrytých příčin trombocytopenie (tab. 3). V odůvodněných případech je vhodné i provedení genetického vyšetření. Počet popsaných genetických změn uplatňujících se v patogenezi trombocytopenie narůstá [38].
Stanovení léčebného programu je vždy individuální a zohledňuje kromě klinického a laboratorního nálezu i věk dítěte a jeho temperament, dosažitelnost zdravotnického zařízení, možnosti spolupráce s rodinou. Léčba by měla být vedena dětským hematologem.
Na rozdíl od nově diagnostikované ITP, u které byla stanovena jasná doporučení založená na dostatečných důkazech, se doporučení pro léčbu dětí s chronickou ITP v poslední době rychle mění, především na podkladě vývoje nových léčiv. Dominuje snaha o oddálení nebo eliminaci nutnosti splenektomie.
Nejčastěji používanými léky 2. linie u dětí jsou v současné době TPO mimetika a léky s imunomodulačním a imunosupresivním účinkem. Nejlépe je dokumentován efekt TPO mimetik romiplostimu, eltrombopagu a imunosupresivní medikace rituximabem. Pozitivní efekt léčby byl popsán rovněž u MMF, sirolimu a azathioprinu.
• TPO agonisté
Eltrombopag a romiplostim nazývané rovněž jako TPO mimetika jsou v léčbě ITP používány již 6 let. Jejich mechanismus účinku spočívá ve stimulaci produkce trombocytů. Jsou zkoumány i jejich imunomodulační účinky. Pohled na jejich postavení v léčbě dětí s ITP se rychle vyvíjí. Efekt obou TPO mimetik používaných u dětských pacientů s ITP byl prokázán již v řadě randomizovaných placebem kontrolovaných studií, které byly zpracovány v systematických přehledech. Studie shodně prokázaly nárůst počtu trombocytů nad 50,0 x 109/l u 50–81 % dětských pacientů [41–46]. Oba léky mají v současnosti pro použití v léčbě ITP i u dětí nejvyšší stupeň důkazu (A1a). Eltrombopag je určen pro perorální podávání, romiplostim je podáván 1x týdně v subkutánní injekci.
Z nežádoucích účinků byly jako nejčastější popsány mírné bolesti hlavy, méně často kloubní a gastrointestinální příznaky. Po podání eltrombopagu byla popsána reverzibilní elevace transamináz, ojediněle rozvoj katarakty. V žádné ze studií se nevyskytly závažné vedlejší příznaky. Tromboembolické příhody popisované u dospělých pacientů nebyly u dětí pozorovány. Zatím nebyla popsána ani retikulinová fibróza v kostní dřeni po déletrvajícím podávání, která je popisována u dospělých.
Meta-analýzy shrnující výsledky řady randomizovaných placebem kontrolovaných studií použití eltrombopagu a romiplostimu u dětí a dospělých potvrdily evidenci třídy 1a o bezpečnosti a účinnosti pro léčbu dospělých i dětí s chronickou formou ITP. Výsledky léčby se nelišily signifikantně mezi dětmi a dospělými s výjimkou incidence krvácení, která byla vyšší u dětí.
U eltrombopagu byla zatím schválena indikace k použití pro děti s perzistující (po 3 měsících trvání nemoci) ITP ve věku 1–18 let. U romiplostinu je dosud schválena indikace k použití u dětí s chronickou formou onemocnění, očekává se uvolnění i pro perzistující ITP u dětí.
Přesto, že efekt TPO mimetik by měl být vázán na dobu podávání léku, bylo u části dospělých i dětských pacientů popsáno přetrvání zvýšení trombocytů i po vysazení léku, dokonce u pacientů s těžkou refrakterní formou onemocnění [47, 48]. Ke zhodnocení potenciálních vedlejších účinků při dlouhodobém podávání je třeba provést dalších studie.
U obou léků bylo ve fázi 3 randomizované, dvojitě slepé placebem kontrolované studie efektu na kvalitu života dětí s primární ITP prokázáno rovněž jednoznačné zlepšení kvality života u dětí s ITP a snížení psychické zátěže rodičů [49, 50].
Prospektivní studie TPO agonistů u dětí byly dosud zaměřeny pouze na pacienty s chronickou primární ITP. Zatím nejsou údaje o jejich možném použití u pacientů s nárokem na přechodné rychlé zvýšení počtu trombocytů, například před chirurgickými výkony nebo při protrahovaném krvácení. Toto použití se nabízí vzhledem k relativně rychlému nástupu účinku a krátkodobému působení stejně jako možné použití u sekundární ITP.
Vzhledem k nejvyšší úrovni důkazů (A1), prokázané možnosti dosažení dlouhodobé remise po vysazení léků a minimálním vedlejším účinkům se TPO mimetika stávají lékem první volby u dětských pacientů s perzistující a chronickou formou ITP.
• Rituximab
Rituximab má u dětí podobný bezpečnostní profil jako u dospělých. Jeho podání je i u dětí s ITP stále indikací „off label“. Dva systematické přehledy efektu rituximabu u dětí zahrnují 14 publikovaných retrospektivních studií hodnotících 323 dětských pacientů s ITP. Kompletní remise bylo dosaženo celkem u 39 % dětí a parciální remise u 68 % dětí. Medián trvání odpovědi byl 12,8 měsíců, vedlejší účinky mírné nebo středně závažné, nebylo popsáno žádné úmrtí [51, 52]. Rituximab může tedy dětským pacientům poskytnout možnost řady měsíců bez trombocytopenie [53]. Při hodnocení dlouhodobého efektu však bylo trvalé remise dosaženo pouze u 26 % léčených dětí s ITP [54]. Jediná prospektivní randomizovaná studie srovnávající efekt rituximabu s jinými léky prokázala signifikantně vyšší frekvenci pozitivní léčebné odpovědi ve srovnání s vincristinem při srovnatelném výskytu nežádoucích účinků. Po podání rituximabu byla u části dětí popsána hypogamaglobulinemie, která v některých případech vyžadovala substituční léčbu. Opakované podání rituximabu je u malých dětí potřeba velmi pečlivě zvážit vzhledem k riziku protrahovaného sekundárního imunodeficitu.
Pro léčbu chronické formy ITP je možno použít i relativně nové léky s imunosupresivním účinkem: mycophenolat mofetil [55, 56] a sirolimus [57, 58]. Tyto léky jsou v dětském věku užívány často u jiných autoimunitních onemocnění s přijatelným bezpečnostním profilem. Příznivý efekt mycophenolat mofetilu byl prokázán u dětí s ITP a Evansovým syndromem. Jejich pozitivní efekt u dětí s ITP byl prokázán na malých souborech pacientů. Systematické práce týkající se efektu azathioprinu u dětí s ITP nebyly publikovány.
• Cyklosporin A, cytostatika, Danazol
Zkušenosti s podáváním výše uvedených léků nejsou u dětí dostatečné a byly publikovány pouze malé soubory pacientů léčených Cyklosporinem A [59]. Používány jsou spíše výjimečně. Podávání cytostatik (cyklofosfamid, vincristin) je u dětí nutno velmi pečlivě zvážit. Většina těchto léků může mít velmi závažné vedlejší účinky, proto v současné době prakticky nejsou v léčbě ITP u dětí používány.
V zemích s nízkým socioekonomickým standardem je hojně využívána léčba Dapsonem, a to vzhledem k jeho dobré dostupnosti a přijatelné ceně [60].
• Splenektomie
Splenektomie je zatím jedinou možností léčby, která u významného procenta pacientů poskytuje dlouhotrvající až trvalý efekt. U dětských pacientů s chronickou formou ITP je dlouhodobá pozitivní odpověď na splenektomii popisována u 66–75 % pacientů.
Strategická pozice splenektomie v léčbě dětských pacientů s chronickou ITP je odlišná od dospělých a v posledních letech se zásadně změnila vzhledem k novým možnostem léčby. [61]. Splenektomie je u dětí velmi pečlivě zvažována v kontextu se zvýšeným dlouhodobým kumulativním rizikem sepse a s reálnou možností dosažení spontánní remise ITP i několik let po stanovení diagnózy [62]. Proto je indikována obvykle až po delší době trvání nemoci, než je tomu u dospělých pacientů. Podle posledního doporučení mezinárodní skupiny expertů je výkon indikován nejdříve až po roce od stanovení diagnózy, a to při rezistenci na léčbu s trvale nízkým počtem trombocytů s výraznými krvácivými projevy. Na druhé straně však může chronická ITP nezbytným omezením fyzických aktivit u některých dětí snížit významně kvalitu života, proto je potřeba při rozhodování o indikaci splenektomie u některých pacientů, hlavně adolescentů, brát i tuto skutečnost v úvahu. Rozhodnutí o splenektomii je proto individuální a může mimo jiné zohlednit i psychosociální aspekty a kvalitu života dětského pacienta.
Splenektomie se nedoporučuje u dětí do 5 let vzhledem k nezralosti imunitního systému a vysokému riziku infekcí. Při rozhodování o indikaci splenektomie je kladen velký důraz na vyloučení primárního imunodeficitu a vrozené trombocytopenie před plánovaným výkonem. Preferováno je použití laparoskopické techniky.
Před splenektomií se doporučuje očkování pneumokokovou a meningokokovou vakcínou 2–4 týdny před operací. Hemofilová vakcína se podává pouze neočkovaným pacientům. Profylaktická léčba penicilinem po splenektomii je indikována u dětí do 6 let, u starších dětí dle zvážení ošetřujícího lékaře podle imunologické kondice pacienta. Přístup k profylaxi však není jednotný, některými pracovními skupinami je zpochybňována. U dětí s chronickou ITP je z tohoto pohledu nutno brát v úvahu, že po dlouhodobé léčbě imunosupresivy a imunomodulačními léky (HDIVIG, kortikoidy a rituximab) může dojít k rozvoji sekundárního přechodného imunodeficitu. Přechodné podání penicilinové profylaxe je tedy u těchto pacientů opodstatněné.
Pozdní rizika splenektomie provedené u dítěte s ITP jako sepse, tromboembolické příhody a plicní hypertenze se mohou manifestovat až v dospělém věku a mohou mít velmi vážné důsledky. Jejich frekvence není známa. Některé studie uvádějí i zvýšené riziko vzniku maligních onemocnění v dospělosti. Pacientům je nutno zajistit celoživotní sledování.
KVALITA ŽIVOTA DĚTÍ S IMUNITNÍ TROMBOCYTOPENIÍ
Již několik studií prokázalo negativní dopad onemocnění na kvalitu života dětských pacientů. U řady z nich je pozorována nadměrná únavnost, deprese a anxieta [63–66]. Významný vliv má především závažnost onemocnění, způsob léčby a trvání nemoci. Sledování kvality života a psychologická podpora rodin a pacientů patří ke standardům péče o dětské pacienty s ITP.
Skupinou expertů byly v posledních 3 letech vypracovány velmi kvalitní pokyny a doporučení pro pohybové a sportovní aktivity u dětí s ITP, které jsou praktickým vodítkem pro učitele, rodiče i pacienty [67, 68].
Doporučení pro pohybové a sportovní aktivity u dětských pacientů s ITP:
• Děti a dospívající ve věku od 5 do 18 let potřebují 60 minut fyzické aktivity denně. To by mělo zahrnovat cvičení nebo sport s tréninkem velkých svalových skupin.
• Běžná docházka a hry v mateřské škole, základní škole nebo škole střední jsou podle věku zásadní. Riziko krvácení a informace o ITP by měly být školním zařízením poskytovány způsobem, který usnadňuje začlenění, nikoliv izolaci.
• Měla by být zachována aktivní účast na činnostech s nízkým rizikem, bez ohledu na počet krevních destiček a léčbu.
• Účast na aktivitách bez rizika musí být projednána s rodinou, školou – především pedagogem tělesné výchovy. Před účastí je třeba vzít v úvahu řadu faktorů včetně věku dítěte, počtu trombocytů, anamnézy krvácení a typu aktivity.
• Účast na vysoce rizikových aktivitách (například box, fotbal, lední hokej, lakros, jízda na motocyklu, motokrosové závody, silové zvedání, horolezectví, ragby, jízda na sněžném skútru, skoky na trampolíně a wrestling) by neměla být povolena, dokud nemá pacient téměř normální počet krevních destiček. Alternativně by měla být léčba podávána tak, aby byl zajištěn bezpečný počet trombocytů během rizikové aktivity.
• Přerušovanou nebo kontinuální léčbu lze poskytnout k pokrytí aktivit s odpovídající diskusí o rizicích vs. přínosech aktivity a léčby, s důrazem na rovnováhu mezi psychickou pohodou a riziky úrazu při aktuální léčbě.
• Volba léčby a cílový počet trombocytů musí být pečlivě hodnoceny na základě konstruktivní konzultace s rodinou a zvážení konkrétní požadované aktivity a tendence ke krvácení dítěte.
ZÁVĚR
Akutní ITP je onemocnění většinou s velmi dobrou prognózou a vysokým procentem odpovědí na léky první volby. Terapeutickým problémem zůstávají pacienti s chronickou ITP. I když nově dostupné léky (TPO agonisté, nová imunosupresiva) prokazatelně zlepšily výsledky léčby a kvalitu života dětí s chronickou ITP, stále zůstává skupina dětí rezistentních na dostupnou léčbu.
Poznatky v oblasti imunopatologie ITP se rychle rozvíjejí. Nová zkoumání imunologických mechanismů vzniku poukazují na jejich variabilitu a stimulují současně výzkum nových léčiv, která jsou cílena přímo na individuální typ vyvolávající příčiny ITP. Patří sem například léky ovlivňující sialylaci, Syk inhibitory, léky ovlivňující apoptózu trombocytů, Atorvastatin aj. S vývojem nových léčiv se otevírají nové trendy perzonalizované cílené léčby zaměřené na individuální imunopatologické mechanismy vzniku ITP.
Došlo: 10. 10. 2021
Přijato: 20. 10. 2021
Korespondující autorka:
Prof. MUDr. Dagmar Pospíšilová, Ph.D.
Dětská klinika Fakultní nemocnice a Lékařské fakulty Univerzity Palackého I. P. Pavlova 6
779 00 Olomouc
e-mail: Dagmar.Pospisilova@fnol.cz
Zdroje
1. Terrell DR, Beebe LA, Vesely SK, et al. The incidence of immune thrombocytopenic purpura in children and adults: A critical review of published reports. Am J Hematol 2010 Mar; 85 (3): 174–180.
2. Moulis G, Palmaro A, Montastruc JL, et al. Epidemiology of incident immune thrombocytopenia: a nationwide population - based study in France. Blood 2014 Nov 20; 124 (22): 3308–3315.
3. Yong M, Schoonen WM, Li L, et al. Epidemiology of paediatric immune thrombocytopenia in the General Practice Research Database. Br J Haematol 2010 Jun; 149 (6): 855–864.
4. Kühne T. Diagnosis and management of immune thrombocytopenia in childhood. Hamostaseologie 2017 Jan 31; 37 (1): 36–44.
5. Rodeghiero F, Stasi R, Gernsheimer T, et al. Standardization of terminology, definitions and outcome criteria in immune thrombocytopenic purpura of adults and children: report from an international working group. Blood 2009 Mar 12; 113 (11): 2386–2393.
6. Neunert C, Lim W, Crowther M, et al. The American Society of Hematology 2011 evidence-based practice guideline for immune thrombocytopenia. Blood 2011 Apr 21; 117 (16): 4190–4207.
7. Provan D, Stasi R, Newland AC, et al. International consensus report on the investigation and management of primary immune thrombocytopenia. Blood 2010 Jan 14; 115 (2): 168–186.
8. Provan D, Arnold DM, Bussel JB, et al. Updated international consensus report on the investigation and management of primary immune thrombocytopenia. Blood Adv 2019; 3 (22): 3780–3817.
9. Neunert C, Terrell DR, Arnold DM, et al. American Society of Hematology 2019 guidelines for immune thrombocytopenia. Blood Adv 2019 Dec 10; 3 (23): 3829–3866.
10. Smalisz-Skrzypczyk K, Romiszewski M, Matyasiak M, et al. The influence of primary cytomegalovirus or Epstein-Barr virus infection on course of idiopathic trombocytopenic purpura. Adv Exp Med Biol 2016; 878 : 83–88.
11. Shah I. Immune thrombocytopenic purpura: a presentation of HIV infection. J Int Assoc Provid AIDS Care 2013; 12 (2): 95–97.
12. Zhang W, Nardi MA, Borkowsky W, et al. Role of molecular mimicry of hepatitis C virus protein with platelet GPIIIa in hepatitis C-related immunologic thrombocytopenia. Blood 2009 Apr 23; 113 (17): 4086–4093.
13. Elalfy MS, Nugent D. Viruses, anti-viral therapy, and viral vaccines in children with immune thrombocytopenia. Semin Hematol 2016 Apr; 53 (Suppl 1): S70–S72.
14. O’Leary ST, Glanz JM, McClure DL, et al. The risk of immune thrombocytopenic purpura after vaccination in children and adolescents. Pediatrics 2012; 129 (2): 248–255.
15. Russo G, Miraglia V, Branciforte F, et al; AIEOP-ITP Study Group. Effect of eradication of Helicobacter pylori in children with chronic immune thrombocytopenia: a prospective, controlled, multicenter study. Pediatr Blood Cancer 2011; 56 (2): 273–278.
16. Treepongkaruna S, Sirachainan N, Kanjanapongkul S, et al. Absence of platelet recovery following Helicobacter pylori eradication in childhood chronic idiopathic thrombocytopenic purpura: a multi-center randomized controlled trial. Pediatr Blood Cancer 2009; 53 (1): 72–77.
17. Al-Samkari H, Kuter DJ. Antiplatelet antibody testing in immune thrombocytopenia and Evan’s syndrome: longitudinal serological evolution and relation to clinical features. Blood 2018; 132 (Suppl 1): 1137.
18. Al-Samkari H, Rosovsky RP, Karp Leaf RS, et al. A modern reassessment of glycoprotein-specific direct platelet autoantibody testing in immune thrombocytopenia. Blood Adv 2020; 4 (1): 9–18.
19. Chang M, Nakagawa PA, Williams SA, et al. Immune thrombocytopenic purpura (ITP) plasma and purified ITP monoclonal autoantibodies inhibit megakaryocytopoiesis in vitro. Blood 2003 Aug 1; 102 (3): 887–895.
20. Olsson B, Andersson PO, Jernas M, et al. T-cell-mediated cytotoxicity toward platelets in chronic idiopathic thrombocytopenic purpura. Nat Med 2003 Sep; 9 (9): 1123–1124.
21. Aslam R, Segel GB, Burack R et al. Splenic lymphocyte subtypes in immune thrombocytopenia: increased presence of a subtype of B-regulatory cells. Br J Haematol 2016; 173 : 159–160.
22. Talaat RM, Elmaghraby AM, Barakat SS, et al. Alterations in immune cell subsets and their cytokine secretion profile in childhood idiopathic thrombocytopenic purpura (ITP). Clin Exp Immunol 2014 May; 176 (2): 291–300.
23. Morodomi Y, Kanaji S, Won E, et al. Mechanisms of anti-GPIbα antibody-induced thrombocytopenia in mice. Blood 2020 Jun 18; 135 (25): 2292–2301.
24. Li J, van der Wal DE, Zhu G, et al. Desialylation is a mechanism of Fc-independent platelet clearance and a therapeutic target in immune thrombocytopenia. Nat Commun 2015 Jul 17; 6 : 7737.
25. Tao L, Zeng Q, Li J, et al. Platelet desialylation correlates with efficacy of first-line therapies for immune thrombocytopenia. J Hematol Oncol 2017 Feb 8; 10 (1): 46.
26. Neunert CE, Buchanan GR, Imbach P, et al. Severe hemorrhage in children with newly diagnosed immune thrombocytopenic purpura. Blood 2008 Nov 15; 112 (10): 4003–4008.
27. Neunert CE, Buchanan GR, Imbach P, et al. Bleeding manifestations and management of children with persistent and chronic immune thrombocytopenia: data from the Intercontinental Cooperative ITP Study Group (ICIS). Blood 2013 May 30; 121 (22): 4457–4462.
28. Neunert C, Noroozi N, Norman G, et al. Severe bleeding events in adults and children with primary immune thrombocytopenia: a systematic review. J Thromb Haemost 2015 Mar; 13 (3): 457–464.
29. Psaila B, Petrovic A, Page LK, et al. Intracranial hemorrhage (ICH) in children with immune thrombocytopenia (ITP): study of 40 cases. Blood 2009 Nov 26; 114 (23): 4777–4783.
30. Elalfy M, Elbarbary N, Khaddah N, et al. Intracranial hemorrhage in acute and chronic childhood immune thrombocytopenic purpura over a ten-year period: an Egyptian multicenter study. Acta Haematol 2010; 123 (1): 59–63.
31. Hill QA, Newland AC. Fatigue in immune thrombocytopenia. Br J Haematol 2015 Jul; 170 (2): 141–149.
32. Blatt J, Weston G, Gold C. Fatigue as marker of thrombocytopenia in childhood idiopathic thrombocytopenic purpura. Pediatr Hematol Oncol 2011 Feb; 27 (1): 65–67.
33. Noris P, Klersy C, Gresele P, et al. Platelet size for distinguishing between inherited thrombocytopenias and immune thrombocytopenia: a multicentric, real life study. Br J Haematol 2013; 162 (1): 112–119.
34. Cybulska A, Meintker L, Ringwald J, et al. Measurements of immature platelets with haematology analysers are of limited value to separate immune thrombocytopenia from bone marrow failure. Br J Haematol 2017; 177 (4): 612–619.
35. Almazni I, Stapley R, Morgan NV. Inherited thrombocytopenia: Update on genes and genetic variants which may be associated with bleeding. Front Cardiovasc Med 2019 Jun 19; 6 : 80.
36. Heitink-Pollé KM, Nijsten J, Boonacker CW, et al. Clinical and laboratory predictors of chronic immune thrombocytopenia in children: a systematic review and meta-analysis. Blood 2014 Nov 20; 124 (22): 3295–3307.
37. Beck CE, Nathan PC, Parkin PC, et al. Corticosteroids versus intravenous immune globulin for the treatment of acute immune thrombocytopenic purpura in children: a systematic review and meta-analysis of randomized controlled trials. J Pediatr 2005 Oct; 147 (4): 521–527.
38. Heitink-Pollé KMJ, Uiterwaal CSPM, Porcelijn L, et al. Intravenous immunoglobulin vs observation in childhood immune thrombocytopenia: a randomized controlled trial. Blood 2018; 132 (9): 883–891.
39. Lioger B, Maillot F, Ternant D, et al. Efficacy and safety of anti-D immunoglobulins versus intravenous immunoglobulins for immune thrombocytopenia in children: Systematic review and meta-analysis of randomized controlled trials. J Pediatr 2019 Jan; 204 : 225–233.
40. Bennett CM, Neunert C, Grace RF, et al. Predictors of remission in children with newly diagnosed immune thrombocytopenia: data from the Intercontinental Cooperative ITP Study Group Registry II participants. Pediatr Blood Cancer 2018; 65 (1): e26736.
41. Bussel JB, Buchanan GR, Nugent DJ, et al. A randomized, double-blind study of romiplostim to determine its safety and efficacy in children with immune thrombocytopenia. Blood 2011 Jul 7; 118 (1): 28–36.
42. Tarantino MD, Bussel JB, Blanchette VS, et al. Romiplostim in children with immune thrombocytopenia: a phase 3, randomised, double-blind, placebo-controlled study. Lancet 2016 Jul 2; 388 (10039): 45–54.
43. Li H, Yang H, Liu WJ. Efficacy of romiplostim in the treatment of ITP in children: a meta-analysis. Eur Rev Med Pharmacol Sci 2018 Sep; 22 (18): 6162–6169.
44. Wong RSM, Saleh MN, Khelif A, et al. Safety and efficacy of longterm treatment of chronic/persistent ITP with eltrombopag: final results of the EXTEND study. Blood 2017; 130 (23): 2527–2536.
45. Grainger JD, Locatelli F, Chotsampancharoen T, et al. Eltrombopag for children with chronic immune thrombocytopenia (PETIT2): a randomised, multicentre, placebo-controlled trial. Lancet 2015 Oct 24; 386 (10004): 1649–1658.
46. Elgebaly AS, Ashal GE, Elfil M, et al. Tolerability and efficacy of Eltrombopag in chronic immune thrombocytopenia: Metaanalysis of randomized controlled trials. Clin Appl Thromb Hemost 2017 Nov; 23 (8): 928–937.
47. Marshall AL, Scarpone R, De Greef M, et al. Remissions after long-term use of romiplostim for immune thrombocytopenia. Haematologica 2016; 101 (12): e476–e478.
48. González-López TJ, Pascual C, Álvarez-Román MT, et al. Successful discontinuation of eltrombopag after complete remission in patients with primary immune thrombocytopenia. Am J Hematol 2015; 90 (3): E40–E43.
49. Mathias SD, Li X, Eisen M, et al. A phase 3, randomized, double - blind, placebo-controlled study to determine the effect of romiplostim on health-related quality of life in children with primary immune thrombocytopenia and associated burden in their parents. Pediatr Blood Cancer 2016; 63 (7): 1232–1237.
50. Grainger JD, Blanchette VS, Grotzinger KM, et al. Healthrelated quality of life in children with chronic immune thrombocytopenia treated with eltrombopag in the PETIT study. Br J Haematol 2019; 185 (1): 102–106.
51. Liang Y, Zhang L, Gao J, et al. Rituximab for children with immune thrombocytopenia: a systematic review. PLoS One 2012; 7 (5): e36698.
52. Qu M, Zhou J, Yang SJ, et al. Efficacy and safety of rituximab for minors with immune thrombocytopenia: a systematic review and meta-analysis. J Int Med Res 2020 Oct; 48 (10): 300060520962348.
53. Dai WJ, Zhang RR, Yang XC, et al. Efficacy of standard dose rituximab for refractory idiopathic thrombocytopenic purpura in children. Eur Rev Med Pharmacol Sci 2015 Jul; 19 (13): 2379–2383.
54. Parodi E, Rivetti E, Amendola G, et al. Long-term follow-up analysis after rituximab therapy in children with refractory symptomatic ITP: identification of factors predictive of a sustained response. Br J Haematol 2009; 144 (4): 552–558.
55. Miano M, Ramenghi U, Russo G, et al. Mycophenolate mofetil for the treatment of children with immune thrombocytopenia and Evans syndrome. A retrospective data review from the Italian Association of Paediatric Haematology/Oncology. Br J Haematol. 2016 Nov; 175 (3): 490–495.
56. Panigrahi A, Clark A, Myers J, et al. A novel immunomodulatory treatment involving mycophenolate mofetil and corticosteroids for pediatric autoimmune cytopenias. Pediatr Blood Cancer 2017 Feb; 64 (2): 287–293.
57. Mousavi-Hasanzadeh M, Bagheri B, Mehrabi S, et al. Sirolimus versus cyclosporine for the treatment of pediatric chronic immune thrombocytopenia: A randomized blinded trial. Int Immunopharmacol 2020 Nov; 88 : 106895.
58. Jasinski S, Weinblatt ME, Glasser CL. Sirolimus as an effective agent in the treatment of immune thrombocytopenia (ITP) and Evans syndrome (ES): A single institution‘s experience. J Pediatr Hematol Oncol 2017 Aug; 39 (6): 420–424.
59. Liu AP, Cheuk DK, Lee AH, et al. Cyclosporin A for persistent or chronic immune thrombocytopenia in children. Ann Hematol 2016 Oct; 95 (11): 1881–1886.
60. Rodrigo C, Gooneratne L. Dapsone for primary immune thrombocytopenia in adults and children: an evidence-based review. J Thromb Haemost 2013 Nov; 11 (11): 1946–1953.
61. Rodeghiero F. A critical appraisal of the evidence for the role of splenectomy in adults and children with ITP. Br J Haematol 2018 Apr; 181 (2): 183–195.
62. Chaturvedi S, Arnold DM, McCrae KR. Splenectomy for immune thrombocytopenia: down but not out. Blood 2018 Mar 15; 131 (11): 1172–1182.
63. Heitink-Pollé KM, Haverman L, Annink KV, et al. Health-related quality of life in children with newly diagnosed immune thrombocytopenia. Haematologica 2014; 99 (9): 1525–1533.
64. Cooper N, Kruse A, Kruse C, et al. Immune thrombocytopenia (ITP) World Impact Survey (I-WISh): Impact of ITP on health-related quality of life. Am J Hematol 2021 Feb 1; 96 (2): 199–207.
65. Grainger JD, Young NL, Blanchette VS, et al. Quality of life in immune thrombocytopenia following treatment. Arch Dis Child 2013; 98 (11): 895–897.
66. Grainger JD, Blanchette VS, Grotzinger KM, et al. Healthrelated quality of life in children with chronic immune thrombocytopenia treated with eltrombopag in the PETIT study. Br J Haematol 2019; 185 (1): 102–106.
67. Kumar M, Lambert MP, Breakey V, et al; ITP Consortium of North America. Sports participation in children and adolescents with immune thrombocytopenia (ITP). Pediatr Blood Cancer 2015; 62 (12): 2223–2225.
68. Howell C, Scott K, Patel DR. Sports participation recommendations for patients with bleeding disorders. Transl Pediatr 2017; 6 (3): 174–180.
Štítky
Neonatologie Pediatrie Praktické lékařství pro děti a dorost
Článek Genu recurvatum congenitum
Článek vyšel v časopiseČesko-slovenská pediatrie
Nejčtenější tento týden
2021 Číslo 8- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Syndrom Noonanové: etiologie, diagnostika a terapie
-
Všechny články tohoto čísla
- Imunitní trombocytopenie – zkušenosti jednoho centra
- Langerhansova histiocytóza v dětském věku
- Zemřel MUDr. František Schneiberg
- Pneumokoková infekční endokarditida nativní aortální chlopně u 5letého chlapce očkovaného pneumokokovou vakcínou
- Genu recurvatum congenitum
- Současné pohledy na patofyziologii, diagnostiku a léčbu imunitní trombocytopenie v dětském věku
- História invazívneho merania tlaku krvi
- Česká lékařská společnost Jana Evangelisty Purkyně k elektronizaci zdravotnictví
- Správa o 36. Celoštátnej konferencii Spoločnosti dorastového lekárstva s medzinárodnou účasťou a 2. Šašinkovom memoriáli v dňoch 17.–18. septembra 2021 na Starých Horách
- Česko-slovenská pediatrie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Současné pohledy na patofyziologii, diagnostiku a léčbu imunitní trombocytopenie v dětském věku
- História invazívneho merania tlaku krvi
- Genu recurvatum congenitum
- Imunitní trombocytopenie – zkušenosti jednoho centra
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



