-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Imunitní trombocytopenie – zkušenosti jednoho centra
Immune thrombocytopenia – a single centre experience
Objective: Current treatment options and their efficacy in patients with immune thrombocytopenia – a single centre experience.
Patients and methods: Between years 2009 and 2019, 153 children with immune thrombocytopenia aged 4 months to 17 years (79 boys and 74 girls) were treated at our department. Early diagnosis of immune thrombocytopenia was made in 101 (66%) children, whereas 21 (14%) patients developed a persistent form and 31 (20%) chronic form.
Results: In 52 (34%) patients, „watch and wait“ strategy was sufficient. At the time of diagnosis, 72 (47%) patients were treated with intravenous immunoglobulins, 20 (13%) with steroids only, and 9 (6%) required both intravenous immunoglobulins and steroids. A complete response was achieved in 128 (84%) patients, 12 (8%) patients achieved partial response, and 13 (8%) had no response at all. There were no significant differences in the best achieved response between boys and girls or children of different ages. When evaluating the efficacy of steroid versus intravenous immunoglobulins treatment, there was no significant difference in the best response between the two groups (p=0.793). At least one relapse of immune thrombocytopenia occurred in 38 (25%) patients.
Patients with persistent or chronic immune thrombocytopenia were commenced on thrombopoietin analogues – 14 (9%), rituximab – 4 (3%), mycophenolate mofetil – 2 (1%), and sirolimus – 2 (1%). Splenectomy had to be performed only in three (2%) patients with chronic immune thrombocytopenia who failed all other previous treatment attempts.
Conclusion: Immune thrombocytopenia is relatively frequent haematological diagnosis in children. Most patients have achieved at least partial remission after the first-line treatment. For children with chronic immune thrombocytopenia, there is currently relatively wide range of treatment options available – thrombopoietin analogues, rituximab, sirolimus, mycophenolate mofetil and other immunosuppressives. Splenectomy, on the other hand, is considered as a last option, mainly for its potential risk of severe infections.
Keywords:
treatment options – children – immune thrombocytopenia
Autoři: V. Fiamoli 1; J. Blatný 1; P. Ovesná 2
Působiště autorů: Oddělení dětské hematologie a biochemie, Fakultní nemocnice Brno 1; Institut biostatistiky a analýz s. r. o., Brno 2
Vyšlo v časopise: Čes-slov Pediat 2021; 76 (8): 431-439.
Kategorie: Původní práce
Souhrn
Cíl: Seznámení s možnostmi léčby a její úspěšností u pacientů s imunitní trombocytopenií z pohledu jednoho centra.
Pacienti a metody: V letech 2009 až 2019 bylo v ambulanci Oddělení dětské hematologie a biochemie FN Brno léčeno 153 dětí s imunitní trombocytopenií ve věku od 4 měsíců do 17 let, 79 chlapců a 74 dívek. Nově diagnostikovanou formu mělo 101 dětí (66 %), u 21 (14 %) dětí došlo k přechodu na formu perzistentní a u 31 (20 %) dětí ve formu chronickou.
Výsledky: U 52 (34 %) dětí byla dostačující léčba „watch and wait“. V době diagnózy bylo monoterapií intravenózními imunoglobuliny léčeno 72 (47 %) pacientů, steroidy 20 (13 %) dětí, konsekutivní léčbou intravenózními imunoglobuliny a steroidy 9 (6 %) dětí. Kompletní odpovědi dosáhlo 128 (84 %) pacientů, pouze částečné odpovědi 12 (8 %) pacientů a 13 (8 %) pacientů bylo bez odpovědi. Nebyly zaznamenány významné rozdíly v nejlepší dosažené odpovědi u chlapců a dívek, ani u dětí různého věku. Při hodnocení efektivity léčby steroidy versus intravenózními imunoglobuliny nebyl prokázán významný rozdíl v nejlepší dosažené odpovědi mezi těmito dvěma skupinami (p = 0,793). U 38 (25 %) pacientů došlo alespoň k jednomu relapsu onemocnění.
S perzistentní či chronickou imunitní trombocytopenií bylo léčeno trombopoetinovými analogy 14 (9 %) pacientů, rituximabem 4 (3%) pacienti, mykofenolát mofetilem 2 (1%) děti, sirolimem 2 (1 %) děti. Ke splenektomii jsme museli přistoupit pouze u tří (2 %) pacientů s chronickou imunitní trombocytopenií.
Závěr: Imunitní trombocytopenie je poměrně častá hematologická diagnóza dětského věku. Většina pacientů dosáhla alespoň parciální remise již po léčbě první linie. Pro děti s chronickou imunitní trombocytopenií v současné době existuje široké spektrum léčebných možností – trombopoetinová analoga, rituximab, mykofenolát mofetil, sirolimus a další imunosupresiva. Ke splenektomii se pro zvýšené riziko vzniku závažné infekce přistupuje jako k nejzazšímu řešení.
Klíčová slova:
deti – možnosti léčby – imunitní trombocytopenie
ÚVOD
Imunitní trombocytopenie (ITP) je definována jako pokles trombocytů pod 100 000/μl [1]. Patofyziologie tohoto onemocnění zahrnuje fixaci komplementu k destičkám pomocí antitrombocytárních protilátek [2], destrukci způsobenou cytotoxickými T lymfocyty, abnormality T a B lymfocytů s poruchou distribuce cytokinů a postiženou megakaryopoézu [3–5].
Podle etiologie lze rozdělit ITP na dvě základní skupiny: primární ITP a sekundární ITP. Primární ITP, původně klasifikovaná jako idiopatická, následuje po virové infekci nejčastěji respirační či gastrointestinální, popřípadě infekcích typu EBV, CMV, parvovirus, varicella [6, 7]. Příčinou sekundární ITP může být mnoho různých faktorů. Řadí se mezi ně specifické infekce, jako např. HIV, hepatitida C, Helicobacter pylori [8–10], léky – některá antibiotika, antivirotika, nesteroidní antiflogistika a vakcíny [11], dále může být sekundární ITP součástí imunodeficitů [12], autoimunitních onemocnění [13], autoimunitního lymfoproliferativního syndromu, ale i malignit – zejména lymfomů [14]. Vzácně se může projevit po opakovaných transfuzích [15] a také může být součástí Evansova syndromu – imunitní bi/tricytopenie [16].
Odhadovaná incidence primární ITP u dětí je 2 až 5 případů na 100 000 doposud zdravých dětí [17]. Podle doby trvání rozlišujeme ITP na nově diagnostikovanou, která trvá do 3 měsíců od stanovení diagnózy, perzistentní trvající 3–12 měsíců a chronickou trvající déle než rok. ITP se v dětském věku vyskytuje nejčastěji mezi 2.–8. rokem. Kojenci tvoří 10 % pacientů s ITP, dětí starších 10 let je přibližně 20 % [18].
Mezi nejčastější klinické projevy patří zejména kožní a slizniční krvácení. Epistaxe a metroragie jsou popisovány asi u 20 % dětí [19], závažná krvácení včetně melény a makroskopické hematurie se vyskytují u 3 % pacientů a pouze 0,5 % pacientů s ITP krvácí do centrální nervové soustavy (CNS) [20].
Pro stanovení diagnózy ITP neexistuje zcela specifický či jednoznačný laboratorní test. U pacientů s nově diagnostikovanou ITP se odebírá krevní obraz s mikroskopickým diferenciálním rozpočtem leukocytů a IPF (immature platelet fraction), základní biochemické vyšetření, včetně hladiny imunoglobulinů a koagulační screening. U pacientů s perzistentní a chronickou ITP je nutno doplnit sérologie EBV, CMV, Parvoviru B19, hepatitid, HIV HHV6, HSV, antigen Helicobacter pylori, protilátky proti trombocytům, v případě podezření na systémové onemocnění antinukleární protilátky anti-ENA, ANA, revmatoidní faktor, antifosfolipidové protilátky, protilátky proti štítné žláze a přímý i nepřímý antiglobulinový test a protilátky proti leukocytům k vyloučení autoimunitních cytopenií. Dále lze doplnit vyšetření kostní dřeně k vyloučení hematologické malignity [21, 22].
Podle nových mezinárodních doporučení mohou být pacienti s lehkým kožním krvácením pouze sledováni – strategie „watch and wait“ (tab. 1) buď za hospitalizace (např. při horší dostupnosti zdravotního zařízení či zvýšené úzkostlivosti rodičů), nebo ambulantně s pravidelnými kontrolami krevního obrazu, nejčastěji 1–2krát týdně. Děti se slizničním či jiným závažným krvácením by měly být léčeny za hospitalizace [22]. První linií léčby jsou intravenózní imunoglobuliny (IVIG) a kortikosteroidy. Mezi druhou linii léčby, kterou využíváme u pacientů s perzistující či chronickou ITP, patří trombopoetinová (TPO) mimetika (romiplostin a eltrombopag), rituximab a jiné imunosupresivní léky, např. mykofenolát mofetil, sirolimus či cyklosporin (tab. 2) [21, 22]. U pacientů rezistentních na medikamentózní léčbu, s nízkým počtem trombocytů a krvácivými projevy je další možností splenektomie, která se vzhledem k nezralosti imunitního systému a vysokému riziku infekcí nedoporučuje u dětí mladších 5 let [21, 22].
Tab. 1. Škála krvácení (zdroj: citace [22]). ![Škála krvácení (zdroj: citace [22]).](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/24b8a854264701989174e5b34bcde44e.jpg)
Hb – hemoglobin Tab. 2. Léčba ITP (upraveno volně dle citace [21, 22]). ![Léčba ITP (upraveno volně dle citace [21, 22]).](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/f677c737058f004266734bc72ac2db22.jpg)
ITP – imunitní trombocytopenie, IVIG – intravenózní imunoglobuliny, TPO mimetika – trombopoetinová mimetika, RTX – rituximab,
MMF – mykofenolát mofetilSOUBOR A METODY
V letech 2009 až 2019 bylo v naší ambulanci léčeno 153 dětí s ITP ve věku od 4 měsíců do 17 let, 79 chlapců (52 %) a 74 dívek (48 %) viz graf 1. Průměrný věk v době stanovení diagnózy byl 5,8 let, medián 5 let. Kojenci tvořili 14 % pacientů, batolata a děti předškolního věku 46 % a děti starší 10 let 16 %.
Nově diagnostikovanou formu ITP manifestovalo 101 dětí (66 %), u 21 (14 %) došlo k přechodu na formu perzistentní a u 31 (20 %) dětí ve formu chronickou (graf 2). V našem souboru jsme retrospektivně posuzovali účinnost léčby při stanovení diagnózy a při prvním relapsu (pokles PLT pod 10x109/l). Parametrem hodnocení efektivity léčby bylo zvoleno dosažení kompletní (KO) či parciální odpovědi (PO). U pacientů s přístupem „watch and wait“ bylo hodnoceno pouze dosažení KO. U léčby druhé linie jsme posuzovali, zda léčba vedla u pacienta ke KO či PO, dlouhodobé remisi s možností úplného ukončení terapie, či v době sledování došlo opět k relapsu (pokles PLT pod 30x109/l), který vyžadoval další léčbu. Dále byly hodnoceny nežádoucí účinky jednotlivých léčebných modalit.
Graf 2. Typy ITP, ITP – imunitní trombocytopenie. 
Podle doporučení Americké hematologické společnosti pro léčbu ITP byla KO definována jako vzestup trombocytů nad 100x109/l, PO jako vzestup nad 30x109/l. Rychlost odpovědi na léčbu byla definována jako časná do 1 týdne od stanovení diagnózy, iniciální do 1 měsíce od stanovení diagnózy [23].
Kategoriální proměnné byly sumarizovány jako absolutní a relativní četnosti. K hodnocení a vizualizaci času do dosažení odpovědi byl použit Kaplanův-Meierův model; děti prozatím bez kompletní odpovědi byly cenzorovány k datu poslední návštěvy. Srovnání doby do dosažení odpovědi u více skupin bylo provedeno log-rank testem. Všechny testy byly provedeny jako oboustranné na 5% hladině významnosti. Analýza byla zpracována v programu R.
VÝSLEDKY
Iniciálně bylo léčeno monoterapií IVIG v dávce 1 g/kg 72 (47 %) pacientů, 45 (69 %) pacientů bylo léčeno 1 dávkou IVIG, 27 (41 %) pacientů 2 dávkami, pulzy methylprednisolonu (30 mg/kg) a následně prednison (1–2 mg/kg) per os byl podán 3 (2 %) dětem, pouze vysoce dávkovaný (4 mg/kg) p. o. prednison 8 (5 %) dětem a monoterapií prednison v dávce 1–2 mg/kg per os bylo léčeno 9 (6 %) pacientů. Konsekutivní léčbu IVIG a steroidy vyžadovalo 9 (6 %) dětí. Přístup „watch and wait“ byl dostačující u 52 (34 %) dětí.
Při léčbě nově diagnostikované ITP dosáhlo KO celkem 128 (84 %) pacientů, z nich 33 (26 %) již během týdne, 47 (37 %) během měsíce. Pouze PO dosáhlo 12 (8 %) pacientů – 10 (83 %) během týdne a 2 (17 %) během měsíce. Třináct (8 %) pacientů bylo bez odpovědi. Průměrný čas do KO byl 21 dní (minimum 1 den, maximum více než 6 let) (tab. 3, graf 3). Nebyly zaznamenány významné rozdíly v nejlepší dosažené odpovědi u chlapců a dívek ani dětí různého věku (tab. 4).
Tab. 3. Dosažená odpověď při léčbě nově diagnostikované ITP. 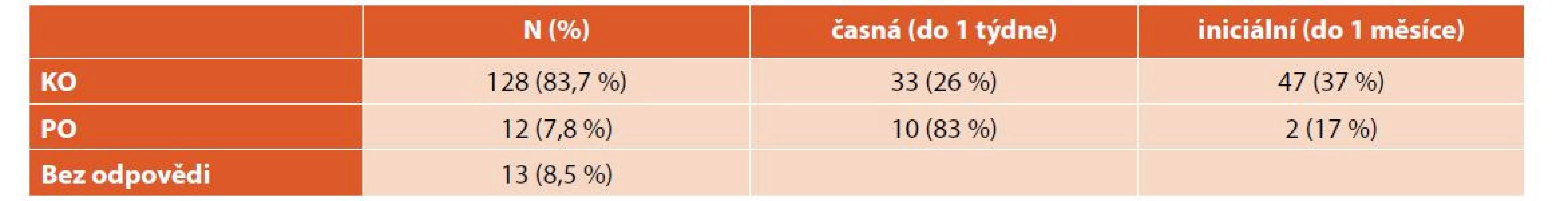
ITP – imunitní trombocytopenie, KO – kompletní odpověď, PO – parciální odpověď Graf 3. Dosažená odpověď při léčbě nově diagnostikované ITP. 
ITP – imunitní trombocytopenie, KO – kompletní odpověď, PO – parciální odpověď Tab. 4. Odpověď na léčbu nově diagnostikované ITP podle pohlaví a věku. 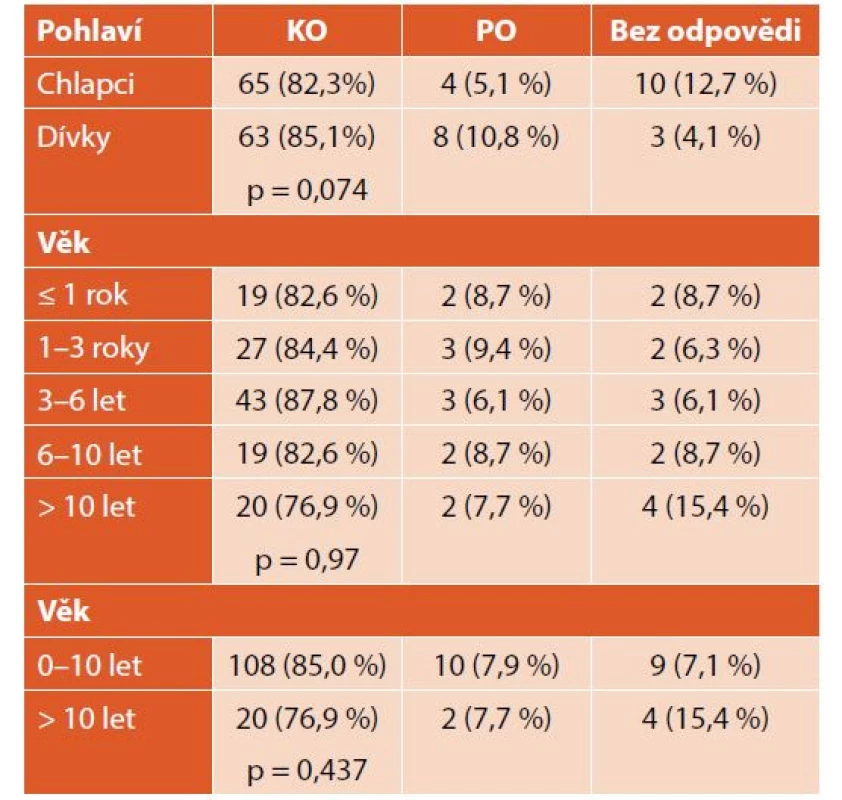
ITP – imunitní trombocytopenie, KO – kompletní odpověď, PO – parciální odpověď Při hodnocení efektivity léčby steroidy versus IVIG nebyl prokázán významný rozdíl v nejlepší dosažené odpovědi mezi těmito dvěma skupinami (p = 0,793), viz graf 4. Rozdílný byl ale medián času do dosažení KO, u IVIG byl 12,5 (8–18) dní, zatímco u steroidů 27,5 (13–285) dní. Rozdíl však nebyl statisticky významný.
Graf 4. Srovnání efektivity léčby steroidy a IVIG u nově diagnostikované ITP. 
ITP – imunitní trombocytopenie, KO – kompletní odpověď, PO – parciální odpověď,
IVIG – intravenózní imunoglobulinyU 38 (25 %) pacientů došlo alespoň k jednomu relapsu onemocnění. První relaps jsme léčili přípravky první linie (tab. 5). Pacienti s relapsem dosáhli při léčbě první linie častěji pouze PO než pacienti bez relapsu (p < 0,001), podrobněji v tabulce 6. Při léčbě prvního relapsu dosáhlo KO 25 (66 %), PO 6 (16 %) a bez odpovědi zůstalo 7 (18 %) pacientů (graf 5). Dva a více relapsů mělo 16 (11 %) pacientů, 4 (3 %) děti měly více jak 10 relapsů, nejvyšší počet relapsů byl 13.
Tab. 5. Léčba 1. linie prvního relapsu ITP. 
ITP – imunitní trombocytopenie, IVIG – intravenózní imunoglobuliny Tab. 6. Srovnání dosažené odpovědi u pacientů s relapsem a bez relapsu. 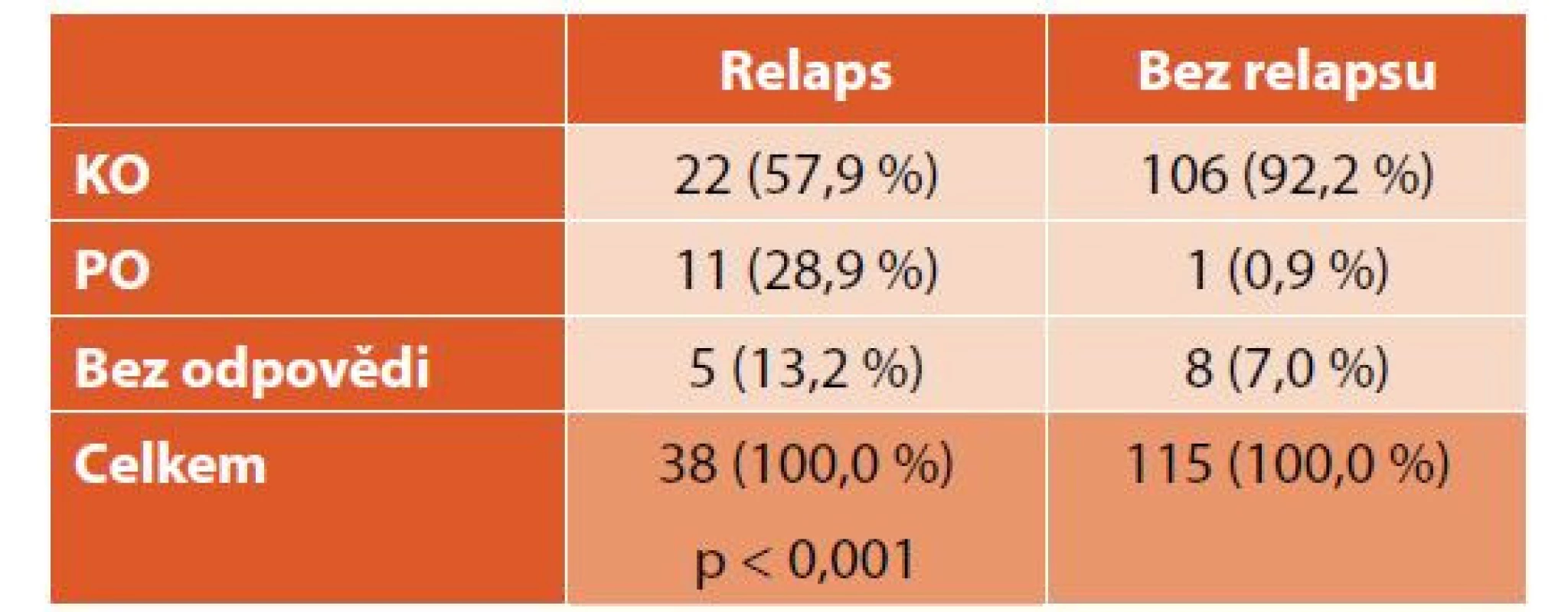
KO – kompletní odpověď, PO – parciální odpověď Graf 5. Odpověď na léčbu prvního relapsu. 
KO – kompletní odpověď, PO – parciální odpověď TPO analogy bylo léčeno celkem 14 (9 %) dětí, z toho 9 (64 %) romiplostinem a 5 eltrombopagem (36 %). Na léčbě romiplostinem 4 (44 %) děti dosáhly KO a léčba u nich mohla být ukončena, u 4 (44 %) pacientů měl přechodný efekt a 1 (12 %) dívka byla zcela bez odpovědi. Léčba eltrombopagem vedla ke KO a dlouhodobé remisi u 1 (20 %) pacienta, u 3 (60 %) pacientů měla přechodný efekt a 1 (20 %) pacientka na tuto léčbu vůbec nereagovala. Imunosupresivy bylo léčeno 8 (5 %) dětí, 4 (50 %) rituximabem, 2 (25 %) mykofenolát mofetilem a 2 (25 %) sirolimem. Léčba rituximabem vedla u jedné pacientky (25 %) ke KO a 5měsíční remisi, u 3 (75 %) pacientů neměla žádný efekt. Při léčbě sirolimem 1 (50 %) pacient dosáhl KO a 1 (50 %) PO. U obou pacientů byl efekt léčby pouze přechodný na dobu 2–3 měsíců. Léčba mykofenolát mofetilem nevedla u našich pacientů k žádné odpovědi.
Tři (2 %) z našich pacientů podstoupili splenektomii. U všech tří pacientů (jedna dívka a dva chlapci) byla splenektomie indikována pro závažnou formu ITP s hladinami trombocytů dlouhodobě nižšími než 5x109/l, a to i přes léčbu TPO mimetiky a imunosupresivy. U dívky vedla splenektomie k dlouhodobé remisi (déle jak 5 let), u jednoho chlapce k remisi na 2 roky, následně došlo opět k poklesu trombocytů vyžadujícímu léčbu a u jednoho chlapce neměla splenektomie žádný efekt (tab. 7).
Tab. 7. Léčba 2. linie. 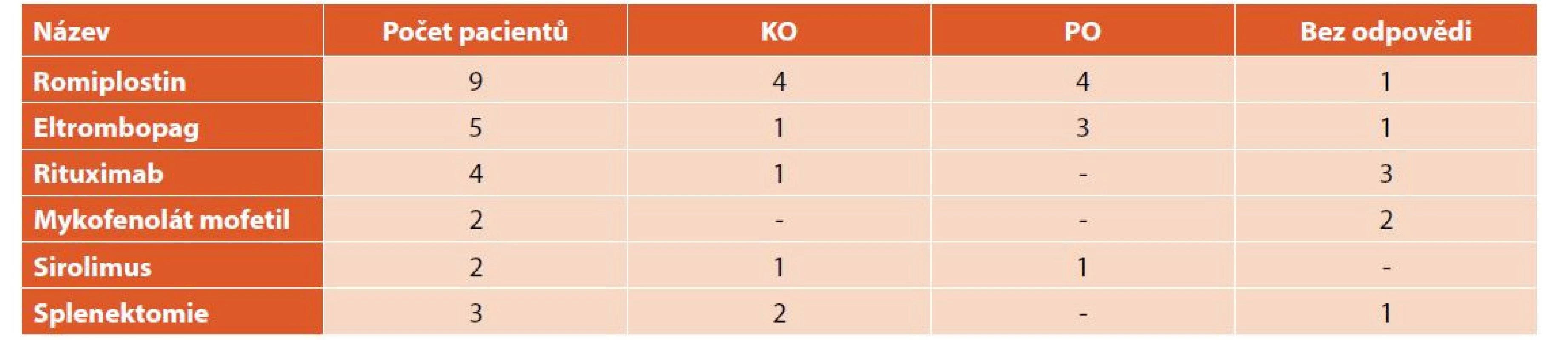
KO – kompletní odpověď, PO – parciální odpověď Závažné nežádoucí účinky léčby jsme zaznamenali pouze u 6 (4 %) pacientů léčených IVIG, jednalo se o bolesti hlavy či meningeální příznaky a 1 (1 %) pacientka na eltrombopagu měla zvýšené jaterní transaminázy.
DISKUSE
ITP je v dětské populaci relativně časté hematologické onemocnění, postihující převážně mladší děti mezi 2. a 8. rokem a v této věkové skupině je častější u chlapců [24]. V našem souboru byla četnost výskytu mezi dívkami a chlapci srovnatelná, ale stejně jako v práci publikované Terrelem, která se zabývala incidencí ITP [24], se i u našich pacientů ITP nejčastěji vyskytovala v kojeneckém, batolecím a předškolním věku. Tyto děti tvořily celkem 61 % všech pacientů. Chronická forma se vyvinula u 31 % dětí, což je na horní hranici publikovaných dat, která uvádí přechod do chronické formy u 20–30 % pacientů [24, 25]. I přes pokročilé diagnostické možnosti zůstává diagnostika ITP stále diagnózou „per exclusionem“. K vyloučení jiné příčiny trombocytopenie je důležitá pečlivá anamnéza a v úvodu zmiňovaná laboratorní vyšetření. Dříve bylo doporučováno vyšetřit kostní dřeň před zahájením léčby steroidy. S ohledem na recentní mezinárodní doporučení se od tohoto vyšetření, pokud klinický a laboratorní nález odpovídá ITP, ustupuje [22]. Na našem pracovišti u všech pacientů vstupně provádíme flowcytometrické vyšetření periferní krve k vyloučení potenciální hematologické malignity. Nová doporučení pro diagnostiku a léčbu ITP zavedla také změny v rozhodování o zahájení léčby, kdy se spíše přikláníme k posuzování krvácivých projevů než hladiny trombocytů [22]. V pediatrické populaci se závažná krvácení popisují u méně jak 10 % dětí a většinou mají tyto děti hladinu trombocytů nižší než 20 000/μl [26]. V našem souboru se závažná krvácení (epistaxe, makroskopická hematurie) vyskytla zcela raritně a vždy pouze při první atace ITP. Všichni tito pacienti měli hladiny trombocytů nižší než 5000/μl. Krvácení do zažívacího traktu či CNS jsme nezaznamenali vůbec. Dokonce ani u pacientů, kteří byli rezistentní na veškerou medikamentózní léčbu a několik let se jejich hodnota trombocytů pohybovala mezi 0–5000/μl, nedošlo k závažnějším krvácivým projevům, vyjma rozsáhlejšího kožního krvácení, a to zejména po inzultu. U jednoho z těchto pacientů docházelo po celou dobu onemocnění spontánně pouze ke zcela diskrétnímu výsevu petechií na bércích.
Standardem léčby nově diagnostikované ITP jsou IVIG a steroidy. Po podání IVIG by mělo dojít k rychlejšímu vzestupu hodnot trombocytů než při podání steroidů. Nicméně dlouhodobý efekt jejich léčby je srovnatelný [27]. Naši pacienti s nově diagnostikovanou ITP, kteří byli léčeni steroidy či IVIG, dosáhli ve více než 90 % minimálně PO. Rozdílný byl ale jejich medián času do dosažení KO, který byl u IVIG 12,5 (8–18) dní, zatímco u steroidů 27,5 (13–285) dní.
Za první volbu terapie druhé linie u perzistentní a chronické ITP jsou pro svou efektivitu, ale i bezpečnost s minimem nežádoucích účinků v současné době považována TPO mimetika [22]. Léčba romiplostinem je schválena pro dětské pacienty s chronickou ITP, revolade lze využít již pro pacienty s perzistující ITP.
Podle dostupných studií má 40 % dětí dlouhodobou (nad 6 měsíců) odpověď na léčbu eltrombopagem [28, 29] a 50 % na léčbu romiplostinem [30]. U většiny našich pacientů (80 % u eltrombopagu a 90 % u romiplostinu) vedla léčba TPO mimetiky k vzestupu trombocytů. Dlouhodobý efekt léčby v rozmezí 2–5 let jsme pozorovali u jednoho pacienta na eltrombopagu a u 4 pacientů na romiplostinu. Všichni naši pacienti na eltrombopagu vyžadovali maximální dávku 75 mg. Průměrná dávka romiplostinu u pacientů dobře odpovídajících na tento lék byla 7,5 μm/kg. Odlišný způsob podávání eltrombopagu a romiplostinu vyhovuje různým věkovým skupinám. Menší děti spíše preferují perorální podávání eltrombopagu. Větší děti, u nichž je již překonán strach ze subkutánní aplikace, upřednostňují romiplostin, který je aplikován pouze jednou týdně. Dietní opatření spojená s užíváním eltrombopagu výrazně nelimitovala ani jednoho pacienta.
Monoklonální protilátka rituximab je u ITP stále léčbou off label, na kterou zareaguje 23–69 % dětí [31–33], relaps do jednoho roku od zahájení léčby se vyskytuje u 14 až 42 % pacientů, dlouhodobá odpověď je zaznamenána pouze u 26 % pacientů [32–34]. Podle dat publikovaných Mianem v roce 2016 má mykofenolát mofetil lepší odpověď u pacientů s Evansovým syndromem než u pacientů s ITP, pravděpodobně na podkladě možné přídatné imunologické poruchy, u které by tento typ léčby mohl být přínosný [35].
Dalším z dobře tolerovaných imunosupresivních léků je sirolimus. Podle retrospektivních studií vede ke kompletní odpovědi u 60 až 83% dětských pacientů [36,37], nebyly u něj zaznamenány žádné zásadní nežádoucí účinky a navíc byla tato léčba úspěšná i u pacientů rezistentních na mykofenolát mofetil [37]. V našem centru jsme imunosupresivy léčili jen 8 (5 %) dětí. Tři z nich dosáhly alespoň parciální remise, ale u všech byl efekt léčby přechodný s maximem 5 měsíců. U 5 dětí nevedlo podání imunosupresiv k jakémukoliv vzestupu trombocytů.
Nežádoucí účinky léčby ITP u pacientů v našem souboru nebyly závažného charakteru. Při dlouhodobé léčbě steroidy jsme u většiny pacientů pozorovali pouze standardní nežádoucí účinky [38] – cushingoidní habitus, část dospívajících děti měla akné a u jednoho předškolního chlapce maminka zaznamenala změny nálad s většími emočními výkyvy. IVIG vyvolaly nežádoucí reakci pouze u 4 % pacientů. Jednalo se o bolesti hlavy a třesavku, 2 dívky měly i meningeální příznaky. I přesto, že se u podávání rituximabu popisuje možnost vzniku četných nežádoucích účinků od alergické reakce, přes horečku, atralgii, pneumonii, meningoencefalitidu, až po možnost vzniku běžného imunodeficitu s prolongovanou hypogamaglubilinemií a rizikem vzniku závažných infekcí [39], ani jeden z našich pacientů žádný z těchto nežádoucích účinků neměl. Podle studie PETIT může dojít při léčbě eltrombopagem ve 4,7 % k elevaci alaninaminotransferázy (ALT) [40]. Pětinásobné zvýšení ALT vedlo u jedné naší pacientky k ukončení léčby eltrombopagem. U jedné dívky užívající mykofenolát mofetil, u jednoho chlapce na sirolimu a u jednoho pacienta při užívání eltrombopagu jsme během léčby zaznamenali subjektivní pocit osobního diskomfortu. Současné možnosti léčby ITP umožňují u dětí volit splenektomii až jako poslední léčebnou možnost, a to pouze u pacientů, jejichž krvácivé projevy je ohrožují na zdraví či na životě.
Snažíme se tímto vyvarovat riziku rozvoje závažných infekcí u pacientů po splenektomii a při našem rozhodování hrají nezanedbatelnou roli i obavy rodičů či pacienta z operačního zákroku a jeho možných komplikací. Na našem pracovišti jsme splenektomii indikovali pouze u 3 pacientů rezistentních na dostupnou medikamentózní léčbu a dlouhodobě úspěšná byla pouze u 1 dívky. Dalo by se spekulovat, že i díky výběru pacientů je efekt splenektomie u našich pacientů horší než v publikované literatuře, která uvádí úspěšnost splenektomie u dětí mezi 65–75 % [41].
ZÁVĚRY
Možnosti léčby ITP u dětí jsou v současné době široké. Z našich dat vyplývá, že léčba ITP steroidy a IVIG je dostatečná u více než 70 % pacientů a srovnatelně efektivní. V minulých deseti letech se léčebné spektrum u dětí rozšířilo o TPO mimetika, která mají velmi dobrý efekt u většiny pacientů. Limitujícím faktorem je, že dle souhrnu údajů o léčivém přípravku lze romiplostin podat pouze u dětí s chronickou ITP a revolade sice již u dětí s perzistentní ITP, ale nejdříve 6 měsíců od stanovení diagnózy. Imunosupresivní léčbu, respektive splenektomii, ponecháváme jako poslední léčebnou možnost.
I přesto, že je počet pacientů, kteří jsou rezistentní vůči veškeré dostupné léčbě, ze statistického pohledu zanedbatelný, dopad neúspěšnosti léčby na psychiku těchto pacientů a jejich rodin je mnohdy velmi závažný a vyžaduje péči psychologa. Naději v další léčbě vidíme u léků, které jsou nyní dostupné pouze pro léčbu ITP u dospělých, např. Avatrombopag či Fostamatinib.
Nezanedbatelnou součástí péče o pacienty s ITP je kvalita jejich života. Naším cílem je dosáhnout bezpečné hladiny trombocytů, tj 50 000/μl, čímž se sníží riziko krvácení při běžných aktivitách na minimum.
Zkratky:
ALT – alaninaminotransferáza
CNS – centrální nervový systém
ITP – imunitní trombocytopenie
IVIG – intravenózní imunoglobuliny
KO – kompletní odpověď
PO – parciální odpověď
TPO – trombopoetin
Došlo: 20. 4. 2021
Přijato: 22. 9. 2021
Korespondující autorka:
MUDr. Veronika Fiamoli, Ph.D.
Oddělení dětské hematologie a biochemie
Dětská nemocnice Fakultní nemocnice Brno
Černopolní 9
613 00 Brno
e-mail: fiamoli.veronika@fnbrno.cz
Zdroje
1. Consolini R, legitimo A, Caparello MC. The cebtenary of imune thrombocytopeniea – Part 1: Revising nomenclature and pathogenesis. Front Pediatr 2016; 4 : 102.
2. Kuwana M. Dysregulated negative immune regulators in immune thrombocytopenia. VOX 2014; 9 : 217–222.
3. Cooper N, Bussel J. The pathogenesis of immune thrombocytopaenic purpura. Br J Haematol 2006; 133 (4): 364–374.
4. Johnsen J. Pathogenesis in immune thrombocytopenia: new insights. Hematology Am Soc Hematol Educ Program 2012; 2012 : 306–312.
5. Olsson B, Andersson PO, Jernas M. T-cell mediated cytotoxicity towards platelets in chronic idiopathic thrombocytopenic purpura. Nat Med 2003; 9 (9): 1123–1124.
6. Yenicesu I, Yetgin S, Ozyurek E, Aslan D. Virus-associated immune thrombocytopenic purpura in childhood. Pediatr Hematol Oncol 2002; 19 (6): 433–437.
7. Smalisz-Skrzypczyk K, Romiszewski M, Matyasiak M, et al. The influence of primary cytomegfalovirus or Epstein-Barr virus infection on course of idiopathic trombocytopenic purpura. Adv Exp Med Biol 2016; 878 : 83–88.
8. Shah I. Immune thrombocytopenic purpura: a presentation of HIV infection. J Int Assoc Provid AIDS Care 2013; 12 (2): 95–97.
9. Pacifico L, Osborn JF, Tromba V, et al. Helicobacter pylori infection and extragastric disorders in children: a critical update. Worl J Gastroenterol 2014; 20 (6): 1379–1401.
10. Sakuraya N, Murakami H, Uchiumi H, et al. Steroid-refractory chronic idiopathic thrombocytopenic purpura associated with hepatitis C virus infection. Eur J Haematol 2002; 68 (1): 49–53.
11. Reese JA, Nguyen LP, Buchanan GR, et al. Drug-induced thrombocytopenia in children. Pediatr Blood Cancer 2013; 60 (12): 1975–1981.
12. Notarangelo LD. Primary immunodeficiencies (PIDs) presenting with cytopenias. Haematology Am Soc Hematol Educ Program 2009; 1 : 139–143.
13. Liu Y, Chen S, Sun Y, et al. Clinical characteristic of immune thrombocytopenia associated with autoimmune disease: a restrospective study. Medicine 2016; 95 (50): e5565.
14. Stern M, Buser AS, Lohri A, et al. Autoimmunity and malignancy in hematology – more than an association. Crit Rev Oncol Hematol 2007; 63 (2): 100–110.
15. Kashyap E, Venkatesh S, Chouldry VP. Post transfusion purpura in thalassemic child. Indian Pediatr 1997; 34 (3): 246–247.
16. Jaime-Perez JC, Aguilar-Calderon PE, Salazar-Cavazos L, Gomez-Almaguer D. Evans syndrome: clinical perspectives, biological insights and treatment modalities. J Blood Med 2018; 9 : 171–184; 3 : 158–169.
17. Consolini R, Legitimo A, Caparello MC. The centenary of immune thrombocytopenia – Part 2: Revising diagnostic and therapeutic approach. Front Pediatr 2017; 5 : 179.
18. Neunert C, Buchanan GR, Imbach P, et al. Intercontinental childhood ITP study Group Registry II Participants. Severe hemorrage in children with newly diagnosed immune thrombocytopenic purpura. Blood 2008; 112 (10): 4003–4008.
19. Imbach P, Kuhne T, Muller D, et al. Childhood ITP: 12 months follow-up data from prospective registry I of the Intercontinental Childhood ITP Study Group (ICIS) Pediatr Blood Cancer 2006; 46 (3): 351–356.
20. Rosthoj S, Rajante J, Treutiger I, et al. NOPHO ITP working group. Duration and morbidity of chronic immune thrombocytopenic purpura in children: five years follow-up of a Nordic cohort. Acta Paediatr 2012; 101 (7): 761–766.
21. Kozák T, Čermák J, Červinek L, et al. Doporučení ČHS pro diagnostiku a léčbu imunitní trombocytopenie. Transfuze Hematol Dnes 2017; 3 : 158–169.
22. Provan D, Arnold DM, Bussel JB, et al. Updated international consensus report on the investigation and management of primary immune thrombocytopenia. Blood Adv 2019; 3 (22): 3780–3817.
23. Neunert C, Terrell DR, Arnold AM, et al. American Society of Hematology 2019 guidelines for immune thrombocytopenia. Blood Adv 2019; 3 (23): 3829–3866.
24. Terell DR, Beebe LA, Vesely SK, et al. The incidence of immune thrombocytopenic purpura in children and adults: A critical review of published reports. Am J Hematol 2010; 85 (3): 174–180.
25. Heitink-Polle KM, Nijsten J, Boonacker CW, et al. Clinical and laboratory predictors of chronic immune thrombocytopenia in children: a systematic review and meta-analysis. Blood 2014; 124 (22): 3295.
26. Kühne T. Diagnosis and management of immune thrombocytopenia in childhood. Hämostaseologie 2017; 37 : 36–44.
27. Celik M, Bulbul A, Aydogan G, et al. Comparison of anti-D immunoglobulin, methylprednisolone, or intravenous immunoglobulin therapy in newly diagnosed pediatric immune thrombocytopenic purpura. J Thromb Thrombolysis 2013; 35 (2): 228–233.
28. Bumess CB, Keating GM, Garnock-Jones KP. Eltrombopag: A review in pediatric chronic immune thrombocytopenia. Drugs 2016; 76 (8): 869–878.
29. Grainger JD, Locatelli F, Chotsampancharoen T, et al. Eltrombopag for children with chronic immune thrombocytopenia (PETIT2): a randomised, multicentre, placebo-controlled trial. Lancet 2015; 386 (10004): 1649–1658.
30. Bussel JB, Hsieh L, Buchanan GR, et al. Long-term use of thrombopoietin mimetic romiplostim in children with severe chronic thrombocytopenia (ITP). Pediatr Blood Cancer 2015; 62 : 208–213.
31. Grace RF, Bennett CM, Ritchey AK, et al. Response to steroids predicts response to rituximab in pediatric chronic immune thrombocytopenia. Pediatr Blood Cancer 2012; 58 (2): 221–225.
32. Parodi E, Rivetti E, Amendola G, et al. Long-term follow-up analysis after rituximab therapy in children with refractory symptomatic ITP: identification of factors predictive of a sustained response. Br J Haematol 2009; 144 (4): 5 52–558.
33. Mueller BU, Bennett CM, Feldman HA, et al. Glaser Pediatric Research Network. One year follow-up of children and adolescents with chronic immune thrombocytopenic purpura (ITP) treated with rituximab. Pediatr Blood Cancer 2009; 52 (2): 259–262.
34. Patel VL, Mahevas M, Lee SY, et al. Outcomes 5 years after response to rituximab therapy in children and adults with immune thrombocytopenia. Blood 2012; 119 (25): 5989–5995.
35. Miano M, Ramenghi U, Russo G, et al. Mycophenolat mofetil for the treatment of children with immune thrombocytopenia and Evans syndrome. A retrospective data review from the Italian Association of Paeditatric Haematology/Oncology. Br J Haematol 2016; 175 : 490–495.
36. Jasinski S, Weinblatt ME, Glasser CL. Sirolimus as an effective agent in the treatment of immune thrombocytopenia (ITP) and Evans syndrome (ES): a single institution’s experience. J Pediatr Hematol Oncol 2017; 39 (6): 420–424.
37. Miano M, Scalzone M, Perri K, et al. Mycophenolate mofetil and sirolimus as second or further line treatment in children with chronic refractory primitive or secondary autoimmune cytopenias: a single centre experience. Br J Haematol. 2015; 171 : 247–253.
38. Rudolf K, Malý J. Kortikosteroidy a imunosupresiva v chronické léčbě. Prakt Lékáren 2011; 7 (5): 228–231.
39. Bennet CM, Rogers ZR, Kinnamon DD, et al. Prospective phase ½ study of rituximab in childhood and adolescent chronic immune thrombocytopenic purpura. Blood 2006; 107 : 2639–2642.
40. Bussel JB, de Miguel PG, Despotovic JM, et al. Eltrombopag for the treatment of children with persistent and chronic immune thrombocytopenia (PETIT): a randomised, multicentre, placebo - controlled study. Lancet Haematol 2015 Aug; 2 (8): e315–e325.
41. Rubin LG, Schaffner W. Clinical practice. Care of asplenic patient. N Engl J Med 2014; 371 (4): 349–356.
Štítky
Neonatologie Pediatrie Praktické lékařství pro děti a dorost
Článek vyšel v časopiseČesko-slovenská pediatrie
Nejčtenější tento týden
2021 Číslo 8- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Stillova choroba: vzácné a závažné systémové onemocnění
-
Všechny články tohoto čísla
- Imunitní trombocytopenie – zkušenosti jednoho centra
- Langerhansova histiocytóza v dětském věku
- Zemřel MUDr. František Schneiberg
- Pneumokoková infekční endokarditida nativní aortální chlopně u 5letého chlapce očkovaného pneumokokovou vakcínou
- Genu recurvatum congenitum
- Současné pohledy na patofyziologii, diagnostiku a léčbu imunitní trombocytopenie v dětském věku
- História invazívneho merania tlaku krvi
- Česká lékařská společnost Jana Evangelisty Purkyně k elektronizaci zdravotnictví
- Správa o 36. Celoštátnej konferencii Spoločnosti dorastového lekárstva s medzinárodnou účasťou a 2. Šašinkovom memoriáli v dňoch 17.–18. septembra 2021 na Starých Horách
- Česko-slovenská pediatrie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Současné pohledy na patofyziologii, diagnostiku a léčbu imunitní trombocytopenie v dětském věku
- História invazívneho merania tlaku krvi
- Genu recurvatum congenitum
- Imunitní trombocytopenie – zkušenosti jednoho centra
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání




