-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Alergická bronchopulmonálna aspergilóza u detských pacientov s cystickou fibrózou
Allergic bronchopulmonary aspergillosis in pediatric patients with cystic fibrosis
Allergic bronchopulmonary aspergillosis (ABPA) is hypersensitive IgE-associated reaction, which occurs as a response of predisposed host to the colonisation of bronchial tree by fungal pathogen Aspergillus fumigatus with production of specific IgE antibodies against certain aspergillus antigens. It occurs almost exclusively in patients with cystic fibrosis or asthma. The disease manifests with increased frequency of pulmonary exacerbations not responding well to conventional therapy, while these exacerbations are characterised by increased mucus and sputum production as well as recurrect attacks of bronchial obstruction. If ABPA is not diagnosed and treated soon enough, it could cause accelerated progression of pulmonary fibrotisation together with the development of cylindrical central bronchiectasis and also lead to irreversible airway damage. Submitted text contains not only an introduction to the topic of such a complex disease, but also a short report on a small cohort of patients with ABPA and cystic fibrosis who are under care of our pediatric center in Košice.
Keywords:
Cystic fibrosis – Aspergillus fumigatus – allergic bronchopulmonary aspergillosis
Autoři: Z. Hribíková; A. Feketeová
Působiště autorů: Klinika detí a dorastu UPJŠ LF a DFN Košice, Slovensko
Vyšlo v časopise: Čes-slov Pediat 2019; 74 (7): 411-423.
Kategorie: SYMPOZIUM: cystická fibróza
Souhrn
Alergická bronchopulmonálna aspergilóza (ABPA) predstavuje hypersenzitívnu IgE-asociovanú reakciu, ktorá vzniká ako odpoveď predisponovaného organizmu na kolonizáciu bronchiálneho stromu mykotickým patogénom Aspergillus fumigatus, pričom dochádza k tvorbe špecifických IgE protilátok namierených proti niektorým aspergilovým antigénom. Vyskytuje sa takmer výlučne u pacientov s diagnózou cystická fibróza, eventuálne asthma bronchiale. Prejaví sa zvýšenou frekvenciou pľúcnych exacerbácií nedostatočne reagujúcich na konvenčnú terapiu, ktoré sú okrem zvýšenej produkcie hlienu a spúta charakterizované najmä rekurentnými atakmi obštrukcie dýchacích ciest. Ak nie je včas diagnostikovaná a adekvátne liečená, môže mať za následok rýchlejšiu progresiu fibrotickej prestavby pľúcneho parenchýmu spolu s tvorbou cylindrických centrálnych bronchiektázií a viesť tak k ireverzibilnému poškodeniu dýchacích ciest.
Súčasťou predkladaného textu je nielen úvod do problematiky tohto komplexného ochorenia, ale aj stručná charakteristika malého súboru pacientov s ABPA a cystickou fibrózou, ktorí sú v starostlivosti nášho pediatrického centra v Košiciach.
Klíčová slova:
alergická bronchopulmonálna aspergilóza – cystická fibróza – Aspergillus fumigatus
ÚVOD
Cystická fibróza
Cystická fibróza (CF) je známa ako najčastejšie auto - zomálne recesívne dedičné ochorenie v kaukazskej populácii s incidenciou 1 : 2500 živo narodených detí. Je spôsobená mutáciou v géne pre proteín CFTR (cystic fibrosis transmembrane conductance regulator), ktorá má vďaka rôznorodej lokalizácii CFTR za následok multiorgánové postihnutie. Najvýraznejšie sú však postihnuté pľúca pacienta, pričom pulmonálne komplikácie CF sú nielen najčastejšie, ale z klinického hľadiska aj najzávažnejšie. Medzi takéto komplikácie patrí aj alergická bronchopulmonálna aspergilóza [1, 2].
Alergická bronchopulmonálna aspergilóza
Alergická bronchopulmonálna aspergilóza (ABPA) je charakterizovaná hypersenzitívnou reakciou sprostredkovanou imunoglobulínmi triedy E (IgE) a odpoveďou T-helper 2 (Th2) lymfocytov [3, 9]. Vzniká ako následok kolonizácie dýchacích ciest spórami Aspergillus fumigatus u predisponovaného jedinca, ktorými sú predovšetkým pacienti s cystickou fibrózou, prípadne bronchiálnou astmou [4]. Následkom spomínanej kolonizácie dýchacích ciest je ich pretrvávajúca iritácia prítomnými aspergilovými antigénmi vedúca k nadmernej produkcii hlienu, poškodzovaniu riasinkového epitelu dýchacích ciest a chronickým zápalovým zmenám [1, 5]. Spoločne dané procesy vedú k výraznej akcelerácii fibrotizácie pľúcneho parenchýmu a tvorbe bronchiektázií. Manifestuje sa zhoršením klinického stavu pacienta, opakovanými epizódami bronchiálnej obštrukcie a zvýšenou frekvenciou exacerbácií základného ochorenia [1, 3, 9].
EPIDEMIOLÓGIA
Presný výskyt ABPA u pacientov s CF nie je dostatočne známy a získané údaje sa líšia mnohokrát nielen medzi krajinami, ale aj v rámci lokálnych centier. Ako dôvod väčšina autorov uvádza chýbanie jednotných diagnostických kritérií ešte v čase veľkých populačných štúdií a nedostatočnú štandardizáciu odporúčaných laboratórnych vyšetrení v zmysle medzinárodnej variability používaných metodík a techník [6, 7, 8, 32].
V 90-tych rokoch 20. storočia Európsky register pre cystickú fibrózu (European Registry of Cystic Fibrosis – ERCF) zozbieral údaje o 12 447 pacientov s CF spomedzi 224 centier v 9 európskych krajinách. Takto zistená celková prevalencia ABPA v tejto populácii bola 7,8 %, pričom najnižšia bola vo Švédsku (2,1 %) a najvyššia v Belgicku (13,6 %) [10]. Na druhej strane, v rámci veľkej medzinárodnej Epidemiologickej štúdie cystickej fibrózy (Epidemiological Study of Cystic Fibrosis – ESCF) realizovanej v Spojených štátoch a v Kanade približne v rovnakom období ako v Európe bola zaznamenaná prevalencia len 2,2 % [5]. Výrazne variabilný bol aj výskyt udávaný v rámci medzinárodnej štúdie zahŕňajúcej 30 krajín v rôznych častiach sveta, kde sa prevalencia u pediatrických pacientov s CF pohybovala v rozsahu menej než 1 % v Srbsku, približne 9,1 % vo Francúzsku a až 18,6 % vo Švajčiarsku [11].
Najnovšie údaje o výskyte ABPA v populácii pacientov s CF sú k dispozícii z dát zbieraných pacientským regist-rom v rámci European Cystic Fibrosis Society (ECFS) Patient Registry. Prevalencia medzi jednotlivými zúčastnenými krajinami je aj naďalej veľmi variabilná. Kým v Litve a Lotyšsku nezaznamenali v rokoch 2010 až 2017 ani jediný prípad ABPA, dlhodobo najvyššiu prevalenciu ABPA má Francúzsko, v priemere približne 10,39 % (najvyššiu v roku 2011, a to 12,61 %) (tab. 1) [12–19].
Tab. 1. Prevalencia ABPA u pacientov s cystickou fibrózou (European Cystic Fibrosis Society Patient Registry) [12–19]. ![Prevalencia ABPA u pacientov s cystickou fibrózou (European Cystic Fibrosis Society Patient Registry) [12–19].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/d4316159abbc8aec424f02dbceb147be.jpeg)
Podľa výsledkov analýzy severoamerickej ESCF bol zaznamenaný vyšší výskyt ABPA medzi adolescentmi, u pacientov s nižšími hodnotami parametrov pľúcnych funkcií a tiež u jedincov kolonizovaných Pseudomonas aeruginosa [5]. Výsledky európskych dát ERCF skôr pouka-zovali na súvislosť ABPA s horším nutričným stavom pacienta, ako aj s kolonizáciou Pseudomonas aeruginosa a Stenotrophomonas maltophilia [10].
IMUNOPATOGENÉZA
Vzhľadom na komplexnosť procesov zahrnutých do vzniku a rozvoja ABPA nie je patogenéza tohto ochorenia plne objasnená. Predpokladá sa, že ABPA vzniká len u geneticky predisponovaných pacientov schopných špecifickým spôsobom reagovať na antigénnu stimuláciu spôsobenú Aspergillus fumigatus [21].
Po inhalácii aspergilových spór dochádza k ich zachyteniu v dýchacích cestách, lokálnej germinácii a tvorbe mycélií. Tie uvoľňujú alergény, ktoré sú spracované antigén prezentujúcimi bunkami nesúcimi molekuly HLA-DR2 alebo HLA--DR5 a takto vystavené T-lymfocytom v bronchoalveolárnom lymfatickom tkanive (BALT). To indukuje vyzrievanie naivných T-lymfocytov s preferenciou Th2 odpovede, čo má za následok aktiváciu B-lymfocytov s masívnou tvorbou IgE. Práve imunoglobulíny triedy E majú kľúčovú úlohu v sprostredkovaní hypersenzitívnej reakcie. Hoci Th2 odpoveď je v rámci ABPA prevládajúca, časť imunitných procesov má aj charakter Th1 odpovede spolu s tvorbou IgA a IgG protilátok namierených špecificky voči antigénom Aspergillus fumigatus. Okrem sprostredkovania produkcie IgE sú T-lymfocyty zodpovedné aj za syntézu a sekréciu prozápalových cytokínov – interleukínov (IL) IL-4, IL-5 a IL-13, ktoré stimulujú tvorbu a diferenciáciu eozinofilov spolu s ich migráciou do pľúc. Vzniká tak chronický eozinofilný zápal v dýchacích cestách, ktorý vedie k produkcii hustého hlienu, poškodeniu bronchiálnej steny, bronchiálnej hyperreaktivite a v dôsledku kombinácie opakovaného poškodzovania a reparačných, remodelačných dejov aj k výraznej progresii fibrotizácie pľúcneho tkaniva a tvorbe bronchiektázií [3–5, 22].
Existuje niekoľko rizikových faktorov a predpokladov pre rozvoj ABPA a už samotná diagnóza cystickej fibrózy do istej miery vytvára podmienky vhodné pre ABPA. Kým u inak zdravých jedincov po inhalácii spór A. fumigatus, ktoré sa inak bežne nachádzajú v ovzduší, dôjde k ich včasnému odstráneniu riasinkovým epitelom, porucha mukociliárneho transportu a tvorba väzkého hlienu prítomná u pacientov s CF vedie k akumulácii a perzistencii spór v dýchacích cestách a sekrétoch pacienta, a teda k chronickej antigénnej stimulácii [1, 5, 23]. Medzi ďalšie najčastejšie popisované predisponujúce faktory patrí napríklad polymorfizmus pre receptor IL-4, ale aj genetická väzba na niektoré HLA-DR molekuly – kým prítomnosť HLA-DR2 a HLA-DR5 je jednou z podmienok vzniku ABPA, prítomnosť HLA-DQ2 má práve naopak protektívnu úlohu [20, 24, 25].
KLINICKÉ PREJAVY
Klinická manifestácia ABPA je pomerne nešpecifická a vo veľkej miere sa prekrýva so symptómami cystickej fibrózy prítomnými počas jej exacerbácie. Klinický obraz ABPA zahŕňa prejavy bronchiálnej obštrukcie, zhoršený produktívny kašeľ so zvýraznenou produkciou výrazne viskózneho hnedavého spúta, niekedy až výskyt hemo-ptýzy. Prítomné môžu byť febrility a subfebrility, únava, malátnosť, zvýšená intolerancia námahy, v niektorých prípadoch aj strata hmotnosti. Veľmi zriedkavo môžu byť pacienti aj asymptomatickí [26, 27].
DIAGNOSTIKA
Stanovenie diagnózy ABPA je založené na prítomnosti špecifickej kombinácie klinických a laboratórnych prejavov, ako aj nálezov zobrazovacích vyšetrení [27]. Žiaľ, u pacientov s CF je pomerne náročné, najmä vzhľadom na prelínanie sa prejavov ABPA spolu s manifestáciami bežne prítomnými v rámci CF [26]. Preto je dôležité myslieť na ABPA predovšetkým u pacientov, ktorí nereagujú na liečbu exacerbácie CF. Rozhodujúci je dôkaz imunopatologickej reakcie s tvorbou IgE a špecifických protilátok [5].
LABORATÓRNE VYŠETRENIA
V rámci laboratórnych vyšetrení majú svoje uplatnenie najmä metódy preukazujúce imunopatologickú hypersenzitívnu odpoveď pacienta na Aspergillus fumigatus. Využívame stanovenie celkových IgE v sére pacienta, špecifické IgE a IgG voči Aspergillus fumigatus, prítomnosť precipitínov a kožný prick test. Pomocným vedľajším nálezom môže byť aj eozinofília [3, 22].
Kožný prick test (SPT – skin prick test)
Kožný prick test možno vďaka jeho vysokej senzitivite využiť v rámci úvodného skríningu na ABPA, ktorá je v prípade negatívneho výsledku veľmi nepravdepodobná – SPT má pri správnej aplikácii 95% negatívnu prediktívnu hodnotu [4, 6, 7]. V prípade negatívneho výsledku a pretrvávania podozrenia na ABPA možno ešte doplniť intradermálny kožný test, ktorý je v rámci záchytu ochorenia senzitívnejší, no má aj vyšší výskyt falošnej pozitivity [28].
Špecificita SPT pre diagnózu ABPA je pomerne nízka. Pacienti s ťažkou atopickou dermatitídou môžu mať falošne pozitívny SPT, zatiaľ čo pacienti, ktorí užili antihistaminiká v priebehu 48–72 hodín pred realizáciou vyšetrenia, môžu mať falošne negatívnu reakciu [26, 29]. Zhruba 40 % astmatikov a 56 % pacientov s CF môže byť a priori senzibilizovaných voči antigénom A. fumigatus a mať prejavy kožnej reaktivity na SPT, a to bez akýchkoľvek ďalších prejavov ABPA. Predstavujú teda skupinu tzv. Aspergillus fumigatus senzibilizovaných (Af-senzibilizovaných) pacientov [6, 7].
Celkové IgE v sére
Zvýšenie celkových IgE v sére pacienta je najčastejším laboratórnym nálezom v rámci ABPA, pričom nezriedka dosahuje niekoľkotisícové hodnoty [26, 30]. Dynamika zmien IgE dobre koreluje s aktivitou ochorenia, preto hodnoty IgE môžu slúžiť ako marker exacerbácie či odpovede na liečbu (hladina celkových IgE zvyčajne klesá do približne 2 mesiacov od začatia kauzálnej liečby), samozrejme v súčinnosti s ďalšími laboratórnymi a klinickými nálezmi [4, 22]. Zároveň však nemožno preceniť validitu celkových IgE. Ich elevácia môže byť vo všeobecnosti následkom senzibilizácie voči akémukoľvek alergénu, takže môže byť prítomná aj pri samotnej atopickej konštitúcii pacienta, bez ohľadu na prítomnosť či neprítomnosť ABPA [21, 29].
Špecifické IgE (ŠIgE) proti A. fumigatus
Pozitivita špecifických IgE protilátok voči Aspergillus fumigatus (zvyčajne definovaná ako ŠIgE >0,35 IU/ml) je kľúčová v diagnostike ABPA, potvrdzuje totiž schopnosť hypersenzitívnej reakcie organizmu na aspergilové antigény [29, 30]. Vzostup hladiny ŠIgE môže byť oneskorený zhruba o 12 až 16 týždňov v porovnaní s eleváciou celkových IgE v sére [4]. Aj Af-senzibilizovaní jedinci vykazujú pozitivitu špecifických IgE voči A. fumigatus, no pacienti s ABPA zvyčajne mávajú oveľa vyššie hodnoty ŠIgE (aj dvojnásobne vyššie) [6, 7]. Hodnota ŠIgE nad 5,70 IU//ml dokáže odlíšiť ABPA od samotnej Af-senzibilizácie so špecificitou 94 % a senzitivitou 100 %. Hodnoty v rozmedzí 3,75 až 5,70 IU/ml boli prítomné u Af-senzibilizovaných pacientov bez ABPA (senzitivita 94 % a špecificita 100 %). Využitie ŠIgE ako markera aktivity ochorenia je nateraz otázne [11].
Špecifické IgG (ŠIgG) proti A. fumigatus
Prítomnosť špecifických IgG namierených proti A. fumigatus odráža čiastočnú participáciu Th1 odpovede v patogenéze ABPA. Sú detekovateľné v sére takmer všetkých pacientov s ABPA. Môžu sa však vyskytovať aj pri iných ochoreniach spôsobených kmeňom Aspergillus, napr. pri chronickej pľúcnej aspergilóze [4, 5].
Precipitíny
Kým v krajinách strednej a východnej Európy je stanovenie precipitujúcich protilátok zriedkavou diagnostickou metódou [1, 4], v niektorých iných oblastiach (vrátane Veľkej Británie) sú naďalej bežne používaným vyšetrením [24, 26]. Žiaľ, chýba štandardizácia laboratórnych metodík imunoelektroforetického stanovovania precipitínových línií, čo sa prejavilo aj v priveľkej variabilite senzitivity (45–100 %) aj špecificity (39–84 %) [21, 29]. Prevalencia detekovateľných precipitujúcich IgG voči A. fumigatus sa u pacientov s CF zvyšuje spolu s vekom, bez ohľadu na prítomnosť ABPA, ich pozitivita môže teda s väčšou pravdepodobnosťou reprezentovať skôr predchádzajúcu expozíciu aspergilovým spóram než aktuálne prebieha-júce imunoalergologické ochorenie [26, 30]. Vyskytovať sa však môžu aj u pacientov s aspergilómom či chronickou pulmonálnou aspergilózou [6, 7]. Precipitíny sú u ABPA len slabo pozitívne v porovnaní so silnou pozitivitou pri mycetómoch. V prípade ABPA imunoelektroforéza zvyčajne ukáže 1 až 3 precipitujúce línie, zvyčajne len voči 1 z extraktov, zatiaľ čo pacienti s aspergilómom mávajú vyšší počet detekovateľných línií voči všetkým vyšetreným antigénnym extraktom [22].
Rekombinantné alergény
Ďalšou metódou v rámci diagnostiky je vyšetrenie rekombinantných aspergilových alergénov (rAsp) a hladiny nimi indukovaných ŠIgE (rAspf1, rAspf2, rAspf3, rAspf4 a rAspf6). Výsledky prvotných štúdií naznačujú, že ich detekcia môže napomôcť rozlíšeniu medzi aspergilovou senzibilizáciou a ABPA [31]. Kým protilátky voči antigénom rAspf1 a rAspf3 boli detekovateľné v sérach pacientov tak Af-senzibilizovaných CF pacientov, ako aj u pacientov s diagnózou ABPA a CF (senzitivita 98 %), ŠIgE voči rAspf2, rAspf4 a/alebo rAspf6 boli zvýšené len u pacientov s ABPA (100% senzitivita, 100% špecificita). 80 % pacientov s ABPA a CF preukázalo IgE odpoveď na rAspf4, 55 % pacientov reagovalo na rAspf6 a 90 % pa-cientov aspoň na 1 z daných 2 antigénov [8, 32].
Potenciálne diagnostické laboratórne metódy
Rozlíšenie medzi ABPA u pacientov s CF a bakteriálnou exacerbáciou CF môže byť veľmi problematické, preto sa hľadajú ďalšie laboratórne markery, ktoré by túto diferenciálnu diagnostiku zjednodušili. Medzi takéto vyšetrenia patrí napr. stanovenie TARC/CCL17 (thymus - and activation regulated chemokine), bazofily aktivačný test (BAT) či CAST (cellular allergen stimulation test). Tieto vyšetrenia však zatiaľ nie sú bežne dostupné v klinickej praxi a ich aplikovateľnosť je ešte predmetom ďalších výskumov [4].
TARC (thymus - and activation regulated chemokine)
TARC (týmusom a aktiváciou regulovaný chemokín; niekedy označovaný aj ako CCL17) je produktom antifungálnej imunitnej odpovede organizmu. Bolo publikovaných už niekoľko prospektívnych štúdií, v rámci ktorých bol TARC bol vysoko elevovaný práve u pacientov s CF a ABPA (a to v porovnaní s inými skupinami pacientov: astma bronchiale s ABPA, CF bez ABPA, CF Af-senzibilizovaní a CF kolonizovaní A. fumigatus, atopickí pacienti s CF a atopickí pacienti bez CF či ABPA) [33]. Bol oveľa presnejším markerom ABPA (93 %) v porovnaní s celkovými IgE (74 %), ŠIgE rAspf4 (75 %) či ŠIgE rAspf6 (79 %), pričom najvyššie hodnoty boli zaznamenané počas období exacerbácie ABPA [24]. V jednej zo spomínaných štúdií autori zaznamenali vzostup TARC/CCL17 dokonca aj v období tesne pred manifestáciou klinických prejavov ABPA a zároveň aj pred eleváciou celkových IgE. Indikoval teda exacerbáciu ABPA s oveľa väčšou presnosťou než hodnota celkových IgE a možno ho považovať za včasný marker exacerbácie ABPA [31].
BAT
Test aktivácie bazofilov (basophil activation test – BAT) patrí medzi metódy prietokovej cytometrie, ktorá takto hodnotí detekciu up-regulácie istých povrchových aktivačných markerov (najčastejšie CD203c) vznikajúcej ako následok stimulácie alergénom, na ktorý je pacient vopred senzibilizovaný. Predbežné výsledky niektorých štúdií nasvedčujú tomu, že BAT dokáže lepšie rozlíšiť Af-senzibilizovaných a nesenzibilizovaných pacientov s CF než zvyčajne používané stanovenie ŠIgE voči A. fumigatus. Použitím BAT spolu so stanovením ŠIgE a celkových IgE bolo možné adekvátne určiť všetkých pacientov s ABPA a CF spĺňajúcich príslušné diagnostické kritériá [25, 34, 35, 36].
ZOBRAZOVACIE VYŠETRENIA
Využitie zobrazovacích metód v diagnostike ABPA u pacientov s CF má isté limity, a to vďaka podobnosti nálezov charakteristických pre samotnú ABPA a typických pre CF. V rámci zobrazovacích vyšetrení využívame RTG hrudníka a CT pľúc, pričom HRCT (high-resolution computed tomography) s rezmi 1–2 mm je považované za primárnu zobrazovaciu modalitu pre stanovenie diagnózy ABPA [1, 24].
Medzi základné procesy, ktoré vedú k charakteristickým rádiologickým nálezom, patrí zvýšená hlienová produkcia (hlienové pláty, hlienové zátky, hlienové odliatky, ...), zápalové zmeny pľúcneho tkaniva a interstícia (prchavé infiltráty, opacity mliečneho skla, ...) a zápalové zmeny bronchiálneho stromu (známky zhrubnutia bronchiálnej steny a prítomnosti bronchiektázií) [5–7].
Najčastejším nálezom sú prechodné parenchymálne infiltratívne zmeny (89–91 %) prítomné v akútnom štádiu či počas exacerbácie (obr. 1). Tranzientný charakter majú vďaka priľahlým hlienovým zátkam, ktoré po adekvátnej mukolytickej liečbe miznú a spolu s nimi aj dané infiltratívne zmeny, ktoré majú po histologickej stránke eozinofilný charakter a môžu imitovať pneumóniu. Zvyčajne sú prítomné v horných, niekedy v stredných pľúcnych poliach [6, 7, 28, 37].
Obr. 1. Zápalový infiltrát s atelektázou prítomný v pravom hornom pľúcnom poli u našej pacientky (#005).
Fig. 1. Pulmonary inflammatory infiltrate with atelectasis present in the right upper lung field in our patient (#005).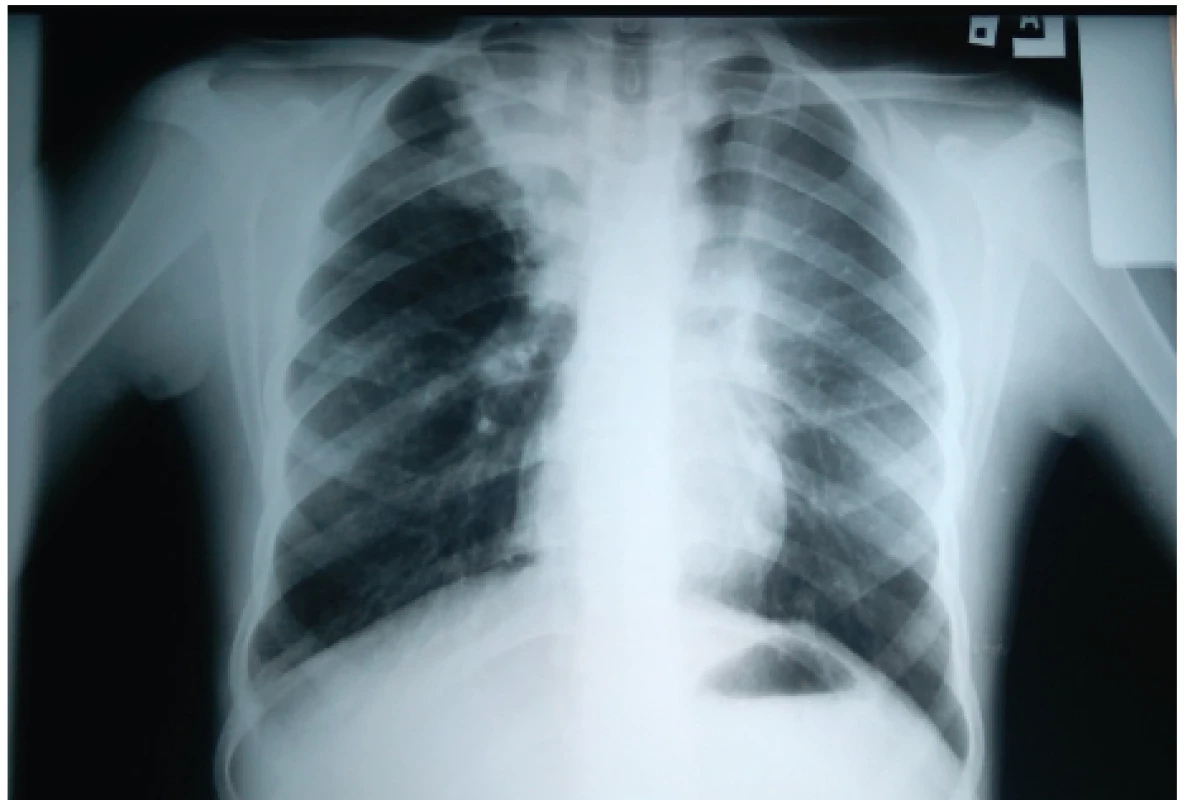
Hlienové zátky vznikajú retenciou respiračných sekrétov v poškodených bronchoch (obr. 2). Najviac špecifickým RTG nálezom svedčiacim o hlienových zátkach či odliatkoch je znak „prstov v rukavici“ (fingers in glove sign); sú výsledkom stázy sekrétu v rozšírených, na konci zaoblených nepriechodných distálnych bronchoch [5]. Na CT hrudníka sa môžu hlienové pláty a zátky manifestovať ako centrilobulárne nodulácie, ktoré môžu miestami vytvárať vzor tree-in-bud („strom v rozkvete“) [24]. Čo sa denzity týka, hlienové zátky a odliatky mávajú najčastejšie zníženú, eventuálne normálnu denzitu. V rámci diagnózy ABPA však môžu byť u časti pacientov (20 %) prítomné aj hlienové odliatky so zvýšenou denzitou, tzv. high-attenuation mucus (HAM) (obr. 3) [28, 37, 38]. Zvýšenie denzity je v prípade HAM spôsobené depozíciou solí železa, zinku a mangánu v prítomnom hliene, ktoré sú vedľajším produktom fungálneho metabolizmu. Daná denzita zvyčajne presahuje hodnoty HU typické pre paraspinálne svalstvo (zvyčajne >70 HU). Nález HAM je popisovaný výhradne len pri ABPA a považuje sa za patognomický pre túto diagnózu [39].
Obr. 2. Hlienový odliatok vypĺňajúci celý ľavý bronchus u nášho pacienta (#004).
Fig. 2. Mucus impaction filling whole left main bronchus in our patient (#004).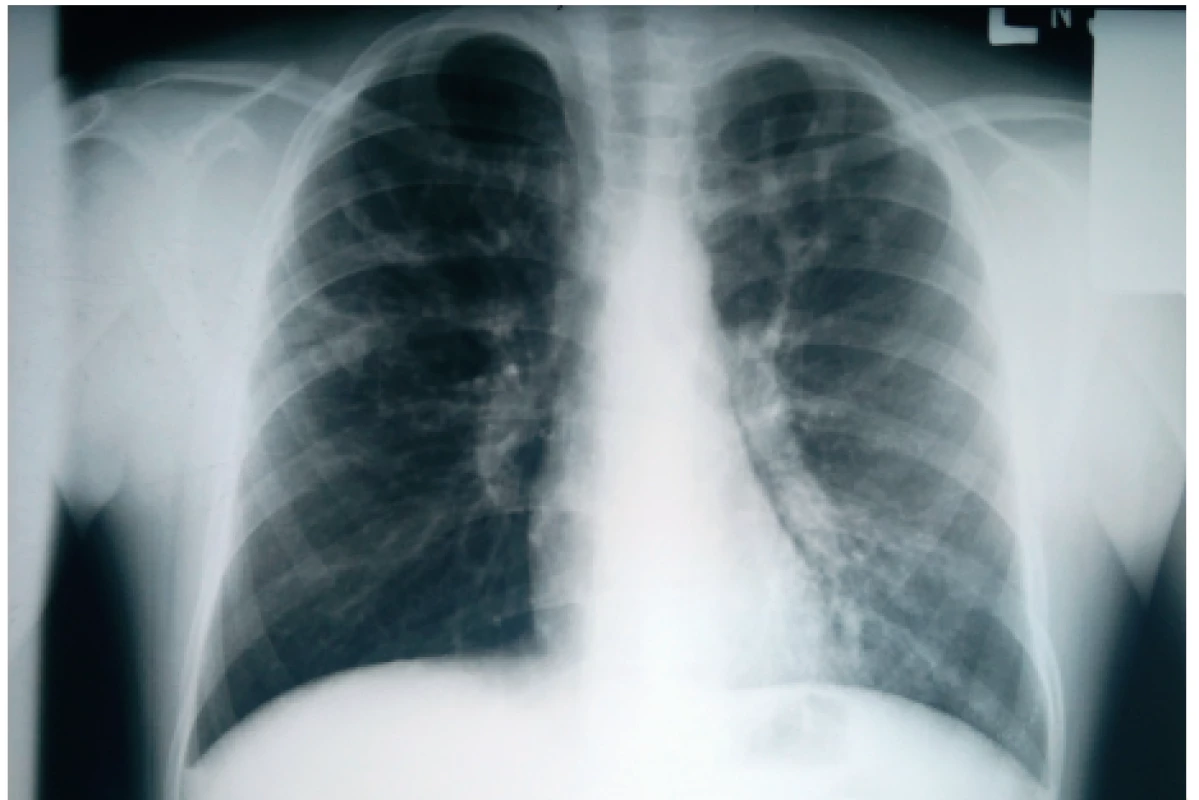
Obr. 3. High-attenuation mucus (HAM) prítomný vpravo parakardiálne u našej pacientky (#005).
Fig. 3. High-attenuation mucus (HAM) present in the righ lung field paracardially in our patient (#005).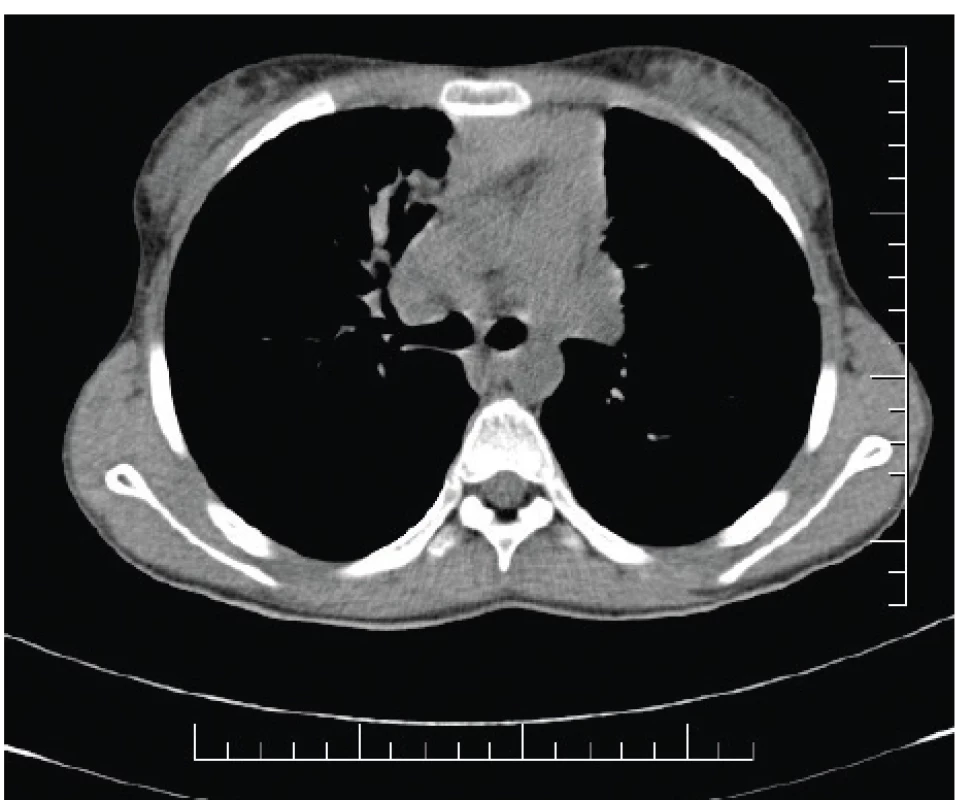
Výrazné zhrubnutie bronchiálnej steny a bronchiektázie stredného až veľkého kalibru môžu byť viditeľné aj na RTG hrudníka (znak prstenca – ring sign, paralelné línie – parallel lines, znak koľajníc – tram tracks) (obr. 4 a 5) [6, 7]. Za účelom ich presnejšieho morfologického zhodnotenia je však potrebné realizovať HRCT. Dominantne centrálna lokalizácia bronchiektázií (t.j. v centrálnych 2/3 pľúcneho poľa) je vo všeobecnosti považovaná za jednu z charakteristických známok ABPA, no tak centrálne ako aj periférne bronchiektázie sú pomerne bežným nálezom u pacientov s CF. Kým cylindrické bronchiektázie sú považované za typické skôr pre samotnú CF, varikózne či cystické bronchiektázie sú viac príznačné pre ABPA (obr. 6) [5].
Obr. 4. Bronchiektázie prítomné ako tzv. ring sign v pravom hornom a strednom pľúcnom poli nášho pacienta (#004).
Fig. 4. Bronchiectases presenting as ring sign in the right upper and middle lung field in our patient (#004).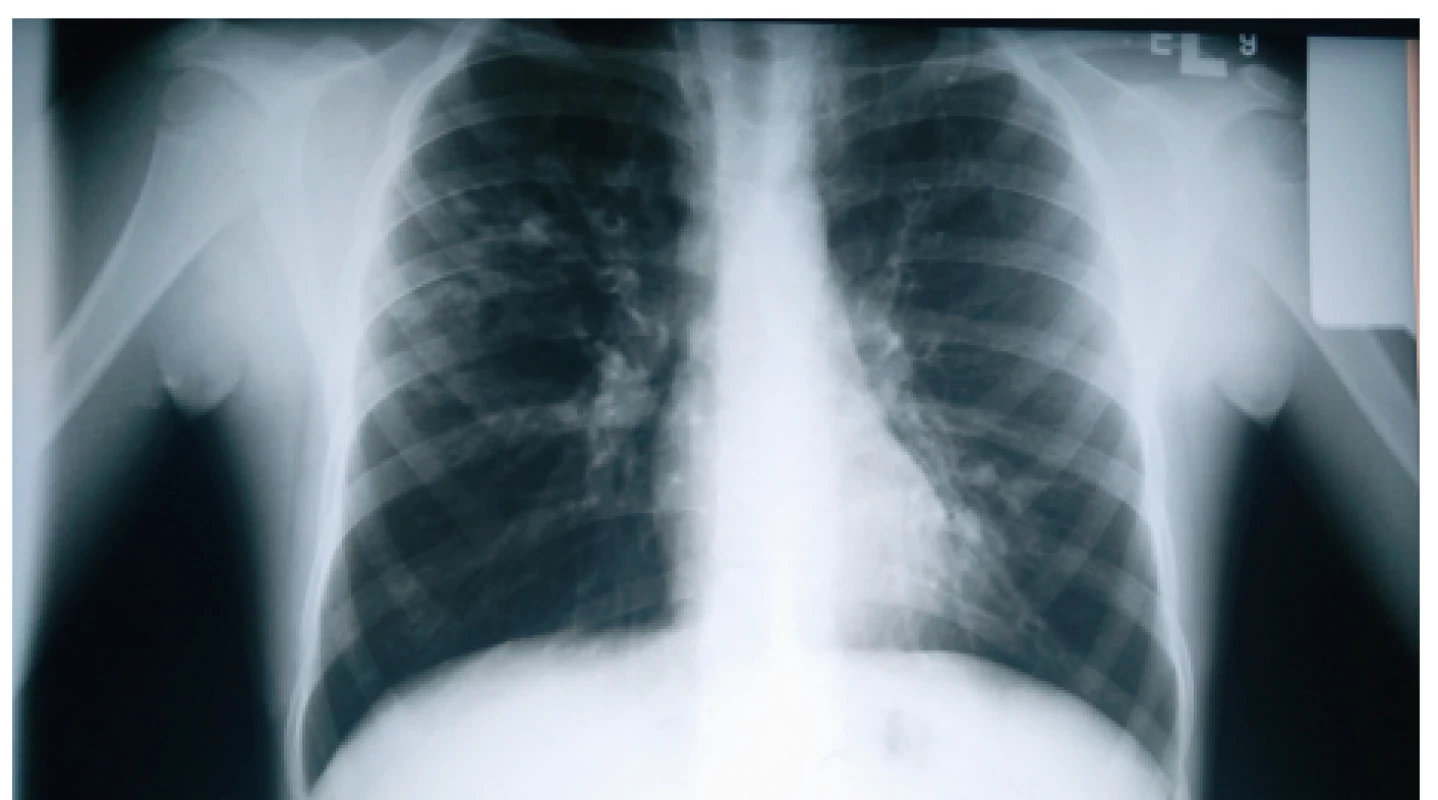
Obr. 5. Zhrubnutie bronchiálnej steny charakteru tram tracks v ľavom hornom pľúcom poli u našej pacientky (#006).
Fig. 5. Bronchial wall thickening presenting as tram tracks sign in the left upper lung field in our patient (#006).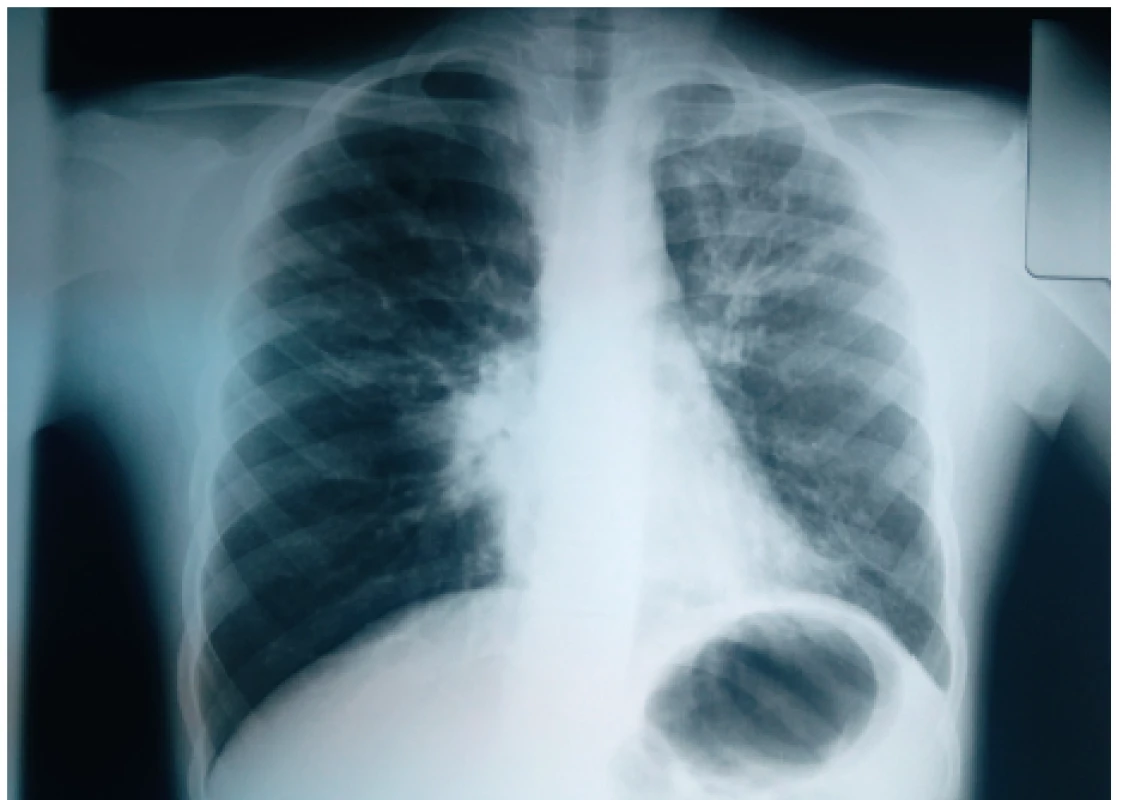
Obr. 6. Cylindrické až varikózne bronchiektázie prítomné u nášho pacienta (#004).
Fig. 6. Cylindrical and varicose bronchiectases present in our patient (#004).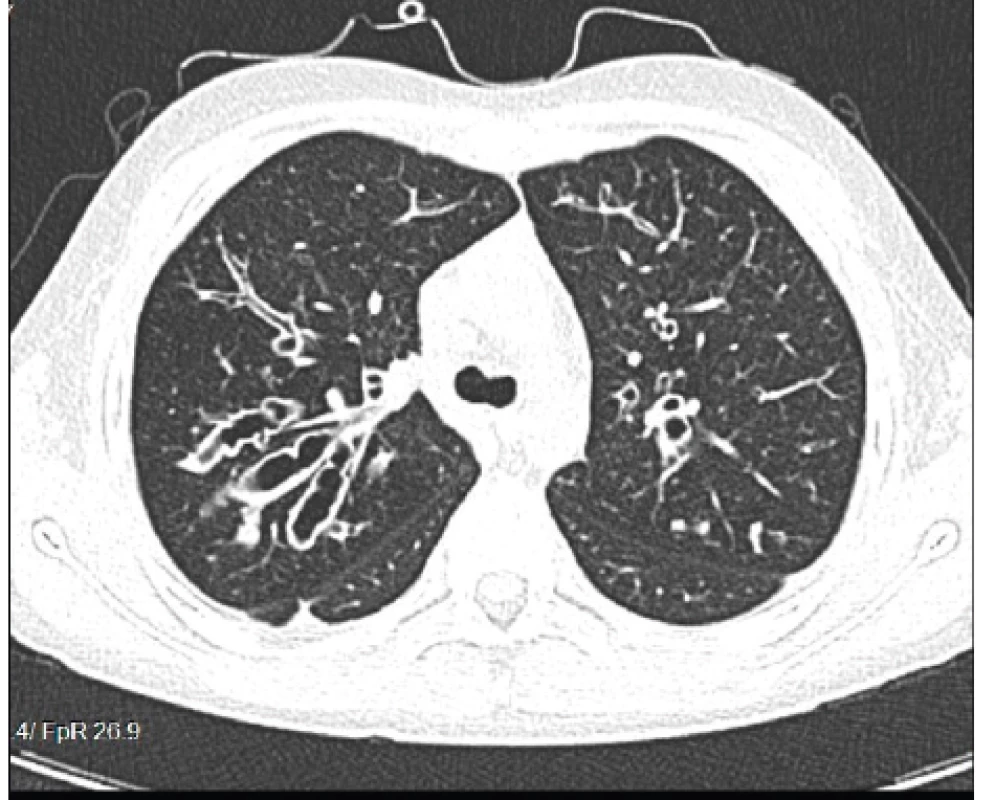
FUNKČNÉ VYŠETRENIE PĽÚC
Počas akútnej fázy ochorenia je v rámci spirometrického vyšetrenia najčastejšie zaznamenaný obštrukčný charakter krivky, zvyčajne aspoň parciálne reverzibilný. Neskôr počas progresie ochorenia a vplyvom opakovaných exacerbácií s poškodením pľúcneho tkaniva sa pridružuje reštrikcia, v rámci funkčného vyšetrenia pľúc je teda vyjadrený reštriktívne-obštrukčný typ krivky, môže byť prítomný fenomén „air-trappingu“, narastá reziduálny objem, redukcia celkovej kapacity pľúc, porucha difúznej kapacity [1, 4]. Pri porovnávaní skupín pacientov s ABPA a CF, atopických pacientov s CF bez ABPA, pacientov s CF chronicky kolonizovaných P. aeruginosa a P. aeruginosa naivných CF pacientov, zhoršenie pľúcnych funkcií bolo najvýraznejšie práve v skupine pacientov s CF a ABPA [3].
DIAGNOSTICKÉ KRITÉRIÁ
Diagnostika ABPA u pacientov s CF je pomerne náročná, predovšetkým vďaka podobnosti prejavov ABPA a akútnej exacerbácie CF. Preto boli v roku 2003 publikované konsenzuálne diagnostické kritériá vypracované Cystic Fibrosis Foundation (CFF), ktoré definujú nielen tzv. klasický typ ABPA u pacientov s CF, ale tiež minimálne diagnostické kritériá pre stanovenie diagnózy ABPA (tab. 2) [1, 5].
Tab. 2. Diagnostické kritériá ABPA pri CF (Cystic Fibrosis Foundation Consensus 2003). 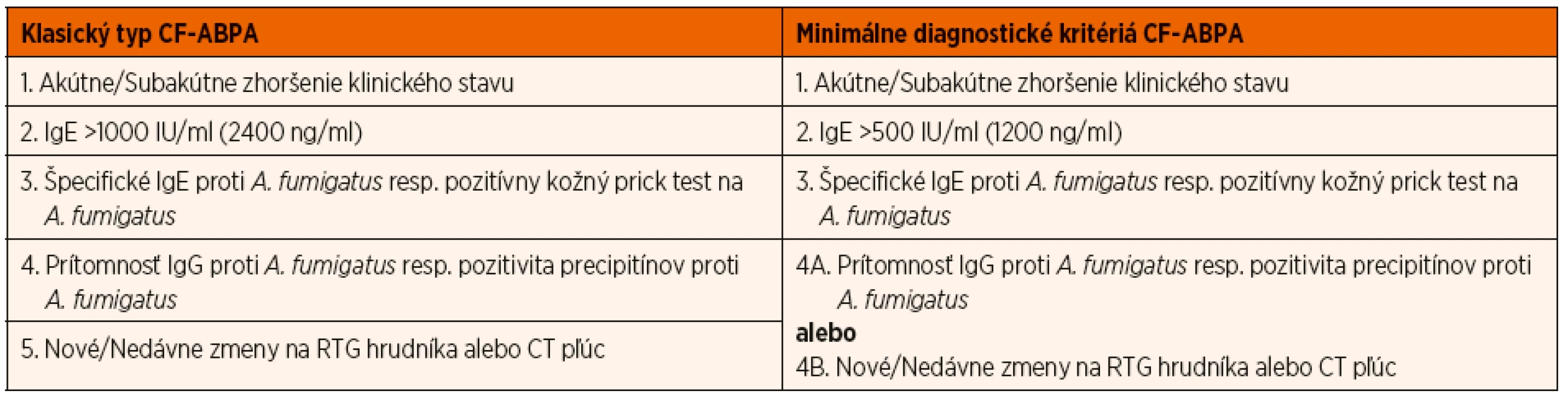
Klasický typ ABPA:
- Akútne alebo subakútne zhoršenie klinického stavu (charakterizované kašľom, bronchiálnou obštrukciou, intoleranciou námahy, zhoršením pľúcnych funkcií, zvýšením tvorby spúta) nevysvetliteľné inou príčinou.
- Elevácia celkových IgE v sére nad 1000 IU/ml (2400 ng/ml) s výnimkou pacientov dlhodobo užívajúcich systémové kortikoidy.
- Pozitivita špecifických IgE proti Aspergillus fumigatus v sére, resp. včasná kožná reaktivita na Aspergillus fumigatus charakterizovaná pozitívnym kožným prick testom (>3 mm) s výnimkou pacientov dlhodobo užívajúcich antihistaminiká.
- Prítomnosť precipitujúcich protilátok alebo špecifických IgG proti Aspergillus fumigatus.
- Nové alebo nedávne zmeny na RTG hrudníka (infiltráty, hlienové zátky) či CT pľúc (bronchiektázie), ktoré neustúpia ani po antibiotickej liečbe a štandardnej respiračnej fyzioterapii.
Minimálne diagnostické kritériá ABPA:
- Akútne alebo subakútne zhoršenie klinického stavu (charakterizované kašľom, bronchiálnou obštrukciou, intoleranciou námahy, zhoršením pľúcnych funkcií, zvýšením tvorby spúta) nevysvetliteľné inou príčinou.
- Elevácia celkových IgE v sére nad 500 IU/ml (1200 ng/ml) s výnimkou pacientov dlhodobo užívajúcich systémové kortikoidy.
- Pozitivita špecifických IgE proti Aspergillus fumigatus v sére, resp. včasná kožná reaktivita na Aspergillus fumigatus charakterizovaná pozitívnym kožným prick testom (>3 mm) s výnimkou pacientov dlhodobo užívajúcich antihistaminiká.
- Prítomnosť jedného z nasledujúcich: (a) výskyt precipitujúcich protilátok resp. špecifických IgG proti Aspergillus fumigatus, alebo (b) nové resp. nedávne zmeny na RTG hrudníka (infiltráty, hlienové zátky) či CT pľúc (bronchiektázie), ktoré neustúpia ani po antibiotickej liečbe a štandardnej respiračnej fyzioterapii [5].
KLINICKÝ PRIEBEH A ŠTÁDIÁ ABPA
Priebeh ABPA je charakterizovaný striedaním akútnych štádií ochorenia (vrátane exacerbácií) s obdobiami remisie a klinickej inaktivity. Aj akútne fázy ochorenia môžu prebiehať variabilne, od pomerne miernych symptómov s prechodnými infiltratívnymi zmenami pľúcneho tkaniva až po ireverzibilné fibrotické zmeny sprevádzané prejavmi respiračného zlyhávania. Bola preto navrhnutá klasifikácia do 5 štádií na základe klinických, laboratórnych a rádiologických prejavov, od ktorých sa odvíja manažment pa-cienta. Pôvodne boli formulované pre pacientov s asthma bronchiale a ABPA, no možno ich čiastočne uplatniť aj pri hodnotení pacientov s ABPA a CF. Dané štádiá nemajú chronologický charakter, pacienti nemusia nevyhnutne prechádzať jednotlivými štádiami postupne [4, 5].
Štádium I je iniciálnou, akútnou fázou ochorenia s plne vyjadrenou klinickou symptomatológiou, eleváciou celkových aj špecifických IgE spolu s eozinofíliou. Spomedzi rádiologických zmien sú najčastejšie prítomné prchavé pľúcne infiltráty [4].
Štádium II označujeme ako remisiu, ktorá sa prejaví regresiou až vymiznutím tak klinických, ako aj rádiologických prejavov. Laboratórne zaznamenáme predovšetkým pokles IgE – zvyčajne dochádza k poklesu o približne 35 % v priebehu 6 týždňov od začatia liečby, čo svedčí pre dobrú terapeutickú odpoveď a retrospektívne potvrdzuje diagnózu ABPA [28]. Novšia klasifikácia klinických štádií vypracovaná International Society for Human and Animal Mycology (ISHAM) z roku 2013 charakterizuje remisiu poklesom IgE aspoň o 25 % v priebehu 8 týždňov od začatia liečby [40].
Štádium III predstavuje exacerbáciu ABPA sprevádzanú rekurenciou pôvodných symptómov a RTG nálezov popisovaných v štádiu I. Môže však prebiehať aj asymp-tomaticky a manifestovať sa len opätovným vzostupom IgE, a to v zmysle zdvojnásobenia hodnôt prítomných vo fáze remisie, hoci novšia ISHAM klasifikácia vyžaduje vzostup len o viac než 50 % oproti bazálnym hodnotám.
Štádium IV možno nazvať aj kortiko-dependentnou fázou ochorenia, kedy nemožno ukončiť systémovú kortikosteroidnú liečbu bez toho, aby opäť nedošlo k exacerbácii ochorenia, resp. je nutná na stabilizáciu prejavov bronchiálnej obštrukcie. Hladina IgE v sére môže byť normálna alebo len mierne zvýšená, klinické prejavy aj nálezy zobrazovacích vyšetrení sú v tomto štádiu veľmi variabilné [4, 22].
Štádium V je prakticky terminálnou fázou ochorenia, je charakterizované permanentnými zmenami pľúcneho parenchýmu nereagujúcimi na podávanú kortikoidnú liečbu (tá však môže aspoň čiastočne zmierňovať prejavy bronchiálnej obštrukcie), ireverzibilnou poruchou pľúcnych funkcií a respiračnou insuficienciou. Laboratórne zmeny v tejto fáze ochorenia nemusia byť vôbec prítomné [4, 5].
LIEČBA
Cieľom liečby ABPA je navodenie remisie, zabránenie rozvoja exacerbácií a vzniku ireverzibilných zmien pľúcneho parenchýmu. To je možné dosiahnuť prostredníctvom zmiernenia zápalových procesov a imunologickej odpovede (v rámci čoho je zvyčajne využívaný imunosupresívny a imunomodulačný účinok systémovej terapie glukokortikoidmi) spolu s redukciou antigénnej mykotickej nálože v dýchacích cestách použitím antimykotickej liečby [3, 30].
Glukokortikoidy
Základom liečby ABPA je podávanie systémových (zvyčajne perorálnych) kortikoidných preparátov, ktoré dokážu efektívne potláčať imunitnú zápalovú odpoveď na Aspergillus fumigatus, vedú k regresii klinických prejavov ABPA, poklesu celkových IgE (event. aj ŠIgE), redukcii eozinofílie, ústupu infiltratívnych zmien v pľúcnom tkanive aj bronchiálnom strome [4, 30]. Odborné usmernenia odporúčajú použitie systémových kortikosteroidov počas všetkých akútnych foriem ABPA (primomanifestácia alebo exacerbácia), pokiaľ nie je prítomná kontraindikácia k ich podávaniu. Negatívnym aspektom tejto liečby je vyššie riziko nežiaducich účinkov kortikoterapie obzvlášť u pacientov s CF, ktorí sú už aj vďaka svojmu základnému ochoreniu náchylnejší na rozvoj osteopénie a osteoporózy, poruchy rastu, poruchy glukózovej tolerancie až diabetes mellitus a tiež infekčných komplikácií [5].
K dnešnému dňu zatiaľ neexistuje jednoznačný konsenzus ohľadom presnej dávkovacej schémy systémovej kortikoterapie a v rámci jednotlivých krajín sa terapeutický manažment výrazne líši. Najčastejšie odpo-rúčaným postupom je iniciálne podávanie prednizolónu v dávke 0,5–2,0 mg/kg/deň (max. 60 mg//deň) po dobu 1 až 2 týždňov s následným prechodom na 0,5–2,0 mg/kg každý druhý deň opäť v trvaní 1 až 2 týždňov. V ďalšom priebehu je odporúčané postupne redukovať dávku individuálne, v závislosti na klinických prejavoch, kontrolných hodnotách celkových IgE, výsledkoch spirometrických a zobrazovacích vyšetrení, s ukončením podávania približne do 2 až 3 mesiacov [5].
Dobrá terapeutická odpoveď na podávanie kortikoidnej liečby je považovaná za potvrdenie správnosti diagnózy ABPA. Ak pretrvávajú prejavy ochorenia aj napriek danej liečbe, je vhodné pátrať po inej príčine ťažkostí [27]. Za remisiu ochorenia považujeme, ak nedôjde k relapsu do 3 mesiacov po ukončení liečby [24, 28]. V prípade relapsu počas priebežného znižovania dávky kortikoidov je odporúčané danú dávku opätovne navýšiť a zvážiť pridanie ďalšieho terapeutika [5, 41]. Rekurencia ochorenia je pomerne častá, a to predovšetkým počas prvých 2–3 rokov po primomanifestácii ochorenia. Títo pacienti zvyčajne vyžadujú prolongované podávanie glukokortikoidov vo vyšších dávkach. Isté percento pacientov s ABPA môže vyžadovať aj chronickú kortikoterapiu (klinické štádium IV) [27].
Bol skúmaný aj efekt podávania kortikoidov inou než perorálnou cestou. Inhalačné kortikosteroidy sú efektívne v manažmente prejavov bronchiálnej obštrukcie, no nemali preukázateľný účinok na nepriaznivú imunopatogénnu aktivitu samotného ochorenia ABPA [30]. Naproti tomu pulzné intravenózne podávanie vysokých dávok metylprednizolónu (10–15 mg/kg/deň, max. 1 g/deň) počas 3 po sebe nasledujúcich dní každé 4 týždne dokázalo preukázateľne stabilizovať ABPA u pediatrických pacientov s CF so zlepšením klinického stavu a normalizáciou laboratórnych aj zobrazovacích vyšetrení [25, 30].
Antimykotiká
Hlavným cieľom použitia antimykotickej terapie je redukcia antigénnej mykotickej nálože A. fumigatus v respiračnom systéme, čo by malo odstránením chronického antigénneho stimulu zmierniť zápalovú odpoveď organizmu, redukovať symptómy a z dlhodobého hľadiska zmierniť riziko progresie ochorenia [3, 5].
Najčastejšie využívaným terapeutikom je itrakonazol podávaný zvyčajne v perorálnej forme. Jeho konkomitantné podávanie má kortikoidy šetriaci účinok s možnosťou primeranej redukcie dávok glukokortikoidov a tým pádom aj redukcie ich nežiaducich účinkov. Neexistuje dostatok dát, na základe ktorých by bolo možné jednoznačne odporúčať podávanie itrakonazolu už v iniciálnej fáze liečby. Zvyčajne je odporúčané jeho pridanie do liečby u pacientov bez dostatočnej terapeutickej odpovede na iniciálne podávanie kortikoidov, u kortiko-dependentných pacientov, v prípade relapsu ABPA a v prípade závažných nežiaducich účinkov kortikosteroidnej liečby [5, 27].
Úvodná dávka je 5 mg/kg/deň (max. 400 mg/deň, pri dávke nad 200 mg/deň rozdelená do dvoch dávok) dlhodobo, v trvaní 3 až 6 mesiacov. Tým, že má len sprostredkovaný, sekundárny vplyv na imunopatogénnu zložku ochorenia, nie je možné ho odporúčať v monoterapii, podávanie itrakonazolu je odporúčané len spolu s glukokortikoidmi [4, 5].
Novšie terapeutické možnosti – Omalizumab
Medzi najviac preskúmané novšie terapeutické možnosti patrí omalizumab – humanizovaná monoklonálna anti-IgE protilátka. Mechanizmom jeho účinku je schopnosť viazať voľné IgE v sére, interferujúc s jeho väzbou na receptory prítomné na mastocytoch a bazofiloch spolu s down-reguláciou prítomných IgE receptorov [23, 25]. Nevýhodou je nemožnosť sledovania terapeutickej odpovede prostredníctvom monitoringu hodnôt celkových IgE [27]. Dávkovanie odráža odporú-čania zaužívané u pacientov indikovaných k anti-IgE liečbe na základe asthma bronchiale – podľa hmotnosti a hladiny celkového IgE pred začatím terapie (max. 600 mg) aplikovaných subkutánne každých 14 dní [23]. Menšia francúzska prehľadová štúdia prezentujúca výsledky 13 pediatrických pacientov s ABPA a CF liečených omalizumabom udávala zlepšenie spirometrických parametrov, minimalizáciu respiračných symptómov a možnosť výraznej redukcie dávky kortikoidov [2, 42, 43].
SÚBOR PACIENTOV
Čo sa týka skúseností nášho centra pre cystickú fibrózu v Detskej fakultnej nemocnici Košice, ktoré má na starosti dispenzárnu starostlivosť o pediatrických pacientov s CF v rámci celého východoslovenského regiónu, počas uplynulých 10 rokov (2009–2019) sme mali v starostlivosti súhrnne 105 pacientov s diagnózou cystická fibróza, spolu 54 dievčat a 51 chlapcov, a spomedzi nich 6 pacientov malo stanovenú diagnózu ABPA (3 chlapci, 3 dievčatá), čo predstavuje prevalenciu 5,71 % v danom období. Tieto údaje sú porovnateľné s celoslovenskou prevalenciou u všetkých sledovaných pacientov (tak pediatrických ako aj dospelých) v rámci 6 regionálnych centier, pričom údaje sú získané z celoeurópskej databázy European Cystic Fibrosis Society Patient Registry, ktorej sme ako krajina a centrum súčasťou. Priemerná celoslovenská prevalencia v rokoch 2010 až 2017 bola 6,13 % (najvyššia v roku 2010 – 9,31 %, najnižšia v roku 2012 – 3,50 %) (graf 1). Väčšina našich pacientov bola diagnostikovaná ako ABPA v období preadolescencie, resp. v staršom školskom veku; priemerný vek v čase stanovenia diagnózy bol 12,66 rokov (najmladší pacient mal v tom čase 9 rokov, najstaršia pacientka 18 rokov) (tab. 3).
Graf 1. Prevalencia ABPA na Slovensku. 
Tab. 3. Základná charakteristika súboru pacientov s ABPA a CF. 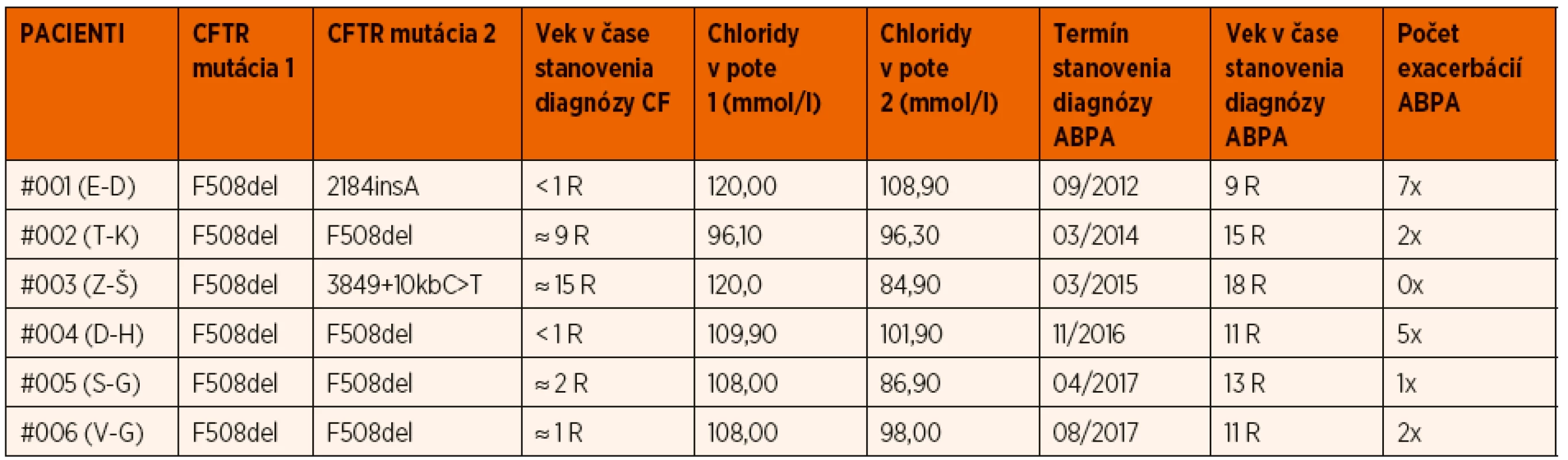
Vysvetlivky: ABPA – alergická bronchopulmonálna aspergilóza, CF – cystická fibróza, CFTR – cystic fibrosis transmembrane conductance regulator, R – roky Diagnóza bola stanovená na základe vyššie uvádzaných diagnostických kritérií Cystic Fibrosis Foundation Consensus Criteria z roku 2003, pričom naše pracovisko nemá možnosť štandardne vyšetrovať špecifické IgG a precipitíny, preto boli v našom súbore uplatnené minimálne diagnostické kritériá: (1) akútne alebo subakútne zhoršenie klinického stavu nevysvetliteľné inou príčinou, (2) elevácia celkových IgE v sére nad 1200 ng/ml, (3) pozitivita špecifických IgE proti Aspergillus fumigatus v sére a (4) nové resp. nedávne zmeny na RTG hrudníka či CT pľúc, ktoré neustúpili ani po antibiotickej liečbe a fyzioterapii. Pre pozitivitu ŠIgE bola na základe odporúčaní dostupnej literatúry ako aj vzhľadom k nastaveným metodickým postupom využívaného laboratória stanovená referenčná hodnota >0,35 IU/ml.
Hodnoty celkových IgE v sére mali veľkú inter-individuálnu variabilitu, tak v čase stanovenia diagnózy ABPA, ako aj v obdobiach exacerbácií. Nebol nájdený jednoznačný súvis medzi vstupnou hodnotou celkových IgE v čase primomanifestácie ochorenia a závažnosťou priebehu ochorenia. Hodnoty ŠIgE v čase stanovenia ABPA sa medzi jednotlivými pacientmi taktiež výrazne líšili, takmer vo všetkých prezentovaných prípadoch však mnohonásobne prevyšovali stanovenú referenčnú hodnotu pre ich pozitivitu (71,50 >>> 0,35 IU/ml) (tab. 4).
Tab. 4. Základné laboratórne, rádiologické a klinické nálezy pacientov v akútnych fázach ochorenia. 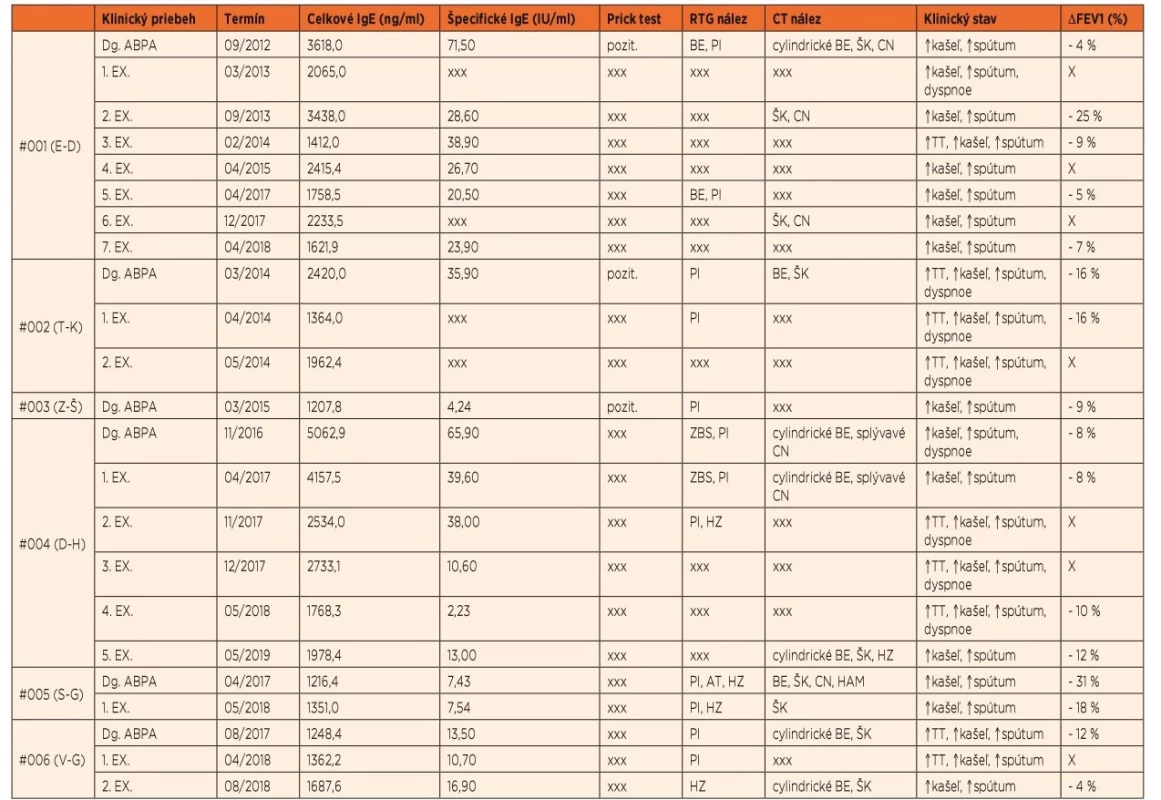
Vysvetlivky: ABPA – alergická bronchopulmonálna aspergilóza, Dg. – diagnóza, EX. – exacerbácia, BE – bronchiektázie, PI – parenchymálny infiltrát, ZBS – zhrubnutie bronchiálnej steny, HZ – hlienová zátka, AT – atelektáza, ŠK – škvrnité kondenzácie, CN – centrilobulárne nodulácie, HAM – high-attenuation mucus, TT – telesná teplota, ΔFEV1 – zmena úsilného výdychového objemu za 1 sekundu v porovnaní s bazálnymi hodnotami, xxx – vyšetrenie nerealizované, X – pacient klinicky nebol schopný absolvovať spirometrické vyšetrenie Najčastejšie pozorovaným RTG nálezom boli infiltratívne zmeny parenchýmu. V rámci CT vyšetrení sa frekventne vyskytovali cylindrické bronchiektázie (ktoré nie sú špecifické pre ABPA) bez predilekčnej lokalizácie (v zmysle centrálnej dominancie), iba jeden z pacientov mal aj varikózne bronchiektázie (#004). Len u jednej z pacientok (#005) bol nájdený high-attenuation mucus (HAM) ako patognomický nález pre ABPA.
Pri všetkých pacientoch bolo v čase akútnej fázy ABPA zaznamenané zhoršenie parametrov pľúcnych funkcií, hodnotené poklesom FEV1 oproti bazálnym hodnotám v stacionárnom období.
Všetci zo 6 ABPA pacientov mali ako nosnú časť liečby systémové podávanie glukokortikoidov. Len u jednej z pacientok (#003) boli kortikosteroidy podávané len v monoterapii, pacient #004 neskôr k iniciálnej dávke kortikoidov vyžadoval pre včasný relaps pridanie antimykotika itrakonazolu. Ostatní 4 pacienti dostávali už v iniciálnej fáze liečby primomanifestácie dvojkombináciu prednizolónu a itrakonazolu; dôvodom začatia podávania antimykotického preparátu už v úvodnej fáze liečby bola snaha využiť ich kortikoidy šetriaci účinok kvôli prítomnosti viacerých faktorov v predchorobí predisponujúcich na rozvoj nežiaducich účinkov glukokortikoidnej liečby (predovšetkým osteopénia a anamnéza poruchy glukózovej tolerancie). Aj napriek tomu u 2 z našich pacientov (#002, #004) sa rozvinul steroidmi indukovaný diabetes mellitus, ktorý vyžadoval prechodne aj inzulinoterapiu. Pri snahe o včasnú redukciu dávky kortikoidov a zmiernenie tohto negatívneho účinku liečby jeden zo spomínaných pacientov (#002) opakovane relaboval v krátkom časovom slede (03/2014 => 04/2014 => 05/2014). Preto bol tomuto pacientovi pridaný do liečby omalizumab v štandardnej dávkovacej schéme (viď vyššie), vďaka čomu bolo možné po necelých 2 mesiacoch od začatia liečby ukončiť podávanie glukokortikoidov, a to bez ďalšieho relapsu ABPA. Podľa vedomia autorov sa jedná o v tom čase prvý prípad pediatrického pacienta s CF a ABPA úspešne liečeného monoklonálnou anti-IgE protilátkou na území Slovenskej republiky.
SKRATKY:
ABPA – alergická bronchopulmonálna aspergilóza
BAT – bazofily aktivačný test
CF – cystická fibróza
CFF – Cystic Fibrosis Foundation
CFTR – cystic fibrosis transmembrane conductance regulator
ECFS – European Cystic Fibrosis Society
FEV1 – forced expiratory volume in 1st second (úsilný výdychový objem za 1 sekundu)
HAM – high-attenuation mucus
HRCT – high resolution computed tomography
IgE – imunoglobulíny E
IL – interleukín
rAsp – rekombinantný aspergilový alergén
SPT – kožný prick test (skin prick test)
ŠIgE – špecifické IgE
TARC – týmusom a aktiváciou regulovaný chemokín (thymus - and activation-regulated chemokine)
MUDr. Zuzana Hribíková
Klinika detí a dorastu UPJŠ LF
a DFN
Trieda SNP 1,
040 11 Košice
Slovenská republika
e-mail: zuzka.hribikova@gmail.com
Zdroje
1. Zápalka M, Kopřiva F, Raclavský V. Aspergillus fumigatus a plicní postižení u cystické fibrózy – přehled problematiky. Čes-slov Pediat 2015; 70 (6): 342–350.
2. Perisson C, Destruys L, Grenet D, et al. Omalizumab treatment for allergic bronchopulmonary aspergillosis in young patients with cystic fibrosis. Respir Med 2017; 133 : 12–15.
3. Janahi IA, Rehman A, Al-Naimi AR. Allergic bronchopulmonary aspergillosis in patients with cystic fibrosis. Ann Thorac Med 2017; 12 (2): 74–82.
4. Heribanová L. Alergická bronchopulmonální aspergilóza. Prakt Lék 2014; 94 (2): 59–63.
5. Stevens DA, Moss RB, Kurup VP, et al. Allergic bronchopulmonary aspergillosis in cystic fibrosis – state of the art: Cystic Fibrosis Foundation consensus conference. Clin Infect Dis 2003; 37 (Suppl 3): S225–S264.
6. Shah A, Panjabi C. Allergic aspergillosis of the respiratory tract. Eur Respir Rev 2014; 23 (131): 8–29.
7. Shah A, Panjabi C. Allergic bronchopulmonary aspergillosis: a per-plexing clinical entity. Allergy Asthma Immunol Res 2016; 8 (4): 282–297.
8. Bussamra MHF, Rodrigues JC. Allergic bronchopulmonary aspergillosis in paediatric cystic fibrosis patients. Paediatr Respir Rev 2006; 7 (1): 67–72.
9. Greenberger PA, Bush RK, Demain JG, et al. Allergic bronchopulmonary aspergillosis. J Allergy Clin Immunol Pract 2014; 2 (6): 703–708.
10. Mastella G, Rainisio M, Harms HK, et al. Allergic bronchopulmonary aspergillosis in cystic fibrosis. A European epidemiological study. Eur Respir J 2000; 16 (3): 464–471.
11. Armstead J, Morris J, Denning DW. Multi-country estimate of different manifestations of aspergillosis in cystic fibrosis. PLoS One 2014; 9 (6): e98502.
12. Zolin A, McKone EF, van Rens J, et al. ECFS Patient Registry Annual Report 2010. https://www.ecfs.eu/sites/default/files/general-content-files/working-groups/ecfs-patient-registry/ECFSPR_Report10_v12014_final_020617.pdf.
13. Zolin A, McKone E, Nährlich L, et al. ECFS Patient Registr Annual Report 2011. https://www.ecfs.eu/sites/default/files/general-content-files/working-groups/ecfs-patient-registry/ECFSPR_Annual_Report_2011_Aug2017.pdf.
14. Zolin A, McKone E, Nährlich L, et al. ECFS Patient Registr Annual Report 2012. https://www.ecfs.eu/sites/default/files/general-content-files/working-groups/ecfs-patient-registry/ECFSPR_Annual_Report_2012_Aug_2017.pdf.
15. Zolin A, McKone EF, van Rens J, et al. ECFS Patient Registry Annual Report 2013. https://www.ecfs.eu/sites/default/files/general-content-files/working-groups/ecfs-patient-registry/ECFSPR_Report2013_02.2016.pdf.
16. Zolin A, McKone EF, van Rens J, et al. ECFS Patient Registry Annual Report 2014. https://www.ecfs.eu/sites/default/files/general-content-files/working-groups/ecfs-patient-registry/ECFSPR_Annual% – 20Report% – 202014_Nov2016.pdf.
17. Zolin A, Naehrlich L, van Rens J et al. ECFS Patient Registr Annual Report 2015. https://www.ecfs.eu/sites/default/files/general-content-images/working-groups/ecfs-patient-registry/ECFSPR_Report2015_Nov2017.pdf.
18. Orenti A, Zolin A, Naehrlich L, et al. ECFS Patient Registry Annual Report 2016. https://www.ecfs.eu/sites/default/files/general-content-images/working-groups/ecfs-patient-registry/ECFSPR_Report2016_06062018.pdf.
19. Orenti A, Zolin A, Naehrlich L, et al. ECFS Patient Registry Annual Report 2017. https://www.ecfs.eu/sites/default/files/general-content-images/working-groups/ecfs-patient-registry/ECFSPR_Report2017_v1.3.pdf.
20. Jubin V, Ranque S, Stremier N, et al. Risk factors for Aspergillus colonisation and allergic bronchopulmonary aspergillosis in children with cystic fibrosis. Pediatr Pulmonol 2010; 45 (8): 764–771.
21. Delhaes L, Frealle E, Pinel C. Serum markers for allergic bronchopulmonary aspergillosis in cystic fibrosis: state of the art and further challenges. Med Mycol 2010; 48 (Suppl 1): S77–S87.
22. Knutsen AP, Slavi RG. Allergic bronchopulmonary aspergillosis in asthma and cystic fibrosis. Clin Dev Immunol 2011; 2011 : 843763. doi: 10.1155/2011/843763. Epub 2011 Apr 5.
23. Lehmann S, Pfannenstiel C, Friedrichs F, et al. Omalizumab: a new treatment option for allergic bronchopulmonary aspergillosis in patients with cystic fibrosis. Ther Adv Respir Dis 2014; 8(5): 141–149.
24. Mahdavinia M, Grammer LC. Management of allergic bronchopulmonary aspergillosis: a review and update. Ther Adv Respir Dis 2012; 6 (3): 173–187.
25. Tracy MC, Okorie CUA, Foley EA, et al. Allergic bronchopulmonary aspergillosis. J Fungi 2016; 2 (2): 17.
26. Thia LP, Balfour Lynn IM. Diagnosing allergic bronchopumonary aspergillosis in children with cystic fibrosis. Paediatr Respir Rev 2009; 10 (1): 37–42.
27. Ohn M, Robinson P, Selvadurai H, et al. Question 11: How should allergic bronchopulmonary aspergillosis be managed in cystic fibrosis. Paediatr Respir Rev 2017; 24 : 35–38.
28. Patterson K, Strek ME. Allergic bronchopulmonary aspergillosis. Proc Am Thorac Soc 2010; 7 (3): 237–244.
29. Carsin A, Romain T, Ranque S, et al. Aspergillus fumigatus in cystic fibrosis: an update on immune interactions and molecular diagnostics in allergic bronchopulmonary aspergillosis. Allergy 2017; 72 (11): 1632–1642.
30. Leonardi L, Cinicola BL, Laitano R, et al. Allergic bronchopulmonary aspergillosis: diagnostic and treatment challenges. J Pulm Respir Med 2016; 6 (4): 361.
31. Latzin P, Harti D, Regamey N, et al. Comparison of serum markers for allergic bronchopulmonary aspergillosis in cystic fibrosis. Eur Respir J 2008; 31 (1): 36–42.
32. Almeida MB, Bussamra MH, Rodrigues JC. ABPA diagnosis in cystic fibrosis patients: the clinical utility of IgE specific to recombinant Aspergillus fumigatus allergens. J Pediatr 2006; 82 (3): 215–220.
33. Hartl D, Latzin P, Zissel G, et al. Chemokines indicate allergic bronchopulmonary aspergillosis in patients with cystic fibrosis. Am J Respir Crit Care Med 2006; 173 (12): 1370–1376.
34. Gernez Y, Dunn CE, Everson C, et al. Blood basophils from cystic fibrosis patients with allergic bronchopulmonary aspergillosis are primed and hyper-responsive to stimulation by aspergillus allergens. J Cyst Fibros 2012; 11 (6): 502–510.
35. Gernez Y, Waters J, Mirković B, et al. Blood basophil activation is a reliable biomarker of allergic bronchopulmonary aspergillosis in cystic fibrosis. Eur Respir J 2016; 47 (1): 177–185.
36. Katelari A, Tzanoudaki M, Noni M, et al. The role of basophil activation test in allergic bronchopulmonary aspergillosis and Aspergillus fumigatus sensitization in cystic fibrosis patients. J Cyst Fibros 2016; 15 (5): 587–596.
37. Agarwal R, Khan A, Garg M, et al. Chest radiographic and computed tomographic manifestations in allergic bronchopulmonary aspergillosis. World J Radiol 2012; 4 (4): 141–150.
38. Agarwal R. High attenuation mucoid impaction in allergic bronchopulmonary aspergillosis. World J Radiol 2010; 2(1): 41–43.
39. Refait J, Macey J, Bui S, et al. CT evaluation of hyperattenuating mucus to diagnose allergic bronchopulmonary aspergillosis in the special condition of cystic fibrosis. J Cyst Fibros 2019; 18 (4): e31–e36.
40. Agarwal R, Chakrabarti A, Shah A, et al. Allergic bronchopulmonary aspergillosis: review of literature and proposal of new diagnostic and classification criteria. Clin Exp Allergy 2013; 43 (8): 850–873.
41. Giavina-Bianchi P, Kalil J. Diagnosis of allergic bronchopulmonary aspergillosis exacerbation. J Allergy Clin Immunol Pract 2017; 5 (6): 1599–1600.
42. Tanou K, Zintzaras E, Kaditis AG. Omalizumab therapy for allergic bronchopulmonary aspergillosis in children with cystic fibrosis: a synthesis of published evidence. Pediatr Pulmonol 2014; 49 (5): 503–507.
43. Ashkenazi M, Sity S, Sarouk I, et al. Omalizumab in allergic bronchopulmonary aspergillosis in patients with cystic fibrosis. J Asthma Allergy 2018; 11 : 101–107.
Štítky
Neonatologie Pediatrie Praktické lékařství pro děti a dorost
Článek vyšel v časopiseČesko-slovenská pediatrie
Nejčtenější tento týden
2019 Číslo 7- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Syndrom Noonanové: etiologie, diagnostika a terapie
-
Všechny články tohoto čísla
- Historie cystické fibrózy u nás – editorial
- Novorozenecký screening cystické fibrózy a diagnostika CFSPID
- Desať rokov novorodeneckého skríningu cystickej fibrózy na Slovensku
- Funkce plic souboru českých kojenců a batolat s cystickou fibrózou
- Pletysmografické a biochemické metody jako nové možnosti neinvazivního hodnocení endotelové dysfunkce u dětí s cystickou fibrózou – kombinovaný diagnostický přístup
- Alergická bronchopulmonálna aspergilóza u detských pacientov s cystickou fibrózou
- Kostné zdravie u detí s cystickou fibrózou
- Vyšetrenie rotačnej tromboelastometrie (ROTEM) v manažmente krvácania a koagulopatie v pediatrii
- Recenzia knižnej publikácie: Ivan Frič, Mirko Zibolen, Viera Haľamová, František Bauer a kolektív: História neonatológie na Slovensku
-
Odešel prof. MUDr. Václav Špičák, CSc.
(14. ledna 1929–13. září 2019)
- Česko-slovenská pediatrie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Novorozenecký screening cystické fibrózy a diagnostika CFSPID
- Vyšetrenie rotačnej tromboelastometrie (ROTEM) v manažmente krvácania a koagulopatie v pediatrii
- Historie cystické fibrózy u nás – editorial
- Alergická bronchopulmonálna aspergilóza u detských pacientov s cystickou fibrózou
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání




