-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Tolerogenní dendritické buňky a jejich využití v léčbě imunopatologických stavů
Tolerogenic dendritic cells and their application in immunopathological processes
Tolerogenic dendritic cells (tDC) are specific group of dendritic cells. At steady-state they are located in diverse tissue and play a pivotal role in maintaining central and peripheral immune tolerance. tDC restore and maintain immune homeostasis by inhibition of antigen-specific T-lymphocytes, induction of T-regulatory cells as well as B-regulatory cells and production of anti-inflammatory cytokines. tDC due to their ability to down-regulate immune response are promising tool to re-establish antigen-specific tolerance in autoimmune diseases without adverse effects of systemic immunosuppression. This interventional strategy also offers an interesting way to treat other immunopathological processes.
Key words:
tolerogenic dendritic cells, cellular therapy, immune tolerance, autoimmune disease
Autoři: A. Grohová 1,2,3; K. Dáňová 1,2; L. Palová-Jelínková 1
Působiště autorů: SOTIO, a. s., Oddělení výzkumu, Praha 1; Ústav imunologie 2. LF UK a FN Motol, Praha 2; Pediatrická klinika 2. LF UK a FN Motol, Praha 3
Vyšlo v časopise: Čes-slov Pediat 2017; 72 (4): 256-262.
Kategorie: Přehledový článek
Souhrn
Tolerogenní dendritické buňky představují specifickou skupinu dendritických buněk. Nachází se v různých tkáních a podílí se na udržování centrální i periferní imunologické tolerance širokým spektrem mechanismů. Mezi jejich nejdůležitější vlastnosti patří schopnost tlumit antigen-specifické T-lymfocyty, schopnost indukovat T-regulační a B-regulační buňky a produkce protizánětlivých cytokinů. Díky schopnosti navodit antigenně specifickou toleranci představují tolerogenní dendritické buňky slibný terapeutický nástroj pro léčbu autoimunitních onemocnění a dalších imunopatologických stavů bez nežádoucího efektu celkové imunosuprese.
KLÍČOVÁ SLOVA:
tolerogenní dendritické buňky, terapie, imunologická tolerance, autoimunitní chorobyÚVOD
Dendritické buňky (DC – dendritic cells) byly poprvé popsány v roce 1973 Steinmanem a Cohnem jako profesionální antigen prezentující buňky (APC – antigen-presenting cells), které jsou důležité v propojení specifické a nespecifické imunity [1]. Jejich hlavní rolí je prezentace antigenů T-lymfocytům. V závislosti na signálech z okolí a také na stupni jejich vyzrání mohou buď zahájit imunitní odpověď, nebo ji naopak utlumit a navodit tak antigenně specifickou toleranci. Proto jsou DC považovány za klíčové hráče v regulaci imunity [2].
DC jsou velice heterogenní populace vznikající z progenitorových buněk kostní dřeně, které mohou vycházet jak z myeloidní, tak z lymfoidní linie [3, 4]. Na základě jejich fenotypu a funkce mohou být rozděleny na konvenční neboli klasické DC (cDC), které mají zásadní postavení v zahájení T-buněčné specifické odpovědi, a plazmacytoidní DC (pDC), které charakterizuje vysoká produkce IFN-alfa (interferon alfa) a uplatňují se zejména v obraně proti virovým infekcím [5]. Dále na základě stupně jejich maturace mohou být DC rozděleny na nezralé DC (imDC – immature DC) a zralé DC (mDC – mature DC). Skupina buněk, která je schopna tlumit imunitní odpověď, se označuje jako tolerogenní nebo regulační DC (tDC) [4, 6, 7]. Další specializované typy DC jsou např. Langerhansovy buňky v kůži či mikroglie v centrálním nervovém systému [8].
V organismu jsou nezralé DC rozmístěné téměř ve všech tkáních a kontinuálně pohlcují antigeny ze svého okolí a vystavují je na svém povrchu v komplexu s MHC molekulami I. i II. třídy (MHC – major histocompatibility complex – hlavní histokompatibilní komplex). Při absenci zánětlivého prostředí nedochází k jejich aktivaci ve zralé DC. V tomto stavu tedy nejsou imunogenní (neindukují imunitní odpověď), jelikož vystavují na povrchu pouze malé množství kostimulačních molekul, které jsou důležité pro aktivaci T-lymfocytů [9]. V případě vzniku zánětlivého prostředí vlivem přítomnosti patogenu či poškození tkáně dojde k jejich aktivaci přes specifické receptory rozeznávající molekulové vzory (pattern recognition receptors – PPR, jako jsou např. Toll-like receptors TLR nebo NOD-like receptors – NLR). Tyto receptory rozpoznávají specifické molekuly asociované s patogeny (pathogen-associated molecular patterns – PAMP) nebo s poškozením tkáně (damage-associated molecular patterns – DAMP) [10]. Po aktivaci DC ztrácí schopnost fagocytózy a migrují do spádových lymfatických uzlin a dalších sekundárních lymfatických orgánů, kde se diferencují v plně maturované DC. Zralé DC se vyznačují expresí velkého množství MHC molekul I. a II. třídy a zvýšenou expresí kostimulačních molekul, dále produkcí cytokinů důležitých pro diferenciaci a stimulaci antigenně specifických efektorových T-lymfocytů (zejména IL-12 a IL-6; IL - interleukin) [11, 12]. Nezralé DC mají tedy nižší schopnost zahájit imunitní reakci oproti zralým DC, nelze je však považovat za totožné s tolerogenními DC [13].
Ačkoliv některé studie považují již nezralé DC nebo semi-maturované DC (částečně vyzrálé DC) za regulační [14, 15], vyčleňuje se samostatná skupina tolerogenních DC, která se významně podílí na aktivním navození a udržování imunologické tolerance. Jejich odlišnost od nezralých DC byla prokázána i na podkladě rozdílné exprese micro-RNA (jednovláknové nekódující RNA) která se může podílet na posttranskripční modifikaci genové exprese [16]. Několik studií prokázalo, že tDC jsou schopny navodit jak centrální, tak periferní toleranci, a to různými mechanismy, zahrnujícími klonální deleci autoreaktivních T-lymfocytů (buněčná smrt určitého autoreaktivního klonu) či jejich anergii (funkční útlum), indukci a expanzi T-regulačních lymfocytů (T-reg) nebo B-regulačních lymfocytů (B-reg), které pak mohou dále aktivně potlačovat imunitní odpověď vyvolanou antigenem [17–19]. Selhání mechanismů udržujících imunologickou toleranci či neodpovídavost na neškodné antigeny je podkladem řady onemocnění. Obnovení a udržení tolerance za pomoci tDC by bylo vhodnou terapeutickou intervencí nejen u autoimunitních chorob, ale i u jiných imunopatologických stavů, kde je zapotřebí navodit antigenně specifickou toleranci.
V tomto článku uvádíme přehled hlavních charakteristik tDC, možnost jejich přípravy in vitro a přehled klinických studií využívajících buněčnou terapii založenou na tDC se zaměřením na diabetes mellitus 1. typu (T1DM), jakožto jednu z nejčastějších autoimunit u dětí.
FENOTYPICKÁ A FUNKČNÍ CHARAKTERISTIKA TOLEROGENNÍCH DC
Tolerogenní DC jsou charakterizovány nízkou povrchovou expresí kostimulačních molekul (CD80, CD86 a CD40; CD – cluster of differentiation), které jsou důležité pro aktivaci efektorových T-lymfocytů [20]. Na druhou stranu vystavují na svém povrchu inhibiční a regulační molekuly, jako jsou ILT-2, 3, 4 (immunoglobulin-like-transcript – transkript podobný imunoglobulinům) a PDL-1, 2 (program-death-ligand – ligand programované buněčné smrti), které interagují s receptory na T-lymfocytech a způsobují jejich apoptózu nebo anergii [21–23]. Tolerogenní DC mají navíc příznivý cytokinový profil, který přispívá k jejich regulačnímu potenciálu. Tolerogenní DC produkují malé nebo žádné množství zánětlivého cytokinu IL-12, který je hlavním stimulem pro aktivaci a proliferaci T-lymfocytů. Dále vykazují produkci protizánětlivých cytokinů jako IL-10 a TGF-beta (transforming growth factor β – transformující růstový faktor beta), což vede k útlumu T-buněčné proliferace a indukci T-regulačních lymfocytů [24–26].
Mezi další důležité charakteristiky tDC patří produkce enzymu indolamin-2,3-dioxygenázy (IDO). IDO reguluje expanzi efektorových T-lymfocytů katalýzou reakce degradující esenciální aminokyselinu tryptofan, která je základní živinou pro T-lymfocyty [27, 28] (schematizováno na obr. 1).
Obr. 1. Základní charakteristika tolerogenních dendritických buněk. Tolerogenní dendritické buňky mají nižší schopnost aktivovat efektorové T-lymfocyty díky snížené expresi <i>kostimulačních</i> molekul (CD80, CD86, CD40) a MHC molekul. Naopak díky zvýšené expresi imunoregulačních molekul PDL-1,2 a ILT- molekul mají schopnost navodit <i>anergii</i> či <i>klonální deleci</i> T-lymfocytů. tDC mají dále příznivý protizánětlivý cytokinový profil, charakterizovaný nízkou nebo žádnou produkcí IL-12 a IL-6 a zvýšenou produkcí IL-10 a TGF-β. Dále exprimují imunoregulační enzym IDO, který dále přispívá k jejich tolerogennímu potenciálu. CD – cluster of differentiation (diferenciační skupina); MHC – major histocompatibility complex (hlavní histokompatibilní komplex); PDL – programmed death-ligand (ligand programované buněčné smrti); ILT – Immunoglobulin-like transcript (transkript podobný imunoglobulinům); tDC – tolerogenní dendritické buňky; IL – interleukin; TGF-β – transforming growth factor β (transformující růstový faktor beta); IDO – indolamin 2,3–dioxygenáza Fig. 1. Basic characteristic of tolerogenic dendritic cells. tDC have a limited ability to prime T cells and induce their anergy or clonal deletion because of down-regulation of co-stimulatory molecules (CD80, CD86, CD40) and MHC molecules and up-regulation of immunoregulatory molecules (PDL-1,2 and ILT molecules). tDC display appropriate anti-inflammatory cytokine profile, which is defined by a low or none production of IL-12 and IL-6 and high production of IL-10 and TGF-β. Moreover, expression of immunomodulatory enzyme IDO contributes to their tolerogenic potential. CD – cluster of differentiation; MHC – major histocompatibility complex; PDL – programmed death-ligand; ILT – immunoglobulin- like transcript; tDC – tolerogenic dendritic cells; IL – interleukin; TGF-β – transforming growth factor β; IDO – indoleamine 2,3-dioxygenase 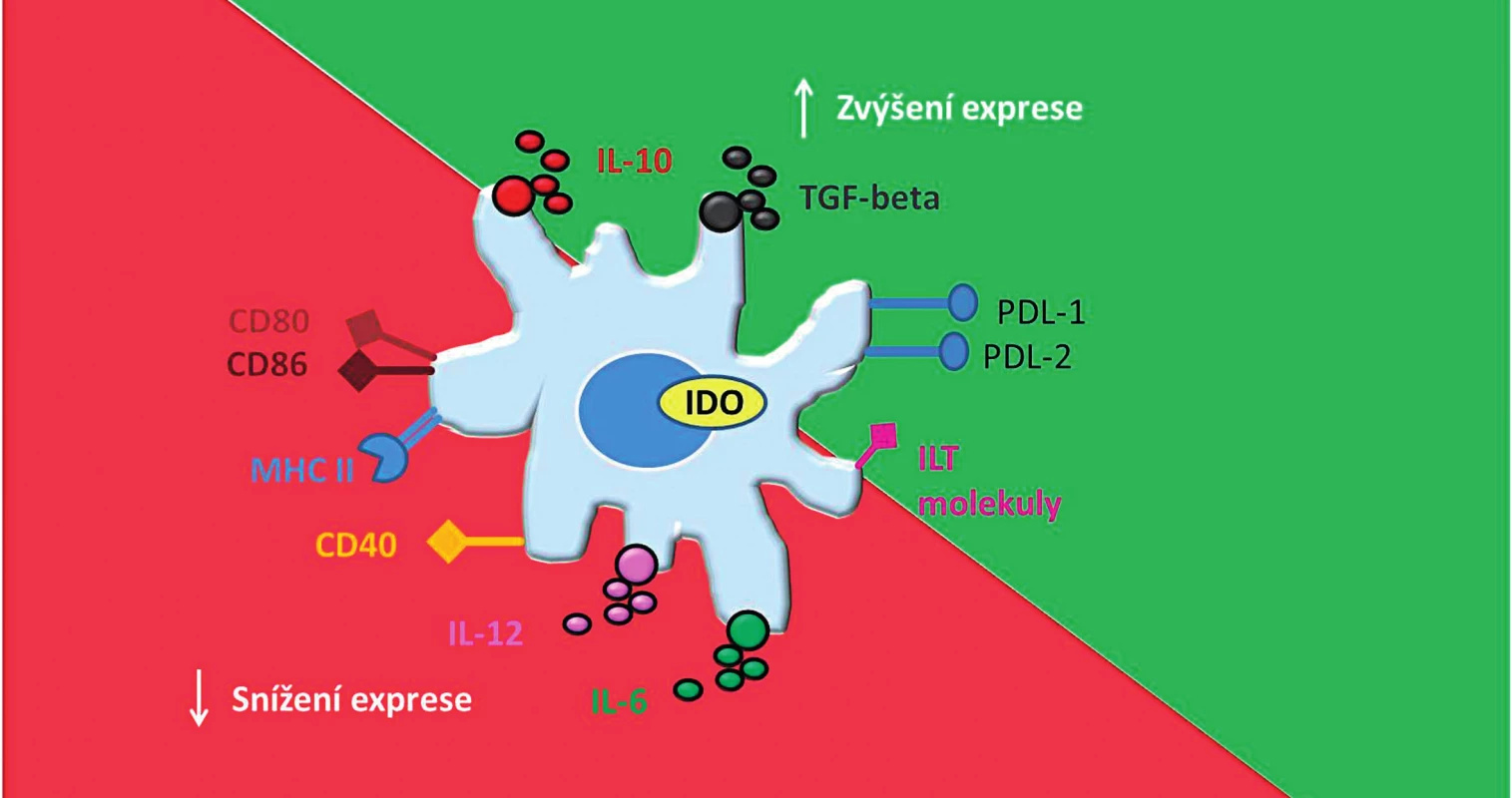
ZPŮSOB PŘÍPRAVY DC A tDC IN VITRO
Na myším modelu se DC standardně získávají z kmenových buněk kostní dřeně (bone-marrow-derived dendritic cells – BMDC), které se kultivují za přítomnosti GM-CSF (granulocyte-macrophage colony-stimulating factor – růstový hormon pro granulocyty a makrofágy) a IL-4 [29, 30]. Takto připravené nezralé DC se dále kultivují s maturačními faktory (látky schopné navodit vyzrání DC) jako např. lipopolysacharid (LPS), aby došlo ke vzniku plně maturovaných DC schopných účinně prezentovat antigen. Další metodou pro získávání DC, která se používá zejména v humánním modelu, je diferencování DC z monocytů z periferní krve. Takto získané DC se označují mo-DC (monocyte-derived DC – dendritické buňky získané z monocytů periferní krve). Buňky se opět připravují za přítomnosti GM-CSF a IL-4 a pro jejich finální aktivaci je nutné přidat maturační signál [31, 32] (schematizováno na obr. 2).
Obr. 2. Příprava tolerogenních dendritických buněk z periferní krve. Monocyty izolované z PBMC jsou kultivované za přítomnosti GM-CSF a IL-4 a imunomodulačního agens. Po přidání maturačního stimulu vznikne aktivovaná tDC, která má na rozdíl od aktivované zralé DC menší schopnost indukovat imunitní odpověď a vyznačuje se spíše imunoregulačním potenciálem. PBMC – peripheral blood mononuclear cells (periferní mononukleární buňky); GM-CSF – granulocyte-macrophage colony-stimulating factor (růstový hormon pro granulocyty a makrofágy); IL-4 – interleukin 4; tDC – tolerogenní dendritické buňky Fig. 2. Generation of tolerogenic dendritic cells from peripheral blood. Monocytes are isolated from peripheral blood mononuclear cells (PBMC) and are cultured in the presence of GM-CSF, IL-4 and immunomodulatory agents. Further stimulation with maturation agent gives rise of activated tDC. The capacity of tDC for inducing an immune response is inferior to that of activated mature DC. PBMC – peripheral blood mononuclear cells; GM-CSF – granulocyte-macrophage colony-stimulating factor; IL-4 – interleukin 4; tDC – tolerogenic dendritic cells 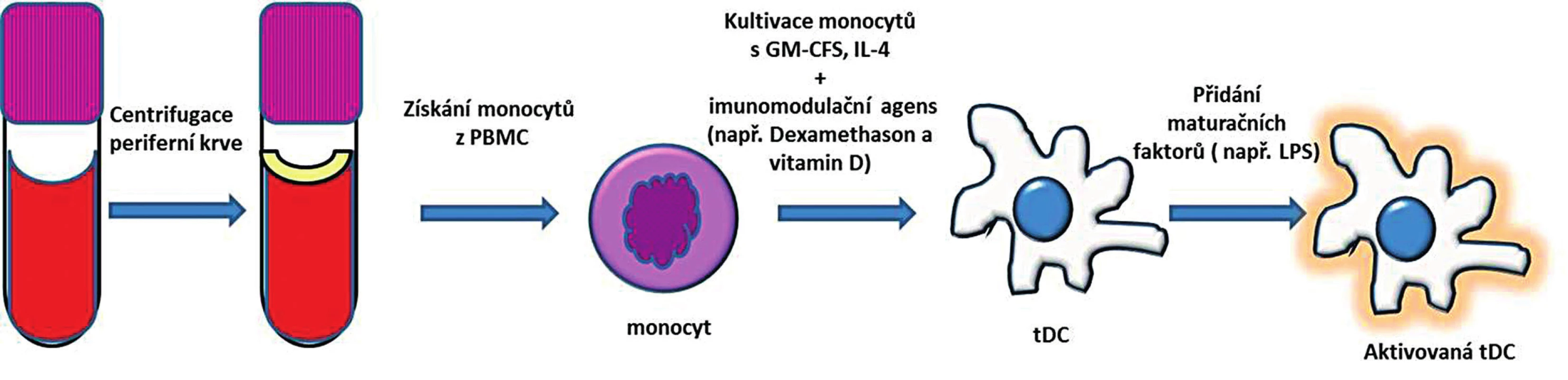
K přípravě tDC se používá řada imunomodulačních látek, které jsou schopny potlačit vyzrávání DC a indukují tak diferenciaci tDC. Ačkoliv bylo popsáno několik faktorů schopných indukovat tDC, zatím není standardizovaný protokol na přípravu univerzálních tDC [33–35].
Mezi popsané faktory schopné navodit tolerogenicitu u DC patří např. protizánětlivé cytokiny IL-10 a TGF-beta [36]. Zajímavou metodou je příprava tDC za pomoci přidání primárně zánětlivého cytokinu IFN-gamma (interferon gamma) k mo-DC. Tolerogenní DC připravené za přítomnosti IFN-gamma nejsou schopné účinně prezentovat antigeny T-lymfocytům a při kultivaci s naivními lymfocyty vykazují schopnost navodit expresi transkripčního faktoru FoxP3 (Forkhead box P3 protein) u CD4+ T-lymfocytů, který je důležitý pro regulaci vývoje a funkci T-regulačních lymfocytů [37]. Schopnost IFN-gamma indukovat tolerogenní vlastnosti u DC je závislá na jeho koncentraci v kultivačním médiu a na době jeho přidání [38, 39].
Další dobře známé tolerogenní látky jsou kortikosteroid dexamethason a vitamin D a jeho analoga [40, 41]. Tolerogenní DC připravené pomocí dexamethasonu a vitaminu D vykazují snížení exprese povrchových kostimulačních molekul, zvýšenou expresi imunoregulačních molekul a vykazují nízkou stimulační schopnost T-lymfocytů. Naše práce ukázala, že takto připravené tDC jsou také stabilní vůči maturačním signálům, což je velmi důležité pro klinickou aplikaci [42]. Vlivem vystavení tDC zánětlivým faktorům v organismu by mohlo dojít k jejich přeměně v plně maturované immunogenní DC, a tedy naopak k posílení imunitní odpovědi vůči autoantigenu/transplantátu [43].
Tolerogenní DC lze připravit i za použití dalších molekul, jako jsou tkáňové faktory (thymový stromální lymfopoetin – TSLP nebo růstový faktor hepatocytů – HGF) [44, 45], salicyláty [46], mykofenylátmofetil [47], rapamycin [48] nebo prostaglandin E2 [49]. Své zastoupení zde má i genetické inženýrství. V klinických studiích byly úspěšně otestovány tDC připravené pomocí antisenseoligonukleotidů cílených proti maturačním a kostimulačním molekulám u pacientů s diabetes mellitus 1. typu (T1DM). Tyto buňky byly nejen dobře tolerovány, ale zároveň došlo k detekci C-peptidu v krvi u některých pacientů, u kterých byl před podáním tDC negativní [50]. V nedávné době byla také publikována studie u alogenní transplantace srdce na myším modelu, kde byly k navození tolerance použity mezenchymální kmenové buňky (mesenchymal stem cells – MSC) [51]. MSC totiž také vykazují schopnost u DC navodit tolerogenní vlastnost [52].
TERAPEUTICKÉ VYUŽITÍ tDC
Za normálních okolností je v organismu udržována imunitní homeostáza, která zajišťuje účinnou ochranu jedince proti invazi patogenů a zároveň udržuje toleranci vůči vlastním antigenům a neškodným agens (jako např. fyziologická flóra, potravinové antigeny). Prolomení této imunologické tolerance může vést k nechtěné imunitní reakci proti vlastní tkáni, což je podkladem autoimunitních chorob [53]. Stejně tak může dojít k závažnému poškození tkáně na podkladě přemrštěné imunitní reakce na neškodný antigen, jako např. u Crohnovy choroby, potravinových alergií apod. V neposlední řadě má velký význam navození imunologické tolerance v transplantologii, kdy rejekce alotransplantátu nebo reakce štěpu proti hostiteli jsou nežádoucí imunitní reakce, které brání úspěšnému přihojení některých tkání či orgánů.
Doposud nejrozšířenější terapií u těchto stavů je dlouhodobá nespecifická imunosuprese, eventuálně podávání biologické léčby. Tyto terapeutické metody nejsou kauzální a mohou mít závažné nežádoucí účinky na organismus v podobě systémové imunosuprese [54]. V pediatrické populaci se výzkum soustřeďuje zejména na T1DM, kde celoživotní terapie inzulinem také není schopna plně nahradit fyziologickou sekreci a nelze zcela zabránit dlouhodobým komplikacím. S rozvojem buněčné terapie je velmi atraktivní terapeutickou strategií aplikace tolerogenních DC a jiných regulačních buněk (jako např. T-regulační lymfocyty, regulační makrofágy či MSC), které se společně s tDC podílejí na udržení imunitní homeostázy. Tyto buňky by mohly znamenat slibný terapeutický nástroj pro svoji nízkou toxicitu a schopnost potlačit nežádoucí imunitní reakci antigenně specificky [7, 55, 56].
V poslední době bylo publikováno mnoho studií zaměřených na buňky, jež jsou schopné navodit imunologickou toleranci. Jejich příznivý efekt byl prokázán jak in vitro, tak i na experimentálních autoimunitních onemocněních u myších modelů. Nicméně pro humánní užití je třeba vyřešit několik otázek, které vycházejí z patogeneze a progrese autoimunitních a hyperimunních patologických stavů. V prvé řadě je pro humánní užití nutné tDC buňky připravit pomocí protokolu, který splňuje požadavky GMP (good manufacturing practices – správná výrobní praxe). Velmi důležité je také správně načasovat dobu aplikace, např. u T1DM by bylo vhodnější aplikovat buněčnou vakcínu v době, kdy ještě nedošlo k převážnému zničení beta buněk pankreatu. Zároveň i stupeň kompenzace T1DM se zdá být rozhodující pro zajištění optimálního efektu tDC, což se ukázalo ve studii u pediatrických pacientů s T1DM s různou hladinou glykovaného hemoglobinu (HbA1c) [57]. Určení způsobu aplikace tDC, určení dávky tDC a frekvence aplikace jsou další faktory ovlivňující efektivní navození tolerance. Jednou z klíčových otázek pro zavedení imunoterapie tolerogenními dendritickými buňkami je výběr vhodného autoantigenu, neboť u autoimunit je obvykle přítomno větší množství autoantigenů, což je dáno fenoménem zvaným „antigen spreading“ (rozšiřování antigenů), kdy místní zánět odkrývá další lokální antigeny [58]. Ve studiích s diabetickými pacienty se ukazují být vhodné antigeny insulin či GAD, probíhají i in vitro studie s proinsulinem. Zároveň i autoreaktivita mezi jednotlivými pacienty je rozdílná, a proto by bylo ideální vytvořit personalizovanou vakcínu jednotlivě pro každého pacienta.
Ve snaze co nejvíce zefektivnit převedení tDC a dalších produktů zaměřujících se na regulační buněčnou terapii do klinické praxe vznikla iniciativa A FACCT (Action to focus and accelerate cell-based tolerance-inducing therapies – Iniciativa pro soustředění a zintenzivnění buněčné terapie zaměřené na navození tolerance) za podpory evropské spolupráce ve vědeckém a technickém výzkumu COST (European Cooperation in Science and Technology). Tato iniciativa má za cíl sjednotit poznatky o současné tolerogenní buněčné terapii a propojit evropská centra, která se zabývají buněčnou terapií navozující toleranci, tak, aby byla maximalizována snaha co nejrychleji zavést tuto buněčnou terapii do klinické praxe [59].
V současné době probíhá nebo již bylo dokončeno několik klinických studií ve fázi 1 zaměřených na regulační buňky, a to pro léčbu pacientů s T1DM, revmatoidní artritidou, roztroušenou sklerózou, astmatem, morbus Crohn a u pacientů po transplantaci ledvin. V tabulce 1 uvádíme přehled klinických studií používajících tDC s dokončenou 1. fází [60–64]. Doposud většina těchto studií vykázala dobrý bezpečnostní profil, tDC byly pacienty dobře tolerovány a nedošlo ke zhoršení základního onemocnění. Kromě toho byl nedávno zahájen nábor pacientů do 2. fáze klinické studie s tDC u pacientů s T1DM (USA).
Tab. 1. Přehled dokončených klinických studií ve fázi I používajících tDC. 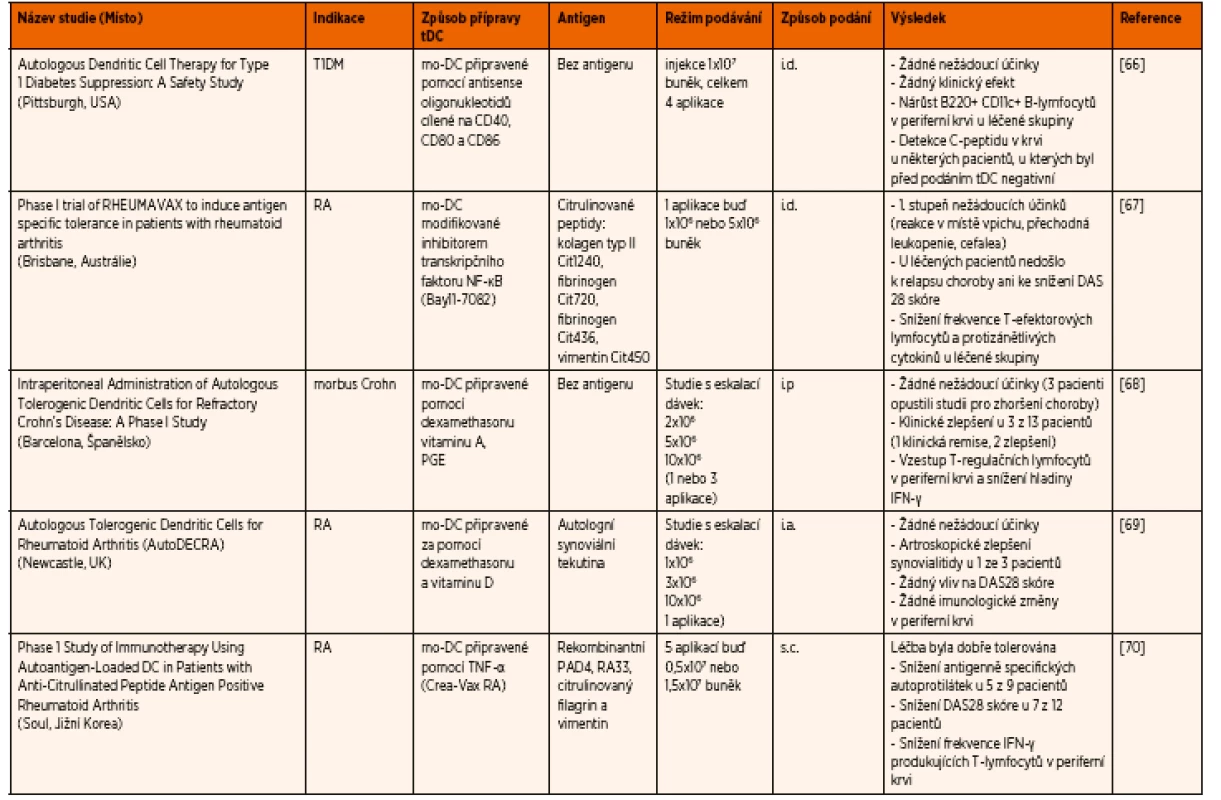
T1DM – diabetes 1. typu; RA – revmatoidní artritida; tDC – tolerogenní dendritické buňky; mo-DC – monocyte derived dendritic cell (DC derivované z monocytů); NF-κB – nuclear factor kappa-light- -chain-enhancer of activated B cells (nukleární faktor kappa B); PGE – prostaglandin E; TNF-α – tumor necrosis factor alpha (faktor nádorové nekrózy alfa); IFN-γ – interferon gamma; PAD4 - peptidyl arginin deimináza 4; RA33 – heterogeneous nuclear ribonucleoprotein A2/B1 (heterogenní jaderný ribonukleoprotein A2/B1); i.d. – intradermálně; s.c. – subkutánně; i.p. – intraperitoneálně; i.a. – intraartikulárně; DAS – disease activity score (škála hodnotící aktivitu nemoci) ZÁVĚR
Tolerogenní dendritické buňky jsou skupinou dendritických buněk, jejichž hlavní funkcí je navození a udržení imunitní tolerance. Nicméně tDC někdy označované také jako regulační DC jsou heterogenní skupinou a jednoznačná definice určující jejich fenotyp a biomarkery nebyla zatím standardizována. Mezi základní fenotypické znaky tDC patří snížená exprese kostimulačních a MHC molekul, které jsou důležité pro aktivaci efektorových T-lymfocytů. Naopak prostřednictvím zvýšeného množství imunoregulačních a tolerogenních molekul na svém povrchu, společně s příznivým cytokinovým profilem, jsou tDC schopny tlumit proliferaci a aktivaci T-lymfocytů a indukují vznik specifické skupiny T-regulačních buněk a B-regulačních buněk, které pak dále aktivně navozují a udržují periferní toleranci.
V současné době existuje několik způsobů přípravy tDC v souladu s GMP, které se již testují v klinických studiích u imunopatologických stavů. I přes některé limitace, jako je zejména určení vhodného spektra antigenů a nutnosti stability tDC, vykazuje zatím terapie s tDC dobrý bezpečnostní profil a je tak možné zahájit další fáze klinického zkoušení. Proto by mohla být tato imunointervence slibným terapeutickým nástrojem v léčbě autoimunitních chorob, alergií i prevence odhojení štěpu, a to bez nežádoucích účinků celkové imunosuprese, které se značně promítají do kvality života pacientů.
Došlo: 30. 11. 2016
Přijato: 20. 1. 2017
MUDr. Anna Grohová
Kopřivnická 615
199 00 Praha 9 – Letňany
e-mail: anna.grohova@gmail.com
Zdroje
1. Banchereau J, Steinman RM. Dendritic cells and the control of immunity. Nature 1998; 392 (6673): 245–252.
2. Steinman RM. Dendritic cells: Understanding immunogenicity. Eur J Immunol 2007; 37 (1): 53–60.
3. Doulatov S, Notta F, Eppert K, et al. Revised map of the human progenitor hierarchy shows the origin of macrophages and dendritic cells in early lymphoid development. Nat Immunol 2010; 11 (7): 585–593.
4. Shortman K, Naik SH. Steady-state and inflammatory dendritic-cell development. Nat Rev Immunol 2007; 7 (1): 19–30.
5. Colonna M, Trinchieri G, Liu YJ. Plasmacytoid dendritic cells in immunity. Nat Immunol 2004; 5 (12): 1219–1226.
6. Cools N, Ponsaerts P, Van Tendeloo VF, et al. Balancing between immunity and tolerance: An interplay between dendritic cells, regulatory T cells, and effector T cells. J Leukoc Biol 2007; 82 (6): 1365–1374.
7. Li H, Shi B. Tolerogenic dendritic cells and their applications in transplantation. Cell Mol Immunol 2015; 12 (1): 24–30.
8. Collin M, Mcgovern N, Haniffa M. Human dendritic cell subsets. Immunology 2013; 140 (1): 22–30.
9. Mahnke K, Schmitt E, Bonifaz L, et al. Immature, but not inactive: The tolerogenic function of immature dendritic cells. Immunol Cell Biol 2002; 80 (5): 477–483.
10. Matzinger P. The danger model: A renewed sense of self. Science 2002; 296 (5566): 301–305.
11. Heufler C, Koch F, Stanzl U, et al. Interleukin-12 is produced by dendritic cells and mediates T helper 1 development as well as interferon-gamma production by T helper 1 cells. Eur J Immunol 1996; 26 (3): 659–668.
12. Banchereau J, Briere F, Caux C, et al. Immunobiology of dendritic cells. Annu Rev Immunol 2000; 18 : 767–811.
13. Maldonado RA, Von Andrian UH. How tolerogenic dendritic cells induce regulatory T cells. Adv Immunol 2010; 108 : 111–165.
14. Sallusto F, Lanzavecchia A. The instructive role of dendritic cells on T-cell responses. Arthritis Res 2002; 4 (3): 127–132.
15. Maggi J, Schafer C, Ubilla-Olguin G, et al. Therapeutic potential of hyporesponsive CD4(+) T cells in autoimmunity. Front Immunol 2015; 6 : 488.
16. Stumpfova Z, Hezova R, Meli AC, et al. Microrna profiling of activated and tolerogenic human dendritic cells. Mediators Inflamm 2014; 2014 : 259689.
17. Gordon JR, Ma Y, Churchman L, et al. Regulatory dendritic cells for immunotherapy in immunologic diseases. Front Immunol 2014; 5 : 7.
18. Lutz MB, Schuler G. Immature, semi-mature and fully mature dendritic cells: Which signals induce tolerance or immunity? Trends Immunol 2002; 23 (9): 445–449.
19. Thompson AG, Thomas R. Induction of immune tolerance by dendritic cells: Implications for preventative and therapeutic immunotherapy of autoimmune disease. Immunol Cell Biol 2002; 80 (6): 509–519.
20. Hubo M, Trinschek B, Kryczanowsky F, et al. Costimulatory molecules on immunogenic versus tolerogenic human dendritic cells. Front Immunol 2013; 4 : 82.
21. Freeman GJ, Long AJ, Iwai Y, et al. Engagement of the PD-1 immunoinhibitory receptor by a novel B7 family member leads to negative regulation of lymphocyte activation. J Exp Med 2000; 192 (7): 1027–1034.
22. Wu J, Horuzsko A. Expression and function of immunoglobulin-like transcripts on tolerogenic dendritic cells. Hum Immunol 2009; 70 (5): 353–356.
23. Latchman Y, Wood CR, Chernova T, et al. PD-L2 is a second ligand for pd-1 and inhibits t cell activation. Nat Immunol 2001; 2 (3): 261–268.
24. Steinman RM. The control of immunity and tolerance by dendritic cell. Pathol Biol (Paris) 2003; 51 (2): 59–60.
25. Roncarolo MG, Battaglia M. Regulatory t-cell immunotherapy for tolerance to self antigens and alloantigens in humans. Nat Rev Immunol 2007; 7 (8): 585–598.
26. Steinman RM, Hawiger D, Nussenzweig MC. Tolerogenic dendritic cells. Annu Rev Immunol 2003; 21 : 685–711.
27. Hwu P, Du MX, Lapointe R, et al. Indoleamine 2,3-dioxygenase production by human dendritic cells results in the inhibition of t cell prolifera-tion. J Immunol 2000; 164 (7): 3596–3599.
28. Terness P, Bauer TM, Rose L, et al. Inhibition of allogeneic t cell proliferation by indoleamine 2,3-dioxygenase-expressing dendritic cells: Mediation of suppression by tryptophan metabolites. J Exp Med 2002; 196 (4): 447–457.
29. Inaba K, Inaba M, Romani N, et al. Generation of large numbers of dendritic cells from mouse bone marrow cultures supplemented with granulocyte/macrophage colony-stimulating factor. J Exp Med 1992; 176 (6): 1693–1702.
30. Helft J, Bottcher J, Chakravarty P, et al. GM-CSF mouse bone marrow cultures comprise a heterogeneous population of CD11c(+) MHCII(+) macrophages and dendritic cells. Immunity 2015; 42 (6): 1197–1211.
31. Thurner B, Roder C, Dieckmann D, et al. Generation of large numbers of fully mature and stable dendritic cells from leukapheresis products for clinical application. J Immunol Methods 1999; 223 (1): 1–15.
32. Steinman RM, Hemmi H. Dendritic cells: Translating innate to adaptive immunity. Curr Top Microbiol Immunol 2006; 311 : 17–58.
33. Yoo S, Ha SJ. Generation of tolerogenic dendritic cells and their therapeutic applications. Immune Netw 2016; 16 (1): 52–60.
34. Naranjo-Gomez M, Raich-Regue D, Onate C, et al. Comparative study of clinical grade human tolerogenic dendritic cells. J Transl Med 2011; 9 : 89.
35. Torres-Aguilar H, Sanchez-Torres C, Jara LJ, et al. IL-10/TGF-beta-treated dendritic cells, pulsed with insulin, specifically reduce the response to insulin of CD4+ effector/memory T cells from type 1 diabetic individuals. J Clin Immunol 2010; 30 (5): 659–668.
36. Boks MA, Kager-Groenland JR, Haasjes MS, et al. Il-10-generated tolerogenic dendritic cells are optimal for functional regulatory t cell induction – a comparative study of human clinical-applicable dc. Clin Immunol 2012; 142 (3): 332–342.
37. Hori S, Nomura T, Sakaguchi S. Control of regulatory T cell development by the transcription factor foxp3. Science 2003; 299 (5609): 1057–1061.
38. Svajger U, Obermajer N, Jeras M. IFN-gamma-rich environment programs dendritic cells toward silencing of cytotoxic immune responses. J Leukoc Biol 2014; 95 (1): 33–46.
39. Kerkar SP, Chinnasamy D, Hadi N, et al. Timing and intensity of exposure to interferon-gamma critically determines the function of monocyte-derived dendritic cells. Immunology 2014; 143 (1): 96–108.
40. Harry RA, Anderson AE, Isaacs JD, et al. Generation and characterisation of therapeutic tolerogenic dendritic cells for rheumatoid arthritis. Ann Rheum Dis 2010; 69 (11): 2042–2050.
41. Ferreira GB, Van Etten E, Verstuyf A, et al. 1,25-dihydroxyvitamin D3 alters murine dendritic cell behaviour in vitro and in vivo. Diabetes Metab Res Rev 2011; 27 (8): 933–941.
42. Danova K, Klapetkova A, Kayserova J, et al. NF-kappaB, p38 Mapk, Erk1/2, mTor, Stat3 and increased glycolysis regulate stability of paricalcitol/dexamethasone-generated tolerogenic dendritic cells in the inflammatory environment. Oncotarget 2015; 6 (16): 14123–14138.
43. Nikolic T, Roep BO. Regulatory multitasking of tolerogenic dendritic cells - lessons taken from vitamin d3-treated tolerogenic dendritic cells. Front Immunol 2013; 4 : 113.
44. Rutella S, Bonanno G, Procoli A, et al. Hepatocyte growth factor favors monocyte differentiation into regulatory interleukin (IL)-10++IL-12low/neg accessory cells with dendritic-cell features. Blood 2006; 108 (1): 218–227.
45. Watanabe N, Wang YH, Lee HK, et al. Hassall’s corpuscles instruct dendritic cells to induce cd4+cd25+ regulatory t cells in human thymus. Nature 2005; 436 (7054): 1181–1185.
46. Hackstein H, Morelli AE, Larregina AT, et al. Aspirin inhibits in vitro maturation and in vivo immunostimulatory function of murine myeloid dendritic cells. J Immunol 2001; 166 (12): 7053–7062.
47. Mehling A, Grabbe S, Voskort M, et al. Mycophenolate mofetil impairs the maturation and function of murine dendritic cells. J Immunol 2000; 165 (5): 2374–2381.
48. Hackstein H, Taner T, Zahorchak AF, et al. Rapamycin inhibits IL-4–induced dendritic cell maturation in vitro and dendritic cell mobilization and function in vivo. Blood 2003; 101 (11): 4457–4463.
49. Trabanelli S, Lecciso M, Salvestrini V, et al. PGE2-induced IDO1 inhibits the capacity of fully mature DCs to elicit an in vitro antileukemic immune response. J Immunol Res 2015; 2015 : 253191.
50. Giannoukakis N. Tolerogenic dendritic cells for type 1 diabetes. Immunotherapy 2013; 5 (6): 569–571.
51. Wang H, Qi F, Dai X, et al. Requirement of B7-H1 in mesenchymal stem cells for immune tolerance to cardiac allografts in combination therapy with rapamycin. Transpl Immunol 2014; 31 (2): 65–74.
52. Jiang XX, Zhang Y, Liu B, et al. Human mesenchymal stem cells inhibit differentiation and function of monocyte-derived dendritic cells. Blood 2005; 105 (10): 4120–4126.
53. Giardino G, Gallo V, Prencipe R, et al. Unbalanced immune system: Immunodeficiencies and autoimmunity. Front Pediatr 2016; 4 : 107.
54. Miller SD, Turley DM, Podojil JR. Antigen-specific tolerance strategies for the prevention and treatment of autoimmune disease. Nat Rev Immunol 2007; 7 (9): 665–677.
55. Hilkens CM, Isaacs JD. Tolerogenic dendritic cell therapy for rheumatoid arthritis: Where are we now? Clin Exp Immunol 2013; 172 (2): 148–157.
56. Hutchinson JA, Geissler EK. Now or never? The case for cell-based immunosuppression in kidney transplantation. Kidney Int 2015; 87 (6): 1116–1124.
57. Danova K, Grohova A, Strnadova P, et al. Tolerogenic dendritic cells from poorly compensated type 1 diabetes patients have decreased ability to induce stable antigen-specific t cell hyporesponsiveness and generation of suppressive regulatory t cells. J Immunol 2017; 198 (2): 729–740.
58. Roep BO, Peakman M. Antigen targets of type 1 diabetes autoimmunity. Cold Spring Harb Perspect Med 2012; 2 (4): 007781.
59. Ten Brinke A, Hilkens CM, Cools N, et al. Clinical use of tolerogenic dendritic cells-harmonization approach in european collaborative effort. Mediators Inflamm 2015; 2015 : 471719.
60. Giannoukakis N, Phillips B, Finegold D, et al. Phase Ii (safety) study of autologous tolerogenic dendritic cells in type 1 diabetic patients. Diabetes Care 2011; 34 (9): 2026–2032.
61. Benham H, Nel HJ, Law SC, et al. Citrullinated peptide dendritic cell immunotherapy in HLA risk genotype-positive rheumatoid arthritis patients. Sci Transl Med 2015; 7 (290): 290–287.
62. Jauregui-Amezaga A, Cabezon R, Ramirez-Morros A, et al. Intraperitoneal administration of autologous tolerogenic dendritic cells for refractory crohn’s disease: A phase I study. J Crohns Colitis 2015; 9 (12): 1071–1078.
63. Bell GM, Anderson AE, Diboll J, et al. Autologous tolerogenic dendritic cells for rheumatoid and inflammatory arthritis. Ann Rheum Dis 2017; 76 (1): 227–234.
64. Joo JB, Chan-Bum CH, Jeongim CH, et al. Phase 1 study of immunotherapy using autoantigen-loaded dendritic cells in patients with anti-citrullinated peptide antigen positive rheumatoid arthritis. http://cris.nih.go.kr/cris/en/search/search_result_st01.jsp?seq=1645.
Štítky
Neonatologie Pediatrie Praktické lékařství pro děti a dorost
Článek Seriál o EET
Článek vyšel v časopiseČesko-slovenská pediatrie
Nejčtenější tento týden
2017 Číslo 4- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Syndrom Noonanové: etiologie, diagnostika a terapie
-
Všechny články tohoto čísla
- Editorial: Rostoucí skelet – oblast zájmu do budoucna
- Osteogenesis imperfecta – současný pohled na problematiku
- Liečebné stratégie na optimalizáciu kostného metabolizmu pri mentálnej anorexii
- Hypofosfatázie – onemocnění skeletu, na které musíme myslet
- Sezónna variabilita deficitu vitamínu D u detí s nešpecifickým zápalovým ochorením čreva a inými chronickými ochoreniami
- Temperament v raném dětství a jeho popis pomocí IBQR VSF
-
Infantilní hemangiomy.
Současné léčebné postupy - Tolerogenní dendritické buňky a jejich využití v léčbě imunopatologických stavů
- Kvalita života dětských hemofiliků v České republice – zkušenosti jednoho centra
- Následná dlouhodobá intenzivní péče pro děti ve Vojenské nemocnici Olomouc
- Seriál o EET
- Česko-slovenská pediatrie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Osteogenesis imperfecta – současný pohled na problematiku
-
Infantilní hemangiomy.
Současné léčebné postupy - Hypofosfatázie – onemocnění skeletu, na které musíme myslet
- Následná dlouhodobá intenzivní péče pro děti ve Vojenské nemocnici Olomouc
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



