-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Neinvazivní hemodynamický monitoring u kriticky nemocných dětí – USCOM
Prospektivní observační studie
Noninvasive hemodynamic monitoring in critically ill children – USCOM.
Prospective observational studyIntroduction:
Cardiopulmonary interactions influence cardiac output during mechanical ventilation. There is limited prospective data investigating these interactions in critically ill pediatric patients.Methods:
We performed a prospective observational study to evaluate the influence of mechanical ventilation strategy on hemodynamic changes using ultrasound cardiac output monitoring (USCOM). This study was conducted with 56 children on protective mechanical ventilation for pulmonary (36 children) and non-pulmonary (20 children) pathology. Circulatory parameters (e.g., cardiac index and systemic vascular resistance index) were evaluated after initiation of mechanical ventilation and at 6, 12 and 48-hour intervals. The circulatory support therapy was indicated based on USCOM measurement results. Fluid balance was monitored.Results:
No significant differences between the groups’ hemodynamic profiles were found. Children ventilated for pulmonary pathology tended to require more frequent inotropic and combined inotropic/vasopressor circulatory support than did the children ventilated for non-pulmonary pathology. Children ventilated for non-pulmonary pathology tended to require more frequent vasopressor circulatory support after the initiation of mechanical ventilation. Both groups required a similar amount of fluid during the study.Conclusion:
The protective strategy of mechanical ventilation was not associated with significant differences in hemodynamic profiles between patients with pulmonary and non-pulmonary pathologies. Although not statistically significant, a trend was observed toward a more frequent requirement for inotropic and combined inotropic/vasopressor therapy in children ventilated for pulmonary pathology, compared to those ventilated for non-pulmonary pathology.Key words:
USCOM, hemodynamics, cardiopulmonary, children
Autoři: J. Fremuth; J. Kobr; L. Šašek; K. Pizingerová; J. Zamboryová; J. Sýkora
Působiště autorů: Dětská klinika, Univerzita Karlova v Praze, Lékařská fakulta a Fakultní nemocnice v Plzni přednosta prof. MUDr. J. Sýkora, Ph. D.
Vyšlo v časopise: Čes-slov Pediat 2016; 71 (5-6): 260-267.
Kategorie: Původní práce
Souhrn
Úvod:
Kardiopulmonální interakce ovlivňují srdeční výdej v průběhu umělé plicní ventilace. Není publikován dostatek dat týkajících se studia těchto interakcí u kriticky nemocných dětí.Metoda:
Provedli jsme prospektivní observační studii hodnotící vliv umělé plicní ventilace na hemodynamické změny pomocí metody sonografického monitoringu srdečního výdeje (USCOM). Do studie bylo zařazeno celkem 56 dětí ventilovaných protektivní umělou plicní ventilací: 36 dětí bylo ventilováno pro plicní a 20 dětí pro mimoplicní patologii. Oběhové parametry (srdeční index, index systémové vaskulární rezistence) byly změřeny po zahájení umělé plicní ventilace a dále v intervalech 6, 12 a 48 hodin od zahájení umělé plicní ventilace. Medikamentózní podpora oběhu byla indikována na základě výsledků získaných metodou USCOM. Byla monitorována tekutinová bilance.Výsledky:
Mezi skupinami nebyly nalezeny významné rozdíly v hemodynamických profilech. Děti ventilované pro plicní patologii měly tendenci vyžadovat častěji inotropní a kombinovanou inotropně/vazopresorickou podporu ve srovnání s dětmi ventilovanými pro mimoplicní patologii. Děti s mimoplicní patologií častěji vyžadovaly vazopresorickou podporu po zahájení umělé plicní ventilace. Rozdíl mezi skupinami nebyl statisticky významný. Obě studované skupiny vyžadovaly srovnatelné množství tekutin.Závěr:
Protektivní strategie umělé plicní ventilace nebyla spojena se signifikantními rozdíly v hemodynamických profilech mezi pacienty ventilovanými pro plicní a mimoplicní patologii. U pacientů ventilovaných pro plicní patologii byl pozorován trend k častější potřebě inotropní a kombinované inotropně/vazopresorické podpory ve srovnání s pacienty ventilovanými pro mimoplicní patologii.KLÍČOVÁ SLOVA:
USCOM, hemodynamika, kardiopulmonální, dětiÚVOD
Potřeba hemodynamického monitoringu představuje jedno z indikačních kritérií k přijetí na jednotku intenzivní a resuscitační péče (JIRP). Sledování hemodynamických změn umožní lékaři identifikovat patofyziologické změny oběhu a zvolit správnou léčebnou strategii [1, 2]. Předchozí publikované studie dokumentují, že klinický odhad hemodynamických parametrů (např. srdeční výdej či systémová vaskulární rezistence) je nepřesný a nekoreluje s výsledky získanými měřením invazivními monitorovacími metodami u kriticky nemocných dětí a dospělých [3, 4]. Použití invazivních monitorovacích metod je mimo jiné spojeno s časovou náročností, kdy zahájení hemodynamického měření často překročí doporučovaný časový interval při léčbě šokových stavů [1].
Hlavním cílem léčby kriticky nemocného pacienta je zajištění adekvátní dodávky kyslíku do periferních tkání. Minutový srdeční výdej je determinovaný tepovou frekvencí a tepovým objemem. Srdeční výdej a systémová vaskulární rezistence jsou determinanty krevního tlaku. Patofyziologické změny kardiovaskulárního systému u kriticky nemocného dítěte zahrnují nedostatečnou intravaskulární náplň, selhání inotropie a poruchy systémové vaskulární rezistence či jejich vzájemné kombinace. Pediatrické studie z posledních let dokazují, že hemodynamický profil u kriticky nemocného není stacionární, naopak se dynamicky v průběhu patologického stavu vyvíjí [5]. Iniciální léčebná strategie hypotenzního septického pacienta v dětském věku je založena na podání tekutin [6]. Další individuální léčebný postup, založený na pokračování v tekutinové resuscitaci, podávání vazopresorických, inotropních či vazodilatačních látek, by měl být stanoven na základě určení hemodynamického profilu [1].
V poslední době je v klinické praxi předmětem zájmu použití semiinvazivních a neinvazivních metod hemodynamického monitoringu. Jednou z měřicích technik používaných v dětském i dospělém věku je metoda USCOM (ultrasound cardiac output monitoring). Neinvazivní metoda USCOM používá kontinuální dopplerovské měření rychlosti toku krve ve výtokovém traktu levé nebo pravé komory srdeční. Měřením je získána hodnota Vti (velocity time integral) odpovídající vzdálenosti, kterou urazí krev při jednom srdečním stahu. Vynásobením Vti a plochy (průřezu) aortální ev. pulmonální chlopně je získána hodnota tepového objemu levé eventuálně pravé komory srdeční. Hodnota plochy výtokového traktu je získána z nomogramu na základě zadání výšky a hmotnosti pacienta. Násobkem mezi tepovým objemem a srdeční frekvencí je následně získána hodnota minutového srdečního výdeje. Zadáním perfuzního tlaku (rozdíl mezi středním arteriálním tlakem a centrálním žilním tlakem) je vypočítána hodnota systémové vaskulární rezistence. Transaortální měření vyhodnocuje systémové hemodynamické parametry [7].
Umělá plicní ventilace (UPV) je vedle tekutinového managementu a medikamentózní podpory oběhu zásadním prvkem v léčbě kriticky nemocných dětí. Aplikace mechanické ventilace u kriticky nemocného může zásadně ovlivnit hemodynamiku pacienta v důsledku kardiopulmonálních interakcí [8, 9]. Pacienti ventilovaní pro plicní patologii vyžadují použití vyšších inspiračních tlaků k dosažení cílových dechových objemů. V této skupině pacientů je možno očekávat výrazněji vyjádřené kardiopulmonální interakce se signifikantními dopady na srdeční výdej [10, 11]. V současnosti máme málo recentních studií pediatrických pacientů, které by se zabývaly studiem těchto kardiopulmonálních interakcí u dětí na UPV.
METODY
Na pracovišti JIRP Dětské kliniky FN Plzeň a LF UK jsme provedli observační deskriptivní neintervenční studii u pacientů na UPV, které jsme monitorovali pomocí metody USCOM.
Cíle studie
Stanovili jsme si dva základní cíle:
- Popsat vývoj hemodynamických změn v prvních 48 hodinách u kriticky nemocných dětí na UPV.
- Srovnat hemodynamické změny u skupin pacientů ventilovaných pro plicní a mimoplicní patologii.
Vedlejším cílem bylo srovnání medikamentózního, hemodynamického a tekutinového managementu a porovnání plicní mechaniky u obou studovaných skupin.
Soubor pacientů
Do studie byli zařazeni pacienti hospitalizovaní na pracovišti všeobecné JIRP Dětské kliniky FN Plzeň. Vzhledem k neintervenčnímu charakteru studie nebyl nutný souhlas místní etické komise. Zařazovací kritéria zahrnovala pacienty mezi 1. měsícem a 17. rokem věku, kteří byli indikováni k UPV pro plicní a mimoplicní patologii. Dalším kritériem bylo provedení hemodynamického monitoringu pomocí metody USCOM do 1 hodiny od zahájení UPV a dále ve stanovených intervalech (6, 12 a 48 hodin od zahájení UPV), a to vždy jedním operátorem. Opakované měření bylo prováděno z oblasti jugulární jamky a monitorovalo levou komoru srdeční a systémovou hemodynamiku.
Skupina A zahrnovala pacienty ventilované pro plicní a skupina B pro mimoplicní patologii.
Protokol studie
Hemodynamické měření mimo v protokolem určených časových intervalech bylo indikováno pouze v případě náhlé změny klinického stavu, která si vyžádala aktuální zhodnocení změn hemodynamiky. Měření jedním operátorem bylo zvoleno z důvodu minimalizace variability při jednotlivých měřeních. Měření bylo v každý časový interval provedeno celkem 3krát ve 2minutových intervalech, přičemž finální užitá hodnota ke statistickému zpracování byla získána zprůměrováním těchto 3 měření.
Pacienti byli v rámci komplexního managementu zajištěni standardními invazivními vstupy (centrální žilní katetr, arteriální linka, permanentní močový katetr s termočidlem, ev. saturační katetr pro kontinuální měření saturace v centrální žilní krvi). V rámci studijního protokolu byly zaznamenávány jednotlivé typy katecholaminů používané ve výše uvedených časových intervalech. Parametry UPV byly kontinuálně monitorovány pomocí ventilačních parametrů a indexů (oxygenační index, hypoxemický index, PEEP, vrcholový inspirační tlak, střední tlak v dýchacích cestách, exspirační dechový objem). Ve výše zmíněných intervalech byla vždy současně prováděna analýza arteriálních krevních plynů. U obou skupin byla vyhodnocována bilance tekutin v průběhu prvních 3 dnů hospitalizace. Predikovaná mortalita byla stanovena pomocí PIM3 skóre [12].
Terapeutickým cílem bylo dosažení doporučeného perfuzního tlaku pro danou věkovou skupinu [13]. V případě sepse provázené hypotenzí nebo při známkách dehydratace byl v souladu s aktuálním doporučením podán bolus krystaloidu 20 ml/kg opakovaně až do 60 ml/kg během první hodiny [14]. Pokud pacient nevykazoval známky sepse a dehydratace, pak bylo vstupně zahájeno podávání udržovací tekutinové terapie podle platných doporučení. Na základě prvního hemodynamického měření a v případě nedosažení cílového perfuzního tlaku bylo indikováno podání jednotlivých katecholaminů s cílem dosáhnout hodnotu CI (srdečního indexu) mezi 3,3–6,0 L.min-1. m-2 a SVRI (indexované systémové vaskulární rezistence) mezi 900–1600 dyne s.cm-5.m-2. Jako základní inotropikum byl volen dobutamin, základním vazopresorickým lékem byl noradrenalin. V případě nízkého CI a vysoké SVRI bylo indikovano podání inhibitoru fosfodiesterázy III. Adrenalin byl indikován v případě nízkého srdečního výdeje a negativní odpovědi na podání tekutin a dobutaminu. Podání dopaminu bylo indikováno v případě nízkého CI provázeného bradykardií.
Statistická analýza
Nasbíraná data byla analyzována statistikem pomocí softwaru SAS (SAS Institute Inc., Cary, NC, USA) a STATISTICA (StatSoft, Inc., Tulsa, USA). Rozdíly mezi skupinami v daném čase byly hodnoceny pomocí Wilcoxonova dvouvýběrového testu. Změny fyziologických parametrů v čase byly hodnoceny párovým Wilcoxonovým testem a Friedman ANOVA testem. Výsledky byly kontrolně hodnoceny parametrickou variační analýzou. Hodnota p <0,05 byla hodnocena jako statisticky významná. Data jsou prezentována jako medián a interkvartilový rozptyl.
VÝSLEDKY
Ve studovaném období 12 měsíců bylo do studie zařazeno celkem 56 pacientů. Základní demografická data obou skupin jsou shrnuta v tabulce 1. Obě skupiny byly srovnatelné z pohledu věku, pohlaví a predikované mortality. Skupina A zahrnovala celkem 36 pacientů s následujícími diagnózami: pneumonie (21), bronchiolitida (8), aspirační příhoda (4), tonutí (2) a bronchiální astma (1). Skupina B zahrnovala celkem 20 pacientů s následujícími diagnózami: sepse (5), epileptický status (5), purulentní meningitis (4), stav po abdominálním chirurgickém výkonu (4), myelitis (1) a mozkový edém (1).
Tab. 1. Charakteristika skupin. 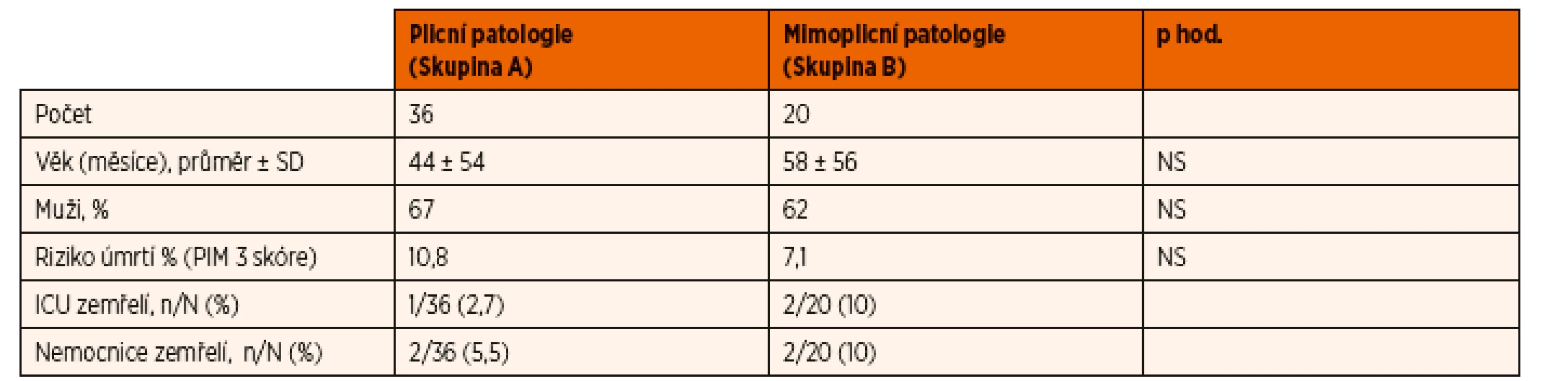
NS – nesignifikantní Hodnoty hemodynamických parametrů měřených pomocí USCOM a invazivních cévních vstupů jsou shrnuty v tabulkách 2 a 3. Systolický krevní tlak se signifikantně zvýšil u obou studovaných skupin v průběhu prvních 48 hodin UPV. SVRI se významně zvýšila ve skupině B v průběhu studie. U ostatních sledovaných parametrů nedošlo v průběhu studie k statisticky významné změně v rámci jednotlivých skupin. Meziskupinové srovnání ostatních hemodynamických parametrů také neprokázalo významné rozdíly v průběhu iniciálních 48 hodin na UPV (CI, SVI, DBP, CVP).
Tab. 2. Inotropika, vazopresory a vazodilatátory. Oběhové parametry. 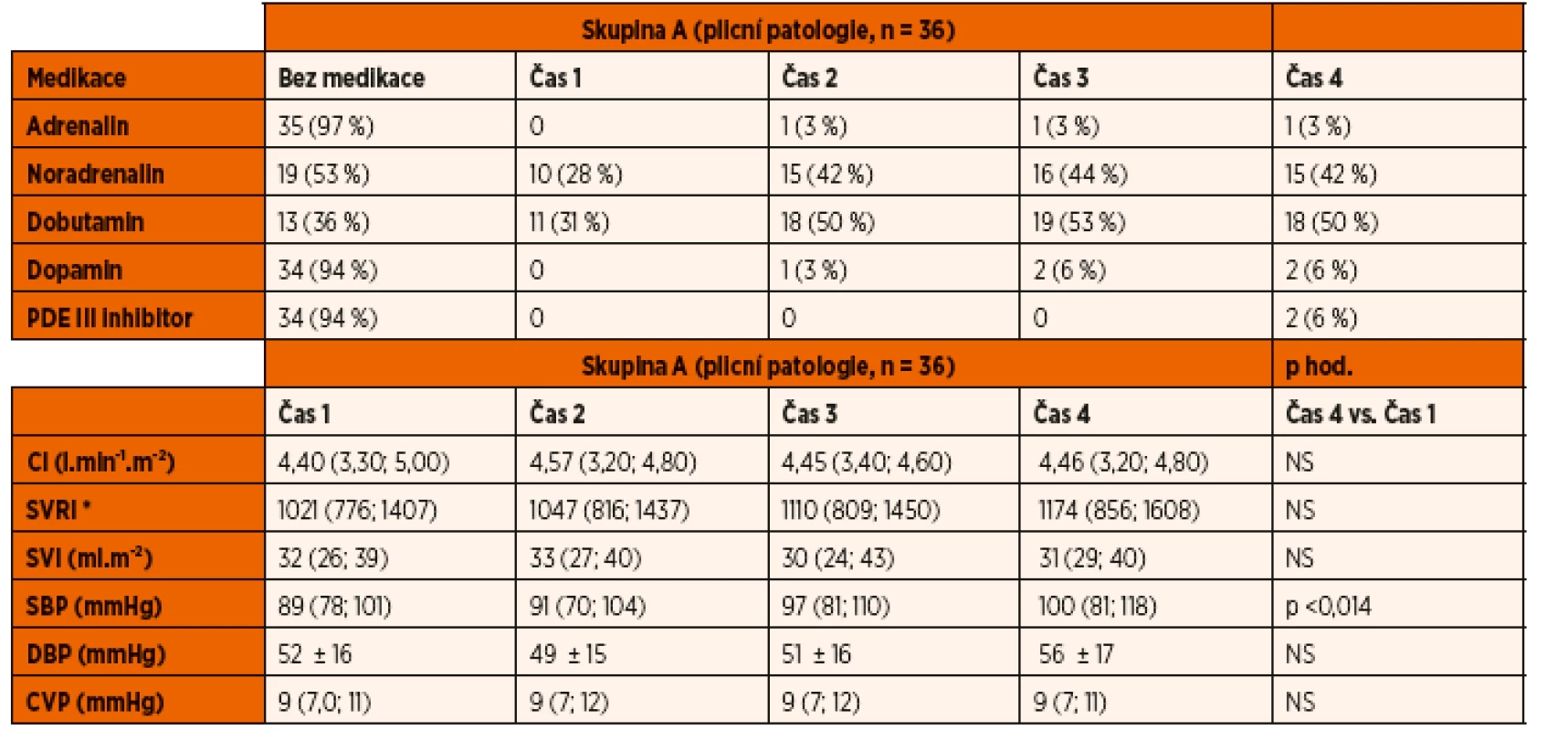
Legenda: CI – srdeční index SVRI – index systémové vaskulární rezistence SVI – index tepového objemu SBP – systolický krevní tlak DBP – diastolický krevní tlak CVP – centrální žilní tlak *(dyne s∙cm-5.m-2) Mezi skupinami nebyly nalezeny významné rozdíly. Hodnoty jsou vyjádřeny jako medián a interkvartilové rozpětí. Tab. 3. Inotropika, vazopresory a vazodilatátory. Oběhové parametry. 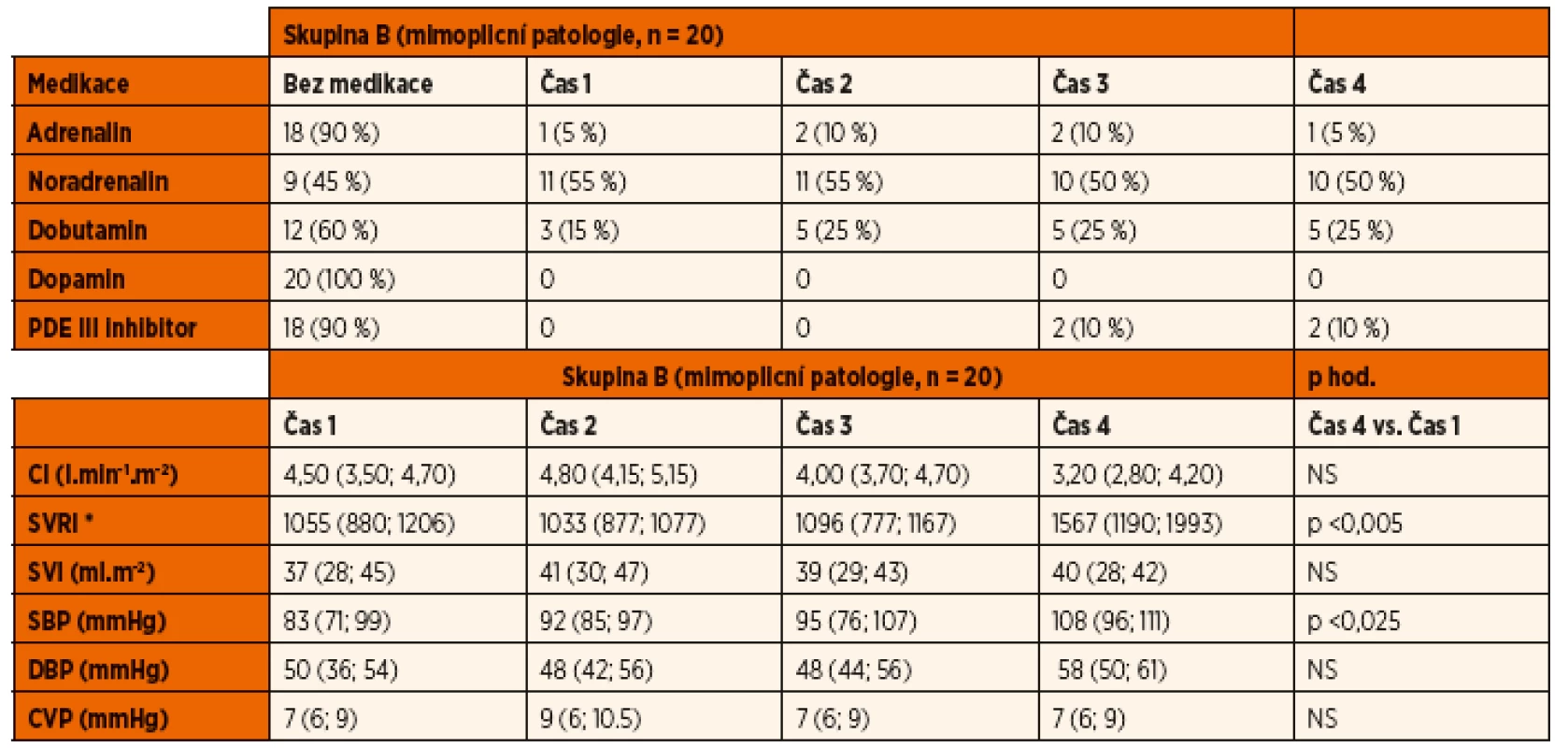
Legenda: CI – srdeční index SVRI – index systémové vaskulární rezistence SVI – index tepového objemu SBP – systolický krevní tlak DBP – diastolický krevní tlak CVP – centrální žilní tlak *(dyne s∙cm-5∙m-2) Mezi skupinami nebyly nalezeny významné rozdíly. Hodnoty jsou vyjádřeny jako medián a interkvartilové rozpětí. Tekutinový management
Parametry tekutinového managementu jsou shrnuty v tabulce 4. U obou skupin byla zaznamenána pozitivní bilance tekutin, která statisticky významně klesala v průběhu 2. a 3. dne hospitalizace. Mezi skupinami nebyly nalezeny významné rozdíly v příjmu tekutin ani v míře tekutinové bilance v průběhu sledování.
Tab. 4. Tekutinová bilance. 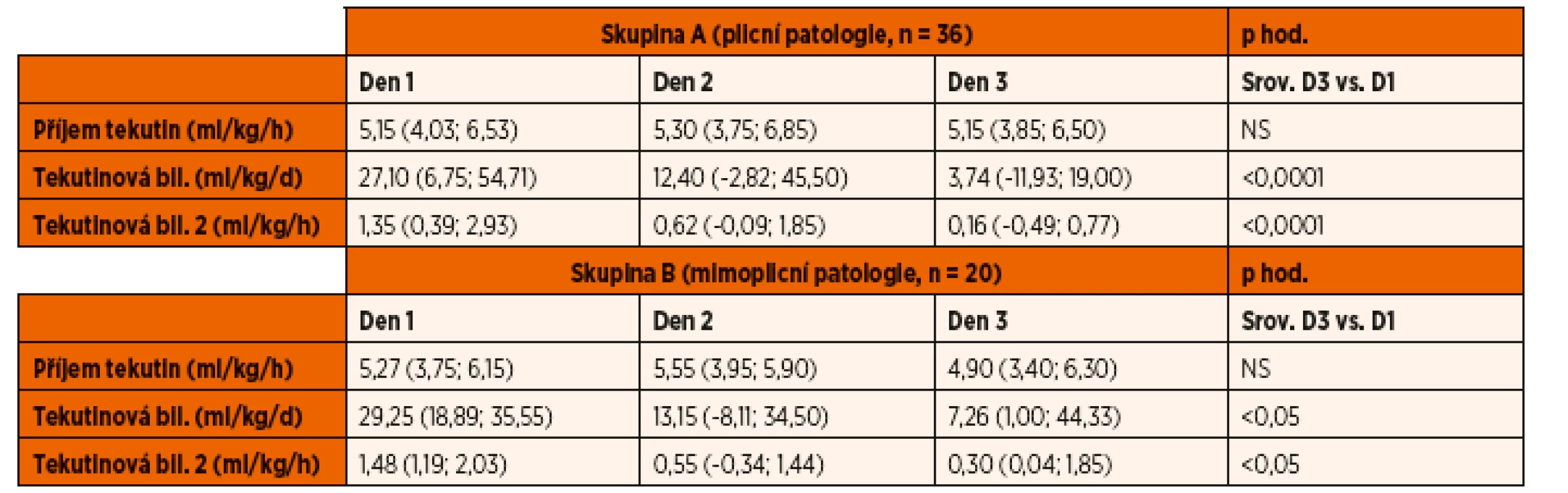
Mezi skupinami nebyly nalezeny významné rozdíly. Hodnoty jsou vyjádřeny jako medián a interkvartilové rozpětí. Ventilační parametry a indexy
Ventilační parametry, indexy, hodnoty arteriálních krevních plynů a laktátu jsou zaznamenány v tabulce 5. V průběhu studie došlo k signifikantnímu poklesu vrcholového inspiračního tlaku u skupiny A, stejně jako k signifikantním změnám v hypoxemickém a oxygenačním indexu té samé skupiny. Žádné jiné změny ve skupině A nebyly pozorovány. Ve skupině B nebyly v průběhu studie pozorovány žádné významné změny. Pacienti ze skupiny A ve srovnání s pacienty ze skupiny B vykazovali signifikantně vyšší hodnoty vrcholového tlaku, středního tlaku a PEEP v dýchacích cestách a významné rozdíly v hypoxemickém a oxygenačním indexu.
Tab. 5. Ventilační parametry. 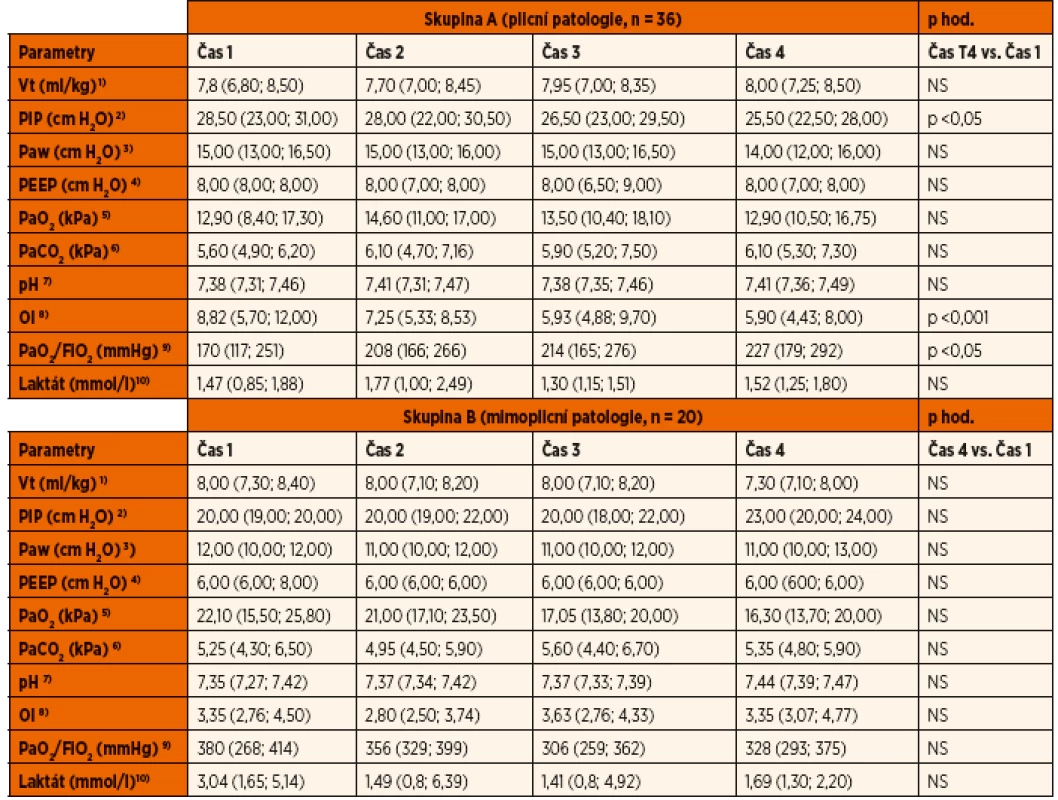
Vt = dechový objem; PIP = vrcholový inspirační tlak; Paw = střední tlak v dýchacích cestách; PEEP = pozitivní tlak na konci výdechu; PaO2 = parciální tlak kyslíku; PaCO2 = parciální tlak oxidu uhličitého, OI = oxygenační index, PaO2/FiO2 = hypoxemický index/ NS – nesignifikantní Hodnoty jsou vyjádřeny jako medián a interkvartilové rozpětí. 1) srovnání skupin A a B v časech 1,4 – NS 2) srovnání mezi A a B v čase 1 (p <0,05) a čase 4 (p <0,05) 3) srovnání mezi A a B v čase 1 (p <0,001) a čase 4 (p <0,05) 4) srovnání mezi A a B v čase 1 (p <0,05) a čase 4 (p <0,001) 5) srovnání mezi A a B v čase 1 (p <0,05) a čase 4 - NS 6) srovnání mezi A a B v čase 1,4 – NS 7) srovnání mezi A a B v čase 1,4 – NS 8) srovnání mezi A a B v čase 1 (p <0,001) a čase 4 (p <0,001) 9) srovnání mezi A a B v čase 1 (p <0,001) a čase 4 (p <0,05) 10) srovnání mezi A a B v čase 1 (p <0,05) a čase 4 – NS Vazoaktivní a inotropní terapie
Frekvence užití medikamentózní oběhové podpory v obou skupinách ukazují tabulky 2 a 3.
Ze skupiny A 64 % (23/36) pacientů vyžadovalo podání inotropní podpory dobutaminem. V době prvního hemodynamického měření byla tato podpora zahájena u 31 % (11/36) pacientů ze skupiny A, v průběhu dalších měření byla terapie postupně indikována u dalších pacientů na základě monitoringu. V této skupině vyžadovalo celkem 47 % (17/36) vazopresorickou podporu noradrenalinem, přičemž celkem 28 % (10/36) vyžadovalo vazopresor v době po napojení na UPV na základě prvního hemodynamického měření. Současnou terapii vazopresorem a inotropikem vyžadovalo celkem 27 % (10/36) pacientů ze skupiny A. Podávání adrenalinu, dopaminu a inhibitoru fosfodiesterázy III bylo indikováno jen u malého procenta pacientů.
Ze skupiny B bylo 40 % (8/20) pacientů v průběhu studie indikováno k podání dobutaminu. V době prvního měření byl dobutamin indikován u 15 % (3/13). Vazopresorická podpora noradrenalinem byla u této skupiny indikována celkem v 55 % (11/20) případů, přičemž ve všech případech byl vazopresor nasazen v době prvního hemodynamického měření. Současné podávání inotropika a vazopresoru vyžadovalo celkem 15 % (3/20) pacientů ze skupiny B. Podání adrenalinu v kombinaci s inhibitorem fosfodiesterázy III bylo indikováno u 1 pacienta se septickou kardiomyopatií. V dalším průběhu tento pacient vyžadoval podávání levosimendanu. Podání inhibitoru fosfodiesterázy III bylo indikováno dále u jednoho pacienta skupiny s nízkým srdečním výdejem a vyšší cévní rezistencí.
Mezi skupinami nebyly nalezeny významné rozdíly v potřebě medikamentózní oběhové podpory. I když nebyl zjištěn statisticky významný rozdíl, u pacientů s plicními patologiemi byl pozorován trend k vyšší potřebě kombinované inotropní a vazopresorické podpory.
DISKUSE
Naše studie přinesla několik základních nových poznatků: (1) v průběhu prvních 48 hodin UPV nebyly nalezeny statisticky významné rozdíly v hemodynamických profilech mezi pacienty ventilovanými pro plicní a mimoplicní patologii; (2) ve skupině dětí s plicní patologií byl pozorován trend k vyšší potřebě kombinované inotropní a vazopresorické podpory ve srovnání se skupinou pacientů ventilovaných pro mimoplicní patologii, tito pacienti měli tendenci k častější potřebě vazopresorické podpory, i když tento rozdíl nebyl statisticky významný; (3) obě skupiny pacientů vyžadovaly podobné množství tekutin k dosažení hemodynamických cílů, u pacientů ventilovaných pro plicní patologii byla aplikována agresivnější deeskalační terapie pozitivní tekutinové bilance; (4) pacienti ventilovaní pro plicní patologii vyžadovali agresivnější nastavení ventilace k dosažení cílových dechových objemů; (5) protektivní strategie umělé plicní ventilace neměla negativní dopad na hemodynamický profil pacientů ventilovaných pro plicní patologii ve srovnání s pacienty ventilovanými pro mimoplicní patologii, i když skupina pacientů ventilovaných pro plicní patologii měla tendenci vyžadovat častěji inotropní a kombinovanou oběhovou podporu.
Do naší prospektivní observační studie byli zařazeni kriticky nemocní pacienti hospitalizovaní na všeobecné dětské JIRP v průběhu 12 měsíců. Tato skupina pacientů určitým způsobem z hlediska spektra diagnóz a věkového profilu reprezentuje populaci pediatrických pacientů vyžadujících všeobecnou multioborovou intenzivní péči. Praktický dopad naší práce vidíme v tom, že studie nezahrnovala selektivně vybrané pacienty zatížené určitou konkrétní diagnózou. Neinvazivní monitoring prováděný v pravidelných časových intervalech nám umožnil vyhodnotit hemodynamické změny v úvodních 48 hodinách od zahájení UPV. Přesnost měření námi použité monitorovací metody (USCOM) byla dříve testována jako dostatečná k diagnostice hemodynamických změn v klinických i experimentálních studiích [15, 16]. Z literárních údajů je zřejmé, že analýza hemodynamického profilu a protokolizovaná léčebná strategie u dětí a dospělých má pozitivní dopady na přežití kriticky nemocných pacientů [17, 18].
Hemodynamický monitoring umožňuje identifikovat patofyziologické mechanismy změn oběhu. Jedním z prvních cílů hemodynamického managementu u kriticky nemocného pacienta je dosažení adekvátní perfuze periferních tkání a zajištění jejich dostatečné oxygenace. Zvyšování srdečního výdeje a dodávky kyslíku periferii do supramaximálních hodnot nepřináší pacientovi žádný další benefit a může být v jistém aspektu i škodlivé [19]. V případě našich pacientů ventilovaných pro plicní patologii byla charakteristická vyšší potřeba inotropní a kombinované inotropně/vazopresorické podpory a tato potřeba narůstala v úvodních 48 hodinách umělé plicní ventilace. Jak bylo zmíněno výše, pacienti z naší kohorty nebyli postiženi pouze bakteriálními infekcemi, i když v obou skupinách dominovaly děti léčené pro infekční etiologii. Studie z nedávné doby používající metodu USCOM u pacientů se septickým šokem ukázaly, že pediatričtí pacienti vykazovali dva základní charakteristické typy postižení oběhu: vysoký srdeční výdej s nízkou vaskulární rezistencí a/nebo nízký srdeční výdej s vysokou vaskulární rezistencí: tzv. teplý a studený typ šoku. Současně bylo prokázáno, že se charakteristika hemodynamické kompromitace u této skupiny pacientů v čase mění a jeden typ postižení může přecházet v druhý. Typ kompromitace byl závislý na délce trvání patologického stavu před přijetím na pracoviště intenzivní péče [5, 20]. V naší studii byla jen malá část pacientů postižena rozvinutým septickým šokem a tak lze vysvětlit rozdílnou hemodynamickou kompromitaci ve srovnání s pacienty z výše citovaných studií.
UPV může prostřednictvím kardiopulmonálních interakcí zásadním způsobem negativně ovlivnit oběh pacienta. V případě pacientů s plicním postižením je nutné použití vyšších ventilačních tlaků, které pak mohou vést k akcentaci kardiopulmonálních interakcí [21]. Naše studie prokázala, že pacienti ze skupiny A (plicní patologie) vyžadovali použití vyšších inspiračních tlaků k dosažení cílových objemů ve srovnání s pacienty ze skupiny B. I když rozdíl mezi skupinami jednoznačně nedosáhl statistické významnosti, pacienti ze skupiny A měli tendenci k častější potřebě inotropní a kombinované inotropně/vazopresorické podpory ve srovnání s pacienty ventilovanými pro mimoplicní patologii.
Analýza krevních arteriálních plynů a ventilačních indexů dokumentuje zlepšení oxygenačních parametrů u pacientů s plicním postižením v průběhu úvodních 48 hodin UPV. Tyto změny jsou obrazem zlepšování plicního patologického procesu. Protektivní ventilační strategie užívající definované a limitované dechové objemy a tlaky v dýchacích cestách byla aplikována u obou studovaných skupin. Námi používané dechové objemy korespondují s dechovými objemy užívanými v léčbě pediatrických ARDS pacientů [22, 23]. Jen malá část pacientů ze skupiny A splnila kritéria těžkého ARDS. Vzhledem k důkazům z experimentálních a klinických studií o negativním dopadu vyšších dechových objemů na možný vznik VILI postižení (s ventilací asociované plicní postižení) jsme aplikovali strategii protektivní UPV i u pacientů s mimoplicní patologií [24, 25]. V průběhu studie nebyla rutinně u všech pacientů monitorována saturace hemoglobinu v centrální žilní krvi jako jeden z možných doplňkových ukazatelů tkáňové oxémie. Hladiny laktátu, které jsou dalším možným ukazatelem zásobení tkání kyslíkem, byly monitorovány u obou sledovaných skupin v pravidelných intervalech. Ve skupině B byla signifikantně vyšší vstupní průměrná hladina laktátu, která v průběhu léčby patologického stavu s časem klesala.
Množství podávaných tekutin se prakticky nelišila u obou sledovaných skupin. Vzhledem k dokumentovanému negativnímu efektu pozitivní tekutinové bilance u dětí i dospělých byla strategie tekutinové deeskalace aplikována u pacientů z obou studovaných skupin a vyrovnaná až negativní tekutinová bilance byla dosažena třetí den hospitalizace. Od 4. dne hospitalizace byli pacienti již v negativní tekutinové bilanci (nepublikovaná data). Dva pacienti ze skupiny A vyžadovali napojení na mimotělní očišťovací metodu z důvodu akutního renálního postižení. Tekutinová resuscitace a doplnění intravaskulárního volumu je obecně prvním léčebným krokem při selhání oběhu u pacientů s těžkou sepsí a septickým šokem [14]. Cílem je zvýšení preloadu a srdečního výdeje u pacientů odpovídajících na tekutiny. K testování pacientů s možnou pozitivní oběhovou odpovědí na podání tekutin je užíváno několik druhů dynamických testů [26]. Pokud podání tekutin nevede ke zvýšení srdečního výdeje, pak další zatěžování pacienta tekutinou nemá pozitivní přínos. Literární údaje dokumentují negativní dopad pozitivní tekutinové bilance na morbiditu a mortalitu dospělých pacientů s ARDS [27]. Podobně data z pediatrických studií dokládají zvýšenou morbiditu a poruchu oxygenace asociovanou s pozitivní tekutinovou bilancí [28].
V klinické praxi je běžně i v dnešní době indikována vazopresorická a inotropní podpora na základě klinického vyšetření, i když jsou známy limitace takto vedené léčebné strategie. USCOM monitorace nabízí možnost opakovaného neinvazivního vyhodnocení hemodynamických parametrů, umožňujícího racionalizaci léčebné strategie konkrétního pacienta. Jako neinvazivní metodu, jejíž praktické ovládnutí není náročné, ji lze doporučit k použití v denní klinické praxi [29, 30, 31].
LIMITACE A VÝHODY STUDIE
Není nám známo, že by byla prezentována prospektivní observační studie používající USCOM monitorace k hodnocení a srovnání vývoje hemodynamiky u pacientů ventilovaných pro plicní a mimoplicní patologii. Vzhledem k tomu, že studie byla provedena v jednom centru a zařazování pacientů do studie probíhalo v průběhu 12 měsíců, nepovažujeme počet pacientů zařazených do studie za příliš vysoký. Přesto považujeme naše závěry za klinicky dobře hodnotitelné a použitelné s dobrou výpovědní hodnotou. Skupiny pacientů z pohledu diagnóz byly logicky heterogenní a prakticky svým složením reprezentovaly běžnou populaci pacientů vyžadujících péči všeobecné dětské JIRP. Skupina pacientů ventilovaných pro plicní patologii zahrnovala větší počet dětí, neboť v populaci pacientů léčených na našem pracovišti převažují děti s patologiemi respiračního traktu. U zahrnutých pacientů nebyla vyhodnocována délka trvání patologického stavu před přijetím na JIRP, což by pravděpodobně mohlo také ovlivnit hemodynamický profil v jednotlivých případech. Důležitou výhodou a předností studie byl monitoring provedený jedním operátorem, což významně minimalizuje variabilitu jednotlivých měření.
Limitací studie je neaplikování bolusové dodávky tekutin u pacientů s hypotenzí a současnou absencí známek dehydratace či septického šoku, které by bylo podpořeno zhodnocením některého z dynamických oběhových parametrů.
ZÁVĚR
Na základě získaných dat lze prohlásit, že protektivní vedení UPV nebylo spojeno se signifikantním rozdílem hemodynamických profilů u pacientů ventilovaných pro plicní a mimoplicní patologii. Skupina pacientů ventilovaných pro plicní patologii vykazovala trend k častější potřebě inotropní a kombinované inotropně/vazopresorické podpory, u pacientů s UPV pro mimoplicní patologii jsme zaznamenali častější potřebu vazopresorické podpory. Přesto, že výše uvedené nálezy nedosáhly statistické významnosti, byly zde pozorovány jasné trendy. USCOM reprezentuje neinvazivní metodu vhodnou k monitoringu hemodynamiky a racionalizaci tekutinové a vazoaktivní terapie u kriticky nemocných dětí.
Poděkování
Práce byla podpořena projektem P36 (Program rozvoje vědních oborů Univerzity Karlovy v Praze).
Došlo: 2. 6. 2016
Přijato: 22. 7. 2016
MUDr. Jiří Fremuth, Ph.D.
Univerzita Karlova v Praze
Lékařská fakulta a FN v Plzni
Dětská klinika
Alej Svobody 80
304 60 Plzeň
e-mail: fremuthj@gmail.com
Zdroje
1. Brierley J, Carcillo JA, Choong K, et al. Clinical practice parameters for hemodynamic support of pediatric and neonatal septic shock: 2007 update from the American College of Critical Care Medicine. Crit Care Med 2009 Feb; 37 (2): 666–688.
2. Gan H, Cannesson M, Chandler JR, et al. Predicting fluid responsiveness in children: a systematic review. Anesth Analg 2013; 117 (6): 1380–1392.
3. Linton RA, Linton NW, Kelly F. Is clinical assessment of the circulation reliable in postoperative cardiac surgical patients? J Cardiothorac Vasc Anesth 2002; 16 (1): 4–7.
4. Tibby SM, Hatherill M, Marsh MJ, et al. Clinicians‘ abilities to estimate cardiac index in ventilated children and infants. Arch Dis Child 1997; 77 (6): 516–518.
5. Deep A, Goonasekera CD, Wang Y, et al. Evolution of haemodynamics and outcome of fluid-refractory septic shock in children. Intensive Care Med 2013; 39 (9): 1602–1609.
6. Weber T, Wagner T, Neumann K, et al. Low predictability of three different noninvasive methods to determine fluid responsiveness in critically ill children. Pediatr Crit Care Med 2015; 16 (3): e89–94.
7. http://www.msac.gov.au/internet/msac/publishing.nsf/Content/app1117-1.
8. Cherpanath TG, Lagrand WK, Schultz MJ, et al. Cardiopulmonary interactions during mechanical ventilation in critically ill patients. Neth Heart J 2013; 21 (4): 166–172.
9. Lansdorp B, Hofhuizen C, van Lavieren M, et al. Mechanical ventilation-induced intrathoracic pressure distribution and heart-lung interactions. Crit Care Med 2014; 42 (9): 1983–1990.
10. Fan E, Needham DM, Stewart TE. Ventilatory management of acute lung injury and acute respiratory distress syndrome. JAMA 2005; 294 (22): 2889–2896.
11. Panico FF, Troster EJ, Oliveira CS, et al. Risk factors for mortality and outcomes in pediatric acute lung injury/acute respiratory distress syndrome. Pediatr Crit Care Med. 2015; 16 (7): e194–200.
12. Straney L, Clements A, Parslow RC, et al. ANZICS Paediatric Study Group and the Paediatric Intensive Care Audit Network. Paediatric index of mortality 3: an updated model for predicting mortality in pediatric intensive care. Pediatr Crit Care Med 2013; 14 (7): 673–681.
13. Report of the second task force on blood pressure control in children – 1987. Task Force on Blood Pressure Control in Children. National Heart, Lung, and Blood Institute, Bethesda, MD. Pediatrics 1987; 79 : 1–25.
14. Dellinger RP, Levy MM, Rhodes A, et al. Surviving sepsis campaign: international guidelines for management of severe sepsis and septic shock: 2012. Crit Care Med 2013; 41 (2): 580–637.
15. Gregory SD, Cooney H, Diab S, et al. In vitro evaluation of an ultrasonic cardiac output monitoring (USCOM) device. J Clin Monit Comput 2016; 30 (1): 69–75.
16. O‘Loughlin E, Ward M, Crossley A, et al. Evaluation of the utility of the Vigileo FloTrac™, LiDCO™, USCOM and CardioQ™ to detect hypovolaemia in conscious volunteers: a proof of concept study. Anaesthesia 2015; 70 (2): 142–149.
17. Rivers E, Nguyen B, Havstad S, et al. Early Goal-Directed Therapy Collaborative Group. Early goal-directed therapy in the treatment of severe sepsis and septic shock. N Engl J Med 2001; 345 (19): 1368–1377.
18. de Olivera CF, de Oliveira DS, Gottschald AF, et al. ACCM/PALS haemodynamic support guidelines for paediatric septic shock: an outcomes comparison with and without monitoring central venous oxygen saturation. Intensive Care Med 2008; 34 (6): 1065–1075.
19. Caile V, Squara P. Oxygen uptake-to-delivery relationship: a way to assess adequate flow. Crit Care 2006; 10 (Suppl 3): S4.
20. Brierley J, Peters MJ. Distinct hemodynamic patterns of septic shock at presentation to pediatric intensive care. Pediatrics 2008; 122 (4): 752–759.
21. Bronicki RA, Anas NG. Cardiopulmonary interaction. Pediatr Crit Care Med 2009; 10 (3): 313–322.
22. Erickson S, Schibler A, et al. Acute lung injury in pediatric intensive care in Australia and New Zeland: a prospective, multicenter, observational study. Pediatr Crit Care Med 2007; 8 (4): 317–323.
23. Santschi M, Jouvet P, Leclerc F, et al. Acute lung injury in children: therapeutic practice and feasibility of internatonal clinical trials. Pediatr Crit Care Med 2010; 11 (6): 681–689.
24. Fremuth J, Kobr J, Pizingerova K, et al. Healthy lung tissue response to mechanical ventilation in an experimental porcine model. In Vivo 2014; 28 (5): 803–809.
25. Sutherasan Y, Vargas M, Pelosi P. Protective mechanical ventilation in the non-injured lung: review and meta-analysis. Crit Care 2014; 18 (2): 211.
26. Guerin L, Monnet X, Teboul JL. Monitoring volume and fluid responsiveness: from static to dynamic indicators. Best Pract Res Clin Anaesthesiol 2013; 27 (2): 177–185.
27. Rosenberg AL, Dechert RE, Park PK. Review of a large clinical series: association of cumulative fluid balance on outcome in acute lung injury: a retrospective review of the ARDSnet tidal volume study cohort. J Intensive Care Med 2009; 24 (1): 35–46.
28. Sinitsky L, Walls D, Nadel S, et al. Fluid overload at 48 hours is associated with respiratory morbidity but not mortality in a general PICU: retrospective cohort study. Pediatr Crit Care Med 2015; 16 (3): 205–209.
29. Turnham H, Brierley J. New methods of monitoring shock in children. Curr Treat Options Pediatrics 2015; 1 : 15-24.
30. Dhanani S, Barrowman NJ, Ward RE, et al. Intra - and inter-observer reliability using a noninvasive ultrasound cardiac output monitor in healthy anesthetized children. Paediatr Anaesth 2011; 21 (8): 858–864.
31. Smith BE, Madigan VM. Non-invasive method for rapid bedside estimation of inotropy: theory and preliminary clinical validation. Br J Anaesth 2013; 111 (4): 580–588.
Štítky
Neonatologie Pediatrie Praktické lékařství pro děti a dorost
Článek vyšel v časopiseČesko-slovenská pediatrie
Nejčtenější tento týden
2016 Číslo 5-6- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Syndrom Noonanové: etiologie, diagnostika a terapie
-
Všechny články tohoto čísla
- Změny vybraných systémových cytokinů při závažném plicním postižení u dětí
-
Neinvazivní hemodynamický monitoring u kriticky nemocných dětí – USCOM
Prospektivní observační studie - Od naražení palce nohy k diagnostice cystické fibrózy
- Vrodená malformácia vena Galeni u novorodenca
- Spondylodiscitida v dětském věku: Kazuistika a přehled literatury
- Porucha kostného metabolizmu pri mentálnej anorexii
- Nová doporučení pro kardiopulmonální resuscitaci u dětí z roku 2015
- Kardiopulmonální resuscitace novorozenců – pokyny a doporučení 2015
- Abstrakta
- Abstrakta
- Profesor MUDr. Miloš Velemínský, CSc., dr. h. c., osmdesátníkem
- Za primářem MUDr. Miroslavem Malým
- Vzpomínka na MUDr. Olgu Böhmovou
- The Psychological Context of Labour Pain
- Sociální a preventivní pediatrie v současném pojetí
- Česko-slovenská pediatrie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Vrodená malformácia vena Galeni u novorodenca
- Kardiopulmonální resuscitace novorozenců – pokyny a doporučení 2015
- Spondylodiscitida v dětském věku: Kazuistika a přehled literatury
- Nová doporučení pro kardiopulmonální resuscitaci u dětí z roku 2015
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



