-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Klinické příznaky a laboratorní data u 75 dětí s neonatální manifestací mitochondriálního onemocnění: návrh diagnostických algoritmů
Clinical Symptoms and Laboratory Data in 75 Children with Neonatal Manifestation of Mitochondrial Disease: Proposed Diagnostic Algorithms
Mitochondrial disorders may manifest at any age. High energetic demands associated with postnatal adaptation to extrauterinne life result in frequent onset of mitochondrial disorders in nenates. The aim of this study is to analyse clinical and laboratory characteristics of mitochondrial disorders with neonatal onset. Further, we would like to propose algorithms for diagnostics of neonatal mitochondrial disorders.
Study group:
Mitochondrial disorder manifested in 75 neonates, who comprise 21% of mitochondrial desease patients diagnosed on biochemical and/or molecular genetic level at our department.Results:
Within our study group, 36% of children were delivered prematurely, intrauterinal growth retardation was present in 40% of them and early postnatal hypotonia was observed in 95% of patients. Ventilation support was necessary in 66% of the newborns, feeding refusal and lethargy predominated in the rest of them. Hypertrophic cardiomyopathy was observed in 50% and neonatal seizures in 24% of newborns. Leigh syndrome was diagnosed in 11% of neonates. The prognosis was not favourable, one third of children died in the first three months of life. Biochemical analyses revealed lactic acidosis (93%), elevated excretion of the Krebs cycle intermediates (75%), and increased creatine kinase activity (28%). Hyperammonemia was present in 22% of the children. All newborns with Tmem70 protein deficiency exhibited higher excretion of 3-methylglutaconic acid in urine.Conclusion:
Neonatal manifestation of mitochondrial disorders is not rare. Only the precise description of clinical signs and laboratory markers of the disease and knowledge of the most common mitochondrial defects with neonatal onset enables to diagnose the specific syndrome in the case of the child death. The diagnostic algorithm for a critically ill newborn with suspicion of mitochondrial energetic metabolism defect was prepared. This algorithm also enables to indicate direct enzymatic or mutation analysis, either with no need of muscle biopsy in some cases.Key words:
mitochondrial disorders, neonatal onset, lactic acidosis, hypertrophic cardiomyopathy, diagnosis algorithm
Autoři: T. Honzík; M. Tesařová; H. Hansíková; L. Wenchich; K. Veselá; P. Ješina; M. Magner; J. Zeman
Působiště autorů: Klinika dětského a dorostového lékařství UK 1. LF a VFN, Praha přednosta prof. MUDr. J. Zeman, DrSc.
Vyšlo v časopise: Čes-slov Pediat 2010; 65 (7-8): 422-431.
Kategorie: Původní práce
Souhrn
Mitochondriální poruchy se mohou projevit v kterémkoliv věku, ale vysoké energetické nároky na poporodní adaptaci novorozence predisponují k časné neonatální manifestaci. Cílem práce je snaha analyzovat klinické a laboratorní projevy mitochondriálních onemocnění v novorozeneckém věku. Navržené algoritmy pomohou usnadnit jejich diagnostiku.
Soubor:
Mitochondriální porucha se klinicky manifestovala u 75 dětí v novorozeneckém věku, což představuje 21 % pacientů s mitochondriálním onemocněním, které jsme diagnostikovali na biochemické a/nebo molekulárně genetické úrovni na našem pracovišti.Výsledky:
Předčasně se narodilo 36 % dětí, intrauterinní růstová retardace byla přítomna u 40 % a časná postnatální hypotonie u 95 % dětí. Dechovou podporu potřebovalo 66 % novorozenců, u ostatních převládalo odmítání pití a letargie. Hypertrofická kardiomyopatie byla zjištěna u 50 %, novorozenecké křeče u 24 % a Leighův syndrom u 11 % novorozenců. Prognóza nebyla příznivá, třetina dětí zemřela v prvních měsících života. Laktátová acidóza byla dokumentována u 93 %, zvýšená hladina kreatinkinázy u 28 % a zvýšené vylučování metabolitů Krebsova cyklu u 75 % novorozenců. Hyperamonémie byla potvrzena u 22 % dětí. Všichni novorozenci s poruchou proteinu Tmem70 měli v moči zvýšené vylučování kyseliny 3-methylglutakonové.Závěr:
Mitochondriální onemocnění se často manifestují v novorozeneckém věku. Byl připraven diagnostický algoritmus pro kriticky nemocného novorozence s podezřením na mitochondriální onemocnění umožňující indikovat přímou enzymatickou nebo mutační analýzu, v některých případech dokonce bez nutnosti provedení svalové biopsie.Klíčová slova:
mitochondriální onemocnění, neonatální manifestace, laktátová acidóza, hypertrofická kardiomyopatie, diagnostický algoritmusÚvod
Se zlepšující se úrovní neonatální medicíny doprovázené poklesem novorozenecké mortality stoupá u nemocných novorozenců podíl geneticky podmíněných onemocnění včetně mitochondriálních poruch energetického metabolismu. Adekvátní biogeneze mitochondriálních funkcí ve fetálním období a rychlá přeměna fetální glykolýzy jako hlavního zdroje energie plodu na oxidativní fosforylaci u novorozence je zásadní pro dobrou poporodní adaptaci [1, 2]. Více než 90 % energetických potřeb dítěte je zajišťováno systémem oxidativní fosforylace (OXPHOS), který funkčně propojuje komplexy dýchacího řetězce (komplexy I–IV) a F1FO-ATP-syntázu (ATP-syntáza, ATPáza, komplex V). OXPHOS je jako jediná výjimka v biologii člověka řízen geny v jaderné DNA (nDNA) a mitochondriální DNA (mtDNA).
Mitochondriální onemocnění představují klinicky, biochemicky i geneticky heterogenní skupinu onemocnění s mendelovským i maternálním typem dědičnosti. Charakterizováno již bylo >110 různých mitochondriálních poruch (OMIM; www.ncbi.nlm.nih.gov/omim). Jejich výskyt v populaci je cca 1 : 4000 [3–5], dosud bylo popsáno >250 různých mutací, delecí a duplikací v mtDNA [6] a mutací ve >80 genech v nDNA [7].
První klinické příznaky mitochondriálních onemocnění se mohou projevit v kterémkoliv věku, nejčastěji jsou postiženy tkáně s vysokými energetickými nároky, jako je mozek, sval, srdce a játra [8]. Mitochondriální etiologii onemocnění lze prokázat u 5 % všech případů hluchoty [9], 2–3 % pacientů s diabetes mellitus typ II, 2–3 % pacientů se získanou slepotou nebo u 1 % pacientů s klinickou příhodou, kterou lze označit termínem „mozková mrtvice“.
Na našem pracovišti jsme v průběhu posledních 18 let potvrdili mitochondriální etiologii onemocnění na biochemické a/nebo molekulární úrovni u více než 350 pacientů. U 75 z nich se onemocnění manifestovalo v novorozeneckém věku. Cílem naší práce je snaha charakterizovat klinické a laboratorní projevy mitochondriálních onemocnění v novorozeneckém věku a navrhnout diagnostické algoritmy umožňující jejich diagnostiku.
Materiál a metody
Soubor tvoří 75 dětí s mitochondriálním onemocněním potvrzeným na biochemické a/nebo molekulárně genetické úrovni, u kterých se první klinické příznaky onemocnění manifestovaly již v novorozeneckém věku. Retrospektivně jsme analyzovali frekvenci klinických příznaků onemocnění a výsledky selektivního screeningu dědičných poruch metabolismu i základních biochemických a cílených enzymatických a molekulárních vyšetření.
Profil organických kyselin v moči byl analyzován pomocí plynové chromatografie ve spojení s hmotnostní spektrometrií. Svalové mitochondrie získané při biopsii nebo autopsii byly izolovány podle Makinena a Lee bez použití proteázy [10] a uchovány v tekutém dusíku. Aktivity enzymů dýchacího řetězce, NADH-koenzym Q10-oxidoreduktázy (NQR, komplex I), sukcinyl-koenzym Q10-oxidoreduktázy (SQR, komplex II), koenzym Q10-cytochrom c oxidoreduktázy (QCCR, komplex III), cytochrome c oxidázy (COX, komplex IV), dihydrolipoamiddehydrogenázy a citrát syntázy (CS) byly měřeny spektrofotometricky [11, 12]. Aktivita a množství pyruvátdehydrogenázy (PDH) byla měřena radiometricky [13] a Western blotem. Genová DNA byla izolována ze svalu a/nebo krve metodou fenolové extrakce. Přítomnost prevalentních mutací byla analyzována pomocí PCR-RFLP, mitochondriální DNA a vybrané nukleární geny byly studovány metodou přímé sekvenace na analyzátoru ABI 3100 Avant (Applied Biosystems).
Výsledky
První klinické příznaky onemocnění se manifestovaly již v novorozeneckém věku u 75 dětí. V souboru byl vysoký podíl nedonošenosti (36 % dětí) i intrauterinní růstové retardace (40 %). Poporodní adaptace byla nejčastěji komplikována těžkou hypotonií (u 95 % novorozenců), která si u 66 % dětí vyžádala zahájení některé z forem dechové podpory nebo byla doprovázena odmítáním pití a letargií. U pěti dětí byl klinicky diagnostikován ”SMA-like” fenotyp (příznaky podobné spinální svalové atrofii), ale následující molekulární diagnostika SMN1 genu byla negativní. Pouze u 4 novorozenců byla pozorována hypertonie. Hypertrofická kardiomyopatie byla nalezena u 50 % novorozenců, novorozenecké křeče se vyskytly u 24 % dětí. Vyšetření MRI CNS ukázalo u 11 % dětí časný rozvoj Leighova syndromu (oboustranné nekrotické změny v bazálních gangliích a mozkovém kmeni). Prognóza pacientů nebyla příznivá, třetina pacientů zemřela již v prvních třech měsících života. Frekvence jednotlivých příznaků v závislosti na konkrétní mitochondriální diagnóze je uvedena v tabulce 1.
Tab. 1. Klinické příznaky u 75 dětí s neonatální manifestací mitochondriálního onemocnění. 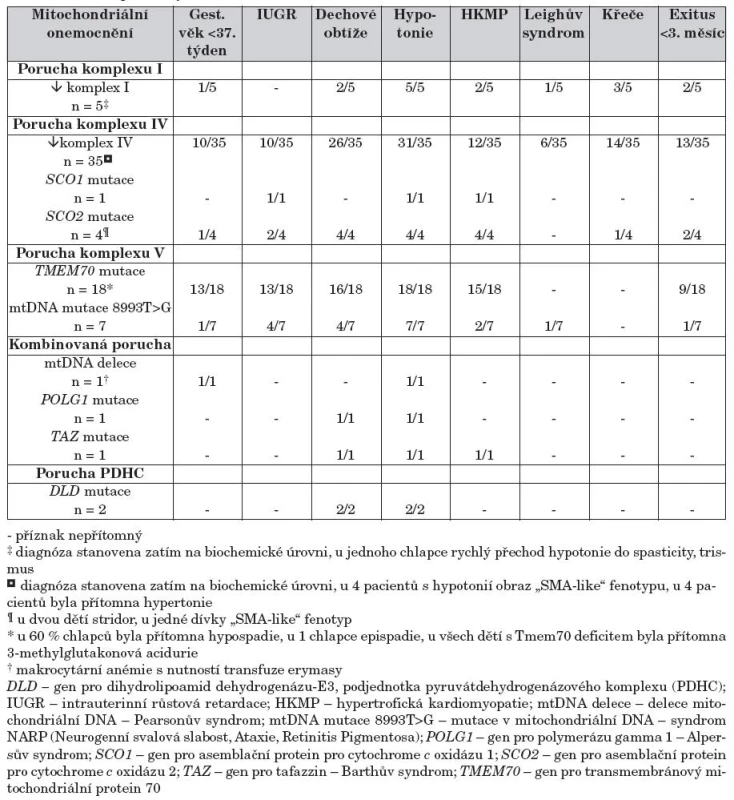
Významná laktátová acidóza byla přítomna u 93 % novorozenců již bezprostředně po narození (tab. 2). Hyperamonémie byla dokumentována u 22 % novorozenců, většinou u dětí s deficitem proteinu Tmem70, u několika dětí s izolovaným deficitem komplexu IV dýchacího řetězce a u jednoho dítěte se syndromem NARP (neurogenní svalová slabost, ataxie, retinitis pigmentosa). Zvýšená hladina kreatinkinázy byla nalezena u 28 % novorozenců. Selektivní metabolický screening ukázal u 62 % dětí zvýšenou koncentraci alaninu v krvi a u 75 % zvýšené vylučování intermediálních metabolitů Krebsova cyklu (malát, fumarát, citrát, sukcinát, akonitát, 2-oxoglutarát) (tab. 2). Všichni novorozenci s poruchou proteinu Tmem70 měli zvýšené vylučování kyseliny 3-methylglutakonové.
Tab. 2. Laboratorní data u 75 dětí s neonatální manifestací mitochondriálního onemocnění. 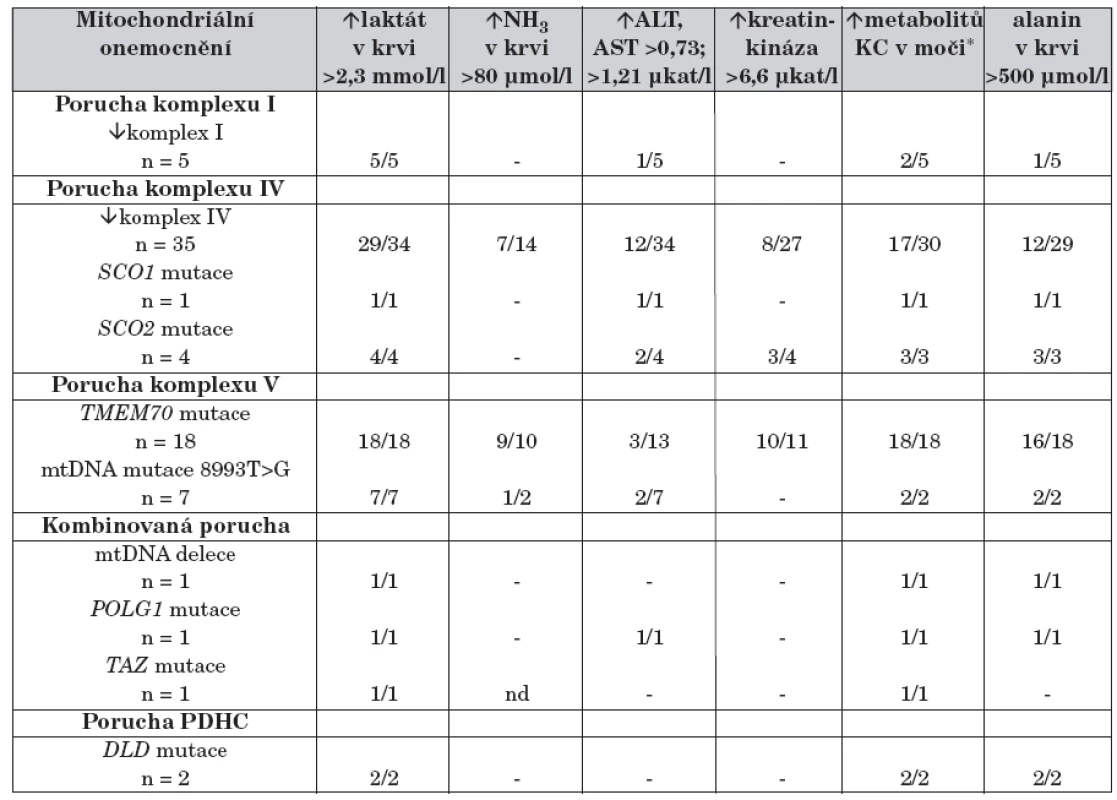
- hodnoty v referenčním rozmezí; nd: nestanoveno * zvýšené vylučování intermediálních metabolitů Krebsova cyklu; popis zkratek v tabulce 1 Mitochondriální etiologie onemocnění byla potvrzena u všech 75 dětí. U 5 dětí byla nalezena porucha komplexu I dýchacího řetězce, u 40 dětí porucha komplexu IV dýchacího řetězce, u 26 dětí porucha ATP-syntázy, u dvou dětí porucha pyruvátdehydrogenázy (PDH) a u 2 dětí kombinovaný deficit více komplexů. Mutační analýzy u dětí s deficitem ATP-syntázy ukázaly u 18 dětí přítomnost mutací v genu TMEM70, u 7 dětí mtDNA mutaci 8993T>G svědčící pro syndrom NARP a u jednoho dítěte byl potvrzen Barthův syndrom. Ve skupině dětí s poruchou komplexu IV jsme u 5 pacientů nalezli poruchu na úrovni proteinu Sco2 (4x) nebo Sco1 (1x), které se podílejí se na biogenezi komplexu IV. Ve skupině dětí s kombinovaným deficitem byl u dvou dětí prokázán Pearsonův syndrom a Alpersův syndrom. Mutace v genu DLD pro E3 podjednotku PDH komplexu byla nalezena u dvou dětí.
Na základě zkušeností s diagnostikou mitochondriálních onemocnění jsme připravili diagnostické algoritmy pro rozvahu nad kriticky nemocným novorozencem s podezřením na dědičnou poruchu metabolismu (schéma 1) a diagnostický algoritmus u novorozence s podezřením na mitochondriální onemocnění (schéma 2).
Schéma 1. Diferenciálně diagnostický algoritmus kriticky nemocného novorozence s podezřením na dědičnou poruchu metabolismu. 
Zkratky: ABR – acidobazická rovnováha; CK – kreatinkináza; DMP – dědičné metabolické poruchy; glc – glukóza; GSD – glykogenóza; JT – jaterní testy; KMP – kardiomyopatie; KO – krevní obraz;MAC – metabolická acidóza;MK – mastné kyseliny;metabolity KC – metabolity Krebsova cyklu; 3-MGKurie – 3-methylglutakonová acidurie; PHHI – perzistující hyperinzulinemické hypoglykémie kojenců; USG – ultrasongrafie; VLI – rozvětvené aminokyseliny Schéma 2. Diferenciálně diagnostický algoritmus kriticky nemocného novorozence s podezřením na poruchu mitochondriálního energetického metabolismu. 
Zkratky: L/P – laktát/pyruvát; NARP – neurogenní svalová slabost, ataxie, retinitis pigmentosa; PDH – pyruvátdehydrogenáza; SCO1 – asemblační faktor pro cytochrome c oxidázu 1; SCO2 – asemblační faktor pro cytochrome c oxidázu 2, TMEM70 – transmembránový protein 70; další použité zkratky viz schéma 1. Diskuse
Vysoké energetické nároky na poporodní adaptaci a následný růst a vývoj predisponují novorozence s těžkou poruchou mitochondriálního energetického metabolismu k časné manifestaci klinických projevů. Mezi první klinické příznaky poruch OXPHOS v novorozeneckém věku patří svalová hypotonie, dechové obtíže, letargie, odmítání pití, zvracení, nedostatečné váhové přírůstky, poruchy vědomí i novorozenecké křeče [14]. Nedostatečná produkce ATP ve fetálním období se může projevit nejen intrauterinní růstovou retardací, ale i vývojovými vadami, jak například dokumentovala studie autorů von Kleist-Retzow et al. [15].
Na rozdíl od starších dětí a dospělých pacientů, u kterých se mitochondriální onemocnění projevuje často tkáňově specifickými příznaky, mezi které patří progredující myopatie, ptóza, zevní oftalmoplegie či Leighův syndrom, jsou klinické příznaky onemocnění u novorozence nespecifické, což významně komplikuje diagnostiku. Navíc rychlý a ve vysokém procentu i fatální průběh onemocnění prakticky neumožňuje rozsáhlé diagnostické kroky. Postižené rodiny tak zůstávají bez možnosti genetického poradenství a prenatální diagnostiky.
Mitochondriální onemocnění se může manifestovat v kterémkoliv věku. V našem souboru více než 350 pacientů, u kterých jsme na biochemické a/nebo molekulárně genetické úrovni prokázali poruchu mitochondriálního energetického metabolismu, se mitochondriální onemocnění manifestovalo v novorozeneckém věku u 21 % pacientů. Je to v souladu s dalšími studiemi, které uvádějí „neonatal onset“ u 15–29 % pacientů s mitochondriálním onemocněním [16–18].
U většiny našich novorozenců s mitochondriálním onemocněním byla přítomna významná svalová hypotonie, poruchy dýchání, odmítání pití a letargie. Oběhová nestabilita a tachykardie vedly k indikaci echokardiografického vyšetření, které ukázalo již v prvních hodinách života hypertrofickou kardiomyopatii u 50 % dětí. Prematurita a/nebo intrauterinní růstová retardace byly přítomny u více než jedné třetiny našich pacientů. Křeče v novorozeneckém věku se vyskytly u 24 % dětí z našeho souboru. Z biochemických vyšetření byla laktátová acidóza nalezena u 93 % novorozenců, zvýšená hladina kreatinkinázy u 28 % a hyperamonémie u 22 %.
Diferenciální diagnostika mitochondriálních onemocnění v novorozeneckém věku
Mezi specifické poruchy mitochondriálního energetického metabolismu s neonatální manifestací patří:
A)
Porucha funkce pyruvátdehydrogenázového komplexu (PDHC) s autozomálně a gonozomálně recesivním typem dědičnosti, která patří mezi nejčastější příčiny primární laktátové acidózy u kojenců a malých dětí [19–21]. Klinicky se tato enzymatická porucha manifestuje nejčastěji již u novorozence [22] a laktátová acidóza se objevuje většinou v průběhu prvních hodin života často doprovázena významnou svalovou hypotonií, letargií, odmítáním kojení, dechovými obtížemi až po poruchu vědomí s kómatem.
B)
Poruchy komplexu I dýchacího řetězce, které v celkovém souhrnu všech mitochondriálních onemocnění patří mezi nejčastější [23–25]. Podle klinických příznaků a věku manifestace rozlišujeme tři skupiny poruch: fatální neonatální typ, myopatický typ s projevy intolerance fyzické zátěže a svalové slabosti a typ encefalomyopatický s příznaky mozečkové dysfunkce, oftalmoplegie, křečí a demence. Fatální neonatální typ se projeví multiorgánovým postižením již v průběhu prvních dnů života s příznaky svalové hypotonie, odmítání pití, apatie, nakupení apnoických pauz, hepatomegalie při srdečním selhání v rámci přítomné hypertrofické kardiomyopatie [17, 26–29].
C)
Poruchy komplexu dýchacího řetězce IV (COX; cytochrom c oxidáza) s mutacemi v genu SCO1, SCO2, COX10 a COX15. Mutace v genu SCO1 vedoucí k izolovanému deficitu komplexu IV byla nalezena u chlapce s rozvojem brzkého jaterního selhání, kritické laktátové acidózy a encefalopatie s exitem ve věku 2 měsíců [30] a u dívky s neonatální manifestací a projevy hypertrofické kardiomyopatie, encefalopatie, hypotonie a hepatopatie, popsané naší skupinou [31]. Mutace v genu SCO2 je častější příčinou fatální infantilní kardioencefalomyopatie než poruchy Sco1 proteinu [32–35]. Mutace v genu COX10 byla prokázána u dvou novorozenců s časným rozvojem anémie, hypotonie a laktátové acidózy. U jednoho chlapce se již v průběhu prvního měsíce života rozvinul na MRI CNS obraz Leighova syndromu, u druhého pacienta porucha sluchu a hypertrofická kardiomyopatie [36]. Antonicka et al. prokázali, že i mutace v genu COX15 [37] může být spolu s mutacemi v genu SCO2 příčinou rozvoje neonatální kardiomyopatie s izolovaným deficitem komplexu IV dýchacího řetězce.
D)
Porucha ATP-syntázy s maternálním typem dědičnosti je způsobena převážně mutacemi v genu MTATP6 pro podjednotku 6 ATP-syntázy [38] a vzácně v genu MTATP8 pro podjednotku 8 ATP-syntázy [39], které jsou kódované mitochondriální DNA. Podle hladiny heteroplazmie se onemocnění projeví buď jako syndrom NARP, nebo jako Leighův syndrom. I když se syndrom NARP převážně manifestuje v kojeneckém věku, časná neonatální prezentace (neprospívání, hypotonie, hypertrofická kardiomyopatie a encefalopatie) onemocnění byla již popsána [17, 40]. Nově byla neonatální manifestace prokázána i u dvou sourozenců s poruchou na úrovni asemblačního genu ATP12 [41].
E)
Onemocnění s kombinovanou poruchou OXPHOS. Izolované velké delece mitochondriální DNA jsou asociovány se syndromem Kearns-Sayre (KSS), chronickou progresivní oftalmoplegií (CPO) a Pearsonovým syndromem [42–44]. Pearsonův syndrom se projevuje refrakterní sideroblastickou anémií, laktátovou acidózou a insuficiencí zevně sekretorické funkce pankreatu s časnou manifestací v kojeneckém věku a ojediněle již u novorozenců [45].
Ze syndromů spojených s deplecí mtDNA byla neonatální manifestace popsána u pacientů s mutacemi v podjednotce A mitochondriální polymerázy γγPOLG1 (Alpersův syndrom) a deoxyguanosinekináza DGUOK [46]. Deficit mitochondriálního proteinu tafazzinu s gonozomálně recesivním typem dědičnosti a s mutacemi v genu TAZ při Barthově syndromu se typicky manifestuje již záhy po porodu rozvinutou dilatační nebo hypertrofickou kardiomyopatií, kritickou laktátovou acidózou a hyperamonémií [47–49].
Mezi vzácná onemocnění s neonatální manifestací (encefalomyopatie, hypertrofická kardiomyopatie, hepatocerebrální forma) dále patří defekt na úrovni mitochondriálního membránového transportního proteinu pro fosfáty (PiC; gen SLC25A3) [50], porucha syntézy koenzymu Q10 (ubiquinone) [51, 52] a mutace v genech kódovaných nukleární DNA, které se účastní translace mtDNA [53–57].
Mitochondriální onemocnění s neonatální manifestací u dětí diagnostikovaných v České republice
Naše nálezy jsou v souladu s výše uvedeným literárním přehledem. Neonatální manifestace byla prokázána u pacientů s diagnózou syndromů Alpers, Barth, NARP, Pearson, s deficitem proteinu Sco1, Sco2 a s deficitem pyruvátdehydrogenázy a komplexu I dýchacího řetězce. U 35 dětí byl zjištěn deficit komplexu IV dýchacího řetězce, zatím bez stanovení diagnózy na molekulárně genetické úrovni (vyloučen byl na základě zjištění deficit proteinu Sco1 a Sco2).
Deficit ATP-syntázy způsobený mutací v genu TMEM70, prokázaný u 18 dětí s neonatální encefalokardiomyopatií a popsaný poprvé naší skupinou [58, 59], rozšířil skupinu mitochondriálních onemocnění s neonatální manifestací.
Návrh diagnostických algoritmů
Zlatým standardem v diagnostice poruch mitochondriálního energetického metabolismu s nástupem v kterémkoliv věku je svalová biopsie. Rychlý a fatální neonatální průběh mitochondriálních onemocnění většinou neumožňuje provést svalovou biopsii. Pokud není k dispozici ani autoptický materiál, ve většině případů není diagnostika mitochondriálního onemocnění možná [60].
Pokusili jsme se proto sestavit základní algoritmy, které by mohly zjednodušit diagnostický proces a umožnit tak na základě klinických příznaků a výsledků biochemických a metabolických vyšetření indikovat přímou enzymatickou a/nebo mutační analýzu, v některých případech dokonce i bez nutnosti provedení svalové biopsie. Příkladem může být nález hypertrofické kardiomyopatie, svalové hypotonie, těžké metabolické laktátové acidózy, hyperamonémie a 3-methylglutakonové acidurie u kriticky nemocného novorozence s indikací přímé mutační analýzy genu TAZ (Barthův syndrom) a TMEM70. Je-li přítomna u chlapců hypospadie, preferujeme vyšetření genu TMEM70. U pacientů romského etnika jako první indikujeme mutační analýzu prevalentní mutace (c.317-2A>G) v genu TMEM70. Při stejné klinické symptomatologii, ale bez nálezu 3-methylglutakonové acidurie indikujeme genetické vyšetření prevalentní mutace v mtDNA pro syndrom NARP (8993T>G,C; gen MTATP6). Tuto mutační analýzu bychom provedli i v případě nálezu časně rozvinutého obrazu Leighova syndromu. Bude-li přítomna kardiomyopatie a laktátová acidóza u kriticky nemocného novorozence, avšak bez hyperamonémie a 3-methylglutakonové acidurie, budeme na prvním místě indikovat sekvenaci genů SCO2 a SCO1. Zhoršená tolerance glukózy s akcentací laktátové acidózy spolu se zvýšenou hladinou rozvětvených aminokyselin v krvi u kriticky nemocného dítěte s hypotonií a dechovými obtížemi vede k podezření na poruchu na úrovni PDHC. Makrocytární anémie s laktátovou acidózou na druhou stranu vede k podezření na Pearsonův syndrom.
Závěr
Mitochondriální onemocnění se často manifestují v novorozeneckém věku. Byl připraven diagnostický algoritmus pro kriticky nemocného novorozence s podezřením na mitochondriální onemocnění umožňující indikovat přímou enzymatickou nebo mutační analýzu, v některých případech dokonce bez nutnosti provedení svalové biopsie. Ale u nejasných případů pouze odběr jaterní a svalové tkáně bezprostředně po úmrtí dítěte umožní odhalit případnou etiologii mitochondriálního onemocnění (bližší informace o postupu odběru tkání jsou uvedeny na webových stránkách naší laboratoře – http://mitolab.lf1.cuni.cz).
Podpořeno projekty IGA NS 9782-4/2008 a IGA NS 9759-4/2008.
Prof. MUDr. Jiří Zeman, DrSc.
Klinika dětského a dorostového lékařství
UK 1. LF a VFN
Ke Karlovu 2
128 08 Praha 2
e-mail: jzem@lf1.cuni.cz
Zdroje
1. Pejznochova M, Tesarova M, Hansikova H, et al. Mitochondrial DNA content and expression of genes involved in mtDNA transcription, regulation and maintenance during human fetal development. Mitochondrion 2010; Jan 20 [Epub ahead of print].
2. Honzik T, Wenchich L, Bohm M, et al. Activities of respiratory chain complexes and pyruvate dehydrogenase in isolated muscle mitochondria in premature neonates. Early Hum. Dev. 2008; 84 : 269–276.
3. Schaefer AM, McFarland R, Blakely EL, et al. Prevalence of mitochondrial DNA disease in adults. Ann. Neurol. 2008; 63 : 35–39.
4. Taylor RW, Turnbull DM. Mitochondrial DNA mutations in human disease. Nat. Rev. Genet. 2005; 6 : 389–402.
5. Thorburn DR. Mitochondrial disorders: prevalence, myths and advances. J. Inherit. Metab. Dis. 2004; 27 : 349–362.
6. Tuppen HA, Blakely EL, Turnbull DM, et al. Mitochondrial DNA mutations and human disease. Biochim. Biophys. Acta 2009.
7. Spinazzola A, Zeviani M. Disorders of nuclear-mitochondrial intergenomic communication. Biosci. Rep. 2007; 27 : 39–51.
8. Munnich A, Rustin P. Clinical spectrum and diagnosis of mitochondrial disorders. Am. J. Med. Genet. 2001; 106 : 4–17.
9. Kokotas H, Petersen MB, Willems PJ. Mitochondrial deafness. Clin. Genet. 2007; 71 : 379–391.
10. Makinen MW, Lee CP, Shy GM. Microanalysis of cytochrome content, oxidative and phosphorylative activities of human skeletal muscle mitochondria. Neurology 1968; 18 : 299.
11. Rustin P, Chretien D, Bourgeron T, et al. Biochemical and molecular investigations in respiratory chain deficiencies. Clin. Chim. Acta 1994; 228 : 35–51.
12. Pelley JW, Little GH, Linn TC, et al. Lipoamide dehydrogenase in serum: a preliminary report. Clin. Chem. 1976; 22 : 275–277.
13. Constantin-Teodosiu D, Cederblad G, Hultman E. A sensitive radioisotopic assay of pyruvate dehydrogenase complex in human muscle tissue. Anal. Biochem. 1991; 198 : 347–351.
14. Sue CM, Hirano M, DiMauro S, et al. Neonatal presentations of mitochondrial metabolic disorders. Semin. Perinatol. 1999; 23 : 113–124.
15. von Kleist-Retzow JC, Cormier-Daire V, Viot G, et al. Antenatal manifestations of mitochondrial respiratory chain deficiency. J. Pediatr. 2003; 143 : 208–212.
16. Skladal D, Sudmeier C, Konstantopoulou V, et al. The clinical spectrum of mitochondrial disease in 75 pediatric patients. Clin. Pediatr. (Phila). 2003; 42 : 703–710.
17. Garcia-Cazorla A, De Lonlay P, Nassogne MC, et al. Long-term follow-up of neonatal mitochondrial cytopathies: a study of 57 patients. Pediatrics 2005; 116 : 1170–1177.
18. Gibson K, Halliday JL, Kirby DM, et al. Mitochondrial oxidative phosphorylation disorders presenting in neonates: clinical manifestations and enzymatic and molecular diagnoses. Pediatrics 2008; 122 : 1003–1008.
19. Brown GK, Brown RM, Scholem RD, et al. The clinical and biochemical spectrum of human pyruvate dehydrogenase complex deficiency. Ann. N. Y. Acad. Sci. 1989; 573 : 360–368.
20. Soares-Fernandes JP, Teixeira-Gomes R, Cruz R, et al. Neonatal pyruvate dehydrogenase deficiency due to a R302H mutation in the PDHA1 gene: MRI findings. Pediatr. Radiol. 2008; 38 : 559–562.
21. Blanco-Barca O, Gomez-Lado C, Rodrigo-Saez E, et al. Pyruvate dehydrogenase deficit associated to the C515T mutation in exon 6 of the E1alpha gene. Rev. Neurol. 2006; 43 : 341–345.
22. Zand DJ, Simon EM, Pulitzer SB, et al. In vivo pyruvate detected by MR spectroscopy in neonatal pyruvate dehydrogenase deficiency. Am. J. Neuroradiol. 2003; 24 : 1471–1474.
23. Vogel RO, Janssen RJ, van den Brand MA, et al. Cytosolic signaling protein Ecsit also localizes to mitochondria where it interacts with chaperone NDUFAF1 and functions in complex I assembly. Genes Dev. 2007; 21 : 615–624.
24. Vahsen N, Cande C, Briere JJ, et al. AIF deficiency compromises oxidative phosphorylation. EMBO J. 2004; 23 : 4679–4689.
25. Bych K, Kerscher S, Netz DJ, et al. The iron-sulphur protein Ind1 is required for effective complex I assembly. EMBO J. 2008; 27 : 1736–1746.
26. Moreadith RW, Batshaw ML, Ohnishi T, et al. Deficiency of the iron-sulfur clusters of mitochondrial reduced nicotinamide-adenine dinucleotide-ubiquinone oxidoreductase (complex I) in an infant with congenital lactic acidosis. J. Clin. Invest. 1984; 74 : 685–697.
27. Robinson BH, Ward J, Goodyer P, et al. Respiratory chain defects in the mitochondria of cultured skin fibroblasts from three patients with lacticacidemia. J. Clin. Invest. 1986; 77 : 1422–1427.
28. Hoppel CL, Kerr DS, Dahms B, et al. Deficiency of the reduced nicotinamide adenine dinucleotide dehydrogenase component of complex I of mitochondrial electron transport. Fatal infantile lactic acidosis and hypermetabolism with skeletal-cardiac myopathy and encephalopathy. J. Clin. Invest. 1987; 80 : 71–77.
29. Saada A, Vogel RO, Hoefs SJ, et al. Mutations in NDUFAF3 (C3ORF60), encoding an NDUFAF4 (C6ORF66)-interacting complex I assembly protein, cause fatal neonatal mitochondrial disease. Am. J. Hum. Genet. 2009; 84 : 718–727.
30. Valnot I, Osmond S, Gigarel N, et al. Mutations of the SCO1 gene in mitochondrial cytochrome c oxidase deficiency with neonatal-onset hepatic failure and encephalopathy. Am. J. Hum. Genet. 2000; 67 : 1104–1109.
31. Stiburek L, Vesela K, Hansikova H, et al. Loss of function of Sco1 and its interaction with cytochrome c oxidase. Am. J. Physiol. Cell Physiol. 2009; 296: C1218–1226.
32. Taylor GP. Neonatal mitochondrial cardiomyopathy. Pediatr. Dev. Pathol. 2004; 7 : 620–624.
33. Verdijk RM, de Krijger R, Schoonderwoerd K, et al. Phenotypic consequences of a novel SCO2 gene mutation. Am. J. Med. Genet. A 2008; 146A: 2822–2827.
34. Vesela K, Hansikova H, Tesarova M, et al. Clinical, biochemical and molecular analyses of six patients with isolated cytochrome c oxidase deficiency due to mutations in the SCO2 gene. Acta Paediatr. 2004; 93 : 1312–1317.
35. Bohm M, Pronicka E, Karczmarewicz E, et al. Retrospective, multicentric study of 180 children with cytochrome c oxidase deficiency. Pediatr. Res. 2006; 59 : 21–26.
36. Antonicka H, Leary SC, Guercin GH, et al. Mutations in COX10 result in a defect in mitochondrial heme A biosynthesis and account for multiple, early-onset clinical phenotypes associated with isolated COX deficiency. Hum. Mol. Genet. 2003; 12 : 2693–2702.
37. Antonicka H, Mattman A, Carlson CG, et al. Mutations in COX15 produce a defect in the mitochondrial heme biosynthetic pathway, causing early-onset fatal hypertrophic cardiomyopathy. Am. J. Hum. Genet. 2003; 72 : 101–114.
38. Houstek J, Klement P, Hermanska J, et al. Altered properties of mitochondrial ATP-synthase in patients with a T—>G mutation in the ATPase 6 (subunit a) gene at position 8993 of mtDNA. Biochim. Biophys. Acta 1995; 1271 : 349–357.
39. Houstek J, Mracek T, Vojtiskova A, et al. Mitochondrial diseases and ATPase defects of nuclear origin. Biochim. Biophys. Acta 2004; 1658 : 115–121.
40. Tesarova M, Hansikova H, Hlavata A, et al. Variation in manifestations of heteroplasmic mtDNA mutation 8993 T>G in two families. Čas. Lék. čes. 2002; 141 : 551–554.
41. De Meirleir L, Seneca S, Lissens W, et al. Respiratory chain complex V deficiency due to a mutation in the assembly gene ATP12. J. Med. Genet. 2004; 41 : 120–124.
42. Holt IJ, Harding AE, Morgan-Hughes JA. Deletions of muscle mitochondrial DNA in patients with mitochondrial myopathies. Nature 1988; 331 : 717–719.
43. Zeviani M, Servidei S, Gellera C, et al. An autosomal dominant disorder with multiple deletions of mitochondrial DNA starting at the D-loop region. Nature 1989; 339 : 309–311.
44. Akman CI, Sue CM, Shanske S, et al. Mitochondrial DNA deletion in a child with megaloblastic anemia and recurrent encephalopathy. J. Child Neurol. 2004; 19 : 258–261.
45. Morel AS, Joris N, Meuli R, et al. Early neurological impairment and severe anemia in a newborn with Pearson syndrome. Eur. J. Pediatr. 2009; 168 : 311–315.
46. Spinazzola A, Invernizzi F, Carrara F, et al. Clinical and molecular features of mitochondrial DNA depletion syndromes. J. Inherit. Metab. Dis. 2009; 32 : 143–158.
47. Barth PG, Valianpour F, Bowen VM, et al. X-linked cardioskeletal myopathy and neutropenia (Barth syndrome): an update. Am. J. Med. Genet. A 2004; 126A: 349–354.
48. Donati MA, Malvagia S, Pasquini E, et al. Barth syndrome presenting with acute metabolic decompensation in the neonatal period. J. Inherit. Metab. Dis. 2006; 29 : 684.
49. Yen TY, Hwu WL, Chien YH, et al. Acute metabolic decompensation and sudden death in Barth syndrome: report of a family and a literature review. Eur. J. Pediatr. 2008; 167 : 941–944.
50. Mayr JA, Merkel O, Kohlwein SD, et al. Mitochondrial phosphate-carrier deficiency: a novel disorder of oxidative phosphorylation. Am. J. Hum. Genet. 2007; 80 : 478–484.
51. Duncan AJ, Bitner-Glindzicz M, Meunier B, et al. A nonsense mutation in COQ9 causes autosomal-recessive neonatal-onset primary coenzyme Q10 deficiency: a potentially treatable form of mitochondrial disease. Am. J. Hum. Genet. 2009; 84 : 558–566.
52. Rahman S, Hargreaves I, Clayton P, et al. Neonatal presentation of coenzyme Q10 deficiency. J. Pediatr. 2001; 139 : 456–458.
53. Coenen MJ, Antonicka H, Ugalde C, et al. Mutant mitochondrial elongation factor G1 and combined oxidative phosphorylation deficiency. N. Engl. J. Med. 2004; 351 : 2080–2086.
54. Smeitink JA, Elpeleg O, Antonicka H, et al. Distinct clinical phenotypes associated with a mutation in the mitochondrial translation elongation factor EFTs. Am. J. Hum. Genet. 2006; 79 : 869–877.
55. Valente L, Tiranti V, Marsano RM, et al. Infantile encephalopathy and defective mitochondrial DNA translation in patients with mutations of mitochondrial elongation factors EFG1 and EFTu. Am. J. Hum. Genet. 2007; 80 : 44–58.
56. Miller C, Saada A, Shaul N, et al. Defective mitochondrial translation caused by a ribosomal protein (MRPS16) mutation. Ann. Neurol. 2004; 56 : 734–738.
57. Saada A, Shaag A, Arnon S, et al. Antenatal mitochondrial disease caused by mitochondrial ribosomal protein (MRPS22) mutation. J. Med. Genet. 2007; 44 : 784–786.
58. Cizkova A, Stranecky V, Ivanek R, et al. Development of a human mitochondrial oligonucleotide microarray (h-MitoArray) and gene expression analysis of fibroblast cell lines from 13 patients with isolated F1Fo ATP synthase deficiency. BMC Genomics 2008; 9 : 38.
59. Cizkova A, Stranecky V, Mayr JA, et al. TMEM70 mutations cause isolated ATP synthase deficiency and neonatal mitochondrial encephalocardiomyopathy. Nat. Genet. 2008; 40 : 1288–1290.
60. Morava E, van den Heuvel L, Hol F, et al. Mitochondrial disease criteria: diagnostic applications in children. Neurology 2006; 67 : 1823–1826.
Štítky
Neonatologie Pediatrie Praktické lékařství pro děti a dorost
Článek vyšel v časopiseČesko-slovenská pediatrie
Nejčtenější tento týden
2010 Číslo 7-8- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Syndrom Noonanové: etiologie, diagnostika a terapie
-
Všechny články tohoto čísla
- Udělení Brdlíkovy ceny
- Klinické příznaky a laboratorní data u 75 dětí s neonatální manifestací mitochondriálního onemocnění: návrh diagnostických algoritmů
- XXVII. sjezd českých a slovenských alergologů a klinických imunologů
- Význam dynamiky sérologií a PCR diagnostiky k pravděpodobnosti vrozené toxoplazmózy u dětí séropozitivních matek
- Výsledky molekulárně genetického vyšetření pacientů Dětské lipidové poradny Fakultní nemocnice Olomouc v rámci projektu MedPed
- Analýza očkovania detskej populácie proti kliešťovej encefalitíde v Slovenskej republike za roky 1997 až 2009
- Současné možnosti léčby hyperfenylalaninémie
- Hodnotenie elasticity cievnej steny v detskom veku metódou merania rýchlosti pulznej vlny
- Revidovaný doporučený postup při diagnostice, léčbě a prevenci alergie na bílkovinu kravského mléka
- Konference myoskeletální medicíny
- 9. celostátní konference Dětská pneumologie
- Vzdělávací akce IPVZ – 2. pololetí 2010
- XII. hradecké pediatrické dny
- Česko-slovenská pediatrie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Současné možnosti léčby hyperfenylalaninémie
- Revidovaný doporučený postup při diagnostice, léčbě a prevenci alergie na bílkovinu kravského mléka
- Hodnotenie elasticity cievnej steny v detskom veku metódou merania rýchlosti pulznej vlny
- Klinické příznaky a laboratorní data u 75 dětí s neonatální manifestací mitochondriálního onemocnění: návrh diagnostických algoritmů
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



