-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Terapeutické přístupy v léčbě novorozenecké anémie z nezralosti
Therapeutical Approaches in Anemia of Prematurity
Anemia is the most common hematological disorder in the neonate. During the first weeks of life, all infants experience a decline in blood hematocrit values. The main cause of anemia is a rapid fall in erythropoietin production after birth due to increased oxygen saturation. This process is called physiologic anemia of the newborn. Anemia of prematurity is related to a combination of factors including increased iatrogenic losses from blood sampling, shorter red blood cells life span due to fetal hemoglobin, and rapid growth.
Blood transfusion remains still the gold standard in the treatment of anemia of prematurity. Between 60 to 100% of preterm infants (80% of VLBW and 95% of ELBW infants) are transfused before three weeks of age. The need of late transfusions decreases with the use of recombinant human erythropoietin. Despite an extensive number of studies, there is currently no clear consensus regarding erythropoietin benefit in the treatment of anemia of prematurity.Key words:
anemia of prematurity, blood transfusion, recombinant human erythropoietin, retinopathy of prematurity
Autoři: S. Šebková 1; J. Zach 1; J. Janota 1,2
Působiště autorů: Novorozenecké oddělení s JIPN, Fakultní Thomayerova nemocnice s poliklinikou, Praha-Krč primář MUDr. J. Janota, PhD. 1; Ústav patologické fyziologie UK 1. LF, Praha přednosta prof. MUDr. E. Nečas, DrSc. 2
Vyšlo v časopise: Čes-slov Pediat 2009; 64 (7-8): 352-358.
Kategorie: Přehledový článek
Souhrn
Anémie je u novorozence nejčastějším hematologickým onemocněním. V prvních týdnech života dochází u všech dětí k poklesu hodnot krevního hematokritu. Hlavní příčinou je rychlý pokles hladiny erytropoetinu po porodu způsobený vyšší saturací krve kyslíkem a zlepšením oxygenace tkání. Tento stav se nazývá fyziologickou anémií novorozence. U nedonošených novorozenců se k těmto příčinám přidávají ztráty způsobené krevními odběry, zkrácené přežívání erytrocytů s vyšším obsahem fetálního hemoglobinu a rychlý růst.
Hlavní léčbou anémie u nedonošených novorozenců je transfuze krve a krevních derivátů. Do věku tří týdnů je 60 až 100 % nedonošených novorozenců (80 % novorozenců s hmotností pod 1500 g a 95 % s hmotností pod 1000 g) léčeno krevním převodem. Potřebu pozdních transfuzí snižuje léčba rekombinantním erytropoetinem. I přes velké množství studií dosud na toto téma publikovaných neexistuje zatím jasný konsenzus o jeho benefitu při léčbě anémie z nezralosti.Klíčová slova:
anémie z nezralosti, krevní transfuze, rekombinantní erytropoetin, retinopatie nedonošenýchÚvod
Anémie novorozence je nejčastějším hematologickým problémem, se kterým se může lékař-neonatolog setkat. Novorozenec může být při signifikantní anémii ohrožen sníženou transportní kapacitou krve pro kyslík. Jejím následkem je hypoxie tkání a metabolická acidóza. V prvních týdnech života dochází u všech dětí k poklesu hodnoty krevního hematokritu a hemoglobinu. Hlavní příčinou je pokles hladiny erytropoetinu po narození, který je způsobený vyšší saturací krve kyslíkem a zlepšením oxygenace tkání. U zdravých donošených novorozenců bývá nejnižší hodnota hematokritu a hemoglobinu v 8 až 12 týdnech po narození, poté pozvolna stoupá. Hodnoty hemoglobinu většinou neklesnou pod 110 g/l. Tento stav se nazývá fyziologická anémie novorozenců [1].
U nedonošených dětí dochází k maximálnímu poklesu hemoglobinu již dříve, obvykle ve věku 4–8 týdnů, a nejnižší hodnoty hemoglobinu mohou dosáhnout až 65 g/l. Je to způsobeno kratším přežíváním erytrocytů s vyšším obsahem fetálního hemoglobinu a zejména pak sníženou tvorbou erytropoetinu v játrech. Hepatocyty jsou v porovnání s buňkami ledvinných tubulů méně citlivé na hypoxii, a proto dochází při relativní hyperoxii tkání ke snížení tvorby erytropoetinu. Předčasný porod neakceleruje ontogenetický proces postupného snižování tvorby erytropoetinu v jaterní buňce a jeho stoupající tvorby v ledvinách. Proto platí do určité míry přímá úměrnost mezi stupněm nezralosti a závažností anémie [1].
Současná péče především o extrémně nezralé novorozence s sebou přináší velké množství krevních odběrů. S tím souvisí i vyšší riziko iatrogenně způsobené anémie u této rizikové skupiny. Průměrné množství krve odebrané nedonošenému novorozenci na JIPN dosahuje 0,8 až 3,1 ml/kg/den. Toto množství odpovídá 30 až 300 % objemu krve těchto dětí ztracené odběry za celý pobyt na JIPN [2]. Ve věku tří až šesti týdnů se k těmto faktorům přidává i rychlý růst předčasně narozeného novorozence a zvýšená potřeba železa. Všechny tyto faktory přispívají k postupné anemizaci pacienta, na kterou je třeba reagovat. Anémie z nezralosti je u předčasně narozených novorozenců nejčastější formou anémie [2].
Definice
Anémie novorozence je definována jako koncentrace hemoglobinu nižší, než je fyziologická hranice pro daný věk [3]. Obvyklým kritériem pro anémii je hladina venózního hemoglobinu pod 130 g/l nebo kapilárního hemoglobinu pod 145 g/l u dětí starších, než je 34. týden těhotenství [1]. U donošených dětí klesá hodnota hemoglobinu obvykle k 94 až 110 g/l ve věku 8 až 12 týdnů.
Specifickým problémem je anémie z nezralosti. Je definována jako normochromní normocytární anémie u předčasně narozených novorozenců. K poklesu hemoglobinu zde dochází již ve 4. až 8. týdnu po narození a koncentrace hemoglobinu může klesnout až k hodnotám 65–90 g/l [3].
Příčiny
V novorozeneckém věku existuje mnoho příčin anémií. Nejčastější z nich shrnuje tabulka 1 [1].
Tab. 1. Nejčastější příčiny anémie u novorozence. 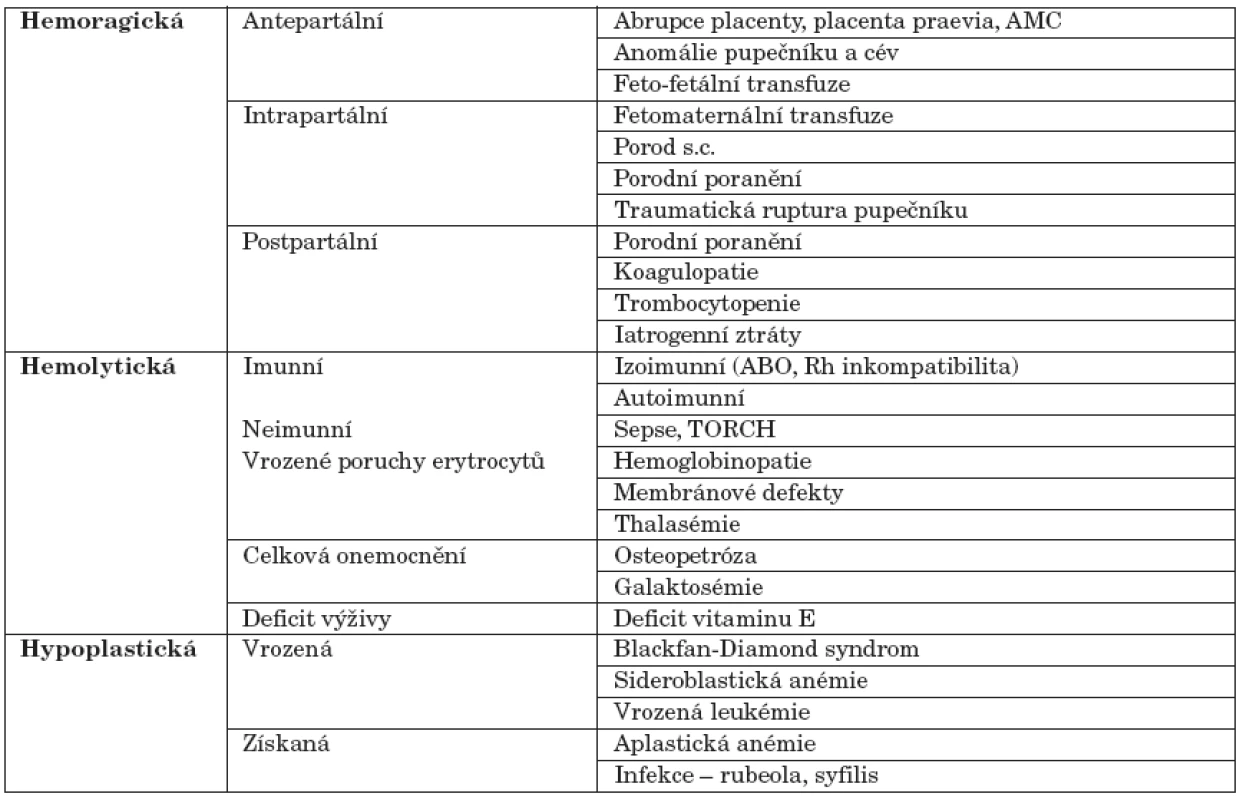
Anémie z nezralosti tvoří významnou podskupinu novorozeneckých anémií. Je způsobena nízkou hladinou erytropoetinu, který je u nedonošených dětí tvořen játry. Ta jsou v porovnání s ledvinami méně citlivá na hypoxii, a proto i tvorba erytropoetinu je pozvolnější. Předčasný porod neakceleruje tento ontogenetický proces, proto platí souvislost mezi stupněm nezralosti a závažností anémie [1]. Významnou roli hraje rovněž zkrácené přežívání erytrocytů s vyšším obsahem fetálního hemoglobinu, rychlý růst dítěte a časté krevní odběry [3].
Příznaky
Rozvoj příznaků anémie u novorozence závisí na rychlosti jejího vzniku. Anémie vzniklá akutním krvácením se může projevit až obrazem hypovolemického šoku provázeného poruchou prokrvení, hypotenzí, tachykardií, tachypnoí. Naopak příznaky chronické ztráty krve mohou být velmi nenápadné, jediným příznakem může být pouze bledost a spavost. Dalším příznakem je neprospívání, které neodpovídá uspokojivému přívodu ostatních živin. Prvním projevem hemolytické anémie bývá ikterus, který u hypoplastické anémie chybí [1]. Příznaky nejčastějších typů anémie shrnuje tabulka 2.
Tab. 2. Klinické příznaky nejčastějších typů anémií u novorozence. 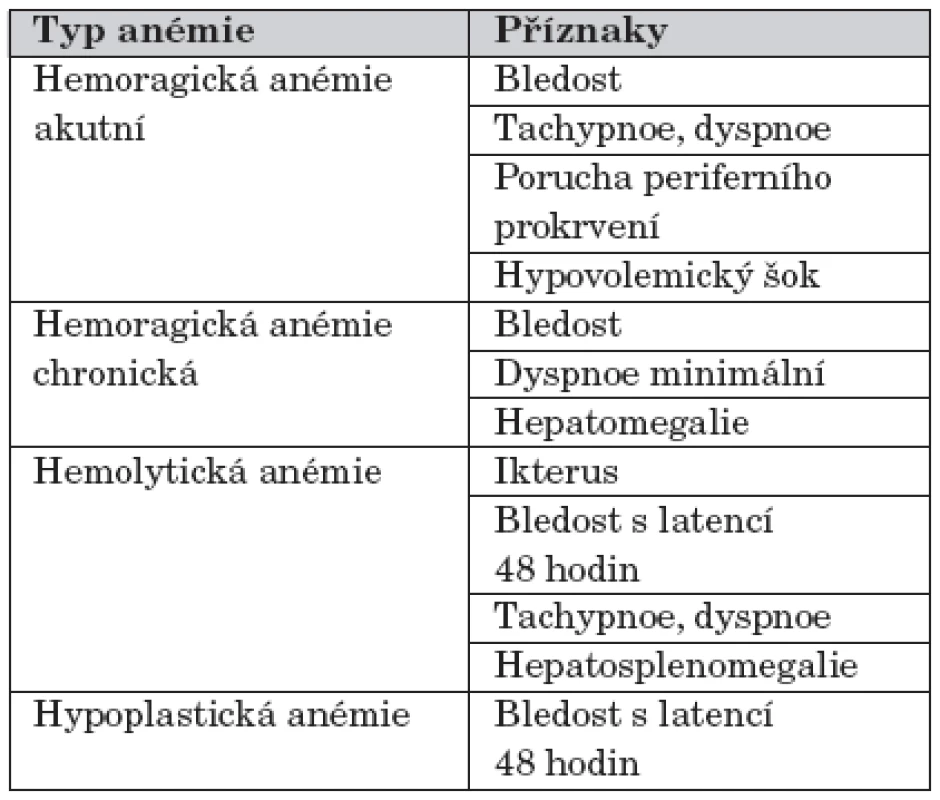
Anémie z nezralosti může být zcela bez klinických příznaků a ani nízké koncentrace hemoglobinu nemusí být provázeny zásadní změnou ve stavu dítěte. Jediným příznakem může být pouze zpomalení růstového tempa. Na anémii z nezralosti je třeba myslet i při častějším výskytu apnoických pauz, snížení aktivity dítěte, která může přejít až v letargii. Dysfunkce kardiovaskulárního a respiračního systému se mohou projevovat tachykardií a tachypnoí. Při auskultaci srdce lze zachytit průtokový šelest. U signifikantní anémie může dojít k rozvoji metabolické acidózy způsobené hypoxií tkání [3].
Prevence a léčba anémie z nezralosti
Prevence
Závažnost anémie z nezralosti a následná potřeba krevní transfuze může být snížena kombinací následujících preventivních přístupů [2]:
- omezením iatrogenních krevních ztrát
- dostatečnou placentární transfuzí – opožděným podvázáním pupečníku (30–120 s)
- včasnou a dostatečnou suplementací železem
- podáváním rekombinantního lidského erytropoetinu
Léčba
Anémii z nezralosti lze léčit dvěma léčebnými přístupy. Starším postupem, který však rychleji obnoví dostatečnou transportní kyslíkovou kapacitu, je krevní transfuze. Druhou možností je podávání lidského rekombinantního erytropoetinu (rHuEPO).
Transfuze
Většina nedonošených dětí, zejména novorozenců narozených mezi 24. a 27. týdnem těhotenství, vyžaduje v prvních týdnech po narození krevní transfuzi. Akutní indikací je rozsáhlá krevní ztráta s nutností okamžité náhrady. U anémie z nezralosti se však jedná o postupnou anemizaci novorozence, kde při indikacích transfuze se přihlíží nejen k hodnotám hematokritu a hemoglobinu, ale také k jeho celkovému klinickému stavu. Indikační kritéria podání transfuze novorozenci zahrnující celkový klinický stav udává tabulka 3 [1].
Tab. 3. Indikační kritéria podání transfuze novorozenci zahrnující celkový klinický stav. 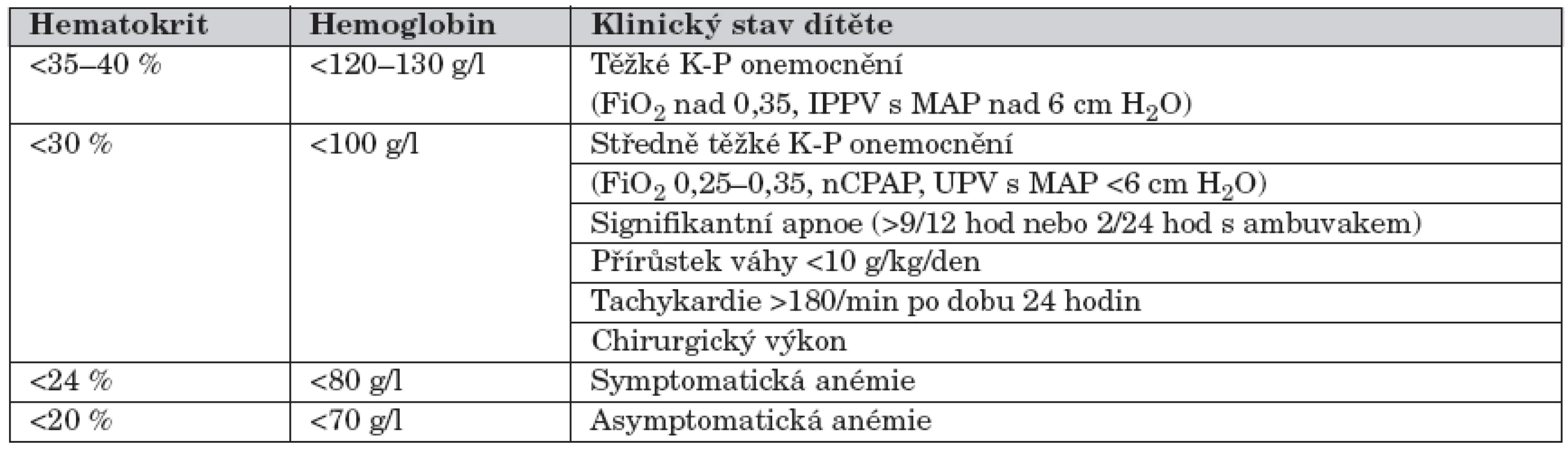
Nejvhodnějšími krevními deriváty při transfuzích jsou krevní resuspenze. Jedná se o roztok s erytrocyty, ve kterém je plazma nahrazená roztokem elektrolytů do hematokritu 55–65 %. Pro novorozence je vhodná krev mladší 5 dnů, neboť skladované erytrocyty prochází morfologickou změnou bikonkávního terčíku na sféroechinocyt. Tyto změny vedou ve svém důsledku k vychytávání změněných erytrocytů v mikrovaskulatuře sleziny. Po pěti dnech dochází v krevním derivátu rozpadem erytrocytů rovněž ke zvýšení hladiny draslíku [4]. Podání plné krve se u novorozenců nedoporučuje. Při hrazení masivního krvácení je vhodnější použít erytrocytární resuspenzi krevní skupiny 0 Rh negativní nakříženou s krví matky [1]. U nedonošených novorozenců se podává resuspenze erytrocytů v objemu 20 ml/kg. Studie prokázaly, že tento větší objem nejen lépe zvýší hladinu hemoglobinu a sníží potřebu dalších transfuzí, ale je u většiny nedonošených dětí dobře tolerován [3, 5].
S krevními převody jsou spojena určitá rizika. Nejčastěji byla historicky v literatuře udávána rizika infekce virem hepatitidy a HIV. Výsledky současné studie National Blood Service ukázaly, že riziko infekce přenesené krevní transfuzí je v současnosti velmi malé [6]. Riziko přenosu viru HIV je 1 : 8 milionům, riziko přenosu viru hepatitidy C je menší než 1 : 30 milionům a hepatitidy B je 1 : 900 tisícům. Snížení rizika bylo dosaženo zejména používáním deleukotizované ozářené krve. Deleukotizace snižuje riziko přenosu infekce, ozáření riziko reakce štěpu proti hostiteli. Ozářená krev je proto vhodná zejména při transfuzi krve od příbuzných osob, u imunokomprimovaných dětí nebo novorozenců po intrauterinní transfuzi [3]. Infekční rizika se (při nutnosti opakovaných transfuzí) snižují opakovaným podáním krve od jednoho dárce, krevní deriváty podané dětem do jednoho roku by měly být CMV negativní [3]. Největším rizikem tak v současném zdravotním systému zůstává krevní převod krve chybné krevní skupiny (1 : 25 tisícům) [6]. Nelze podceňovat ani riziko poškození kyslíkovými radikály, zvláště při větších objemech převedené krve, protože adultní hemoglobin má menší afinitu ke kyslíku, ve tkáních kyslík ochotněji uvolňuje a dochází tak k hyperoxemii tkání. Rodiče často požadují, aby byla dítěti podána krev od příbuzného dárce. To však skrývá mnoho nevýhod a není obecně doporučováno. Příbuzní dárci se totiž ukázali rizikovější z hlediska rizika přenosných nemocí a pro podobnost HLA haplotypů je rovněž zvýšeno riziko reakce štěpu proti hostiteli.
Erytropoetin
Erytropoetin je glykoprotein, který je u plodu a nedonošených novorozenců tvořen játry, u donošených novorozenců játry a ledvinami. Jedná se o růstový faktor, který je zodpovědný za erytropoézu plodu a novorozence. Erytropoetin neprochází placentou a in utero probíhá fetální a maternální erytropoéza odděleně [7]. Primárním zdrojem EPO ve vyvíjejícím se plodu jsou játra. Jak ukázaly randomizované studie, anefritické plody mají normální hladinu EPO a normální hodnotu hematokritu. Je dokázáno, že tvorba EPO v ledvinách není pro erytropoézu in utero rozhodující. Při léčbě anémie z nezralosti se využívá schopnosti EPO stimulovat erytropoézu novorozence [8, 9].
Výsledky randomizovaných studií prokázaly srovnatelný efekt v účinnosti léku při vyšším (1500 jednotek/kg/týden) a nižším (750 jednotek/kg/týden) dávkování. Doporučená dávka erytropoetinu je proto 250 jednotek/kg třikrát týdně po dobu 4 až 6 týdnů [10]. Toto doporučení je podpořeno mezinárodními expertními skupinami v European Multicentre Erythropoetin Study Group i British National Formulary for Children [10]. Při intravenózním podání erytropoetinu dochází k výraznému, avšak krátkodobému zvýšení hladiny EPO, které je však pro erytropoézu méně efektivní. Po subkutánním nebo kontinuálním intravenózním podání dochází naopak k déletrvající a proto efektivnější odpovědi kostní dřeně. Pro svoji jednoduchost je vhodnější aplikace subkutánní, která je proto v současnosti doporučována jako standardní [6]. Výsledky studií zaměřených na enterální podávání rHuEPO zatím nejsou přesvědčivé [11, 12].
V současnosti jsou názory na používání erytropoetinu při léčbě anémie z nezralosti kontroverzní. Výsledky randomizovaných studií ukázaly, že časné podání erytropoetinu (tj. do 8. dne života) nesnižuje riziko časných transfuzí. Do třetího týdne života je přitom transfundováno 60–100 % nedonošených novorozenců [13]. Časné podání erytropoetinu navíc signifikantně zvyšuje riziko rozvoje závažných forem onemocnění způsobeného nadměrnou proliferací cév sítnice oka – retinopatie nedonošených (ROP) [13]. Riziko tohoto onemocnění bylo zvýšeno také při podání více než 20 dávek erytropoetinu a iniciaci léčby před 20. dnem života [14]. Zatím není zcela jasné, zda se na tomto riziku podílí i současná suplementace železem [6]. K pozitivnímu působení erytropoetinu může patřit určitý ochranný vliv při ischemickém poškození nervových buněk, který byl zjištěn v animálních studiích [15, 16].
Speciální kapitolou je léčba anémie z nezralosti u dětí rodičů, jejichž náboženské přesvědčení zasahuje do možnosti podání krevních derivátů, jak je tomu například u Svědků Jehovových. Na světě je kolem 5,5 milionů osob hlásících se k této víře. Pokud se nejedná přímo o život ohrožující stav (např. akutní krvácení), je souhlas rodičů k provedení krevního převodu u dítěte nezbytný. V tomto případě může erytropoetin představovat možnou alternativu. Přesto však nelze plošně doporučit každé dítě v podobné situaci k primární léčbě rHuEPO. Je třeba se řídit aktuální situací a upřednostnit vždy zájem dítěte [6].
Železo
Železo hraje důležitou úlohu v životních funkcích celého organismu. Jeho potřeba je větší zejména v rychle rostoucích a dělících se buňkách. Železo slouží jako přenašeč kyslíku a elektronů, je katalyzátorem celé řady nezbytných reakcí včetně oxygenace a hydroxylace. Je koenzymem enzymů dýchacího řetězce cytochromoxidázy, katalázy a peroxidázy. V rostoucím organismu ovlivňuje tvorbu a sekreci hormonů, syntézu kolagenu a DNA. Významný je rovněž vliv železa na funkce imunitního systému, zejména jeho buněčné složky a funkce neutrofilů. Dostatečné zásoby železa jsou nezbytné pro růst a vývoj centrální nervové soustavy a rozvoj mentálních schopností [17].
Železo je v organismu distribuováno následujícím způsobem:
- erytrocyty – 70–80 % (1 g hemoglobinu obsahuje 3,4 mg železa)
- tkáňové proteiny (myoglobin, cytochromy) – 10 %
- zásobní železo (feritin, hemosiderin) – 10–15 %
Celkové množství železa u novorozence narozeného ve 3. trimestru gravidity se pohybuje kolem 75 mg/kg hmotnosti. Kojené donošené děti mají dostatečné zásoby železa do 4. až 6. měsíce věku. Nedonošené děti, zejména pak ty narozené před 32. týdnem těhotenství, mohou mít nedostatek železa již ve 2 měsících věku i dříve [18]. Absorpce železa je při jeho suplementaci ovlivněna gestačním a postnatálním stářím, množstvím železa v organismu, dietetickými faktory a využitím železa buňkami. Mezi predisponující faktory nedostatku železa patří nedostatečné fetální zásoby, excesivní krevní odběry, pozdní zahájení suplementace, její poddávkování a rychlý postnatální růst novorozence. Tyto faktory uvádí tabulka 4 [18].
Tab. 4. Faktory ovlivňující hladinu železa u novorozence. 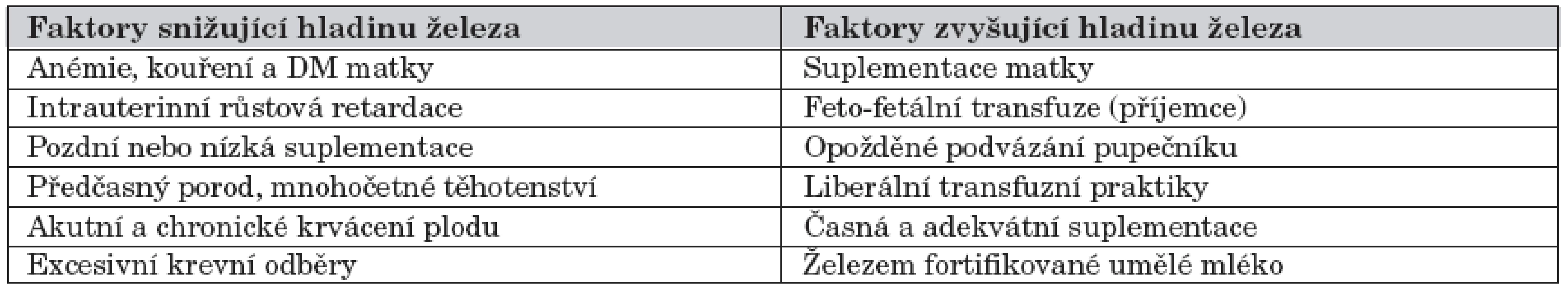
Nedostatek železa je spojen s ireverzibilními změnami neurologického vývoje. Ve studii hodnotící novorozence s hladinou feritinu pod 75 µg/l narozené ve 37. týdnu těhotenství byla prokázána přítomnost abnormálních neurologických reflexů [17]. Pro vyvíjející organismus je však i nadbytek tohoto prvku škodlivý. Při nadbytku železa se uplatňuje jeho prooxidační účinek. Antioxidační systémy jsou u novorozenců nezralé a zvýšená hladina železa může u novorozence narušením oxidativní fosforylace způsobit poškození funkce mitochondrií. Tyto faktory negativně ovlivní zejména játra, srdce, ledviny a plíce. Mohou být významné při zvyšování rizika ROP a chronické plicní pneumopatie předčasně narozených novorozenců – bronchopulmonální dysplazie [18, 19]. Nadbytek železa se může negativně projevit i svou korozivní toxicitou, která způsobuje gastrointestinální obtíže, spojené často s hematemezou, průjmy, nechutenstvím, nauzeou a bolestmi břicha. Zvýšený přívod železa v potravě snižuje mechanismem kompetice o přenašečový systém resorpci některých stopových prvků, např. mědi a zinku. Zvýšená nabídka železa pro bakterie zvyšuje rovněž riziko infekce [18, 19].
Pro diagnostiku nedostatku železa je nejvhodnější hladina feritinu. Feritin je protein představující solubilní zásoby železa uvnitř buněk. Jeho malé množství cirkuluje v plazmě a jeho plazmatická hladina je nejspolehlivějším odrazem stavu zásob železa v organismu. U novorozenců je poměr sérového feritinu k jaterním zásobám železa 1 : 2,7 [20].
Podle AAP (American Academy of Pediatrics) je vhodné zjišťovat případný nedostatek železa u donošených dětí v 6. měsíci, u nedonošených již ve 2. až 4. měsíci věku [18]. Doporučená denní dávka železa je u kojených donošených dětí 1 mg/kg/den. U nekojených je vhodné používat mléčné formule bohaté na železo [18]. Pro nedonošené novorozence je doporučená denní dávka železa 2 až 4 mg/kg. Při léčbě erytropoetinem a hladině feritinu pod 100 µg/l se pro vystupňování erytropoézy suplementace železem zvyšuje na 9 až 12 mg/kg/den. Suplementace železem se ukončuje při normalizaci hladiny hemoglobinu a feritinu [21].
Pro suplementaci železa u nedonošených jsou k dispozici dva přípravky – s dvojmocným a trojmocným železem. Dvojmocné železo se z trávicího traktu lépe vstřebává, jeho resorpce probíhá aktivně po navázání se na feritin buněk sliznice tenkého střeva. Dalším krokem je jeho vazba na plazmatický transferin a jeho přenos do cílových orgánů. Při zvýšené nabídce železa se uplatní i pasivní transport. Tato forma může být hůře tolerována s výskytem nežádoucích gastrointestinálních příznaků. Přípravek s trojmocným železem ve formě hydroxidu železitého se vstřebává rovněž aktivním procesem. Podle principu konkurenční výměny ligandů však může každá bílkovina v gastrointestinální tekutině, která je schopna vázat železo, z tohoto přípravku železo vyvázat. Jeho snášenlivost je však lepší, trávicí potíže u přípravků s trojmocným železem jsou vzácné [22].
Kyselina listová
Součástí dostatečné nutriční podpory anemických novorozenců je rovněž suplementace kyselinou listovou [23]. Kyselina listová je sloučenina složená z heterocyklu pteridinu, paraaminobenzoové a glutamové kyseliny a patří mezi vitaminy skupiny B. V organismu se redukuje na účinný tetrahydrofolát, který se jako koenzym účastní na řadě metabolických procesů, zejména při syntéze purinových a pyrimidinových nukleotidů, které jsou součástí jaderné DNA. Podílí se rovněž na konverzi a syntéze některých aminokyselin. Její karence postihuje zejména rychle se dělící buňky.
Doporučená dávka kyseliny listové pro nedonošené děti je 1 až 2 mg/týden [1]. Suplementace se ukončuje po dosažení gestačního věku 40 týdnů [3].
Závěr
Léčba anémie z nezralosti je důležitou součástí péče o předčasně narozené děti. Anémie může negativně ovlivnit růst a vývoj nezralých novorozenců. Její léčba je možná prostřednictvím krevních transfuzí, aplikací rHuEPO a výživovou suplementací. Anémii je třeba nejen léčit, ale hlavně se jí snažit předcházet. Mezi preventivní opatření patří zejména restrikce krevních odběrů, využití mikrometod, podpora opožděného podvázání pupečníku a včasná a dostatečná suplementace železem, případně zvážit podání rekombinantního erytropoetinu.
Standardem současné léčby anémie z nezralosti je transfuze krevní resuspenze. Vzhledem k vývoji nových vyšetřovacích metod a používání deleukotizované ozářené krve jsou rizika spojená s krevními převody nízká. Přestože je potvrzeno, že rHuEPO zvyšuje retikulocytózu a hodnotu hematokritu, nenabízí v současnosti tento růstový faktor při znalosti minimálních rizik transfuzí signifikantní přínos pro nedonošené novorozence. Vzhledem k tomu, že léčba rHuEPO je spojena s progresí ROP, není možné v současné době obhajovat jeho plošné podávání u nezralých dětí. Rozhodnutí o podání rHuEPO při anémii z nezralosti u novorozenců rodičů Svědků Jehovových se řídí specifičností situace, přáním rodičů, ale především prospěchem dítěte.
Při léčbě anémie se doporučuje monitorování stavu železa v organismu nedonošených dětí. V případě nedostatku je nutná suplementace železem. Pro zahájení terapie železem má největší přínos sledování hladiny feritinu. Součástí léčby anémie z nezralosti je rovněž suplementace kyselinou listovou.
Ztratky použité v textu
K-P: kardio-pulmonální
FiO2: index frakce vdechovaného kyslíku
IPPV: přerušovaná ventilace s pozitivním tlakem
MAP: střední tlak v dýchacích cestách
UPV: umělá plicní ventilace
nCPAP: kontinuální pozitivní tlak v dýchacích cestách
rHuEPO: lidský rekombinantní erytropoetin
EPO erytropoetin
Fe: železo
JIPN: jednotka intenzivní péče o novorozence
ROP: retinopatie nedonošených novorozenců
AMC: amniocentéza
AAP: American Academy of Pediatrics
Došlo: 5. 2. 2009
Přijato: 29. 4. 2009
MUDr. Sylva Šebková
267 27 Skuhrov – Hatě 88
e-mail: sylva.sebkova@meditorial.cz
Zdroje
1. Gomella TL, Cunningham MD, et al. Neonatology. 5th ed. The McGraw-Hill Companies, Inc, 2004 : 334–340.
2. Miyashiro A, et al. Strict red blood cell transfusion guideline reduces the need for transfusions in very-low-birthweight infants in the first 4 weeks of life: a multicentre trial. Vox Sang 2005;88 : 107–113.
3. Rennie JM. Roberton’s Textbook of Neonatology. 4th ed. Elsevier, 2005 : 741–751.
4. Fetus and Newborn Committee. Red blood cell transfusions in newborn infants: Revised guidelines. Paediatrics and Child Health 2002;7(8): 553–558.
5. Paul DA, Leef KH, et al. Transfusion volume in infants with very low birth weight: A randomized trial of 10 versus 20 ml/kg. J. Pediatr. Hematol. Oncol. 2002; 24 : 43–46.
6. Mainie P. Is there a role for erythropoetin in neonatal medicine? Early Human Development 2008;84 : 525–532.
7. Widness JA, Sawyer ST, et al. Lack of maternal to fetal transfer of 125l-erythropoietin in sheep. J. Dev. Physiol. 1991;15 : 139–143.
8. Zanjani ED, Pixley JS, et al. Erythropoietin does not cross the placenta into the fetus. Pathobiology 1993;61(3–4): 211–215.
9. Widness JA, Phillips AF, et al. Erythropoietin levels and erythropoiesis at birth in infants with Potter’s syndrome. J. Pediatr. 1990;117 : 155–158.
10. Maier RF, Obladen M, et al. High-versus low-dose erythropoietin in extremely low birth weight infants. J. Pediatr. 1998;132 : 866–870.
11. Juul SE. Enterally dosed rekombinant human erythropoietin does not stimulate erythropoiesis in neonates. J. Pediatr. 2003;143 : 321–326.
12. Pasha YZ, Ahmadpour-Kacho M, et al. Enteral erythropoietin increases plasma erythropoietin level in preterm infants: a randomized controlled trial. Indian. Pediatr. 2008;45 : 25–28.
13. Ohlsson A, Aher SM. Early erythropoetin for preventing red blood cell transfusion in preterm and/or low birth weight infants. Cochrane Database Syst. Rev. 2006;3.
14. Suk KK, Dunbar JA, et al. Human recombinant erythropoietin and the incidence of retinopathy of prematurity: a multiple regression model. J AAPOS 2008;12 : 221–222.
15. Wei L, Han BH, et al. Cell death mechanism and protective effect of erythropoietin after focal ischaemia in whisker-barrel cortex of neonatal rats. J. Pharmacol. Exp. Ther. 2006;317 : 109–116.
16. Demers EJ, McPherson RJ, et al. Erythropoetin protects dopaminergic neurons and improves neurobehavioural outcomes in juvenile rats after hypoxia-ischaemia. Pediatr. Res. 2005;58 : 297–301.
17. Siddappa AM, Rao R, et al. The assesment of newborn Iron Stores at birth: A review of the literature and standards for ferritin concentrations. Neonatology 2007;92 : 73–82.
18. Rao R, Georgieff MK. Iron in fetal and neonatal nutrition. Seminars in Fetal and Neonatal Medicine 2007;12 : 54–63.
19. Agget PJ. Trace elements of the micropremie. Clin. Perinatol. 2000;27 : 119–121.
20. Aggett PJ, Agostoni C, et al. Iron metabolism and requirements in early childhood: Do we know enough? A commentary by the ESPGHAN committee on nutrition. J. Pediatr. Gastroenterol. Nutr. 2002;34 : 337–345.
21. Aher SM, Ohlsson A. Early versus late erythropoietin for preventing blood cell transfusion in preterm and/or low birth weight infants. Cochrane Database Syst. Rev. 2007;4.
22. Vento M, Vina J, et al. Erythropoietin and iron therapy for preterm infants. J. Pediatr. 1999;134 : 520.
23. The Canadian Pediatric Society. Red blood cell transfusions in newborn infants: Revised guidelines. Pediatr. Child Health 2002;7(8): 553–558.
Štítky
Neonatologie Pediatrie Praktické lékařství pro děti a dorost
Článek Komplikace varicely u dětíČlánek X. TEYSCHLŮV PEDIATRICKÝ DENČlánek XI. Hradecké pediatrické dny
Článek vyšel v časopiseČesko-slovenská pediatrie
Nejčtenější tento týden
2009 Číslo 7-8- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Syndrom Noonanové: etiologie, diagnostika a terapie
-
Všechny články tohoto čísla
- Komplikace varicely u dětí
- Úloha variací genu ABCB4 v etiologii idiopatické cholelitiázy dětského věku
- Vitamín D – nový pohľad na starý vitamín
- Terapeutické přístupy v léčbě novorozenecké anémie z nezralosti
- Intrauterinní růstová retardace a její vliv na další vývoj extrémně nezralých novorozenců
- Prenatální život z pohledu etiky
- Etický kontext tzv. „baby- boxů“
- Lázně pro děti – léčba nebo rekreace?
- X. TEYSCHLŮV PEDIATRICKÝ DEN
- XI. Hradecké pediatrické dny
- Celostátní konference dětské gastroenterologie a výživy
- Česko-slovenská pediatrie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Terapeutické přístupy v léčbě novorozenecké anémie z nezralosti
- Intrauterinní růstová retardace a její vliv na další vývoj extrémně nezralých novorozenců
- Vitamín D – nový pohľad na starý vitamín
- Komplikace varicely u dětí
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



