-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Kawasakiho choroba (40. výročí první publikace)
Kawasaki Disease (40th Anniversary of the First Publication)
Acute vasculitis of medium arteries – Kawasaki disease – is not a rare illness even in our geographical conditions, although it clearly predominates in the Japanese population. In most cases there is a spontaneous decline in clinical picture symptoms, but without any therapeutic intervention the disease represents a 20 – 25% risk of affected coronary arteries with acute and chronic consequences. The administration of high doses of immunoglobulins is clearly a method of choice, which significantly decreases the risk. The diagnostic pitfalls represent incomplete forms, especially in infants. In this age there is a greater risk of coronary lesions.
Key words:
Kawasaki disease, incomplete forms, coronary aneurysms, intravenous immunoglobulins
Autoři: J. Gut
Působiště autorů: Dětské oddělení NsP, Česká Lípa primář MUDr. J. Gut
Vyšlo v časopise: Čes-slov Pediat 2008; 63 (3): 156-163.
Kategorie: Postgraduální vzdělávání
Souhrn
Akutní vaskulitida středních arterií – Kawasakiho nemoc – není raritním onemocněním ani v našich geografických podmínkách, i když zůstává jasná predominance u japonské rasy. Ve většině případů dochází k spontánnímu ústupu klinického obrazu, ale bez léčebné intervence představuje onemocnění 20–25% riziko postižení koronárních tepen s akutními i chronickými důsledky. Aplikace vysokých dávek imunoglobulinů je jasnou metodou volby, která významně toto riziko snižuje. Diagnostickou záludnost představují inkompletní formy, zvláště v kojeneckém věku, navíc se zvýšeným rizikem koronární léze.
Klíčová slova:
Kawasakiho nemoc, inkompletní formy, koronární aneuryzmata, intravenózní imunoglobulinyÚvod
Málokterá z pediatrických nozologických jednotek vzbuzuje takovou pozornost, emoce i obavy a také tak dlouho i přes intenzivní výzkum a pečlivě vedené databáze pacientů dlouhodobě sledovaných vzdoruje klíčovému etiopatogenetickému rozluštění. Byla vlastně definována poměrně nedávno – právě před 40 lety v roce 1967 japonský pediatr Tomisaku Kawasaki poprvé publikoval svoje pozorování akutního febrilního onemocnění typu vaskulitidy postihujícího především kojence, batolata a předškolní děti všech ras po celém světě [11].
První popis v české literatuře je spojen s prací Kouřima z roku 1981 [12] a po něm byla publikována jednotlivá kazuistická sdělení [7]. Během oněch 40 let se ukázalo, že v některých lokalitách se opakovaně objevuje v malých epidemických shlucích, což neustále vrací do hry úvahy o přenosném zevním agens. Kawasakiho nemoc (KD) je jednou z nejčastějších forem vaskulitidy dětského věku (hned po Henochově-Schönleinově purpuře). Akutní onemocnění ve většině případů spontánně odeznívá bez chronického postižení [1]. Zdrojem uvedených obav je ovšem zhruba 20–25% riziko postižení koronárních arterií s možnými akutními (vzácnými, ale až katastrofickými dopady) a především dlouhodobými, resp. celoživotními následky poškozeného endotelu koronárního řečiště [3]. Tento znepokojující fakt je navíc akcentován skutečností, že stupeň koronárního postižení nekoreluje se spektrem a stupněm klinických příznaků.
V současné době ve většině rozvinutých zemí odsunula KD v žebříčku příčin získaného chronického srdečního postižení dětského věku z první pozice revmatickou horečku, jejíž incidence (alespoň typický průběh) v posledních dekádách klesá.
Epidemiologie
Kawasakiho nemoc není raritní choroba, byla a je jen mnohdy „poddiagnostikována“, skrývající se v rozpačitých diagnostických závěrech typu: nejasný protrahovaný febrilní stav, nejasný septický stav, nejasný febrilní stav s exantémem a se submandibulární lymfadenitidou, spála, Stillova nemoc, aseptická meningitida apod. Není divu, diagnóza je totiž primárně postavena na popisných příznakových kritériích, která občasně působí problémy v rozpoznání a která mohou být navíc tranzitorní. Proto by bylo asi přece jen vhodnější používat termínu syndrom než nemoc.
Na KD je třeba především znovu a znovu myslet v rámci diferenciálně diagnostické rozvahy. Původní Kawasakiho popis (mimochodem dětí bez kardiálního postižení) a opakované publikace z této oblasti nějaký čas budily dojem, že se jedná o onemocnění pro Evropu exotické a neobvyklé. Ač i po 40 letech pečlivého sledování nadále zůstává onemocněním s jasnou predominancí pro japonské děti a i pro potomky Japonců žijících mimo vlastní domovské území, tak se postupně ukázalo, že není výlučně rasově a lokalitou vázané. Roční japonská incidence se dlouhodobě pohybuje v pásmu 100–120 případů na 100 000 dětí mladších 5 let, zatímco u japonských dětí téže věkové kategorie žijících na americkém kontinentu okolo 30. Naproti tomu roční incidence bílých amerických vrstevníků se pohybuje kolem 9/100 000 dětí.
Kdybychom čistě aritmeticky transponovali tato americká čísla na naši populaci, pak bychom měli ročně diagnostikovat zhruba 40–50 nových případů u dětí mladších 5 let. Děti mladší 5 let tvoří typickou rizikovou skupinu, protože se v ní vyskytuje 80–90 % případů KD [9, 18]. Malé procento případů se objevuje i u starších dětí a tito jedinci podobně jako kojenci mladší půl roku vykazují podstatně vyšší riziko kardiálních komplikací [5, 9, 16, 21]. V literatuře je publikováno dokonce několik desítek případů KD u dospívajících a dospělých jedinců a na druhé straně byly raritně popsány i případy novorozeneckého věku [11]. Ve velkých sestavách mírně převažují chlapci v poměru 1,5 : 1. Byl zaznamenán i výskyt v úzkém rodinném vztahu, dokonce i u dvojčat, a případy s rekurentním průběhem. Na základě velkých japonských databází je uváděna mortalita akutní fáze nižší než 1 promile, ovšem celková mortalita včetně pozdních následků koronárních aneuryzmat je podstatnější vyšší: okolo 2 %.
Etiopatogeneze
KD je akutní vaskulitida se spontánně regredujícím průběhem (self limited), ale s možnou chronickou zánětlivou destrukcí cévní stěny. Etiologie KD i přes vynaložené úsilí zůstává v rovině obecných obrysů. KD je řazena do skupiny vaskulitid postihujících arterie středního kalibru, resp. do okruhu polyarteriitis nodosa, se kterou sdílí řadu podobných znaků.
Epidemiologická data (mikroepidemie, výskyt u sourozenců, nahromadění výskytu v zimních a časných jarních měsících) vzbuzují podezření na možné zevní přenosné agens, i když je málo pravděpodobné, že by se mohlo jednat o interpersonální přenos. Zdá se, že zevní agens je schopné spouštět imunitní kaskádu ve vulnerabilním období útlého věku. Byla testována celá řada potenciálních vyvolavatelů chemických (toxiny, pesticidy, čisticí prostředky, těžké kovy) i infekčních (plísně, viry, bakterie), ale zatím bez jednoznačného závěru. Na přelomu století velká očekávání vzbuzovala možnost vzniku onemocnění v důsledku polyklonální aktivace lymfocytů cestou superantigenů produkovaných stafylokokovými nebo streptokokovými kmeny (dokonce byly publikovány práce, které nacházely podobné imunitní změny i u pacientů s KD), ale i tato hypotéza je dnes více méně opuštěna. Jednoznačná rasová predispozice ukazuje ke geneticky podmíněné senzitivitě.
Momentální představa by se snad dala shrnout takto: Za KD stojí exogenní přenositelné agens (respektive různá agens) a genetická predispozice ve věkově podmíněném vulnerabilním období [3, 14, 18].
Ačkoliv vaskulitida koronárních tepen je klinicky zpravidla dominantním (a právem obávaným) postižením, KD je generalizovanou vaskulitidou, o čemž svědčí publikované případy s aneuryzmaty nejrůznějších tepen (brachiální, axilární, renální, mezenteriální…). Pozoruhodným, zcela recentním nálezem, který vyvolává nové otazníky nad relativní benigností onemocnění, je průkaz vysokého procenta chronických jizev ledvinného parenchymu detekovaných pomocí DMSA skenu u pacientů po prodělané KD bez současné bakteriální infekce močového systému [24].
Klinická diagnóza
Diagnóza KD je postavena na výskytu příznaků jednak z užšího souboru klinických i laboratorních („typických“) kritérií, ale také ze širšího okruhu možných příznaků a nálezů (tab. 1 a 2). Opora v laboratorních nálezech, zvláště v úvodní fázi, je poměrně malá (tab. 3). Díky širokému spektru nespecifických souběžných příznaků a nálezů je definitivní diagnóza leckdy s ohledem na terapeutický postup „závěrem opožděným“ a per exclusionem [1, 18].
Tab. 1. Klasická kritéria Kawasakiho choroby. 
Tab. 2. Další možné klinické projevy Kawasakiho choroby. 
Tab. 3. Laboratorní nálezy akutní fáze Kawasakiho choroby. 
Z výčtu příznaků je zjevné, že nejtypičtějším z nich je febrilní stav u kojence, batolete či předškolního dítěte. Je charakterizován septickými špičkami dosahujícími 39–40 ºC, které mnohdy špatně reagují na antipyretika. Febrilní stav je obvykle v počátku provázen chudým klinickým obrazem. Dítě může být zvláště v mezidobí mezi febrilními špičkami v překvapivě dobrém stavu. Leckdy je febrilní stav provázen nespecifickými příznaky (zvracení, průjem, myalgie, artralgie, meningismus, lymfadenitida, prchavý exantém). Situace zpravidla vede k laboratornímu pátrání po příčině, které může přinést nález výrazné aktivace zánětlivých markerů a nespecifických odchylek (sterilní leukocyturie – uretrálního i ledvinného původu, elevace transamináz, pleiocytóza v moku) a tím vyvolává tlak na aplikaci širokospektrálních antibiotik před definitivními výsledky kultivačních vyšetření (moči, krve, likvoru). Opora v laboratorních a často i v klinických nálezech je v prvním týdnu malá a nespecifická. Trombocytóza (často přesahující hodnoty 1 000 000/mm3), která je typickým patologickým nálezem u KD, se objevuje obvykle až ve druhém týdnu febrilního stavu.
Iniciální pracovní diagnóza pak může znít akutní pyelonefritida, aseptická meningitida, sepse, okultní bakteriémie, lymfadenitida submandibulární, akutní gastroenteritida. Po změnách na sliznicích, kůži a spojivkách je třeba každodenně pečlivě pátrat. Mnohdy teprve trvající febrilní stav bez odezvy na širokospektrální, někdy i vyměňovaná ATB začíná vzbuzovat podezření na jinou než infekční etiologii. Toto podezření navíc umocňují negativní nálezy kultivačních vyšetření, neklesající respektive stoupající zánětlivé markery, objevení se trombocytózy ve 2. týdnu febrilií. Zvláštnost KD spočívá v její spontánní klinické remisi, byly zaznamenány jen zcela ojedinělé případy s přetrvávajícím febrilním stavem déle než 20 dní, a to i bez léčebného zásahu. Nakonec i u jedinců s významným postižením koronárních arterií klesají febrilie po 3. týdnu. Ač protrahovaný febrilní stav je nejkonstantnějším příznakem, zcela vzácně byly popsány případy s nevýraznými hodnotami teplot a krátkého trvání. Kožní změny jsou zpravidla časné, někdy jen tranzitorní a navíc polymorfní (rash, makulární nebo morbiliformní exantém až velkoskvrnitý výsev). Vezikulózní či bulózní výsev byl popsán zcela raritně [13]. Změny na spojivkách podobně jako změny na sliznici dutiny ústní (mukositida) se objevují v prvních dnech, naopak změny na akrech končetin se objevují až v delším průběhu (nejprve dochází k indurovanému edému dorzálních ploch rukou a nohou a difuznímu zarudnutí dlaní a plosek, které v rekonvalescentní fázi přechází v olupovaní kůže).
Echokardiografie
Při podezření na KD sehrává klíčovou roli včasná indikace k echokardiografickému vyšetření, leckdy i opakovanému. Vyšetření by mělo být provedeno zkušeným echokardiografistou a za dobrých podmínek, někdy i při sedaci midazolamem nebo chloralhydrátem. Při vyšetření je nutné posouzení přítomnosti perikardiální efúze, funkční zdatnosti myokardu, funkčního stavu chlopní a především zobrazení pravé (RCA), levé hlavní (LMCA) a levé přední descendentní (LAD) koronární arterie a stanovení jejich průměru. Je třeba mít na paměti, že pomocí echokardiografie jsou zpravidla přehledné jen krátké úseky v odstupu koronárních arterií, které sice bývají nejčastěji postižené, ale aneuryzmata v distálních částech arterií jsou tomuto vyšetření obvykle nedostupná. Zcela nové možnosti se v tomto směru v některých indikacích otevírají pomocí MRI angiografie a spirální CT angiografie.
Patologické echokardiografické změny koronárních tepen jsou vzácně prokazatelné před 10. dnem průběhu onemocnění a stejně tak je nepravděpodobný jejich nález na opačném konci po 28. dni od počátku febrilie. Aneuryzmatická rozšíření jsou popisována dvojího typu – sakulární (vakovitá) a fuziformní (vřetenitá). V případě rozšíření průměru koronárních tepen nad rozměry příslušnými dané normě bez typického obrazu aneuryzmatu pak mluvíme o ektázii. Orientačně jsou aneuryzmata do průměru 5 mm označována jako malá, mezi 5–8 mm jako střední a nad 8 mm jako velká. Konkrétní rozměr je ovšem třeba vztahovat na normy dané věkové skupiny (respektive na tělesný povrch, viz obr. 1). Nález patologických změn koronárních tepen radikálním způsobem obrací nejen diagnostické, ale především terapeutické kroky. Řada studií se zabývala hledáním prediktivních rizikových faktorů pro postižení koronárních arterií, které by se daly v současné době shrnout následovně: věk pod 1 rok, perzistentní nebo rekurentní horečka déle než 14 dní, anémie pod 100 g/l, leukocytóza přes 30 000/mm3, perzistentní FW nad 100 za hodinu [16, 17].
Diferenciální diagnóza
Už byly zmíněny některé jednotky, které mohou být s KD zaměňovány: virové infekty (morbilli, exantémové nemoci), lékové reakce typu syndromu Stevensova-Johnsonova, systémové formy revmatoidní artritidy SOJIA (Systemic Onset Juvenile Idiopathic Arthritis), stafylokokový toxický syndrom SSSS (Staphylococcal Scalded Skin Syndrome), septické stavy.
Inkompletní formy (IF)
Už tak svízelná diagnostická situace je komplikována skutečností, že u některých pacientů nemůžeme zaznamenat dostatečný počet tzv. klasických kritérií uvedených v tabulce 1 (mimo nejasný febrilní stav). Dokonce v některých případech lze spolehlivě prokázat v akutní fázi pouze 1 či 2 z těchto kritérií a jsou známy případy febrilních dětí i s postižením koronárních cév bez dalších příznaků. V nomenklatuře byl zaveden pro tyto jedince pojem inkompletní forma KD, které podle japonských přehledů tvoří asi 10 % všech případů. Nejméně často vyskytujícím se příznakem u IF je lymfadenitida [5, 8, 9, 15]. Zvláštní pozornost je třeba věnovat febrilním dětem mladším 6 měsíců, u kterých je riziko IF několikanásobně vyšší než u starších dětí (45 % versus 12 % u starších). Tato skutečnost je navíc umocněna zjištěním, že riziko koronárního postižení je také podstatně vyšší právě u kojenců, zvláště mladších 6 měsíců (60–70 % versus 9 % u starších).
A proto je třeba myslet na KD u každého kojence s nejasným febrilním stavem trvajícím déle než 5 dní při přítomností 2–3 z klasických příznaků, resp. u každého febrilního kojence bez jakýchkoliv dalších příznaků s nevysvětlitelnou horečkou trvající déle než 7 dní (s CRP nad 30 mg/l a FW nad 40/hod). Za této situace je plně indikováno echokardiografické vyšetření [15, 16].
V literatuře se objevuje ještě také termín atypická forma KD, ten je v současné době vyhrazen pro ty případy, u kterých se vyskytují v klinickém spektru projevy výrazně neobvyklé, např. parézy periferních nervů, akutní selhání ledvin nebo purulentní submandibulární lymfadenitida.
Postup po stanovení diagnózy KD
Snaha utlumit aktivované zánětlivé kaskády vedla již v 70. a 80. letech k zavedení aplikace kortikoidů v různém stupni dávkování do léčebných schémat, jejich význam pohasl v polovině 80. let, ale nové snahy o využití kortikoidů v léčbě KD by se daly nazvat evergreenem i v dalších desetiletích.
Intravenózní gamaglobuliny
Zlomový okamžik v terapii KD nastal v roce 1984 uveřejněním práce Furusha a spol., kteří přesvědčivě prokázali efekt vysokých dávek intravenózních imunoglobulinů (IVIG) jak na klinický průběh (ukončení a zkrácení doby febrilie), tak ale hlavně na podstatné snížení rizika postižení koronárních tepen [6]. Teploty po aplikaci IVIG klesají často během několika hodin. Časná aplikace IVIG během prvních 10 dnů horečky významně snižuje riziko postižení koronárního řečiště (z původních 20–25 % u neléčených na zhruba 5 % – především přechodné tepenné ektázie – a dokonce na pouhé 1 % klesá riziko vzniku velkého aneuryzmatu). Furushovy závěry byly opakovaně potvrzeny novými studiemi v USA, Japonsku i v Evropě. Několik rozsáhlých studií hledalo optimální stanovení celkové dávky IVIG i léčebného schématu (jednorázová dávka, dvou - nebo čtyřdenní aplikace).
V současné době mezinárodní konsensus doporučuje jednorázovou aplikaci 2000 mg/kg IVIG nejlépe v průběhu prvních 10 dní (ještě lépe v průběhu prvních 7 dní). Doporučuje se však podat IVIG i po tomto termínu, pokud byla diagnóza spolehlivě stanovena [2, 4, 16, 18, 20, 22, 23]. V případech bez adekvátní klinické odezvy (asi v 10 % případů chybí klinická odpověď na podání 1. dávky IVIG) je možno zvážit aplikaci stejně velké druhé, případně třetí dávky. Pro velmi malou skupinu dětí zcela neodpovídajících na IVIG jsou hledány další alternativy, zatím však bez jednoznačných závěrů. Mechanismus účinku IVIG zůstává v rovině spekulací, uvažuje se o blokádě a neutralizaci toxinů, superantigenů, blokádě cytokinů, aktivaci supresorových T lymfocytů, uvolnění antiidiotypových protilátek. Nicméně použití IVIG v léčbě KD je v současné době nezpochybňovanou indikací, vedle kritických stavů při idiopatické trombocytopenii, polyradikuloneuritidě typu Guillan-Barrého a několika onkohematologických indikací [14].
Po podání tak velkých dávek IVIG je nutno počítat s modifikací očkovacího kalendáře.
Antiagregační léčba
Kyselina acetylsalicylová (ASA) byla jako první lék zavedena do základních schémat pro svoje protizánětlivé, ale následně především pro antiagregační účinky, ačkoliv tyto dva efekty se liší v závislosti na výši podané dávky (antiagregační nízká dávka versus protizánětlivá vysoká dávka). Nebylo však zatím prokázáno, že by ASA byla schopna sama o sobě zásadním způsobem ovlivnit vznik koronárních změn. Ve stávajících schématech je podávání ASA doporučováno jako doplněk k aplikaci IVIG, v úvodní fázi ve vysokých dávkách 80–100 mg/kg s přechodem na antiagregační malou dávku 3–5 mg/kg. Načasování přechodu na sníženou dávku se v různých doporučeních liší od časného (2–3 dny po poklesu febrilie) až po pozdní (14 dní po poklesu febrilie). U jedinců s koronárním postižením se pak antiagregačně dávkovaná ASA stává dlouhodobou léčbou [18, 23]. Nutno však připustit, že tato doporučení mají jen malou oporu v kontrolovaných studiích.
Potenciální riziko vzniku Reyova syndromu při dlouhodobém podávání ASA není vysoké, ale nelze ho zcela opomíjet, o čemž svědčí ojedinělá pozorování.
Kortikoidy
Jak bylo uvedeno, otázka aplikace kortikoidů (KS) byla a je v průběhu 40 let opakovaně diskutována a bylo hledáno jejich místo v léčebných schématech. Zdá se, že z pozice léku první volby byly definitivně odsunuty.
Recentní, velká, multicentrická randomizovaná studie koordinovaná J. Newburgerovou ukončila dlouhodobé diskuse, protože nepotvrdila ani jejich aditivní efekt k aplikaci IVIG v úvodním léčebném kroku [19] ve srovnání s aplikací pouhých IVIG. Na druhé straně některé práce naznačují možný prospěch aplikace metylprednisolonového pulzu u pacientů nereagujících na iniciální podání IVIG. Dá se předpokládat, že diskuse kolem kortikoidů ještě neskončily.
Další možnosti
V literatuře se opakovaně objevují zprávy o použití pentoxyfilinu (blokátor transkripce mRNA pro TNF-alfa), imunosupresiv a cytostatik (cyklosporin A, cyklofosfamid), monoklonálních protilátek proti cytokinům, biologickým lékům (ulinastatin – inhibitor neutrofilové elastázy, abciximab – inhibitor destičkových glykoproteinových receptorů) a plazmaferézy.
Jsou zpravidla zkoušeny u pacientů rezistentních na IVIG a tak je velmi obtížné porovnávat efekt v kontrolovaných studiích a závěry jsou spíše anekdotálního charakteru [18].
Preventivní léčba u pacientů s koronárním postižením
Není-li prokázáno postižení koronárních arterií ani při opakovaných echokardiografických kontrolách, pak antiagregační podávání ASA lze ukončit po 2 měsících od počátku nemoci. Zcela jiná situace však vzniká při průkazu koronární patologie, kde antiagregační dlouhodobá preventivní léčba je základním postupem, i když její optimální nastavení není opřeno o data ze spolehlivých kontrolovaných studií. Jde pouze o empirické údaje. Stupeň této prevence je modifikován podle tíže koronárního postižení, základem je ASA, případně kombinovaná s blokátory destičkové agregace – clopidogrelem nebo dipyridamolem nebo s antikoagulačními léky – nízkomolekulárním heparinem nebo warfarinem.
Nejčastější variantou u velkých aneuryzmat je kombinace nízkodávkované ASA s warfarinem při udržování INR Quickova testu mezi 2,0–2,5. U malých dětí pro technické problémy s nastavením antikoagulační léčby je metodou volby v této kombinaci dlouhodobá aplikace nízkomolekulárního heparinu (s kontrolou efektivního nastavení podle hodnoty antifaktoru Xa).
Speciální problematiku tvoří průkaz tvořícího se trombu v aneuryzmatu, který může rychle progredovat. Na druhé straně tromby při KD nevykazují vysoké riziko nestability s možností ruptury a zánětu jako tromby aterosklerotické. Léčebné možnosti v podobě streptokinázy, urokinázy nebo tPA (tkáňový plazminogenový aktivátor) byly využity i u některých malých dětí.
Pro malou část pacientů jsou pak vyhrazeny katetrizační a kardiochirurgické intervence. A pro jednotlivé pacienty s těžkým postižením myokardu, ventrikulárními dysrytmiemi, srdečním selháním a těžkými koronárními lézemi může být jedinou metodou volby transplantace srdce [18].
Dlouhodobý vývoj koronárních patologií
Léze koronárních arterií procházejí výraznými změnami po odeznění akutní fáze. Asi 50 % aneuryzmat, zvláště malého rozsahu, má tendenci ke spontánní regresi. Pravidelnými echokardiografickými kontrolami je nutno sledovat dynamické změny, včetně včasného záchytu tvorby trombu nebo přechodu do stenózy. Vedle echokardiografie zůstává ke zvážení v indikovaných případech provedení koronarografie zvláště v případech s uvažovanou katetrizační intervencí.
Pokroky v oblasti NMR a spirálního CT otevírají možnosti neinvazivního sledování dynamických změn koronárních lézí i u dětí. I přes poměrně příznivou dlouhodobou prognózu zůstává řada nezodpovězených otázek ohledně dlouhodobého vývoje v dospělosti, a to i pro jedince bez prokázaných akutních koronárních změn. Dlouhodobé osudy přechodného koronárního postižení jsou stále předmětem vyhodnocování. Některé práce naznačují, že prodělání KD i s prokázaným přechodným koronárním postižením nemusí představovat rizikový faktor do dospělosti.
Kazuistika inkompletní formy KD
U dosud zdravého 4měsíčního děvčátka s negativní rodinnou i perinatální anamnézou, prospívajícího, dosud kojeného, se objevily febrilní špičky 39–39,5 ºC. Dítě nejevilo známky respiračního infektu (bez kašle, rýmy, zvracení, průjmu). V mezidobí při poklesu teploty bylo děvčátko spokojené, bez celkové alterace.
První den febrilií byl rodiči zaznamenán prchavý, několikahodinový drobnoskvrnitý makulózní exantém po trupu. Po vyšetření u svého PLDD byl 3. den nasazen penicilin bez laboratorního vyšetřování a při negativním somatickém nálezu. Pro neustupující febrilie bylo dítě 6. den odesláno k hospitalizaci pro nejasný febrilní stav.
Při vyšetření bylo děvčátko bez alterace celkového stavu, afebrilní, s čistou kůží, beze změn na akrech končetin, s klidnými spojivkami, pouze s nálezem lehce zarudlých patrových oblouků bez povlaků na tonzilách, bez zvětšených krčních a submandibulárních uzlin, s čistým dýcháním, s dvěma ohraničenými ozvy, bez hepatosplenomegalie, ameningeální. V úvodní laboratoři nalezena jen lehce vyšší FW 26/60, mírná leukocytóza 15 800/mm3 bez posunu doleva, počet trombocytů 617 000/mm3, s normálními hodnotami jaterních transamináz, s normálním močovým sedimentem. Rtg snímek plic byl bez patologického nálezu. Byly odebrány vzorky moči a krve a stěry z tonzil na kultivační vyšetření. Při ultrazvukovém vyšetření zastižena drobná efúze v perikardu (4 mm) a v Douglasově prostoru při echokardiografickém normálním nálezu na koronárních tepnách. Vzhledem k dobrému stavu a mírné aktivaci zánětlivých markerů bylo změněno ATB na cefuroxim.
Během následujících 5 dní se objevují v průběhu dne 2–3 febrilní špičky 39 ºC bez výraznější alterace, mimo tyto špičky je pacientka spokojená a klidná, pije dobře. Během této doby je také opakovaně kontrolována laboratoř a bylo pátráno po další možné etiologii. EKG je opakovaně negativní. Výsledky kultivací docházejí jako negativní. Opakovaně bylo pečlivě klinicky pátráno po kožních a slizničních změnách s negativním výsledkem. Přehled vývoje laboratorních nálezů zachycuje tabulka 4.
Tab. 4. Přehled vývoje laboratorních nálezů. 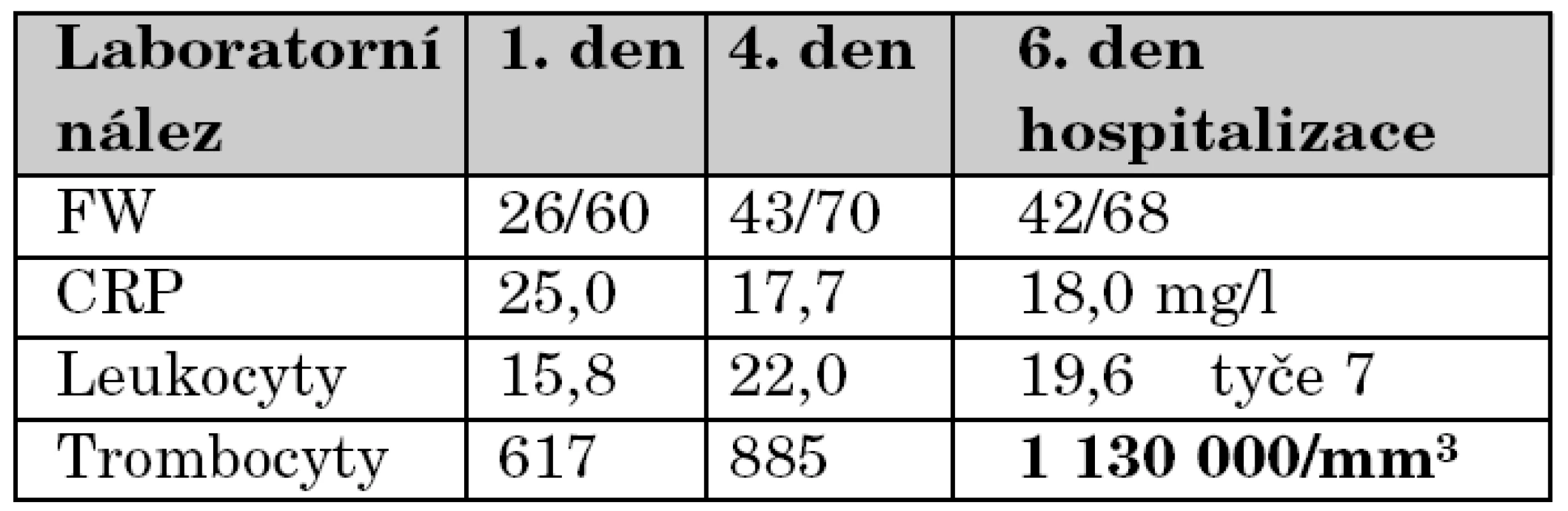
Šestý den pobytu při zjištění vzestupu trombocytózy bylo opakováno echokardiografické vyšetření, při němž byla prokázána výrazná vřetenovitá dilatace hlavního kmene levé koronární arterie 6 mm (95. percentil normy pro daný tělesný povrch je 2,5 mm), viz obrázky 1 a 2. Bylo vysloveno podezření na inkompletní formu KD a podána dávka 2000 mg/kg IVIG s promptním a trvalým poklesem teplot a zahájena aplikace útočné dávky ASA s následným přechodem na dlouhodobou antiagregační léčbu. Během následujících 2 týdnů dochází k pozvolné normalizaci zánětlivých markerů, počtu trombocytů a částečné regresi dilatace koronární arterie. Vzhledem k předpokládané obtížně nastavitelné antikoagulační léčbě cestou warfarinizace bylo děvčátko převedeno na dlouhodobou fraxiparinizaci. Dávka byla vyladěna monitorací antifaktoru aktivovaného X faktoru. Dívka zůstává nadále zcela bez obtíží a prospívá.
Obr. 1. Fuziformní aneuryzma hlavního kmene levé koronární arterie. Fig. 1. Fusiform aneurysms of the main stem of the left coronary artery. 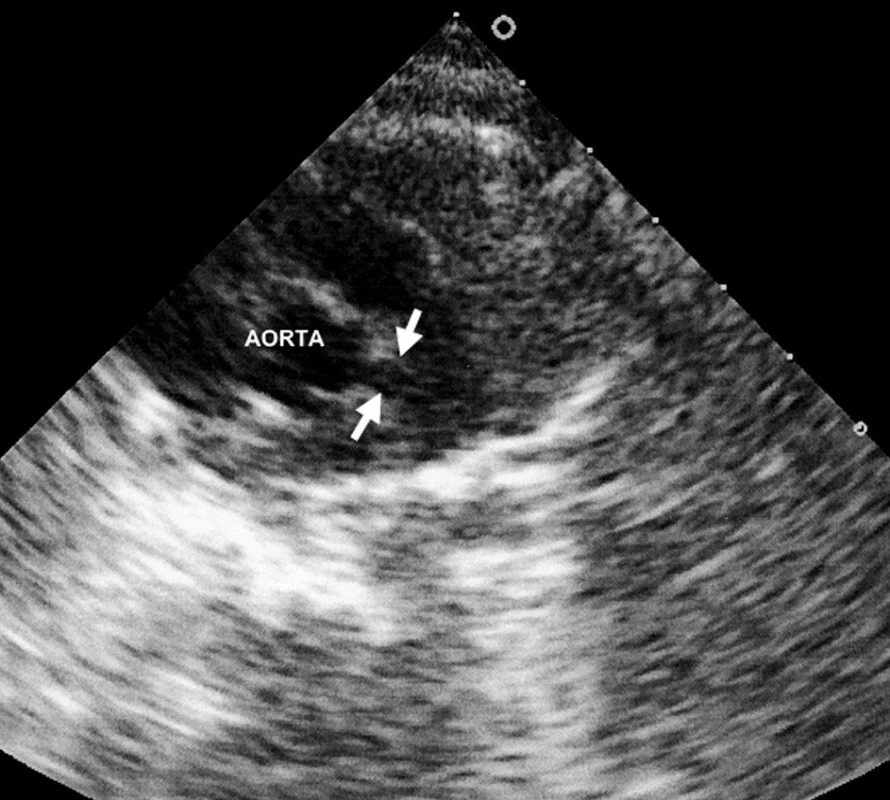
Obr. 2. Šíře hlavního kmene levé koronární arterie (LMCA) vztažená na povrch těla (BSA). Fig. 2. Range of the main stem of the left coronary artery (LMCA) with relation to body (BSA). 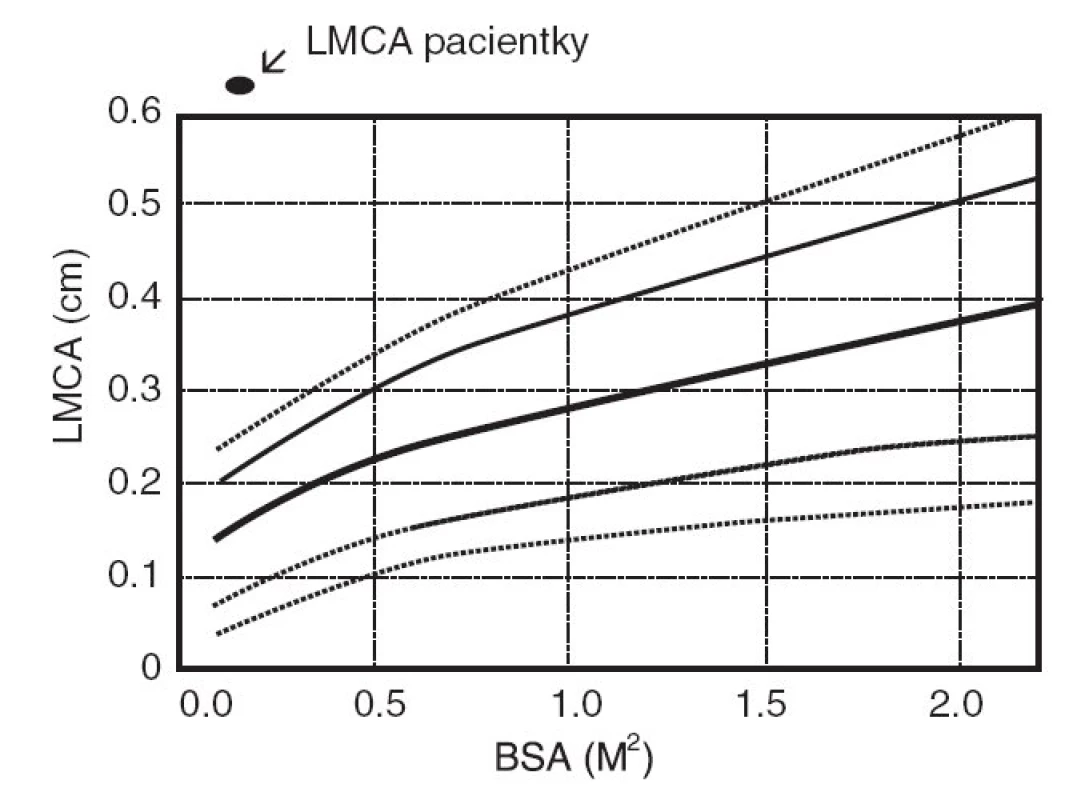
Podle následných echokardiografických kontrol se šíře levé arterie vrací téměř do normy, ale kontura endotelu je nepravidelná s kalcifikací stěny v rozsahu 6 mm, beze známek stenózy. Proto zůstává nutnost dlouhodobé antiagregační a antikoagulační léčby, pravidelné echokardiografické monitorace s plánovaným zobrazením koronárních arterií pomocí MRI angiografie. Teprve 4. týden od počátku onemocnění se u dívenky objevilo povrchové olupování kůže začínající od konečků prstů.
Stav lze zcela jednoznačně uzavřít jako inkompletní formu Kawasakiho nemoci s aneuryzmatickým postižením hlavního kmene levé koronární arterie. Z klasických příznaků byly zastiženy: nejasný febrilní stav, prchavý několikahodinový exantém a následná deskvamace akrálních partií prstů. Vzhledem k prchavému exantému první den teplot je možno v akutní fázi označit tento průběh prakticky jako monosymptomatický.
Uvedený případ velmi názorně ilustruje záludnost klinického obrazu KD v kojeneckém věku akcentovaný zvýšeným rizikem koronární vaskulitidy.
Závěr
Přestože u většiny pacientů s KD se jedná o self-limited vaskulitidu, tak u 25 % pacientů je reálné riziko koronárního postižení s akutními a dlouhodobými komplikacemi. Toto riziko je z velké části odvratitelné včasnou aplikací IVIG. U léčených pacientů se objevuje endoteliální léze jen asi v 5 %. Malá část pacientů zůstává refrakterní na tento standardizovaný léčebný postup.
Inkompletní formy malých kojenců se zvýšeným koronárním rizikem zůstávají noční pediatrickou můrou a je třeba na KD myslet a v případě nevyjasněných febrilních stavů včas zvážit indikaci k echokardiografickému (někdy i opakovanému) vyšetření.
Poděkování za odbornou pomoc a echokardiografickou dokumentaci doc. MUDr. J. Homolovi, CSc., a Dr. J. Popelkovi.
Došlo: 7. 7. 2007
Přijato: 30. 12. 2007
Prim. MUDr. Josef Gut
Dětské oddělení NsP
Purkyňova 1849
470 01 Česká Lípa
e-mail: josef.gut@nemcl.cz
Redakční poznámka: Kontrolní otázky k tomuto článku jsou uveřejněny na vložené příloze v tomto čísle.
Zdroje
1. Deodoglu F, Sundel R. Vasculitis in children. Pediatr. Clin. North. Am. 2005;52 : 547–575.
2. Duronggpisistkul K, et al. The prevention of coronary aneurysm in Kawasaki disease. A metanalysis on the efficacy of aspirin and imunoglobulin treatment. Pediatrics 1995;96 : 1057–1061.
3. Fischer P, Uttenreuther-Fischer M. Kawasaki disease: update on diagnosis, treatment and a still controversial etiology. Ped. Hematol. Oncol. 1996;13 : 487–501.
4. Fukunishi M, et al. Prediction of non responsiveness to intravenous high dose gamma globulin therapy in patients with Kawasaki disease at onset. J. Pediatr. 2000;137 : 172–176.
5. Fukushige J, Takahashi N, Ueda Y. Incidence and clinical features of incomplete Kawasaki disease. Acta Pediatr. Scand. 1994;83 : 1057–1060.
6. Furusho K, et al. High dose intravenous gamma globulin for Kawasaki disease. Lancet 1984;2 : 184–192.
7. Gut J. Quo vadis, Kawasaki, v roce 1994. Čes.-slov. Pediat. 1995;9 : 538–542.
8. Helin I, Oskarson G. Prolonged fever, thrombocytosis and coronary aneurysma – incomplete Kawasaki disease or separate entity? Eur. J. Pediatrics 1998;157 : 473–474.
9. Chang FY, Hwang B, et al. Characteristics of Kawasaki disease in infants younger than six months. Pediatr. Infect. Dis. J. 2006;25(3): 241–244.
10. Kawasaki T. Acute febrile mucocutaneous syndrome: clinical observation of 50 cases. Jpn J. Allergy 1967;16 : 178–222.
11. Kogulan P, Mbualungu E, Villanueva E, et al. Kawasaki syndrome in an adult. Case report and review of the literature. J. Clin. Rheumatol. 2001;7 : 194–198.
12. Kouřim J, Schlegerová D. Kawasakiho syndrom a infantilní polyarteriitis nodosa. Čs. Pediat. 1981;36(2): 79–82.
13. Kuijpers TW. A boy with chickenpox whose fingers peeled. Lancet 1998;351 : 1782.
14. Leung D. Kawasaki disease. Curr. Opin. Rheumatol. 1993;5 : 41–50.
15. McMaster P. Is it Kawasaki disease? J. Pediatr. Child. Health 2000;36 : 506–508.
16. Mori M, et al. Predictors of coronary artery lesions after intravenous gammaglobulin treatment in Kawasaki disease. J. Pediatr. 2000;137 : 177–180.
17. Newburger JW. Kawasaki disease: Who is at risk? J. Pediatr. 2000;137 : 149–152.
18. Newburger JW, et al. Diagnosis, treatment and long term managment of Kawasaki disease. A statement for health professionals from Committee on Rheumatic Fever, Endocarditis and Kawasaki Disease 2004. Council on Cardiovascular Disease in the Young, American Heart Association.
19. Newburger JW, Sleeper L, McCrindle BW, et Pediatric Heart Network Investigators. Randomized trial of pulsed corticosteroid therapy for primary treatment of Kawasaki disease. N. Engl. J. Med. 2007;356 : 663–675.
20. Oates-Whitehead RM, et al. Intravenous gamma globulin for the treatment of Kawasaki disease. Cochrane Database Syst. Rev. 2003;(4): CD004000.
21. Stanley TV, Grimwood K. Classical Kawasaki disease in neonate. Arch. Dis. Child. 2002;86(2): 135–136.
22. Sundel R, Burns J, Baker A, Newburger J. Gamma globulin retreatment in Kawasaki disease. J. Pediatr. 1993;123 : 657–659.
23. Terai M, Hulman S. Prevalence of coronary artery abnormalities in Kawasaki disease is highly dependend on gamma globulin but independent of salicylate dose. J. Pediatr. 1997;131 : 888–893.
24. Wang J, Chiou Y, Chiu N, Chen M. Renal scarring sequelae in childhood Kawasaki disease. Pediatr. Nephrol. 2007;22(5): 684–689.
Štítky
Neonatologie Pediatrie Praktické lékařství pro děti a dorost
Článek Sauna a děti
Článek vyšel v časopiseČesko-slovenská pediatrie
Nejčtenější tento týden
2008 Číslo 3- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Syndrom Noonanové: etiologie, diagnostika a terapie
-
Všechny články tohoto čísla
- Panu profesoru MUDr. Václavu Tošovskému s úctou a poděkováním
- K práci Dr. Guta – Kawasakiho choroba
- Výskyt nadváhy a obezity u 7427 českých dětí vyšetřených v roce 2006
- Závislost dětských úrazů na úrazovosti rodičů
- Tularémie: vzácná příčina horečky a lymfadenopatie v kojeneckém věku
- Plazmaferéza a imunoadsorpce v pediatrii
- Kawasakiho choroba (40. výročí první publikace)
- Diagnostika a léčba dyslipidémií u dětí a dospívajících Doporučení pro diagnostiku a léčbu dyslipidémií u dětí a dospívajících vypracované výborem České společnosti pro aterosklerózu
- Správné odpovědi na kontrolní otázky k doškolovacímu článku Hrdlička M., Dudová I.: Dětský autismus jako modelová porucha se sociálním deficitem (č. 11/2007)
- Sauna a děti
- VIII. ČESKÝ PEDIATRICKÝ KONGRES S MEZINÁRODNÍ ÚČASTÍ
- Česko-slovenská pediatrie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Tularémie: vzácná příčina horečky a lymfadenopatie v kojeneckém věku
- Plazmaferéza a imunoadsorpce v pediatrii
- Diagnostika a léčba dyslipidémií u dětí a dospívajících Doporučení pro diagnostiku a léčbu dyslipidémií u dětí a dospívajících vypracované výborem České společnosti pro aterosklerózu
- Kawasakiho choroba (40. výročí první publikace)
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



