-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Plazmaferéza a imunoadsorpce v pediatrii
Plasmapheresis and Immunoadsorption in Pediatrics
The article deals with plasmapheresis and immunoadsorption at the child age. It describes the indications, contraindications, untoward effects and technical aspects of the methods and offers evaluation of more recent, selective and patient-friendly immunoadsorption as compared with classical plasmapheresis. Whereas plasmapheresis is an already established method, immunoadsorption represents a therapeutic possibility, which is relatively new for pediatrics and its use has been continuously given increasing precision.
At the present time the main indications of immunoadsorption include the group of autoimmune diseases and diseases with presumed immunological etiological participation (for example dilatation cardiomyopathy, hemophilia with inhibitors, thrombotic thrombocytopenic purpura, rheumatoid arthritis), metabolic diseases (LDL apheresis in familial hypercholesterolemia) and the application in transplantology (for instance organ transplantation with HLA hyperimmunization, and reaction of the graft against the host).Key words:
plasmapheresis, immunoadsorption, children
Autoři: F. Fencl; T. Seeman; E. Šimková; J. Janda
Působiště autorů: Pediatrická klinika UK 2. LF a FN Motol, Praha přednosta prof. MUDr. J. Lebl, CSc.
Vyšlo v časopise: Čes-slov Pediat 2008; 63 (3): 148-155.
Kategorie: Přehledový článek
Souhrn
Článek se zabývá plazmaferézou a imunoadsorpcí v dětském věku. Popisuje indikace, kontraindikace, nežádoucí účinky a technické provedení obou metod, snaží se zhodnotit přínos novější, selektivnější a vůči pacientovi šetrnější imunoadsorpce ve srovnání s klasickou plazmaferézou. Zatímco plazmaferéza je již zavedenou léčebnou metodou, imunoadsorpce představuje v pediatrii poměrně novou léčebnou možnost a její použití se stále upřesňuje.
V současné době patří mezi hlavní indikace imunoadsorpce především skupina autoimunitních onemocnění a onemocnění s předpokládaným imunologickým etiologickým podílem (například dilatační kadiomyopatie, hemofilie s inhibitory, trombotická trombocytopenická purpura, revmatoidní artritida), metabolická onemocnění (LDL aferéza u familiární hypercholesterolémie) a použití v transplantologii (například orgánové transplantace s HLA hyperimunizací, reakce štěpu proti hostiteli).Klíčová slova:
plazmaferéza, imunoadsorpce, dětiÚvod
Autoři referují o použití dvou eliminačních metod v pediatrii. Zatímco plazmaferéza je uznávanou léčebnou metodou a její použití u dětí se spíše jen upřesňuje, je imunoadsorpce v tomto věkovém období metodou relativně novou. Pro svou přístrojovou a provozní náročnost se řada indikací zatím ještě diskutuje, chybí kontrolované studie prokazující jednoznačně její přednosti a také cost/benefit efekt. Z léčebného hlediska jde ovšem o metodu daleko logičtější, než je plazmaferéza, z plazmy se eliminuje skutečně cíleně jen její malá část. Vzhledem k tomu, že speciální přístrojové vybavení pro děti je v ČR dnes již k dispozici, považujeme za přínosné na to pediatrickou veřejnost upozornit.
I. Plazmaferéza
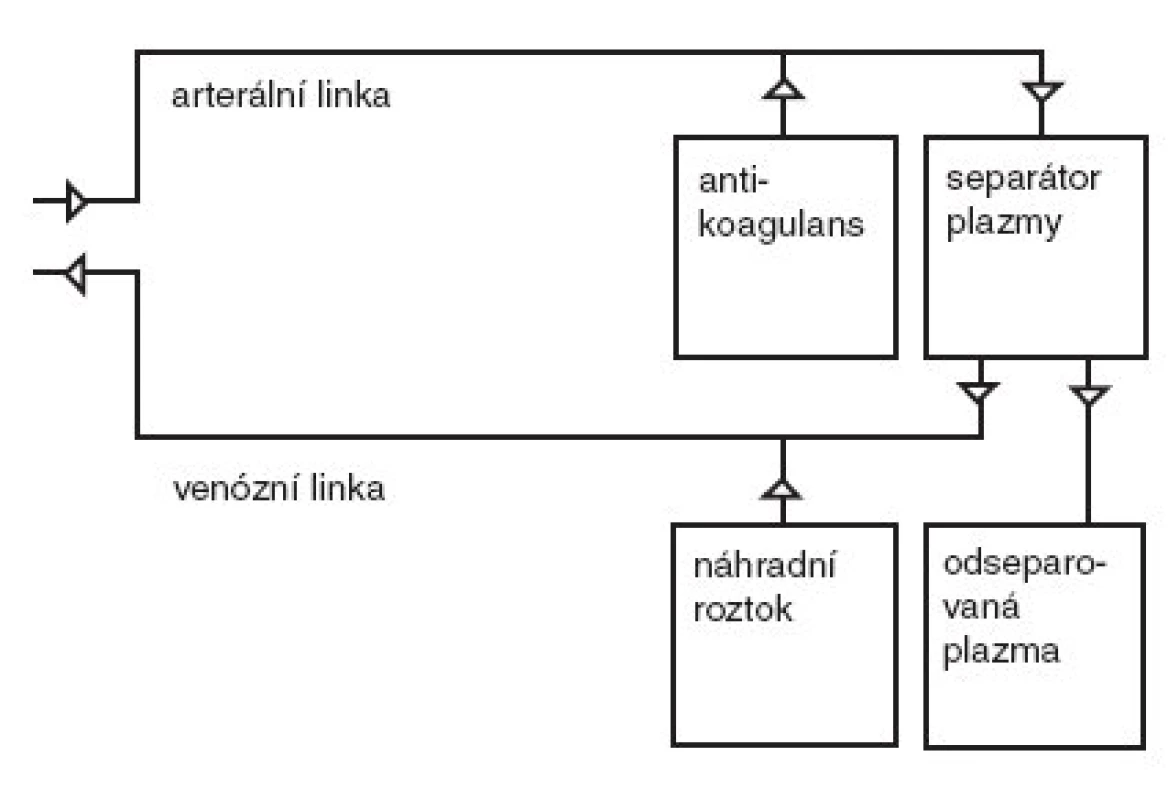
Plazmaferéza je eliminační metodou, jejíž podstatou je odstranění plazmy pacienta a její náhrada roztoky. Během provádění výkonu je krev vedena tzv. arteriální linkou do separátoru plazmy. Pro cévní přístup se u větších dětí pro centrifugační plazmaferézu obvykle používají žíly na předloktí nebo v kubitální jamce. Neumožňuje-li to stav žilního řečiště, u malých dětí a při membránové plazmaferéze se využívá dvoucestných centrálních žilních katétrů zavedených nejčastěji do v. subclavia nebo v. femoralis. Při nutnosti opakovaných procedur s perspektivou několikaměsíční nebo i delší léčby je možné zřízení arterio-venózních zkratů jako při chronické hemodialýze [1]. Antikoagulace je zajištěna heparinem nebo častěji citrátem, event. i jejich kombinací.
Separace plazmy od krevních elementů je umožněna buď centrifugací (separátor plazmy), nebo filtrací (membránová plazmaferéza). Při centrifugaci se oddělují krevní elementy od plazmy na podkladě rozdílné specifické hmotnosti. Filtrace využívá vysoce propustnou membránu s póry o velikosti 0,2–0,4 μm propouštějící i vysokomolekulární proteiny krevní plazmy. Během plazmaferézy je tedy z oběhu odstraněna řada látek – kromě vody a elektrolytů také vysokomolekulární látky jako albumin, globuliny, lipidy, enzymy, léky apod. Odstraněný materiál je shromažďován ve sběrném vaku a nahrazován náhradním roztokem, který je spolu s krevními elementy veden venózní linkou zpět do oběhu pacienta. Jako náhradní roztok se používá buď plazma, nebo koloidní roztok albuminu ve směsi s krystaloidy. Schéma technického provedení plazmaferézy je znázorněno na obr. 1.
Pro terapeutickou plazmaferézu je nutné splnění následujících patofyziologických předpokladů:
- a) existence známé nebo předpokládané patologické součásti plazmy způsobující dané onemocnění (například permeability faktor u fokálně segmentální glomerulosklerózy, přítomnost inhibitoru koagulačního faktoru u hemofilie, autoprotilátky u autoimunitních onemocnění, toxiny a další),
- b) možnost zbavit organismus nežádoucí látky v takovém rozsahu, že její koncentrace a množství v těle významně poklesne,
- c) plazmatická hladina nežádoucí látky se rychle neobnovuje.
Léčebný efekt plazmaferézy není dán pouze odstraněním patologické substance plazmy, ale také substitucí chybějících fyziologických plazmatických faktorů (například u trombotické trombocytopenické purpury, sepse).
Z výše uvedených podmínek vyplývá okruh onemocnění, pro která lze plazmaferézu léčebně využít – patří sem autoimunitní a metabolické nemoci, některé typy hemolyticko-uremického syndromu, hyperviskózní syndrom, intoxikace apod. V infektologii se plazmaferéza indikuje zejména u akutní polyradikuloneuritidy (syndrom Guillainův-Barrého) nebo septického šoku, indikace jsou ale daleko širší, uvedeny jsou v následujícím odstavci.
Indikace k provedení plazmaferézy
Plazmaferéza byla testována u velkého počtu onemocnění (v současnosti více než sto diagnóz). Indikace plazmaferézy byly rozděleny na základě dosažených terapeutických výsledků do několika kategorií. V současnosti jsou akceptovány směrnice (guidelines) ASFA (American Society for Apheresis). Indikace k provedení plazmaferézy jsou zde děleny do 4 skupin: skupina I – indikace standardní nebo akceptované buď jako primární léčba nebo adjuvantní terapie první linie, skupina II – všeobecně uznávané, ale jako adjuvantní léčba při jiné účinné terapii, skupina III – předpokládaný účinek, benefit nebyl ještě plně prokázán, a skupina IV – kontrolované studie nebo jiná pozorování neprokázaly efekt, není dostatek důkazů. Přehled indikačních skupin a jednotlivých onemocnění je uveden v tabulce 1, tučným písmem jsou zde zvýrazněny indikace podle ASFA z roku 2000 [2], normálním písmem jsou psány indikace z další literatury [3, 4, 5, 6, 7, 8].
Tab. 1. Indikační skupiny k provedení plazmaferézy. 
Pozn.: tučným písmem jsou v tabulce zvýrazněny indikace podle AFSA z r. 2000, normálním písmem jsou psány indikace z další literatury). Naše dialyzační středisko má vlastní zkušenosti s plazmaferézou u desítek pacientů, provádí se zde od roku 1991 [9]. V současnosti jsou nejčastějšími indikacemi atypický hemolyticko-uremický syndrom a trombotická trombocytopenická purpura.
Stanovení počtu a frekvence výkonů
Množství odebrané plazmy během jednoho výkonu a frekvenci výkonů lze určit na základě výpočtu a předchozích zkušeností s léčbou.
V grafu 1 je zobrazena závislost dosažené koncentrace dané komponenty plazmy (c) na odstraněném objemu plazmy (násobky objemu plazmy V) – závislost je exponenciální (c = c . e-v).
Graf 1. Závislost dosažené koncentrace dané komponenty plazmy (c) na odstraněném objemu plazmy (násobky objemu plazmy V). 
Odstraněním 1 objemu plazmy je odstraněno přes 60 % dané komponenty, při zpracování 1,3násobku plazmatického objemu je odstraněno přes 72 % dané komponenty. V praxi se používá nejčastěji následující schéma pro výpočet objemu vyměněné plazmy během jednoho výkonu a frekvence výkonů [1]:
- a) akutní život/orgán–ohrožující onemocnění: 1,5–2násobek objemu plazmy pacienta, denně do remise onemocnění,
- b) aktivní onemocnění: 1,3–1,5násobek objemu plazmy, alternativně do remise onemocnění,
- c) chronické onemocnění: dvakrát týdně až jednou za dva týdny.
Uvedené schéma je však pouze orientační, uvedené parametry jsou vždy individuálně upraveny podle daného onemocnění, klinického stavu pacienta a jeho odezvy na předchozí terapii. Obecně platí, že optimální léčbou je minimální možná terapie, která stačí pro dosažení a udržení remise onemocnění.
Vzhledem k neselektivní povaze plazmaferézy dochází tedy při výměně 1 objemu plazmy u dospělého pacienta k odstranění řady normálních substancí: cca 150 g bílkovin (z toho 110 g albuminu, 40 g globulinů), koagulačních faktorů, antitrombinu III, bílkovin tzv. časné reakce, komplementu, hormonů, minerálů, případně léků (např. odstranění antiepileptik) a v malém množství i buněčných krevních složek. Vlastní patologické substance je při její nízké koncentraci odstraněno jen relativně malé množství (řádově gramy) [2, 10, 11]. Ve skutečnosti však mají imunologicky aktivní komponenty odstraňované pomocí plazmaferézy odlišnou dynamiku, která závisí na řadě dalších faktorů. Během výkonu dojde ke snížení koncentrace látky v intravaskulárním prostoru, která následně ovlivní její distribuci mezi intra - a extravaskulárním prostorem. Dále závisí na rychlosti syntézy dané látky a jejím biologickém poločasu (například IgM se vyskytuje převážně intravaskulárně, poločas 5 dní, IgG má smíšenou distribuci s poločasem 22 dní). Vzhledem k těmto parametrům je pro odstranění dostatečného množství dané komponenty obvykle nutné upravit spíše frekvenci provádění plazmaferéz než objem vyměňované plazmy. Koncentraci látky v plazmě po provedení plazmaferézy zachycuje graf 2.
Graf 2. Graf 2. Závislost koncentrace odstraňované substance v plazmě na čase. I – zvyšování koncentrace dané látky v plazmě je dáno přesunem z extracelulárního prostoru, tato fáze trvá řádově hodiny. II – zvyšování koncentrace dané látky v plazmě je dáno její novou syntézou, tato fáze probíhá řádově ve dnech. 
V případě autoimunitních onemocnění je hlavním cílem plazmaferézy odstranění autoprotilátek. Kromě tohoto základního efektu má plazmaferéza i vliv nespecificky imunomodulační, kdy dochází i k odstranění složek komplementu a cytokinů. Plazmaferézu tedy nelze chápat jako čistě eliminační metodu, ale zároveň také jako nespecifickou modulaci imunokompetentních buněk. Znalosti o těchto mechanismech ovlivnění imunitní reakce organismu však dosud nejsou dostatečné [12, 13, 14]. Odstranění autoprotilátek však není kauzální léčbou – autoantigenní i autoreaktivní imunitní buňky v organismu přetrvávají, proto se po provedení plazmaferézy syntéza autoprotilátek urychluje (overshoot fenomén). Nezbytnou součástí léčby je kombinace eliminační metody a podávání imunosupresiv, která tomuto fenoménu brání.
Nežádoucí účinky a komplikace plazmaferézy
Nežádoucí účinky a komplikace plazmaferézy jsou způsobeny zejména extrakorporální cirkulací krve, možností poškození cévní stěny, nutností antikoagulace, objemovou zátěží kardiovaskulárního aparátu, odstraňováním i fyziologických součástí plazmy a rizikem infekcí.
Moderní přístroje umožňují snížit množství extrakorporálně cirkulující krve pod 200 ml (toto množství je u dospělého zanedbatelně malé, u malých dětí zhruba do 20 kg hmotnosti však vyžaduje předplnění systému plazmou nebo jiným náhradním roztokem), ztráty krve jsou rovněž malé (cca 30 ml), množství trombocytů poklesne po výměně plazmy asi o 25–30 % [1]. Odstraněním koagulačních faktorů trvá 8–12 hodin po výkonu hypokoagulační stav, poté naopak v důsledku zpožděné syntézy antitrombinu III nastává 24–72 hodin po výkonu hyperkoagulační stav se zvýšeným rizikem trombóz (zejména v kombinaci s dalšími faktory – zánět, imobilizace). Při opakovaných výkonech může docházet i přes substituci albuminem k hypoproteinémii a hypoalbuminémii, což velmi komplikuje dlouhodobou terapii. Zároveň je také při opakovaných plazmaferézách s náhradou albuminu nutné substituční podávání imunoglobulinů přibližně po každém 5.–7. výkonu.
Nežádoucí účinky a komplikace plazmaferézy jsou shrnuty v tabulce 2.
Tab. 2. Nežádoucí účinky a komplikace plazmaferézy. 
Kontraindikace provedení plazmaferézy
Kontraindikace provedení plazmaferézy vyplývají:
- a) z extrakorporálního zpracování krve – nestabilní závažné kardiovaskulární choroby jako např. hemodynamická nestabilita při kardiogenním šoku, perikardiální krvácení,
- b) z antikoagulace – závažné poruchy hemostázy (je nutné se pokusit o korekci před výkonem),
- c) z plazmaferézou navozené imunosuprese – těžká infekční onemocnění,
- d) z těžké přidružené choroby (například pokročilá stadia tumorů).
Závěrem
Plazmaferéza je vysoce účinnou eliminační metodou, která odstraňuje pacientovu plazmu a nahrazuje ji náhradními roztoky, čímž buď odstraňuje patologické složky pacientovy plazmy, nebo nahrazuje chybějící složku plazmy nemocného. Nevýhodou je však její nespecificita – spolu s odstraněním dané patologické složky plazmy jsou vedlejším efektem léčby vysoké ztráty fyziologických součástí plazmy i léků. Vyžaduje také použití substitučních roztoků, z čehož vyplývá ekonomická náročnost plazmaferézy (podávání albuminu, plazmy) i riziko nežádoucích účinků (např. alergické, infekční komplikace). Při opakovaném a častém užití plazmaferézy dochází k významné hypoproteinémii a dlouhodobá léčba může být velmi obtížná.
Tyto nevýhody plazmaferézy vedly ke snaze o použití specifičtější, či dokonce selektivní metodiky odstraňující pouze patologické složky plazmy. Mezi částečně selektivní metody je možné počítat například diferenciální (kaskádovou) filtraci, termofiltraci, kryoprecipitaci, lipaferézu, DALI (direct absorption of lipoproteins) a další. Patří sem také imunoadsorpce, která bude podrobněji rozebrána v další části textu.
II. Imunoadsorpce
Imunoadsorpce je metodou, při které je nejdříve odseparována plazma pacienta stejně jako při plazmaferéze a poté je plazma čerpána přes kolonu obsahující adsorbent. Zde je zbavována pouze látek, které se na adsorbent váží. Následně je takto očištěná plazma navrácena zpět do oběhu pacienta. Protože se jedná o selektivní odstraňování všech složek plazmy, není zapotřebí používat náhradní roztoky jako u plazmaferézy. Adsorpční metody tedy využívají schopnosti určitých látek vázat selektivně jen některé složky plazmy, převážně imunoglobuliny tříd IgG, IgA, IgM, fragmenty imunoglobulinů a cirkulující imunokomplexy [4, 15, 16, 17, 18]. Kromě vlastního odstranění imunoglobulinů má imunoadsorpce stejně jako plazmaferéza nespecifický imunomodulační vliv na buňky imunitního systému. Byla vyvinuta německým biochemikem Stoffelem v roce 1981.
V průběhu výkonu je arteriální linkou odváděna krev pacienta do separátoru plazmy, kde musí být oddělována vysoce čistá plazma (primární okruh). Ta je dále odváděna přes kompenzátor objemu k vlastnímu zpracování do jedné ze dvou imunoadsorpčních kolon (sekundární okruh). Zde probíhá navázání (adsorpce) imunoglobulinů a plazma očištěná od imunoglobulinů se vrací po zpětném smísení s krevními elementy zpět pacientovi. Vazba imunoglobulinů v koloně je reverzibilní, kolona je vypláchnutím regenerována a připravena k dalšímu použití. Jak bylo uvedeno výše, má zařízení k dispozici dvě totožné imunoadsorpční kolony. V jedné z kolon probíhá adsorpce, druhá je zároveň regenerována. Po každém cyklu a regeneraci kolony je stanovena účinnost procesu. Každý terapeutický výkon se skládá z několika takových cyklů. Možnost opakování výkonu je teoreticky neomezená, v praxi je však limitována garantovanou dobou použitelnosti nebo v případě častého používání postupným snižováním účinnosti kolon. Pro každého pacienta musí být používána dvojice kolon.
Schéma primárního i sekundárního okruhu při imunoadsorpci je zobrazeno na obrázku 2 (primární okruh je totožný s okruhem pro plazmaferézu). Na obrázku 3 je fotografie vlastního imunoadsorpčního přístroje – odpovídá sekundárnímu okruhu na obrázku 2.
Obr. 2. Schéma imunoadsorpce. Poznámka: 1. Primární okruh je totožný s okruhem pro plazmaferézu. 2.Do frakčního vaku jemožné odvádět samostatně imunoglobuliny vypláchnuté z imunoadsorpčních kolon k další analýze. 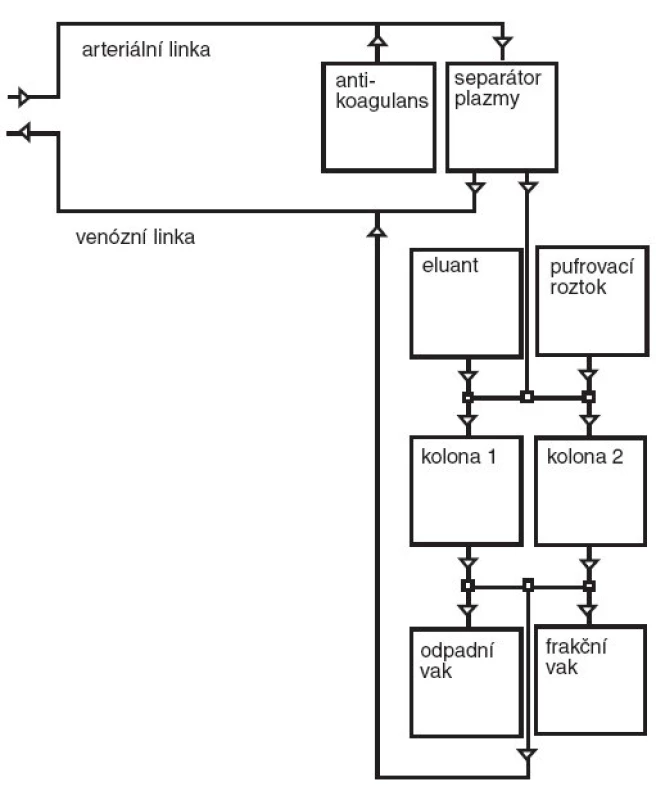
Obr. 3. Fotografie sekundárního okruhu imunoadsorpce. 
Během zpracování 1 objemu plazmy dojde k odstranění 50 % intravaskulárního IgG. Stejně jako u plazmaferézy je nutné brát v úvahu i extravaskulárně se nacházející imunoglobuliny a výkon opakovat. V takovém případě je možné imunoglobuliny téměř odstranit bez výrazného vlivu na ostatní komponenty plazmy. Z literárních údajů i podle našich zkušeností klesá po výkonech i plazmatická koncentrace ostatních bílkovin, koagulačních faktorů a složek komplementu o cca 15–20 % [11, 17]. Pokles je dán ztrátami během výkonu (ztráty plazmy při regeneraci kolon a výplachu systému) a také částečným naředěním cirkulujícího objemu dalšími roztoky (předplnění soustavy, proplachy). Tyto ztráty jsou však rychle spontánně upraveny bez nutnosti podávat substituční roztoky i při opakovaných výkonech. Počet a frekvence prováděných imunoadsorpcí závisí na typu užité kolony, její aktuální účinnosti, na základním onemocnění i na jeho aktivitě. Obecné principy stanovení počtu a frekvencí výkonů jsou obdobné jako u plazmaferézy. Ve většině indikací je imunoadsorpce kombinována s medikamentózní imunosupresivní terapií, přičemž u řady pacientů umožňuje imunoadsorpce významné snížení počtu či dávek užívaných imunosupresiv.
Podle použitých adsorbentů je možné imunoadsorpční kolony dělit na ireverzibilní a reverzibilní.
Ireverzibilní využívají syntetické pryskyřice složené z nosiče (polyvinylalkohol) a na něj kovalentně navázané aminokyseliny (fenylalanin nebo tryptofan). Proces adsorpce je selektivní – jsou odstraňovány převážně imunoglobuliny (proto byl tento proces nazván imunoadsorpcí). Po vyčerpání vazebné kapacity adsorbentu pro imunoglobuliny je nutno použít novou kolonu s novým adsorbentem. Výhodou je ekonomická nenáročnost (kolem deseti tisíc korun za kolony), nevýhodou naopak jednorázové použití [19].
Reverzibilní kolony používají v současnosti jeden ze dvou adsorbentů. První využívá schopnosti jedné součásti buněčné membrány bakterie Staphylococcus aureus – proteinu A [20]. Ten na sebe váže imunoglobuliny, především IgG, reakce s ostatními plazmatickými proteiny je zanedbatelná. Vazba IgG probíhá pouze na podkladě vysoké afinity k proteinu A, nejedná se o imunologickou interakci, touto metodou je možné odstranit až 87–95 % IgG [16, 20]. Reakce probíhá silně s podtřídami IgG1, IgG2, IgG4, zatímco u podtřídy IgG3 a tříd IgA a IgM je slabší. Samotný protein A je proti úniku z kolony do oběhu pacienta vázán na nosič, používána je sepharosa. V průběhu odstranění navázaných imunoglobulinů je využíváno rezistence proteinu A vůči změně pH – kolona je při odstraňování imunoglobulinů proplachována roztokem o nízkém pH, který uvolňuje vazbu Ig na protein A. Nevýhodou této metody je především vysoká jednorázová ekonomická náročnost při pořízení těchto opakovaně použitelných kolon (řádově statisíce Kč za dvojici kolon pro jednoho pacienta), naopak odpadá nutnost používat drahé substituční roztoky jako u plazmaferézy.
Druhý v současnosti používaný reverzibilní imunoadsorpční princip je založen na specifické imunitní reakci antigen – protilátka. Používaným adsorbentem jsou v tomto případě polyklonální ovčí protilátky proti lidským imunoglobulinům [21], které jsou rovněž kovalentně navázány na nosič – sepharosu. Technika vlastního provedení výkonu je podobná jako při použití kolon obsahujících stafylokokový protein A, používají se také dvě kolony – jedna adsorbuje imunoglobuliny z plazmy, druhá v té době regeneruje. Jako eluant se používá glycin. Rozdílné je naopak spektrum adsorbovaných imunoglobulinů. Zatímco při použití stafylokokového proteinu A je adsorbován především IgG, jsou při použití ovčích protilátek proti lidským Ig adsorbovány všechny podtřídy IgG (IgG1 – IgG4) a také třídy IgA a IgM. Stejně jako u proteinu A dochází také k vazbě fragmentů imunoglobulinů a cirkulujících imunokomplexů. Rizikem této metody je naopak možnost alergické reakce na ovčí bílkoviny a rizika vyplývající z přípravy polyklonálních protilátek ze zvířecího materiálu. Pokud je filtr naplněn ovčí protilátkou proti lidskému apoproteinu B, odstraňuje se z plazmy LDL cholesterol a jedná se o život zachraňující léčbu v případech těžké (např. homozygotní) hypercholesterolémie. V současnosti jsou však vyvíjeny nové typy imunoadsorpčních kolon.
Indikace k provedení imunoadsorpce
U některých diagnóz je již imunoadsorpce zařazena do podobného indikačního schématu jako u plazmaferézy – do skupiny I patří LDL aferéza u pacientů s familiární hypercholesterolémií, do skupiny II patří idiopatická trombocytopenická purpura a revmatoidní artritida. Protože se však jedná o relativně novou metodu, je v současnosti její indikace u většiny výše jmenovaných onemocnění stále předmětem výzkumu a zároveň se v poslední době stále rozšiřuje spektrum onemocnění, u nichž je imunoadsorpce využívána a zkoušena [4, 22, 23, 24, 25, 26, 27].
Současné hlavní indikace k provedení imunoadsorpce jsou shrnuty v tabulce 3.
Tab. 3. Současné hlavní indikační skupiny k provedení imunoadsorpce. 
Na našem pracovišti máme zatím vlastní omezené zkušenosti s léčbou pomocí imunoadsorpce u dvou pacientek s rekurencí fokálně segmentální glomerulosklerózy v transplantované ledvině [28].
Nežádoucí účinky a kontraindikace
Nežádoucí účinky a kontraindikace jsou podobné jako v případě plazmaferézy, odpadají však rizika spojená s odstraňováním fyziologických komponent plazmy a podáváním náhradních roztoků. Riziko aktivace komplementu stafylokokovým proteinem A je při jeho vazbě na nosič a při použití citrátu sodného jako antikoagulačního roztoku minimální, stejně tak i riziko alergické reakce při použití kolon s obsahem ovčích protilátek proti lidským imunoglobulinům.
Závěr
Závěrem lze shrnout, že léčebná plazmaferéza získala svoje pevné místo v terapii řady chorob (viz indikace podle ASFA, skupiny I, II), v dalších indikacích je ještě její význam vymezován. Budoucnost však bude pravděpodobně patřit selektivním metodám, které budou moci zachytit z plazmy (nebo dokonce přímo z krve) pouze patogeneticky působící faktor, s minimem vedlejších účinků za ekonomicky přijatelných podmínek.
Imunoadsorpce je semiselektivní eliminační metoda, která umožňuje odstranění patologických humorálních komponent (především autoprotilátek) z plazmy bez narušení homeostatických mechanismů. Ve srovnání s klasickou plazmaferézou je efektivita této poměrně nové eliminační metody vyšší a zátěž pro pacienta významně menší. Proto imunoadsorpce nahrazuje v posledních letech v mnoha indikacích klasickou plazmaferézu [29]. Optimalizace terapeutických postupů, sledování efektivity terapie a posouzení vlivu imunoadsorpce u pacientů léčených kombinovanou imunosupresí a sledování vedlejších účinků léčby je otázkou dalšího výzkumu.
Imunoadsorpce je v České republice používána téměř výhradně u dospělých pacientů, a proto je vhodné při zvážení výhod této metody (především mnohem větší šetrnosti vůči pacientovi) její častější používání i u dětských pacientů.
Podpořeno: VZ MZ ČR 00064203/6906, VZ MŠMT ČR 0021620819.
Došlo: 28. 3. 2007
Přijato: 17. 9. 2007
MUDr. Filip Fencl
Pediatrická klinika UK 2. LF
FN Motol
V Úvalu 84
150 06 Praha 5
e-mail: filipfencl@seznam.cz
Zdroje
1. Wayne AS, Fosburg MT. Therapeutic plasma exchange and cytapheresis. In Nathan DG, Oski FA. Hematology of Infancy and Childhood. 4th ed. Mexico: W. B. Saunders Comp., 1993 : 1819–1830.
2. McLeod BC. Introduction to the this special issue: Clinical application of therapeutic apheresis. J. Clin. Apheresis 2000;15 : 1–5.
3. Avner ED, Harmon WE, Niaudet P. Pediatric Nephrology. 5th ed. Philadelphia: LW&W, 2004.
4. Bosch T, et. al. Extracorporeal plasma treatment in primary and recurrent focal segmental glomerular sclerosis: a review. Ther. Apher. 2001;5(3): 155–160.
5. Bunchman TE. Plasmapheresis and renal replacement therapy in children. Curr. Opin. Pediatr. 2002;14(3): 310–314.
6. Madore F. Plasmapheresis. Technical aspects and indications. Crit. Care Clin. 2002;18(2): 375–392.
7. Smith JW. Therapeutic apheresis in the United States: Current indication and direction. Ther. Apher. 1999;3 : 1–3.
8. Hladík M. Volba eliminační metody v intenzivní péči. In Fedor M, Minarik M, Kunovský P, et. al. Intenzivní péče v pediatrii. Martin: Osveta, 2006 : 270–282.
9. Kreisinger J, Šimková E, Feber J, et al. Plazmaferéza u dětí – indikace, technika, výsledky. Čes.-slov. Pediat. 1999;54(8): příloha VI.
10. Pineda A. Selective therapeutic extraction of plasma constituents, revisited. Transfusion 1999;39 : 671–673.
11. Pták J. Imunoadsorpce – nová možnost léčby autoimunitních onemocnění. Prakt. Lék. 2002;82(6): 336–339.
12. Agishi T. The current status of extracorporeal immunomodulation. Transfus. Sci. 1996;17 : 439–444.
13. Borberg H, Jimenez C, Belák M, et al. Treatment of autoimmune disease by immunomodulation through extracorporeal elimination and intravenous immunoglobulin. Transfus. Sci. 1994;15 : 409–418.
14. Dau PC. The fundamental basis for therapeutic plasmapheresis in autoimmune diseases. Transfus. Sci. 1996;17 : 235–244.
15. Brunkhorst R. Clinical immunoadsorption, Hannover, Germany, February 28th – March 1st, 1997. Nefrol. Dial. Transplant. 1998;13 : 222–224.
16. Gjorstrup P, Watt RM. Therapeutic protein A immunoadsorption. A review. Transfus. Sci. 1990;11 : 281–302.
17. Jones FR, Balint JP, Snyder HW. Selective extracorporeal removal of immunoglobulin-G and circulating immune complexes: a review. Plasma Ther. Transfus. Technol. 1986;7 : 333–349.
18. Toepfer M, Sitter T, Burchardi C, et al. Klinische Immunoadsorption. Dtsch. med. Wschr. 1999;124 : 461–465.
19. Takamori M, Ide Y. Specific removal of antiacetylcholine receptor antibodies in patients with myasthenia gravis. Transfus. Sci. 1996;17 : 445–453.
20. Belák M, Borberg H, Jimenez C, et al. Technical and clinical experience with protein A immunoadsorption columns. Transfus. Sci. 1994;15 : 419–422.
21. Matic G, Hofmann D, Winkler R, et al. Removal of immunoglobulin by a protein A versus an antihuman immunoglobulin G-based system: Evaluation of 602 sessions of extracorporeal immunoadsorption. Artificial Organs 2000;24 : 103–107.
22. Moriconi L, et al. Proteinuria in FSGS: role of circulating factors and therapeutic approach. Ren. Fail. 2001;23(3–4): 533–541.
23. Moriconi L, et al. Apheresis in primary focal segmental glomerulosclerosis of native and transplanted kidneys: a therapeutic protocol. J. Nephrol. 2000;13(5): 347–351.
24. Muller J, Wallukat C, Dandel M, et al. Immunoglobulin adsorption in patients with idiopathic dilated cardiomyopathy. Circulation 2000;101 : 385–391.
25. Nilsson IM, Berntorp E, Freiburghaus Ch. Treatment of patients with factor VIII and IX inhibitor. Thrombosis and Hemostasis 1993;70 : 56–59.
26. Savin VJ, et al. Permeability factors in focal segmental glomerulosclerosis. Semin. Nephrol. 2003;23(2): 147–160.
27. Braun N, Kadar JG, Risler T. Therapeutic immunoadsorption – its role in clinical practice. Transfus. Sci. 1998;19(Suppl): 65–69.
28. Fencl J, Janda J, Seeman T, et al. Recurrence of nephrotic proteinuria in children with focal segmental glomerulosclerosis after renal transplantation treated with plasmapheresis and imunoadsorption: case reports. Transplant. Proc. 2007; Dec 39(10): 3488–3490.
29. Schneider KM. Plasmapheresis and immunoadsorption: Different techniques and their current role in medical therapy. Kidney Int. 1998;53(Suppl. 64): S61–S65.
Štítky
Neonatologie Pediatrie Praktické lékařství pro děti a dorost
Článek Sauna a děti
Článek vyšel v časopiseČesko-slovenská pediatrie
Nejčtenější tento týden
2008 Číslo 3- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Stillova choroba: vzácné a závažné systémové onemocnění
-
Všechny články tohoto čísla
- Panu profesoru MUDr. Václavu Tošovskému s úctou a poděkováním
- K práci Dr. Guta – Kawasakiho choroba
- Výskyt nadváhy a obezity u 7427 českých dětí vyšetřených v roce 2006
- Závislost dětských úrazů na úrazovosti rodičů
- Tularémie: vzácná příčina horečky a lymfadenopatie v kojeneckém věku
- Plazmaferéza a imunoadsorpce v pediatrii
- Kawasakiho choroba (40. výročí první publikace)
- Diagnostika a léčba dyslipidémií u dětí a dospívajících Doporučení pro diagnostiku a léčbu dyslipidémií u dětí a dospívajících vypracované výborem České společnosti pro aterosklerózu
- Správné odpovědi na kontrolní otázky k doškolovacímu článku Hrdlička M., Dudová I.: Dětský autismus jako modelová porucha se sociálním deficitem (č. 11/2007)
- Sauna a děti
- VIII. ČESKÝ PEDIATRICKÝ KONGRES S MEZINÁRODNÍ ÚČASTÍ
- Česko-slovenská pediatrie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Tularémie: vzácná příčina horečky a lymfadenopatie v kojeneckém věku
- Plazmaferéza a imunoadsorpce v pediatrii
- Diagnostika a léčba dyslipidémií u dětí a dospívajících Doporučení pro diagnostiku a léčbu dyslipidémií u dětí a dospívajících vypracované výborem České společnosti pro aterosklerózu
- Kawasakiho choroba (40. výročí první publikace)
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání