-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
ÚVOD DO MOLEKULÁRNÍ PATOLOGIE
Autoři: Lenka Krsková
Působiště autorů: Ústav patologie a molekulární medicíny, 2. lékařská fakulta Univerzity Karlovy v Praze a Fakultní nemocnice v Motole, Praha
Vyšlo v časopise: Čes.-slov. Patol., 49, 2013, No. 3, p. 114-118
Kategorie: Preface
Molekulární patologie je vědní disciplína zabývající se studiem molekulárních mechanismů vzniku a progrese nenádorových i nádorových chorob s využitím metod molekulární biologie. Tento přístup umožňuje se dobrat až k samým počátkům vzniku nemoci, až na jejich genovou úroveň. Očekává se, že právě za pomoci molekulární patologie budeme moci vysvětlit příčiny některých nemocí, kterým dosud dobře nerozumíme. Současná molekulární patologie využívá molekulárně biologické postupy k identifikaci sekvencí nukleových kyselin odpovědných za vznik různých onemocnění, k diagnostice infekčních chorob, k přesné diagnostice a klasifikaci nádorových onemocnění, ke zjištění prognózy a monitorování terapie u pacientů s nádory, k testování lékové senzitivity a rezistence nádorových a infekčních chorob, k určení příbuznosti při transplantacích, ale i k testování otcovství nebo k účelům forenzní medicíny.
Metody molekulární patologie umožňují analýzu biopolymerů, zejména těch, které nesou a následně uskutečňují genetickou informaci, tedy nukleových kyselin a bílkovin.
Život závisí na schopnosti buněk uchovávat, překládat a předávat genetickou informaci, která je nezbytná k vytvoření a udržení živého organismu. Při dělení buněk přechází tato dědičná informace z mateřské buňky do dceřinné. Tato informace je v každé živé buňce uložena v podobě genů – základních informačních jednotkách, které určují vlastnosti jednotlivce, ale i celého druhu.
Chromozom
Na počátku dvacátého století bylo zjištěno, že se geny nacházejí na chromozomech – nitkovitých útvarech v jádře eukaryotických buněk, které je možno pozorovat na počátku buněčného dělení. Metafazický chromozom vypadá jako dvě ramena, mezi nimiž je ztenčená oblast – centromera. Centromery jsou tvořeny vysoce repetitivní sekvencí DNA. Koncová část ramen se potom označuje jako telomera, která sestává z mnoha tandemových repetic specifické sekvence TTAGGG. Telomery jsou důležité pro stabilitu chromozomů a prevenci „end-to-end“ fúzí. Raménka chromozomů nemusí být stejně dlouhá – rozlišujeme krátké raménko (p – petit) a dlouhé raménko (q – následuje v abecedě po p). Soubor všech chromozomů v organismu se označuje jako karyotyp. Chromozomy se dělí na autozomy, které tvoří homologické páry a gonozomy – pohlavní chromozomy, které určují pohlaví jedince. Existence chromozomů umožňuje rovnoměrné rozdělení genetické informace do dceřinných buněk. Chromozom se skládá z histonů a molekuly DNA, která se na histonové bílkoviny namotává. Tento komplex DNA a histonů se nazývá chromatin. Základní stavební jednotkou chromozomu jsou nukleozomy – útvary tvořené osmi histony, které jsou omotány 146 páry bazí (bp) molekuly DNA. Spiralizací těchto nukleozomů vznikají chromatinová vlákna a další spiralizací pak celé chromozomy.
První důkazy, že geny jsou tvořeny deoxyribonukleovou kyselinou – DNA, pocházejí z roku 1944, kdy bylo prokázáno, že přidání purifikované DNA k bakteriím může změnit jejich vlastnosti a tyto vlastnosti jsou předávány z generace na generaci (1).
DNA
DNA – deoxyribonukleová kyselina je tvořena dvěma polynukleotidovými řetězci. Jejími základními stavebními kameny jsou nukleotidy, které sestávají z pětiuhlíkatého cukru 2-deoxy-D-ribózy, zbytku kyseliny fosforečné a dusíkatých bazí. Dle zákonů komplementarity se v DNA k sobě váží vždy 1 baze purinová (Adenin, Guanin) s jednou bazí pyrimidinovou (Cytosin, Thymin). Obě polynukleotidová vlákna pak nejčastěji vytváří pravotočivou šroubovici. Dvoušroubovicový model DNA poprvé představili laureáti Nobelovy ceny James D. Watson a Francis Crick v roce 1953 v časopise Nature. Při vysoké teplotě či extrémním pH dochází k oddělení vláken DNA – denaturaci, snížením teploty či úpravou pH dojde k opětovnému spojení vláken – hybridizaci (renaturaci). Obou těchto jevů se využívá v metodách molekulární biologie.
Pro rozmnožování je nezbytné, aby potomci dostali plnohodnotnou genetickou informaci. Při replikaci vzniknou z jedné mateřské molekuly DNA dvě naprosto identické dceřinné DNA. Klíčovou roli při replikaci DNA sehrávají enzymy přepisující DNA – tzv. DNA polymerázy. DNA polymerázy (v tomto případě termostabilní Taq polymerázy) se pak využívá i v nejrozšířenější metodě molekulární patologie a to v metodě polymerázové řetězové reakce – PCR (viz dále). DNA polymerázy jak in vitro tak in vivo nejsou schopny zahájit polymeraci od jediného nukleotidu, proto v buňce při replikaci funguje enzym primáza, která nasyntetizuje krátký úsek RNA – tzv. primer, od kterého DNA polymeráza může zahájit polymeraci. V metodě PCR se pak využívá syntetických primerů (většinou krátká sekvence DNA), které vymezují syntetizovanou oblast.
Vzniku replikační vidlice při replikaci DNA se účastní enzymy helikázy schopné oddálit obě molekuly dvoušroubovice a vytvořit charakteristickou strukturu ve tvaru písmene Y, aby mezi nimi vzniklo místo pro syntézu DNA. Od sebe oddělená vlákna pak pomáhají udržet SSB proteiny. Oddálení obou vláken od sebe pomocí helikáz ale vede ke zvýšení spiralizace na konci replikační vidlice. Tento problém řeší topoizomerázy, jež provedou jednovláknový zlom, molekula se protočí a posléze ho opět slepí.
Každé z vláken původní templátové DNA je replikováno odlišným způsobem. Důvodem je skutečnost, že je DNA polymeráza schopná pracovat pouze ve směru 5’→3’. Po jednom řetězci (tzv. vedoucí řetězec) postupuje DNA polymeráza běžným způsobem. Druhý řetězec, který je orientován ve směru 3’→5’, se označuje jako opožďující se řetězec. Tento řetězec však musí být kopírován rovněž v 5’→3’ směru, a tak DNA polymeráza replikuje tento řetězec po malých částech, tzv. Okazakiho fragmentech o délce asi 100 – 200 nukleotidů. Na začátku každého Okazakiho fragmentu se musí pokaždé vytvořit nový RNA primer, ten je později vystřihnut a Okazakiho fragmenty jsou spojovány enzymem DNA ligázou do souvislého vlákna, jež je totožné s vedoucím řetězcem (obr. 1).
Obr. 1. Replikační vidlice je místo na dvoušroubovici DNA, kde právě probíhá replikace. Má tvar písmene Y. Oddělení vláken dvoušroubovice způsobují enzymy helikázy, tento tvar stabilizují SSB proteiny a samotné replikaci se věnuje DNA polymeráza. Tyto a další enzymy postupují po molekule DNA a přepisují ji. 
DNA v buňce může být metylována. Metylace DNA slouží k udržení struktury chromatinu, k potlačení parazitické DNA, hraje roli v diferenciaci buněk, v inaktivaci X chromozomu a imprintingu. Metylace je reverzibilní proces, kdy během ontogeneze dochází ke změnám metylace. Metylace DNA postihuje většinou cytosin v dinukleotidové sekvenci CpG. Tyto tzv. CpG ostrůvky se nejčastěji nacházejí v repetitivních sekvencích. Asi 60 % všech genů má promotorové oblasti asociované s CpG dinukleotidy. Metylace těchto oblastí tedy logicky vede k intaktivaci genů, neboť metylace brání vazbě transkripčních faktorů, popř. umožňuje vazbu inhibičních komplexů obsahujících histondeacetylázy, které vedou k přestavbě chromatinu do jeho neaktivní formy. Proces metylace je zajišťován enzymy – metyltransferázami. Změny metylace bývají často spojovány s maligními procesy, neboť hypometylací může dojít k aktivaci imprintovaných protoonkogenů, navíc hypometylace vede ke genomové nestabilitě. Naopak hypermetylace promotorů nádorových supresorů (Rb1, inhibitorů cyklin dependentních kináz apod.), mutátorových genů (hMLH1) vede k jejich inaktivaci.
DNA neřídí syntézu bílkovin sama jako taková, ale spíše se podobá šéfovi, který rozděluje pracovní úlohy týmu pracovníků. Jestliže je v buňce potřeba určitého proteinu, je sekvence v patřičné oblasti molekuly DNA v chromozomu nejprve přepsána do RNA (ribonukleová kyselina).
RNA
RNA – kyselina ribonukleová. Molekula RNA je většinou (existují i výjimky) tvořena jen jedním polynukleotidovým vláknem. Z tohoto důvodu je mnohem fragilnější než dvouřetězcová DNA. Sacharidovou složku RNA tvoří cukr D-ribóza, dusíkaté baze tvoří Adenin, Cytosin, Guanin a Uracil. RNA díky svým -OH skupinám v poloze 2´ a 3´ může sama vykonávat i některé enzymatické funkce.
Eukaryotní geny obsahují kódující sekvence – exony a nekódující sekvence – introny. Pro začátek transkripce eukaryotních buněk je nutná přítomnost specifické sekvence na DNA (většinou několik desítek nukleotidů před začátkem genu) tzv. promotoru a transkripčních faktorů. Transkripční faktory spolu s RNA polymerázou vytvářejí tzv. preiniciační komplex, který se váže k promotorové oblasti a spouští transkripci. K ukončení transkripce dochází, když RNA polymeráza narazí na stop sekvenci, neboli terminátor a dojde k zastavení přepisu a uvolnění hnRNA, která je prekurzorem mRNA. Tento tzv. primární transkript musí být následně upraven pomocí splicingu, nebo-li sestřihu a posttranskripčních modifikací. Na sestřihu hnRNA se podílí jaderné enzymové komplexy – splicezomy. Splicezomy tvoří komplex pěti malých RNA (U1, U2, U4, U5 a U6) spolu s proteiny a tvoří tak snRNP (small nuclear ribonucleoprotein particles). Tyto snRNP rozeznávají cílovou sekvenci AGGU, která se nachází na rozhraní mezi exonem a intronem a označuje tak úsek intronu, který má být vystřižen. Jak již bylo zmíněno, molekula RNA je značně fragilní, z tohoto důvodu existuje v eukaryotních buňkách proces posttranskripčních modifikací. Na 3´ konec RNA se připojuje cca 200 adenylových zbytků a vytváří se tzv. polyA konec. Na 5´ konci molekuly RNA se na trifosfát naváže zbytek 7-methylguanosinu, tzv. 5´ čepička (obr. 2). Výsledná mRNA je využívána jako templát pro tvorbu proteinu. Právě 5´ čepička mRNA je důležitá pro rozpoznání mRNA ribozomem (2).
Obr. 2. Souhrn procesů vedoucích od genu k proteinu. V eukaryontních buňkách vzniká transkripcí molekula primárního transkriptu, která obsahuje exonové i intronové sekvence. Oba její konce jsou modifikovány a introny vyštěpeny v enzymově katalyzovaném sestřihu. Výsledná mRNA je transportována z jádra do cytoplazmy, kde je překládána. 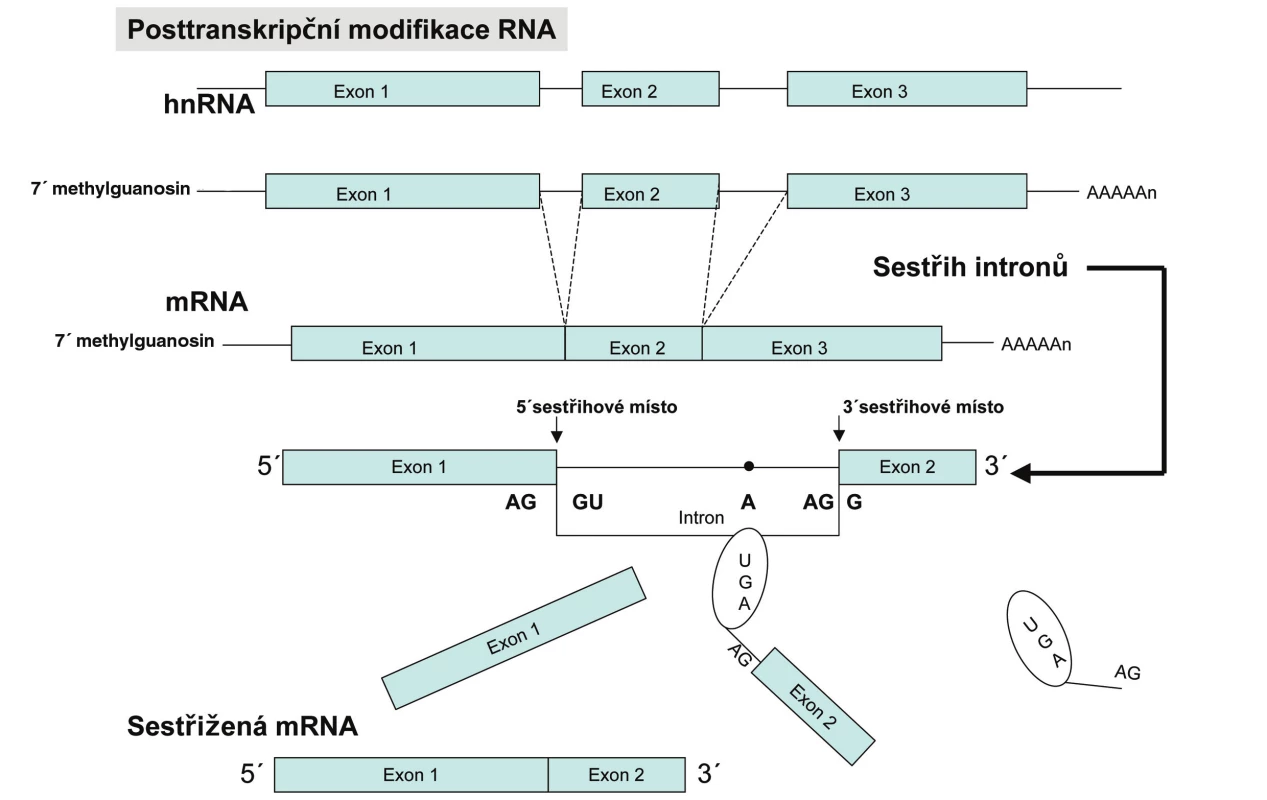
Základní typy RNA:
- mRNA – messenger RNA neboli informační RNA. Poskytuje informaci o pořadí aminokyselin, přenáší informaci o primární struktuře určité bílkoviny z genu na ribozom (lokalizace proteosyntézy).
- tRNA – transferová RNA. Přenáší aminokyseliny na proteosyntetický aparát buňky – na ribozom.
- rRNA – ribozomální RNA. Tvoří stavební složku ribozomálních podjednotek.
- hnRNA – heterogenní jaderná RNA. Jde o makromolekulární prekursor mRNA u eukaryot.
- virRNA – virová RNA v níž je uložena genetická informace RNA virů.
- další RNA, které se podílejí na výstavbě nukleoproteinových komplexů jako jsou spliceozomy, RISC (RNA-induced silencing complex) zapojené do RNA-interference - RNAi, což je mechanismus, jímž jsou v buňkách likvidovány dvouřetězcové molekuly RNA zřejmě jako obrana buněk proti infekci virovou dvouřetězcovou dsRNA.
- miRNA – dalším typem RNA vyskytujícím se přirozeně v buňkách je tzv. micro RNA. Tyto molekuly se podílejí na potlačení exprese určitých genů. Obsahují vlásenkovité struktury, které připomínají dsRNA a jsou štěpeny za vzniku siRNA, která se váže na RISC. Zabraňují translaci mRNA, která je k jednomu z řetězců komplementární. V současné době se RNAi často využívá v genovém inženýrství k cílenému snížení exprese sledovaných genů. Za objev RNA-interference získali roku 2006 A.Z. Fire a C.C. Mello Nobelovu cenu.
- SnRNA – (small nuclear RNA), podílí se na sestřihu (splicingu)
Proteiny
Proteiny rovněž patří mezi biopolymery. Jedná se o vysokomolekulární látky s relativní molekulární hmotností 103 až 106 složené z aminokyselin. V proteinech jsou aminokyseliny vzájemně vázány aminoskupinami a karboxylovými skupinami amidovou vazbou, která se nazývá peptidová vazba. Rozlišujeme primární, sekundární, terciární a u některých složitějších proteinů ještě kvartérní strukturu bílkovinného řetězce. Bílkoviny jsou ve většině případů kódovány geny, které jsou v procesu transkripce přepisovány do mRNA a následně na ribozomu dochází k syntéze proteinů – translaci dle této mRNA a jednotlivých aminokyselin napojených na specifické tRNA. Počet proteinů je vyšší než počet genů hlavně z důvodu alternativního splicingu RNA a posttranslačním modifikacím proteinu. Proteiny v organizmu plní celou řadu funkcí – stavební, transportní, katalytické a regulační, zajišťují pohyb a velmi podstatná je i funkce obranná.
METODY MOLEKULÁRNÍ DIAGNOSTIKY
Je důležité, aby lékaři měli v současné době přehled o molekulárních metodách a molekulární diagnostice a tím i o možnostech, které molekulární patologie nabízí, ale také čím jsou jednotlivé metody limitovány, aby bylo možné zajistit co nejvhodnější materiál pro požadovaná vyšetření.
Tak jako u jiných oborů, je i rozvoj molekulární patologie závislý na rozvoji metod využívaných v tomto oboru. Následuje stručný přehled některých metod nejčastěji používaných v molekulární patologii. Ty budou následně dopodrobna diskutovány v jednotlivých článcích této doškolovací série.
K hlavním metodickým přístupům molekulární patologie patří separace a purifikace nukleových kyselin, amplifikace nukleových kyselin, různé způsoby manipulace s nukleovými kyselinami, sekvenování DNA a dále pak různé metody analýzy genové exprese (studium transkripce a translace).
Izolace nukleových kyselin
Izolace DNA, RNA, popř. proteinů je prvním krokem většiny molekulárně biologických technik. Principem izolace nukleových kyselin je rozrušení buněk nebo virových kapsidů působením enzymů a/nebo detergentů, odstranění histonů z DNA a dalších proteinů pomocí enzymů (proteináza, RNAáza) a následně vlastní extrakce DNA – nejčastěji pomocí fenol–chloroformové extrakce. K izolaci DNA či RNA ze vzorků krve, kostní dřeně či tkání je možné použít komerčně dodávané izolační kity, které výrazně zjednodušují a urychlují postup získání nukleových kyselin. Spektrum vstupního materiálu pro izolaci nukleových kyselin je velmi pestré od buněk periferní krve, aspirátu kostní dřeně, nátěrů, nativního materiálu, mraženého či fixovaného biologického materiálu, apod. Při fixaci biologického materiálu ve formaldehydu a následného zalití do parafínových bloků dochází ke fragmentaci nukleových kyselin, což je pro řadu aplikací nežádoucí a pro řadu analýz i limitujícím faktorem.
Polymerázová řetězová reakce – PCR
Dnes nejužívanější metody v diagnostice jsou založeny na polymerázové řetězové reakci (PCR – Polymerase Chain Reaction). Jejich výhody spočívají především ve vysoké specificitě, citlivosti, možnosti standardizovaného přístrojového provedení s minimálním množstvím biologického materiálu potřebného k vyšetření.
Principem metody je opakovaná denaturace dvouvláknové DNA při 94 – 95 °C následovaná ochlazením reakční směsi na teplotu většinou v rozmezí 50 – 60 °C, kdy se k jednořetězcovým DNA napojují syntetické oligonukleotidové primery, které slouží jako specifická místa počátku polymerace. Cyklus uzavírá dosyntetizování komplementárního řetězce termostabilní polymerázou při teplotě kolem 72 °C. Cyklus se většinou opakuje 20 – 40x, což má za následek miliónové až miliardové zmnožení cílové sekvence DNA. Obdobným způsobem se amplifikuje i mRNA, která se však nejprve musí přepsat do sekvence komplementární DNA (cDNA) s použitím enzymu reverzní transkriptázy. Tato metoda je pak označována jako RT-PCR. Za metodu PCR obdržel Kary Mullis v roce 1993 Nobelovu cenu za chemii. Ze základní metody PCR se k dnešnímu dni vyvinula celá řada různých modifikací, o kterých bude pojednáno později.
Gelová elektroforéza
Gelová elektroforéza patří k nejpoužívanějším separačním technikám sloužícím k analýze nukleových kyselin a proteinů. Principem metody je pohyb záporně nabitých molekul nukleových kyselin (hlavním nositelem náboje nukleových kyselin jsou záporně nabité fosfátové skupiny) v elektrickém poli směrem k anodě. Pomocí gelové elektroforézy můžeme separovat molekuly DNA na základě rozdílných rychlostí pohybu molekul DNA v gelu, které jsou nepřímo úměrné velikosti molekuly DNA. Po ukončení elektroforetické separace je nutno separované fragmenty DNA zviditelnit. Pro vizualizaci DNA se používá značení barvivem, které se váže na DNA, např. ethidiumbromid nebo SYBR Green a v UV záření zviditelnit fragmenty DNA.
Sekvenování DNA
Tímto termínem se označuje metoda vedoucí ke stanovení přesné lineární sekvence nukleotidů v DNA. Od sedmdesátých let 20. století je používána zejména Sangerova metoda sekvenování, která využívá v klasické podobě dideoxynukleotidů ddNTP (tyto ddNTP slouží jako terminátory syntézy) a následné elektroforézy. Při sekvenci Sangerovou metodou dochází opět k cyklické polymeraci, jako v případě PCR, templátem je však již namnožený úsek DNA. Na rozdíl od PCR je polymerace zahajována jen od jednoho primeru. Velkým pokrokem v této metodě bylo zavedení fluorescenčně značených dideoxynukleotidů, kdy PCR produkty zakončené dideoxynukleotidem s fluorochromem jsou pak děleny pomocí kapilární elektroforézy a jednotlivé fluorochromy jsou snímány pomocí laseru. V poslední době se do popředí dostává hlavně pyrosekvenování a další metody, jež slibují zrychlení i zlevnění celého procesu.
RFLP - restrikční reakce
RFLP (restriction fragment length polymorphism, neboli polymorfizmus délky restrikčních fragmentů) je metoda, jejíž podstatou je enzymatické štěpení molekul DNA ve specifickém štěpném místě enzymem, který se nazývá restrikční endonukleáza. Každý typ restrikční endonukleázy štěpí cílovou DNA v různých místech, v závislosti na sekvenci DNA. Po rozdělení vzniklých fragmentů pomocí elektroforézy lze na základě velikosti a počtu fragmentů sledovat rozdíly v délce studovaných sekvencí, tzv. polymorfizmy. Polymorfizmy v délkách restrikčních fragmentů jsou způsobeny mutacemi (např. inzercemi, delecemi a substitucemi bazí) ve studované sekvenci, které způsobí změnu počtu restrikčních míst.
Blotování
Southernův přenos (Southern blotting) je hybridizační metoda využívaná při práci s DNA. Vyvinul ji Edwin Southern. Umožňuje přenos fragmentů DNA z agarového gelu, v němž probíhala elektroforéza, na nitrocelulozovou nebo nylonovou membránu. Následně je vzorek vizualizován pomocí radioaktivně nebo jinak značených sond.
Podobně k analýze RNA slouží tzv. Northern blot a k analýze proteinů Western blot.
Western Blot (též označovaný jako imunoblot) je analytická technika používaná k detekci specifického proteinu ve směsi s dalšími proteiny, např. ve vzorku homogenátu tkáně či jiného biologického vzorku. Využívá gelovou elektroforézu k separaci proteinů podle jejich velikosti. Následně jsou proteiny přeneseny (“přeblotovány”) z gelu na povrch membrány (nejčastěji nitrocelulozové), na jejímž povrchu jsou detekovány specifickými protilátkami.
Expresní DNA čipy
Technologie mikročipů umožňuje získat informace o aktuální transkripci v buňkách. Na podložní sklíčko či malou membránu jsou speciální technologií naneseny desetitisíce až statisíce DNA sond. Dále pak probíhá hybridizace srovnávací mRNA značené jedním fluorochromem, a zároveň mRNA značenou druhým fluorochromem z lyzátu sledovaných buněk. Fluorescenční signály jsou následně počítačově vyhodnoceny a podle jejich poměru stanovena hladina exprese určitých mRNA. Tato metoda je pro svoji finanční nákladnost v současnosti zatím využívána zejména ve výzkumu.
In situ hybridizace, fluorescenční in situ hybridizace (ISH, FISH, CISH)
Metoda vychází z klasické hybridizace nukleových kyselin. Metoda FISH umožňuje pomocí fluorescenčně značených sond vizualizaci konkrétních genů nebo oblastí chromozomů nejen při mitózách (na metafyzických jádrech), ale i v interfázních jádrech a prokáže i malé změny, které klasickou cytogenetickou analýzou není možno stanovit. Systém je možné uspořádat tak, aby bylo možné výslednou reakci pozorovat v mikroskopu s procházejícím světlem (CISH), kdy je detekce prováděna pomocí protilátek a enzymatické reakce, podobně jako imunohistochemické metody. Při značení sondy fluorochromem je možno pozorovat signál fluorescenčním mikroskopem přímo v jádrech buněk a detekovat změny v genomu. Pomocí lokus specifických sond se vyšetřují amplifikace genů, delece chromozomálních oblastí, chromozomální translokace a zlomy. Pomocí sond centromerických lze zjistit počet chromozomů. Hodnotí se buď počet signálů (např. amplifikace genů, počet chromozomů), nebo jejich uspořádání v interfázických jádrech (např. translokace nebo chromozomální zlomy).
Klasická cytogenetická analýza
Vyšetření klasickou cytogenetickou analýzou slouží ke stanovení karyotypu nemocných s vrozenými vývojovými vadami, jedinců s poruchou plodnosti, v prenatální diagnostice k určení chromozomového vybavení plodu, ke zpřesnění diagnózy a určení prognózy některých nádorových onemocnění.
Buňky periferní krve, kostní dřeně, plodové vody nebo tkání se množí v růstových médiích za přísně sterilních podmínek. Speciálním postupem se buňky zastaví ve stadiu mitózy (M-fáze), kdy jsou chromozomy vysoce spiralizované a vhodné pro cytogenetickou analýzu. Pak se preparáty nabarví (například tzv. G-pruhováním), tím je umožněno rozlišení jednotlivých párů chromozomů a vyhodnocení karyotypu klasickou cytogenetickou analýzou.
Komparativní genomová hybridizace (CGH)
Komparativní genomová hybridizace je molekulárně – cytogenetická metoda založená na kvantitativní dvoubarevné FISH. Principem CGH je porovnávání intenzit fluorescence dvou rozdílně fluorescenčně značených DNA sond – DNA pacienta a DNA zdravého jedince. Detekuje a mapuje kvantitativní změny genomu - ztrátu genetického materiálu (delece, monozomie) a nadbytek genetického materiálu (duplikace a amplifikace, trizomie), nedetekuje ale strukturální přestavby chromozomů (translokace, inverze). Metoda analyzuje v jedné reakci celý genom bez předchozích znalostí chromozomových změn. Výhodou metody CGH je, že pro analýzu nevyžaduje dělící se buňky pacienta. CGH má nezastupitelnou úlohu v identifikaci chromozomových aberací u solidních nádorů, u kterých je velmi těžké získat hodnotitelné mitózy. Pomáhá lokalizovat místa v genomu, které mohou mít spojitost se vznikem a vývojem nádorových onemocnění a vytypovat tak onkogeny popř. nádorové supresory hrající roli v daném onemocnění.
Průtoková cytometrie
Průtoková cytometrie je metoda umožňující získání informací o povrchových nebo intracelulárních proteinech na úrovni buňky. Principem průtokové cytometrie je měření a následná analýza fyzikálních charakteristik vyšetřovaných buněk v nosné kapalině interagujících se světelným paprskem. Základními analyzovanými veličinami jsou velikost buněk, denzita jejich vnitřního obsahu (granularita) a intenzita fluorescence. Vzorek značených buněk je vnášen do kapiláry s laminárně proudící kapalinou, kde hydrodynamická isofokusace zajišťuje stabilní pozici a rychlost analyzovaných částic. K vlastnímu stanovení, tedy interakci buněk s laserovým paprskem, dochází v měřící komoře.
V klinické praxi se využívá monoklonálních protilátek proti povrchovým nebo intracelulárním antigenům, které jsou asociovány s typem buňky (T-lymfocyt, B-lymfocyt, apod.), jejím vývojovým stadiem nebo klonalitou (např. lehké řetězce povrchových imunoglobulinů). Klasifikace těchto antigenů vychází z mezinárodní nomenklatury CD (clusters of differentiation).
ZÁVĚR
Na závěr lze shrnout, že diagnostika v oboru patologie je komplexní proces. Erudovaný patolog má v rukou základní makroskopické a mikroskopické vyšetření. Lékař patologický proces klasifikuje a vymezuje jeho rozsah. Hlavním vyšetřovacím přístupem patologů zůstává histologické vyšetření s navazujícími imunohistochemickými a hybridizačními technikami. Stále významnější podíl na stanovení diagnózy, prognózy a predikce chování různých chorob ať už nádorových či nenádorových, mají molekulární metody, které přispívají ke zpřesnění a zlepšení diagnostiky a ke zlepšování léčby pacientů. Tento trend v diagnostice a sledování např. nádorových onemocnění je již zohledněn v nové klasifikaci nádorů vydávané Světovou zdravotnickou organizací.
Poděkování
Podpořeno projektem koncepčního rozvoje výzkumné organizace 00064203 (FN Motol) a projektem OPPK CZ 2.16/3.1.00/24022.
Adresa pro korespondenci:
RNDr. Lenka Krsková, Ph.D.
Ústav patologie a molekulární medicíny
2. lékařská fakulta Univerzity Karlovy v Praze a Fakultní nemocnice v Motole
V Úvalu 84, 150 06 Praha 5
tel.: 224435634
lenka.krskova@lfmotol.cuni.cz
Štítky
Patologie Soudní lékařství Toxikologie
Článek Jak se vám líbí?Článek Sekvenování nové generace
Článek vyšel v časopiseČesko-slovenská patologie

2013 Číslo 3-
Všechny články tohoto čísla
- Molekulární a personalizovaná medicína - budoucnost patologie v 21. století
- Rád se dívám na svět i jinak než mikroskopem
- MONITOR aneb nemělo by vám uniknout, že ...
- ÚVOD DO MOLEKULÁRNÍ PATOLOGIE
-
Prof. MUDr. Zdeněk Lukáš, CSc.
In Memoriam - Polymerázová řetězová reakce: princip metody a využití v molekulární patologii
- Sekvenování – klasická metodika
- Jak se vám líbí?
- Sekvenování nové generace
- MONITOR aneb nemělo by vám uniknout, že ...
- Endometrióza v mezotelovej cyste tunica vaginalis testis. Kazuistika
- MONITOR aneb nemělo by vám uniknout, že ...
- Nepravá výduť stěny žilního štěpu u pacienta s implantovaným MGuard typem koronárního stentu: kazuistické sdělení a popis mikroskopických změn
- Obrovskobuněčná intersticiální pneumonie bez souvislosti s expozicí tvrdokovům
- Praktická poznámka pro elektronové mikroskopiky
- Česko-slovenská patologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Polymerázová řetězová reakce: princip metody a využití v molekulární patologii
- Sekvenování – klasická metodika
- Sekvenování nové generace
- Rád se dívám na svět i jinak než mikroskopem
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



