-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Nepravá výduť stěny žilního štěpu u pacienta s implantovaným MGuard typem koronárního stentu: kazuistické sdělení a popis mikroskopických změn
False aneurysm of the wall of a venous graft in a patient with an implanted MGuard type of coronary stent: case report and description of the microscopic changes
The present case report demonstrates a development of a false aneurysm in a venous coronary bypass graft wall, which developed at the previous MGuard stent implantation area in a 67-year-old patient. Subsequent histological examination revealed a false aneurysm image, without detection of vascular wall layers in its wall. Microscopically mild neointimal proliferation within the stent was also detected, with a strong granulomatous inflammatory reaction, mostly focused on the PET fibre mesh present on the surface of the stent. This article demonstrates the need for a multidisciplinary approach in dealing with pathological changes in stented blood vessels; the authors would also like to remind the public of the possibility of histological examination of stented vessels in the Czech Republic.
Keywords:
coronary bypass – pseudoaneurysm – PCI – MGuard stent – histology
Autoři: Tomáš Jirásek 1; Viktor Kočka 2; Ondrej Szárszoi 3; Jan Pirk 3
Působiště autorů: Ústav patologie 3. LF UK a FNKV, Praha 1; III. interní-kardiologická klinika 3. LF UK a FNKV, Praha 2; Klinika kardiovaskulární chirurgie IKEM, Praha 3
Vyšlo v časopise: Čes.-slov. Patol., 49, 2013, No. 3, p. 137-140
Kategorie: Přehledový článek
Souhrn
Předkládaná kazuistika demonstruje rozvoj nepravého aneuryzmatu stěny žilního aortokoronárního bypassu, které vzniklo v místě předchozí implantace MGuard koronárního stentu do stenotického úseku tohoto bypassu u 67-letého nemocného. Následné histologické vyšetření ukázalo obraz nepravého aneuryzmatu, bez záchytu vrstev stěny cévní v jeho stěně. Mikroskopicky byla dále zjištěna mírná neointimální proliferace stěny štěpu v místě stentu, s výraznou granulomatózní zánětlivou reakcí, která byla vázána převážně na vlákna PET síťky na povrchu stentu. Sdělení ukazuje nutnost multidisciplinárního přístupu při řešení patologických změn ve stěně stentovaných cév, autoři by také rádi upozornili odbornou veřejnost na možnost provádění histologických vyšetření stentovaných cév v České republice.
Klíčová slova:
koronární bypass – pseudoaneuryzma – PCI – MGuard stent – histologie
Rozvoj aneuryzmatu stěny cévního štěpu po aplikaci stentu představuje vzácnou, nicméně známou a v literatuře dokumentovanou komplikaci tohoto výkonu (1–10). V předloženém sdělení ukazují autoři na případu konkrétního nemocného klinický průběh a histomorfologické změny, které lze u tohoto stavu pozorovat. Autoři by rádi odbornou veřejnost upozornili na možnost provádění histomorfologických vyšetření koronárních stentů a na dostupnost této metody v ČR.
Popis případu
67-letý muž, dříve kuřák cigaret, trpící chronickou ischemickou chorobou srdeční, který v roce 1998 prodělal kardiochirurgický výkon (coronary artery bypass surgery – CABG), s provedením anastomózy mezi ramus interventricularis anterior levé koronární arterie a arteria thoracica interna levé strany (tzv. „RIA-LIMA“) a trojnásobného aortokoronárního by-passu žilními štěpy, kdy štěpy byly našity na kmen pravé věnčité tepny, na ramus interventricularis posterior (RIP) pravé koronární arterie a na ramus diagonalis levé koronární arterie. Pro zhoršující se anginózní obtíže mu byla v létě 2010 provedena selektivní koronarografie s nálezem uzávěru žilních štěpů na pravou věnčitou tepnu a RIP a dvou významných stenóz žilního štěpu našitého na ramus diagonalis. Jedna tato stenóza v těle žilního štěpu cca 3 cm od proximální anastomózy byla ošetřena implantací MGuard stentu délky 19 mm, průměru 3 mm, druhá stenóza v distální anastomóze byla ošetřena pomocí balónkové angioplastiky, s reziduální stenózou v distální anastomóze asi 70 % průměru cévy; stent nebylo možné zavést. Pro pozvolnou progresi klinických obtíží byla v květnu 2011 opakována koronarografie, s nálezem kritické 90 % stenózy v distální anastomóze žilního štěpu na ramus diagonalis. V místě implantace stentu MGuard byl nález příznivý s patrnou restenózou do 30 % (obr. 1). Byl indikován druhý kardiochirurgický revaskularizační výkon s našitím nových žilních štěpů na pravou koronární arterii, RIP a ramus diagonalis. Tato reoperace byla provedena v květnu 2011. Vedlejším nálezem byla makroskopicky patrná výduť stěny žilního štěpu v místě zavedení výše popsaného stentu; postižený úsek štěpu byl resekován a spolu s in situ ponechaným stentem a výdutí zaslán k histologickému vyšetření.
Obr. 1. Selektivní koronarografie žilního štěpu na ramus diagonalis. Je patrno nálevkovité ústí štěpu. Oblast dříve implantovaného stentu MGuard (čára) je bez významné restenosy a je patrna kritická 90% stenosa v distální anastomose (šipka). 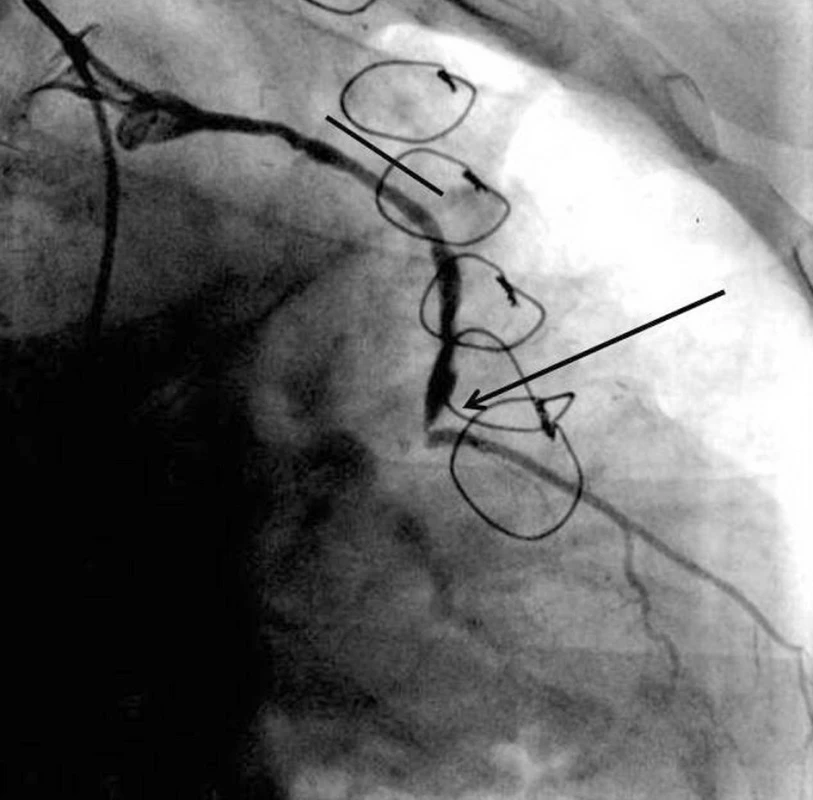
MGuard stent představuje méně obvyklý typ stentu. Jeho základem je ocelový stent, na vnějším povrchu opatřený roztažitelnou síťkou tvořenou PET (polyetylentereftalát), která je ke stentu fixována pouze na jeho proximálním a distálním konci; přítomnost PET síťky na povrchu stentu má za cíl snižovat riziko ruptury ateromového plátu a riziko embolizace po zavedení stentu do cévy (11).
Materiál a metody
K histologickému vyšetření byla zaslána nerozstřižená céva s přiléhajícími měkkými tkáněmi, rozměrů asi 5,5 x 0,5 x 0,5 cm, fixovaná formalinem. Ve vzdálenosti asi 0,3 cm od jednoho neznačeného okraje cévy bylo zastiženo výraznější vyklenutí stěny cévní rozměrů asi 0,8 x 0,6 x 0,7 cm. Před dalším zpracováním byl resekát vyšetřen pomocí RTG, stent MGuard byl dobře a symetricky rozvinut bez patrné fraktury (obr. 2). Zaslaná céva byla poté v celém rozsahu po odvodnění vzestupnou alkoholovou řadou zalita ve skleněné zkumavce do polymetylmetakrylátové pryskyřice s benzoylperoxidem po dobu tří dnů, za vzestupné teploty, včetně v lumen patrného kovového stentu (obr. 3). Po několikadenním vytvrzení pryskyřice byla céva v oblasti vyklenutí stěny histologicky zpracována pomocí plně motorizovaného rotačního mikrotomu HYRAX M55 a wolfram-karbidového nože; touto metodou bylo pořízeno několik řezů stěnou cévy kolmých na její dlouhou osu, které byly dále barveny již standardně běžnými histochemickými metodami (HE, PAS, alciánová modř, modrý trichrom, van Gieson + elastika, von Kossa, Pearlsova reakce).
Obr. 2. Povrchový epitel močového měchýře reaguje negativně s protilátkou proti CK 7 (v pravé části obrázku) přechází do uroteliálního karcinomu, který je CK 7 pozitivní (imunohistologie, 200x). 
Obr. 3. Resekát po zalití do polymetylmetakrylátové pryskyřice. V horní části je patrná výduť stěny štěpu (zelené šipky); červená šipka ukazuje strukturu MGuard stentu, který prosvítá stěnou resekátu. 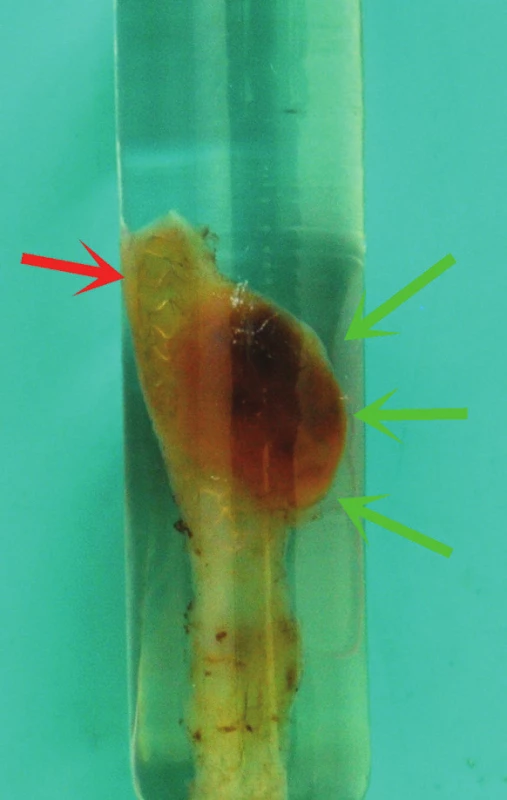
Histopatologický nález v resekátu
Ve vyšetřených řezech byla zachycená stěna větší cévy, která je prakticky kompletně fibrotizovaná, lumen cévy nevykazovalo přítomnost trombózy (obr. 4). Ve stěně cévy byly zachyceny jednak průřezy kovovou částí stentu s opticky prázdným prostorem v okolí, zevně od těchto kovových částí pak cizorodý světlolomný materiál (obr. 5 – 7), který odpovídá shora popsané PET síťce na povrchu stentu. Na více místech byla zachycena poměrně intenzivní, smíšená, převážně však granulomatózní zánětlivá reakce, se záchytem histiocytárních elementů, místy i vzhledu buněk obrovských vícejaderných, dále pak lymfoplazmocytární zánětlivá infiltrace v okolí vláken této síťky. Zánětlivá reakce byla místy přítomna i v okolí zbytků kovových vláken stentu. Hladkou svalovinu a elastické membrány se ve fibrotizované stěně cévy nepodařilo identifikovat. V místě makroskopicky patrné výdutě stěny cévy byl zachycen amorfní eozinofilní materiál, s hojnými opticky prázdnými prostory po cholesterolových krystalech (obr. 8), v jejich blízkosti byla ojediněle též zachycena převážně granulomatózní zánětlivá reakce, místy i pěnité makrofágy. Ložisko bylo mikroskopicky ohraničené vazivovým pouzdrem. Depozice železa nebyla v místě výdutě speciálním barvením prokázána, stejně tak depozita kalcia nebyla zastižena. Shora popsaná výduť neměla charakter pravého aneuryzmatu, mikroskopický obraz ukazuje na možnost starého organizovaného hematomu (pseudoaneuryzmatu). Rozsah neointimální hyperplazie byl měřen individuálně nad každým kovovým vláknem stentu pomocí morfometrického programu NIS Elements AR (Laboratory Imaging s.r.o. Praha), pohyboval se v rozmezí 13,29 – 357,74 μm, průměrná tloušťka neointimy představovala 174,69 μm. Bližší morfometrické zhodnocení tkáně nebylo z důvodu extenzivní fibrózy stěny štěpu provedeno.
Obr. 4. Příčný řez cévou, v levé části vlastní lumen a stěna žilního stěpu s průřezy dráty kovové části stentu (černě) a průřezy síťky; v pravé části oblast nepravého aneuryzmatu (zelené hvězdičky – A). Detail vazivové stěny pseudoaneurysmatu (C). Barveno hematoxylinem eozinem (A, C) a modrým trichromem (B) (zvětšeno 20x; pouze C zvětšení 400x). 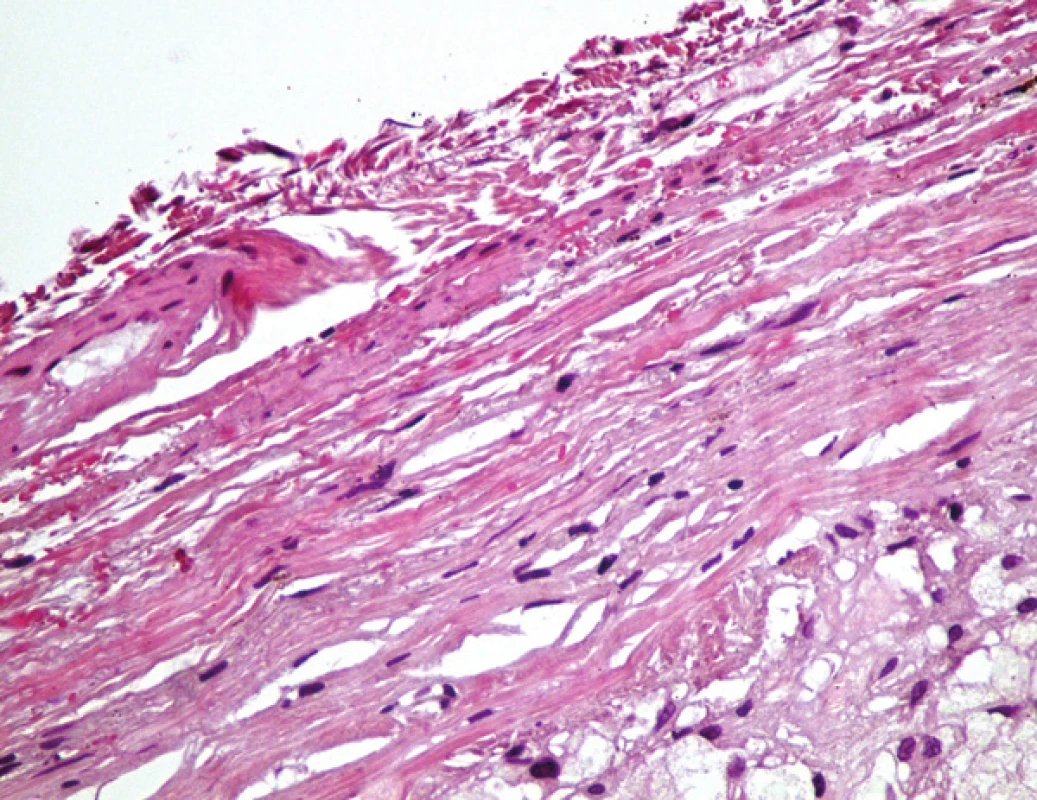
Obr. 5. Detail stěny štěpu, červené šipky označují kovovou část stentu (černě) a opticky prázdné prostory v místě kovového materiálu, který se v původním místě ve tkáni při histologickém zpracování neudržel; zelené šipky ukazují na vlákna síťky stentu. V okolí struktur stentu je přítomna výrazná zánětlivá reakce, včetně nápadných obrovských vícejaderných buněk. Barveno hematoxylinem eozinem (zvětšeno 200x). 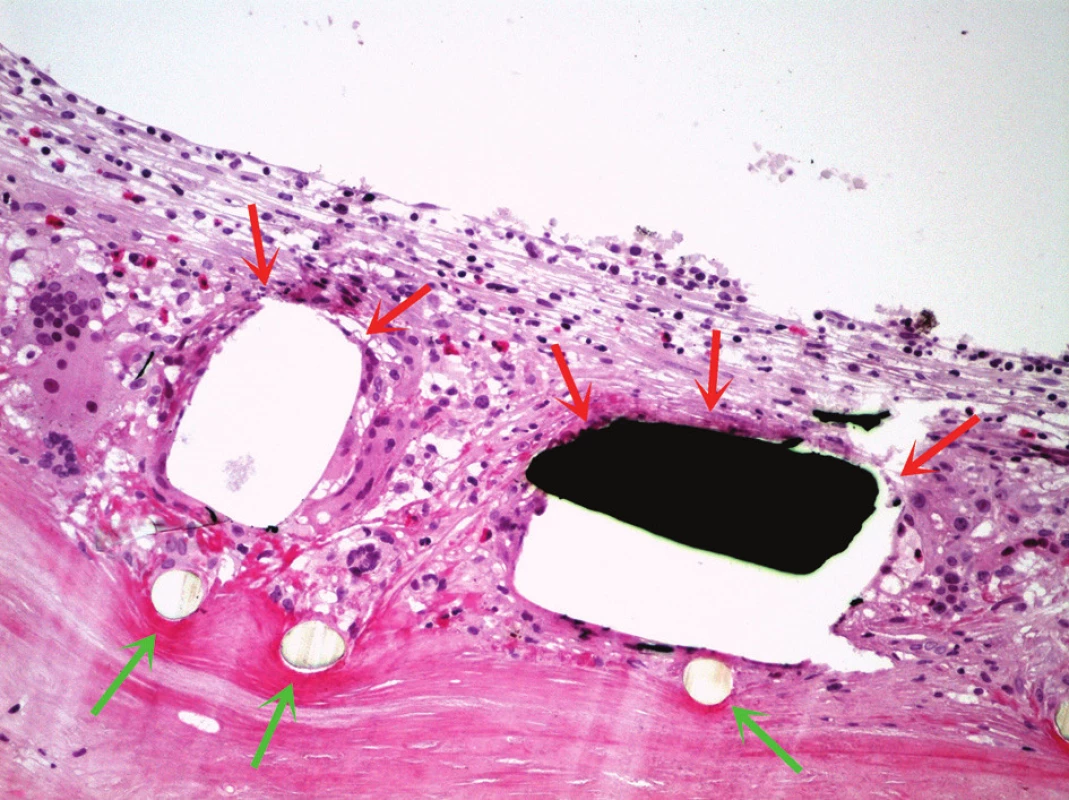
Obr. 6. Identická oblast jako na obr. 5, snímek v polarizovaném světle, červená šipka oznaãuje kovovou část stentu (černě); zelené šipky ukazují na vlákna síťky stentu. Barveno hematoxylinem eozinem (zvětšeno 200x). 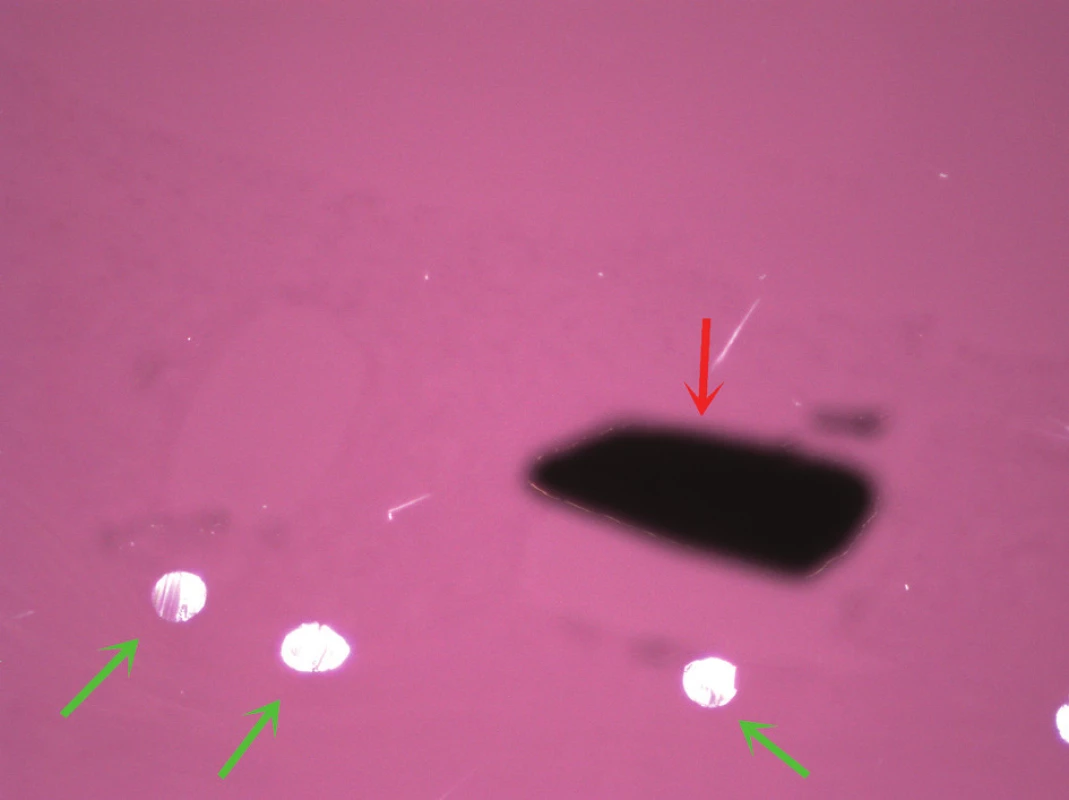
Obr. 7. Detail stěny štěpu, známky fibrotizace stěny cévní. Barveno modrým trichromem (zvětšeno 200x). 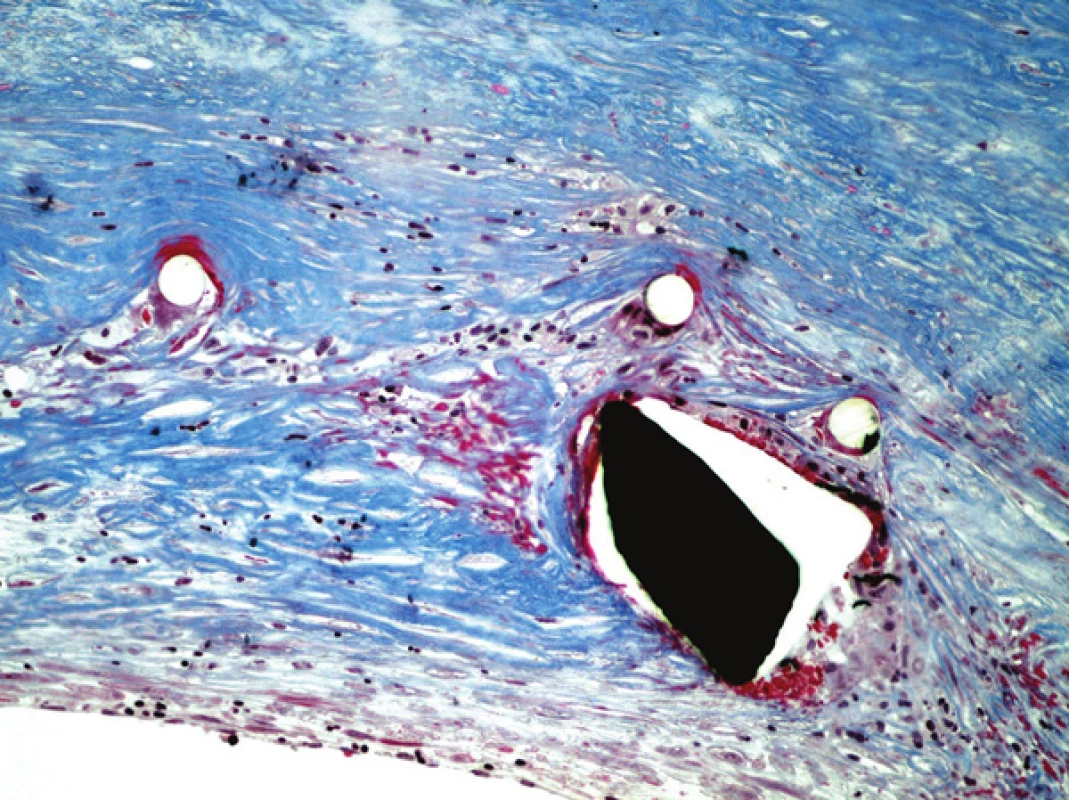
Obr. 8. Detail oblasti nepravého aneuryzmatu, cholesterolové hlatě. Barveno modrým trichromem (zvětšeno 100x). 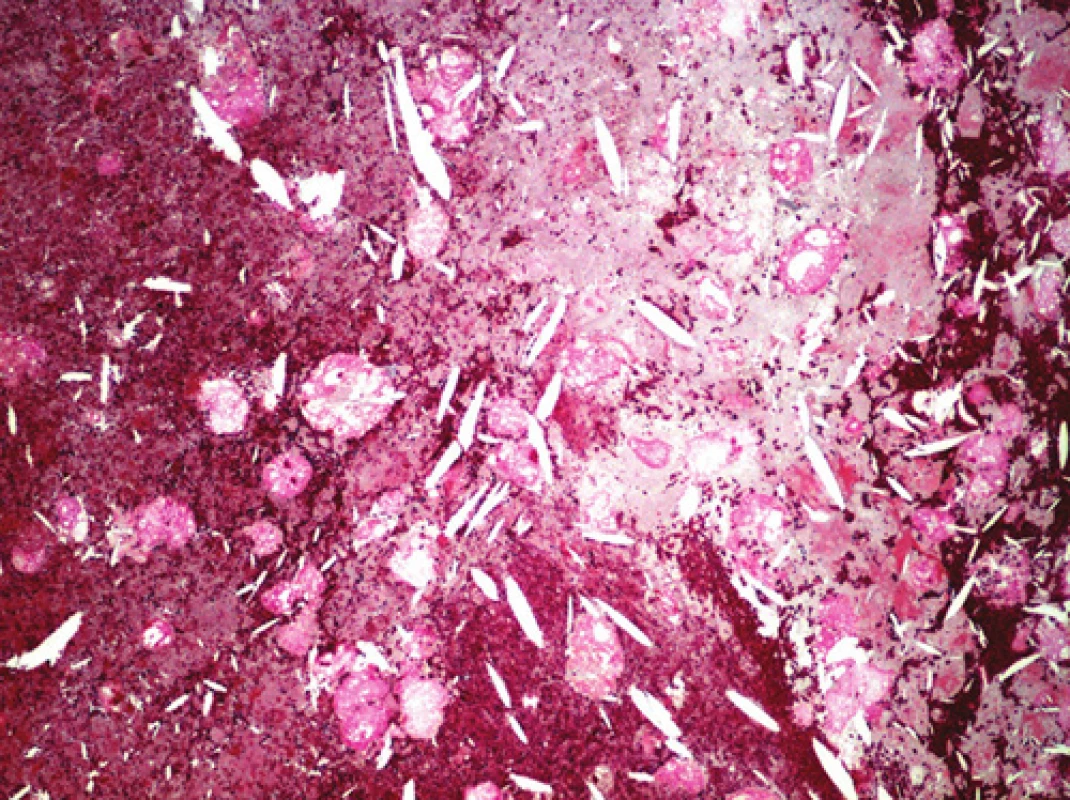
Diskuze
Výdutě srdečních tepen jsou definovány jako lokální rozšíření lumina dosahující alespoň 1,5 až 2-násobku průměru přiléhajícího cévního lumina. Pravá výduť dle IVUS (intravascular ultrasonography) představuje segment cévy s plochou lumen větší nejméně o 50 % proti luminu přiléhající cévy; současně má stěna pravé výduti obsahovat všechny tři vrstvy stěny cévní, tedy tunica intima, media i adventicia (12). Naproti tomu nepravá výduť (pseudoaneuryzma) vzniká v místě perivaskulárního hematomu při poruše integrity stěny cévy. Stěna pseudoaneuryzmatu postrádá typické uspořádání stěny cévní (13). Pseudoaneuryzma obvykle vzniká v souvislosti s koronarografií jako důsledek traumatické disekce či perforace cévy (14,15); rozvoj pseudoaneuryzmatu byl pozorován i v souvislosti s frakturou stentu (16), či jeho malapozicí (17,18).
Rozšíření stěny cévní při jednom okraji zavedeného stentu představuje významnou a klinicky detekovanou změnou u našeho pacienta. Etiopatogeneticky připadalo v úvahu jak pravé, tak i nepravé aneuryzma stěny štěpu. Popsaný histologický nález možnost pravého aneuryzmatu vylučuje, mikroskopický obraz odpovídá staršímu organizujícímu se hematomu. Určení přesného mechanismu a doby vzniku krvácení je obtížné, nejpravděpodobnějším se jeví souvislost vzniku s provedenými koronarografiemi. Možnost malapozice, fraktury stentu, či jen zlomu některého z jeho vláken, jsme vyloučili rentgenologickým vyšetřením explantované cévy před definitivním zpracováním tkáně pro histologické účely.
Popsaný případ dále názorně demonstruje komplexnost změn, které vznikají při a po zavedení stentu v místě jeho aplikace do cévního řečiště. Na prvním místě je třeba jmenovat zánětlivou reakci ve stěně cévní. V našem případě byla přítomna převážně granulomatózní reakce vázaná zvláště na PET síťku stentu, která místy kompletně obklopovala jednotlivá vlákna této síťky@ zánětlivá reakce byla vyjádřena přibližně rovnoměrně po celém obvodu stentu. V okolí kovových částí stentu zánětlivá reakce byla také přítomna, nicméně její intenzita byla nižší. Tento typ reakce je dobře známý z histomorfologických studií, které se zabývají problematikou biokompatibility stentů, včetně stentů potahovaných léky (drug eluted stents – DES). Zánětlivá reakce se v těchto případech spolupodílí u části pacientů na rozvoji stenózy/okluze zavedeného stentu s větším časovým odstupem po jeho aplikaci a představuje v současné době významnou komplikaci této léčebné metody (19,20). Z dalších změn stěny cévní, ke kterým dochází v místě implantace stentu, představuje reakce tunica intima stěny s jejím ztluštěním a rozvojem neointimální proliferace, která může dosáhnout až významného stupně a způsobit stenózu cévy. V našem případě nedosahovala neointimální proliferace ve vyšetřeném úseku významnějšího rozsahu.
Předložený případ představuje, dle autorům dostupných informací, první popis histologických změn stěny cévní v místě aplikace MGuard stentu, který byl získán po jeho terapeutické aplikaci nemocnému; předchozí informace o histologických změnách stěny cévní u MGuard stentů jsou dostupné pouze ze zvířecího modelu. Obraz námi popsaných změn v lidské tkáni vcelku dobře koreluje s těmito výsledky (11). Autoři by rádi zdůraznili potřebu a nutnost multidisciplinárního přístupu při řešení problematiky patologie koronárních stentů a komplikací z ní vznikajících.
Poděkování
Autorský kolektiv děkuje prim. MUDr. Davidu Horákovi z Kardiocentra Krajské nemocnice Liberec, a. s. za laskavé poskytnutí obrazové dokumentace (obrázek 1) k případu.
Práce byla podpořena projektem BIOKOM “Bioaktivní biokompatibilní povrchy a nové nanostrukturované kompozity pro aplikace v medicíně a farmacii” KAN200100801 Akademie věd České republiky.
Adresa pro korespondenci:
doc. MUDr. Tomáš Jirásek, Ph.D.
Ústav patologie 3. LF UK a FNKV
Šrobárova 50, 100 34, Praha 10
tel.: 267 163 199, fax: 267 163 002
e-mail: tjirasek@fnkv.cz
Zdroje
1. Riahi M, Vasu CM, Tomatis LA, Schlosser RJ, Zimmerman G. Aneurysm of saphenous vein bypass graft to coronary artery. J Thorac Cardiovasc Surg 1975; 70(2): 358–359.
2. Sherry CS, Harms SE. MR imaging of pseudoaneurysms in aortocoronary bypass graft. J Comput Assist Tomogr 1989; 13(3): 426–429.
3. Ennis BM, Zientek DM, Ruggie NT, Billhardt RA, Klein LW. Characterization of a saphenous vein graft aneurysm by intravascular ultrasound and computerized three-dimensional reconstruction. Cathet Cardiovasc Diagn 1993; 28(4): 328–331.
4. Dieter RS, Patel AK, Yandow D, et al. Conservative vs. invasive treatment of aortocoronary saphenous vein graft aneurysms: Treatment algorithm based upon a large series. Cardiovasc Surg 2003; 11(6): 507–513.
5. Brilakis ES, Lichtenwalter C, de Lemos JA, et al. A randomized controlled trial of a paclitaxel-eluting stent versus a similar bare-metal stent in saphenous vein graft lesions the SOS (Stenting of Saphenous Vein Grafts) trial. J Am Coll Cardiol 2009; 53(11): 919–928.
6. Mehilli J, Pache J, Abdel-Wahab M, et al. Drug-eluting versus bare-metal stents in saphenous vein graft lesions (ISAR-CABG): a randomised controlled superiority trial. Lancet 2011; 378(9796): 1071–1078.
7. Couto WJ, Livesay JJ, Allam A. Off-pump repair of a giant pseudoaneurysm of a distal saphenous vein bypass graft. Ann Thorac Surg 2005; 80(6): 2376–2378.
8. Gyenes G, Lazzam C, Feindel C, Roth SL. Successful treatment of a saphenous vein graft pseudoaneurysm with PTFE-covered JoStents. Can J Cardiol 2003; 19(5): 569–571.
9. Kavanagh EC, Hargaden G, Flanagan F, Murray JG. CT of a ruptured vein graft pseudoaneurysm: an unusual cause of superior vena cava obstruction. AJR Am J Roentgenol 2004; 183(5): 1239–1240.
10. Topaz O, Rutherford MS, Mackey-Bojack S, et al. Giant aneurysms of coronary arteries and saphenous vein grafts: angiographic findings and histopathological correlates. Cardiovasc Pathol 2005; 14(6): 298–302.
11. Kaluski E, Groothuis A, Klapholz M, Seifart P, Edelman E. Coronary stenting with M-Guard: feasibility and safety porcine trial. J Invasive Cardiol 2007; 19(8): 326–330.
12. Robinson FC. Aneurysms of the coronary arteries. Am Heart J 1985; 109(1): 129–135.
13. Caruso M, Evola S, Fattouch K, et al. Chest pain duelante huge coronary pseudoaneurysm following stent implantation. Intern Med 2011; 50(6): 577–579.
14. Kitzis I, Kornowski R, Miller HI. Delayed development of a pseudoaneurysm in the left circumflex artery following angioplasty and stent placement, treated with intravascular ultrasound-guided stenting. Cathet Cardiovasc Diagn 1997; 42(1): 51–53.
15. Schobel WA, Voelker W, Haase KK, Karsch KR. Occurrence of a saccular pseudoaneurysm formation two weeks after perforation on the left anterior descending coronary artery during baloon angioplasty in acute myocardial infarction. Cathet Cardiovasc Interv 1999; 47(3): 341–346.
16. Okamura T, Hiro T, Fujii T, et al. Large giant coronary aneurysm associated with a fracture of sirolimus eluting stent: a case report. J Cardiol 2008; 51(1): 74–79.
17. Ruin-Nodar JM, Valencia J, Pineda J. Coronary aneurysm after drug-eluting stent implantation. Eur H Journal 2007; 28(23): 2826.
18. Zbinden R, Eshtehardi P, Cook S. Coronary aneurysm formation in a patient early after everolimus-eluting stent: a case report. J Invasive Cardiol 2008; 20(5): 174–175.
19. Kornowski R, Hong MK, Tio FO, Bramwell O, Wu H, Leon MB. Contribution of inflammatory responses and aterial injury to neointimal hyperplasia. JACC 1998; 31(1): 224–230.
20. Schwartz RS, Edelman ER, Carter A, et al. Drug-eluting stents in preclinical studies: Recommended evaluation from a consensus group. Circulation 2002; 106(14): 1867–1873.
Štítky
Patologie Soudní lékařství Toxikologie
Článek Jak se vám líbí?Článek Sekvenování nové generace
Článek vyšel v časopiseČesko-slovenská patologie

2013 Číslo 3-
Všechny články tohoto čísla
- Molekulární a personalizovaná medicína - budoucnost patologie v 21. století
- Rád se dívám na svět i jinak než mikroskopem
- MONITOR aneb nemělo by vám uniknout, že ...
- ÚVOD DO MOLEKULÁRNÍ PATOLOGIE
-
Prof. MUDr. Zdeněk Lukáš, CSc.
In Memoriam - Polymerázová řetězová reakce: princip metody a využití v molekulární patologii
- Sekvenování – klasická metodika
- Jak se vám líbí?
- Sekvenování nové generace
- MONITOR aneb nemělo by vám uniknout, že ...
- Endometrióza v mezotelovej cyste tunica vaginalis testis. Kazuistika
- MONITOR aneb nemělo by vám uniknout, že ...
- Nepravá výduť stěny žilního štěpu u pacienta s implantovaným MGuard typem koronárního stentu: kazuistické sdělení a popis mikroskopických změn
- Obrovskobuněčná intersticiální pneumonie bez souvislosti s expozicí tvrdokovům
- Praktická poznámka pro elektronové mikroskopiky
- Česko-slovenská patologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Polymerázová řetězová reakce: princip metody a využití v molekulární patologii
- Sekvenování – klasická metodika
- Sekvenování nové generace
- Rád se dívám na svět i jinak než mikroskopem
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání





