-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Vyšetření cirkulujících nádorových buněk u karcinomu ledviny
Examination of circulating tumor cells in renal carcinoma
Serial examination of circulating tumor cell presence after renal cancer surgery could become an irreplaceable source of information reporting on tumor heterogeneity and evolution in time. Test for presence of circulating tumor cells belongs to the group of liquid biopsy tests and one of its main advantages is the relatively minimal invasiveness (blood withdrawal), which indeed enables tumor dynamics follow-up. Besides circulating tumor cells the presence in patients with renal cell carcinoma undergoing surgery, molecular character of circulating cells can be evaluated by gene expression analysis.
Keywords:
Renal cell carcinoma – circulating tumor cells – liquid biopsy – Gene expression – circulating tumor microemboli
Autoři: Petr Klézl 1; Jindřich Šonský 1; Eliška Pospíšilová 2; Katarína Kološtová 2; Vladimír Bobek 2,3; Robert Grill 1
Působiště autorů: Urologická klinika FN Královské Vinohrady a 3. LF UK, Praha 1; Oddělení laboratorní diagnostiky, laboratorní genetika, 3. LF UK a FN Královské Vinohrady, Praha 2; III. chirurgická klinika 1. LF UK Praha a FN Motol, Praha 3
Vyšlo v časopise: Ces Urol 2020; 24(2): 100-104
Kategorie: Přehledový článek
Zařazení vyšetření na cirkulující nádorové buňky do běžného algoritmu vyšetření u pacientů po operaci ledviny pro nádor by se mohlo stát nenahraditelným zdrojem informací vypovídajících o heterogenitě a vývoji nádoru v průběhu onemocnění. Vyšetření na přítomnost cirkulujících nádorových buněk spadá do skupiny takzvaných tekutých biopsií, jejichž neopomenutelnou výhodou je jejich minimální invazivnost při získávání vzorku (odběr periferní krve), které umožňuje sledování vývoje tumoru. Dále je možné u pacientů s cirkulujícími nádorovými buňkami podstupujících operaci pro karcinom ledviny vyšetřit molekulární charakter cirkulujících buněk zhodnocením analýzy genové exprese.
Souhrn
Zařazení vyšetření na cirkulující nádorové buňky do běžného algoritmu vyšetření u pacientů po operaci ledviny pro nádor by se mohlo stát nenahraditelným zdrojem informací vypovídajících o heterogenitě a vývoji nádoru v průběhu onemocnění. Vyšetření na přítomnost cirkulujících nádorových buněk spadá do skupiny takzvaných tekutých biopsií, jejichž neopomenutelnou výhodou je jejich minimální invazivnost při získávání vzorku (odběr periferní krve), které umožňuje sledování vývoje tumoru. Dále je možné u pacientů s cirkulujícími nádorovými buňkami podstupujících operaci pro karcinom ledviny vyšetřit molekulární charakter cirkulujících buněk zhodnocením analýzy genové exprese.
Klíčová slova:
karcinom ledviny – cirkulující nádorové buňky – tekutá biopsie – genová exprese – mikroemboly cirkulujícího nádoru
ÚVOD
Cirkulující nádorové buňky (CTC) jsou popisovány jako maligní buňky nacházející se v periferní krvi, pocházejí z primárního či sekundárního ložiska tumoru, které popsal již v roce 1869 Ashoford (1). Zdá se, že kterýkoli aspekt diagnostiky, léčby a farmakokinetiky onkologického onemocnění může být zásadním způsobem ovlivněn identifikací cirkulujících či diseminovaných nádorových buněk (2).
V současné době mohou být CTC izolovány prakticky u všech druhů urologických malignit, ale ne ve všech stadiích. S postupně se zdokonalující technikou se zlepšuje i jejich záchyt a charakterizace. Počet a charakterizace CTC má potenciál zlepšit monitoraci onemocnění, ale také vést terapii a predikovat průběh. V současné době je značným nedostatkem CTC vyšetřování nedostatek standardizovaných postupů. Jedinou doposud schválenou metodou je systém Cellsearch® (schválen FDA v USA r. 2005), jako pomocný marker k určení prognózy u metastatického karcinomu prostaty, karcinomu prsu a karcinomu kolorekta.
Na rozdíl od karcinomu prostaty, nemáme u karcinomu ledviny doposud využitelný onkomarker. Co se týče incidence nádoru ledviny dosahujeme v ČR celosvětového prvenství. CTC by mohly být vhodným kandidátem na pozici biomarkeru u nádoru ledviny. V posledních letech přišli s rozvojem imunocytochemie a dalších metod zajímavé výsledky několika studií s CTC. Doposud se však nepodařilo zařadit vyšetření CTC do vyšetřovacího algoritmu renálního karcinomu, a to jak lokalizovaného, tak metastatického.
METODY DETEKCE CTC
Řídce se vyskytující CTC v periferní krvi (od ‑ hadem jedna buňka na miliardu krevních buněk) vyžadují využití pokročilých laboratorních a bioinženýrských technologií k jejich separacia určení jejich počtu. K detekci CTC u nádorů ledvin se nejčastěji využívá metod založených na:
- izolaci buněk dle epiteliálních či non‑epiteliálních markerů (např. EpCAM – Epithelial Cell Adhesion Molecule, CA IX – carboanhydráza 9, CD 147…),
- detekci CTC pomocí RT‑PCR (cílem této metody jsou nejčastěji detekce transkritpů CA IX, VHL – gen Von‑Hippel‑Lindau, CDH 6 – Cadherin (6)),
- izolace na základě velikosti (např. filtrace dle ve ‑ likosti – aparát Metacell – obr. č. 1) v kombinaci s cytomorfologickou a genovou analýzou (3).
Obr. 1. Metacell separační aparát a schéma separace
Fig. 1. The MetaCell separation device and the separation scheme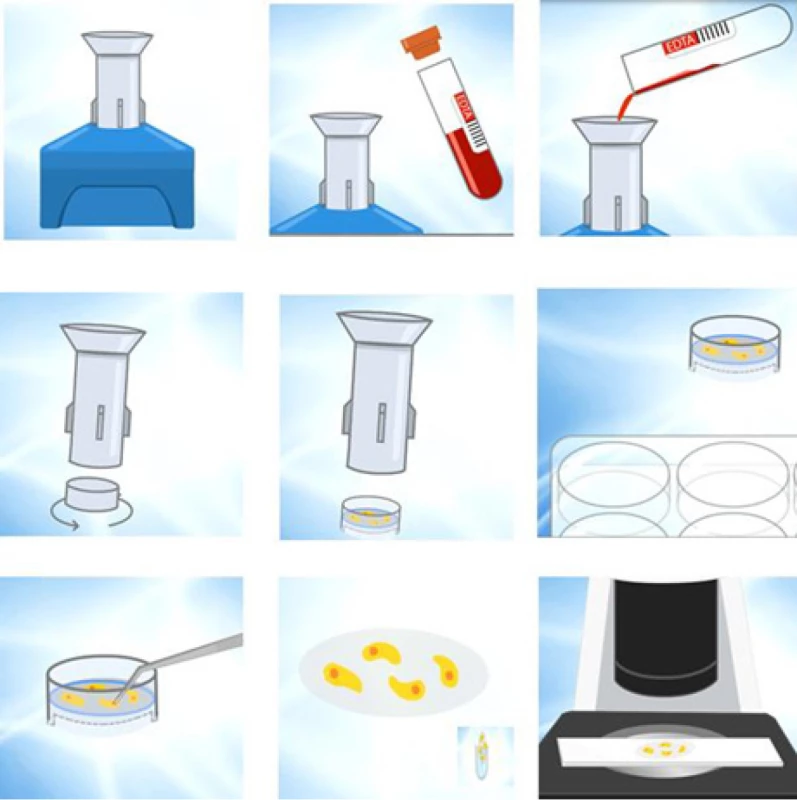
VÝSLEDKY STUDIÍ
V studii Zhu et al. (2014), testovali filtrační systém CellSieveTM v kombinaci s imunofluorescenčními metodami (Obr. č. 2), kdy na nádorových buňkách detekovali přítomnost CD45, CD10 a vimentinu. Kombinací těchto tří markerů (CD45-, CD10+, VIM+) bylo dosaženo na třech typech buněčných linií světlobuněčného renálního karcinomu (ccRCC) detekce nádorových buněk u 98, 98 a 97 % (4).- V roce 2017 byly prezentovány výsledky studie srovnávající účinnost různých metod separace CTC u ccRCC. Studie srovnávala imunohistochemickou metodu založenou na přítomnosti EpCAM metodou CellSearch® – dosahující slabších výsledků (29 %), dále metodu leukocytární deplece, dosahující o něco lepších výsledků (40 %), a metodu separace na podkladě velikosti (Parsortix systém), dosahující nejlepších výsledků (až 87 %). Separační filtrační metoda Parsortix umožnila testování exprese cytokeratinu 8. Ten se zdá být velmi slibným biomarkerem a také velmi výhodným v kombinaci se systémem Parsortix k monitoraci léčby a průběhu one ‑ mocnění (5).
V dalších studiích byly CTC detekovány v periferní krvi u pacientů s karcinomem ledviny pomocí imunocytochemie a PCR. Imunocytochemickými metodami bylo dosaženo detekce CTC u 32–53 % pacientů s metastatickým onemocněním (6, 7, 8). Analýzou PCR bylo dosaženo detekce CTC v rozmezí mezi 37,5 % a 49 % (9, 10). Buchner a kol. navíc studovali 256 vzorků kostní dřeně pacientů s nemetastatickým karcinomem ledviny a zaznamenali úspěšnost detekce diseminovaných nádorových buněk (DTC) u 25 % vzorků, ale bez jakéhokoliv prognostického významu. Prognostický význam DTC cytokeratin pozitivních izolovaných z kostní dřeně byl demonstrován u 55 pacientů s metastatickým karcinomem ledviny ve srovnání s 256 pacienty bez systémového postižení, přičemž signifikantně více DTC bylo detekováno u metastatického onemocnění (42 % vs. 25 %). Vícerozměrná analýza poukázala, že tři a více cytokeratin pozitivních DTC v kostní dřeni u metastatického karcinomu ledviny je nezávislý prognostický faktor (11). Bluemke a kol. hodnotily přítomnost CTC ze vzorků periferní krve od 154 pacientů s karcinomem ledviny získané pomocí metody magnetické separace s následnou imunohistochemickou detekcí cytokeratinu. Četnost cytokeratin‑pozitivních CTC a tumoru‑podobných bez exprese cytokeratinu ukázala významnou korelaci s postižením lymfatických uzlin a přítomností synchronních metastáz u karcinomu ledviny. CTC byly identifikovány ve 41% vzorků u 53% pacientů. Ve vícerozměrné analýze, cytokeratin‑pozitivní CTC byly identifikovány jako nezávislý prognostický faktor pro kratší celkové přežití. Je zajímavé, že v pooperačních krevních vzorcích byl vyšší záchyt CTC ve srovnání se vzorky před výkonem, což značí zvýšenou diseminaci nádorových buněk v průběhu operace (8). Basso et al. využili metody CellSearch® k ozřejmění významu CTC k určení prognózy pacientů s karcinomem ledviny v rámci první linii systémové léčby. Z jeho výsledků vyplývá, že pacienti s tři a více CTC mají signifikantně kratší dobu do progrese (5,8 proti 15 měsícům) a celkového přežití (13,8 proti 52,8 měsíců). Avšak v této studii nepozoroval významnou korelaci mezi přítomností CTC a odpovědí na léčbu (12).Jedním z významných faktorů ovlivňujících přežívání CTC v krevním řečišti byly tzv. mikroemboly cirkulujícího nádoru (CTM – Circulating Tumor Microemboli). CTM jsou složeny z buněčných clusterů obsahujících dvě a více CTC (i více než 50), leukocyty, fibroblasty, endoteliální buňky a trombocyty (13). CTM mají vysoký metastatický potenciál pomocíinhibice apoptózy, podporováním buněčné klonální proliferace, poskytnutím odolnosti vůči mechanickým silám a ochranou centrálně uložených buněk před identifikací NK buňkami a jejich cytolytickou aktivitou (14). V rámci studií s kolorektálním karcinomem byla pozorována kratší doba přežití u pacientů s CTM oproti pacientům „pouze“ s CTC (15). U nemalobuněčného karcinomu plic byla pozorována schopnost CTM poskytnout buňkám rezistenci vůči cytotoxickým léčivům (16). Nagaya a kol. v roce 2018 prezentovali případ, kdy sledovali vývoj počtu CTC u pacientky s metastatickým karcinomem ledviny (pravděpodobně nesvětlobuněčným) při léčbě sunitinibem. Na začátku léčby pozorovali nárůst počtu CTC, po kterém následoval postupný pokles až pod iniciální hodnotu před léčbou (17).Obr. 2. Cirkulující nádorová buňka od pacienta s karcinomem ledviny po separaci, pětidenní in vitro kultivaci a fluorescenčním barvení, obraz z fluorescenčního mikroskopu
Fig. 2. A circulating tumour cell from a patient with renal cell carcinoma after separation, a five-day in vitro culture, and fluorescent staining; a fluorescence-microscope image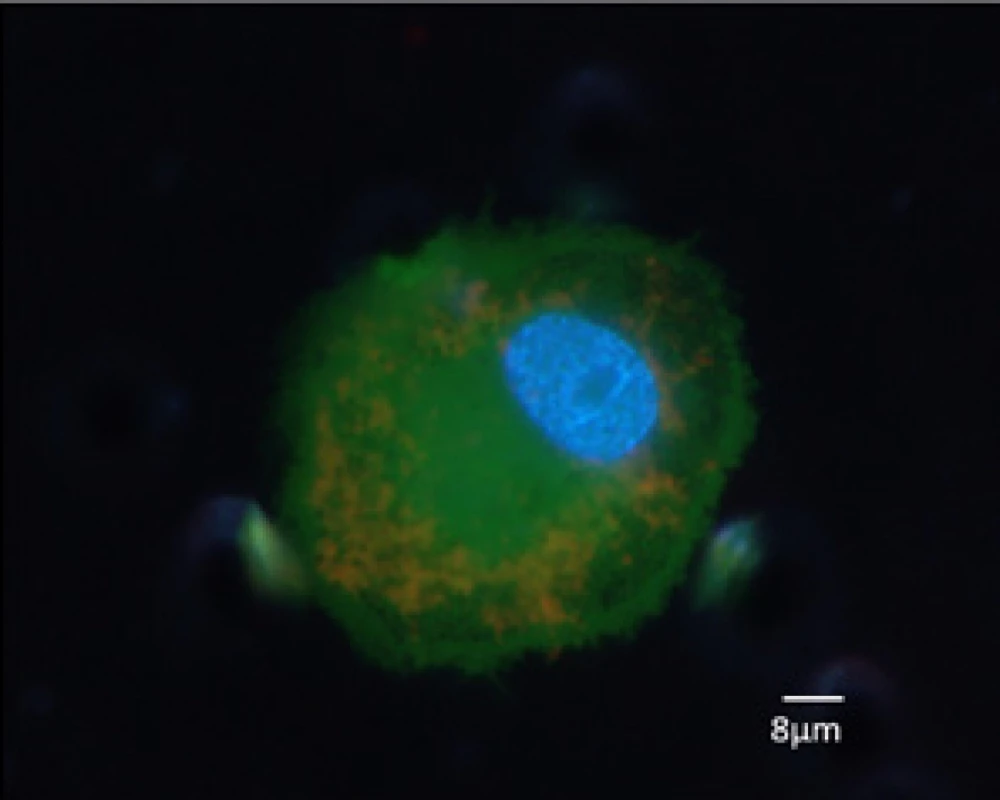
ZÁVĚR
Výzkum CTC by mohl poskytnout karcinomu ledviny tolik chybějící onkomarker umožňující správný management léčby. Zavedení analýzy CTC v denní klinické praxi pro pacienty s RCC se však v tuto chvíli zdá být stále ještě daleko. Pokroky získané v posledních letech v izolaci a analýze CTC však přinášejí optimizmus ohledně budoucích terapeutických možností u pacientů s RCC.Střet zájmů: Žádný.Prohlášení o podpoře: Zpracování článku neby ‑ lo podpořeno žádnou společností.Došlo: 19. 8. 2019Přijato: 22. 11. 2019Kontaktní adresa:MUDr. Petr Klézl
Urologická klinika FNKV a 3. LF UKŠrobárova 1150/50,100 34 Praha 10e‑mail: petr.klezl@fnkv.cz
Zdroje
1. Asworth TR. A case of cancer in which cells similar to those in tumors were seen in the blood after death. Aust Med J 1869; 14 : 146–149.
2. Lugo TG, Braun S, Cote RJ, Pantel K, Rusch V. Detection and measurement of occult disease for the prognosis of solid tumors. J Clin Oncol 2003; 21 : 2609–2615.
3. Santoni M, Cimadamore A, Cheng L, et al. Circulating Tumor Cells in Renal Cell Carcinoma: Recent Findings and Future Challenges. Front Oncol 2019; 9 : 228.
4. Zhu P, Ho T, Castle EP, et al. Detection of Circulating Tumor Cells in Renal Cell Carcinoma. San Diego: AACR, 2014.
5. Maertens Y, Humberg V, Erlmeier F, et al. Comparison of isolation platforms for detection of circulating renal cell carcinoma cells. Oncotarget 2017; 50 : 87710–87717.
6. Bilkenroth U, Taubert H, Riemann D, et al. Detection and enrichment of disseminated renal carcinoma cells from peripheral blood by immunomagnetic cell separation. Int J Cancer 2001; 92 : 577–582.
7. Meye A, Bilkenroth U, Schmidt U, et al. Isolation and enrichment of urologic tumor cells in blood samples by a semi‑automated CD45 depletion autoMACS protocol. Int J Oncol 2002; 21 : 521–530.
8. Bluemke K, Bilkenroth U, Meye A, et al. Detection of circulating tumor cells in peripheral blood of patients with renal cell carcinoma correlates with prognosis. Cancer Epidemiol Biomarkers Prev. 2009; 18 : 2190–2194.
9. Shimazui T, Yoshikawa K, Uemura H, et al. Detection of cadherin-6 mRNA by nested RT‑PCR as a potential marker for circulating cancer cells in renal cell carcinoma. Int J Oncol 2003; 23 : 1049–1054.
10. Li G, Passebosc‑Faure K, GentilPerret A, et al. Cadherin-6 gene expression in conventional renal cell carcinoma: a useful marker to detect circulating tumor cells. Anticancer Res. 2005; 25 : 377–381.
11. Buchner A, Riesenberg R, Kotter I, et al. Frequency and prognostic relevance of disseminated tumor cells in bone marrow of patients with metastatic renal cell carcinoma. Cancer 2006; 106 : 1514–1520.
12. Basso U, Facchinetti A, Rossi E, et al. Prognostic role of circulating tumor cells‑CTCs in metastatic renal cell carcinoma. J Clin Oncol. 2017; 35 : 4568–4568.
13. Krebs MG, Metcalf RL, Carter L, et al. Molecular analysis of circulating tumour cells‑biology and biomarkers. Nat Rev Clin Oncol. 2014; 11 : 129–144.
14. Palumbo JS, Talmage KE, Massari JV, et al. Platelets and fibrin(ogen) increase metastatic potential by impeding natural killer cell‑mediated elimination of tumor cells. Blood 2005; 105 : 178–185.
15. Zhang D, Zhao L, Zhou P, et al. Circulating tumor microemboli (CTM) and vimentin+ circulating tumor cells (CTCs) detected by a size‑based platform predict worse prognosis in advanced colorectal cancer patients during chemotherapy. Cancer Cell Int. 2017; 17 : 6.
16. Hou JM, Krebs MG, Lancashire L, et al. Clinical significance and molecular characteristics of circulating tumor cells and circulating tumor microemboli in patients with small‑cell lung cancer. J Clin Oncol. 2012; 30 : 525–532.
17. Nagaya N, Kanayama M, Nagata M, Horie S. The Surge in the Number of Circulating Tumor Cells Following Treatment with Sunitinib for Metastatic Renal Cell Carcinoma. Intern Med. 2018; 57(18): 2695–2700
Štítky
Dětská urologie Nefrologie Urologie Onkologie
Článek vyšel v časopiseČeská urologie
Nejčtenější tento týden
2020 Číslo 2- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Kterým pacientům se SLE nasadit biologickou léčbu?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Nostiriazyn – spolehlivá 1. volba u nekomplikovaných infekcí močových cest
- Nejasný stín na plicích – kazuistika
-
Všechny články tohoto čísla
- Vyšetření cirkulujících nádorových buněk u karcinomu ledviny
- Přirozený proces hojení po částečné excizi glandu penisu za použití nové hemostatické náplasti VerisetTM – popis metody a prvotní pohled chirurga
- Biopsie nádorů ledvin – indikace, provedení, výsledky
- Náš přístup k diagnostice a léčbě nehmatného varlete
- Brachyterapie s vysokým dávkovým příkonem jako orgán šetřící léčba u časného karcinomu penisu
- Poranění pankreatu spojené s urologickým výkonem a možnosti řešení pankreatické píštěle
- Konverze kontinentní derivace na konduit retubularizací stěny neoveziky
- Objemný cystický lymfangiom levé nadledviny – diferenciálně diagnostický omyl
- Pandemii navzdory – Komplexní novinky v onkourologii 2020
- Editorial
- Rekonstrukce bulbární uretry po rozsáhlém zánětlivém abscedujícím procesu v oblasti hráze na podkladě cizího tělesa
- Komentář k práci Drlík P, Čermák M. Rekonstrukce bulbární uretry po rozsáhlém zánětlivém abscedujícím procesu v oblasti hráze na podkladě cizího tělesa (video) Ces Urol 2020; 24(2): 90–93
- Rukou asistovaná laparoskopická adrenalektomie u objemných tumorů nadledvin
- Česká urologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Biopsie nádorů ledvin – indikace, provedení, výsledky
- Vyšetření cirkulujících nádorových buněk u karcinomu ledviny
- Přirozený proces hojení po částečné excizi glandu penisu za použití nové hemostatické náplasti VerisetTM – popis metody a prvotní pohled chirurga
- Objemný cystický lymfangiom levé nadledviny – diferenciálně diagnostický omyl
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



