-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Brachyterapie s vysokým dávkovým příkonem jako orgán šetřící léčba u časného karcinomu penisu
Background: HDR brachytherapy of penis is suitable organ-sparing method of treatment for selected patients.
Material and methods: A total of 28 patients were treated at the Department of Oncology and radiotherapy at University Hospital Hradec Králové between 2002 and 2020 for early penile tumor using high-dose rate brachytherapy (HDR brachytherapy), the total dose was 18× 3 Gy, applied twice a day.
Results: The median follow-up of patients is 92 months (3,7–219). Seven patients developed recurrence of the penile cancer (25%) with median time to recurence of 39 months (3.7–219). Six patients underwent partial amputation of penis without further recurence. Twenty patients are alive with a preserved penis, 19 of them are sexually active. Four patients died (1 patient of duplicate lung tumor, 3 of internal comorbidities). Five-year overall survival in our cohort is 96,4% (95% CI: 89,6–100,0%), penile cancer free survival 100%, five-year disease free survival is 77,7% (95% CI: 61,8–93,5%) and fiveyear survival without local reccurence is 81,1% (95% CI: 66,0–96,1%).
Conclusion: Hyperfractionated interstitial high-dose rate brachytherapy with 18 times 3Gy per fraction twice daily is a promising method in selected patients with penile carcinoma and deserves further evaluation in larger prospective study.
Keywords:
brachytherapy – conservative treatment – penile carcinoma
Autoři: Denisa Pohanková 1; Igor Sirák 1; Linda Kašaová 1; Jakub Grepl 1; Petr Paluska 1; Miroslav Louda 2; Lukáš Holub 2; Jiří Špaček 2
; Petr Prošvic 3; Jiří Petera 1
Působiště autorů: Klinika onkologie a radioterapie, FN a LF Hradec Králové 1; Urologická klinika, FN a LF Hradec Králové 2; Urologické oddělení, Nemocnice Náchod 3
Vyšlo v časopise: Ces Urol 2020; 24(2): 132-140
Kategorie: Originální práce
Souhrn
Východiska: HDR brachyterapie penisu je vhodnou orgán šetřící metodou léčby u vybraných pacientů s časným karcinomem penisu (Tis, T1–2) v porovnání s chirurgickou terapií.
Materiál a metody: Celkem 28 pacientů bylo mezi lety 2002–2020 léčeno na Klinice onkologie a radioterapie FN Hradec Králové pro časný tumor penisu pomocí brachyterapie s vysokým dávkovým příkonem (HDR brachyterapie), celková dávka byla 18× 3 Gy, aplikována 2× denně.
Výsledky: Medián sledování pacientů činí 92 měsíců (3,7–219). S mediánem do recidivy 39 měsíců (7–98) se u sedmi pacientů rozvinula recidiva na glans penis (25 %). Šest pacientů podstoupilo parciální amputaci penisu bez další recidivy, u jednoho pacienta byla provedena parciální amputace pro radionekrózu. Dvacet pacientů žije se zachovalým penisem, z toho sexuálně aktivně 19 pacientů. Celkem čtyři pacienti zemřeli (jeden zemřel na duplicitní tumor plíce, další tři na interní komorbidity). Celkové pětileté přežití v našem souboru pacientů je 96,4 % (95 % CI: 89,6–100,0 %), pětileté přežití bez lokálních známek karcinomu penisu či jeho diseminace 100 %, pětileté přežití bez známek recidivy 77,7 % (95 % CI: 61,8–93,5 %) a pětileté přežití bez lokální recidivy 81,1 % (95 % CI: 66,0–96,1 %).
Závěr: HDR BT s dávkou 18× 3 Gy aplikovaných 2x denně je slibná metoda orgán zachovávající léčby u vybraných pacientů s karcinomem penisu a zaslouží si zhodnocení ve větší prospektivní studii.
Klíčová slova:
brachyterapie – konzervativní léčba – karcinomy penisu
ÚVOD
Karcinom penisu patří ve vyspělých zemích ke vzácným nádorovým onemocněním, v Evro ‑ pě a Severní Americe incidence dosahuje méně než 1/100 000 obyvatel, což je < 1 % ze všech malignit u mužů (1). Avšak v některých asijských, afrických a jihoamerických zemích je výskyt tohoto onemocnění až kolem 10 % všech malignit (2). V zemích, kde je již v dětském věku chlapcům prováděna obřízka, je incidence karcinomu penisu blízko 0/100 000 obyvatel, jedná se mimo jiné např. o Izrael a jiné asijské a africké oblasti, kde se z náboženských důvodů tradičně provádí cirkumcize. Je známo, že cirkumcize v dětském věku snižuje až o 70 % riziko vzniku karcinomu penisu během života (3).
Na druhou stranu se toto onemocnění může rozvinout i u pacientů po předchozí obřízce, ve většině případů se jedná o HPV asociovanou infekci (4). Celkově se odhaduje, že asi polovina nádorů penisu je asociována s infekcí lidským papillomavirem, nejčastěji se jedná o sérotypy HPV 16, 18, 31, 33, 45, 56 a 65. Dalšími rizikovými faktory jsou užívání tabákových výrobků, sexuální praktiky a hygiena (5, 6), v neposlední řadě také chronický zánět, který může být v souvislosti s např. lichen sclerosus nebo chronickým zánětem předkožky při fimóze (7). 95 % karcinomů penisu tvoří skvamózní nádory, ostatní typy nádorů (melanom, sarkom) jsou v této oblasti vzácné. Nejčastější výskyt je v oblasti glandu a preputia.
Karcinom penisu se typicky objevuje u starších pacientů (medián v USA je kolem 68 let) (8), ale nezanedbatelný výskyt je i u mladších pacientů, pro které by byl radikální chirurgický výkon mutilující fyzicky i psychicky. Mnoho pacientů v době zjištění diagnózy žije aktivním sexuálním životem, a proto je zásadní snahou u karcinomu in situ a T1–T2 karcinomů orgán zachovávající léčba. Z léčebných technik, které se snaží o co nejmenší poškození pacienta, můžeme jmenovat například glans resurfacing či laserovou terapii u velmi malých superfi ‑ ciálních lézí. Při primární snaze o zachování orgánu se osvědčily i radioterapeutické metody (zevní radioterapie nebo brachyterapie). Při nemožnosti využít šetrnější techniky u větších nádorů je třeba pacientům nabídnout chirurgickou léčbu (excize, parciální nebo totální glansektomie), která však, při nesprávné indikaci (zvláště u malých karcinomů), může i zbytečně poškodit pacienta s negativním ovlivněním jeho kvality života (9).
Výběr vhodné terapie závisí na velikosti tumoru, jeho histologii, gradingu a stagingu, lokalizaci nádoru a v neposlední řadě také preferencích pacienta. Vzhledem k riziku vzniku časných metastáz do lymfatických uzlin je velmi důležité vstupní zhodnocení regionálních (inguinálních a pelvických) lymfatických uzlin. U pacientů s časnými nádory (pTis, pTa a pT1G1) je riziko uzlinových metastáz velmi nízké, pacienti s pT1G2 mají střední riziko a pacienti s pT1G3 a většími nádory s cN0 mají riziko lymfogenní disseminace vysoké, u takových pacientů bývá doporučován chirurgický staging lymfatických uzlin. U pacientů s hmatnými tříselnými uzlinami je indikována lymfadenektomie, v době diagnózy má cca 20 % pacientů palpovatelné regionální lymfatické uzliny (10). Lokálně pokročilý karcinom penisu vyžaduje multimodální přístup, který zahrnuje primání lymfadenektomii a adjuvatní radioterapii a/nebo chemoterapii, avšak i přes tuto agresivní léčbu má špatnou prognózu se signifikantní morbiditou a mortalitou (11).
Skvamózní karcinomy patří všeobecně k radiosenzitivním nádorům, proto radioterapie hraje v terapii karcinomu penisu velkou roli. Mezi používané metody patří zevní radioterapie a brachyterapie (BT). Zevní radioterapie v léčbě lokalizovaného karcinomu se vyznačuje dobrou lokální kontrolou (u T1–2 asi 62 % v pěti letech sledování), přibližně ve 40 % případů uchrání pacienta od mutilujícího chirurgického výkonu (10). U tumorů T3–4 je pětiletá lokální kontrola cca 40 % a desetiletá pravděpodobnost zachování penisu asi 38 % (12). Pro zajištění reprodukovatelné dávky je penis vkládán do krytu z plexiskla, ozařování probíhá v supinační poloze. Při plánování zevní radioterapie zahrnuje klinický cílový objem (CTV) celou tloušťku penisu a bezpečnostní okraj minimálně 1 cm, dále se přidává další 1 cm k zajištění denních variací nastavení k vytvoření plánovacího objemu (PTV), který tak zvětšuje ozařovaný objem celkem o 2 cm oproti původní velikosti nádoru (13), proto je ozářena i větší oblast zdravé tkáně s negativními důsledky s tím spojenými. V současné době je doporučovaná celková dávka 65–70 Gy.
Další metodou radioterapie u T1–2 tumorů je brachyterapie, u které je pravděpodobnost zachování penisu u 74 % pacientů (14). V urologii se již dlouhou dobu velmi úspěšně uplatňuje brachyterapie v léčbě nádorů prostaty s velmi dobrými terapeutickými výsledky, ať již v monoterapii nebo jako součást kombinované terapie. V léčbě tumoru penisu se brachyterapie využívá již od 80. let 20. století, kdy se začala používat brachyterapie s nízkým dávkovým příkonem (low dose rate, LDR), tj. 0,45–0,5 Gy/hod. Jde o efektivní metodu pro T1–2 karcinomy penisu a některé vybrané T3 léze (menší než 4 cm). Oproti zevní radioterapii tato terapie trvá pouze 5–7 dní a dovoluje podání vysoké dávky (60–70 Gy) do oblasti tumoru při šetření okolních struktur (15). pěti a desetileté zachování penisu je 88 % a 67 % (16). Mezi hlavní nevýhody patří nutnost manuálního zavádění iridiových drátů do plánované ozařované oblasti, je zde proto zvýšené riziko radiační zátěže pro ošetřující personál.
Další možností terapie byla v minulosti spíše i technika muláže. Na oblast tumoru se přikládal individuálně zhotovený aplikátor, ve kterém byly zabudovány iridiové drátky. Terapie trvala přibližně jeden týden. Tato metoda byla vhodná pouze pro zcela superficiální tumory vzhledem k rychlému dávkovému spádu do hloubky. Nevýhodou byla celkově nižší dávka ve srovnání s intersticiální brachyterapií, proto poměrně velké množství pacientů vyžadovalo záchrannou chirurgickou léčbu po selhání léčby (cca 45 % pacientů) (13). Technika muláže se poněkud omezeně využívá i v dnešní době.
V současnosti je preferována high‑dose rate brachyterapie (HDR BT), kdy využíváme dálkově ovládané přístroje s vyšším dávkovým příkonem (> 12 Gy/hod). Její výhodou oproti LDR brachyterapii je vyšší stupeň radiační bezpečnosti, zvýšené pohodlí pro pacienta a možnost zlepšení dávkové distribuce v cílovém objemu pomocí počítačové optimalizace pozic radioaktivního zdroje a času, po který v nich setrvává (17). Kontraindikací je invaze do uretry, velikost karcinomu > 4 cm a předpokládaná hloubka invaze > 1 cm. V těchto případech se totiž neúměrně zvyšuje riziko recidivy a postradiační nekrózy. Nevýhodou této metody je teoreticky vyšší riziko vedlejších účinků vzhledem k odlišnému způsobu reparace tkání oproti LDR BT. Řešením je frakcionace záření 2× denně s minimálním rozestupem 6 hodin, nejběžnější dávka 30–54 Gy (13). Stanovení počtu frakcí a celková dávka HDR BT je zásadní podmínkou k dosažení srovnatelných výsledků s LDR BT. Na našem pracovišti využíváme metodu HDR BT již od roku 2002, nyní přinášíme aktualizované výsledky našeho souboru pacientů.
MATERIÁL A METODY
Mezi roky 2002–2019 bylo léčeno na Klinice onkologie a radioterapie FN a LF Hradec Králové celkem 28 pacientů se spinocelulárním karcinomem penisu metodou intersticiální HDR brachyterapie. Všichni pacienti před zahájením BT podstoupili stagingové vyšetření UZ pánevních a tříselných lymfatických uzlin nebo CT, které prokázalo nepřítomnost rozsevu nádorového onemocnění. U pacientů byla provedena biopsie s verifikací tumoru, zhodnocením stupně dife ‑ renciace nádorových buněk a velikosti nádoru ve třech rozměrech. Cirkumcize byla provedena u 27 pacientů. U pěti pacientů se jednalo o Tis N0M0. Důvodem brachyterapie byla recidiva po chirurgickém řešení (3 pacienti), po fotodyna ‑ mické léčbě a aplikaci imiquimodu (1 pacient) a pozitivní okraje (1 pacient). Dalších 22 pacientů bylo klasifikováno jako T1N0M0 a jeden pacient jako T1N1M0. U tohoto pacienta byla provedena lymfadenektomie. Nádor byl dobře diferencovaný (G1) v 18 případech, středně diferencovaný (G2) v 9 případech, jedenkrát se jednalo o špatně diferencovaný tumor (G3), a proto bylo provedeno ozáření regionálních uzlin zevní radioterapií. U 27 pacientů byl tumor lokalizován do oblasti glandu, v jednom případě na těle penisu. Medián věku zjištění diagnózy byl 57 let (36–72).
Léčba byla uskutečněna za cca 10–12denní hospitalizace, po ukončení terapie byli všichni pacienti sledováni v pravidelných tříměsíčních intervalech urologem a radiačním onkologem. Při každé kontrole byli pacienti dotazování na urologické a sexuální funkce, dále bylo provedeno UZ tříselných a pánevních uzlin a klinické vyšetření. Všichni pacienti podepsali informovaný souhlas s léčbou.
BRACHYTERAPIE
Terapie byla zahájena zavedením permanentního močového katétru a následně aplikací dutých ocelových jehel o průměru 1,6 mm do oblasti ná ‑ doru tak, aby cílový objem zahrnující tumor s bezpečnostním okrajem 0,5–1 cm byl uvnitř templátu a zároveň minimální vzdálenost od uretry byla 5 mm (Obr. 1). Aplikace jehel byla prováděna v celkové nebo spinální anestezii, celá procedura trvala asi 20–30 minut. U všech pacientů jsme preventivně aplikovali nitrožilně kortikosteroidy, abychom zabránili potenciálnímu pooperačnímu otoku penisu.
Obr. 1. Brachyterapeutický aparát
Fig. 1. Brachytherapy apparatus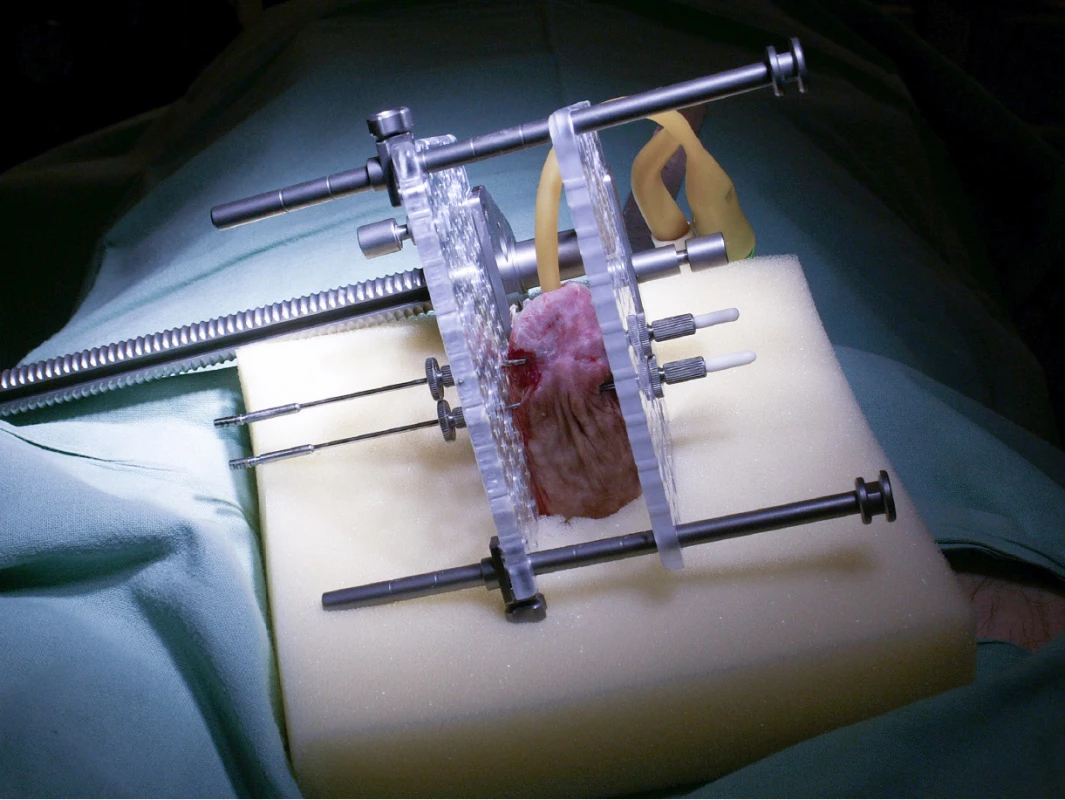
Pro zajištění stabilní a reprodukovatelné pozice penisu v průběhu léčby jsme využívali stabilizačních pomůcek (mammární intersticiální brachyterapeutický můstek, molitanový límec při zavádění vodičů). Dávkovou distribuci u prvních dvou pacientů jsme počítali v plánovacím systému Abasus Gammamed (Gammamed, Německo), ostatní dávkové distribuce v plánovacím systému BrachyVision (Varian, USA). Při použití ocelových brachyterapeutických aplikačních jehel by na plánovacím CT vznikly artefakty, které by znehodnotily celý ozařovací plán, proto jsme využili metodu měření vzdálenosti mezi destičkami fixačního můstku, mezi špičkou jehel a můstkem, špičkou jehel a jejich výstupem ze sliznice a špičkou jehel a vstupem do sliznice. Následně byla data přesunuta do plánovacího systému (program pro čtvercovou geometrii), referenční bod byl specifikován 5 mm od roviny jehel a na povrchu mukózy. Při výpočtu jsme využívali geometické optimalizace. Pomocí automatického afterloadingového přístroje Gammamed (Gammamed, Německo) jsme v celkem devíti dnech aplikovali dávku 18× 3 Gy, ozařování probíhalo 2× denně s minimálním rozestupem šesti hodin mezi jednotlivými frakcemi. Ihned po aplikaci poslední frakce jsme odstranili brachyterapeutické jehly a permanentní močový katétr a pacient mohl být propuštěn z nemocnice do domácího ošetřování.
V jednom případě jsme použili techniku dosud nepopsanou v literatuře. Jednalo se o pacienta s bifokálním karcinomem glans penis, kde by standardní brachyterapeutická aplikace byla spojena s velkým ozářeným objemem a rizikem postradiační nekrózy (Obr. 2). V jeho případě jsme užili aplikace plastických trubiček aplikovaných paralelně s dlouhou osou penisu a plánovaní brachyterapie založené na CT (obr. 3).
Obr. 2. Pacient s bifokálním in situ karcinomem penisu po neúspěšné fotodynamické léčbě a aplikaci imiquimodu
Fig. 2. Patient with bifocal penile in situ carcinoma with tumor persisting after photodynamic treatment and application of imiquimodum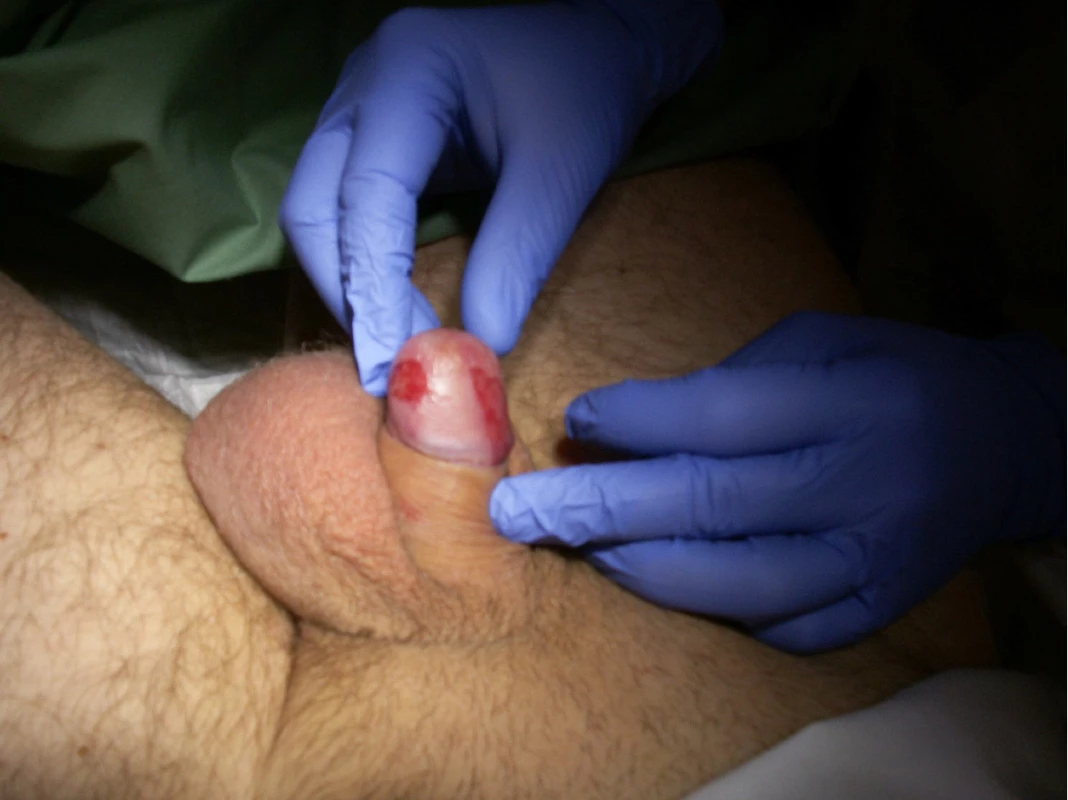
Obr. 3. Paralelní aplikace plastických trubiček u pacienta s bifokálním karcinomem penisu
Fig. 3. Parallel application of plastic tubes in patient with bifocal penile carcinoma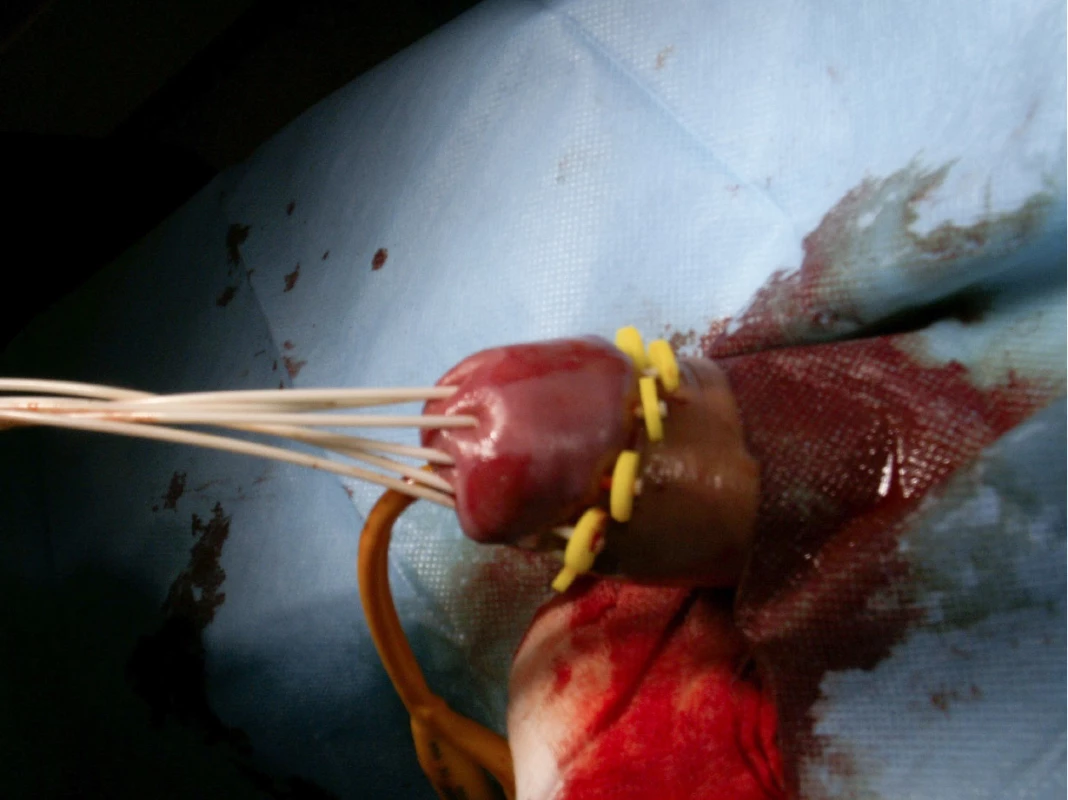
STATISTICKÉ ZPRACOVÁNÍ
Základní deskriptivní statistické metody (jako je medián, aritmetický průměr, 95% intervaly spolehlivosti, ad.) byly použity k běžnému hodnocení spojitých dat. U výskytu kategorických dat byly použity absolutní a relativní frekvence. K výpočtu přežití byla použita Kaplan‑Maierova analýza přežití. Statistické analýzy byly provedeny statistickým softwarem NCSS 8 (NCSS, Keysville, Utah).
VÝSLEDKY
S mediánem sledování 92 měsíců (3,7–219) se celkem u 7 z 28 pacientů rozvinula recidiva na glans penis (25 %), medián doby do recidivy byl 39 měsíců (7–98). Šest pacientů podstoupilo parciální amputaci penisu, další recidiva se u těchto pacientů nevyvinula, všichni sledovaní pacienti jsou naživu bez přítomnosti známek onemocnění. Jeden pacient s lokální recidivou zemřel na duplicitní diseminovaný histologicky potvrzený karcinom plic bez léčby pro lokální recidivu karcinomu penisu. U jiného pacienta došlo k uzlinovému relapsu bez lokální recidivy, byla provedena lymfadenektomie a pooperační radioterapie, pacient je nadále bez známek recidivy onemocnění. Z 28 léčených pacientů je v současné době naživu 24, jeden pacienti zemřel na duplicitní plicní karcinom, jeden na kardiální selhání a zbylí dva na interní komorbidity. HDR brachyterapie je celkově velmi dobře snášenou léčebnou terapií, všichni indikovaní pacienti zvládli celou terapii bez nutnosti přerušení. Z akutních radiačních reakcí se nejčastěji objevovala mukositida 2. stupně, která se obvykle velmi dobře zhojila do osmi týdnů po terapii. Z pozdních reakcí se objevily postradiační angiektázie stupně 1 na glandu celkem u sedmi pacientů, u dvou pacientů se vyvinula uretrální stenóza a jeden pacient musel podstoupit parciální amputaci penisu pro postradiační vřed. Celkem 20 pacientů žije se zachovalým penisem (71 %), z toho sexuálně aktivním životem žije 19 pacientů. Tito pacienti dle dotazníků mají sexuální život i sexuální uspokojení stejné jako před zahájením léčby (obr. 4). Dle statistických šetření v našem souboru pacientů vyšlo pětileté celkové přežití 96,4 % (95 % CI: 89,6–100,0 %), pětileté přežití bez známek recidivy 77,7 % (95 % CI: 61,8–93,5 %) a pětileté přežití bez lokální recidivy 81,1 % (95 % CI: 66,0–96,1 %) (Graf 1). Žádný pacient nezemřel na karcinom penisu.
Obr. 4. Kosmetický výsledek po brachyterapii
Fig. 4. Cosmetic effect after brachytherapy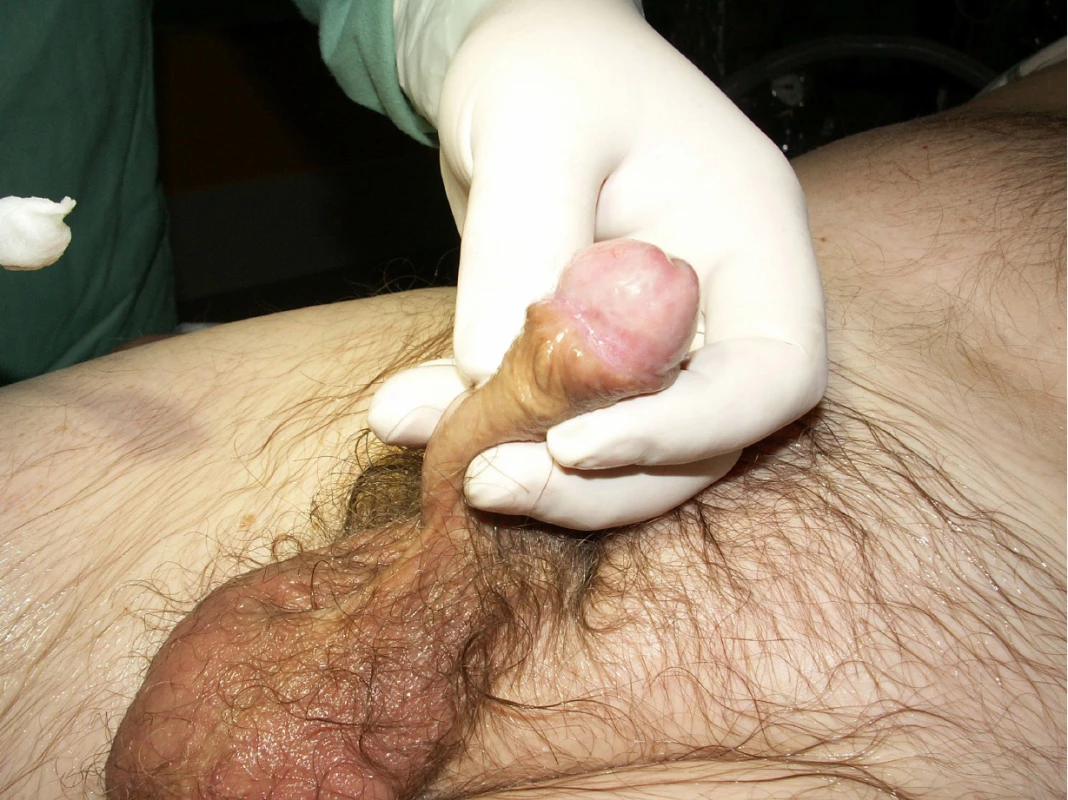
Graf 1. Křivka přežití: OS = celkové přežití; DFS = přežití bez známek onemocnění; LRFS = přežití bez lokální recidivy
Graf. 1. Survival plot: OS = overal survival; DFS = disease-free survival; LRFS = local recurrence-free survival
DISKUZE
V případě lokalizovaného karcinomu penisu by intersticiální brachyterapie měla být standardní metodou konzervativní léčby. Kontraindikacemi použití intersticiální brachyterapie jsou velikost tumoru (> 4 cm), staging tumoru (T3 a více) a invaze do uretry, které signifikatně zvyšují riziko recidivy a postradiační nekrózy (18, 19). V našem souboru bylo zařazeno pět pacientů s carcinoma in situ. Jednalo se o pacienty s recidivou tumoru po předchozí chirurgické léčbě nebo fotodynamické terapii a aplikaci imiquimodu a jednoho pacienta s pozitivními okraji po chirurgickém, výkonu. Užití brachyterapie v této indikaci je možné v souladu s doporučeními Americké brachyterapeutické společnosti a Evropské skupiny curieterapie (18).
V minulosti byla hojně využívaná LDR BT s dlou ‑ hodobými verifikovanými excelentními výsledky (20), v současnosti se však vzhledem ke zlepšování brachyterapeutických technik, plánovacího software a afterloadingových přístrojů do popředí dostala HDR BT, která již svou účinnost prokázala v řadě jiných nádorových onemocnění (terapie nádorů prostaty, cervixu, žlučových cest) (22, 23, 24). První zkušenosti s HDR BT u karcinomu penisu byly publikovány naší klinikou (17). Od té doby vyšlo několik prací potvrzujících efekt a nízkou toxicitu této léčby. V roce 2014 publikoval Sharma et al. (25) výsledky HDR BT v souboru 14 pacientů. Byla použita technika plastických trubiček a CT plánování. Výhodou této techniky je přesnější dávková kalkulace, nevýhodou hypoteticky horší zabezpečení geometrie implantátu v porovnání s rigiditou ocelových jehel fixovaných můstkem, které používá naše pracoviště. U 2 ze 14 pacientů došlo k recidivě, stenóza uretry nebo nekróza měkkých tkání nebyly pozorovány u žádného pacienta. V roce 2019 byla publikována studie s HDR BT u 76 pacientů s invazivním karcinomem penisu. U pacientů byly užity jednotlivé frakce o velikosti 3–3,5 Gy. S mediánem follow-up 76 měsíců bylo pozorováno 18,4 % lokál ‑ ních recidiv a 10,5 % perzistence tumoru. Pětileté a desetileté zachování penisu bylo 69,5 % a 66,9 %. V jednom případě se vyvinula stenóza uretry (26).
Cílem brachyterapie je také mimo jiné limitace dopadu této léčby na nežádoucí urologické komplikace, nejzávažnější z nich bývá stenóza uretry. V našem souboru se objevili celkem dva pacienti s těmito obtížemi (7 %), v ostatních publikacích dle Rouscoffa (23) bývá tato hodnota mezi 8–45 %. Dalším důležitým cílem brachyterapie je zachování sexuálních funkcí. Celkem 20 z 28 našich pacientů do současnosti žije sexuálním životem, všichni frekvenci a kvalitu sexuálního prožitku hodnotí za srovnatelnou jako před zahájením brachy‑terapie. Dle Maddinenniho a spol. (24) vede mutilující léčba karcinomu penisu k negativním dopadům na psychickou pohodu pacientů, až 50 % z nich může mít psychické symptomy, u 2/3 pacientů dochází k redukci sexuálních funkcí v důsledku parciální nebo totální amputace penisu, proto brachyterapie může být vhodnou alternativou.
Při brachyterapii je i riziko vzniku dalších pozdních nežádoucích reakcí, zejména nekrózy. V našem souboru se vyskytl jeden případ postradiační nekrózy, důvodem byla nízká homogenita provedené aplikace (dose homogenity index, DHI), případ byl vyřešen parciální amputací penisu. V literatuře jsou popisované případy úspěšného použití hyperbarické komory u pacientů s rozvinutou kožní nekrózou (23, 27). Daleko častější jsou však akutní komplikace, v našem souboru všechny akutní reakce ustoupily do osmi týdnů po dokončení brachyterapie.
Brachyterapie nezhoršuje OS u časných karcinomů penisu v porovnání s chirurgickou léčbou, umožňuje zachování plně funkčního orgánu v 70–80 % případů. V případě lokálního relapsu po primární brachyterapii vede salvage chirurgie provedením parciální nebo totální amputace penisu ke stejným výsledkům jako při použití chirurgie jako primární volby. Navíc po záchranné chirurgické léčbě se míra přežití pohybuje v rozmezí 84–92 %, což jsou obdobné hodnoty jako při použití chirurgie jako primární léčby (28, 29), míra druhého relapsu po záchranném radikálním chirurgickém výkonu pro lokální relaps se pohybuje mezi 0–7,1 % (23, 29). V metaanalýze dle Hassana (14) bylo pětileté OS (Overall Survival) po chirurgické terapii 76 % v porovnání s 73 % po brachyterapii, penektomie byla asociována s vyšší pětiletou lokální kontrolou (LC) (84 %) oproti orgán zachovávající léčbě brachyterapií (74 %) bez signifikantního vlivu na OS. Recidivy po brachyterapii jsou řešeny záchrannou chirurgickou léčbou s excelentním výsledkem bez negativního vlivu na OS. Brachyterapie dává šanci na zachování urologicky a sexuálně funkčního penisu.
V současné době je většina karcinomů penisu řešena chirurgickou léčbou, aniž by bylo pomýšleno na jiné terapeutické možnosti, které by mohly pacientovi přinést benefit. Rozhodování léčby karcinomu penisu by mělo být předmětem interdisciplinárních sezení pro zajištění nejlepší možné léčby pro každého pacienta.
ZÁVĚR
HDR BT s dávkou 18× 3 Gy aplikovaných 2× denně je slibná metoda orgán zachovávající léčby u vybraných pacientů s karcinomem penisu a zaslouží si zhodnocení ve větší prospektivní studii. Rozhodování léčby karcinomu penisu by mělo být předmětem interdisciplinárních indikačních seminářů pro zajištění nejlepší možné léčby pro každého pacienta.
Prohlášení o podpoře: Autoři prohlašují, že zpracování tohoto článku nebylo podpořeno žádnou společností.
Střet zájmů: žádný.
Došlo: 4. 5. 2020
Přijato: 8. 6. 2020
Kontaktní adresa:
MUDr. Igor Sirák, Ph.D.
Klinika onkologie a radioterapie FN a LF Hradec Králové
Sokolská 581,
500 05 Hradec Králové
e‑mail: igor.sirak@fnhk.cz
Zdroje
1. Brierley JD, Gospodarowicz MK, Wittekind C. TNM classification of malignant tumours Union for International Cancer Control; Oxford. John Wiley & Sons. 2017
2. Montes Cardona CE, García‑Perdomo HA. Incidence of penile cancer worldwide: systematic review and meta‑analysis. Rev Panam Salud Publica 2017; 41: e117. doi: 10.26633/RPSP.2017.117.
3. Larke NL, Thomas SL, dos Santos Silva I, Weiss HA. Male circumcision and penile cancer: a systematic review and meta‑analysis. Cancer Causes Control 2011; 22(8): 1097–1110.
4. Schoen EJ. The relationship between circumcision and cancer of penis. CA Cancer J Clin 1991; 41(5): 306–309.
5. Siegel RL, Miller Kd, Jemal A. Cancer Statistics, 2017. CA Cancer J Clin 2017; 67(1): 7–30. doi: 10.3322/caac.21387.
6. Morrison BF. Risk factors and prevalence of penile cancer. West Indian Med J 2014; 63(6): 559–560. doi: 10.7727/wimj.2015.381.
7. Hakenberg OW, Dräger DL, Erbersdobler A, et al. The Diagnosis and Treatment of Penile Cancer. Dtsch Arztebl Int 2018; 115(39): 646–652. doi: 10.3238/arztebl.2018.0646.
8. Horner MJ, Ries LAG, Krapcho M, et al. (2009) SEER cancer statistics review, 1975–2006.
9. Uroweb.org. Penile cancer. European Association of Urology. [online]. Available from: https://uroweb. org/guideline/penile‑cancer/.
10. Azrif M, Logue JP, Swindell R, et al. External‑beam radiotherapy in T1-2 N0 penile carcinoma. Clin Oncol (r Coll radiol) 2006; 18(4): 320–325.
11. Hakenberg OW, Comperat EM, Minhas S, et al. EAU guidelines on penile cancer: 2014 update. Eur Urol. 2015; 67 : 142–150.
12. Zouhair A, Coucke PA, Jeanneret W, et al. Radiation therapy alone or combined surgery and radiation therapy in squamous‑cell carcinoma of the penis? Eur J Cancer 2001; 37 : 198–203. doi: 10.1016/S0959-8049(00)00368-3.
13. Korzeniowski MA, Crook JM. Contemporary role of radiotherapy in the management of penile cancer. Transl Androl Urol 2017; 6(5): 855–867. doi: 10.21037/tau.2017. 07. 02.
14. Hasan S, Francis A, Hagenauer A, et al. The role of brachytherapy in organ preservation for penile cancer: A meta‑analysis and review of the literature. Brachytherapy 2015; 14 : 517–524. doi: 10.1016/j.brachy.2015.03.008.
15. Crook J, Jezioranski J, Cygler JE. Penile brachytherapy: technical aspects and postimplant issues. Brachytherapy 2010; 9 : 151–158. doi: 10.1016/j.brachy.2009.05.005
16. Crook J, Ma C, Grimard L. Radiation therapy in the management of the primary penile tumor: an update. World J Urol 2009; 27 : 189–196. doi: 10.1007/s00345-008-0309-5.
17. Petera J, Sirak I, Kasaova L, et al. High‑dose rate brachytherapy in the treatment of penile carcinoma – first experience. Brachytherapy 2011; 10 : 136–140. doi: 10.1016/j.brachy.2010.05.007.
18. Crook JM, Haie‑Meder C, Demanes DJ, et al. American Brachytherapy Society‑Groupe Européen de Curiethérapie‑European Society of Therapeutic Radiation Oncology (ABS‑GEC‑ESTRO) consensus statement for penile brachytherapy. Brachytherapy 2013; 12 : 191–198.
19. De Crevoisier R, Slimane K, Sanfilippo N, et al. Long‑term results of brachytherapy for carcinoma of the penile confined to the glans (N - or NX). Int J Radiat Oncol Biol Phys 2009; 74 : 1150–1156.
20. Cordoba A, Escande A, Lopez S, et al. Low‑dose brachytherapy for early stage penile cancer: a 20year single‑institution study (73 patients) [published correction appears in Radiat Oncol 2016; 11(1): 129]. Radiat Oncol 2016; 11 : 96. doi: 10.1186/s13014-016-0676-9.
21. Hoskin PJ, Colombo A, Henry A, et al. GEC/ESTRO recommendations on high dose rate afterloading brachytherapy for localised prostate cancer: an update. Radiother Oncol 2013; 107 : 325–332.
22. Hannoun‑Levi JM, Chand‑Fouche ME, Gautier M, et al. Interstitial preoperative high‑dose‑rate brachytherapy for early stage cervical cancer: dose‑volume histogram parameters, pathologic response and early clinical outcome. Brachytherapy 2013; 12 : 148–155.
23. Rouscoff Y, Falk AT, Durand M, et al. High‑dose rate brachytherapy in localized penile cancer: short‑term clinical outcome analysis. Radiat Oncol 2014; 9 : 142. doi: 10.1186/1748-717X-9-142.
24. Maddineni SB, Lau MM, Sangar VK. Identifying the needs of penile cancer sufferers: a systematic review of the quality of life, psychosexual and psychosocial literature inpenile cancer. BMC Urol 2009; 9 : 8.
25. Sharma DN, Joshi NP, Nikhil P, et al. High‑dose‑rate interstitial brachytherapy for T1-T2 stage penile carcinoma: Short‑term results. Brachytherapy 2014; 13 : 481–487.
26. Kellas‑Sleczka S, Bialas B, Fijalkowski M, et al. Nineteen‑year single‑center experience in 76 patients with penile cancer treated with high‑dose‑rate brachytherapy. Brachytherapy 2016; 18 : 493–502.
27. Gomez‑Iturriaga A, Crook J, Evans W, Saibishkumar EP, Jezioranski J. The efficacy of hyperbaric oxygen therapy in the treatment of medically refractory soft tissue necrosis after penile brachytherapy. Brachytherapy 2011; 10 : 491–497.
28. Crook J. Radiation therapy for cancer of the penis. Urol Clin North Am 2010; 37 : 435–443. 29. Solsona E, Bahl A, Brandes SB. New developments in the treatment of localized penile cancer. Urology 2010; 76(2 Suppl 1): S36–S42.
Štítky
Dětská urologie Nefrologie Urologie
Článek Editorial
Článek vyšel v časopiseČeská urologie
Nejčtenější tento týden
2020 Číslo 2- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Kterým pacientům se SLE nasadit biologickou léčbu?
- Nostiriazyn – spolehlivá 1. volba u nekomplikovaných infekcí močových cest
- Nitrofurantoin s řízeným uvolňováním: osvědčená účinnost, lepší snášenlivost a méně tablet při akutní cystitidě
- Jak souvisí časné zahájení biologické léčby SLE/LN s prevencí nevratného poškození?
-
Všechny články tohoto čísla
- Vyšetření cirkulujících nádorových buněk u karcinomu ledviny
- Přirozený proces hojení po částečné excizi glandu penisu za použití nové hemostatické náplasti VerisetTM – popis metody a prvotní pohled chirurga
- Biopsie nádorů ledvin – indikace, provedení, výsledky
- Náš přístup k diagnostice a léčbě nehmatného varlete
- Brachyterapie s vysokým dávkovým příkonem jako orgán šetřící léčba u časného karcinomu penisu
- Poranění pankreatu spojené s urologickým výkonem a možnosti řešení pankreatické píštěle
- Konverze kontinentní derivace na konduit retubularizací stěny neoveziky
- Objemný cystický lymfangiom levé nadledviny – diferenciálně diagnostický omyl
- Pandemii navzdory – Komplexní novinky v onkourologii 2020
- Editorial
- Rekonstrukce bulbární uretry po rozsáhlém zánětlivém abscedujícím procesu v oblasti hráze na podkladě cizího tělesa
- Komentář k práci Drlík P, Čermák M. Rekonstrukce bulbární uretry po rozsáhlém zánětlivém abscedujícím procesu v oblasti hráze na podkladě cizího tělesa (video) Ces Urol 2020; 24(2): 90–93
- Rukou asistovaná laparoskopická adrenalektomie u objemných tumorů nadledvin
- Česká urologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Biopsie nádorů ledvin – indikace, provedení, výsledky
- Vyšetření cirkulujících nádorových buněk u karcinomu ledviny
- Přirozený proces hojení po částečné excizi glandu penisu za použití nové hemostatické náplasti VerisetTM – popis metody a prvotní pohled chirurga
- Objemný cystický lymfangiom levé nadledviny – diferenciálně diagnostický omyl
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



