-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Korelace výsledku pozitronové emisní tomografie a nálezu při resekci reziduálních lézí po chemoterapii neseminomových germinálních nádorů
Positron emission tomography and histology of residual postchemotherapy masses in patients with nonseminomatous germ cell tumours
Aim:
The value of using fluorodeoxyglucose positron emission tomography (FDG-PET) before residual mass resection was studied in patients with nonseminomatous germ cell tumours (NSGCTs) after orchiectomy and platinumbased chemotherapy.Methods:
Thirty patients with NSGCTs who had been investigated with FDG-PET in the preoperative period were evaluated retrospectively. We have calculated specificity, sensitivity, positive predictive value (PPV) and negative predictive value (NPV) of FDG-PET to correctly predictt he presence of viable carcinoma, mature teratoma,and necrotic/ scar tissue in postchemotherapy residual masses.Results:
FDG-PET was evaluated as negative, positive, or inconclusive in 11 (37%), 17 (57%) and 2 (7%) patients, respectively. Histological examination of the resected residual masses showed immature tumour elements, mature teratoma, and no tumour structures in 12 (40%), 11 (37%), and 7(23%) patients, respectively. FDG-PET correctly identified only 50% of lesions with immature tumour elements. FDG-PET was negative in 13/21 (62%) patients with immature elements and/or mature teratoma – histologies that require surgical resection because of high risk of relapse.Conclusions:
Sensitivity, specificity, PPV, and NPV of FDGPET were insufficient for characterisation of postchemotherapy residual lesions in NSGCT patients. These residual masses should be resected if technically possible regardless of the FDG-PET result.Key words:
positron emission tomography, testicular cancer, therapy.
Autoři: Jana Grimová 1*; Tomáš Büchler 1*; Pavel Fencl 2; Kateřina Šimonová 2; Zuzana Donátová 1; Ludmila Boublíková 1; Martin Kupec 1; Jaroslav Jarabák 3; Roman Zachoval 3; Jitka Abrahámová 1
Působiště autorů: Onkologická klinika Thomayerovy nemocnice a 1. lékařské fakulty Univerzity Karlovy, Praha 1; Oddělení nukleární medicíny a PET centrum, Nemocnice Na Homolce, Praha 2; Urologické oddělení Thomayerovy nemocnice, Praha 3
Vyšlo v časopise: Ces Urol 2012; 16(1): 43-49
Kategorie: Původní práce
*přispěli stejným dílem
Souhrn
Cíl:
V souboru pacientů s neseminomových germinálním tumorem (NSGT) po orchiektomii a platinové chemoterapii jsme hodnotili přínos FDG-PET před resekcí reziduálních postchemoterapeutických ložisek.Metody:
Retrospektivně jsme identifi kovali 30 nemocných s NSGT, kteří podstoupili resekci rezidua a měli v předoperačním období provedeno FDG-PET/CT. Byla hodnocena specifi cita, senzitivita, pozitivní a negativní prediktivní hodnota FDG-PET pro odlišení lézí obsahujících nezralé nádorové elementy, zralý teratom a ložiska bez nádorových buněk.Výsledky:
Jedenáct (37 %) nemocných mělo v předoperačním období FDG-PET hodnocený jako negativní, 17 (57 %) jako pozitivní a u dvou (7 %) nebylo jednoznačné hodnocení možné. Ve vzorcích z následně provedené resekce reziduálních ložisek byly nezralé nádorové elementy nalezeny u 12 (40 %) a zralý teratom u 11 (37 %) pacientů, u 7 (23 %) nemocných nebyly přítomné nádorové struktury. FDG - -PET správně identifi kovalo jen 50 % lézí s nezralými nádorovými elementy. Na druhou stranu bylo negativní u 13/21 (62 %) pacientů s nezralými elementy nebo ložisky zralého teratomu v reziduu, což jsou nálezy vyžadující resekci z důvodu vysokého rizika relapsu.Závěry:
Senzitivita, specifi cita, PPV i NPV vyšetřeni FDG-PET je nedostatečná pro charakterizaci reziduálních ložisek po chemoterapii pro NSGCT. Tato ložiska by měla být pokud možno resekována, a to bez ohledu na výsledek FDG-PET.Klíčová slova:
pozitronová emisní tomografie, nádory varlat, terapie.ÚVOD
Germinální nádory varlat jsou nejčastějším zhoubným nádorem u mužů ve věku 15–35 let. V posledních letech jejich incidence ve vyspělých zemích stoupá jak v číslech absolutních, tak relativních. Za rok 2007 byla incidence nádorů testis v České republice 9,5/100 000 mužů (482 osob) a mortalita 0,7/100 000 mužů (35 osob) (1, 2).
Pozitronová emisní tomografie s využitím 18-fluorodeoxyglukózy (FDG-PET) ve spojení s CT je zobrazovací modalita poskytující funkční a morfologické informace. U testikulárních germinálních nádorů (TGN) byl význam vyšetření FDG-PET zkoumán v rámci stagingu, diferenciální diagnostiky reziduálních ložisek po chemoterapii, hodnocení odpovědi na léčbu, hodnocení chemosenzitivity nádoru a dlouhodobého sledování pacientů po léčbě (3). Zatímco u seminomových nádorů je přínos vyšetření FDG-PET prokázán a metoda je součástí standardního hodnocení efektivity terapie, u pacientů s neseminomovými germinálními tumory (NSGT) zatím není postavení FDG-PET hodnoceno jednoznačně, i když se tato modalita poměrně často využívá.
Jednou z příčin nízké specificity a senzitivity FDG-PET po systémové léčbě generalizovaných NSGT je možnost spontánní nebo chemoterapii indukované diferenciace do tzv. zralého teratomu, což chemo - a radiorezistentní novotvar (4). Zralý teratom je geneticky nestabilní a může být zdrojem časného nebo pozdního relapsu po chemoterapii. Viabilní nádor nebo zralý teratom se přitom v postchemoterapeutických reziduích vyskytují až v 35 % případů (5). Standardním postupem u NSGT je proto chirurgické odstranění reziduálních ložisek (5, 6).
Cílem naší práce bylo zjistit korelaci nálezu na FDG-PET a histologického nálezu po resekci reziduálních lézí z hlediska přítomnosti viabilní nádorové tkáně.
MATERIÁL A METODY
Pacienti
Ve skupině 1057 pacientů s germinálním tumorem léčených na našem pracovišti za období 1993–2010 jsme identifikovali 30 pacientů s NSGT, kteří podstoupili resekci postchemoterapeutického rezidua a kterým bylo provedeno vyšetření FDG-PET v předoperačním období. Protokol léčby nebyl vzhledem k výše uvedenému relativně dlouhému časovému úseku jednotný, všichni pacienti však byli před operací léčeni vysokou ingvinální orchiektomií a systémovou chemoterapií na bázi platiny. Podmínkami provedení resekce postchemoterapeutických ložisek byla jejich radikální resekabilita, vyhovující stav nemocného a negativita nádorových markerů α-fetoproteinu a β-podjednotky choriogonadotropinu nebo markery stacionární bez odpovědi na chemoterapii vyšší linie.
Soubor byl hodnocen retrospektivně. Studie byla schválena Etickou komisí Thomayerovy nemocnice a Institutu klinické a experimentální medicíny.
Provedení a hodnocení FDG-PET
Radioaktivní farmakum 18-fluorodeoxyglukóza (FDG) se aplikovalo nitrožilně obvykle s 4 hodinovým předstihem v množství závislém na hmotnosti pacienta. Před podáním farmaka byla změřena hladina glykémie. Vyšetření nebylo provedeno při hodnotách glykémie vyšších než 10 mmol/l, protože při vyšších hodnotách dochází k nasycení tkání glukózou a nedostatečnému vychytávání FDG. Během akumulace FDG byla intravenózně podána jódová CT kontrastní látka, perorální kontrastní látku pil pacient frakcionovaně. Po uplynutí času akumulace (minimálně 50 min) se provedla detekce a akvizice funkčních a morfologických dat pomocí hybridního PET/CT přístroje Biograph 40 TruePoint TrueView HD PET scanner. Během snímání ležel pacient nehybně na lůžku, které se posouvalo skrze detekční prstenec gantry přístroje.
CT vyšetření bylo provedeno v rozsahu od ústní dutiny po proximální třetinu stehen. Pomocí speciálního software jsme pak provedli fúzi se ziskem morfologických i funkčních informací o vyšetřované oblasti. Pro fúzované zobrazení jsme použili barevné zobrazení PET a zobrazení CT ve škále šedé.
Analýza dat
Výsledek FDG-PET bylo hodnocen jako pozitivní, negativní nebo nejednoznačný. K výsledku FDG-PET byla přiřazena příslušná histologie reziduální léze po resekci. Byly provedeny dvě analýzy podle následujících kritérií (viz rovněž diskuse).
Analýza 1. Přítomnost nezralé nádorové složky byla hodnocena jako pozitivní výsledek, přítomnost výhradně zralého teratomu a/nebo nepřítomnost jakýchkoliv nádorových buněk byl hodnocena jako negativní výsledek histologie.
Analýza 2. Přítomnost nezralé nádorové složky a/nebo zralého teratomu byla hodnocena jako pozitivní výsledek, nepřítomnost jakýchkoliv nádorových buněk byl hodnocena jako negativní výsledek histologie.
Byl stanoven počet falešně pozitivních a falešně negativních výsledků a následně byla hodnocena senzitivita, specificita, pozitivní prediktivní hodnota (PPV) a negativní prediktivní hodnota (NPV) možnosti využití FDG-PET k předpokladu nálezu při resekci reziduálních retroperitoneálních lézí.
VÝSLEDKY
Nalezli jsme 30 pacientů s diagnózou NSGT nádoru, kteří po primární léčbě orchiektomií a systémovou chemoterapií absolvovali resekci reziduální léze. Vyšetření FDG-PET/CT bylo provedeno s mediánem 52 dní od operace. Před chirurgickým zákrokem bylo provedeno. Medián věku při operaci byl 31 let (rozsah 20–55 let). Devět pacientů (30 %) absolvovalo před resekcí reziduálního tumoru jednu řadu chemoterapie, jedenáct pacientů (36,6 %) dvě řady, devět pacientů (26,6 %) tři řady, jeden pacient (7,5 %) čtyři řady a jeden pacient (7,5 %) až šest řad chemoterapie. Žádný nemocný nebyl před operací léčený aktinoterapií. Devět pacientů (26,6 %) podstoupilo v průběhu léčby vysokodávkovanou chemoterapii, jeden pacient dvakrát. Další základní vstupní charakteristiky pacientů jsou uvedeny v tabulce 1.
Tab. 1. Základní charakteristiky souboru Table 1. Baseline characteristics of patients 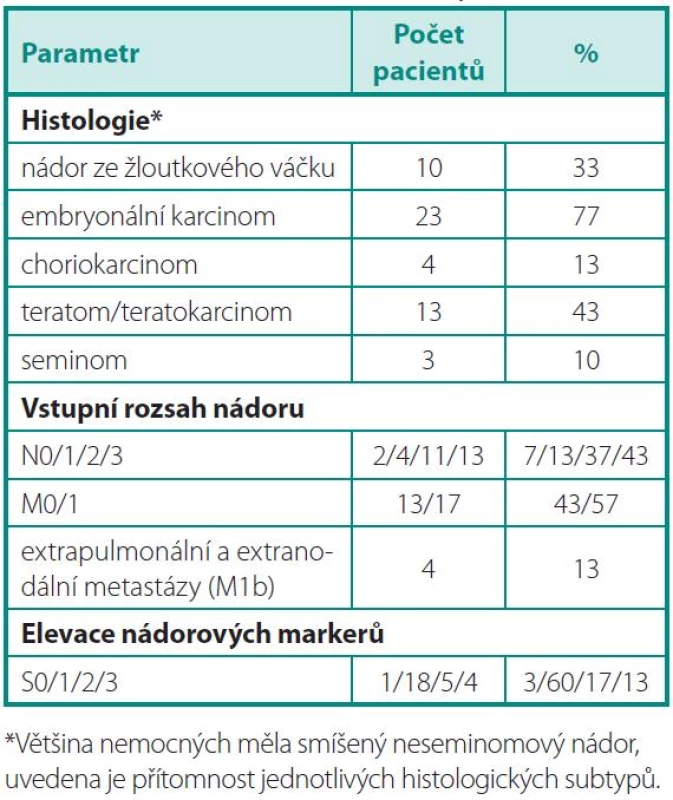
Tab. 2. Parametry nádoru v době předoperačního PET/CT, resekce reziduálních ložisek a histologie Table 2. Tumour parameters at the time of preoperative PET/CT, resection of residual masses, and residual lesion histology 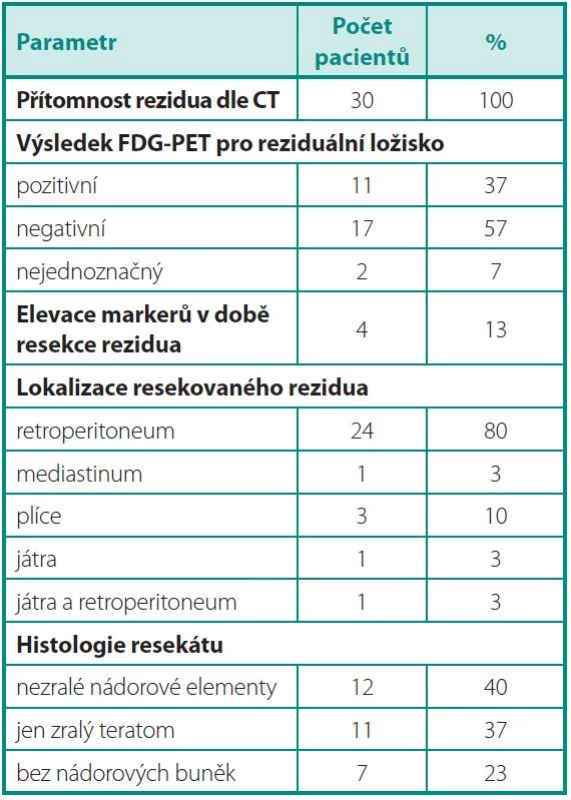
Z výsledků vyplývá, že senzitivita, specificita, PPV i NPV vyšetřeni FDG-PET je nedostatečná pro charakterizaci reziduálních ložisek po chemoterapii pro NSGCT. V případě, že analýza byla provedena s cílem odhalit neoplazii charakteru nezralých nádorových elementů (tj. Analýza 1), dosáhla specificita vyšetření a PPV jen 50 % (tab. 3).
Tab. 3. Analýza 1: Specificita, senzitivita, PPV a NPV vyšetření PET/CT Table 3. Analysis 1: Specificity, sensitivity, positive and negative predictive value of PET/CT 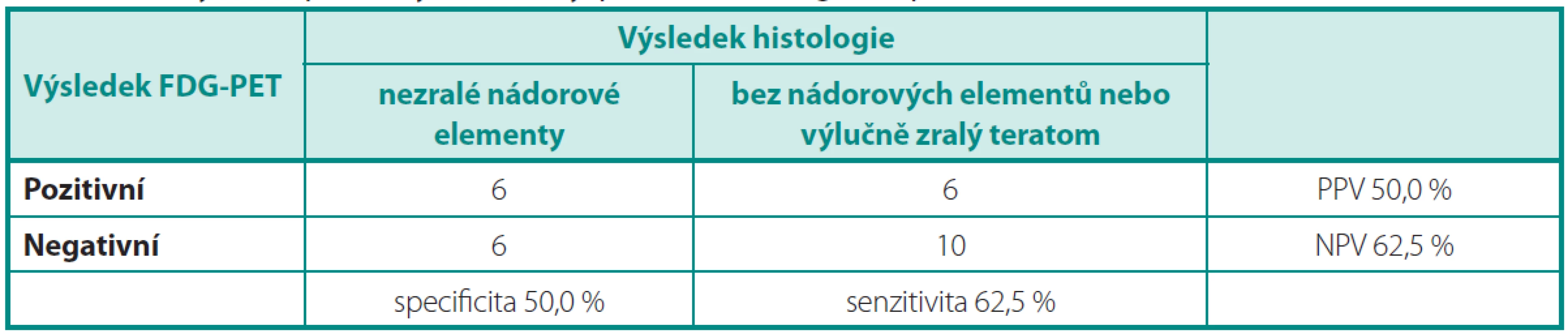
Pokud bylo cílem vyšetření FDG-PET identifikovat nemocné, kteří nepotřebují resekci reziduálního ložiska (Analýza 2), je nejdůležitější hodnotou NPV a ta byla jen 18,8 % (tab.4), protože FDG-PET selhává v diferenciální diagnostice zralého teratomu versus nekrotických/jizevnatých ložisek.
Tab. 4. Analýza 2: Specificita, senzitivita, PPV a NPV vyšetření PET/CT Table 4. Analysis 2: Specificity, sensitivity, positive and negative predictive value of PET/CT 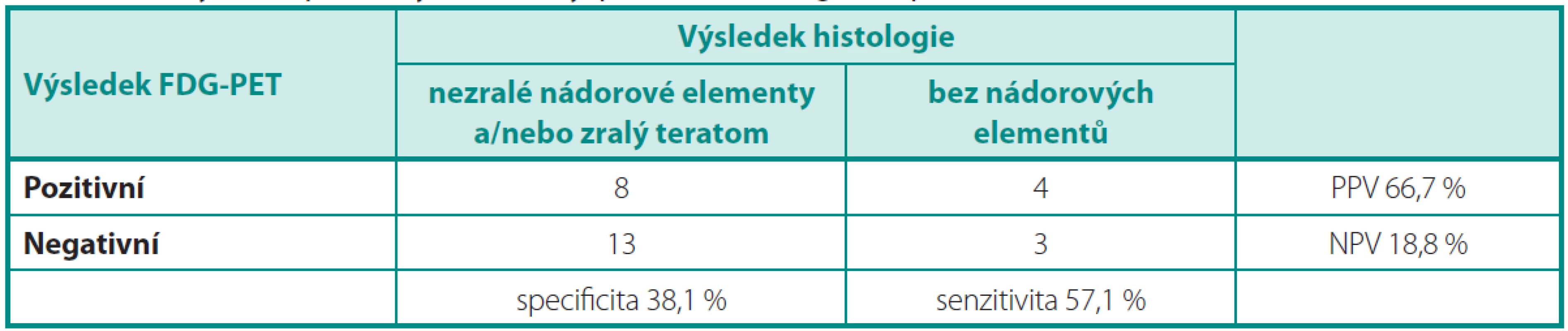
DISKUSE
Na našem souboru pacientů, u kterých byla potvrzena postchemoterapeutická reziduální retroperitoneální léze, jsme hodnotili přínos využití FDG-PET k odlišení pacientů s viabilním zbytkovým nádorem charakteru nezralých maligních elementů nebo zralého teratomu a nemocných s neviabilním nekrotickým či jizevnatým reziduem.
Využití FDG-PET pro diagnostiku perzistence nemoci po chemoterapii bylo zkoumáno v řadě retrospektivních a prospektivních studií s kontrolou histologie postchemoterapeutických reziduálních ložisek a/nebo dlouhodobým hodnocením klinického průběhu (3). FDG-PET je vhodnou metodou pro charakterizaci reziduálních ložisek po chemoterapii pacientů se seminomovým nádorem (7, 8). V této indikaci je u reziduí velikosti 3 cm a větší senzitivita FDG-PET 80% a jeho specificita 100% (9).
V naší analýze jsme prokázali nedostatečnost FDG-PET pro posouzení viability nádorového rezidua po chemoterapii. Protože zralý teratom nemá jednoznačnou FDG-PET charakteristiku (může, ale nemusí akumulovat FDG), použili jsme dvě metody analýzy, v nichž jsme jednou hodnotili zralý teratom jako„negativní“ histologii a ve druhé jako „pozitivní“ histologii. Tato zvolená metoda analýzy je ve shodě s pracemi Kolmannsbergera et al.(10) a Oechsle et al. (11).
Spolehlivá predikce viabilního nádorového rezidua po chemoterapii NSGT by měla velký klinický význam. Odlišení nekrotická a jizevnaté léze od viabilního nádoru a zralého teratomu na základě zobrazovací nebo funkční metody by umožnilo některé pacienty s reziduem po chemoterapii dále jen sledovat. Resekce reziduálních postchemoterapeutických ložisek, které bývají nejčastěji v retroperitoneu, patří mezí náročné chirurgické výkony spojené s významnou morbiditou, i když jejich mortalita je nízká. V současnosti by k resekci měli být indikováni všichni pacienti s neseminomovým nádorem a zvětšenými lymfatickými uzlinami nebo jiným suspektním nádorovým reziduem v retroperitoneu, přičemž operace by měla být provedena do 6–8 týdnů od ukončení chemoterapie (8). Možnost resekce ložisek v jiných lokalizacích se posuzuje individuálně. Další indikací resekce nádorového rezidua může být limitující toxicita chemoterapie.
Největší studii s hodnocením významu FDG-PET pro postchemoterapeutická reziduální ložiska je práce Oechsle a jejích spolupracovníků z německé kooperativní skupiny. V této prospektivní studii s hodnocením histologie u všech reziduálních tumorů u 121 pacientů s neseminomovými nádory stadií IICa III predikovalo vyšetření FDG-PET přítomnost viabilního nádoru nebo zralého teratomu správně jen v 56 % případů při senzitivitě 70% a specificitě 48% (11). Procento pacientů s viabilním nádorem nebo zralým teratomem v reziduu v této studii bylo 55 %, což je vyšší procento než v jiných sériích (5), ale nižší než 77 % v našem souboru, který zahrnoval nemocné vybrané na základě vstupní histologie, předchozího klinického průběhu a velikosti reziduálního ložiska. Silným prediktorem přítomnosti viabilního nádoru v německé studii bylo zvýšení konzumpce glukózy ve více reziduálních lézích (11). V této studii mělo ovšem po chemoterapii zvýšené markery až 27 % nemocných, zatímco v našem souboru jen 13 % (4/30). Důležitým rozdílem je rovněž vysoké procento našich pacientů s teratomem nebo teratokarcinomem v primární histologii (43 % vs. 17 % v německé studii), což může být faktor negativně ovlivňující výtěžnost vyšetření FDG-PET.
Oba výše uvedené rozdíly oproti jiným publikovaným pracím zřejmě vyplývají to z naší léčebné taktiky, podle níž indikujeme k resekci rezidua jen pacienty s negativními markery, nebo s markery stacionárními bez odpovědi na chemoterapii vyšší linie.
Při vyšetření nemocných s NSGT metodou FDG-PET se potýkáme nejen s jeho nízkou senzitivitou a negativní prediktivní hodnotou, ale i občasnou falešnou pozitivitou, a to u přibližně u 5–10 % pacientů a nejednoznačně interpretovatelnými výsledky u dalších asi 10 % nemocných (12).
Z našich autorů prezentovali zkušenosti s vyšetřením PET/CT před retroperitoneální lymfadenektomii na menších souborech Chocholatý a spolupracovníci a Havránek a spolupracovníci a jejich závěry rovněž svědčí o malé spolehlivosti této metody u nemocných s NSGCT (13, 14).
Pro neseminomové nádory zůstává tedy přinos využití FDG-PET nejistý. Falešně negativní výsledky mohou být způsobené potlačením metabolické aktivity nádoru po chemoterapii obvykle do dvou týdnů po ukončení léčby, naproti tomu falešně pozitivní výsledky jsou někdy spojeny se zvýšenou aktivitou makrofágů v oblasti nekrózy nádoru po chemoterapii (tzv. úklidová reakce) (3, 11).
ZÁVĚR
Z našich výsledků vyplývá, že FDG-PET nemá dostatečně vysokou senzitivitu pro detekci perzistujícího nádoru po chemoterapii NSGT. Pozitivní výsledek PET/CT má pro operační histologický nález pozitivní prediktivní hodnotu pouhých 50 %. FDG-PET tudíž nepřispívá k rozhodování o provedení resekce postchemoterapeutických lézí u nemocných s NSGT. Ty by měly být bez ohledu na akumulaci FDG operačně odstraněny, pokud je to technicky možné.
Poděkování
Za dlouholetou spolupráci při multidisciplinární léčbě nemocných s germinálními nádory by autoři rádi poděkovali doc. MUDr. Ivanu Kawaciukovi, CSc. a doc. MUDr. Vladimíru Visokaiovi, CSc.
S podporou grantu IGA MZ ČR G9005(NS10420-3/2009).
Došlo: 6. 2. 2012.
Přijato: 23. 3. 2012.
Kontaktní adresa
MUDr. Tomáš Büchler, PhD.
Onkologická klinika Thomayerovy nemocnicea 1. LF UK
Vídeňská 800,
140 59 Praha 4
e-mail: tomas.buchler@ftn.cz
Zdroje
1. Dušek L, Mužík J, Gelnarová E, et al. Cancer incidence and mortality in the Czech Republic. Klin Onkol 2010; 23 : 311–324.
2. Dušek L, Mužík J, Büchler T, Abrahámová J. Současné trendy v epidemiologii zhoubných nádorů varlete v ČR a predikce na rok 2012. In: Vybrané otázky onkologie XV. – 19. onkologicko-urologické sympozium a 15. mammologické sympozium. Praha 2011 : 12–14.
3. Büchler T, Šimonová K, Fencl P, Abrahámová J. Pozitronová emisní tomografie v diagnostice a sledování pacientů s neseminomovými germinálními nádory. Klin Onkol 2011; 24 : 413–417.
4. Povýšil C. Patomorfologie nádorovitých afekcí a nádorů varlete a paratestikulárních struktur. In: Abrahámová J, Dušek L, Povýšil C. a kol. Nádory varlat. Praha: Grada Publishing 2008; 93–120.
5. Fosså SD, Qvist H, Stenwig AE, et al. Is postchemotherapy retroperitoneal surgery necessary in patients with nonseminomatous testicular cancer and minimal residual tumor masses? J Clin Oncol 1992; 10 : 569–573.
6. Bosl GJ, Motzer RJ. Weighing risks and benefi ts of postchemotherapy retroperitoneal lymph node dissection: not so easy. J Clin Oncol 2010; 28 : 519–521.
7. Schmoll HJ, Jordan K, Huddart R, et al. Testicular seminoma: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2010; 21(Suppl 5): v 140–146.
8. Albers P, Albrecht W, Algaba F, et al. EAU guidelines on testicular cancer: 2011 update. Eur Urol 2011; 60 : 304–319.
9. De Santis M, Becherer A, Bokemeyer C, et al. 2-18fl uoro-deoxy-D-glucose positron emission tomography is a reliable predictor for viable tumor in postchemotherapy seminoma: an update of the prospective multicentric SEMPET trial. J Clin Oncol 2004; 22 : 1034–1039.
10. Kollmannsberger C, Oechsle K, Dohmen BM, et al. Prospective comparison of (18F) fluorodeoxyglucose positron emission tomography with conventional assessment by computed tomography scans and serum tumor markers for the evaluation of residual masses in patients with nonseminomatous germ cell carcinoma. Cancer 2002; 94 : 2353–2362.
11. Oechsle K, Hartmann M, Brenner W, et al. (18F)Fluorodeoxyglucose positron emission tomography in nonseminomatous germ cell tumors aft er chemotherapy: the German multicenter positron emission tomography study group. J Clin Oncol 2008; 26 : 5930–5935.
12. Karapetis CS, Strickland AH, Yip D, et al. Use of fl uorodeoxyglucose positron emission tomography scans in patients with advanced germ cell tumour following chemotherapy: single-centre experience with long-term follow up. Intern Med J 2003; 33 : 427–435.
13. Chocholatý M, Dušek P, Kawaciuk I, et al. Korelace pozitronové emisní tomografi e, CT a histologie po retroperitoneální lymfadenektomii u nemocných s germinálním nádorem. In: Abrahámová J (ed). Vybrané otázky onkologie XI. Praha: Galén 2007; 46–48.
14. Havránek O, Krhut J, Kopecký J, Hájek J. Výsledky pozitronové emisní tomografi e před retroperitoneální lymfadenektomií u pacientů s metastatickým testikulárním nádorem neseminomového typu. Česká urologie 2008; 12(2): A51.
Štítky
Dětská urologie Nefrologie Urologie
Článek vyšel v časopiseČeská urologie
Nejčtenější tento týden
2012 Číslo 1- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Kterým pacientům se SLE nasadit biologickou léčbu?
- Nostiriazyn – spolehlivá 1. volba u nekomplikovaných infekcí močových cest
- Nitrofurantoin s řízeným uvolňováním: osvědčená účinnost, lepší snášenlivost a méně tablet při akutní cystitidě
- Jak souvisí časné zahájení biologické léčby SLE/LN s prevencí nevratného poškození?
-
Všechny články tohoto čísla
- Do akej miery je aktívne sledovanie malých nádorov obličiek bezpečná stratégia?
- Srovnání výsledků miniinvazivní léčby ženské stresové inkontinence metodou AjustTM a MiniArcTM
- Urologické komplikace po zavedení močového katétru po náhradách velkých kloubů u mužů
- Editorial
- Matematické modelování deformace penisu při induratio penis plastica po terapii rázovými vlnami (SWT)
- Korelace výsledku pozitronové emisní tomografie a nálezu při resekci reziduálních lézí po chemoterapii neseminomových germinálních nádorů
- Využití neuromodulace v léčbě dysfunkcí dolních močových cest
- Možnosti intervenční radiologie při léčbě nádorů ledvin
- Stanovení exprese SHB v tkáni karcinomu prostaty: využití v diagnostice a prognostice
- Oboustranná adrenalektomie – u pacientů s Cushingovým syndromem při ektopické sekreci ACTH
- Vzpomínka na pana docentra MUDr. Jaroslava Nováka, CSc.
- Výbor ČUS vyhlašuje soutěž o nejlepší vědecké publikace za rok 2011
- Výsledek losování o účast na ESOU
- Výbor ČUS společně se sponzory odměnili původní práce rezidentů v české urologii za rok 2011
- Česká urologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Urologické komplikace po zavedení močového katétru po náhradách velkých kloubů u mužů
- Do akej miery je aktívne sledovanie malých nádorov obličiek bezpečná stratégia?
- Využití neuromodulace v léčbě dysfunkcí dolních močových cest
- Oboustranná adrenalektomie – u pacientů s Cushingovým syndromem při ektopické sekreci ACTH
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



