-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaproLékaře.cz / Odborné časopisy / Česká a slovenská neurologie a neurochirurgie / 2020 - supplementum 1Využití optické koherenční tomografie u neuromyelitis optica a onemocnění jejího širšího spektra
The use of optical coherence tomography in neuromyelitis optica spectrum disorders
Optical coherence tomography (OCT) is an imaging technique that allows repeated non-invasive assessment of retinal layers. The report summarizes the use of OCT in the diagnostics of optic neuritis (ON) as one of the main characteristics of neuromyelitis optica spectrum disorder (NMOSD). ON in NMOSD leads to widespread destruction of ganglion cells and their fibers across the retina, resulting in a thinning of retinal nerve fiber layer (RNFL) in all peripapillary segments, as well as in a thinning of ganglion cell layer in macula. Unlike in NMOSD, ON in MS results in a predominant thinning of peripapillary RNFL in temporal segment. OCT helps differentiation between ON in the context of MS and NMOSD and thus contributes to early diagnosis of MS and NMOSD.
Keywords:
optical coherence tomography – neuromyelitis optica spectrum disorders
Autoři: J. Lízrová Preiningerová
Působiště autorů: Neurologická klinika a Centrum klinických neurověd, 1. LF UK a VFN v Praze
Vyšlo v časopise: Cesk Slov Neurol N 2020; 83/116(supplementum 1): 37-43
doi: https://doi.org/10.14735/amcsnn2020S37Souhrn
Optická koherenční tomografie (optical coherence tomography; OCT) je zobrazovací metoda, která umožňuje opakované neinvazivní detailní zobrazení vrstev sítnice. Článek popisuje použití OCT v diagnostice zánětu očního nervu (ON) jako jednoho z hlavních znaků neuromyelitis optica a poruch jejího širšího spektra (NMOSD). U NMOSD dochází při ON k destrukci gangliových buněk a jejich vláken v celé ploše sítnice, a proto na OCT pozorujeme snížení vrstvy retinálních nervových vláken (RNFL) ve všech peripapilárních segmentech i v makule a snížení vrstvy gangliových buněk v makule. Tento vzorec postižení je odlišný od nálezu po ON u RS, kde dochází ke snížení peripapilární vrstvy RNFL zvláště v temporálním kvadrantu. Vyšetření OCT nám pomáhá odlišit ON u RS a NMOSD a přispívá tak ke správné časné diagnóze těchto nemocí.
Klíčová slova:
optická koherenční tomografie – neuromyelitis optica a onemocnění jejího širšího spektra
Úvod
Optická koherenční tomografie (optical coherence tomography; OCT) je neinvazivní zobrazovací metoda, která na základě analýzy infračerveného paprsku odraženého od vrstev tkáně umožňuje detailní zobrazení vrstev sítnice. Tento článek popisuje použití optické koherenční tomografie v diagnostice zánětu očního nervu (optická neuritida; ON) u neuromyelitis optica a poruch jejího širšího spektra (neuromyelitis optica spectrum disorder; NMOSD) a shrnuje současné poznatky o nálezech na sítnici u NMOSD.
Neuromyelitis optica (NMO) byla po dlouhou dobu považována za agresivní formu RS. Objev patogenních protilátek proti akvaporinu-4 (AQP4-IgG) byl prvním krokem k definici NMO jako samostatného onemocnění, u něhož je autoimunitní reakce namířena proti membránám bohatým na akvaporin-4 (AQP4). Autoprotilátky proti AQP4 jsou detekovatelné u 50–80 % pacientů (v závislosti na kohortě a použité metodě stanovení protilátek) splňujících klinická kritéria NMO, resp. NMOSD [1,2]. U části AQP4-IgG séronegativních pacientů splňujících kritéria NMOSD byly kolem roku 2014 detekovány autoprotilátky proti myelinovému oligodendrocytárnímu glykoproteinu (MOG-IgG), které se naopak u pacientů s přítomností AQP4-IgG prakticky nevyskytují [3,4]. U nemocí charakterizovaných přítomností MOG-IgG je autoimunitní reakce namířena proti antigenu na povrchu myelinu (nikoliv proti astrocytům a Müllerovým buňkám). Ačkoliv se mohou klinické příznaky nemocí s přítomností MOG-IgG velmi podobat příznakům AQP4-IgGpozNMOSD, jde patofyziologicky o jiný proces a diagnóza nemocí asociovaných s MOG-IgG se proto od NMOSD začíná v literatuře oddělovat [5].
Při hodnocení dostupné literatury popisující nálezy na OCT u NMOSD je nutno pamatovat na to, že diagnostika některých autoprotilátek nebyla v době jejich vzniku známa, popř. se užívaly jiné laboratorní metody jejich stanovení, a proto mohou být zkoumané kohorty značně heterogenní.
Klinický obraz ON u NMOSD
Akutní ON je jedním z kardinálních příznaků NMOSD a v 70 % případů postihne postupně obě oči. ON se projevuje snížením centrální zrakové ostrosti, často i bolestí za okem akcentovanou pohybem bulbu a poruchou barvocitu. V akutní fázi ON při NMOSD není klinický obraz ani nález na fundu odlišitelný od tzv. typické ON objevující se v rámci RS. Na možnou přítomnost NMOSD může u ON upozornit postižení obou zrakových nervů (u 20 % případů NMOSD je oboustranný zánět očního nervu prvním příznakem nemoci), těžký nezlepšující se zrakový deficit a neodpovídavost příznaků ON na léčbu vysokou dávkou kortikoidů [6]. Postižení zraku po jedné epizodě ON je u NMOSD mnohem závažnější než u RS [6–9]. Ke slepotě v jednom oku dochází u 22 % pacientů s NMOSD po první atace a u 60 % pacientů po rekurentních ON [10]. Přítomnost AQP4-IgG je jednoznačně velmi špatným prognostickým faktorem při probíhající ON [11–14] a také rizikem opakování ON s destruktivními účinky [11].
Nález na OCT
U ON pozorujeme pomocí OCT změny zvláště ve vrstvě nemyelinizovaných vláken gangliových buněk (retinal nerve fiber layer; RNFL) běžících po vnitřním povrchu sítnice směrem k papile, vrstvě těl gangliových buněk (ganglion cell layer; GCL) a vnitřní plexiformní vrstvě (inner plexiform layer; IPL), v níž se nachází výběžky gangliových a bipolárních buněk. Ve vnějších vrstvách sítnice ke změnám nedochází.
Optická neuritida u NMOSD způsobuje závažné postižení sítnice [7,15,16]. Průměrný pokles tloušťky peripapilární vrstvy retinálních nervových vláken (pRNFL) po jedné ON byl 31 μm ve studii Ratchforda et al z roku 2009 (n = 26, 60 % AQP4-IgG séropozitivních), což je o 24 μm více než u pacientů v kohortě ON u RS. Následná epizoda ve stejném oku vedla k poklesu pRNFL o dalších 10 μm [7]. Další studie tyto nálezy potvrzují [11–13,15,16]. Hlavním rozlišovacím znakem mezi ON u NMOSD a ON u RS na OCT je kromě míry postižení i rozdílná topografie ztráty vláken v peripapilární oblasti (obr. 1) i v oblasti makuly. Následkem ON u NMOSD dochází k úbytku vláken v pRNFL nejen v temporálním kvadrantu (jako je tomu u RS), ale i v kvadrantu horním, dolním a nazálním [1]. Na rozdíl od ON u RS, kdy zánět očního nervu i bez léčby spontánně ustoupí a RNFL poklesne v prvních 3–6 měsících v průměru o 6 µm, při ON u NMOSD dochází ke kontinuálnímu úbytku RNFL, dokud zánět probíhá. Zánětlivé změny sítnice u NMOSD přestáváme být schopni hodnotit, když dojde ke ztenčení pRNFL na 30 µm a její tloušťka je tvořena hlavně cévními strukturami (obr. 2). V naší kohortě pacientů s NMOSD jsme prokázali korelaci mezi poklesem RNFL a délkou trvání choroby, ale neprokázali jsme korelaci mezi titry AQP4-IgG a poklesem RNFL [17].
Obr. 1. Tloušťka vrstev RNFL v peripapilární oblasti měřená optickou koherenční tomografií. Hodnoty mezi 5. a 95. percentilem normy jsou kódovány zeleně, mezi 1. a 5. percentilem normy žlutě a pod 1. percentilem normy červeně. (a) zobrazuje normální nález. (b, c) zobrazují nálezy u pacientů s RS, u nichž proběhla optická neuritida – k poklesu tloušťky RNFL došlo hlavně v temporálním kvadrantu (červeně a žlutě).
Fig. 1. Peripapillary thickness of RNFL as measured by optical coherence tomography. Results of RNFL thickness are color coded with values between 5th and 95th percentile of normal coded in green, values between 1st and 5th percentile yellow and values below 1st percentile red. (a) depicts normal fi nding. (b, c) show a loss of RNFL post optic neuritis in multiple sclerosis with a decrease in RNFL in temporal quadrant (yellow and red).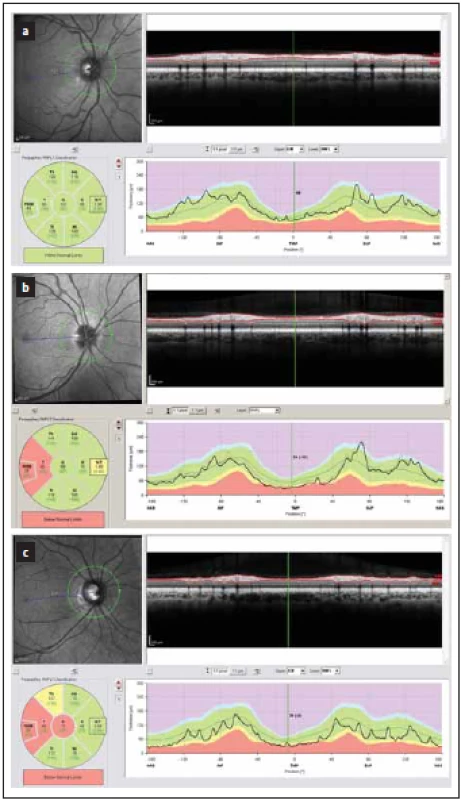
RNFL – vrstva retinálních nervových vláken
RNFL – retinal nerve fiber layerObr. 2. Tloušťka vrstev RNFL v peripapilární oblasti měřená optickou koherenční tomografií. Hodnoty mezi 5. a 95. percentilem normy jsou kódovány zeleně, mezi 1. a 5. percentilem normy žlutě a pod 1. percentilem normy červeně.
(d–f) zobrazují nálezy po proběhlém zánětu zrakového nervu u neuromyelitis optica a onemocnění jejího širšího spektra. V těchto očích je zjevný výrazný pokles tloušťky RNFL ve všech peripapilárních segmentech (červeně a žlutě).
Fig. 1. Peripapillary thickness of RNFL as measured by optical coherence tomography. Results of RNFL thickness are color coded with values between 5th and 95th percentile of normal coded in green, values between 1st and 5th percentile yellow and values below 1st percentile red. (d–f) show a loss of RNFL in all peripapillary segments (yellow and red) in patients post optic neuritis in neuromyelitis optica spectrum disorders.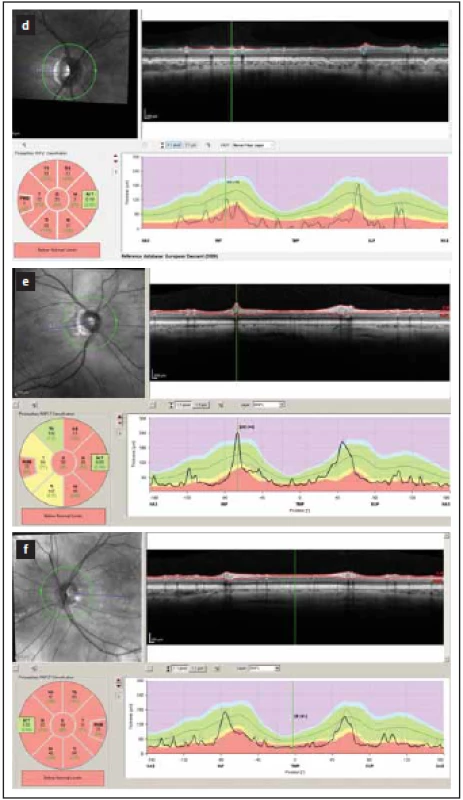
RNFL – vrstva retinálních nervových vláken
RNFL – retinal nerve fi ber layerCelkový objem makuly (total macular volume; TMV) (obr. 3) je po ON u NMOSD významně snížený [7]. Na OCT můžeme pozorovat následky rozsáhlé destrukce gangliových buněk sítnice, při níž se významně sníží tloušťka GCL, IPL i RNFL v makule a to v mnohem větší míře, než po ON u RS [18]. Ve studii autorů z Charité (2017) byl objem GCL + IPL v oblasti makuly po ON u AQP4-IgGpozNMOSD (n = 19) významně snížený (1,54 vs. 1,87 mm3 u zdravých kontrol). Vrstva GCL je přirozeně nejsilnější v parafoveolární oblasti. Právě tam dochází i k největšímu úbytku gangliových buněk a foveolární jamka se tím mírně rozšiřuje [19]. Zatímco tloušťka vrstev GCL + IPL po ON u RS byla ve studii australských autorů (2019) snížena o cca 22 % v celém rozsahu makuly, vrstva GCL + IPL byla po ON u NMOSD snížena o 25–35 % s maximem těsně parafoveolárně [20].
Obr. 3. Longitudinální sledování tloušťky RNFL v peripapilární oblasti pravého oka pomocí optické koherenční tomografi e u pacientky s AQP4-IgGpozNMOSD. V průběhu sledování proběhly dvě epizody zánětu očního nervu – na počátku října 2010 a v únoru 2011. (a) ukazuje nález v akutní fázi zánětu. (b) ukazuje nález po 4 měsících. Tloušťka RNFL v jednotlivých segmentech je sice ve většině segmentů v mezích normy (kódována zeleně), avšak křivka RNFL na grafu dole je jasně oploštělá a vykazuje pokles ve všech segmentech. Na mírném zvýšení tloušťky RNFL oproti předchozímu vyšetření se podílí edém při právě probíhající recidivě optické neuritidy ve vyšetřovaném oku. Místo, kde křivku RNFL zvedá céva probíhající na povrchu sítnice, je označeno žlutou šipkou. (c) ukazuje stav sítnice rok po počátku prvního zánětu. RNFL je natolik ztenčeno, že je na několika místech prakticky neměřitelné.
Fig. 2. Longitudinal follow up of peripapillary RNFL thickness (right eye) in a patient with AQP4-IgGposNMOSD. Two episodes of optic neuritis occurred during the follow-up – in October 2010 and in February 2011. (a) shows fi nding in the acute phase of optic neuritis. (b) shows fi ndings 4 months later. The thickness of RNFL still falls within normal values in most peripapillary segments (coded in green) however, the curve of RNFL thickness has been fl attened and shows a loss of RNFL in all segments. A slight increase in RNFL thickness on this day in comparison with the prior exam is caused by edema caused by the second optic neuritis in the right eye. The blood vessels artifi cially increase the RNFL thickness (marked by a yellow arrow). (c) shows retinal fi ndings a full year after the onset of fi rst optic neuritis in the eye. RNFL has been thinned and cannot be reliably quantifi ed.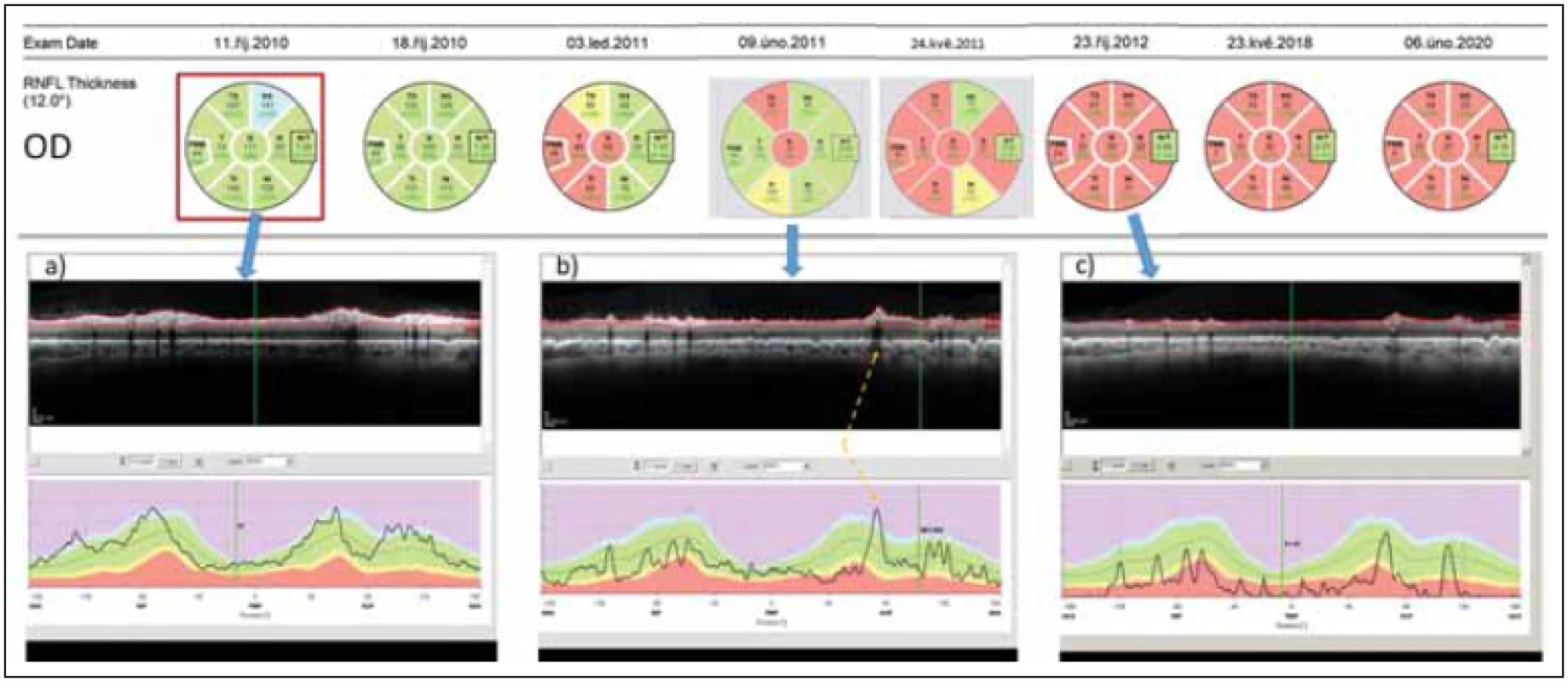
RNFL – retinálních nervových vláken
RNFL – retinal nerve fi ber layerObr. 4. Vyšetření makuly pomocí optické koherenční tomografi e u pacientky s probíhající optickou neuritidou u neuromyelitis optica a onemocnění jejího širšího spektra. Barevná legenda tloušťky vyšetřované vrstvy je ve sloupci vpravo u každé mapy. V prvním sloupci jsou výsledky měření TMV, v prostředním sloupci je tloušťka vrstvy NFL a v pravém sloupci je tloušťka vrstvy GCL. U prvního vyšetření z 31. 10. 2017 (v prvním řádku), které bylo provedeno krátce po počátku příznaků optické neuritidy, pozorujeme známky peripapilárního edému zasahujícího do NFL a TMV (modré šipky). Vyšetření provedené s odstupem 6 týdnů (výsledky ve druhém řádku) již ukazuje mírné tenčení vrstvy GCL a ústup peripapilárního edému. Ve třetím řádku je vyšetření provedené s odstupem od optické neuritidy (v červnu 2019), kde můžeme pozorovat ztrátu NFL a GCL ve všech segmentech makuly a s tím spojené snížení TMV.
Fig. 3. Optical coherence tomography assessment of macula in a patient with optic neuritis in neuromyelitis optica spectrum disorders. The thickness of retinal layers is color-coded to the right of each map. The fi rst column shows the measurement of TMV, the middle column shows the thickness of NFL, and the thickness of GCL is in the column on the right. The fi rst assessment was performed in October 2017 shortly after the fi rst symptoms of optic neuritis and reveals peripapillary edema (blue arrows) aff ecting the NFL and TMV (results in the fi rst row). The assessment performed six weeks later shows thinning of GCL and decrease of peripapillary edema (results in the second row). The fi nal assessment shown was performed in June 2019 and shows loss of NFL and GCL in all macular segments and related decrease of TMV.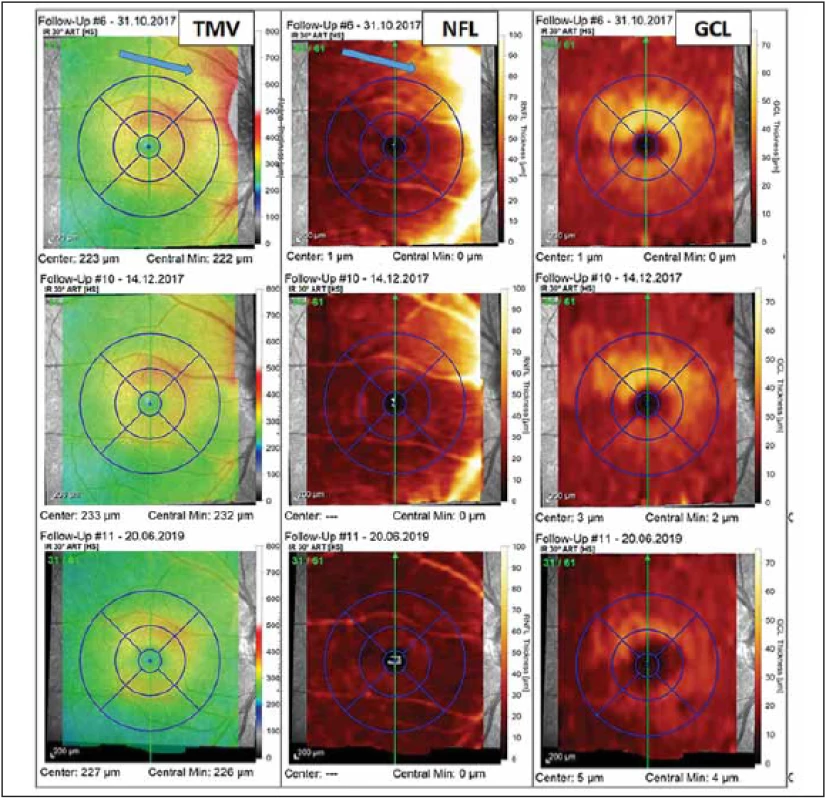
GCL – gangliové buňky; NFL – nervová vlákna v oblasti makuly; TMV – celková tloušťka makuly
GCL – ganglion cell layer; NFL – nerve fi ber layer in macula; TMV – total macular volumeMikrostrukturální změny u NMOSD bez ON
V očích pacientů s NMOSD, u nichž neproběhl zánět ani v jednom očním nervu (NON-NMOSD), nedochází ke snižování pRNFL, a proto byly tyto oči dlouho považovány za nepostižené. Průměrná tloušťka pRNFL je v NON-NMOSD očích hraničně vyšší, avšak nedosahuje nad horní hranici normy pro věk a pohlaví pacienta (vlastní data) [18]. Vysvětlení pro toto pozorování zatím není známo, ale může souviset s poruchou homeostázy vody u NMOSD. Existují i další důkazy, že sítnice u NON-NMOSD očí není zcela nepostižená.
Oertel et al ukázali, že objem GCIPL v NON-NMOSD očích je nižší než u zdravých kontrol (0,60 ± 0,05 vs. 0,63 ± 0,04 mm3; p = 0,016), a to i v případě, že do kohorty zahrnuli jen pacienty, kteří neměli postižení ani na jednom oku (ON u NMOSD často postihuje i chiasma, což by mohlo měření ovlivnit). Mírný úbytek vrstvy GCIPL byl naměřen i během 3letého longitudinálního sledování [21,22].
ON u NMOSD je destruktivnější než ON u RS
Naši představu o mechanizmu poškození sítnice u NMOSD odvozujeme od známých charakteristik lézí v CNS. Autoprotilátky proti AQP4 překročí hematoencefalickou bariéru (o spouštěcím mechanizmu porušení bariéry se vedou debaty) [23], reagují s transmembránovými akvaporinovými kanály astrocytů objímajících kapiláry, aktivují komplement a spustí cytotoxickou reakci s formováním membrány atakujícího komplexu. V procesu se také uplatňuje protilátkově zprostředkovaná buněčná cytotoxická reakce proti astrocytům. V CNS do místa zánětu vycestují na podkladě chemotaxe další buňky imunitního systému (eozinofily, neutrofily a monocyty/makrofágy), které způsobí sekundární poranění oligodendrocytů a neuroaxonální poranění. Geneze postižení sítnice u NMOSD se (oproti CNS) liší na několika úrovních. Za prvé je namířena nejen proti astrocytům, ale také proti Müllerovým buňkám. Na zvířecím modelu bylo ukázáno, že k autoimunitní reakci v oku nemusí být nutně přítomen komplement [24]. Vazba AQP4-IgG na astrocyty CNS vede k internalizaci AQP4, poruše transportu vody, edému astrocytů a zánětu [25]. Ačkoliv byl tento jev prokázán na astrocytech CNS, dokážeme si představit, že stejný efekt by byl pro citlivé buňky sítnice toxický. Müllerovy buňky jsou nejen strukturální oporou sítnice a zajišťují metabolizmus vody, ale také chrání neurony před nadměrnou expozicí glutamátu. Přesný mechanizmus postižení sítnice u NMOSD není zcela objasněn.
Destruktivnost procesu u pacientů s AQP4--IgGpozNMOSD je dána topografickým vztahem Müllerových buněk a astrocytů sítnice ke gangliovým buňkám [26]. Plochá těla astrocytů sítnice (exprimují AQP4, stejně jako v CNS) se nachází na povrchu vrstvy RNFL a jejich výběžky se proplétají v celé vrstvě RNFL. Těla Müllerových buněk sídlí ve vnitřní jaderné vrstvě (INL), prochází celou sítnicí a jejich výběžky tvoří vnitřní a zevní limitující membránu sítnice. Müllerovy buňky jsou v sítnici mimo jiné zodpovědné za metabolizmus vody a jejich stěna je bohatá na kanály AQP4. Axony gangliových buněk jsou tedy obklopeny buňkami, které bohatě exprimují AQP4, a při aktivaci zánětu u NMOSD jsou vystaveny plošné destrukci [23].
Patofyziologie NMOSD je předmětem intenzivního studia a její částečné pochopení již přineslo úspěšné terapeutické strategie [27–29].
Klinický význam OCT u NMOSD
Správná diagnóza u první ON v životě je kritická pro správnou volbu léčebné strategie a záchranu zraku. OCT je unikátním nástrojem, který nám umožňuje neinvazivně studovat změny ve vrstvách sítnice a odlišit vzorec postižení typický pro ON u NMOSD a u RS. První vyšetření OCT je vhodné provést již na počátku příznaků ON. V tu chvíli sice ještě nemůžeme hodnotit vzorec ztráty vrstev, ale získáme tím důležité výchozí měření stavu obou očí. Pokud jde o první ON a je skutečně postiženo jen jedno oko (u NMOSD je často postiženo chiasma), tak můžeme porovnávat tloušťku sítnice v postiženém a nepostiženém oku. V dalších týdnech jsou změny RNFL v postiženém oku maskovány pomalu ustupujícím peripapilárním otokem. Vyšetření OCT mezi 2. a 3. měsícem od počátku příznaků ON u NMOSD již odhalí pokles vrstvy RNFL v peripapilární oblasti ve více než jen v temporálním segmentu.
Grantová podpora
Podpořeno projektem Progres Q27/LF1.
Konflikt zájmů
Autoři deklarují, že v souvislosti s předmětem studie nemají žádný konflikt zájmů.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
MUDr. Jana Lízrová Preiningerová, Ph.D.
Neurologická klinika a Centrum klinických neurověd
1. LF UK a VFN v Praze
Kateřinská 30
128 08 Praha
e-mail: jana.lizrova@vfn.cz
Zdroje
1. Monteiro ML, Fernandes DB, Apostolos-Pereira SL et al. Quantification of retinal neural loss in patients with neuromyelitis optica and multiple sclerosis with or without optic neuritis using Fourier-domain optical coherence tomography. Invest Ophthalmol Vis Sci 2012; 53 (7): 3959–3966. doi: 10.1167/iovs.11-9324.
2. Mealy MA, Wingerchuk DM, Greenberg BM et al. Epidemiology of neuromyelitis optica in the United States: a multicenter analysis. Arch Neurol 2012; 69 (9): 1176–1180. doi: 10.1001/archneurol.2012.314.
3. Sato DK, Callegaro D, Lana-Peixoto MA et al. Distinction between MOG antibody-positive and AQP4 antibody-positive NMO spectrum disorders. Neurology 2014; 82 (6): 474–481. doi: 10.1212/WNL.0000000000000101.
4. Probstel AK, Rudolf G, Dornmair K et al. Anti-MOG antibodies are present in a subgroup of patients with a neuromyelitis optica phenotype. J Neuroinflammation 2015; 12 : 46. doi: 10.1186/s12974-015-0256-1.
5. Zamvil SS, Slavin AJ. Does MOG Ig-positive AQP4-seronegative opticospinal inflammatory disease justify a diagnosis of NMO spectrum disorder? Neurol Neuroimmunol Neuroinflamm 2015; 2 (1): e62. doi: 10.1212/NXI.0000 000000000062.
6. Merle H, Olindo S, Bonnan M et al. Natural history of the visual impairment of relapsing neuromyelitis optica. Ophthalmology 2007; 114 (4): 810–815. doi: 10.1016/j.ophtha.2006.06.060.
7. Ratchford JN, Quigg ME, Conger A et al. Optical coherence tomography helps differentiate neuromyelitis optica and MS optic neuropathies. Neurology 2009; 73 (4): 302–308. doi: 10.1212/WNL.0b013e3181af78b8.
8. Schneider E, Zimmermann H, Oberwahrenbrock T et al. Optical coherence tomography reveals distinct patterns of retinal damage in neuromyelitis optica and multiple sclerosis. PLoS One 2013; 8 (6): e66151. doi: 10.1371/journal.pone.0066151.
9. Park KA, Kim J, Oh SY. Analysis of spectral domain optical coherence tomography measurements in optic neuritis: differences in neuromyelitis optica, multiple sclerosis, isolated optic neuritis and normal healthy controls. Acta Ophthalmol 2014; 92 (1): e57–e65. doi: 10.1111/aos.12215.
10. Wingerchuk DM, Hogancamp WF, O‘Brien C et al. The clinical course of neuromyelitis optica (Devic‘s syndrome). Neurology 1999; 53 (5): 1107–1114. doi: 10.1212/wnl. 53.5.1107.
11. Matiello M, Lennon VA, Jacob A et al. NMO-IgG predicts the outcome of recurrent optic neuritis. Neurology 2008; 70 (23): 2197–2200. doi: 10.1212/01.wnl.0000303817.82134.da.
12. Jitprapaikulsan J, Chen JJ, Flanagan E et al. Aquaporin-4 and myelin oligodendrocyte glycoprotein autoantibody status predict outcome of recurrent optic neuritis. Ophthalmology 2018; 125 (10): 1628–1637. doi: 10.1016/j.ophtha.2018.03.041.
13. Sotirchos ES, Filippatou A, Fitzgerald KC et al. Aquaporin-4 IgG seropositivity is associated with worse visual outcomes after optic neuritis than MOG-IgG seropositivity and multiple sclerosis, independent of macular ganglion cell layer thinning. Mult Scler 2019 : 1352458519864928. doi: 10.1177/1352458519864928.
14. Sato DK, Nakashima I, Takahashi T et al. Aquaporin-4 antibody-positive cases beyond current diagnostic criteria for NMO spectrum disorders. Neurology 2013; 80 (24): 2210–2216. doi: 10.1212/WNL.0b013e318296ea08.
15. de Seze J, Blanc F, Jeanjean L et al. Optical coherence tomography in neuromyelitis optica. Arch Neurol 2008; 65 (7): 920–923. doi: 10.1001/archneur.65.7.920.
16. Merle H, Olindo S, Donnio A et al. Retinal peripapillary nerve fiber layer thickness in neuromyelitis optica. Invest Ophthalmol Vis Sci 2008; 49 (10): 4412–4417. doi: 10.1167/iovs.08-1815.
17. Nytrova P, Kleinova J, Lizrova Preiningerova J et al. Neuromyelitis optica a poruchy jejího širšího spektra – retrospektivní analýza klinických a paraklinických nálezů. Cesk Slov Neurol N 2015; 78/111 (1): 72–77. doi: 10.14735/amcsnn201572.
18. Fernandes DB, Raza AS, Nogueira RG et al. Evaluation of inner retinal layers in patients with multiple sclerosis or neuromyelitis optica using optical coherence tomography. Ophthalmology 2013; 120 (2): 387–394. doi: 10.1016/j.ophtha.2012.07.066.
19. Oertel FC, Kuchling J, Zimmermann H et al. Microstructural visual system changes in AQP4-antibody-seropositive NMOSD. Neurol Neuroimmunol Neuroinflamm 2017; 4 (3): e334. doi: 10.1212/NXI.0000000000000334.
20. Shen T, You Y, Arunachalam S et al. Differing structural and functional patterns of optic nerve damage in multiple sclerosis and neuromyelitis optica spectrum disorder. Ophthalmology 2019; 126 (3): 445–453. doi: 10.1016/j.ophtha.2018.06.022.
21. Wingerchuk DM, Banwell B, Bennett JL et al. International consensus diagnostic criteria for neuromyelitis optica spectrum disorders. Neurology 2015; 85 (2): 177–189. doi: 10.1212/WNL.0000000000001729.
22. Oertel FC, Havla J, Roca-Fernandez A et al. Retinal ganglion cell loss in neuromyelitis optica: a longitudinal study. J Neurol Neurosurg Psychiatry 2018; 89 (12): 1259–1265. doi: 10.1136/jnnp-2018-318382.
23. Zeka B, Lassmann H, Bradl M. Muller cells and retinal axons can be primary targets in experimental neuromyelitis optica spectrum disorder. Clin Exp Neuroimmunol 2017; 8 (Suppl 1): 3–7. doi: 10.1111/cen3.12345.
24. Felix CM, Levin MH, Verkman AS. Complement-independent retinal pathology produced by intravitreal injection of neuromyelitis optica immunoglobulin G. J Neuroinflammation 2016; 13 (1): 275. doi: 10.1186/s12974-016-0746-9.
25. Hinson SR, Romero MF, Popescu BF et al. Molecular outcomes of neuromyelitis optica (NMO) -IgG binding to aquaporin-4 in astrocytes. Proc Natl Acad Sci U S A 2012; 109 (4): 1245–1250. doi: 10.1073/pnas.1109980108.
26. Levin MH, Bennett JL, Verkman AS. Optic neuritis in neuromyelitis optica. Prog Retin Eye Res 2013; 36 : 159–171. doi: 10.1016/j.preteyeres.2013.03.001.
27. Bradl M, Reindl M, Lassmann H. Mechanisms for lesion localization in neuromyelitis optica spectrum disorders. Curr Opin Neurol 2018; 31 (3): 325–333. doi: 10.1097/WCO.0000000000000551.
28. Mader S, Kumpfel T, Meinl E. Novel insights into pathophysiology and therapeutic possibilities reveal further differences between AQP4-IgG - and MOG-IgG-associated diseases. Curr Opin Neurol 2020; 33 (3): 362–371. doi: 10.1097/WCO.0000000000000813.
29. Chen T, Lennon VA, Liu YU et al. Astrocyte-microglia interaction drives evolving neuromyelitis optica lesion. J Clin Invest 2020; 130 (8): 4025–4038. J Clin Invest 2020; 130 (8): 4025–4038.
Štítky
Dětská neurologie Neurochirurgie Neurologie
Článek vyšel v časopiseČeská a slovenská neurologie a neurochirurgie
Nejčtenější tento týden
2020 Číslo supplementum 1- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Magnosolv a jeho využití v neurologii
- Zolpidem může mít širší spektrum účinků, než jsme se doposud domnívali, a mnohdy i překvapivé
- Nejčastější nežádoucí účinky venlafaxinu během terapie odeznívají
-
Všechny články tohoto čísla
- Neuromyelitis optica – imunopatogenetické mechanizmy
- Epidemiologie, klinický obraz a průběh onemocnění u neuromyelitis optica a onemocnění jejího širšího spektra
- Nálezy na magnetické rezonanci u neuromyelitis optica a onemocnění jejího širšího spektra
- Editorial
- Laboratorní vyšetření u neuromyelitis optica a onemocnění jejího širšího spektra
- Využití optické koherenční tomografie u neuromyelitis optica a onemocnění jejího širšího spektra
- Evokované potenciály u neuromyelitis optica a spektra ochorení neuromyelitis optica
- Historie neuromyelitis optica a onemocnění jejího širšího spektra, vývoj diagnostických kritérií
- Diferenciální diagnostika neuromyelitis optica a onemocnění jejího širšího spektra
- Terapie relapsů u neuromyelitis optica a onemocnění jejího širšího spektra
- Chronická a symptomatická léčba neuromyelitis optica a onemocnění jejího širšího spektra
- Specifika onemocnění ze širšího spektra neuromyelitis optica u dětí
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Nálezy na magnetické rezonanci u neuromyelitis optica a onemocnění jejího širšího spektra
- Laboratorní vyšetření u neuromyelitis optica a onemocnění jejího širšího spektra
- Epidemiologie, klinický obraz a průběh onemocnění u neuromyelitis optica a onemocnění jejího širšího spektra
- Diferenciální diagnostika neuromyelitis optica a onemocnění jejího širšího spektra
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



