-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaproLékaře.cz / Odborné časopisy / Česká a slovenská neurologie a neurochirurgie / 2020 - supplementum 1Laboratorní vyšetření u neuromyelitis optica a onemocnění jejího širšího spektra
Neuromyelitis optica spectrum disorders – laboratory examination
The assessment of neuronal antibodies improves diagnostic accuracy in a group of autoimmune disorders of the CNS. One of these examples is the detection of autoantibodies to aquaporin-4 (AQP4-IgG) in patients with neuromyelitis optica (NMO). The discovery of these antibodies has improved understanding of the pathogenesis and therapeutic approach in this syndrome. Furthermore, these antibodies facilitated the differentiation between NMO and MS. The sensitivity and specificity of these antibodies increased thanks to the assessment using cell-based assays in which antigen is expressed as a native protein in a membrane of the transfected cell. This was confirmed by testing of other antibodies targeting myelin oligodendrocyte glycoprotein, which are associated with acute disseminated encephalomyelitis or AQP4-IgGnegNMO. These autoantibodies are rarely detected in patients with MS.
Keywords:
MOG encephalomyelitis – neuromyelitis optica – antibodies to aquaporin-4 – antibodies to myelin oligodendrocyte glycoprotein – cell-based assays
Autoři: P. Nytrová 1; V. Král 2
Působiště autorů: Neurologická klinika a Centrum klinických neurověd, 1. LF UK a VFN v Praze 1; Centrum imunologie a mikrobiologie, Zdravotní ústav se sídlem v Ústí nad Labem 2
Vyšlo v časopise: Cesk Slov Neurol N 2020; 83/116(supplementum 1): 31-36
doi: https://doi.org/10.14735/amcsnn2020S31Souhrn
Stanovení neurálních autoprotilátek výrazně zlepšuje a zrychluje diagnostiku některých autoimunitních onemocnění CNS. Jedním z příkladů jsou protilátky proti akvaporinu-4 (AQP4-IgG) u pacientů s neuromyelitis optica (NMO). Jejich objev umožnil částečné porozumění patogeneze tohoto syndromu, zlepšil terapeutické přístupy a umožnil definitivní odlišení NMO od RS. Díky metodám stanovení protilátek proti proteinům v jejich přirozené prostorové konformaci pomocí cell-based assays (antigen je exprimován v membránách transfekovaných buněk) se výrazně zvýšila jejich specificita a senzitivita. Toto se také potvrdilo u protilátek proti myelinovému oligodendrocytárnímu glykoproteinu, u kterých byla původně předpokládána asociace s RS. Je známo, že protilátky proti nativnímu myelinovému oligodendrocytárnímu glykoproteinu jsou např. asociovány s akutní diseminovanou encefalomyelitidou nebo AQP4-IgG séronegativní NMO. U pacientů s RS jsou tyto autoprotilátky vzácné.
Klíčová slova:
neuromyelitis optica – MOG encefalomyelitida – protilátky proti akvaporinu-4 – protilátky proti myelinovému oligodendrocytárnímu glykoproteinu – cell-based assay
Úvod
Antigenně specifické protilátky jsou součástí adaptivní imunitní odpovědi, která nás významně chrání proti různým patogenům. V některých případech může jedinec tvořit protilátky, jejichž terče (antigeny) jsou exprimovány v normálních strukturách CNS. Tyto (auto) protilátky můžeme rozdělit v neurologii s ohledem na klinické konsekvence na dvě velké skupiny v závislosti na lokalizaci cílového antigenu. V první skupině jsou autoprotilátky namířeny proti strukturám jádra nebo cytosolu buněk. Často jsou paraneoplastické etiologie a nezasahují významně do funkcí buněk. Předpokládáme, že jsou spíše epifenoménem poškozujícího zánětu než klíčovým patogenetickým hráčem. Druhou skupinu tvoří později objevené protilátky rozpoznávající antigenní strukturu nativních proteinů, které jsou dostupné na povrchu buněk v jejich membránách. U těchto protilátek byl prokázán zřejmý efektorový účinek, ať již cytotoxický (lytické působení aktivace komplementu po vazbě na imunitní komplex) či ovlivnění funkce buněk blokádou ligand – receptorové interakce. Navázání těchto protilátek vede ke změně funkce buněk a předpokládáme jejich přímý patogenní efekt [1]. Pochopení tohoto zásadního rozdílu je důležité i pro výběr adekvátní metody pro jejich stanovení.
Základní metody, kterými stanovujeme tyto autoprotilátky v neuroimunologii, jsou ve zjednodušení tři:
- tissue-based assays (TBA) – stanovení na tkáňových řezech metodou nepřímé imunofluorescence nebo imunohistochemicky;
- protein-based assays (PBA) – stanovení pomocí rekombinantního proteinu, např. ELISA, imunoblot atd.;
- cell-based assays (CBA) – stanovení na buňkách transfekovaných vektorem nesoucím příslušný antigen [2].
TBA je běžně používaná v neurologii pro iniciální identifikaci autoprotilátky, při jejich pozitivitě lze pozorovat v mikroskopickém obraze určitý charakteristický obraz. Jednou z výhod může být i určení koexistujících protilátek [3]. Toto klade vysoké nároky na člověka trénovaného v odečítání nálezů a také na standardizaci vyšetření. Pokud je antigen autoprotilátky znám, pak používáme antigen specifické metody, které využívají rekombinantní proteiny (např. ELISA, imunoblot a další) nebo je genetická informace pro daný protein v podobě plazmidu vnášena do buněk v tkáňových kulturách pomocí transfekce. Tento protein je pak buňkou exprimován v její cytoplazmatické membráně (CBA – obr. 1) [4]. CBA přináší jednu zásadní výhodu, a to expresi antigenu v jeho přirozené konformaci v membráně (tedy zachované terciální struktuře). Toto je právě zásadní pro stanovení protilátek proti akvaporinu-4 (aquaporin-4 immunoglobulin G; AQP4-IgG) a myelinovému oligodendrocytárnímu glykoproteinu (myelin oligodendrocyte glycoprotein antibody; MOG-IgG) u pacientů s klinickým obrazem odpovídajícím neuromyelitis optica (NMO) a onemocněním jejího širšího spektra (neuromyelitis optica spectrum disorder; NMOSD), jako je optická neuritida, myelitida, syndrom area postrema nebo jiný kmenový syndrom, vzácně pak diencefalické nebo cerebrální léze [5,6].
Obr. 1. Schéma transfekce genu pro AQP4 (plazmid) do lidské buněčné linie (např. HEK293) s jeho následnou expresí.
Fig. 1. Diagram of the transfection of a plasmid encoding AQP4 in a human cell line. Transfected cells express AQP4 in the plasma membrane.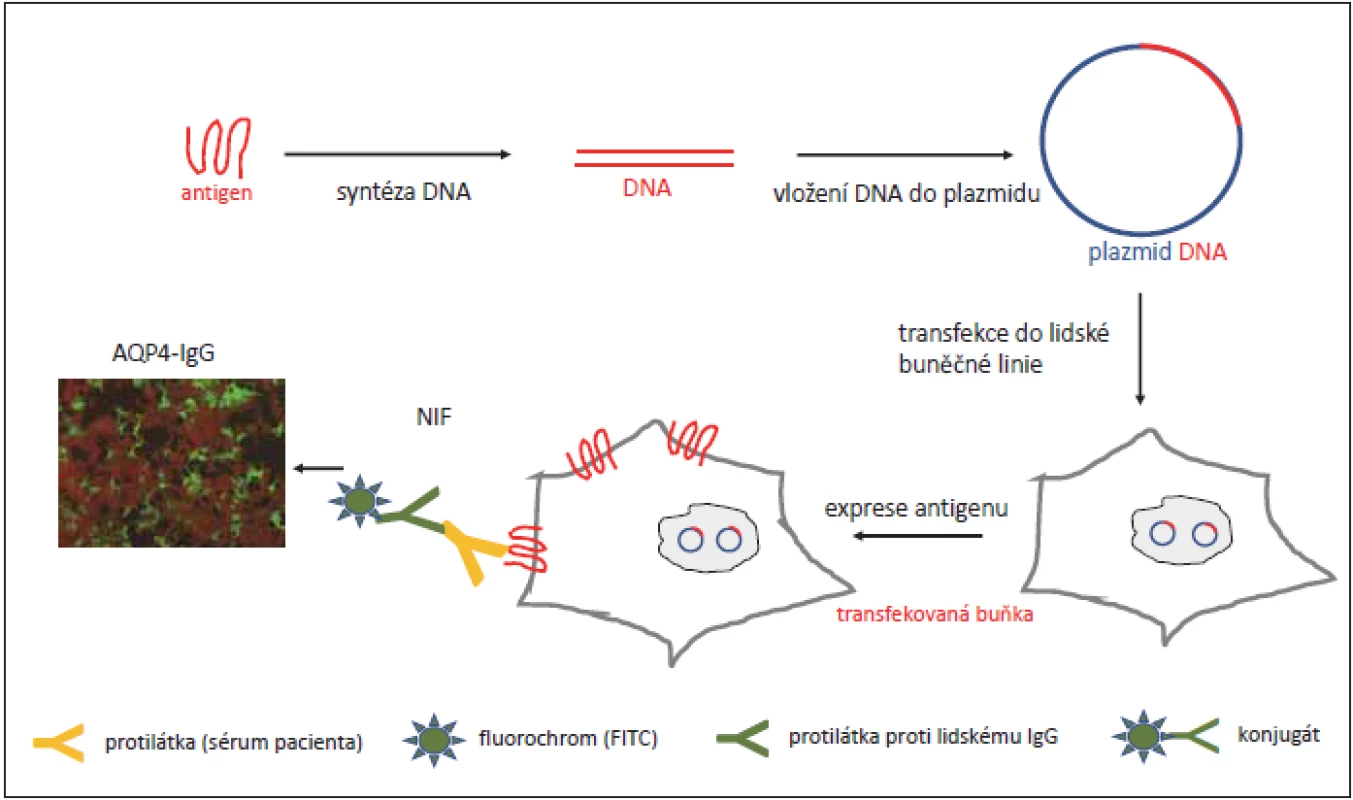
Transfekované buňky postupně inkubujeme se sérem pacienta a protilátkami proti lidskému imunoglobulinu značené fl uoresceinem (metoda NIF). Pokud je sérum pozitivní na protilátky proti AQP4, dochází k zobrazení pozitivních buněk ve fl uorescenčním mikroskopu (zde zeleně). Volně dle L. KOmorowski (Euroimmun).
These cells are incubated with a patient’s serum and fl uorescein-conjugated anti-human immunoglobulin G antibodies (method of NIF) at the second step. If the serum is positive, we can see positive staining in a microscope (green, fl uorescein-conjugated anti-human immunoglobulin G). AQP4 – aquaporin-4; NIF – indirect immunofl uorescenceVyšetření autoprotilátek u NMO a NMOSD
Význam vyšetření autoprotilátek v diagnostice autoimunitního postižení CNS roste a při podezření na NMOSD je jedním z klíčových momentů diferenciálně diagnostického procesu.
Protilátky proti akvaporinu-4 (AQP4-IgG dříve NMO-IgG)
Tyto autoprotilátky byly popsány v roce 2004 v krvi některých pacientů splňujících Wingerchukova kritéria pro NMO z roku 1999. Séra těchto pacientů byla inkubována na tkáňových řezech opičího mozečku, v dalším kroku proběhla inkubace s protilátkami proti lidskému imunoglobulinu G značenými fluoresceinem (fluorescein isothiocyanate; FITC). U části pacientů bylo pozorováno poměrně typické perivaskulární barvení (obr. 2A). Tyto autoprotilátky byly označeny NMO-IgG [7]. Senzitivita této metody (při velmi dobré specifitě) však byla maximálně 53 % [8].
Obr. 2. Tkáňové řez a cell-based assay u AQP4-IgG pozitivního pacienta.
Fig. 2. Tissue based assay and cell-based assay for AQP4-IgG.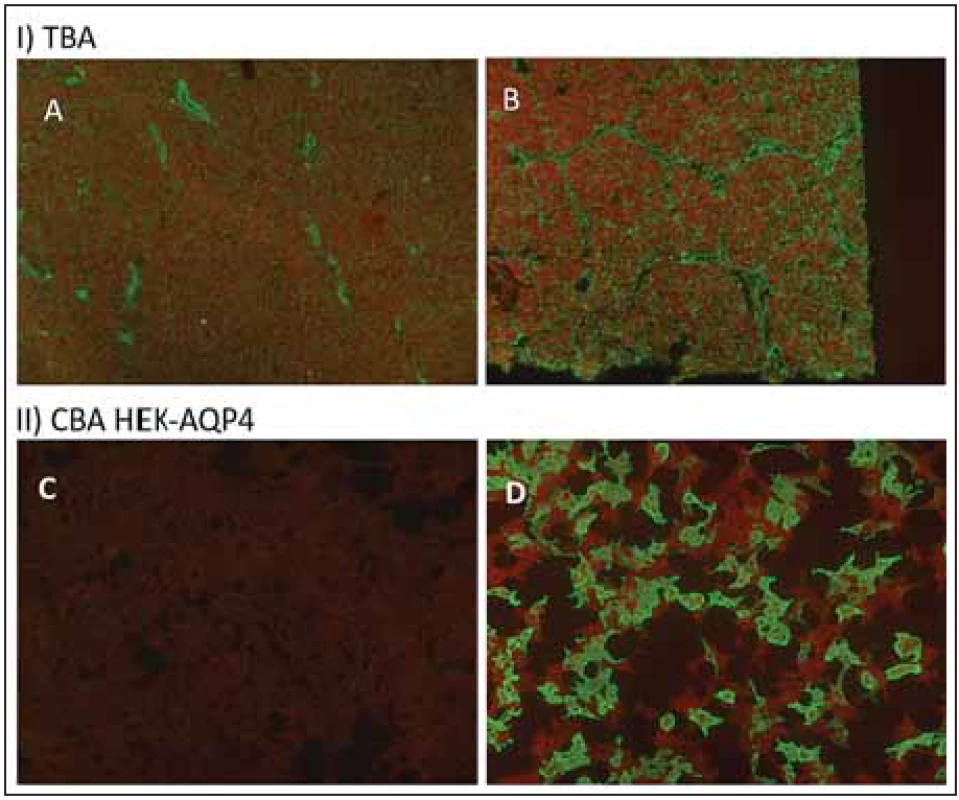
Řádek I – tkáňový řez mozkem potkana (A) a optickým nervem opice (B, transverzální řez) byly inkubovány se sérem pacienta s NMO a následně s protilátkami proti lidskému imunoglobulinu G (anti-hIgG konjugované s FITC – zelená barva) s dobarvením Evansovou modří (zvětšeno 40 × 10). Typické perivaskulární barvení rozetovitého charakteru (A) a barvení astrocytů optického nervu (B).
Řádek II – cell based assay – HEK293 buňky transfekované M1 izoformou AQP4 inkubované se sérem zdravého jedince (C) a NMO pacienta (D), metoda detekce nepřímá imunofl uorescence (anti-hIgG konjugované s FITC). anti-hIgG – protilátky proti lidskému imunoglobulinu; AQP4 – akvaporin-4; FITC – fl uorescein; NMO – neuromyelitis optica
Line I – rat hippocampus (A) and primate optic nerve tissue (B, transverse frozen section) were incubated with NMO patient’s serum and FITC-conjugated anti-hIgG (indirect immunofl uorescence) at the second step and Evans blue (magnifi cation 40 × 10). Typical perivascular staining in a rim and rosette pattern (A) and staining of astrocytes of the optic nerve (B).
Line II – AQP4 transfected HEK293 cells (M1 isoform). These cells were incubated with a serum of healthy control (C) or patient’s serum (D) and FITC-conjugated anti-hIgG (green colour). anti-hIgG – anti-human immunoglobulin G antibody; AQP4 – aquaporin-4; FITC – fl uorescein; NMO – neuromyelitis opticaV roce 2005 Lennon et al identifikovali cílový antigen těchto protilátek – akvaporin-4 (AQP4) [9]. AQP4 je protein exprimovaný převážně astrocyty a vyskytuje se ve dvou izoformách M1 a M23 [10]. Tento objev umožnil vyvíjet specifičtější a senzitivnější metody stanovení těchto autoprotilátek. Některé laboratoře zkoušely využít Western blotu, ale ten detekuje lineární epitopy AQP4 [11] a pro stanovení těchto protilátek není vhodný, což platí i pro ELISA metody. Tento problém eliminuje CBA, kdy dochází k expresi AQP4 v membráně buněk (nejčastěji se jedná o tkáňové kultury lidských embryonálních buněk ledvin [human embryonic kidney; HEK]), kde extracelulární antigenní část je poměrně malá a protein je v přirozené konformaci.
Nejvyšší senzitivitu mají metody CBAs hodnocené vizuálně v imunofluorescenčním mikroskopu (senzitivita 73 %) nebo průtokovou cytometrií (senzitivita 77 %) [8]. CBAs používající M23 izoformu AQP4 mají vyšší senzitivitu než CBA s transfekcí izoformou M1. CBA je v současnosti považována za zlatý standard v detekci AQP4-IgG [12]. Je důležité si uvědomit, že právě zlepšení specificity metod detekce AQP4-IgG (> 99 %) umožnilo i rozšíření klinického fenotypu projevů NMO. Metody CBAs mohou být komerčně dostupné pro standardní testování v klinických laboratořích (obr. 2C, D) nebo CBAs na vědeckých pracovištích, kde jsou vlastní protokoly pro transfekce, barvení atd. (tzv. in-house metody) (obr. 3A, B). V případě pozitivního nálezu je možné semikvantitativní stanovení protilátek v titrech. Tedy nejvyšší ředění séra, kdy byla přítomna pozitivita protilátek.
Obr. 3. Cell-based assay, kde jsou HEK buňky transfekovány plazmidem kódujícím izoformu M23 AQP4. Současná kotransfekce EGFP (zelené zbarvení).
Fig. 3. In-house cell-based assay for AQP4-IgG (isoform M23) with cotransfection of EGFP (green colour).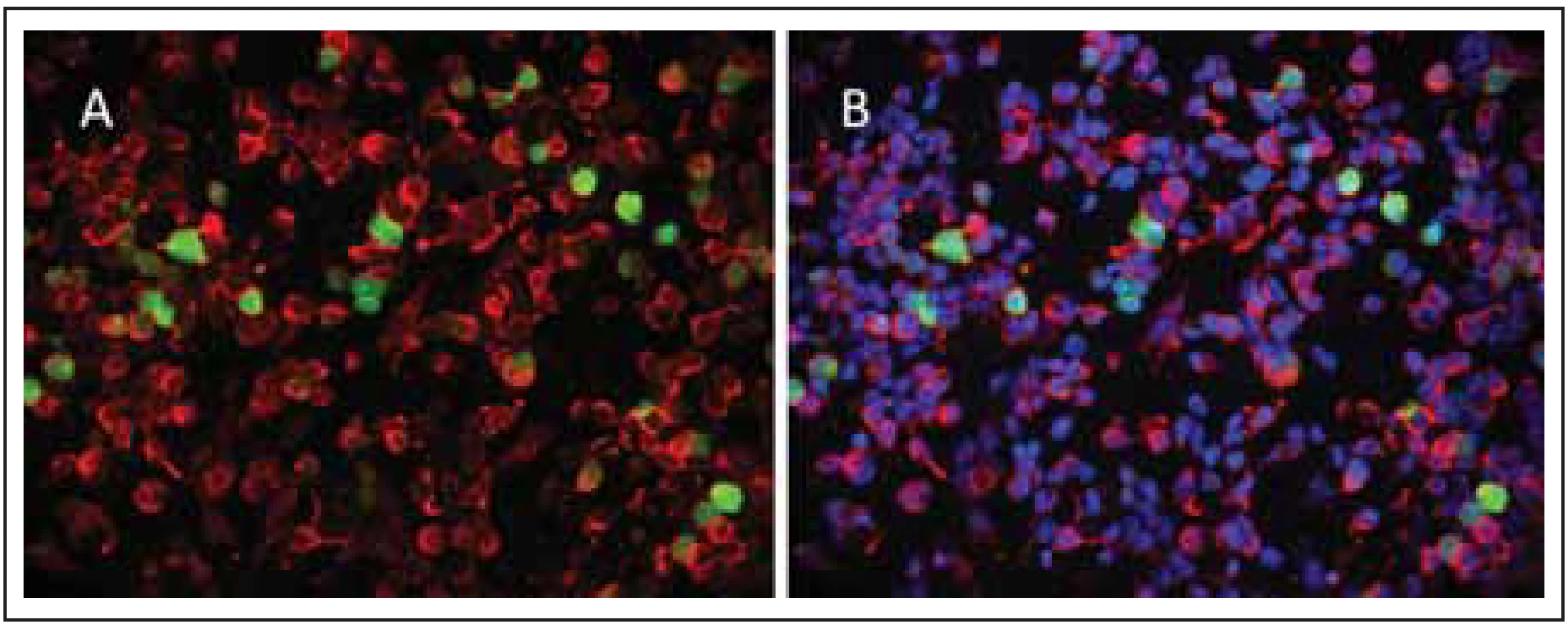
Tyto transfekované buňky jsou inkubovány se sérem pacienta s NMO a následně s anti-hIgG 594 Alexa Fluor protilátkou (červené zbarvení dominantně membrány buněk) (A). Na obrázku B lze vidět sloučený obraz 3A s dobarvením pomocí DAPI (4´,6-diamidino-2-fenylindol dihydrochlorid), které se váže na DNA a vizualizuje viabilní buňky. EGFP produkované kontrolními HEK buňkami je distribuováno z jádra do cytoplazmy. anti-hIgG – protilátky proti lidskému imunoglobulinu; AQP4 – akvaporin-4
These cells were incubated with patient’s serum and Alexa Fluor 594-conjugated anti-hIgG (red colour) (A). The patient’s AQP4-IgG binds to the plasma membrane of cultured HEK cells transfected with AQP4. Figure B merged images. DAPI (4´,6-diamidino-2-phenylindole dihydrochloride) is a cell permeable, fl uorescent dye that binds to DNA. EGFP produced in control transfected cells is distributed throughout the nucleus and cytoplasm. anti-hIgG – anti-human immunoglobulin G antibody; AQP4 – aquaporin-4Zcela zásadní prací pak bylo multicentrické srovnání jednotlivých metod stanovení AQP4-IgG [12]. Potvrzení velmi vysoké specificity AQP4-IgG pomocí CBAs na různých pracovištích umožnilo tento biomarker postavit v rámci diagnostických kritérií pro NMOSD z roku 2015 na úroveň znaku potvrzujícího diagnózu i v případě jediné ataky akutní myelitidy, optické neuritidy nebo kmenové ataky, pokud vyloučíme jiné možné diagnózy [5].
Stanovení AQP4-IgG v séru je dostačující. AQP4-IgG jsou často v likvoru negativní, objevují se v období těsně před relapsem a také je jejich přítomnost závislá na množství protilátek v krvi [13]. Stanovení AQP4-IgG pomocí CBAs, u kterých se fixované transfekované buňky inkubují se sérem pacienta, může někdy mít svá úskalí. U pacientů s koincidencí s vysokými titry antinukleárních protilátek může být hodnocení komplikováno pro překrývající se imunofluorescenční obraz, a proto je v těchto případech lépe využít CBA, kde se inkubuje sérum pacienta s ještě nefixovanými buňkami.
Někdy může být analýza ovlivněna i léčbou pacienta. Např. pokud je pacient léčen natalizumabem, tak může docházet k vazbě této molekuly na povrch transfekovaných buněk, pokud využíváme ke transfekci buňky lidských embryonálních ledvin, kde je molekula VLA4 (very late activation antigen-4, též integrin a4) přirozeně exprimována [14]. Natalizumab je monoklonální protilátkou vázající se na integrin a4b1 na povrchu aktivovaných lymfocytů a monocytů a blokuje interakci s molekulou VCAM-1 na endotelu [15]. Jedná se o případy pacientů s RS, u kterých je tato diagnóza revidována na základě klinických (např. přetrvávající aktivita nemoci) a dalších nálezů. Pokud tedy provádíme odběr krve z diagnostických důvodů, je lepší jej provést před infuzí natalizumabu, popř. i jinou biologickou léčbou na principu protilátek. Otázkou je význam stanovení titrů AQP4-IgG. Jsou práce, kde titry mohou korelovat např. s délkou míšní léze na MR páteře, tíží neurologického deficitu a dalšími parametry [16,17]. Na druhou stranu longitudinální sledování neumožnilo predikovat relaps, byla prokázána redukce titrů protilátek u pacientů s NMO léčených rituximabem [18]. Pozitivita AQP4-IgG v séru pacientů s ON, myelitidami nebo jinou symptomatikou jasně určuje remitentní průběh onemocnění. Neexistuje daný titr protilátek, který by předpovídal relaps. Hodnoty protilátek nelze srovnávat mezi pacienty ve vztahu k aktivitě choroby. Je také prokázáno, že pozitivita protilátek vztažená k věku a pohlaví významně roste s dekádou života, a to zejména u žen nad 50. rokem života. Naopak nejnižší hodnoty jsou okolo 20. roku života u mužů s NMO [19]. Interpretovat tato data můžeme i tak, že množství protilátek u mužů v nižších dekádách života jsou pod detekčními limity dané metody, popř. klinický obraz NMO je zejména v pediatrické kohortě asociován s jinými protilátkami (např. MOG-IgG). Pokud trvá klinické podezření na NMOSD, ale přetrvává negativita AQP4-IgG, pak je jednou z možností odeslání vzorků do některé z laboratoří využívajících CBA s transfekcí izoformou M23, která má větší senzitivitu než komerčně dostupná CBA využívaná v ČR.
Protilátky proti myelinovému oligodendrocytárnímu glykoproteinu (MOG-IgG)
Myelinový oligodendrocytární glykoprotein je exprimovaný oligodendrocyty savců v CNS a je považován za potenciální marker maturace oligodendrocytů. Primáti jej exprimují v několika izoformách, ale přesná funkce MOG není známá. Předpokládá se jeho role jako adhezivní molekuly s možným ovlivněním organizace mikrotubulů [20]. Části tohoto proteinu se používají k indukci modelu experimentálních autoimunitních encefalitid (EAE) u hlodavců. Zájem o detekci protilátek proti MOG (MOG-IgG) trvá již několik desetiletí. První studie zabývající se přítomností MOG-IgG u pacientů s klinicky izolovaným syndromem či RS naznačovala, že výskyt těchto protilátek může být až u 20 % pacientů [21,22]. Nicméně k detekci se používaly metody ELISA nebo imunoblot, kdy v kontrolních skupinách (zdravé kontroly nebo jiná nezánětlivá neurologická onemocnění) byl zachycen taktéž vysoký výskyt pozitivity. Navíc byly mezi jednotlivými pracemi značné rozdíly. A v současnosti se na protilátky proti strukturně změněnému MOG (lineárním epitopům), které se poměrně často vyskytují i v běžné populaci, pohlíží jako na neasociováné s onemocněním CNS [23]. Až později se při využití CBA (obr. 4) ukázalo, že protilátky prokazované touto metodou (tedy proti nativnímu MOG) jsou asociovány s některými zánětlivými autoimunitními onemocněními CNS. Jednalo se o pacienty s akutní diseminovanou encefalomyelitidou (ADEM), s NMOSD při negativitě AQP4-IgG, popř. s recidivujícími optickými neuritidami a dalšími syndromy. Jejich průkaz u získaných demyelinizačních onemocnění u dětí predikoval non-RS průběh onemocnění. Zejména v případech, kdy nebyly přítomny ani oligoklonální pásy v likvoru [24]. Zdá se však, že u některých pacientů s klinickým obrazem NMO může být průběh monofázický a pozitivita protilátek je tranzientní. Zde má význam opakované stanovení těchto protilátek. Přetrvávající pozitivita MOG-IgG v séru v odstupu šesti měsíců od ataky predikuje spíše relaps remitentní průběh [23]. Vyšetření MOG-IgG by se mělo provádět i v likvoru. V kohortě pacientů s ADEM nebo AQP4-IgGnegNMOSD byly u sedmi procent pacientů tyto protilátky prokázány pouze v likvoru a nikoliv séru [25]. Důvod, proč by měly být stanovovány titry MOG-IgG i v séru, je v určité relevantnosti pro diagnostický proces. Z multicentrické studie srovnávající jednotlivé CBAs a laboratoře vyplývá, že je velmi dobrá shoda výsledků u sér s vysokým titrem protilátek nebo jasně negativními vzorky. U vzorků hraničních tomu tak není [26]. Bylo prokázáno, že protilátky MOG-IgG mohou aktivovat komplementovou kaskádu [27]. Průkaz MOG-IgG má prokazatelný prognostický význam.
Obr. 4. Cell-based assay, kde jsou HEK293 buňky transfekovány plazmidem kódujícím MOG.
Fig. 4. Cell-based assay for MOG-IgG.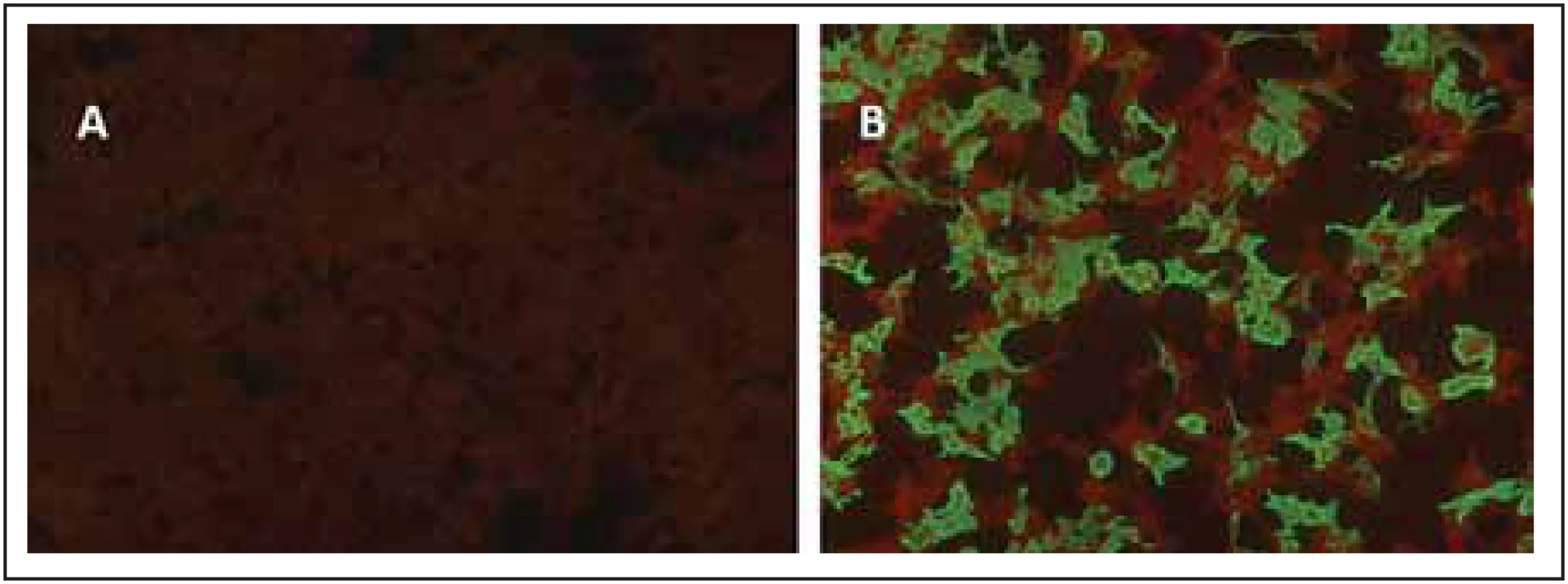
Na obrázku A je inkubace se sérem zdravého jedince a sekundární protilátkou (antihIgG konjugované s FITC) negativní nález. Na obrázku B lze vidět pozitivní nález MOG-IgG opět s využitím metody nepřímé imunofl uorescence (anti-hIgG konjugované s FITC) s dobarvením Evansovou modří. anti-hIgG – protilátky proti lidskému imunoglobulinu; FITC – fl uorescein; MOG – myelinový oligodendrocytární glykoprotein
MOG transfected HEK293 cells were incubated with serum of a healthy control (A – negative staining) or with patient’s serum (B – positive staining) and with FITC-conjugated anti-hIgG (green colour) and Evans blue at the second step. anti-hIgG – anti-human immunoglobulin G antibody; FITC – fl uorescein; MOG – myelin oligodendrocyte glycoproteinOdchylky v rámci běžných laboratorních parametrů
V rámci relapsů se můžeme u pacientů s AQP4-IgGpozNMOSD setkat s elevací kreatin kinázy, poklesem koncentrací C3 nebo C4 složky komplementu.
Také se poměrně často setkáváme s přítomností dalších autoprotilátek nebo jiného autoimunitního onemocnění, které často o několik let předchází vlastní neurologické onemocnění. Typická je koincidence s autoimunitní tyreoiditidou, systémovým lupus erythematodes, Sjögrenovým syndromem, idiopatickými střevními záněty, celiakií atd. Z toho vyplývá i možné spektrum autoprotilátek: proti tyreoproxidáze, transglutamináze, acetylcholinovému receptoru, dvouřetězcové (ds) DNA, strukturám buněčných jader (antinukleární protilátky), fosfolipidům (antifosfolipidové protilátky) atd. [17,28].
Vyšetření mozkomíšního moku u NMOSD
Vyšetření mozkomíšního moku není explicitně vyžadováno v rámci diagnostických kritérií pro NMOSD z roku 2015, nicméně je velmi důležité v rámci diferenciální diagnostiky. Indikujeme jej nejčastěji v okamžiku ataky prvních neurologických obtíží. Méně často pak v situaci, kdy pacient přichází v období remise s nejasnou diagnózou k dalšímu vyšetření a zvažujeme diferenciálně diagnosticky např. RS. Další indikací je vyšetření likvoru při podezření na neuroinfekci u pacienta s již známou diagnózou NMOSD a novou netypickou neurologickou symptomatikou. Tyto rozdílné situace pak odrážejí i odlišný likvorový nález (tab. 1).
Tab. 1. Typické nálezy v mozkomíšního moku u pacientů s neuromyelitis optica a onemocněním jejího širšího spektra [17,29]. ![Typické nálezy v mozkomíšního moku u pacientů s neuromyelitis optica
a onemocněním jejího širšího spektra [17,29].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/b0c5772a8b962ddf4077e91417288d13.png)
Typickým nálezem v mozkomíšním moku v okamžiku relapsu NMOSD je syndrom cytoproteinové asociace. To platí zejména pro středně těžké nebo těžké ataky. Vyšší koncentrace celkové bílkoviny a albuminu jakožto marker poškození hematoencefalické bariéry je typickým nálezem v atace myelitid. Počet buněk v likvoru během atak je zvýšený, medián 19 bb/1 µl (6–380 bb / 1 µl) [17,29]. Vzácněji vídáme i normální počet buněk (především u čistě senzitivních atak). Nálezy také nejsou tak výrazné u izolovaných optických neuritid.
Ještě před objevem AQP4-IgG byl cytologický nález součástí Wingerchukových kritérií pro NMO z roku 1999, kde mezi hlavní podpůrná kritéria patřila pleocytóza v likvoru > 50 leukocytů / 1 µl nebo > 5 neutrofilů / 1 µl [30]. Mezi další nálezy podporující diagnózu NMO patří přítomnost eozinofilních, popř. neutrofilních granulocytů v cytologickém nálezu.
Nálezy v mozkomíšním moku v okamžiku dlouhodobé remise bývají často v normě. Typická je absence oligoklonálních pásů, nicméně jejich přítomnost nevylučuje diagnózu NMO. U některých pacientů mohou být OCB pozitivní pouze přechodně [17,29].
Někdy pouze z klinického obrazu, neurologického vyšetření a anamnézy indikujeme vyšetření AQP4-IgG v séru pacienta (např. u transverzálních míšních lézí, těžkých optických neuritíd a dalších syndromů). Jsou však také situace, kdy toto stanovení doplňujeme až na základě nálezů v mozkomíšním moku. Mezi jedny ze zásadních „red flags“ patří absence oligoklonálních pásů u pacientů s podezřením na demyelinizační onemocnění CNS. Dalšími z podpůrných nálezů v akutních fázích nemoci jsou vyšší počty elementů, než vídáme u pacientů s RS, porucha hematoencefalické bariéry a nález granulocytů (neutrofilních nebo eozinofilních).
Prognostické markery a markery aktivity onemocnění.
Interleukin-6 (IL-6) je prozánětlivý cytokin s řadou biologických funkcí, jako jsou např. podpora přežívání plazmablastů a produkce protilátek. Sérová koncentrace IL-6 je vyšší v okamžiku relapsu. Koncentrace IL-6 v séru koreluje s počtem leukocytů a koncentrací gliálního fibrilárního acidického proteinu (GFAP) v likvoru. Koncentrace IL-6 je v likvoru signifikantně vyšší u NMO v porovnání s pacienty s RS. Poměr IL-6 v likvoru/séru je u NMO značně vyšší, což nasvědčuje jeho intrathekální produkci [31,32]. Ovlivnění biologické funkce tohoto cytokinu blokací jeho receptoru pomocí satralizumabu se nyní ukázalo jako efektivní ve snížení rizika relapsů u AQP4-IgGpozNMOSD [33].
Vzhledem k primárnímu postižení astrocytů po navázání protilátek na AQP4 dochází k uvolnění GFAP do likvoru/séra, což je markerem poškození astrocytů [31]. Markerem poškození neuronu jsou lehké řetězce neurofilament (NfL), které můžeme díky moderním metodám stanovení (ultrasenzitivní single-molecule array assays; SIMOA) měřit i v séru [34]. Sérové koncentrace NfL korelovaly s tíží neurologického deficitu a vysoké koncentrace byly asociovány se špatným outcomem pacientů, což ukazuje práce Watanabeho et al. Je zde také dobrá korelace mezi koncentracemi obou markerů v séru a likvoru. Sérový kvocient koncentrací GFAP/NfL u pacientů s NMOSD v relapsu byl vyšší než u RS (cut-off value 5,71 se senzitivitou 73 % a specificitou 75,8 %). V období remise u obou onemocnění byly hodnoty obdobné jako u zdravých kontrol [35].
Vzhledem k aktivaci komplementu po navázání protilátek u AQP4-IgGpozNMOSD jsou nadějným biomarkerem aktivity onemocnění i produkty aktivace komplementového systému, např. C3a nebo solubilní C5b-9. Nicméně jejich stanovení je potřeba provést ihned po odběru nebo je nutné vzorek plazmy uložit do –80 °C do doby provedení testu [36].
Závěr
AQP4-IgG a MOG-IgG představují velmi užitečné markery autoimunitních onemocnění CNS. Vždy je však potřeba je indikovat uvážlivě a hodnotit v kontextu s klinickým obrazem a dalšími laboratorními nálezy nebo výsledky zobrazovacích metod.
Grantová podpora
Podpořeno projektem Progres Q27/LF1. Stáž autorky na Nuffield Department of Clinical Neurosciences, University of Oxford, byla podpořena Newsom-Davis Visiting Fellowship.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
MUDr. Petra Nytrová, Ph.D.
Neurologická klinika a Centrum klinických neurověd
1. LF UK a VFN v Praze
Kateřinská 30
128 08 Praha
e-mail: petra.nytrova@lf1.cuni.cz
Zdroje
1. Bauer J, Bien CG. Neuropathology of autoimmune encephalitides. Handb Clin Neurol 2016; 133 : 107–120. doi: 10.1016/B978-0-444-63432-0.00007-4.
2. Molina RD, Conzatti LP, da Silva AP et al. Detection of autoantibodies in central nervous system inflammatory disorders: clinical application of cell-based assays. Mult Scler Relat Disord 2020; 38 : 101858. doi: 10.1016/j.msard.2019.101858.
3. Waters PJ, Pittock SJ, Bennett JL et al. Evaluation of aquaporin-4 antibody assays. Clin Exp Neuroimmunol 2014; 5 (3): 290–303. doi: 10.1111/cen3.12107.
4. Waters P, Pettingill P, Lang B. Detection methods for neural autoantibodies. Handb Clin Neurol 2016; 133 : 147–163. doi: 10.1016/B978-0-444-63432-0.00009-8.
5. Wingerchuk D, Banwell B, Bennett JL et al. International consensu diagnostic criteria for neuromyelitis optica spectrum disorders. Neurology 2015; 85 (2): 177–189. doi: 10.1212/WNL.0000000000001729.
6. Jarius S, Paul F, Aktas O et al. MOG encephalomyelitis: international recommendations on diagnosis and antibody testing. J Neuroinflammation 2018; 15 (1): 134. doi: 10.1186/s12974-018-1144-2.
7. Lennon VA, Wingerchuk DM, Kryzer TJ et al. A serum autoantibody marker of neuromyelitis optica: distinction from multiple sclerosis. Lancet 2004; 364 (9451): 2106–2112. doi: 10.1016/S0140-6736 (04) 17551-X.
8. Waters PJ, McKeon A, Leite MI et al. Serologic diag-nosis of NMO: a multicenter comparison of aquaporin-4-IgG assays. Neurology 2012; 78 (9): 665–669. doi: 10.1212/WNL.0b013e318248dec1.
9. Lennon VA, Kryzer TJ, Pittock SJ et al. IgG marker of optic-spinal multiple sclerosis binds to the aquaporin-4 water channel. J Exp Med 2005; 202 (4): 473–477. doi: 10.1084/jem.20050304.
10. Jung JS, Bhat RV, Preston GM et al. Molecular characterization of an aquaporin cDNA from brain: candidate osmoreceptor and regulator of water balance. Proc Natl Acad Sci U S A 1994; 91 (26): 13052–13056. doi: 10.1073/pnas.91.26.13052.
11. Marnetto F, Hellias B, Granieri L et al. Western blot analysis for the detection of serum antibodies recognizing linear aquaporin-4 epitopes in patients with neuromyelitis optica. J Neuroimmunol 2009; 217 (1–2): 74–79. doi: 10.1016/j.jneuroim.2009.10.002.
12. Waters P, Reindl M, Saiz A et al. Multicentre comparison of a diagnostic assay: aquaporin-4 antibodies in neuromyelitis optica. J Neurol Neurosurg Psychiatry 2016; 87 (9): 1005–1015. doi: 10.1136/jnnp-2015-312601.
13. Jarius S, Franciotta D, Paul F et al. Cerebrospinal fluid antibodies to aquaporin-4 in neuromyelitis optica and related disorders: frequency, origin, and diagnostic relevance. J Neuroinflammation 2010; 7 : 52. doi: 10.1186/1742-2094-7-52.
14. Cohen M, De Sèze J, Marignier R et al. False positivity of anti aquaporin-4 antibodies in natalizumab-treated patients. Mult Scler 2016; 22 (9): 1231–1234. doi: 10.1177/1352458516630823.
15. Stüve O, Bennett JL. Pharmacological properties, toxicology and scientific rationale for the use of natalizumab (Tysabri) in inflammatory diseases. CNS Drug Rev 2007; 13 (1): 79–95. doi: 10.1111/j.1527-3458.2007.00003.x.
16. Takahashi T, Fujihara K, Nakashima I et al. Anti-aquaporin-4 antibody is involved in the pathogenesis of NMO: a study on antibody titre. Brain 2007; 130 (Pt 5): 1235–1243. doi: 10.1093/brain/awm062.
17. Nytrová P, Kleinová P, Preiningerová Lízrová J et al. Neuromyelitis optica a poruchy jejího širšího spektra – retrospektivní analýza klinických a paraklinických nálezů. Cesk Slov Neurol N 2015; 78/111 (1): 72–77. doi: 10.14735/amcsnn201572.
18. Valentino P, Marnetto F, Granieri L et al. Aquaporin-4 antibody titration in NMO patients treated with rituximab: a retrospective study. Neurol Neuroimmunol Neuroinflamm 2016; 4 (2): e317. doi: 10.1212/NXI.000 0000000000317.
19. Quek AM, McKeon A, Lennon VA et al. Effects of age and sex on aquaporin-4 autoimmunity. Arch Neurol 2012; 69 (8): 1039–1043. doi: 10.1001/archneurol.2012.249.
20. Johns TG, Bernard CC. The structure and function of myelin oligodendrocyte glycoprotein. J Neurochem 1999; 72 (1): 1–9. doi: 10.1046/j.1471-4159.1999.0720001.x.
21. Reindl M, Linington C, Brehm U et al. Antibodies against the myelin oligodendrocyte glycoprotein and the myelin basic protein in multiple sclerosis and other neurological diseases: a comparative study. Brain 1999; 122 (Pt 11): 2047–2056. doi: 10.1093/brain/122.11.2047.
22. Berger T, Rubner P, Schautzer F et al. Antimyelin antibodies as a predictor of clinically definite multiple sclerosis after a first demyelinating event. N Engl J Med 2003; 349 (2): 139–145. doi: 10.1056/NEJMoa022328.
23. Reindl M, Waters P. Myelin oligodendrocyte glycoprotein antibodies Nat Rev Neurol 2019; 15 (2): 89–102. in neurological disease. doi: 10.1038/s41582-018-0112-x.
24. Hacohen Y, Absoud M, Deiva K et al. Myelin oligodendrocyte glycoprotein antibodies are associated with a non-MS course in children. Neurol Neuroimmunol Neuroinflamm 2015; 2: e81. doi: 10.1212/NX I.0000000000000081.
25. Mariotto S, Gajofatto A, Batzu L et al. Relevance of antibodies to myelin oligodendrocyte glycoprotein in CSF of seronegative cases. Neurology 2019; 93 (20): e1867–e1872. doi: 10.1212/WNL.0000000000008479.
26. Waters PJ, Komorowski L, Woodhall M et al. A multicenter comparison of MOG-IgG cell-based assays. Neurology 2019; 92 (11): e1250–e1255. doi: 10.1212/WNL.0000 000000007096.
27. Mader S, Gredler V, Schanda K et al. Complement activating antibodies to myelin oligodendrocyte glycoprotein in neuromyelitis optica and related disorders. J Neuroinflammation 2011; 8 : 184. doi: 10.1186/1742-2094-8-184.
28. Pittock SJ, Lennon VA, de Seze J et al. Neuromyelitis optica and non organ-specific autoimmunity. Arch Neurol 2008; 65 (1): 78–83. doi: 10.1001/archneurol.2007.17.
29. Jarius S, Paul F, Franciotta D et al. Cerebrospinal fluid findings in aquaporin-4 antibody positive neuromyelitis optica: results from 211 lumbar punctures. J Neurol Sci 2011; 306 (1–2): 82–90. doi: 10.1016/j.jns.2011.03.038.
30. Wingerchuk DM, Hogancamp WF, O‘Brien PC et al. The clinical course of neuromyelitis optica (Devic‘s syndrome). Neurology 1999; 53 (5): 1107–1114. doi: 10.1212/ wnl.53.5.1107.
31. Uzawa A, Mori M, Arai K et al. Cytokine and chemokine profiles in neuromyelitis optica: significance of interleukin-6. Mult Scler 2010; 16 (12): 1443–1452. doi: 10.1177/1352458510379247.
32.Uzawa A, Mori M, Ito M et al. Markedly increased CSF interleukin-6 levels in neuromyelitis optica, but not in multiple sclerosis. J Neurol 2009; 256 (12): 2082–2084. doi: 10.1007/s00415-009-5274-4.
33. Yamamura T, Kleiter I, Fujihara K et al. Trial of satralizumab in neuromyelitis optica spectrum disorder. N Engl J Med 2019; 381 (22): 2114–2124. doi: 10.1056/NEJMoa1901747.
34. Disanto G, Barro C, Benkert P et al. Serum neurofilament light: a biomarker of neuronal damage in multiple sclerosis. Ann Neurol 2017; 81 (6): 857–870. doi: 10.1002/ana.24954.
35. Watanabe M, Nakamura Y, Michalak Z et al. Serum GFAP and neurofilament light as biomarkers of disease activity and disability in NMOSD. Neurology 2019; 93 (13): e1299–e1311. doi: 10.1212/WNL.0000000000008160.
36. Nytrova P, Potlukova E, Kemlink D et al. Complement activation in patients with neuromyelitis optica. J Neuroimmunol 2014; 274 (1–2): 185–191. doi: 10.1016/j.jneuroim.2014.07.001.
Štítky
Dětská neurologie Neurochirurgie Neurologie
Článek vyšel v časopiseČeská a slovenská neurologie a neurochirurgie
Nejčtenější tento týden
2020 Číslo supplementum 1- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Magnosolv a jeho využití v neurologii
- Zolpidem může mít širší spektrum účinků, než jsme se doposud domnívali, a mnohdy i překvapivé
- Nejčastější nežádoucí účinky venlafaxinu během terapie odeznívají
-
Všechny články tohoto čísla
- Neuromyelitis optica – imunopatogenetické mechanizmy
- Epidemiologie, klinický obraz a průběh onemocnění u neuromyelitis optica a onemocnění jejího širšího spektra
- Nálezy na magnetické rezonanci u neuromyelitis optica a onemocnění jejího širšího spektra
- Editorial
- Laboratorní vyšetření u neuromyelitis optica a onemocnění jejího širšího spektra
- Využití optické koherenční tomografie u neuromyelitis optica a onemocnění jejího širšího spektra
- Evokované potenciály u neuromyelitis optica a spektra ochorení neuromyelitis optica
- Historie neuromyelitis optica a onemocnění jejího širšího spektra, vývoj diagnostických kritérií
- Diferenciální diagnostika neuromyelitis optica a onemocnění jejího širšího spektra
- Terapie relapsů u neuromyelitis optica a onemocnění jejího širšího spektra
- Chronická a symptomatická léčba neuromyelitis optica a onemocnění jejího širšího spektra
- Specifika onemocnění ze širšího spektra neuromyelitis optica u dětí
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Nálezy na magnetické rezonanci u neuromyelitis optica a onemocnění jejího širšího spektra
- Laboratorní vyšetření u neuromyelitis optica a onemocnění jejího širšího spektra
- Epidemiologie, klinický obraz a průběh onemocnění u neuromyelitis optica a onemocnění jejího širšího spektra
- Diferenciální diagnostika neuromyelitis optica a onemocnění jejího širšího spektra
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



