-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Koincidence roztroušené sklerózy a myasthenia gravis
Autoři: P. Hemerková 1; H. Matulová 1; J. Jandura 2
Působiště autorů: Neurologická klinika LF UK a FN Hradec Králové 1; Radiologická klinika LF UK a FN Hradec Králové 2
Vyšlo v časopise: Cesk Slov Neurol N 2020; 83/116(6): 649-651
Kategorie: Dopis redakci
doi: https://doi.org/10.48095/cccsnn2020649Vážená redakce,
prezentujeme případ vzácné koincidence RS a myastenia gravis (MG) u našeho nyní 70letého pacienta.
Roztroušená skleróza je chronické autoimunitní onemocnění mozku a míchy, které má s destrukcí myelinu spojenou nejen složku zánětlivou, ale i neurodegenerativní, přičemž dochází ke ztrátě axonů. Přibližná prevalence nemoci v ČR převyšuje 160/100 000 obyvatel a incidence se pohybuje okolo 11,7/100 000 [1]. Stanovení diagnózy závisí na klinickém obrazu a nálezu na MR mozku. Vyšetření mozkomíšního moku a eventuálně průkaz intrathekální syntézy (ITS) imunoglobulinů IgG má spíše doplňkový charakter a vyloučí diagnózy jiné.
Myastenia gravis je také autoimunitní onemocnění, u kterého dochází k poruše nervosvalového přenosu.
Incidence se v jednotlivých epidemiologických studiích liší. Piťha v roce 2010 odhadoval prevalenci nemoci v ČR na 240/1 000 000 a incidenci na 21/1 000 000 [2].
První příznaky onemocnění se mohou objevit v jakémkoliv věku, ale lze pozorovat dva vrcholy incidence, a to kolem 30. roku, kdy jsou postiženy spíše ženy, a kolem 60. roku, kdy je choroba častěji pozorována u mužů [3]. Dochází zde k produkci autoprotilátek B-lymfocyty proti nikotinovému acetylcholinovému receptoru (anti-AChR), svalově specifické tyrozinkináze (anti-MuSK) či nízkodenzitnímu lipoproteinovému receptoru (anti-Lrp4). Kromě produkce protilátek hraje v imunopatogenezi nemoci roli dysregulace na úrovni T lymfocytů (a to jak pomocných CD4+ T lymfocytů, tak cytotoxických CD8+ T lymfocytů) [4].
Referovaný pacient se narodil v roce 1949 a do svých 56 let vážněji nestonal. V roce 2003 havaroval při sáňkování, došlo k ruptuře pouzdra kolenního kloubu vpravo a poranění nervus peroneus communis s následnou těžkou pravostrannou peroneální parézou. Léky trvale neužíval. Rodinná anamnéza byla neurologicky negativní, až na syna trpícího dětskou mozkovou obrnou. Pracoval jako dělník a žil s nemocným synem v bytě. První příznaky možného neurologického onemocnění se u pacienta objevily v roce 2005, kdy byl neurologem vyšetřen pro vestibulocerebelární symptomatiku. Na naše pracoviště se nemocný dostavil v roce 2006 s vertiginózními potížemi. V neurostatu byl přítomen disociovaný horizontální nystagmus oboustranně v temporálních pohledech, na horních končetinách byla dystaxe, pozitivní Trömnerův jev vlevo, na dolních končetinách byla poúrazová peroneální paréza vpravo a byla přítomna také sfinkterová dysfunkce. Pociťoval zvýšenou únavu, s oporou jedné hole ušel 1 km. Byla vyslovena suspekce na demyelinizační onemocnění. Kritéria na MR pro RS byla splněna (obr. 1). V likvoru byla pozitivní ITS IgG (16 pásů). Byla stanovena diagnóza relaps-remitentní formy RS typu „late onset“. Do medikace byly nasazeny prednison 5 mg, azathioprin 50 mg/d a pacient byl odeslán k přeléčení 5 g metylprednisolonu intravenózně. V roce 2009 nemocný ušel s oporou 50 m, v neurostatu dominovala těžká spastická paraparéza dolních končetin, přidávala se slabost končetin horních. Hodnota Expanded Disability Status Scale byla 6 bodů. Nesplňoval tehdejší kritéria pro podání chorobu modifikujícího léčiva (DMD). Byla zahájena terapie dle Harvardského protokolu (každé 4 týdny 1 g Solumedrolu s následnou aplikací 800 mg cyklofosfamidu, postupně se interval prodlužoval na každých 8 týdnů). Tuto léčbu nemocný dobře toleroval. V roce 2017 byl stav stacionární. Poté však pacient z neznámých důvodů přerušil léčbu a ke kontrole se dostavil až v listopadu 2019 pro celkové zhoršení stavu. Nejvíce si stěžoval na rozmazané vidění a v neurostatu byla navíc přítomná léze nervus oculomotorius vpravo. Pacienta jsme přijali k přešetření v průběhu hospitalizace. Na MR mozku se zobrazily známé ložiskové změny bílé hmoty kompatibilní s RS, avšak nebyla popsána progrese či aktivita onemocnění. Hodnoty glykovaného hemoglobinu a hormonů štítné žlázy byly v normě. Likvorologické vyšetření bylo bez průkazu neuroinfektu. Při vyšetření EMG byla detekována porucha nervosvalového přenosu postsynaptického typu (obr. 2). CT mediastina byla bez průkazu expanze. Byla odebrána hladina protilátek, anti-AChR a anti-MuSK. Zahájili jsme medikaci pyridostigminem (Mestinon 60 mg tbl. p. o. 1–1–1) a pacienta jsme ve zlepšeném stavu propustili domů s plánem ambulantní kontroly. Za 6 dní po dimisi se pacient znovu do naší ambulance. Stěžoval si na rozmazané vidění, celkovou slabost a potíže s polykáním. Při neurologickém vyšetření byla pozorována ptóza pravého a semiptóza levého horního víčka, byl pozitivní Simpsonův i Gorelickův test. Byla již k dispozici hladina protilátek anti-AChR, které byly pozitivní (více než 8 nmol/l). Byla stanovena diagnóza generalizované séropozitivní MG. Do medikace byly přidány distigmin, prednison (v úvodu s postupnou titrací na 60 mg/d) a azathioprin. Při této terapii došlo k výraznému zlepšení. Zprvu byla s pacientem horší spolupráce – štípal doma dříví, věnoval se cyklistice a často se vracel do poradny pro nervosvalová onemocnění s epizodami dekompenzace onemocnění. Později pochopil důležitost režimových opatření a přibližně posledních 10 měsíců, při medikaci prednisonu (10 mg/d), pyridostigminu (60 mg 1–1–1 tbl.) a azathioprinu (25 mg/d), je bez příznaků MG. Stran RS je stav také stabilní. Poslední měsíce ho trápily bolesti zad při kompresivních frakturách obratlů, které vznikly následkem pádů a v terénu osteoporózy při chronické kortikoterapii. Byl dlouho hospitalizován v léčebně dlouhodobě nemocných. Nakonec se mu podařilo zrekonstruovat byt na bezbariérový a pobývá doma.
Obr. 1. Vyšetření MR. (A) Mozek, T2 FLAIR sekvence, sagitální obraz – vícečetná hyperintenzní ložiska v periventrikulární bílé hmotě mozku uložená při postranní komoře – obraz „Dawsonových prstů“ (typický obraz distribuce demyelinizačních ložisek při RS). (B) Krční páteř, T2 STIR sekvence, sagitální obraz – hyperintenzní ložiskové postižení míchy v úrovni obratlů C3–4 a v úrovni meziobratlového prostoru Th1–2 – ložiska odpovídají demyelinizačnímu postižení při RS. (C) Mozek, T2 FLAIR sekvence, axiální obraz – hyperintenzní ložiskové postižení bílé hmoty mozku; jedno malé ložisko je v juxtakortikální lokalizaci frontálně vpravo, několik dalších ložisek je bilaterálně periventrikulárně a jedno ložisko je v paraventrikulární bílé hmotě mozku frontálně vlevo.
Fig. 1. MRI examination. (A) Brain, T2 FLAIR sequence, sagittal scan – multiple hyperintensive lesions in the periventricular white matter of the brain beside the lateral ventricle – „Dawson fi ngers“ (a typical picture of the distribution of demyelinating lesions in MS). (B) Cervical spine, T2 STIR sequence, sagittal scan – focal spinal cord hyperintensive lesions at the level of vertebrae C3–4 and at the level of the intervertebral space Th1–2 – lesions correspond to demyelinating involvement in MS. (C) Brain, T2 FLAIR sequence, axial scan – hyperintensive focal lesions of the white matter of the brain; one small lesion is frontally on the right in the juxtacortical localization, several other lesions are bilaterally periventricular, and one lesion is frontally on the left in the paraventricular white matter of the brain.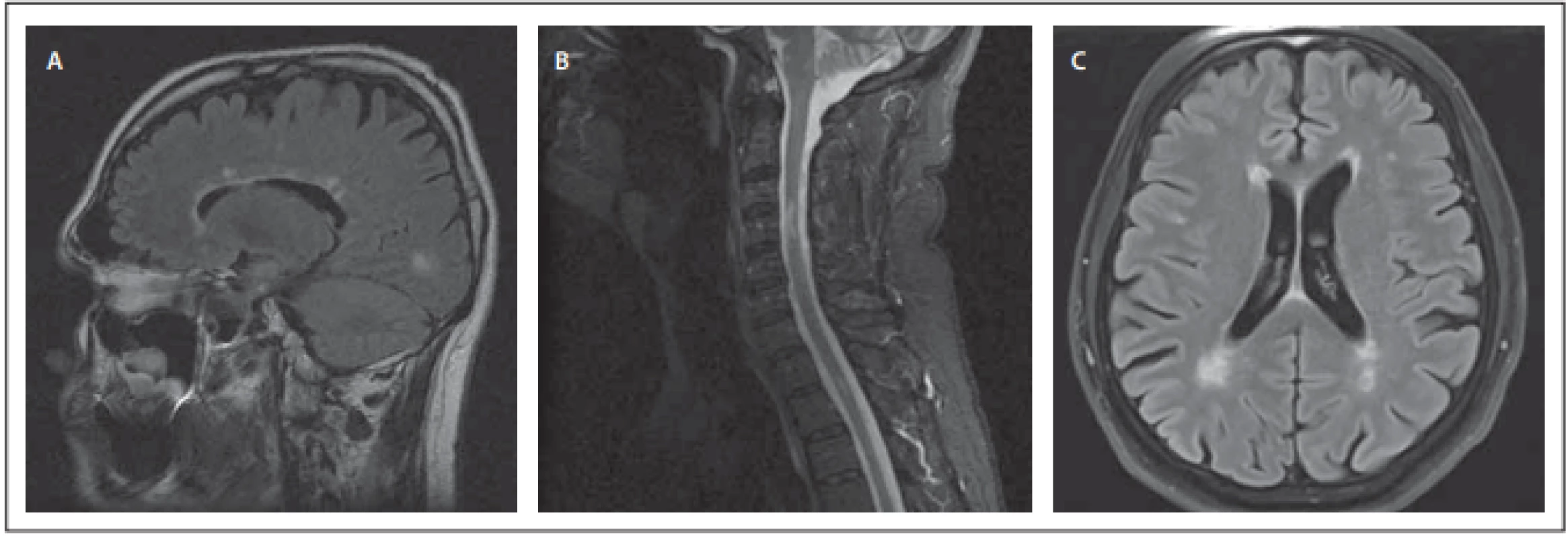
FLAIR – fl uid attenuated inversion recovery; STIR – short tau inversion recovery
FLAIR – fl uid attenuated inversion recovery; STIR – short tau inversion recoveryObr. 2. Vyšetření EMG. Při repetitivní stimulaci (3 Hz) 37 % dekrement amplitudy sumačního svalového akčního potenciálu z musculus nasalis svědčící pro poruchu transmise na nervosvalové ploténce postsynaptického typu a tedy podporující diagnózu myastenia gravis.
Fig. 2. EMG examination. At repetitive stimulation (3 Hz), 37% decrement of the amplitude of the cumulative muscle action potential from the nasalis muscle, indicating a transmission disorder on the postsynaptic neuromuscular disc and thus supporting the diagnosis of myasthenia gravis.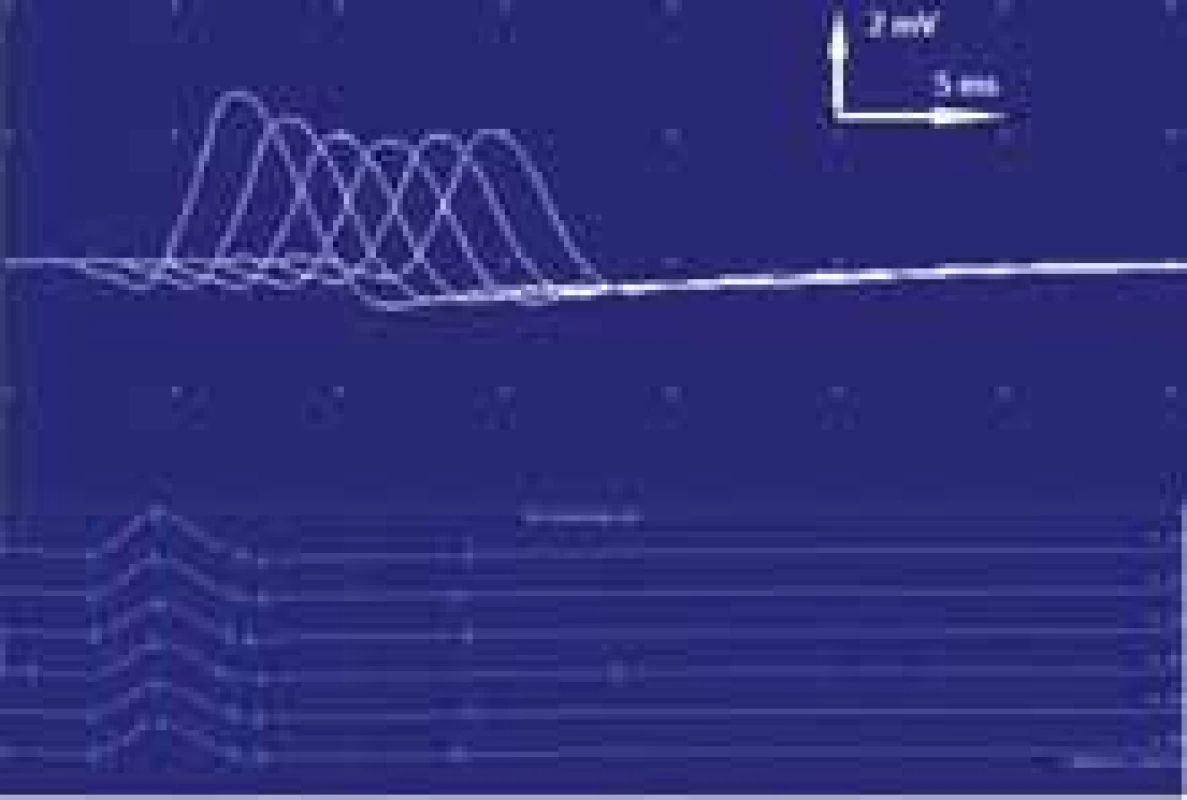
Koincidence RS a MG je vzácná, nicméně vyskytuje se častěji, než pokud by se jednalo pouze o náhodnou asociaci. Základním společným rysem je autoimunitní pato geneze obou onemocnění. Z toho vyplývají i obdobné etiopatogenetické mechanizmy. Mezi predispozice obou onemocnění patří faktory genetické i hormonální či nedostatek vitamínu D. Možným spouštěčem pak může být např. infekce či chronický stres interagující s imunitním systémem. MG se může objevit před nebo až po onemocnění RS. Američtí autoři Dehbashi et al v roce 2019 zpracovali rešerši, ve které v literatuře publikované od roku 1980 nalezli 29 kazuistik popisujících koincidenci těchto dvou onemocnění. Ve 26 případech se jednalo o ženy mající mírný průběh obou onemocnění, jaký je pozorován i u našeho nemocného. U třech pacientů došlo k rozvoji MG po léčbě RS interferonem beta, u jednoho nemocného po léčbě glatirameracetátem a alemtuzumabem. Není jisté, zda tyto léky zafungovaly přímo jako spouštěče onemocnění anebo byly u predisponovaných nemocných jen jakýmsi trigger faktorem [5]. Autoři Danikowski et al přikládají zásadní vliv v patogenezi autoimunitních nemocí dysfunkci tzv. Treg lymfocytů, které normálně tlumí funkci CD4+T lymfocytů schopných autoimunitních reakcí, detaily ale přesahují rámec tohoto sdělení [6].
Chtěli jsme upozornit na možnost opomíjené diagnostiky koincidence těchto dvou jednotek při překrytí zvláště bulbární symptomatiky a okulárních příznaků u obou onemocnění.
Mějme tento možný souběh na paměti a neváhejme doplnit příslušná pomocná vyšetření u nemocných s atypickým průběhem MG či RS.
Grantová podpora
Podpořeno MZ ČR – RVO (FNHK, 00179906) a UK (PROGRES Q40). Financováno z projektu IT4Neuro (degeneration), reg. č. CZ.02.1.01/0.0/0.0/18_069/0010054.
MUDr. Pavlína Hemerková
Neurologická klinika LF UK a FN Hradec Králové
Sokolská 581
500 05 Hradec Králové
e-mail: pavlinahemerkova@seznam.cz
Přijato k recenzi: 23. 4. 2020
Přijato do tisku: 25. 11. 2020
Zdroje
1. Vachová M. Současná epidemiologická data roztroušené sklerózy v ČR. Cesk Slov Neurol N 2010; 73/106 (Suppl 2): S124.
2. Piťha J. Klinický obraz myasthenia gravis. In: Piťha J (ed). Myasthenia gravis a ostatní poruchy nervosvalového přenosu. Praha: Maxdorf 2010 : 96–114.
3. Špalek P. Myasténia gravis. Cesk Slov Neurol 2008; 71/104 (1): 7–24.
4. Jakubíková M., Piťha J. Současný pohled na imunopatogenezi myasthenia gravis. Cesk Slov Neurol N 2015; 78/111 (6): 649–654.
5. Dehbashi S, Hamouda D, Shanina E. Co-occurrence of multiple sclerosis and myasthenia gravis: a case report and review of immunological theories. Mult Scler Relat Disord 2019; 34 : 135–136. doi: 10.1016/j.msard.2019.06.027.
6. Danikowski KM, Jayaraman S, Prabhakar BS. RegulatoryT cells in multiple sclerosis and myasthenia gravis. J Neuroinflammation 2017; 14 (1): 117. doi: 10.1186/s12974-017-0892-8.
Štítky
Dětská neurologie Neurochirurgie Neurologie
Článek Supraskapulární neuropatie
Článek vyšel v časopiseČeská a slovenská neurologie a neurochirurgie
Nejčtenější tento týden
2020 Číslo 6- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Zolpidem může mít širší spektrum účinků, než jsme se doposud domnívali, a mnohdy i překvapivé
- Nejčastější nežádoucí účinky venlafaxinu během terapie odeznívají
-
Všechny články tohoto čísla
- Progresivní supranukleární obrna
- Mezinárodní klasifikace orofaciální bolesti (ICOP) – oficiální český překlad prvního vydání
- Supraskapulární neuropatie
- Endoskopické vs. skríninkové vyšetření polykání a jejich vliv na výsledný stav u pacientů po akutní cévní mozkové příhodě
- Hemodynamické změny ve čtyřech aneurysmatech vedoucí k jejich ruptuře v průběhu sledování
- Srovnání měření průtokových parametrů v oblastikarotické stenózy in vivo a in vitro – pilotní výsledky testování hemodynamického fantomu
- Klinická charakteristika nově diagnostikovaných pacientů s Parkinsonovou nemocí zařazených do longitudinální studie BIO-PD
- Encefalopatie při infekci COVID-19 s odezvou na léčbu intravenózními imunoglobuliny
- Nemocný s pomalu progredující symptomatikou cervikokraniálního přechodu
- Syndrom neadekvátní sekrece antidiuretického hormonu jako první příznak estezioneuroblastomu
- Koincidence roztroušené sklerózy a myasthenia gravis
- Časná revaskularizace po kombinovaném výkonu u nemoci moyamoya
- Endoskopická laváž intraventrikulárního krvácení nezralých novorozenců
- Stanovisko České neurologické společnosti ČLS JEP k organizaci péče o pacienty s akutní bolestí zad v bederní úrovni u dospělých
- Doporučené postupy pro nutriční podporu u cévních mozkových příhod
- Odešel doc. MUDr. Roman Schröder, CSc.
- Zemřel doc. MUDr. Edgar Lukáš, DrSc. (1932–2020)
- MUDr. Michal Králik, CSc. Spomienka na vzácneho človeka.
- Prof. MUDr. Ľubomír Lisý, DrSc.
- Rozloučení s prof. MUDr. Valentinou Stýblovou, DrSc. (1922–2020)
- MUDr. Hanuš Baš, CSc., devadesátiletý
- Prof. MUDr. Peter Kukumberg, PhD. – 75-ročný
- Léčba aktivní sekundárně progresivní roztroušené sklerózy selektivním modulátorem receptoru pro sfingosin-1-fosfát
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Progresivní supranukleární obrna
- Supraskapulární neuropatie
- Endoskopické vs. skríninkové vyšetření polykání a jejich vliv na výsledný stav u pacientů po akutní cévní mozkové příhodě
- Encefalopatie při infekci COVID-19 s odezvou na léčbu intravenózními imunoglobuliny
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



