-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Časná revaskularizace po kombinovaném výkonu u nemoci moyamoya
Autoři: V. Přibáň 1; J. Dostál 1
; J. Mraček 1; J. Baxa 2; P. Duras 2
Působiště autorů: Neurochirurgická klinika LF UK a FN Plzeň 1; Klinika zobrazovacích metod LF UK a FN Plzeň 2
Vyšlo v časopise: Cesk Slov Neurol N 2020; 83/116(6): 652-654
Kategorie: Dopis redakci
doi: https://doi.org/10.48095/cccsnn2020652Vážená redakce,
nemoc moyamoya (moyamoya disease; MMD) je chronické progresivní stenookluzivní onemocnění terminálních úseků vnitřních karotid (a. carotis interna; ACI) a iniciálních úseků předních (a. cerebri anterior; ACA) a středních mozkových tepen (a. cerebri media; ACM) doprovázené tvorbou kolaterál na bazi mozku. Vzhled těchto kolaterál dal nemoci název. Na DSA připomínají „prchavý obláček kouře“ – japonsky moyamoya [1]. Další kolaterály mohou být leptomeningeální a dále transdurální ze zevního karotického povodí (rete mirabile, vault moyamoya). První zmínky o MMD pocházejí z Japonska z konce 50. let 20. století a dlouho byla nemoc považována za endemickou. Koncem 60. let byly publikovány první případy u neasijské populace. V českých textech popsali onemocnění již v roce 1970 Urbánek et al [2]. Pokroky a dostupnost moderní diagnostiky navýšily původně raritní počty případů. Aktuální incidence a prevalence v Japonsku jsou 0,94/100 000, respektive 10,4/100 000. Četnost onemocnění v západní populaci je výrazně nižší [3]. Etiologie a mechanizmy patogeneze jsou dosud nejasné. Od počátku byli zastánci kongenitální teorie vzniku a na druhé straně zastánci získaného původu. Ti se domnívali, že příčinou je zánět v oblasti krku s následnou tvorbou humorálních protilátek, které atakují krční sympatikus. Výsledkem jsou vazospazmy s následným postižením cévní stěny (excentrická hyperplazie intimy, ztenčení tuniky medie a nařasení lamina elastika interna) a rozvojem stenookluzivního postižení. Pro kongenitální původ svědčí objev genu RNF213 na chromozomu 17q25-ter. Polymorfizmus c.14576G>A byl popsán u 95 % pacientů s familiární formou nemoci a u 79 % pacientů se sporadickým onemocněním. Argumentem pro získaný původ by mohl být vliv autoprotilátek proti štítné žláze při hypertyreóze při rozvoji nemoci moyamoya [1,4]. Formálně se rozlišuje onemocnění moyamoya, které je charakterizováno postižením obou hemisfér a nepřítomností dalšího onemocnění. Syndrom moyamoya je charakterizován jednostranným nebo oboustranným postižením a přítomností přidružené choroby (ateroskleróza, m. Recklinghausen, Downův syndrom, poradiační stav).
Věkové rozvrstvení má bimodální charakteristiku s vrcholy kolem 10. a 40. roku. Pro dětský věk je typická ischemická forma s projevy CMP, tranzitorní ischemické ataky (TIA), křečí, bolestí hlavy. V dospělosti je nejčastějším projevem krvácení.
Suzuki rozdělil onemocnění na základě DSA do šesti stadií. První tři stadia reprezentují rozvoj bazálních kolaterál coby kompenzaci uzávěru terminálních ACI. Ve 4.–5. stupni postupně bazální kolaterály mizí a jejich roli přebírají transdurální kolaterály. V posledním stadiu je patrná kompletní absence v obou ACI a prokrvení je zajištěno pouze ze zevních karotid a vertebrálního řečiště [5]. Jednotlivá stadia nejsou vyjádřením tíže klinického průběhu. Ve snaze predikovat rizika navrhla berlínská skupina nové rozdělení na základě kombinace DSA, nálezu na MR a přítomnosti nebo vyčerpání cerebrovaskulární reaktivity (cerebrovascular reserve capacity; CVRC) na perfuzi CT do stupňů: I. lehký; II. střední a III. těžký. Predikce systému je přesvědčivá: symptomatické projevy byly přítomny u stupně I v 21 %, u stupně II v 63 % a u stupně III v 94 % [6]. Konzervativní léčba MMD je v zásadě neefektivní.
Chirurgickou léčbu je možné rozdělit na direktní, indirektní a kombinovanou revaskularizaci.
Direktní revaskularizaci představuje extra-intrakraniální nízkoprůtokový bypass mezi větví a. temporalis superficialis a korovou větví ACM. Jeho výhodami jsou rychlý vzestup mozkového krevního průtoku a časná regrese bazálních kolaterál. Tím je významně sníženo riziko následného krvácení u MMD, jak bylo prokázáno v multicentrické randomizované studii [7,8]. Nevýhodou bypassu je technická náročnost a obtížná proveditelnost u dětských pacientů. Indirektní revaskularizace využívá bohatě vaskularizovanou tkáň (temporální sval, dura mater s a. meningea media, periost), která je přiložena na mozkový kortex. Následně dochází k novotvorbě kapilár a jejich vrůstu do mozku. To je principiálně možné proto, že (na rozdíl od aterosklerózy) jsou u pacientů s MMD v krvi přítomné cévní růstové faktory (vaskulární endoteliální růstový faktor, matrix metaloproteináza-9, interleukin 1b). Nevýhodou nepřímé techniky je delší časový interval do efektivní revaskularizace. Kombinovaný výkon zahrnuje využití techniky přímé a nepřímé revaskularizace [9].
Dvacetičtyřletá pacientka, jejíž potíže začaly před 5 lety v podobě brnění a lehké slabosti pravostranných končetin, byla nejprve léčena pro suspektní neuroboreliózu; ta byla posléze vyloučena. Potíže odezněly, aby po 4 měsících propukly znovu. Subjektivně pacientka udávala parestezie pravostranných končetin, objektivně byly přítomny kvadruspasticita a lehká pravostranná hemiparéza. Vyšetření MR prokázalo subakutní až chronické mikrovaskulární postižení. Vyšetření likvoru, imunologické a kardiologické vyšetření byly bez patologie. DSA prokázala vícečetné stenózy ACA a ACM oboustranně s významnou kolateralizací cestou perforátorů. Nález byl uzavřen jako vaskulitis s obrazem ne zcela typickým pro chorobu moyamoya. Následně byla vyloučena infekční (HIV, syfilis, hepatitis B a C) a genetická (cerebral autosomal dominant arteriopathy with subcortical infarcts and leukoencephalopathy [CADASIL]) etiologie vaskulitidy. Pracovní závěr zněl izolovaná CNS vaskulitida, negativní antineutrofilní cytoplazmatické protilátky. V terapii byly dlouhodobě podávány kortikoidy, imuran a cyklofosfamid v 6 cyklech. Navzdory této léčbě na kontrolních MR přibývaly kontinuálně mikrovaskulární léze subkortikálně oboustranně. Na DSA se prokázaly okluze původně stenotických ACM oboustranně s nárůstem bazálních kolaterál (obr. 1). Původně průměrné kognitivní funkce se objektivně zhoršily. Negativní efekt dlouhodobého podávání kortikoidů se projevil v podobě obezity, strií, hirsutizmu. Pacientka se stala depresivní. Nakonec došlo k rozvoji tranzitorní symptomatologie z pravostranného karotického povodí na podkladě infarktu zobrazeného na MR. Nález byl přehodnocen na MMD stadium Suzuki III. Podle berlínské škály byly hemisféry hodnoceny separátně. Levá hemisféra – střední stupeň rizika, pravá hemisféra – vysoký stupeň rizika ischemie vzhledem k vyčerpané CVRC.
Obr. 1. (a) DSA s uzávěrem arteria cerebri media (šipka) a bazálními kolaterálami moyamoya (značka). (b) Pooperační DSA s příznivou revaskularizací (šipka), bazální kolaterály moyamoya jsou stále přítomny (značka).
Fig. 1. (a) DSA with occlusion of the middle cerebral artery (arrow) and basal moyamoya collaterals (mark). (b) Postoperative DSA with suffi cient revascularization (arrow), basal moyamoya collaterals are still present (mark).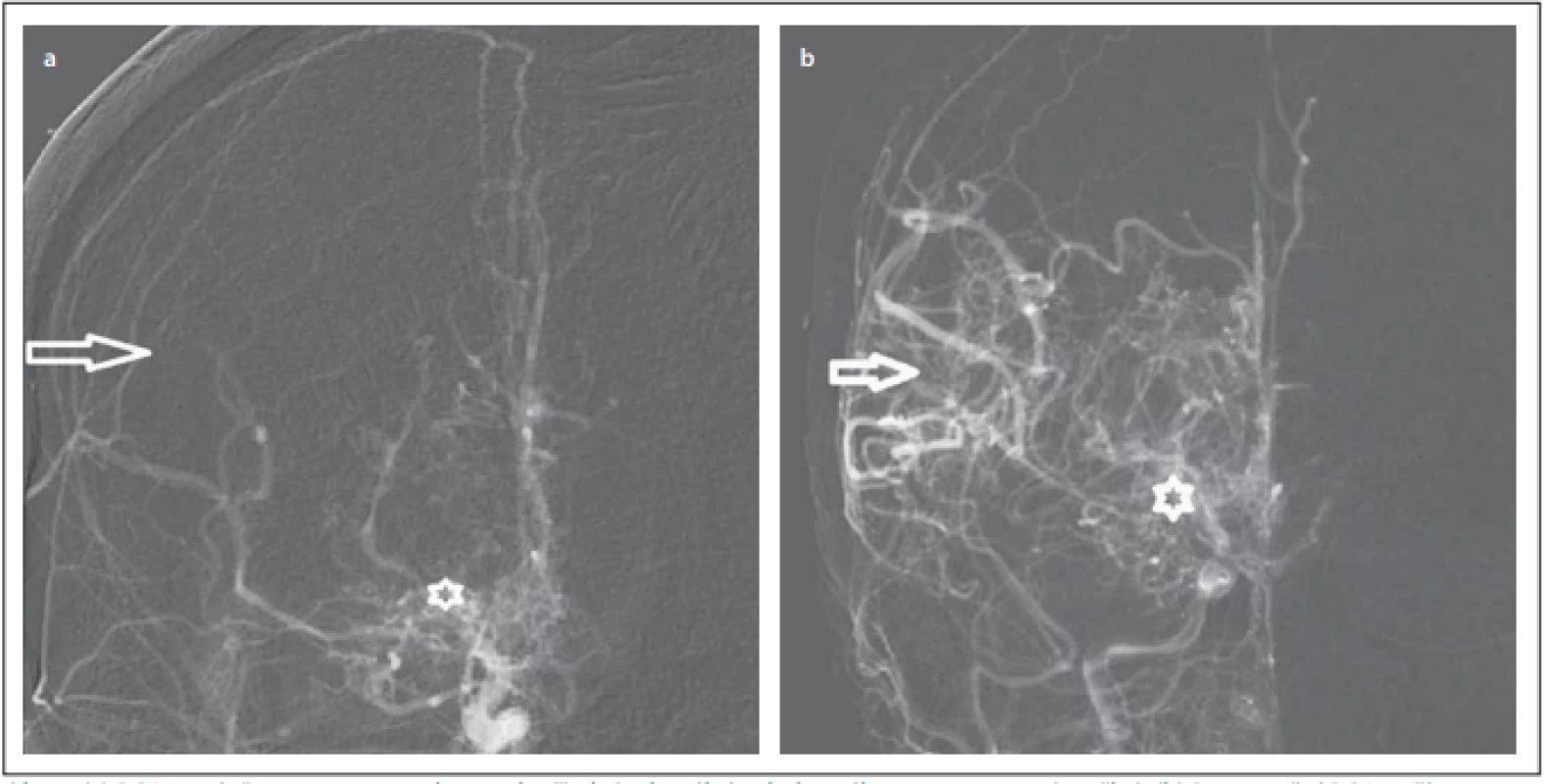
Vyšší stupeň rizika vedl k iniciální kombinované revaskularizaci pravé hemisféry. Po otevření pleny byla odstraněna arachnoidea v oblasti sulků a okolí. Standardní technikou jednotlivých stehů byl našit bypass mezi parietální větví a. temporalis superficialis a korovou větví ACM temporálně. Finálně byl temporální sval našit k okrajům dury a volně přiložen na obnažený kortex. Pooperační průběh byl bez pozoruhodností. V odstupu dvou měsíců byla provedena grafická kontrola s přesvědčivým nálezem časné revaskularizace. Skóre revaskularizace bylo hodnoceno dle Matshushimy jako excelentní [9].
Kontrolní perfuzní CT po zátěži dosahovala 46 ml, přičemž před operací to bylo pouze 19 ml/100 ml/min (obr. 2).
Obr. 2. Perfuzní CT se zátěží Diamoxem před revaskularizací 19/100 ml/min (a) a po revaskularizaci 46/100 ml/min (b) v teritoriu a. cerebri media vpravo.
Fig. 2. CT perfusion with Diamox challenge before revascularization 19 ml/100 ml/min (a) and after revascularization 46 ml/100 ml/min (b) in the right middle cerebral artery territory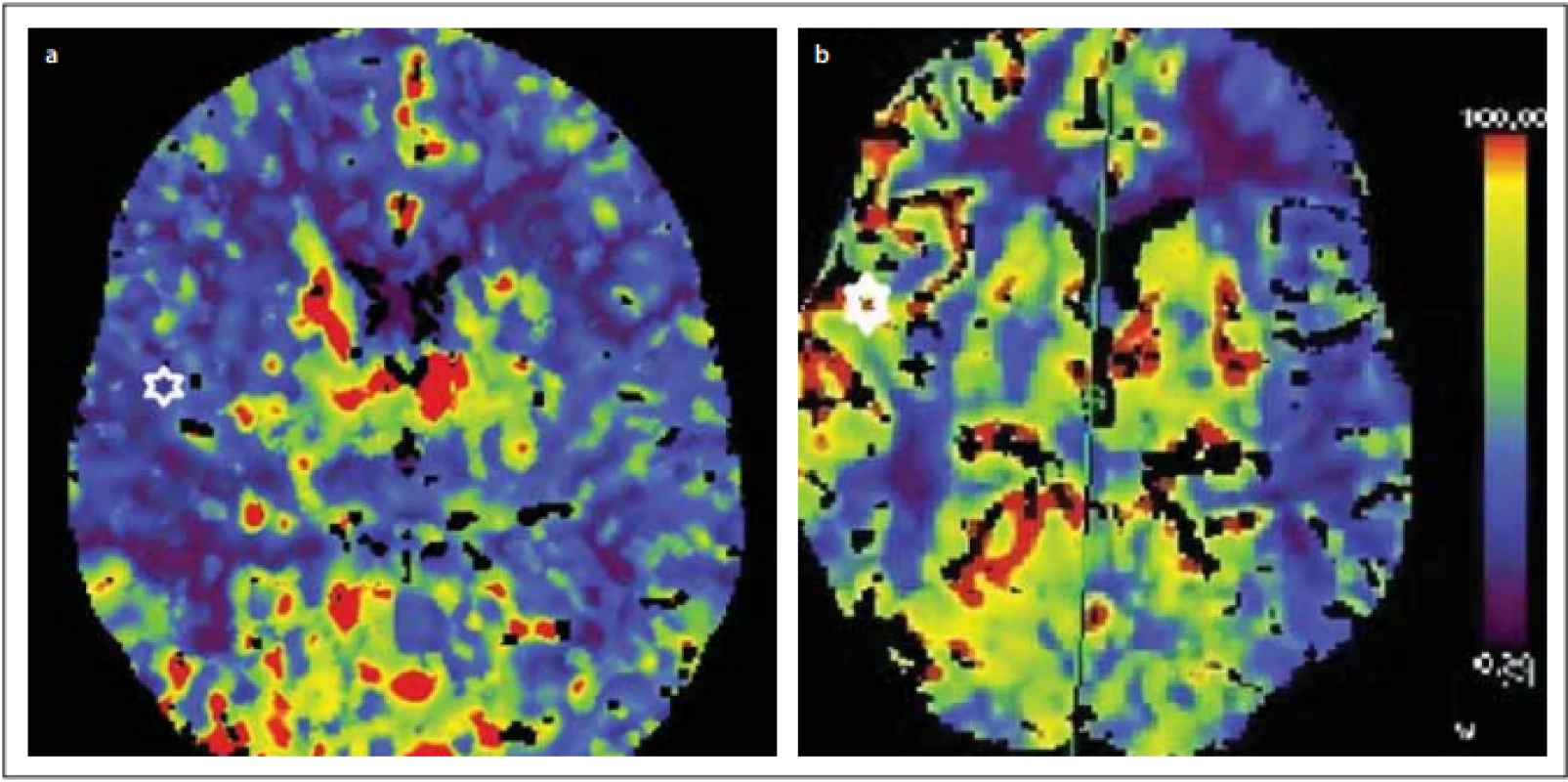
Obr. 3. (a) Low-flow end-to-side bypass parietální větve a. temporalis spf. na temporální větev M4 vpravo. Technika jednotlivých stehů; (b) funkční bypass; (c) odstranění arachnoidey nad kortikálními tepnami před našitím temporálního svalu.
Fig. 3. (a) Low-flow end-to-side bypass STA(p)-M4(t). Interrupted suture technique; (b) functioning bypass; (c) arachnoidea cut over cortical arteries before temporalis muscle placement.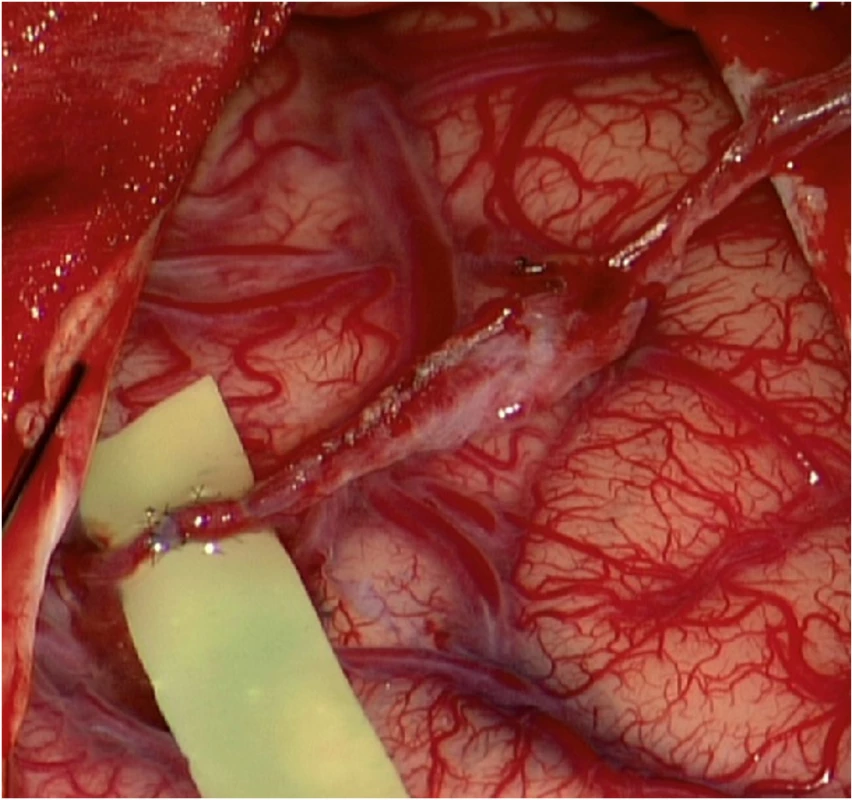
Česká literatura je na téma MMD chudá, zahrnuje čtyři deskriptivní kazuistiky a jednu práci se souborem 9 pacientů. Pouze v práci Häckela a Beneše ml. je zmíněna terapie, která zahrnovala čtyři indirektní revaskularizace a jeden kombinovaný výkon (bypass a encefalomyosynangiózu). Hodnocení výsledků bylo klinické, grafické pooperační kontroly prezentovány nebyly [10]. Časnost a efektivita kombinované revaskularizace u naší pacientky pro nás byla překvapením. To bylo spolu s dokumentováním současných diagnostických a indikačních postupů u MMD důvodem pro naše sdělení.
Sledování pacientky v delším časovém intervalu s kontrolou efektu výkonu na prevenci CMP a výsledný kognitivní stav bude naším dlouhodobým cílem.
Grantová podpora
Práce byla podpořena MZ ČR – RVO (Fakultní nemocnice Plzeň – FNPl, 00669806)
doc. MUDr. Vladimír Přibáň, Ph.D.
Neurochirurgická klinika LF UK a FN Plzeň
alej Svobody 80
301 00 Plzeň
e-mail pribanv@fnplzen.cz
Přijato k recenzi: 8. 9. 2020
Přijato do tisku: 3. 12. 2020
Zdroje
1. Suzuki J, Takaku A. Cerebrovascular „Moyamoya“ disease. Disease showing abnormal net-like vessels in base of brain. Arch Neurol 1969; 20 (3): 288–299. doi: 10.1001/archneur.1969.00480090076012.
2. Urbánek K, Fárková H, Klaus E. Nishimoto-Takeuchi-Kudo disease: case report. J Neurol Neurosurg Psychiatry 1970; 33 (5): 671–673. doi: 10.1136/jnnp.33.5.671.
3. Baba T, Houkin K, Kuroda S. Novel epidemiological features of Moyamoya disease. J Neurolo Neurosurg Psychiatry 2008; 79 (8): 900–904. doi: 10.1136/jnnp.2007.130666.
4. Fujimura M, Tomigata T. Diagnosis of Moyamoya disease: international standard and regional differences. Neurol Med Chir (Tokyo) 2015; 55 (3): 189–193. doi: 10.2176/nmc.ra.2014-0307.
5. Suzuki J. Cerebral angiography. In: Suzuki J. Moyamoya disease. Berlin, Heidelberg: Springer 1986 : 17–52.
6. Czabanka M, Peňa-Tapia P, Schubert GA et al. Proposal for a new grading of moyamoya disease in adult patients. Cerebrovasc Dis 2011; 32 (1): 41–50. doi: 10.1159/000326077.
7. Miyamoto S, Yoshimoto T, Hashimoto N et al. Effects of extracranial-intracranial bypass for patients with hemorrhagic moyamoya disease: results of the Japan Adult Moyamoya Trial. Stroke 2014; 45 (5): 1415–1421. doi: 10.11 61/STROKEAHA.113.004386.
8. Acker G, Fekonja L, Vajkoczy P. Surgical management of moyamoya disease. Stroke 2018; 49 (2): 476–482. doi: 10.1161/STROKEAHA.117.018563.
9. Matsushima Y, Inaba Y. Moymoya disease in children and its surgical treatment. Introduction of a new surgical procedure and its follow-up angiograms. Childs Brain 1984; 11 (3): 155–170. doi: 10.1159/000120172.
10. Häckel M, Beneš V ml. Onemocnění moyamoya. Přehled a soubor 9 nemocných. Cesk Slov Neurol N 1997; 3 : 142–151.
Štítky
Dětská neurologie Neurochirurgie Neurologie
Článek Supraskapulární neuropatie
Článek vyšel v časopiseČeská a slovenská neurologie a neurochirurgie
Nejčtenější tento týden
2020 Číslo 6- Magnosolv a jeho využití v neurologii
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Zolpidem může mít širší spektrum účinků, než jsme se doposud domnívali, a mnohdy i překvapivé
- Nejčastější nežádoucí účinky venlafaxinu během terapie odeznívají
-
Všechny články tohoto čísla
- Progresivní supranukleární obrna
- Mezinárodní klasifikace orofaciální bolesti (ICOP) – oficiální český překlad prvního vydání
- Supraskapulární neuropatie
- Endoskopické vs. skríninkové vyšetření polykání a jejich vliv na výsledný stav u pacientů po akutní cévní mozkové příhodě
- Hemodynamické změny ve čtyřech aneurysmatech vedoucí k jejich ruptuře v průběhu sledování
- Srovnání měření průtokových parametrů v oblastikarotické stenózy in vivo a in vitro – pilotní výsledky testování hemodynamického fantomu
- Klinická charakteristika nově diagnostikovaných pacientů s Parkinsonovou nemocí zařazených do longitudinální studie BIO-PD
- Encefalopatie při infekci COVID-19 s odezvou na léčbu intravenózními imunoglobuliny
- Nemocný s pomalu progredující symptomatikou cervikokraniálního přechodu
- Syndrom neadekvátní sekrece antidiuretického hormonu jako první příznak estezioneuroblastomu
- Koincidence roztroušené sklerózy a myasthenia gravis
- Časná revaskularizace po kombinovaném výkonu u nemoci moyamoya
- Endoskopická laváž intraventrikulárního krvácení nezralých novorozenců
- Stanovisko České neurologické společnosti ČLS JEP k organizaci péče o pacienty s akutní bolestí zad v bederní úrovni u dospělých
- Doporučené postupy pro nutriční podporu u cévních mozkových příhod
- Odešel doc. MUDr. Roman Schröder, CSc.
- Zemřel doc. MUDr. Edgar Lukáš, DrSc. (1932–2020)
- MUDr. Michal Králik, CSc. Spomienka na vzácneho človeka.
- Prof. MUDr. Ľubomír Lisý, DrSc.
- Rozloučení s prof. MUDr. Valentinou Stýblovou, DrSc. (1922–2020)
- MUDr. Hanuš Baš, CSc., devadesátiletý
- Prof. MUDr. Peter Kukumberg, PhD. – 75-ročný
- Léčba aktivní sekundárně progresivní roztroušené sklerózy selektivním modulátorem receptoru pro sfingosin-1-fosfát
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Progresivní supranukleární obrna
- Supraskapulární neuropatie
- Endoskopické vs. skríninkové vyšetření polykání a jejich vliv na výsledný stav u pacientů po akutní cévní mozkové příhodě
- Encefalopatie při infekci COVID-19 s odezvou na léčbu intravenózními imunoglobuliny
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání




