-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaEndoskopické vs. skríninkové vyšetření polykání a jejich vliv na výsledný stav u pacientů po akutní cévní mozkové příhodě
Flexible endoscopic evaluation of swallowing vs. screening tests for dysphagia and their effect on the final outcome in post-acute stroke patients
Aim: Dysphagia is a common and often severe stroke complication. Dysphagia screening is used to detect presence of dysphagia in post stroke patients in the Czech Republic. The Gugging Swallowing Screen (GUSS) is the most common method. Flexible Endoscopic Evaluation of Swallowing (FEES) is another objective method capable of detecting dysphagia. Aim of this study was to correlate results of GUSS and FEES and to evaluate the impact of FEES on functional outcomes in stroke patients.
Patients and methods: 100 patients with acute stroke were randomized in two groups, 50 patients were tested with GUSS and FEES, and 50 patients only with GUSS. Death, dysphagia severity, severity of neurological deficit, and disability status were followed up to 30 days.
Results: 47 men and 53 women (mean age 71.2 years) were included in the study. We did not find any significant difference in deaths, length of hospitalizations, dysphagia severity, and pneumonia incidence between both groups. Correlation coefficient between GUSS and FEES screening was 0.8. In the FEES group, we adjusted the diet according to the FEES results in 20% of patients; in this group we found significantly lower respiratory infection incidence (P = 0.045).
Conclusion: Testing patients with FEES did not lead to better functional outcome after stroke in our patients. We lowered respiration infection incidence by adjusting the diet according to the FEES results.
Keywords:
dysphagia – screening – The Gugging Swallowing Screen – flexible endoscopic evaluation
Autoři: G. Solná 1; D. Václavík 1,2; O. Pavlík 1; B. Gwardová 1; Lucia Staníková 3
; Pavel Komínek 3,4
Působiště autorů: Vzdělávací a výzkumný institut Agel, o. p. s., Neurologické oddělení, Vítkovická nemocnice, a. s., Ostrava 1; Katedra neurologie, LF OU, Ostrava 2; Klinika otorinolaryngologie a chirurgie hlavy a krku FN Ostrava 3; Katedra kraniofaciálních oborů, LF OU, Ostrava 4
Vyšlo v časopise: Cesk Slov Neurol N 2020; 83/116(6): 614-620
Kategorie: Původní práce
doi: https://doi.org/10.48095/cccsnn2020614Souhrn
Cíl: Dysfagie je běžná a často závažná komplikace po CMP. Její detekce je prováděna v ČR u pacientů po CMP formou dysfagického skríninku. Nejčastěji užívaným je The Gugging Swallowing Screen (GUSS). Dysfagii pomáhají diagnostikovat i objektivní metody, např. flexibilní endoskopie (Flexible Endoscopic Evaluation of Swallowing; FEES). Cílem sdělení bylo korelovat výsledky testu GUSS a objektivního vyšetření FEES a zjistit, jestli má FEES vliv na výsledný klinický stav pacientů s CMP.
Soubor a metody: 100 pacientů po akutní CMP s pozitivním GUSS testem bylo konsekventně randomizováno do 2 skupin, 50 pacientům byl proveden GUSS a FEES a 50 pacientům jen GUSS. Po 30 dnech jsme sledovali úmrtí, tíži dysfagie, tíži neurologického deficitu a stupeň soběstačnosti.
Výsledky: Do studie bylo zařazeno 47 mužů a 53 žen (průměrný věk 71,2 let). Nebyl prokázán signifikantní rozdíl mezi skupinami v žádném z parametrů exitus, délka hospitalizace, tíže dysfagie, incidence pneumonie mezi oběma skupinami. Korelační koeficient mezi skríninkem GUSS a FEES byl 0,8. Ve skupině s FEES byla upravena dieta podle výsledku FEES u 20 % pacientů, což vedlo ke statisticky významnému poklesu respiračních infektů (p = 0,045).
Závěr: Provedení FEES nemělo v našem souboru vliv na výsledný stav pacientů s dysfagií po CMP. Výskyt respiračních infektů byl snížen úpravou dietetických opatření na základě výsledků FEES.
Klíčová slova:
dysfagie – skríning – The Gugging Swallowing Screen – flexibilní endoskopie
Úvod
V ČR patří CMP k třetí nejčastější příčině úmrtí [1]. Vedou k invalidizujícímu postižení až 60 % pacientů.
Dysfagie patří ke třem nejtěžším komplikacím CMP, která je riziková zejména v prvních dnech po příhodě. Může být i hlavním symptomem CMP [2]. Výskyt se uvádí mezi 37 a 78 % všech CMP [3]. Jejím největším rizikem je tzv. tichá aspirace, což je průnik sousta do dýchacích cest bez schopnosti obranného kašle, která je způsobena sníženou senzitivitou v orofaryngeální oblasti polykacího ústrojí anebo oslabením schopnosti expektorace. Tichá aspirace se objevuje až u 50 % pacientů s dysfagií [4] v prvních dnech od vzniku onemocnění. Aspirace způsobuje u pacientů pneumonii, která ztěžuje další léčbu pacienta a může končit i letálně. Mezi další důsledky dysfagie spadají i malnutrice a dehydratace. Dysfagie je prediktorem vyšších nákladů na zdravotní péči – RTG, antibiotika (ATB), délku hospitalizace i ošetřovatelskou péči [5,6].
Prevence dysfagie je prováděna v ČR systematicky dle dat z roku 2017 u všech pacientů po CMP v 57 % iktových centrech, a to formou dysfagického skríninku. V 73 % tento skríning provádějí zdravotní sestry. Celkem 82 % pracovišť užívá test The Gugging Swallowing Screen (GUSS) [7]. GUSS je standardizovaný test, který na základě výsledků určuje stupeň dysfagie, riziko aspirace a nabízí dietetická opatření vzhledem ke stupni závažnosti dysfagie [7–10]. Byla prokázána jeho 100% senzitivita vůči riziku dysfagie, GUSS má specificitu 50–69 % [7]. Může za pacienta v riziku aspirace označit i pacienta bez rizika dle flexibilní endoskopie (Flexible Endoscopic Evaluation of Swallowing; FEES). Přesnou detekci poruchy polykání pomáhají diagnostikovat i objektivní metody videofluoroskopie (videofluoroscopy; VFS) a FEES. V ČR jsou dostupné objektivní metody na 51 % pracovišť [8].
Cílem naší práce bylo zjistit, zda má provedení FEES vliv na výsledný klinický stav pacientů (exitus, délka hospitalizace, soběstačnost, tíže dysfagie, respirační infekty, pneumonie a léčba ATB) oproti užití pouze skríninkového testu GUSS. Také jsme chtěli ověřit, jak přesně korelují výsledky testu GUSS a objektivního vyšetření FEES a jejich dopad na výskyt respiračních infektů.
Byla stanovena hypotéza: Objektivní vyšetření polykání bude mít významnější vliv na výsledný stav pacientů po akutní CMP než jen skríninkové vyšetření GUSS.
Materiál a metodika
Do této prospektivní monocentrické komparativní kohortové studie byli začleňováni pacienti od 1. 7. 2015 do 30. 6. 2018.
Indikačními kritérii byly akutní CMP bez předchozího neurologického deficitu, schopnost podat souhlas se zařazením do studie a pozitivní test na dysfagii (GUSS < 20 bodů).
Vylučujícími kritérii byly kvantitativní/kvalitativní porucha vědomí, zavedená nazogastrická sonda (NGS; pro vysokou invazivitu výkonu), anatomické překážky znemožňující provedení FEES a riziko krvácení. Byla sledována demografická data (věk, pohlaví).
Po přijetí (max. do 24 h) byl pacientům proveden test GUSS, dle kterého byly stanoveny tíže dysfagie a příslušná dieta. Tíže CMP byla kvantifikována pomocí škály National Institutes of Health Stroke Scale (NIHSS). Byl proveden vstupní RTG plic a z krve byly vyšetřeny parametry zánětu – C-reaktivní protein (CRP). Test GUSS byl prováděn vyškolenými sestrami. Pacienti s pozitivním testem GUSS (≤ 19 bodů) byli konsekventně rozděleni do dvou skupin.
První skupina byla vyšetřena navíc zobrazovacím vyšetřením FEES, které proběhlo do 24 h od přijetí. Pacienti byli od přijetí do vyšetření non per os. Vlastní endoskopické vyšetření polykacího aktu bylo prováděno u lůžka na jednotce intenzivní péče flexibilním fibroskopem ENF-GP (Olympus, Shinjuku, Japonsko). Vyšetření prováděl vyškolený neurolog ve spolupráci s klinickou logopedkou (oba proškoleni v provádění a hodnocení FEES na Otorinolaryngologické (ORL) klinice FN Ostrava před zahájením studie) (obr. 1). Tato personálně odlišná metodika byla zvolena jednak z důvodu absence ORL lékaře s možností provádět akutní endoskopické vyšetření na našem pracovišti a jednak po vzoru např. Německa, kde běžně FEES provádějí neurologové nebo i kliničtí logopedi.
Obr. 1. Flexibilní endoskopické vyšetření polykání na neurologické jednotce intenzivní péče – neurolog a klinická logopedka.
Fig. 1. Flexible Endoscopic Evaluation of the Swallowing on stroke unit – neurologist, and speech therapist.
Pacient byl vyšetřován minimálně v polosedě na lůžku, musel být schopen spolupráce. Nosní dírkou mu byl zaveden endoskop, bylo provedeno základní anatomické a neurologické zhodnocení orofaryngeální oblasti, následně bylo hodnoceno polykání slin, logopedkou podaného pyré, tekutiny a pevného sousta se zaměřením na detekci penetrace, aspirace nebo tiché aspirace. Pro zlepšení přehlednosti byly tekutina a pyré obarveny rozdílnými potravinářskými barvivy. Eventuální průnik/neprůnik materiálu do dýchacích cest byl hodnocen klinickou logopedkou a neurologem jednak přímo během výkonu a poté z videozáznamu pomocí Rosenbekovy penetračně aspirační škály (PAS) (tab. 1) [11]. Supervizi při hodnocení výkonů prováděl ORL specialista. Management další péče se řídil dle výsledku FEES.
Tab. 1. Penetračně aspirační škála dle Rosenbeka [11]. ![Penetračně aspirační škála dle Rosenbeka [11].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/d90cd1a36761e30ee41f4c5278df0965.png)
DC – dýchací cesty U druhé skupiny byl nastaven příjem stravy a tekutin standardně na základě výsledku testu GUSS. Test GUSS byl proveden v den propuštění pacienta, minimálně po čtyřech dnech hospitalizace. Management péče o pacienty ve skupině s testem GUSS se řídil výsledkem testu a jeho následným nutričním doporučením (tab. 2).
Tab. 2. Management péče dle výsledku testu GUSS. 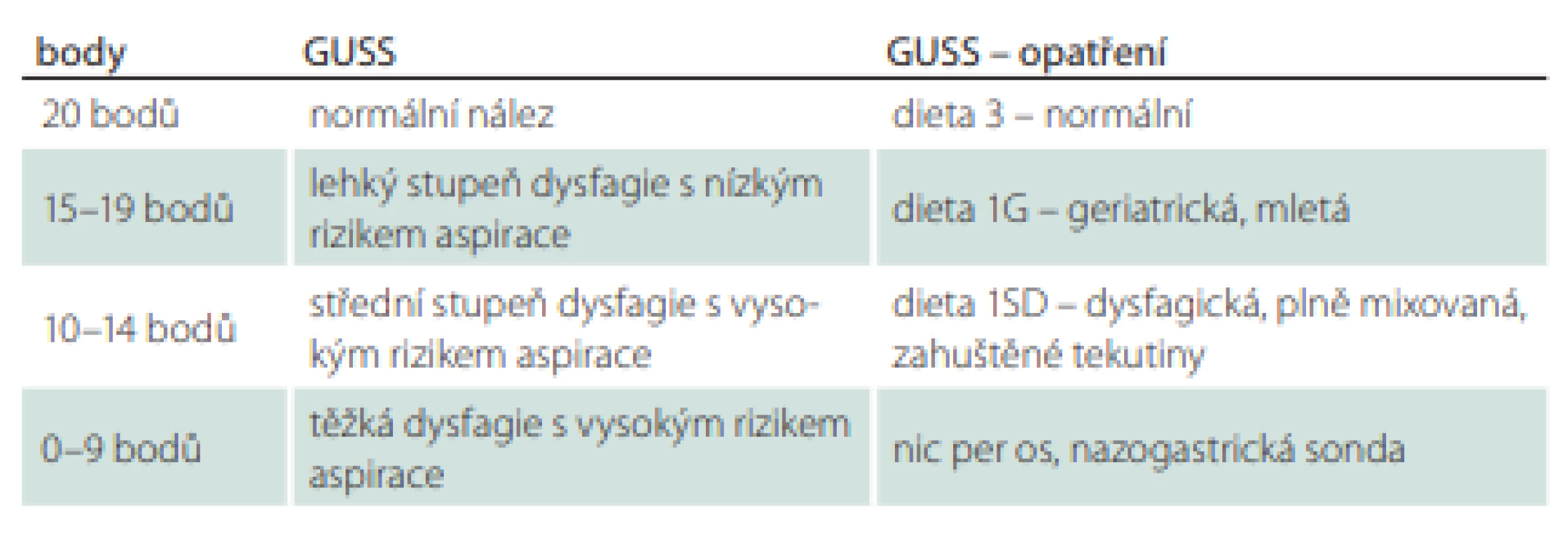
GUSS – The Gugging Swallowing Screen Hodnotili jsme NIHSS sedmý den hospitalizace, resp. v den dimise, pokud proběhla dříve než sedmý den, nejdříve však čtvrtý den, soběstačnost dle modifikované Rankinovy škály (mRS) – 7, RTG, CRP, GUSS. Byl sledován typ léčby (intravenózní trombolýza a/nebo mechanická rekanalizace), léčba ATB a výskyt respiračního infektu, resp. pneumonie.
Respirační infekt byl definován přítomností poslechového nálezu, kašle, elevací CRP a/nebo leukocytózou a léčbou ATB. U všech pacientů byl proveden RTG plic a odebrán biologický materiál ke kultivaci (stěr z krku/sputum), negativní nález nebyl považován za exkluzivní pro přítomnost respiračního infektu.
Pneumonie byla hodnocena dle parametrů České pneumologické a ftizeologické společnosti ČLS JEP, kdy podmínkou stanovení je nález čerstvého infiltrátu na skiagramu hrudníku spolu s nejméně dvěma příznaky infekce respiračního traktu (nejčastěji kašel, dále dušnost, bolest na hrudníku, horečka a poslechový nález) [12]. Toto hodnocení odpovídá i kritériím Centra pro kontrolu a prevencí nemocí (Centers for Disease Control and Prevention; CDC) z roku 2015 [13].
Poslední kontrola proběhla min. 30–40 dní od CMP. Byl zhodnocen stav polykání subjektivním popisem pacienta, jeho příbuzného nebo ošetřujícího, druh příjmu potravy (běžná, mixovaná, zahuštěné tekutiny apod.), stupeň soběstačnosti dle škály mRS a byl zjištěn aktuální výskyt respiračního onemocnění (léčba ATB, febrilie).
Dle typu diety byli pacienti rozděleni do skupin na pacienty s lehkou dysfagií – dieta 3 (normální konzistence), 1G (mletá, geriatrická) a pacienty se středně těžkou a těžkou dysfagií – dieta 1 SD (plně mixovaná) a výživa pomocí NGS, popř. perkutánní gastrostomií.
Byla srovnána výše uvedená data mezi oběma skupinami s cílem zjistit rozdíl ve výsledném klinickém stavu, ve výskytu respiračních infektů, resp. pneumonií.
Pro popis souboru byla použita popisná statistika (frekvenční tabulky, medián, aritmetický průměr, směrodatná odchylka, min. a max. hodnota). Statistické testy byly hodnoceny na hladině významnosti 5 %. Pro zpracování byl použit program Stata verze 13 (StataCorp, College Station, TX, USA).
Pro popis dat byla použita základní popisná statistika. U kvantitativních dat byla ověřena normalita pomocí Shapir-Wilkova testu a dle rozložení dat byly použity parametrické a neparametrické statistické testy.
Pro vyhodnocení vstupních a výstupních hodnot (dle sledování po 24 h, 7 dnech, 30 dnech) byly použity párové testy – Wilcoxonův test pro kvantitativní data a test symetrie pro kvalitativní data.
Pro srovnání sledovaných parametrů dle zvolených parametrů (tíže dysfagie za 24 h a 30 dní, FEES) byly použity testy pro dva výběry – t-test, Mann-Whitneyho U test pro kvantitativní data a chí-kvadrát test, v případě nesplnění podmínek pro jeho použití byl použit Fisherův exaktní test.
Výsledky
Během 36 měsíců bylo zařazeno 100 pacientů (47 mužů). Průměrný věk byl 71,2 let, průměrná délka hospitalizace 11 dní (medián 9 dní), vstupní hodnota GUSS byla v průměru 12,6 bodů, hodnota tíže aspirace na FEES dle škály PAS byla v průměru 3,98, hodnota NIHSS byla při přijetí v průměru 7,7. Středně těžkou a těžkou dysfagii při přijetí mělo 86 % pacientů, 14 % mělo dysfagii lehkého stupně, 30 % pacientů bylo intervenováno.
Homogenita skupin
Základní vstupní charakteristiky pacientů ukazuje tab. 3. Skupiny se statisticky lišily, ve sku-pině FEES byly vyšší hodnoty NIHSS (p = 0,0358) a také vyšší výskyt intervencí. V této skupině bylo intervenováno 22 osob oproti skupině s GUSS, kde jich bylo intervenováno 8 (p = 0,002). Hodnoty NIHSS po 7 dnech již byly u obou skupin srovnatelné. V dalších důležitých parametrech byly skupiny homogenní, např. hodnota testu GUSS nebo tíže dysfagie.
Tab. 3. Vstupní charakteristika celého souboru. 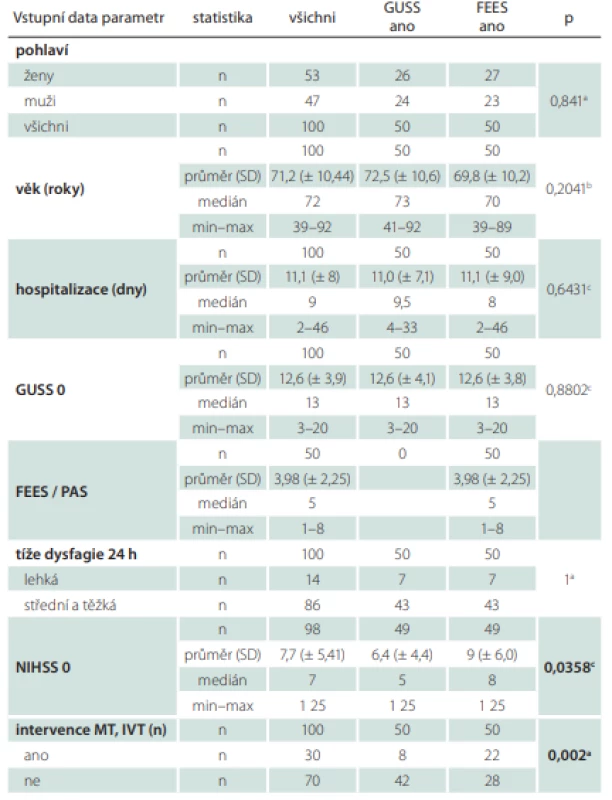
a Chí-kvadrát test; b t-test pro dva výběry; c Wilcoxonův (Man-Whitneyho) test
0 – vstupní hodnota; FEES – Flexible Endoscopic Evaluation of Swallowing; GUSS – The Gugging Swallowing Screen; IVT – intravenózní trombolýza; MT – mechanická trombektomie; n – počet; NIHSS – National Institutes of Health Stroke Scale; PAS – Rosenbekova penetračně aspirační škála; SD – směrodatná odchylkaVýstupní data celého souboru
Ze souboru zemřelo 5 % pacientů, průměrná délka hospitalizace byla 11 dní, test GUSS se v průměru zlepšil o 3,2 bodu z původních 12,6 na 15,8, hodnota NIHSS se snížila o 2,2 bodu z průměrných 7,7 na 5,5, hodnota mRS se mírně snížila o 0,3 bodu z průměrné 3,8 na 3,5.
Respirační infekty mělo 25 % pacientů, z toho bylo 6 % pneumonií, 24 % pacientů bylo léčeno ATB. Z 86 % těžkých dysfagiků se po 7 dnech zlepšilo 48 % a těžkých zůstalo 38 % pacientů. Po 30 dnech došlo ke zlepšení u dalších 19 % pacientů a zůstalo těžkých 19 %. Lehkých nebo minimálních dysfagiků bylo po 30 dnech původně 14–75 % pacientů a zlepšilo se 61 % pacientů. Výstupní data celého souboru zobrazuje tab. 4.
Tab. 4. Výsledná data celého souboru. 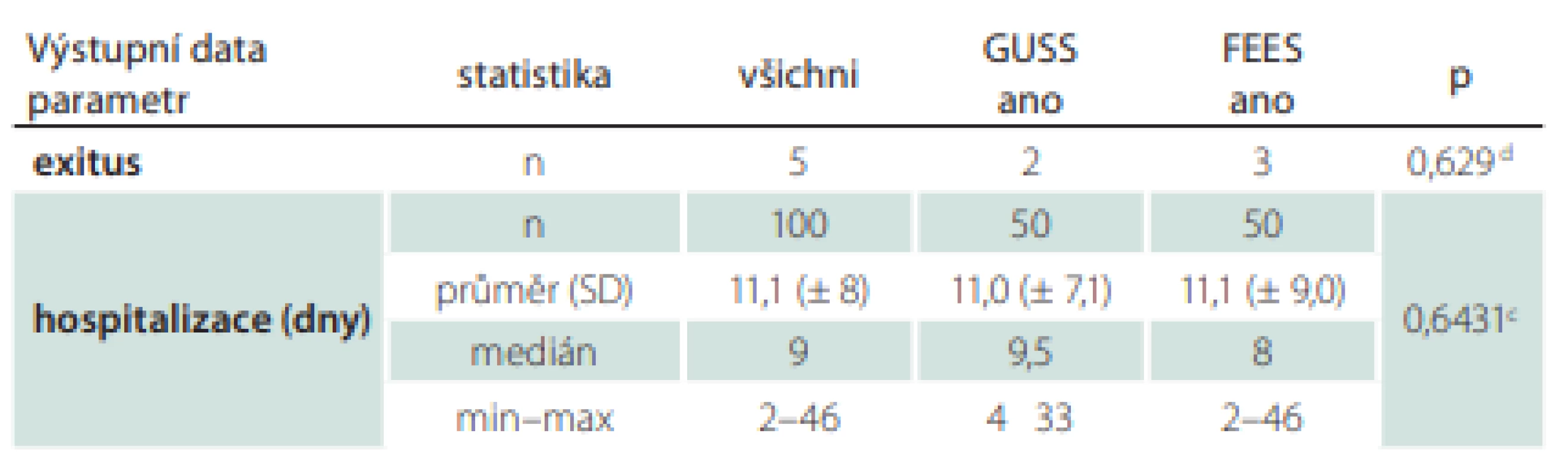
Tab. 4. Výsledná data celého souboru. 
a Chí-kvadrát test; b t-test pro dva výběry; c Wilcoxonův (Man-Whitneyho) test
0 – vstupní hodnota; d – dny; FEES – Flexible Endoscopic Evaluation of Swallowing; GUSS – The Gugging Swallowing Screen; IVT – intravenózní trombolýza; MT – mechanická trombektomie; n – počet; NIHSS – National Institutes of Health Stroke Scale; PAS – Rosenbekova penetračně aspirační škála; SD – směrodatná odchylkaVýstupní data srovnávající obě skupiny – výsledky 1 (exitus, délka hospitalizace, tíže dysfagie, GUSS, NIHSS, mRS)
Rozdíly mezi skupinami v jednotlivých výstupních parametrech nebyly statisticky významné. Nebyl prokázán vliv objektivního vyšetření FEES na žádný ze sledovaných parametrů – exitus, délka hospitalizace, tíže dysfagie (viz tab. 3 a 4 – srovnání dle Wilcoxonova [Mann-Whitneyho] testu).
Hodnoty GUSS, NIHSS, mRS a tíže dysfagie byly srovnány u obou skupin v časových odstupech a jsou zobrazeny v obr. 2.
Obr. 2. Znázornění hodnoty GUSS, NIHSS, mRS a tíže dysfagie GUSS u obou skupin v časovém intervalu 0 d, 7 d, 30 d.
Fig. 2. Representation of the value of GUSS, NIHSS, mRS, and severity of dysphagia GUSS in both groups at time interval 0 d, 7 d, and 30 d.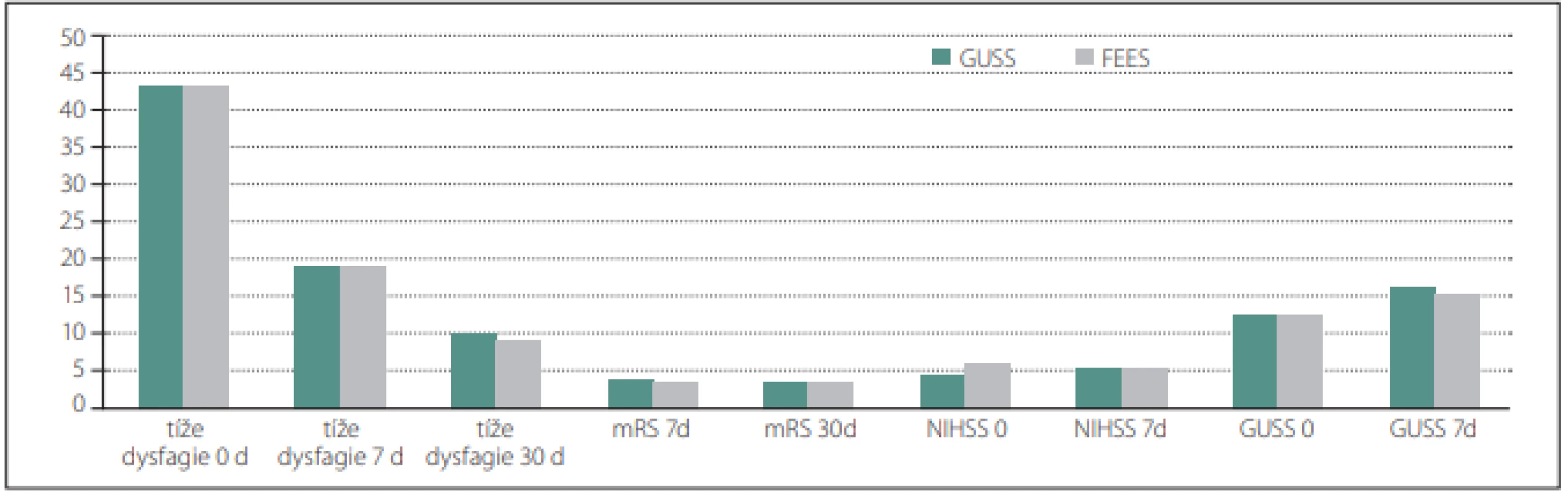
d – dny; FEES – Flexible Endoscopic Evaluation of Swallowing; GUSS – The Gugging Swallowing Screen; mRS – modifi kovaná Rankinova škála; NIHSS – National Institutes of Health Stroke Scale
d – days; FEES – Flexible Endoscopic Evaluation of Swallowing; GUSS – The Gugging Swallowing Screen; mRS – The Modifi ed Ranking Scale; NIHSS – National Institutes of Health Stroke ScaleVýstupní data srovnávající obě skupiny – výsledky 2 (infekční komplikace)
Ze 100 pacientů bylo 50 vyšetřeno testem GUSS (50 %), 50 pacientů bylo vyšetřeno testem GUSS a FEES (50 %). Všechna vyšetření FEES byla provedena v celém rozsahu a bez komplikací. Ve skupině s testem GUSS bylo 24 % respiračních infektů a z nich 2 pacienti měli pneumonii. Ve skupině s FEES bylo 26 % respiračních infektů a z nich 4 pacienti měli pneumonii. Léčba ATB u obou skupin byla obdobná, 11 % u pacientů s testem GUSS a 13 % ve skupině pacientů s FEES. Tyto rozdíly nebyly statisticky významné (p = 0,817 vs. 0,678 vs. 0,64) dle chí-kvadrát testu a dle Fisherova exaktního testu (obr. 3).
Obr. 3. Znázornění infektů u obou skupin.
Fig. 3. Representation of infections in both groups.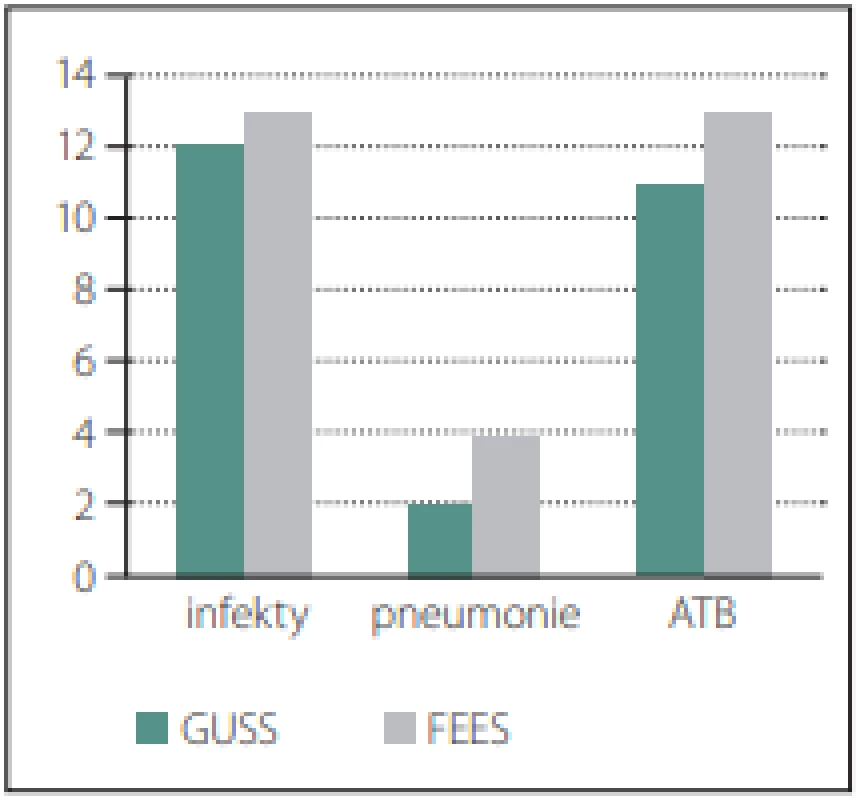
ATB – antibiotika; FEES – Flexible Endoscopic Evaluation of Swallowing; GUSS – The Gugging Swallowing Screen
ATB – antibiotics; FEES – Flexible Endoscopic Evaluation of Swallowing; GUSS – The Gugging Swallowing ScreenKorelace výsledků vyšetření FEES vs. test GUSS
U skupiny pacientů s FEES jsme srovnávali výsledek vyšetření a jeho dopad na dietetická opatření s výsledkem testu GUSS (tab. 5).
Tab. 5. Srovnání výsledků vyšetření FEES vs. test GUSS. 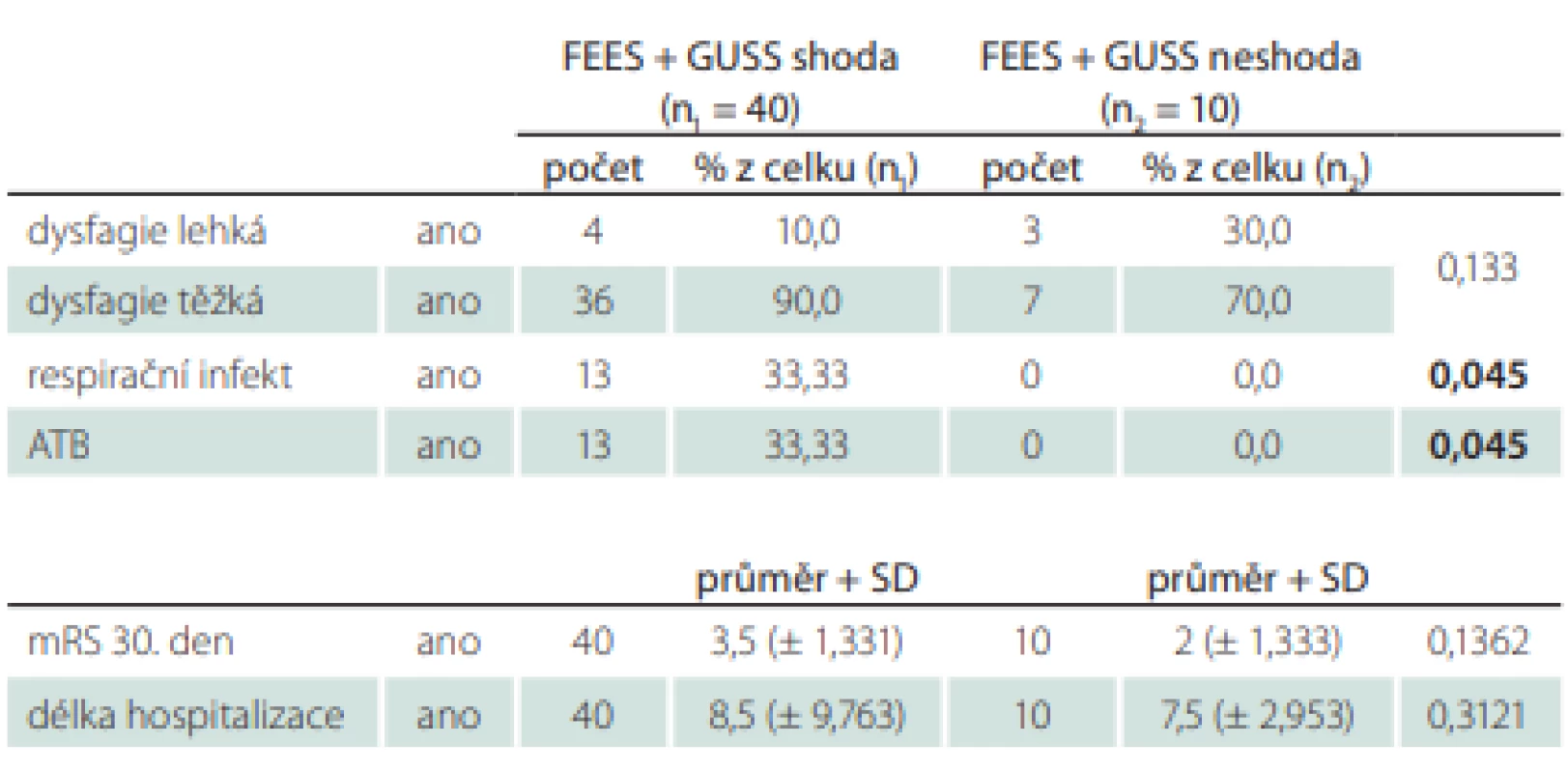
ATB – antibiotika; FEES – Flexible Endoscopic Evaluation of Swallowing; GUSS – The Gugging Swallowing Screen; n – počet; mRS – modifi kovaná Rankinova škála; SD – směrodatná odchylka Shoda byla u 40 pacientů (80 %). U 10 pacientů jsme na základě výsledku z vyšetření FEES nastavili jiná opatření, než stanovil test GUSS. Opatření, která byla méně omezující (lehčí typ diety, 1× jsme neindikovali NGS), jsme nastavili 5× a také 5× opatření, která výsledek testu GUSS zpřísňovala (byla zavedena NGS). U těchto 20 % pacientů, kterým jsme modifikovali typ příjmu stravy, nebyl zaznamenán žádný respirační infekt. Tento rozdíl byl statisticky významný (p = 0,045).
Oproti tomu pacienti, u kterých byla shoda FEES a testu GUSS, měli ve 33 % respirační infekt a byli léčeni ATB. Celkově se tyto dvě skupiny pacientů nelišily z hlediska tíže dysfagie, také se nelišily ve výsledném mRS 30. den, statisticky významný rozdíl nebyl ani v délce hospitalizace.
Diskuze
Skrínink GUSS vs. objektivní vyšetření FEES
Skrínink dysfagie je nedílnou součástí doporučení v péči o pacienta s dysfagií po CMP [14]. Existují ale i srovnávací studie, které jednoznačný vliv skríninku na snížení výskytu pneumonie, mortality nebo soběstačnosti po CMP neprokazují [15]. Mnohé další ale význam skríninku jednoznačně potvrzují, a to zejména raného skríninku [16–19].
Objektivní vyšetření FEES pomáhá objektivizovat sporné nebo nejisté výsledky ze skríninku nebo klinického logopedického vyšetření pacientů se suspektní dysfagií. FEES má tedy svoji nespornou diagnostickou hodnotu, ale také přesah do dalších opatření stran diety a také logopedické intervence. Např. u některých pacientů byl nález na FEES shodný s výsledkem testu GUSS, nepotvrzoval aspiraci, nicméně polykání u pacientů bylo tak pomalé a neefektivní, že by bylo pro pacienta nebezpečné (únava při snězení celé porce by mohla způsobit zhoršení polykání a aspiraci), a volili jsme NGS.
Celkově byla u 20 % pacientů ze skupiny FEES na základě výsledku vyšetření FEES upravena dietetická opatření. U 10 % pacientů méně přísně, než stanovil výsledek skríninkového testu, 1× jsme neindikovali NGS a ve 4 případech jsme zvolili jiný typ diety, než kterou doporučoval test GUSS (místo dysfagické diety – homogenní mixované stravy – jsme zvolili geriatrickou dietu). U dalších 10 % jsme naopak místo dysfagické diety indikovali NGS. U těchto 20 % pacientů nebyl zaznamenán žádný respirační infekt. Tento rozdíl byl statisticky významný (tab. 4). Je tedy možné usuzovat, že FEES měl u těchto pacientů pozitivní vliv na výsledný stav.
Přesto v našem souboru při srovnání obou skupin provedení objektivního vyšetření FEES nesnížilo výskyt respiračních infektů ani pneumonie. Také nesnížilo mortalitu. Neprokázali jsme tedy jednoznačnou superioritu FEES vs. testu GUSS. Naše hypotéza nebyla potvrzena. Tato skutečnost mohla být ovlivněna vstupně statisticky vyšší hodnotou NIHSS a také statisticky vyšším počtem intervencí ve skupině FEES. Tyto pacienty můžeme tedy hodnotit vstupně celkově za těžší a rizikovější. Výsledky také potvrzují vysokou citlivost testu GUSS. Tu se znovu pokoušeli ověřit Warnecke et al [9], kteří revidovali výsledky testu GUSS pomocí FEES. Zjistili, že původní výsledky korelují s novými daty [7], že dietetická doporučení dle testu GUSS jsou konzervativnější než dle FEES a že se oproti FEES přeceňuje i užití NGS. Test GUSS je tedy ve svém doporučení zpravidla přísnější.
Dysfagie
Při přijetí mělo těžkou a středně těžkou dysfagii 84 % pacientů. Již po týdnu došlo ke zlepšení o 48 % a po 30 dnech o dalších 19 %, tedy s těžkou dysfagií po 4 týdnech zůstalo 19 % pacientů. I zde je pravděpodobné, že se ještě někteří pacienti v rámci terapeutických logopedických doporučení nebo logopedické intervence v institucích následné péče a rehabilitace zlepšili. Logopedická péče byla indikována u všech pacientů a pacienti byli v případě potřeby dále překládáni i s ohledem na možnost v pokračování logopedické péče. Další sledování ale v tomto směru již neproběhla.
Infekty, mortalita
Z mnoha studií bylo potvrzeno, že pacienti po CMP s dysfagií mají vyšší riziko vzniku pneumonie než pacienti bez dysfagie [16,17,20,21] a nejvyšší riziko je u pacientů s těžkou dysfagií. Ke konsenzu ve stanovení kritérií pro pneumonii došlo v roce 2015 [13], ale do té doby se v mnoha pracích respirační infekty nebo pneumonie definují nejednoznačně [22] a výsledky studií jsou těžko srovnatelné.
Na našem pracovišti jsme u pacientů s dysfagií zaznamenali celkově 25 % časných respiračních infektů. Podobný výsledek (23 %) při podobné definici infektu uvádějí Arnold et al [21]. Falsetti et al uvádějí 30 % infektů dolních dýchacích cest [23], ke stejným číslům dochází i metaanalýza Westendorpa et al [24]. Současně s tím byla očekávaně vyšší spotřeba ATB – u nás 22 %, Arnold et al uvádějí 28 % [21].
V našem souboru mělo 6 % pacientů prokázanou pneumonii. K velmi podobným závěrům došli Teuschl et al [25], kdy při časném skríningu testem GUSS a modifikaci stravy mělo 5,2 % pacientů časnou pneumonii. V dalších metaanalýzách Brayeho et al nebo Masrura et al se objevuje 4–10 % pacientů s pneumonií [26,27]. V metaanalýze ESO and ESSD guidelines 2018 se uvádí 20 % časných pneumonií u pacientů s dysfagií po CMP [28], zde ale bohužel nemáme k dispozici přesné definování pneumonie. Výše uvedená data jsou s naším souborem srovnatelná.
Ze souboru zemřelo 5 % pacientů, jeden pacient zemřel na pneumonii, další dva pacienti zemřeli na následky těžkého iktu při uzávěru bazilární tepny a jedna pacientka na renální selhání.
Limitací této studie může být jiná metodika při kontrolním vyšetření u pacientů v den 30, kdy byla data získána pouze zprostředkovaně od samotných pacientů nebo jejich ošetřovatelů či zdravotnických pracovníků a ne objektivním hodnocením (např. pomocí testu GUSS, stanovením CRP apod.). Nicméně se domníváme, že i přesto je možné je považovat za relevantní a že pacient sám nebo zdravotník je schopen posoudit a popsat typ výživy a tekutin, které přijímá, a zda aktuálně u něj probíhá respirační infekt.
Závěr
Provedení FEES nemělo v našem souboru vliv na výsledný stav pacientů s dysfagií po akutní CMP. FEES ale má vliv na přesnější dietetická opatření, a tím i sekundárně na prevenci rozvoje respiračních infektů. Ve skupině pacientů s FEES byl prokázán statisticky nižší výskyt respiračních infektů u pacientů, u kterých nebyla shoda s testem GUSS ve stanovení formy příjmu stravy a kterým byl na základě této objektivní metody příjem stravy modifikován.
Metoda GUSS se jeví vzhledem ke své jednoduchosti a snadné aplikaci sestrami jako dostatečný nástroj pro detekci aspirace a prevenci komplikací dysfagie a koreluje s výsledky objektivního vyšetření FEES.
Etické aspekty
Autoři prohlašují, že studie na lidských subjektech popsaná v manuskriptu byla provedena v souladu s etickými standardy příslušné komise (institucionální a národní) odpovědné za provádění klinických studií a s Helsinskou deklarací z roku 1975, revidovanou v roce 2000. Pacient souhlasil s pořízením fotografie (obr. 1).
Grantová podpora
Práce byla podpořena interním grantem skupiny AGEL INT 2014002, VAVIA, Výzkumný a vzdělávací institut AGEL, Česká republika.
Konflikt zájmů
Autoři deklarují, že v souvislosti s předmětem studie nemají žádný konflikt zájmů.
Mgr. Gabriela Solná
Neurologické oddělení
Vítkovická nemocnice
Zalužanského 1192
703 00 Ostrava
e-mail: g.solna@email.cz
Přijato k recenzi: 19. 5. 2020
Přijato do tisku: 22. 10. 2020
Zdroje
1. Škoda O, Herzig R, Mikulík R et al. Klinický standard pro diagnostiku a léčbu pacientů s ischemickou cévní mozkovou příhodou a s tranzitorní ischemickou atakou – verze 2016. Cesk Slov Neurol N 2016; 79/112 (3): 351–363. doi: 10.14735/amcsnn2016351
2. Scottish Intercollegiate Guidelines Network (SIGN) (2010): Management of patients with stroke: identification and management of dysphagia. A national clinical guideline. [online]. Available from URL: http: //www.sign.ac.uk.
3. Martino R, Foley N, Bhogal S et al. Dysphagia after stroke: incidence, diagnosis, and pulmonary complications. Stroke 2005; 36 (12): 2756–2763. doi: 10.1161/01.STR.0000190056.76543.eb.
4. Smith CH, Logemann JA, Colangelo LA et al. Dysphagia. Incidence and patient characteristics associated with silent aspiration in the acute care setting. Dysphagia 1999; 14 (1): 1–7. doi: 10.1007/PL00009579.
5. Solná G, Lasotová N, Lebedová Z et al. Návrh jednotného postupu v péči o pacienty s dysfagií na iktových jednotkách v ČR. [online]. Dostupné z URL: http: //nemocnicevitkovice.agel.cz/pracoviste/oddeleni/neurologicke-oddeleni/pdf/pece-o-pac-dysfagie.pdf.
6. Václavík D, Solná G, Lasotová N et al. Standard léčebného plánu – Péče o pacienty s dysfagií po cévní mozkové příhodě. Cesk Slov Neurol N 2015; 78/111 (6): 721–727. doi: 10.14735/amcsnn2015721.
7. Trapl M, Enderle P, Nowotny M et al. Dysphagia bedside screening for acute-stroke patients: the Gugging Swallowing Screen. Stroke 2007; 38 (11): 2948–2952. doi: 10.1161/STROKEAHA.107.483933.
8. Solná G, Václavík D, Lasotová N et al. Péče o pacienty po cévní mozkové příhodě v České republice. Cesk Slov Neurol N 2018; 81 (5): 528–531. doi: 10.14735/amcsnn2018528.
9. Warnecke T, Im S, Kaiser C et al. Aspiration and dysphagia screening in acute stroke – the Gugging Swallowing Screen revisited. Eur J Neurol 2017; 24 (4): 594–601. doi: 10.1111/ene.13251.
10. Lasotová N. Screening dysfagie GUSS. [online]. Dostupné z URL: http: //www.fnbrno.cz/nemocnice-bohunice/neurologicka-klinika/screening-dysfagie-guss/t4943.
11. Rosenbek JC, Robbins JA, Roecker EB et al. A penetration-aspiration Scale. Dysphagia 1996; 11 (2): 93–98. doi: 10.1007/BF00417897.
12. Kolek V, Kolář M, Kašák V et al. [online]. Dostupné z URL: https: //www.infekce.cz/Legislativa/Pneumonie%20DP170311.pdf.
13. Smith CJ, Kishore AK, Vail A et al. Diagnosis of stroke-associated pneumonia: recommendations from the Pneumonia in Stroke Consensus Group. Stroke 2015; 46 (8): 2335–2340. doi: 10.1161/STROKEAHA.115.009617.
14. Powers WJ, Rabinstein AA, Ackerson T et al. 2018 guidelines for the early management of patients with acute ischemic stroke: a guideline for healthcare professionals from the American Heart Association/American Stroke Association. Stroke 2018; 49 (3): e46–110. doi: 10.1161/STR.0000000000000158.
15. Smith EE, Kend DM, Bulsara KR et al. Effect of dysphagia screening strategies on clinical outcomes after stroke: a systematic review for the 2018 guidelines for the early management of patients with acute ischemic stroke. Stroke 2018; 49 (3): e123–128. doi: 10.1161/STR.0000000000000159.
16. Al-Khaled M, Matthis C, Binder A et al. Dysphagia in patients with acute ischemic stroke: early dysphagia screening may reduce stroke-related pneumonia and improve stroke outcomes. Cerebrovasc Dis 2016; 42 (1–2): 81–89.
17. Joundi RA, Martino R, Saposnik G et al. Predictors and outcomes of dysphagia screening after acute ischemic stroke. Stroke 2017; 48 (4): 900–906. doi: 10.1161/STROKEAHA.116.015332.
18. Hinchey JA, Shephard T, Furie K et al. Formal dysphagia screening protocols prevent pneumonia. Stroke 2005; 36 (9): 1972–1976. doi: 10.1161/01.STR.000017 7529.86868.8d.
19. Palli CH, Fandler S, Doppelhofer K et al. Early dysphagia screening by trained nurses reduces pneumonia rate in stroke patients: a clinical intervention study. Stroke 2017; 48 (9): 2583–2585. doi: 10.1161/STROKEAHA.117.018157.
20. Martino R, Foley N, Bhogal S et al. Dysphagia after stroke: incidence, diagnosis, and pulmonary complications. Stroke 2005; 36 (12): 2756–63. doi: 10.1161/01.STR.0000190056.76543.eb.
21. Arnold M, Liesirova K, Broeg-Morvay A et al. Dysphagia in Acute Stroke: Incidence, Burden and Impact on Clinical Outcome. PloS One 2016; 11 (2): e0148424. doi: 10.1371/journal.pone.0148424.
22. Kishore AK, Vail A, Chamorro A et al. How is pneumonia diagnosed in clinical stroke research? A systematic review and meta-analysis. Stroke 2015; 46 (5): 1202–1209. doi: 10.1161/STROKEAHA.114.007843.
23. Falsetti P, Acciai C, Palilla R et al. Oropharyngeal dysphagia after stroke: incidence, diagnosis, and clinical predictors in patients admitted to a neurorehabilitation unit. J Stroke Cerebrovasc Dis 2009; 18 (5): 329–335. doi: 10.1016/j.jstrokecerebrovasdis.2009.01.009.
24. Westendorp WF, Nederkoorn PJ, Vermeij J-D et al. Post-stroke infection: a systematic review and meta--analysis. BMC Neurol 2011; 11 : 110. doi: 10.1186/1471-2377-11-110.
25. Teuschl Y, Trapl M, Ratajczak P et al. Systematic dysphagia screening and dietary modifications to reduce stroke-associated pneumonia rates in a stroke-unit. PLoS One 2018; 13 (2): e0192142. doi: 10.1371/journal.pone.0192142.
26. Bray BD, Smith CJ, Cloud GC et al. The association between delays in screening for and assessing dysphagia after acute stroke, and the risk of stroke-associated pneumonia. J Neurol Neurosurg Psychiatry 2017; 88 (1): 25–30. doi: 10.1136/jnnp-2016-313356.
27. Masrur S, Smith EE, Saver JL et al. Dysphagia screening and hospital-acquired pneumonia in patients with acute ischemic stroke: findings from Get with the Guidelines–Stroke. J Stroke Cerebrovasc Dis 2013; 22 (8): e301–309. doi: 10.1016/j.jstrokecerebrovasdis.2012.11.013.
28. Dziewas R. ESO guidelines on stroke & dysphagia. Proceedings of the 4th European Stroke Organisation Conference, 2018, Gothenburg, Sweeden.
Štítky
Dětská neurologie Neurochirurgie Neurologie
Článek Supraskapulární neuropatie
Článek vyšel v časopiseČeská a slovenská neurologie a neurochirurgie
Nejčtenější tento týden
2020 Číslo 6- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Zolpidem může mít širší spektrum účinků, než jsme se doposud domnívali, a mnohdy i překvapivé
- Magnosolv a jeho využití v neurologii
- Nejčastější nežádoucí účinky venlafaxinu během terapie odeznívají
-
Všechny články tohoto čísla
- Progresivní supranukleární obrna
- Mezinárodní klasifikace orofaciální bolesti (ICOP) – oficiální český překlad prvního vydání
- Supraskapulární neuropatie
- Endoskopické vs. skríninkové vyšetření polykání a jejich vliv na výsledný stav u pacientů po akutní cévní mozkové příhodě
- Hemodynamické změny ve čtyřech aneurysmatech vedoucí k jejich ruptuře v průběhu sledování
- Srovnání měření průtokových parametrů v oblastikarotické stenózy in vivo a in vitro – pilotní výsledky testování hemodynamického fantomu
- Klinická charakteristika nově diagnostikovaných pacientů s Parkinsonovou nemocí zařazených do longitudinální studie BIO-PD
- Encefalopatie při infekci COVID-19 s odezvou na léčbu intravenózními imunoglobuliny
- Nemocný s pomalu progredující symptomatikou cervikokraniálního přechodu
- Syndrom neadekvátní sekrece antidiuretického hormonu jako první příznak estezioneuroblastomu
- Koincidence roztroušené sklerózy a myasthenia gravis
- Časná revaskularizace po kombinovaném výkonu u nemoci moyamoya
- Endoskopická laváž intraventrikulárního krvácení nezralých novorozenců
- Stanovisko České neurologické společnosti ČLS JEP k organizaci péče o pacienty s akutní bolestí zad v bederní úrovni u dospělých
- Doporučené postupy pro nutriční podporu u cévních mozkových příhod
- Odešel doc. MUDr. Roman Schröder, CSc.
- Zemřel doc. MUDr. Edgar Lukáš, DrSc. (1932–2020)
- MUDr. Michal Králik, CSc. Spomienka na vzácneho človeka.
- Prof. MUDr. Ľubomír Lisý, DrSc.
- Rozloučení s prof. MUDr. Valentinou Stýblovou, DrSc. (1922–2020)
- MUDr. Hanuš Baš, CSc., devadesátiletý
- Prof. MUDr. Peter Kukumberg, PhD. – 75-ročný
- Léčba aktivní sekundárně progresivní roztroušené sklerózy selektivním modulátorem receptoru pro sfingosin-1-fosfát
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Progresivní supranukleární obrna
- Supraskapulární neuropatie
- Endoskopické vs. skríninkové vyšetření polykání a jejich vliv na výsledný stav u pacientů po akutní cévní mozkové příhodě
- Encefalopatie při infekci COVID-19 s odezvou na léčbu intravenózními imunoglobuliny
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



