-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Laboratorní účinnost kyseliny acetylsalicylové v sekundární prevenci ischemických cévních mozkových příhod
Laboratory efficacy testing of acetylsalicylic acid treatment in secondary prevention of ischemic stroke
Aim:
To assess the efficacy of antiplatelet therapy with acetylsalicylic acid (ASA) in secondary prevention in a strictly selected group of patients after ischemic stroke.
Patients and methods:
The group included 106 patients with a minimum of factors potentially affecting the effect of ASA. While compliance was verified by laboratory determination of ASA levels in plasma, presence of previous embolic events was minimized by thorough examination of the heart and carotid arteries. All patients taking 100 mg of ASA daily had their serum 11-dehydrotromboxane B2 levels determined.
Results:
Even in this strictly selected set of patients, effective thromboxane suppression (95% and higher) was only achieved in 76 patients, with suppression levels of 80 – 94.9% determined in 24 patients, and lower in another six patients. Patients with inadequate thromboxane suppression had statistically higher body mass index, cholesterol and LDL cholesterol, and uric acid levels.
Conclusion:
While ASA use led to marked thromboxane suppression in all patients, the required level of suppression was not achieved in over a fourth of our patients. Consistent with latest reports, it is likely that the seemingly inadequate suppression of thromboxane is due to its production from sources other than platelets.
Key words:
acetylsalicylic acid – ischemic stroke – 11-dehydrothromboxane
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
乙酰水杨酸治疗缺血性脑卒中的实验室疗效试验
目的:
目的:评价乙酰水杨酸(ASA)抗血小板治疗在缺血性脑卒中后二级预防中的作用。
患者和方法:
本组纳入106例患者,其中影响ASA疗效的因素最少。虽然通过实验室测定血浆中ASA水平证实了依从性,但通过对心脏和颈动脉的彻底检查,以前的栓塞事件的存在被最小化。所有每天服用100毫克ASA的患者的血清中11-脱氢托姆波塞烷B2水平被测定。
结果:
即使在这组严格选择的患者中,有效的血栓素抑制(95%及以上)仅在76例患者中实现,其中24例患者的抑制水平为80 - 94.9%,另外6例患者的抑制水平较低。血栓素抑制不足的患者,其体重指数、胆固醇和低密度脂蛋白胆固醇以及尿酸水平均有统计学意义上的升高。
结论:
虽然ASA的使用导致所有患者血栓素明显抑制,但超过四分之一的患者没有达到所需的抑制水平。与最新的报道相一致,血栓素的抑制作用似乎并不充分,这可能是由于血栓素不是由血小板产生的。
关键词:
乙酰水杨酸-缺血性脑卒中 - 11-脱氢血栓素
Autoři: T. Adámek 1; Z. Paluch 2; L. Sadílková 1; Š. Alušík 3
Působiště autorů: Interní oddělení, Thomayerova nemocnice, Praha 1; Ústav farmakologie, 2. LF UK, Praha 2; Katedra vnitřního lékařství, Institut postgraduálního vzdělávání ve zdravotnictví, Praha 3
Vyšlo v časopise: Cesk Slov Neurol N 2019; 82(1): 84-90
Kategorie: Původní práce
Souhrn
Cíl:
Určit účinnost antiagregační léčby kyselinou acetylsalicylovou v sekundární prevenci v přísně selektovaném souboru pacientů po ischemické CMP.
Soubor a metody:
Do souboru bylo zahrnuto 106 pacientů s minimalizací možných faktorů, které by mohly ovlivnit efekt kyseliny acetylsalicylové. Compliance byla potvrzena laboratorním vyšetřením kyseliny salicylové v plazmě, embolizační příhody minimalizovány pečlivým vyšetřením srdce a karotických tepen. U všech pacientů užívajících 100 mg kyseliny acetylsalicylové denně jsme vyšetřili sérové koncentrace 11-dehydrotromboxanu B2.
Výsledky:
I v tomto přísně selektovaném souboru k účinné supresi tromboxanu (95 % a více) došlo jen u 76 pacientů, ale u dalších 24 suprese dosahovala 80 – 94,9 % a pouze u šesti pacientů byla ještě nižší. Pacienti s neúčinnou supresí tromboxanu měli statisticky významně vyšší body mass index, cholesterol a LDL cholesterol a kyselinu močovou.
Závěr:
Kyselina acetylsalicylová vedla k výrazné supresi tromboxanu u všech pacientů, požadovaný stupeň suprese nedosáhla více než čtvrtina souboru pacientů. V souladu s nejnovějšími poznatky je pravděpodobné, že zdánlivě nedostatečná suprese tromboxanu je způsobena produkcí tromboxanu z mimodestičkových zdrojů.
Klíčová slova:
kyselina acetylsalicylová – ischemická cévní mozková příhoda – 11-dehydrotromboxan
Úvod
V sekundární prevenci ischemických CMP (iCMP) se kromě korekce rizikových faktorů a případných intervenčních zákroků zejména na karotických tepnách připisuje značný význam antiagregační léčbě. Mezi antiagreganci si důležitou roli nadále zachovává kyselina acetylsalicylová (ASA), a to i po zavedení nejnovějších doporučených postupů [1 – 3].
Pro laboratorní hodnocení účinku ASA se za zlatý standard pokládá vyšetření sérových koncentrací tromboxanu B2 [4] a také European Medicines Agency (EMA) považuje sérové koncentrace tromboxanu B2 za jediný validní marker pro hodnocení účinku různých přípravků s obsahem ASA [5]. Vyšetření sérových koncentrací tromboxanu B2 probíhá ve vzorku krve bez použití antikoagulancií a po hodinové inkubaci vzorku při teplotě 37 °C [6]. Nevýhodou stanovení tohoto markeru je značná variabilita výsledků, které ovlivňují zejména nejednotné postupy při zpracování vzorku [7]. Naměřené hodnoty v klinických studiích se často liší až 10násobně [8,9]. Při doporučovaném postupu s inkubací vzorku jsou již dobře měřitelné i sérové koncentrace jeho stabilnějšího metabolitu 11-dehydrotromboxanu B2 (11-dTXB2). Ten se nejčastěji vyšetřuje v moči [10], ale i toto vyšetření je zatíženo značnou chybou. Odhaduje se, že až 30 % 11-dTXB2 v moči pochází z mimodestičkových zdrojů [11].
Proto jsme se rozhodli ověřit v naší studii, zda pro hodnocení efektu ASA lze použít vyšetření sérových koncentrací 11-dTXB2 B2. Koncentrace 11-dTXB2 v séru, zejména po inkubaci vzorku, jsou mnohem vyšší než v plazmě. O podrobnostech měření tromboxanů (a zejména rozdílech při vyšetření 11-dTXB2 v séru a plazmě) v závislosti na použité metodě jsme referovali na jiném místě [12].
Nedostatečná suprese tromboxanu má za následek častější výskyt kardiovaskulárních příhod vč. mozkových [13]. Příčiny nedostatečné suprese tromboxanu jsou různé. Za nejčastější je pokládána non-compliance. Výsledky léčby ASA mohou být ovlivněny také embolizačními příčinami iCMP. V naší práci jsme se snažili vyhodnotit antiagregační účinek ASA v souboru pacientů s laboratorně ověřenou compliancí a minimalizací embolizačních příhod.
Soubor a metody
Prospektivní jednocentrová klinická studie byla provedena na interním oddělení Thomayerovy nemocnice v Praze. Studie byla schválena společnou etickou komisí Institutu klinické a experimentální medicíny a Thomayerovy nemocnice v Praze. Všichni pacienti podepsali informovaný souhlas.
Zařazovací kritéria
Do studie byli zařazeni pacienti, kteří v sekundární prevenci iCMP užívali dlouhodobě 100 mg ASA (Anopyrin 100 mg tbl. [Zentiva, Praha, ČR]) denně a prodělali iCMP min. půl roku před zařazením do studie. Podmínkou byl EKG verifikovaný sinusový rytmus a echokardiografickým vyšetřením vyloučení všech diagnóz uvedených níže. Diagnóza iCMP byla v akutním stadiu potvrzena klinickým nálezem a vyšetřením CT nebo MR.
Vylučovací kritéria
Do studie nebyli zařazeni pacienti s kardiovaskulární příhodou, k níž došlo před méně než půl rokem, pacienti po aortokoronárním bypassu, s kardiostimulátorem a s fibrilací síní, pacienti s echokardiograficky prokázanou systolickou dysfunkcí levé komory srdeční, endokarditidou, změněnými či umělými chlopněmi, pravolevými srdečními zkraty, myxomem a aneuryzmatem síňového septa. Dále nebyli zařazeni pacienti s jaterní cirhózou, maligním onemocněním, tromboembolickou chorobou, chronickým zánětlivým onemocněním a akutní infekcí. Rovněž nebyli zařazeni nemocní s kombinovanou antiagregační nebo antikoagulační terapií, pacienti s patologickými hodnotami leukocytů, trombocytů, erytrocytů a sérovým kreatininem mimo referenční rozmezí a s elevací C-reaktivního proteinu (CRP). Vyřazeni byli i pacienti, kteří užívali v posledních 14 dnech nesteroidní antiflogistika nebo inhibitory protonové pumpy.
Charakteristika souboru
Do souboru jsme zařadili celkem 106 pacientů, průměrný věk byl 66,5 let, obě pohlaví byla podobně zastoupena. U všech jsme provedli podrobné klinické a laboratorní vyšetření, vč. vyšetření 11-dTXB2 a kyseliny salicylové.
V tab. 1 – 4 jsou uvedeny přítomné rizikové faktory kardiovaskulárních chorob, biometrické ukazatele a laboratorní parametry, podtyp iCMP a ultrasonografický nález na extrakraniálním průběhu karotických tepen.
Tab. 1. Charakteristika souboru, klinické ukazatele, kardiovaskulární rizikové faktory. 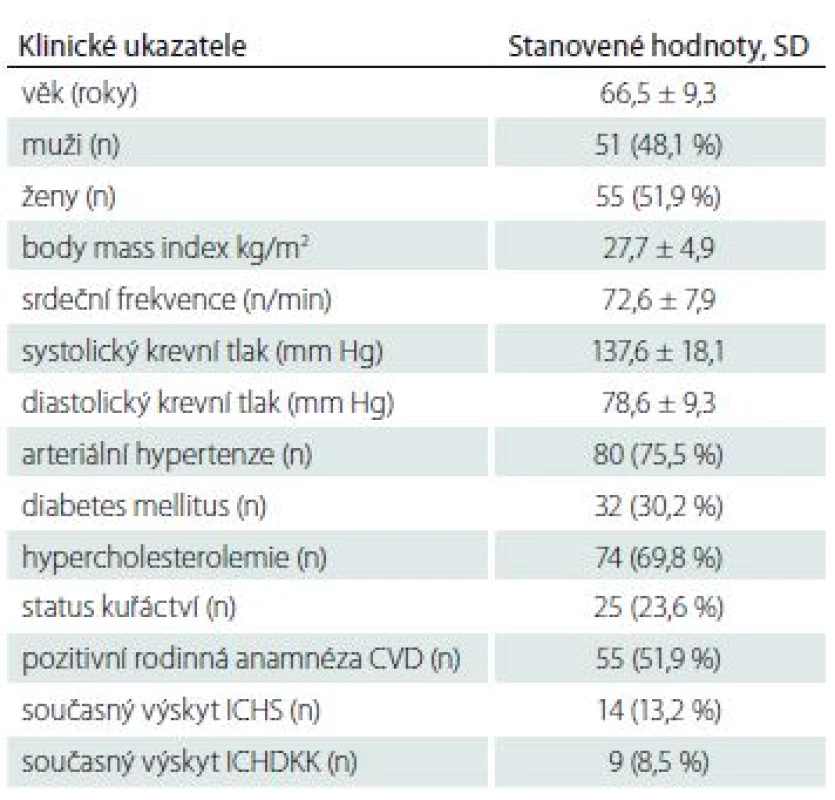
CVD – kardiovaskulární choroby; ICHDKK – ischemická choroba dolních končetin; ICHS – ischemická choroba srdeční; n – počet pacientů; SD – směrodatná odchylka Tab. 2. Charakteristika souboru podle stupně aterosklerotických změn na extrakraniálním průběhu karotid 
n – počet pacientů Tab. 3. Charakteristika souboru z pohledu sledovaných rutinních laboratorních parametrů, celý soubor n = 106. 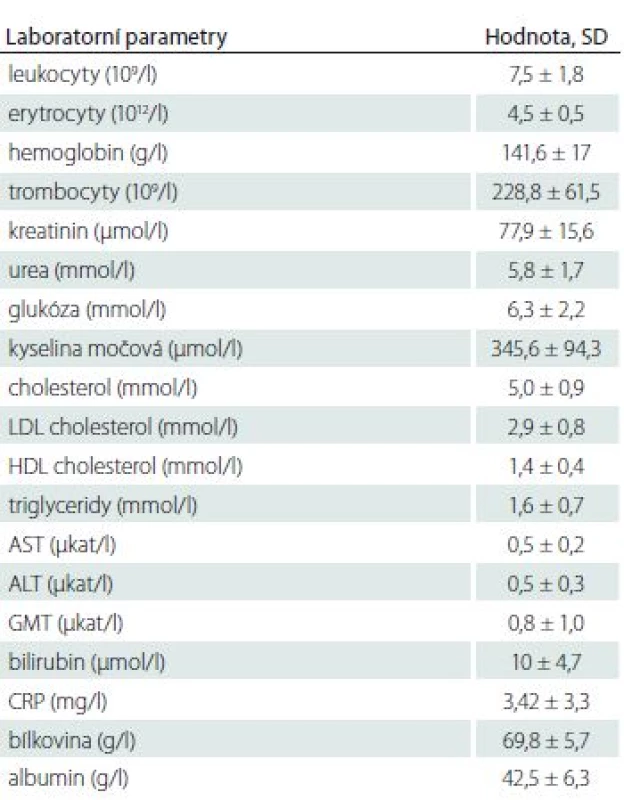
ALT – alaninaminotransferáza; AST – aspartátaminotransferáza; CRP – C-reaktivní protein; GMT – γ-glutamyltransferáza; SD – směrodatná odchylka Tab. 4. Charakteristika souboru podle typu a lokalizace CMP. 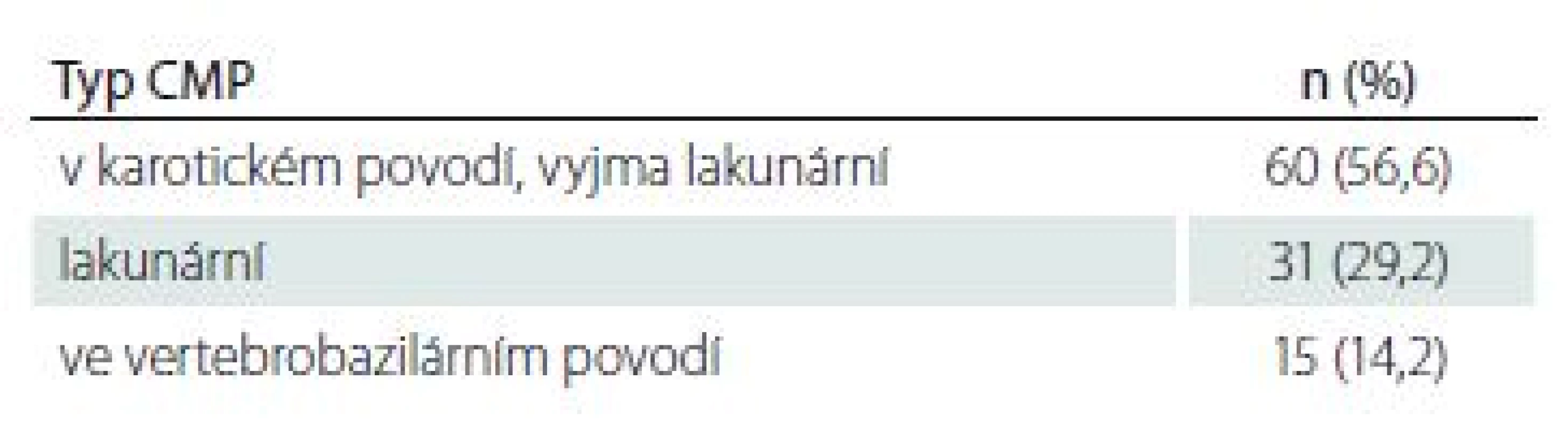
Vyšetření 11-dehydrotromboxanu B2
Vzorky krve byly odebírány do zkumavek BD Vacutainer* Clot Activator tube (Becton, Dickinson and Company, Franklin Lakes, NJ, USA) 2 h po požití 100 mg ASA. Po odběru byl vzorek inkubován při teplotě 37 °C po dobu 1 h a následně byl centrifugován při otáčkách 1 000 g po dobu 15 min. Po odlití séra jsme provedli vyšetření koncentrace 11-dTXB2, a to metodou EIA za použití kitů Cayman Chemicals (Cayman Europe, Tallin, Estonsko) a Neogen (Neogen Corporation, Lexington, KY, USA). Na základě vyšetření kontrolní skupiny pacientů před podáním ASA a po něm byla v naší laboratoři určena horní hranice pro účinnou supresi 11-dTXB2 v séru 200 pg/ ml (průměr +2 SD). Koncentrace 11-dTXB2 v plazmě po podání ASA se pohybovaly kolem 100 pg/ ml [14,15].
Ověření compliance
Compliance byla ověřena vyšetřením koncentrace ASA v plazmě metodou vysoce účinné kapalinové chromatografie s fluorescenční detekcí, jež byla publikována a podrobně popsána jinde [16].
Statistické metody
Ke zpracování jsme využili parametrické a neparametrické testy. Použili jsme t-test k porovnání průměrů dvou skupin pro data, která mají Gaussovo rozložení. Pro ostatní data byl použit dvouvýběrový Wilcoxonův test. Kontingenční tabulky jsme pak použili ke zjištění závislosti mezi dvěma kvantitativními veličinami. Dále byl aplikován chí-kvadrát test ke zhodnocení významnosti rozdílů relativních četností mezi skupinami. Všechny testy byly dvoustranné a byla zvolena 5% hladina významnosti. Pro analýzu dat byl použit statistický software SYSTAT 10 (Systat Software, Inc. San Jose, CA, USA).
Výsledky
Compliance
Hodnoty ASA v plazmě se pohybovaly v rozmezí 1,0 až 4,3 µg/ ml a potvrdily užívání ASA u všech pacientů.
Měření sérových koncentrací 11-dTXB2
U většiny pacientů byly sérové koncentrace 11-dTXB2 dobře měřitelné, ale u 10 (9,4 %) pacientů byly suprimované hodnoty pod detekčním limitem použitého setu.
Ze 106 vyšetřených pacientů mělo účinnou supresi tvorby tromboxanu 76 (71,7 %) nemocných. Průměrná koncentrace 11-dTXB2 ve skupině nemocných s účinnou supresí byla 69,9 ± 59,6 pg/ ml. Neúčinnou supresi (tj. odpovídající méně než 95 %) tvorby 11-dTXB2 jsme detekovali u 30 (28,3 %) nemocných. Tato skupina měla průměrnou koncentraci 11-dTXB2 508 ± 445 pg/ ml (tab. 5). Zdánlivě se jedná o relativně velkou skupinu pacientů, ale při bližším zkoumání (obr. 1) zjistíme, že u dalších 24 pacientů byla suprese tromboxanu relativně vysoká a pohybovala se v rozmezí 80 – 94,9 %. Jen u šesti pacientů byly hodnoty 11-dTXB2 vyšší než 800 pg/ ml.
Tab. 5. Průměrná měřená koncentrace sérového 11-dehydrotromboxanu B2 (11-dTXB2). 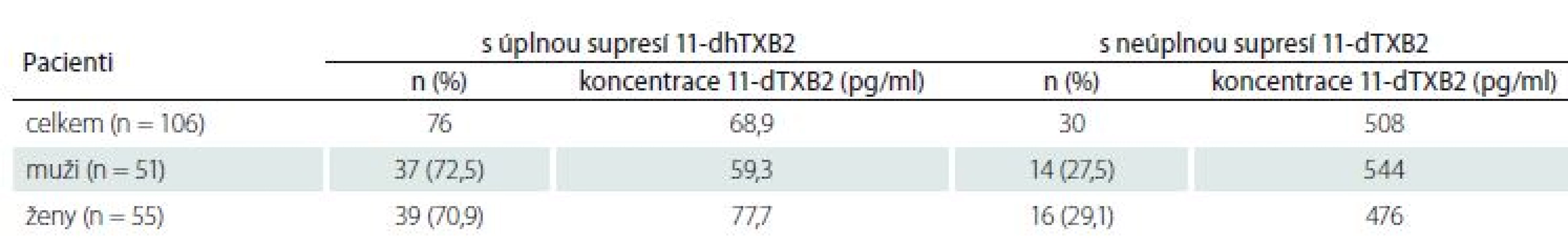
n – počet pacientů Obr. 1. Sérová koncentrace 11-dehydrotromboxanu B2 (pg/ml).
Fig. 1. Serum 11-dehydrothromboxane B2 levels (pg/ml).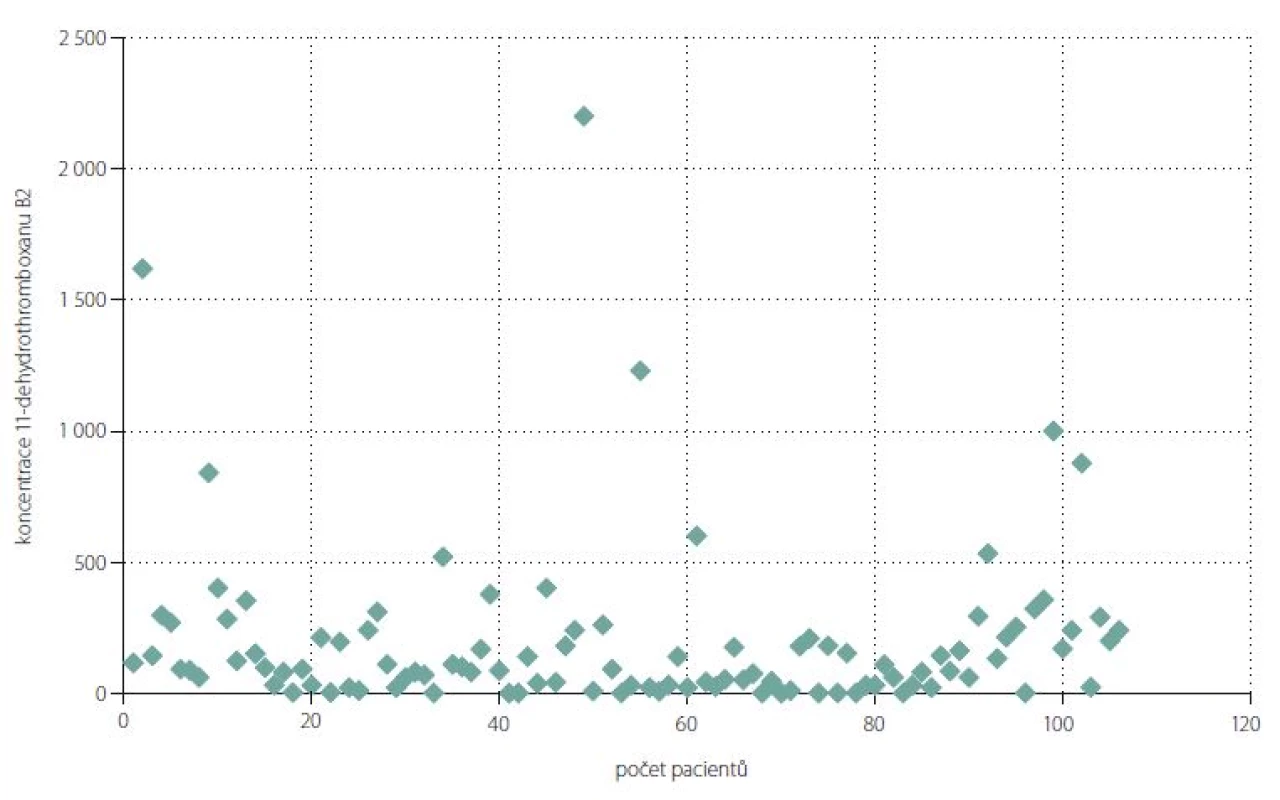
Porovnání souborů pacientů s úplnou a neúplnou supresí 11-dTXB2
Při porovnání pacientů byla prokázána statisticky významná asociace mezi vyšší koncentrací tromboxanu a vyšším body mass indexem, zvýšenou koncentrací kyseliny močové, celkového a LDL cholesterolu. Pacienti s nedostatečnou supresí tromboxanu měli i vyšší CRP, rozdíl nebyl statisticky významný (3,8/ 3,2 mg/ l). Patrný byl také vyšší výskyt nedostatečné suprese 11-dTXB2 u diabetiků, i když nebyl statisticky významný (tab. 6, 7).
Tab. 6. Srovnání pacientů s úplnou a neúplnou supresí 11-dehydrotromboxanu B2 (11-dTXB2) z pohledu klinických parametrů. 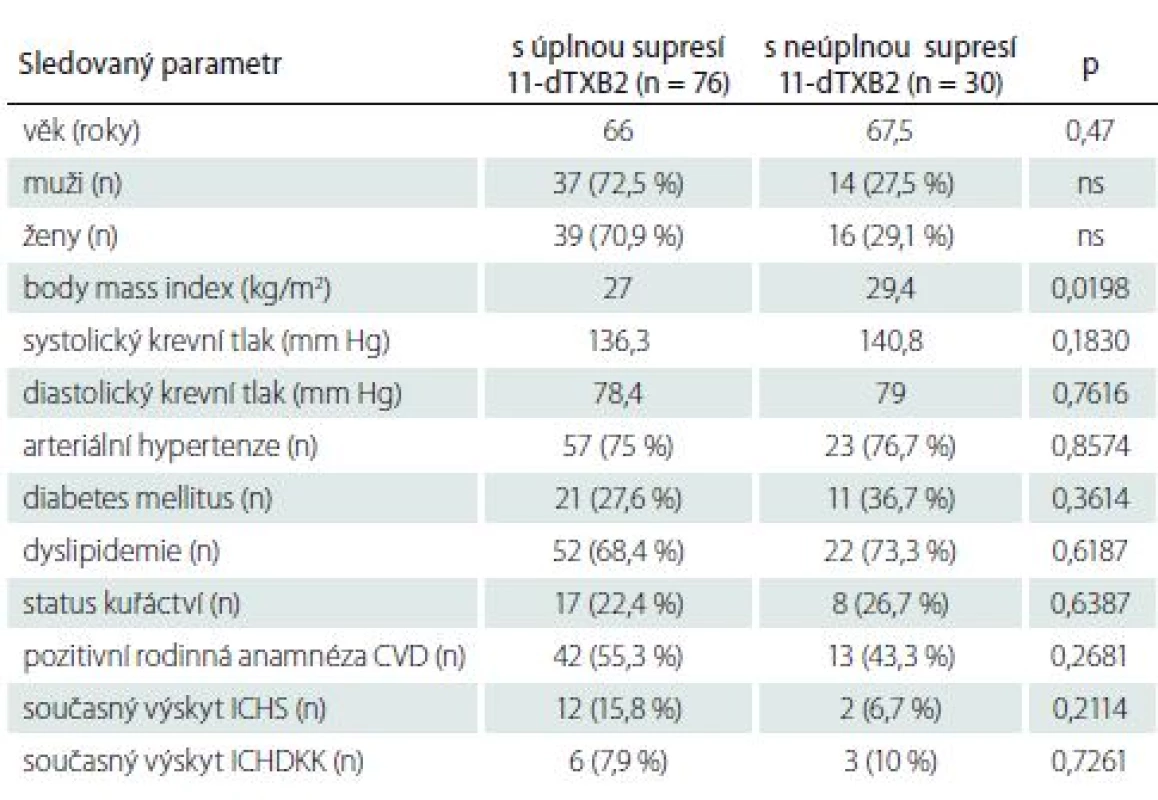
CVD – kardiovaskulární choroby; ICHDKK – ischemická choroba dolních končetin; ICHS – ischemická choroba srdeční; n – počet pacientů; ns – není signifi kantní Tab. 7. Srovnání laboratorních parametrů u pacientů s úplnou a neúplnou supresí 11-dehydrotromboxanu B2 (11-dTXB2). 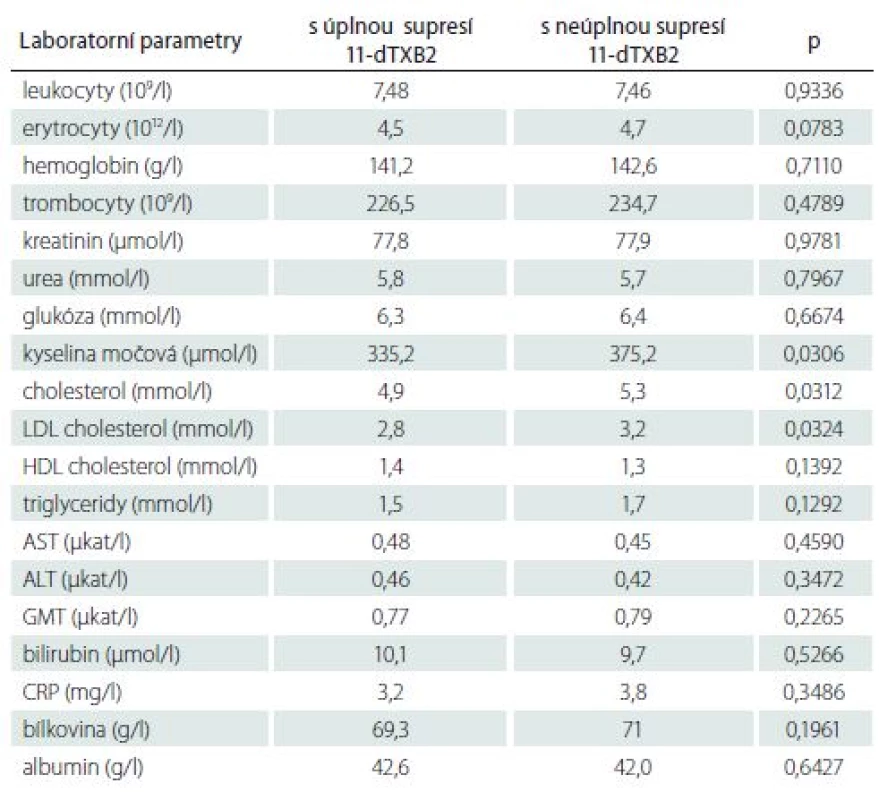
ALT – alaninaminotransferáza; AST – aspartátaminotransferáza; CRP – C-reaktivní protein; GMT – γ-glutamyltransferáza Efekt zvýšené dávky ASA ze 100 mg na 300 mg denně na supresi 11 - dTXB2
U devíti pacientů s nedostatečnou supresí tvorby 11-dTXB2 při terapii 100 mg ASA jsme zvýšili dávku ASA na 300 mg denně a následně provedli opětovné stanovení koncentrace 11-dTXB2 v séru. U osmi z nich jsme prokázali větší supresi 11-dTXB2 než po dávce 100 mg, ale jen u čtyř pacientů jsme zvýšením dávky dosáhli požadované suprese tvorby 11-dTXB2.
Diskuze
Sérové koncentrace 11-dTXB2 jsou uvedeným postupem s hodinovou inkubací velmi dobře měřitelné. ASA však vyvolává mohutnou supresi tromboxanu a v našem souboru byly u 9 % pacientů suprimované hodnoty již pod detekčním limitem použitého setu. Přes určité výhody stanovení 11-dTXB2 si myslíme, že vhodnějším parametrem vyšetřování je sérová koncentrace tromboxanu B2, se kterým jsou i větší dosavadní zkušenosti.
Také nejnovější práce prokazují, že nedostatečná suprese tromboxanu ASA představuje zvýšené kardiovaskulární riziko [17,18].
Zatímco u zdravých dobrovolníků malé dávky ASA vedou k téměř kompletní inhibici tvorby tromboxanu B2 (98 %) [19], v souborech pacientů je to mnohem méně [20,21]. Sérové koncentrace tromboxanu může ovlivňovat celá řada faktorů [22], které jsme se snažili eliminovat přísnými zařazovacími kritérii. U pacientů s iCMP přetrvávají zvýšené hodnoty tromboxanu až několik měsíců, a proto jsme je v našem souboru vyšetřovali nejdřív až za půl roku po příhodě [23]. Za nejčastější příčinu neefektivní suprese tromboxanu je však pokládána noncompliance k léčbě. Proto jsme v našem souboru potvrdili 100% adherenci k léčbě laboratorním ověřením. V takto selektovaném souboru pacientů po iCMP jsme prokázali, že ASA u 100 z nich (94,3 %) suprimovala sérové koncentrace 11-dTXB2 na 80% úrovni a u 76 (72 %) na požadované 95% úrovni a více. Menší supresi tromboxanu vysvětlujeme relativně častým zastoupením pacientů s arteriální hypertenzí, cukrovkou, hypercholesterolemií a kuřáků. Menší účinnost ASA u pacientů s diabetem, resp. metabolickým syndromem je dobře známa [24]. Také v našem souboru byla nedostatečná suprese tromboxanu zaznamenána více než u jedné třetiny diabetiků (34 %). Diabetici mají ve srovnání s nediabetickou populací též vyšší riziko iCMP, která je provázena vyšší úmrtností a vyšším rizikem recidiv [25].
V našem souboru (vzhledem k vylučovacím kritériím) byli více zastoupeni pacienti s lakunárním typem iktu (29 %), u kterých nebyl prokázán lepší efekt jiných antiagregancií vč. duálních kombinací v porovnání s ASA v monoterapii [26]. Menší účinnost ASA u diabetu mellitu 2. typu vysvětlují někteří autoři vlivem oxidativního stresu [27]. Zcela převratná je práce čínských autorů [28], kteří zjistili, že pacienti s diabetem mellitem 2. typu mají 4× vyšší expresi receptoru P2Y12 v porovnání se zdravými jedinci, což přispívá k hyperaktivitě destiček a snižuje účinnost antiagregační léčby.
Při porovnávání skupiny s účinnou a nedostatečnou supresí tromboxanu jsme zjistili statisticky významnou asociaci mezi nižším stupněm suprese tromboxanu a vyšším body mass indexem, hypercholesterolemií a hyperurikemií. Zatímco u obezity a hypercholesterolemie jde o nález v souladu s literárními údaji, souvislost s hyperurikemií je velmi zajímavá. Dnes se pokládá za nezávislý rizikový faktor vzniku velkých kardiovaskulárních příhod [29]. Hyperurikemie středně zvyšuje riziko vzniku CMP i mortality [30]. Námi prokázaná asociace mezi zvýšenou koncentrací kyseliny močové a nedostatečnou supresí 11-dTXB2 je dalším pomocným argumentem do diskuze o léčbě asymptomatické hyperurikemie. Na rozdíl od USA a Evropy se v některých státech, např. v Japonsku a Číně, léčí i asymptomatická hyperurikemie v případě přítomnosti dalších kardiovaskulárních rizikových faktorů a chorob již od hladiny 476 μmol/ l [31]. V některých pracích léčba hyperurikemie snižovala výskyt srdečního infarktu, iCMP i celkovou mortalitu [32].
Mezi faktory, které mohly ovlivňovat hodnoty 11dTXB2, patří i současně užívané léky. Některé inhibitory angiotenzin konvertujícího enzymu, statiny a selektivní inhibitory zpětného vychytávání serotininu mohou hodnoty tromboxanu lehce snižovat, inhibitory protonové pumpy naopak zvyšovat [33,34]. Nesteroidní antirevmatika snižují antiagregační efekt ASA reverzibilní inhibicí cyklooxygenázy 1 [35]. Užívání inhibitorů protonové pumpy i nesteroidních antirevmatik bylo kontraindikací zařazení do studie, z ostatních skupin užívali pacienti nejčastěji ACE inhibitory a statiny.
Efekt ASA také závisí na velikosti dávky, frekvenci podávání i způsobu aplikace. Při vyšší dávce dochází k větší supresi tromboxanu [36]. Proto jsme u devíti našich pacientů s nedostatečnou supresí 11-dTXB2 podali vyšší dávku ASA (300 mg), jež je stále ještě pokládána za nízkou dávku. U osmi z nich došlo k dalšímu poklesu tromboxanu, ale požadovanou supresi jsme dosáhli jen u čtyř z nich. Vysvětlení nabízí nejnovější poznatky o mimodestičkových zdrojích tromboxanu, které dokáží produkovat monocyty/ makrofágy, endotel i svalové buňky cév cestou COX-2. Pro tento důvod by svědčily i vyšší hodnoty CRP v této skupině. Lze se domnívat, že i tento mimodestičkový tromboxan představuje pro pacienta zvýšené kardiovaskulární riziko. Pacienti po aortokoronárním bypassu s nedostatečně suprimovanými hodnotami tromboxanu (hodnocený jako mimodestičkový) měli horší vyhlídky vč. smrti po dobu sledování 5 let [37]. ASA má také příznivý vliv na endotel a mohla by nepřímo snižovat produkci tromboxanu v endoteliálních buňkách [38].
V současnosti je známo kolem 50 různých receptorů, jejichž blokádou zabráníme funkci destiček, přičemž v klinické praxi nyní využíváme dva. Dnes víme, že ASA dokáže blokovat jen jednu z několika cest aktivace destiček, a proto zcela nedokáže zabránit vzniku kardiovaskulárních příhod, podobně jako i jiná antiagregancia.
Jaká je její pozice v antiagregační léčbě v sekundární prevenci iCMP v současnosti?
Duální léčba (ASA + klopidogrel) výrazně zvyšuje riziko hemoragických komplikací. Na základě podrobného hodnocení výsledků studií CHANCE a POINT [39,40] doporučují odborníci pro získání optimálního poměru riziko/přínos omezení duální léčby na 3 – 4 týdny od vzniku příhody a dále pokračovat v monoterapii ASA. Inhibitory receptoru P2Y12 nemají žádný vliv na aktivitu tromboxanu, a proto k jeho supresi je nutno podávat ASA. Podpůrným argumentem pro dlouhodobé použití ASA může být i její protinádorový účinek, který se v současnosti intenzivně studuje.
Klady a zápory studie
Za silnou stránku studie pokládáme fakt, že:
- a) vyšetření jsme provedli v relativně homogenním souboru pacientů, kdy jsme minimalizovali možnost výskytu embolizačních příčin iCMP;
- b) přísnými zařazovacími a vylučovacími kritérii jsme také eliminovali faktory, které by mohly ovlivňovat hodnoty vyšetřovaného 11-dTXB2;
- c) adherence k léčbě byla potvrzena laboratorním vyšetřením;
- d) za nejdůležitější však pokládáme důkaz, že i v takto selektovaném souboru léčba ASA nevedla k dostatečné supresi tromboxanu u velké části pacientů.
Za omezení v naší studii považujeme skutečnost, že šlo o jednorázové a neopakované vyšetření tromboxanu, podobně jako u většiny provedených klinických studií.
Závěr
U pacientů po iCMP s ověřenou compliancí a minimalizací embolizačních příhod ASA výrazně suprimovala tvorbu tromboxanu téměř u všech pacientů. Požadovanou 95% supresi tromboxanu však nedosáhla více než čtvrtina pacientů a 34 % diabetiků. V souladu s nejnovějšími poznatky je pravděpodobné, že zdánlivě nedostatečná suprese tromboxanu je způsobena produkcí tromboxanu z mimodestičkových zdrojů.
Autoři prohlašují, že studie na lidských subjektech popsaná v manuskriptu byla provedena v souladu s etickými standardy příslušné komise odpovědné za provádění klinických studií a Helsinskou deklarací z roku 1975, revidovanou v roce 2000, a veškerý výzkum s prací spojený je v souladu s platnými zákony ČR. Autoři nejsou v žádném konfliktu zájmů.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Tomáš Adámek
Interní oddělení
Thomayerova nemocnice
Vídeňská 800
140 59 Praha 4
e-mail: tomas.adamek@ftn.cz
Přijato k recenzi: 1. 10. 2018
Přijato do tisku: 18. 12. 2018
Zdroje
1. Oza R, Rundell K, Garcellano M. Recurrent ischemic stroke: strategies for prevention. Am Fam Physician 2017; 96(7): 436 – 440.
2. Rothwell PM, Algra A, Chen Z et al. Effects of aspirin on risk and severity of early recurrent stroke after transient ischaemic attack and ischaemic stroke:time-course analysis of randomised trials. Lancet 2016; 388(10042): 365 – 375. doi: 10.1016/ S0140-6736(16)30468-8.
3. Kernan WN, Ovbiagele B, Black HR et al. Guidelines for the prevention of stroke in patients with stroke and transient ischemic attack. A guideline for healthcare professionals from the American Heart Association/ American Stroke Association. Stroke 2014; 45(7): 2160 – 2236. doi: 10.1161/ STR.0000000000000024.
4. Cattaneo M. The clinical relevance of response vari-ability to antiplatelet therapy. Hematology Am Soc Hematol Educ Program 2011; 2011 : 70 – 75. doi: 10.1182/ asheducation-2011.1.70.
5. Committee for Proprietary Medicinal Products. Position paper on the regulatory requirements for the authorization of low-dose modified release ASA formulations in the secondary prevention of cardiovascular events. [online] EMEA: London 2002. Available from URL: http:/ / www.ema.europa.eu/ docs/ en_GB/ document_library/ Scientific_guideline/ 2009/ 09/ WC500003340.pdf.
6. Kuliczkowski W, Witkowski A, Polonski L et al. Interindividual variability in the response to oral antiplatelet drugs: a position paper of the Working Group on antiplatelet drugs resistance appointed by the Section of Cardiovascular Interventions of the Polish Cardiac Society, endorsed by the Working Group on Thrombosis of the European Society of Cardiology. Eur Heart J 2009; 30(4): 426 – 435. doi: 10.1093/ eurheartj/ ehn562.
7. Santos MT, Moscardó A, Latorre A et al. The time between venepuncture and blood incubation is critical for serum thromboxane B2 synthesis. Platelets 2017; 28(3): 310 – 311. doi: 10.1080/ 09537104.2016.1246719.
8. Brun C, Daali Y, Combescure C et al. Aspirin response: differences in serum thromboxane B2 levels between clinical studies. Platelets 2016; 27(3): 196 – 202. doi: 10.3109/ 09537104.2015.1072147.
9. van Diemen JJ, Fuijkschot WW, Spit K et al. Influence of pre-analytical time and temperature conditions on serum thromboxane B2 levels. Thromb Res 2018; 163 : 1 – 5. doi: 10.1016/ j.thromres.2018.01.010.
10. Paluch Z, Jedlicková V, Skibova J et al. The effectiveness of antiplatelet treatment with aspirin in polymorbid patients. Int Angiol 2007; 26(3): 206 – 212.
11. Cattaneo M. Letter by Cattaneo regarding article“Incomplete inhibition of thromboxane biosynthesis by acetylsalicylic acid: determinants and effect on cardiovascular risk“. Circulation 2009; 119(24): e594. doi: 10.1161/ CIRCULATIONAHA.108.838888.
12. Adámek T, Paluch Z, Alušík Š. Úskalí měření tromboxanů v klinické praxi. Chem Listy. In press 2018.
13. Eikelboom JW, Hirsh J, Weitz JI et al. Aspirin-resistant thromboxane biosynthesis and the risk of myocardial infarction, stroke, or cardiovascular death in patients at high risk for cardiovascular events. Circulation 2002; 105(14): 1650 – 1655.
14. Sadilkova L, Paluch Z, Mottlova J et al. The purification is not crucial in EIA measurement of thromboxane B2 and 11-dehydrothromboxane B2 in human plasma. Clin Lab 2012; 58(1 – 2): 177 – 183.
15. Sadilkova L, Paluch Z, Mottlova et al. The effect of selected pre-analytical phase variables on plasma thromboxane A2 measurements in humans. Int J Lab Hematol 2013; 35(1): 92 – 100. doi: 10.1111/ j.1751-553X.2012.01458.x.
16. Alusik S, Jedlickova V, Paluch Z et al. Determination of plasma salicylic acid levels to assess compliance to acetylsalicylic acid therapy. Chem Listy 2010; 104 : 803 – 806.
17. Cheng X, Xie NC, Xu HL et al. Biochemical aspirin resistance is associated with increased stroke severity and infarct volumes in ischemic stroke patients. Oncotarget 2017; 8(44): 77086 – 77095. doi: 10.18632/ oncotarget.20356.
18. Zhang N, Wang Z, Zhou L. Aspirin resistance are associated with long-term recurrent stroke events after ischaemic stroke. Brain Res Bull 2017; 134 : 205 – 210. doi: 10.1016/ j.brainresbull.2017.08.012.
19. Patrono C, Ciabattoni G, Pinca E et al. Low dose of aspirin and inhibition of thromboxane B2 production in healthy subjects. Thromb Res 1980; 17(3 – 4): 317 – 327.
20. Eikelboom JW, Hankey GJ, Thom J et al. Incomplete inhibition of thromboxane biosynthesis by acetylsalicylic acid: determinants and effect on cardiovascular risk. Circulation 2008; 118(17): 1705 – 1712. doi: 10.1161/ CIRCULATIONAHA.108.768283.
21. Lopez RL, Guyer KE, Torre IG et al. Platelet thromboxane (11-dehydro-Thromboxane B2) and aspirin response in patients with diabetes and coronary artery disease. World J Diabetes 2014; 5(2): 115 – 127. doi: 10.4239/ wjd.v5.i2.115.
22. Rocca B, Dragani A, Pagliaccia F. Identifying determinants of variability to tailor aspiirin therapy. Expert Rev Cardiovasc Ther 2013; 11(3): 365 – 379. doi: 10.1586/ erc.12.144.
23. Kooten F, Ciabattoni G, Koudstaal PJ et al. Increased platelet activation in the chronic phase after cerebral ischemia and intracerebral hemorrhage. Stroke 1999; 30(3): 546 – 549.
24. Smith JP, Haddad EV, Taylor MB et al. Suboptimal inhibition of platelet cyclooxygenase-1 by aspirin in metabolic syndrome. Hypertension 2012; 59(3): 719 – 725. doi: 10.1161/ HYPERTENSIONAHA.111.181404.
25. Chen W, Pan Y, Jing J et al. Recurrent stroke in minor ischemic stroke or transient ischemic attack with metabolic syndrome and/ or diabetes mellitus. J Am Heart Assoc 2017; 6(6): pii: e005446. doi: 10.1161/ JAHA.116.005446.
26. Kwok C, Shoamanesh A, Copley H et al. Efficacy of antiplatelet therapy in secondary prevention following lacunar stroke: pooled analysis of randomized trials. Stroke 2015; 46(4): 1014 – 1023. doi: 10.1161/ STROKEAHA.114.008422.
27. Santilli F, Lapenna D, La Barbara S et al. Oxidative stress-related mechanisms affecting response to aspirin in diabetes mellitus. Free Radic Biol Med 2015; 80 : 101 – 110. doi: 10.1016/ j.freeradbiomed.2014.12.010.
28. Hu L, Chang L, Zhang Y et al. Platelets express activated P2Y12 receptor in patients with diabetes mellitus. Circulation 2017; 136(9): 817 – 833. doi: 10.1161/ CIRCULATIONAHA.116.026995.
29. Capuano V, Marchese F, Capuano R et al. Hyperuricemia as an independent risk factor for major cardiovascular events:a 10-year cohort study from Southern Italy. J Cardiovasc Med (Hagerstown) 2017; 18(3): 159 – 164. doi: 10.2459/ JCM.0000000000000347.
30. Li M, Hou W, Zhang X et al. Hyperuricemia and risk of stroke: a systematic review and meta-analysis of prospective studies. Atherosclerosis 2014; 232(2): 265 – 270. doi: 10.1016/ j.atherosclerosis.2013.11.051.
31. Guo L. Interpretation of the Chinese expert consensus: recommendations for diagnosis and treatment of asymptomatic hyperuricemia complicated with cardiovascular diseases. J Transl Intern Med 2014; 2(2): 93 – 96.
32. Larsen KS, Pottegard A, Lindegaard HM et al. Effect of allopurinol on cardiovascular outcomes in hyperuricemic patients: a cohort study. Am J Med 2016; 129(3): 299 – 306. doi: 10.1016/ j.amjmed.2015.11.003.
33. Blinden K, Singla A, Gesheff M et al. Statin therapy and thromboxane generation in patients with coronary artery disease treated with high-dose aspirin. Thromb Haemost 2014; 112(2): 323 – 331. doi: 10.1160/ TH14-01-0094.
34. Würtz M, Grove EL, Kristensen SD et al. The antiplatelet effect of aspirin is reduced by proton pump inhibitors in patients with coronary artery disease. Heart 2010; 96(5): 368 – 371. doi: 10.1136/ hrt.2009.181107.
35. Brune K, Patrignani P. New insights into the use of currently available non-steroidal anti-inflammatory drugs. J Pain Res 2015; 8 : 105 – 118. doi: 10.2147/ JPR.S75160.
36. Gurbel PA, Bliden KP, DiChiara J et al. Evaluation of dose - related effects of aspirin on platelet function. Results from the Aspirin-Induced Platelet Effect (ASPECT) study. Circulation 2007; 115(25): 3156 – 3164. doi: 10.1161/ CIRCULATIONAHA.106.675587.
37. Kakorous N, Gluckman T, Conte JV et al. Differential impact of serial measurement of nonplatelet thromboxane generation on long-term outcome after cardiac surgery. J Am Heart Assoc 2017; 6(11): e007486. doi: 10.1161/ JAHA.117.007486.
38. Dzeshka MS, Shantsila A, Lip GY. Effects of aspirin on endothelial function and hypertension. Curr Hypertens Rep 2016; 18(11): 83. doi: 10.1007/ s11906-016-0688-8.
39. Wang Y, Wang Y, Zhao X et al. CHANCE Investigators. Clopidogrel with aspirin in acute minor stroke or transient ischemic attack. N Engl J Med 2013; 369(1): 11 – 19. doi: 10.1056/ NEJMoa1215340.
40. Johnston SC, Easton JD, Farrant M et al. On behalf of the POINT Investigators. Clopidogrel and aspirin in acute ischemic stroke and high-risk TIA. N Engl J Med 2018; 379(3): 215 – 225. doi: 10.1056/ NEJMoa1800410.Štítky
Dětská neurologie Neurochirurgie Neurologie
Článek vyšel v časopiseČeská a slovenská neurologie a neurochirurgie
Nejčtenější tento týden
2019 Číslo 1- Magnosolv a jeho využití v neurologii
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Zolpidem může mít širší spektrum účinků, než jsme se doposud domnívali, a mnohdy i překvapivé
- Nejčastější nežádoucí účinky venlafaxinu během terapie odeznívají
-
Všechny články tohoto čísla
- Genetika neurodegenerativních demencí v deseti bodech – co může neurolog očekávat od molekulárního genetika?
- Lehká mozková poranění – konsenzuální odborné stanovisko České neurologické společnosti ČLS JEP
- Analýza dat v neurologii LXXIII. Problematika interpretace Pearsonova korelačního koeficientu
- Vieme dobre diagnostikovať dyskinetickú formu DMO? ÁNO
- Umíme dobře diagnostikovat dyskinetickou formu DMO? NE
- Umíme dobře diagnostikovat dyskinetickou formu DMO?
- Sub signum coma – súčasný pohľad na chronické poruchy vedomia
- Chronický subdurální hematom
- Editorial
- Iatrogenizácia pacientov so psychogénnymi neepileptickými záchvatmi – možné východiská
- Praktické užití a indikace transkraniální stimulace stejnosměrným proudem
- Poděkování recenzentům
- Transkraniální magnetická stimulace u hraniční poruchy osobnosti – série kazuistik
- Změny v expresi TNFα a microRNA-15b u experimentálního modelu subarachnoidálního krvácení
- Raschova analýza dotazníku Q-LES-Q-SF na podkladě odpovědí pacientů s neuropatickou bolestí
- Oligoklonální IgG a volné lehké řetězce – srovnání izoelektrické fokusace v agarózovém a polyakrylamidovém gelu
- Evokované potenciály vyvolané kontaktním teplem – vliv fyziologických proměnných
- Ketogenní dieta – účinná nefarmakologická léčba dětské a adolescentní epilepsie
- Laboratorní účinnost kyseliny acetylsalicylové v sekundární prevenci ischemických cévních mozkových příhod
- Parietální atrofie na magnetické rezonanci mozku u Alzheimerovy nemoci s pozdním začátkem
- Nové možnosti ultrazvuku v predikci výskytu bolesti dolní části zad u dospívajících mužů – pilotní studie
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Lehká mozková poranění – konsenzuální odborné stanovisko České neurologické společnosti ČLS JEP
- Chronický subdurální hematom
- Oligoklonální IgG a volné lehké řetězce – srovnání izoelektrické fokusace v agarózovém a polyakrylamidovém gelu
- Ketogenní dieta – účinná nefarmakologická léčba dětské a adolescentní epilepsie
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



