-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Myxovirus resistance protein A v terapii interferony-β u pacientů s roztroušenou sklerózou a algoritmus sledování účinnosti léčby
Myxovirus Resistance Protein A in Interferon-β Therapy in Patients with Multiple Sclerosis and Treatment Effectiveness Monitoring Algorithm
Introduction:
Interferon-β (IFNβ) is the first-line treatment for relapsing-remitting multiple sclerosis. Myxovirus resistance protein A (MxA) is considered to be an IFNß bioactivity marker. Responsiveness to the IFNß treatment may be reduced by neutralizing antibodies (NAbs).Material and methods:
We investigated the presence of NAbs and mRNA MxA expression in a group of patients who had started IFNß treatment. mRNA MxA was measured with real-time PCR every three months. MxA induction was performed in patients in whom continuous decline was detected. NAbs were determined using the cytopathic effect method every six months. Patients were regularly observed clinically and with MRI.Results:
119 patients were included, 99 completed the observation period of 24 months. NAbs positivity was observed in 17 patients, mostly in month 12 and 18. NAbs positivity was permanent in ten patients (10%). Nabs titre of 20–100 TRU/ml was associated with a decline in MxA levels under the cut-off in 85% of cases, and in all patients when Nabs titre exceeded 100 TRU/ml. Permanent MxA decline was seen in 19 patients – in all 10 patients with permanent NAbs positivity, in three patients with transitional NAbs positivity and in six patients without NAbs. The MxA induction was insufficient in all permanent NAbs positive patients and in two patients with isolated MxA decrease and without NAbs. MxA decrease preceded NAbs positivity in 40% of cases.Conclusion:
MxA becomes the main laboratory marker of IFNβ efficacy as it can indicate patients at risk of IFNβ efficacy loss, even in situations when patients produce NAbs. MxA induction is necessary to verify IFNβ efficacy.Key words:
interferon-β –MxA induction test – myxovirus resistance protein A – neutralising antibodies – multiple sclerosis
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Autoři: J. Libertínová 1; E. Meluzínová 1; E. Havrdová 2; D. Horáková 2
; I. Kovářová 2; E. Hynčicová 1; P. Lišková 1; E. Houžvičková 1; V. Maťoška 3; M. Zajac 4; A. Tomek 1; M. Bojar 1; P. Marusič 1
Působiště autorů: Neurologická klinika 2. LF UK a FN v Motole, Praha 1; Neurologická klinika a Centrum klinických neurověd, 1. LF UK a VFN v Praze 2; Laboratoř molekulární diagnostiky, Nemocnice Na Homolce, Praha 3; Ústav lékařské mikrobiologie, 2. LF UK a FN v Motole, Praha 4
Vyšlo v časopise: Cesk Slov Neurol N 2016; 79/112(5): 547-551
Kategorie: Původní práce
Souhrn
Úvod:
Interferony-β (IFNβ) patří mezi léky první volby v terapii roztroušené sklerózy. Myxovirus resistance protein A (MxA) je považován za marker účinnosti IFNβ. Odpovídavost na léčbu IFNβ může být snížena přítomností neutralizačních protilátek (NAbs).Soubor a metodika:
Ve skupině pacientů zahajujících léčbu IFNβ jsme po dobu 24 měsíců prospektivně sledovali výskyt NAbs a expresi mRNA MxA. mRNA MxA byla vyšetřována real-time PCR každé tři měsíce, při opakovaném poklesu následoval MxA indukční test. NAbs byly stanovovány každých šest měsíců pomocí metody cytopatického efektu. Pacienti byli pravidelně sledováni klinicky i pomocí MR.Výsledky:
Do sledování bylo zařazeno 119 pacientů, z nichž 99 jej dokončilo. Pozitivita NAbs se objevila u 17 pacientů, nejčastěji v měsíci 12 a 18, u 10 pacientů (10 %) zůstala trvale. Při NAbs v titru 20–100 TRU/ml kleslo MxA pod cut-off v 85 % případů, při titru > 100 TRU/ml ve 100 %. Opakovaný pokles MxA pod cut-off jsme zaznamenali u 19 (19 %) pacientů – u všech pacientů s trvalou NAbs pozitivitou (10 pacientů), u některých s přechodnou pozitivitou NAbs (u třech z pěti takových pacientů) a také u šesti pacientů bez NAbs. MxA indukční test byl nedostatečný u všech pacientů s trvalou NAbs pozitivitou. Nedostatečný byl navíc i u dvou pacientů s poklesem MxA bez NAbs. Pokles MxA předcházel obecně vzniku NAbs ve 40 % případů.Závěr:
MxA se stává hlavním laboratorním ukazatelem účinnosti IFNβ, neboť zachytí pacienty s podezřením na ztrátu účinnosti IFNβ i v případech, kdy NAbs nevznikají. K ověření reaktivity na IFNβ je nezbytné doplnit MxA indukční test.Klíčová slova:
interferon-β – MxA indukční test – myxovirus resistance protein A – neutralizační protilátky – roztroušená sklerózaÚvod
Interferony-β (IFNβ) se řadí mezi léky první volby používané v léčbě pacientů s klinicky izolovaným syndromem (CIS) s vysokým rizikem rozvoje roztroušené sklerózy (RS) a/nebo v léčbě pacientů s relaps-remitentní formou RS (RR RS). Díky jejich imunomodulačnímu účinku dochází ke snížení aktivity zánětlivého procesu v centrálním nervovém systému [1]. Pacienti, kteří neodpovídají na léčbu IFNβ, bývají v literatuře děleni do dvou skupin [2]:
- patogeneticky podmínění nonrespondenti, u nichž léčba IFNβ nedokáže dostatečně ovlivnit vysokou aktivitu onemocnění;
- imuno-farmakologicky podmínění nonrespondenti, u nichž IFNβ selhává v důsledku vzniku neutralizačních protilátek (NAbs), které jeho biologickou účinnost snižují.
Podávání IFNβ může způsobit tvorbu NAbs u 2–42 % pacientů [2].
Myxovirus resistance protein A (MxA), který lze v podobě mRNA MxA detekovat metodou PCR (Polymerase Chain Reaction), je obecně považován za spolehlivý marker účinnosti léčby IFNβ [3]. Při poklesu mRNA MxA pod určitou hodnotu (cut-off) vzniká podezření na ztrátu účinnosti IFNβ [3,4].
Zatím nebylo jednoznačně stanoveno, zda pro sledování účinnosti léčby IFNβ je vhodnějším markerem stanovení hladiny NAbs nebo mRNA MxA [5,6].
Cílem naší práce bylo sledovat dynamiku mRNA MxA po zahájení léčby IFNβ, stanovit vzájemnou souvislost hladiny MxA a klinického vývoje onemocnění a v případě pozitivity NAbs pak časový vztah a souvislost hodnoty MxA s titrem NAbs.
Metodika
Prospektivní, observační, nerandomizovaná studie probíhala v letech 2010–2015 paralelně v RS centrech Neurologické kliniky 1. LF UK a VFN v Praze a Neurologické kliniky 2. LF UK a FN v Motole. Zařazeni byli všichni dosud neléčení pacienti indikovaní k zahájení terapie IFNβ s diagnózou CIS nebo RR RS stanovené dle McDonaldových kritérií [7]. Protokol studie byl schválen etickou komisí FN v Motole a všichni pacienti podepsali při vstupu do studie informovaný souhlas.
Sledování trvalo 24 měsíců. V rámci pravidelných tříměsíčních kontrol byly prováděny standardní krevní odběry (krevní obraz vč. diferenciálu, základní biochemie), byl hodnocen klinický stav a sledovány nežádoucí vedlejší účinky IFNβ.
MxA bylo vyšetřováno v podobě mRNA MxA pomocí real-time PCR každé tři měsíce. Množství detekované mRNA MxA je vztahováno k mRNA genu GAPDH (glyceraldehyd-3-fosfát-dehydrogenáza), jehož exprese na stimulaci IFNβ nereaguje a zůstává stabilní. Výsledný poměr tak umožňuje interindividuální srovnání. Jako hraniční (cut-off) byla stanovena hodnota 160 – ta odpovídá 95. percentilu hodnot mRNA MxA získaných vyšetřením 100 pacientů s RR RS, kteří nebyli léčeni IFNβ [8].
Při opakovaném poklesu hodnot mRNA MxA pod cut-off byl u pacientů při následující kontrole proveden MxA indukční test – po týdenní periodě, kdy pacient IFNβ neaplikuje („wash out“), je odebrána krev před aplikací IFNβ a 4 hod po ní. Za účinnou je terapie považována v případě minimálně trojnásobného vzestupu nebo při hodnotě mRNA MxA nad cut-off ve vzorku odebraném po 4 hod [9].
Hladina NAbs byla stanovena každých šest měsíců pomocí metody cytopatického efektu. Za pozitivní byly považovány hodnoty ≥ 20 TRU/ml.
Vyšetření mozku magnetickou rezonancí (MR) proběhlo v době zahájení sledování (měsíc 0) a dále v měsíci 6, 12 a 24. Všechna vyšetření byla na obou pracovištích prováděna na stejném přístroji – MR 1,5T a ve stejném protokolu – axiální FLAIR, tloušťka řezů 1,5 mm a axiální T1 vážené obrazy, tloušťka řezu 1 mm.
Za klinicky stabilizovaného byl považován pacient bez relapsu, se stabilní hodnotou EDSS. Relapsy byly hodnoceny pomocí „relapse rate“ – četnosti atak za 12 měsíců. K analýze klinického průběhu v rámci celého souboru byla použita veličina „time to next relapse“ vyjadřující dobu, která u jednotlivých pacientů uplynula k první atace. Tíže neurologického postižení byla stanovována dle škály EDSS, za zhoršení byla považována konfirmovaná progrese EDSS, tj. vzestup hodnoty EDSS nejméně o 1 bod (pokud je vstupní EDSS ≥ 1,0) a o 1,5 (pokud je vstupní EDSS = 0) přetrvávající po dobu minimálně 6 měsíců.
Pacient s diagnózou CIS konvertoval do klinicky definitivní RR RS při prokázané klinické aktivitě (výskyt další ataky) či při progresi na MR (nárůst o ≥ 1 nové ložisko).
Statistické analýzy byly provedeny v softwaru IBM SPSS Statistics 22, (IBM Corporation, Armonk, New York, USA). K výpočtu rizika relapsu (Hazard Ratio; HR) byl použit Coxův model poměrných rizik s 95% konfidenčními intervaly, jako čas byl stanoven čas k relapsu. Výsledky byly považovány za statisticky signifikantní v případě p < 0,05.
Výsledky
Do sledování bylo zařazeno celkem 119 pacientů, 43 mužů a 76 žen, v době zařazení medián věku 33 let (rozpětí 19–65 let) s diagnózou CIS (54 pacientů) či RR RS (65 pacientů). Vstupní EDSS se pohybovalo od 0 do 4,5 (medián 2,0).
U 38 pacientů byla zahájena léčba IFNβ-1a i. m., u 42 pacientů IFNβ-1a s.c. a 39 pacientů bylo léčeno preparátem IFNβ-1b s.c. Léčba byla volena individuálně dle klinické rozvahy ošetřujícího lékaře.
Dvouleté sledování dokončilo 99 pacientů, 20 pacientů léčbu předčasně ukončilo, důvody jsou detailně uvedeny v tab. 1.
Tab. 1. Důvody předčasného ukončení léčby IFNβ a doba setrvání ve studii do ukončení sledování u jednotlivých pacientů. 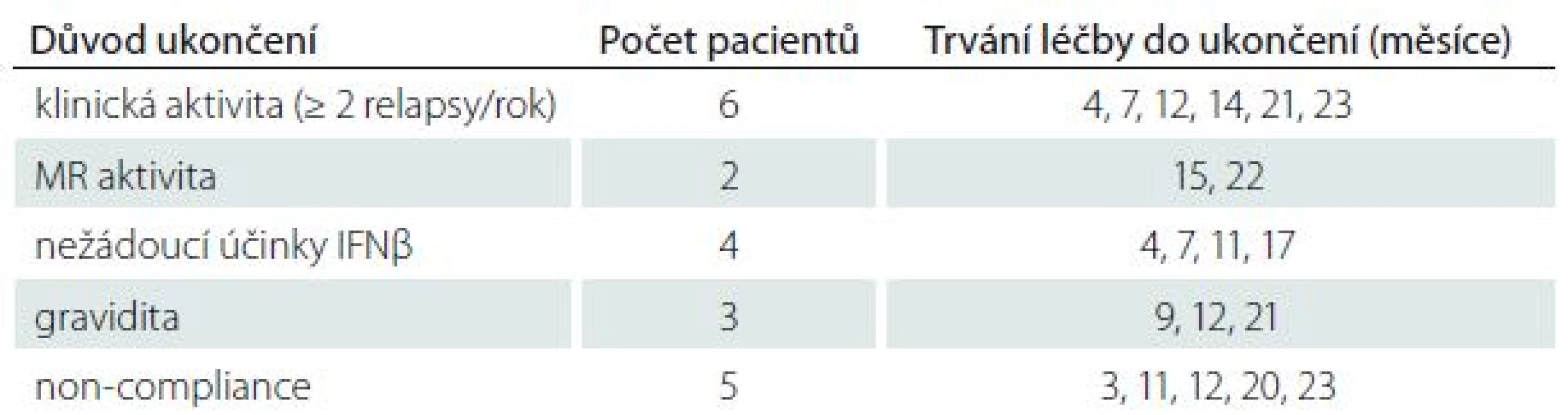
MxA
Hodnoty MxA se před zahájením terapie IFNβ a po třech měsících léčby významně lišily, léčbou IFNβ došlo k nárůstu průměrně o 610,7 (95 % CI 544,8–676,7; p < 0,001).
V průměru zůstávala během léčby IFNβ hodnota MxA trvale nad cut-off hodnotou.
U jednotlivých pacientů jsme však zachytili jak přechodné poklesy (s hodnotou MxA při další kontrole již nad cut-off), tak poklesy trvalé.
K trvalému poklesu MxA pod cut-off hodnotu v průběhu léčby IFNβ došlo u 19 pacientů (19 %, tab. 2). U 10 pacientů s poklesem MxA se současně trvale vyskytovala NAbs pozitivita. U třech pacientů s trvalým poklesem MxA se NAbs objevily jen přechodně. U šesti pacientů se MxA od určité kontroly trvale pohybovalo pod cut-off bez současného výskytu NAbs.
Tab. 2. Podezření na pokles účinnosti IFNβ. Pacienti NAbs+ a/nebo s poklesem MxA pod cut-off hodnotu. 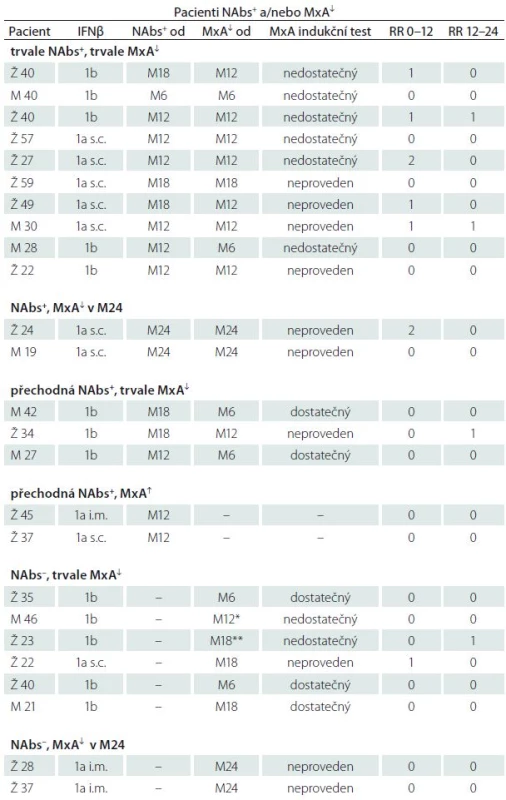
Tabulka zachycuje mj. i časový výskyt a posloupnost vzniku abnormit obou laboratorních parametrů. S ohledem na možnost časového srovnání poklesu MxA s výskytem NAbs jsou zohledněny pouze náběry MxA prováděné paralelně s vyšetřením NAbs, tj. à 6 měsíců. V 1. sloupci je uveden věk a pohlaví v době zahájení studie (Ž – žena, M – muž). Sloupec „NAbs+ od“ udává návštěvu, při které byla poprvé zachycena NAbs pozitivita, nebo od které pak již byla pozitivita trvalá. „MxA↓ od“ udává návštěvu, kdy došlo poprvé k poklesu MxA, nebo od které byl již pokles trvalý. NAbs+ – NAbs pozitivita, NAbs– – NAbs negativita, MxA↓ – pokles MxA pod cut-off hodnotu (< 160), MxA ↑ – MxA nad cut-off (≥ 160), RR – relaps rate. *vyřazen M15 pro progresi na MR, **vyřazena M22 pro progresi na MR. NAbs a jejich vztah k MxA
Pozitivita NAbs se v průběhu studie objevila celkem u 17 pacientů (17 %).
U 10 pacientů (10 %) byla NAbs pozitivita trvalá, tzn. po první detekci přetrvávala i při dalších kontrolách. U všech těchto pacientů došlo i k trvalému poklesu MxA pod cut-off hodnotu (graf 1).
Graf 1. Porovnání hodnoty mRNA MxA v závislosti na NAbs pozitivitě. NAbs pozitivita na ose X: 0 – NAbs negativní, 1 – NAbs pozitivní. 
U pěti pacientů se jednalo o přechodnou NAbs pozitivitu – MxA kleslo pod cut-off hodnotu jen u třech z nich, u dvou bylo dostatečné.
U dvou pacientů se NAbs objevily poprvé až v posledním, 24. měsíci sledování a o jejich přetrvávání v čase se není možné vyjádřit (tab. 2).
Jinými slovy, v případě přítomnosti NAbs v titru 20–100 TRU/ml kleslo MxA pod cut-off v 85 % případů, při titru NAbs > 100 TRU/ml kleslo MxA ve 100 %.
Trvale NAbs pozitivní pacienti byli léčeni IFNβ-1a s.c. (pět pacientů) a IFNβ-1b s.c. (pět pacientů). Oba pacienti, u kterých se NAbs poprvé objevily v 24. měsíci léčby, užívali IFNβ-1a s.c. Pacienti s jednorázovým výskytem NAbs a pacienti s izolovaným poklesem MxA bez NAbs byli léčeni různými přípravky (tab. 2).
Výskyt NAbs a pokles MxA v čase
V šesti případech z 15 (40 %), kdy se objevila NAbs pozitivita i kleslo MxA, předcházel pokles MxA vzniku NAbs pozitivity. U devíti pacientů kleslo MxA pod cut-off až při kontrole, kdy byl současně poprvé zaznamenán výskyt NAbs. Situaci, že by NAbs pozitivita předcházela poklesu MxA, jsme nezaznamenali.
U pacientů s přechodnou pozitivitou NAbs a poklesem MxA (pokud k němu došlo) přetrvával pokles MxA i po normalizaci hladiny NAbs, po celou dobu studie.
MxA indukční test
Pokud byl u pacientů s trvalou pozitivitou NAbs a poklesem MxA proveden MxA indukční test, byl vždy s nedostatečnou odpovědí. Byl-li ale proveden MxA indukční test u pacientů s přechodnou pozitivitou NAbs, reaktivita MxA (i přes pokles v předchozích vyšetření MxA) v něm byla pokaždé zachována. MxA indukční test u pacientů s poklesem MxA bez NAbs pozitivity byl nedostatečný jen u dvou z nich – tito pacienti byli posléze vyřazeni pro významnou progresi nálezu na MR, čtyři zbývající měli reaktivitu v indukčním testu zachovanou.
Uvedené spektrum hodnot MxA a NAbs umožňuje z hlediska pravděpodobné účinnosti IFNβ rozdělit pacienty do následujících skupin:
- Biologičtí respondenti jsou pacienti bez NAbs, s hodnotou MxA nad cut-off hodnotou – 74 pacienti.
- Pravděpodobní biologičtí respondenti definovaní jako:
- a) pacienti s NAbs pozitivitou, ale s dostatečným MxA indukčním testem – v našem souboru se jednalo o pět pacientů s přechodnou NAbs pozitivitou, tři z nich měli sice MxA pod cut-off hodnotou, nicméně byl-li proveden MxA indukční test, reaktivita na IFNβ byla v normě;
- b) pacienti s poklesem MxA bez NAbs, ale s dostatečným MxA indukčním testem – čtyři pacienti.
- Biologičtí nonrespondenti, mezi kterými lze opět odlišit dvě podkategorie:
- a) NAbs pozitivní pacienti s poklesem MxA a nedostatečným MxA indukčním testem – takových pacientů jsme zachytili 10 (ne u všech byl proveden MxA indukční test);
- b) pacienti s opakovaným poklesem MxA a nedostatečným MxA indukčním testem, ale bez NAbs – dva pacienti.
- Pacienti, u nichž k výskytu NAbs či poklesu MxA došlo poprvé při ukončení studie (měsíc 24), a k dynamice abnormit se proto není možné vyjádřit – čtyři pacienti.
Klinický průběh
Do studie bylo zařazeno 54 pacientů s CIS, z nichž 51 (94 %) v průběhu následujících 24 měsíců konvertovalo do klinicky definitivní RR RS dle klinické nebo MR aktivity.
U šesti pacientů, u nichž byla léčba IFNβ ukončena pro klinickou aktivitu (tab. 1), jsme nedetekovali NAbs pozitivitu ani pokles MxA.
Pacienti s přítomnými NAbs (NAbs+) tvoří spolu s pacienty s poklesem MxA (MxA¯) skupinu, u kterých máme podezření na pokles účinnosti IFNβ (souhrnně v tab. 2). V průběhu našeho sledování se riziko rozvoje relapsu v této skupině ve srovnání s ostatními pacienty nelišilo (HR = 1,032 (95% CI 0,493–2,162; p = 0,933)).
U dvou pacientů byla léčba a sledování ukončeno pro aktivitu na MR. Jednalo se o pacienty s poklesem MxA i nedostatečnou reaktivitou v MxA indukčním testu.
Konfirmovanou EDSS progresi dosáhlo ve studii celkem 11 pacientů. Tři z nich patřili do skupiny pacientů NAbs+/MxA¯, nárůst postižení vždy souvisel iniciálně s atakou. Ostatních osm pacientů s konfirmovanou progresí EDSS mělo hladinu MxA nad cut-off a NAbs u nich byly negativní.
Ukončení léčby IFNβ u NAbs pozitivních pacientů vycházelo z doporučení skupiny expertů Evropské federace neurologických společností (EFNS) [10], nověji konzorcia odborníků sdružených v rámci NABINMS (Neutralising AntiBodies on Interferon beta in Multiple Sclerosis) [5] a z rozhodnutí ošetřujícího lékaře. Nebylo závislé na klinické aktivitě onemocnění pacienta – léčba IFNβ byla ukončena u šesti NAbs pozitivních pacientů. Pacienti byli dále sledováni.
Z důvodu izolovaného poklesu pouze hodnoty MxA (bez NAbs pozitivity) nebyla léčba při současné klinické a MR stabilizaci ukončena u žádného z pacientů.
Diskuze
Prokázali jsme, že kromě pacientů, kteří na léčbě IFNβ selhávají z důvodu aktivity onemocnění, může být pokles účinnosti IFNβ způsoben různými patofyziologickými mechanizmy – u části pacientů tvorbou NAbs, v jiných případech ale mechanizmy na NAbs nezávislými.
MxA odráží biologickou odpověď na léčbu IFNβ, jeho hladina po zahájení terapie významně stoupá a při účinné léčbě se po celou dobu sledování udržuje nad cut-off hodnotou. U jednotlivých pacientů však může hladina MxA nárazově kolísat. Interkurentní, i subklinicky probíhající infekt způsobí nárůst hodnot mRNA MxA [11], naopak nesprávná aplikace, nedostatečná compliance, nebo přechodná saturace receptoru při aplikaci několikrát týdně (IFNβ-1a s.c., IFNβ-1b s.c.) mohou způsobit jednorázový pokles MxA pod cut-off hodnotu [12,13].
Nejčastější příčinou trvalého poklesu MxA je tvorba NAbs. V našem souboru se NAbs trvale vyskytly v 10 % případů, což je v souladu s literárními údaji [3]. Zachyceny byly v průběhu celé studie, nejčastěji v měsíci 12 (šest pacientů) a 18 (tři pacienti). V literatuře se udává možnost jejich vzniku od 6. do 24. měsíce po zahájení terapie IFNβ [2]. I v rámci našeho sledování jsme zachytili pacienty, u kterých byla pozitivita NAbs detekována poprvé až ve 24. měsíci léčby.
U šesti pacientů s pozitivitou NAbs předcházel jejich detekci pokles MxA pod cut-off (tab. 2). Situaci, kdy by se nejprve izolovaně objevily NAbs a teprve poté kleslo MxA pod cut-off, jsme nezachytili. Jistě to ale neznamená, že k takovému vývoji nemůže dojít. NAbs jsou nepřímým markerem účinnosti a jejich přítomnost svědčí pouze o možnosti inaktivace IFNβ. U některých pacientů vede NAbs pozitivita k významnému poklesu aktivity IFNβ, zatímco u jiných může při srovnatelných (zejména při pouze mírně zvýšených) titrech zůstávat IFNβ ještě dostatečně účinný [6]. U dvou pacientů s jednorázovou pozitivitou NAbs (titry 20 a 67 TRU/ml) zůstal MxA nad cut-off (336 a 836). Souhrnně při NAbs v titru 20–100 TRU/ml kleslo v našem souboru MxA pod cut-off v 85 % případů, při titru > 100 TRU/ml ve 100 %.
Pokud MxA klesá pod cut-off opakovaně, je doporučováno provedení MxA indukčního testu.
U všech našich pacientů s trvalou pozitivitou NAbs a poklesem MxA pod cut-off potvrdil následně provedený MxA indukční test ztrátu účinnosti IFNβ. Jeho doplnění je tedy v takových případech možné, ale s ohledem na rozhodnutí o dalším postupu nepřínosné. Naopak v případě jen přechodného výskytu NAbs pozitivity doprovázené poklesem MxA a zejména pak v případě izolovaného poklesu MxA bylo provedení indukčního testu zásadní. V klinické praxi by provedení MxA indukčního testu mělo předcházet vyšetření NAbs (schéma 1). Pokud prokáže indukční test zachovanou reaktivitu na IFNβ, je možné v léčbě pokračovat. To byl i případ všech našich pacientů s jednorázovou pozitivitou NAbs.
Schéma 1. Monitoring účinnosti IFNβ pomocí MxA a NAbs v klinické praxi. *Je možné v tuto chvíli pátrat po příčině poklesu MxA a testovat přítomnost NAbs, ale k rozhodnutí o ukončení terapie není tato informace nutná. **Situaci MxA ≥ cut-off (160) a NAbs pozitivní považujeme za nepravděpodobnou. 
Pokud je reaktivita v indukčním testu nedostatečná, je indikována změna terapie. Ze šesti pacientů s izolovaným poklesem MxA v našem souboru byl MxA indukční test nedostatečný u dvou z nich. V průběhu sledování jsme NAbs u těchto pacientů nezachytili a vzhledem k následné progresi na MR (plus ≥ 2 nová ložiska/rok) byli pacienti převedeni na jinou medikaci. Je možné spekulovat, zda by se u těchto pacientů NAbs pozitivita objevila později.
Riziko vzniku relapsu ve skupině pacientů s podezřením na pokles účinnosti IFNβ (tab. 2) bylo srovnatelné s rizikem pacientů bez NAbs a s hladinou MxA nad cut-off. Výhodou laboratorní detekce pacientů s podezřením na ztrátu účinnosti IFNβ je ale právě časový předstih, a tedy možnost optimalizovat terapii, dříve než dojde k reálnému klinickému zhoršení [3]. K ověření této skutečnosti by bylo nutné sledovací období delší než 24 měsíců [14].
V klinické praxi lze na základě našich výsledků doporučit u všech pacientů monitoring účinnosti IFNβ pomocí mRNA MxA vzhledem k jednoduchosti jeho stanovení, rychlosti získávání výsledků a jejich snadné interpretaci. Sledováním hodnot MxA zachytíme situace, kdy je za ztrátu účinnosti odpovědná tvorba NAbs. Můžeme ale navíc zachytit i ztrátu účinnosti v případě, kdy NAbs nevznikají. Důležité je, že jednorázový pokles MxA nelze považovat za průkaz ztráty účinnosti léčby IFNβ, a vyšetření je nutné v takovém případě opakovat a doplnit indukčním testem (schéma 1).
MxA se stává hlavním laboratorním ukazatelem účinnosti IFNβ, vyšetření NAbs ho může významně doplnit. Vzhledem k tomu, že jsme v našem souboru zachytili pokles MxA (doprovázený vznikem NAbs) až na konci sledovacího období, bylo by v klinické praxi vhodné prodlou
Práce byla podpořena výzkumným projektem IGA MZ ČR NT/12385-5 a programem PRVOUK-P26/LF1/4.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Mgr. Jana Libertínová
Neurologická klinika
2. LF UK a FN v Motole
V Úvalu 84
150 06 Praha
e-mail: jana.libertinova@fnmotol.cz
Přijato k recenzi: 19. 1. 2016
Přijato do tisku: 18. 3. 2016
Zdroje
1. Loleit V, Biberacher V, Hemmer B. Current and future therapies targeting the immune system in multiple sclerosis. Curr Pharm Biotechnol 2014; 15 (3): 276–96.
2. Hesse D, Sorensen PS. Using measurements of neutralizing antibodies: the challenge of IFN-beta therapy. Eur J Neurol 2007; 14 (8): 850–9.
3. Bertolotto A, Granieri L, Marnetto F, et al. Biological monitoring of IFN-β therapy in multiple sclerosis. Cytokine Growth Factor Rev 2015; 26 (2): 241–8. doi: 10.1016/j.cytogfr.2014.12.002.
4. Malucchi S, Gili F, Caldano M, et al. Predictive markers for response to interferon therapy in patients with multiple sclerosis. Neurology 2008; 70 (13): 1119–27. doi: 10.1212/01.wnl.0000304040.29080.7b.
5. Polman CH, Bertolotto A, Deisenhammer F, et al. Recommendations for clinical use of data on neutralizing antibodies to interferon-β therapy in multiple sclerosis. Lancet Neurol 2010; 9 (7): 740–50. doi: 10.1016/S1474-4422 (10) 70103-4.
6. Libertínová J, Meluzínová E, Maťoška V, et al. Neutralizační protilátky a Myxovirus resistence protein A při sledování biologické účinnosti interferonu β. Cesk Slov Neurol N 2014; 77/110 (5): 638–41.
7. Polman CH, Reingold S, Banwell B, et al. Diagnostic criteria for multiple sclerosis: 2010 revisions to the McDonald criteria. Ann Neurol 2011; 69 (2): 292–302. doi: 10.1002/ana.22366.
8. Libertínová J, Kumstýřová T, Meluzínová E, et al. mRNA MxA jako marker biologické účinnosti léčby interferonem-β u pacientů s RS v ČR. Cesk Slov Neurol N 2009; 72/105 (Suppl 2): S120.
9. Voort van der LF, Kok A, Visser A, et al. Interferon-β bioactivity measurement in multiple sclerosis: feasibility for routine clinical practice. Mult Scler 2009; 15 (2): 212–8. doi: 10.1177/1352458508096877.
10. Sorensen PS, Deisenhammer F, Duda P, et al. Guidelines on use of anti-IFN-β antibody measurements in multiple sclerosis: report of an EFNS Task Force on IFN-β antibodies in multiple sclerosis. Eur J Neurol 2005; 12 (11): 817–27.
11. Roers A, Hochkeppel HK, Horisberger MA, et al. MxA gene expression after live virus vaccination: a sensitive marker for endogenous type I interferon. J Infect Dis 1994; 4 (4): 807–813.
12. Bertolotto A, Sala A, Malucchi S, et al. Biological activity of interferon betas in patients with multiple sclerosis is affected by treatment regimen and neutralising antibodies. J Neurol Neurosurg Psychiatry 2004; 75 (9): 1294–9.
13. Serana F, Imberti L, Amato MP, et al. MxA mRNA quantification and disability progression in interferon beta-treated multiple sclerosis patients. PLoS One. 2014; 9 (4): e94794. doi: 10.1371/journal.pone.0094 794.
14. Voort van der LF, Visser A, Knol DL, et al. Lack of interferon-beta bioactivity is associated with the occurence of relapses in multiple sclerosis. Eur J Neurol 2009; 16 (9): 1049–52. doi: 10.1111/j.1468-1331.2009.02 649.x.
Štítky
Dětská neurologie Neurochirurgie Neurologie
Článek Rasmussenova encefalitídaČlánek Detekce pravolevých zkratů u mladých pacientů po ischemické cévní mozkové příhodě – pilotní studieČlánek Komentář k článku Vaško et alNeurofyziologická vyšetření u traumatických lézí brachiálního plexuČlánek Webové okénko
Článek vyšel v časopiseČeská a slovenská neurologie a neurochirurgie
Nejčtenější tento týden
2016 Číslo 5- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Magnosolv a jeho využití v neurologii
- Zolpidem může mít širší spektrum účinků, než jsme se doposud domnívali, a mnohdy i překvapivé
- Nejčastější nežádoucí účinky venlafaxinu během terapie odeznívají
-
Všechny články tohoto čísla
- Rasmussenova encefalitída
- Jsou nemotorické projevy Parkinsonovy nemoci indikací k léčbě pomocí hluboké mozkové stimulace subthalamických jader?
- Jsou nemotorické projevy Parkinsonovy nemoci indikací k léčbě pomocí hluboké mozkové stimulace subthalamických jader?
-
Komentář ke kontroverzím
Hluboká mozková stimulace u Parkinsonovy nemoci – revize indikačních kritérií? - Léky navozená spánková endoskopie – cesta k lepším chirurgickým výsledkům při léčbě syndromu obstrukční spánkové apnoe
- Současná kortikoterapie u nádorů mozku
- Individualizovaný přístup k léčbě roztroušené sklerózy
- Aktuální pohled na management nízkostupňových gliových nádorů centrálního nervového systému
- Detekce pravolevých zkratů u mladých pacientů po ischemické cévní mozkové příhodě – pilotní studie
- Myxovirus resistance protein A v terapii interferony-β u pacientů s roztroušenou sklerózou a algoritmus sledování účinnosti léčby
- Myasténia gravis asociovaná s tymómom – súbor pacientov v Slovenskej republike (1978–2015)
- Bezpečnost karotického stentingu – srovnání protekčních systémů
-
Komentář k článku Pavlík et al
Bezpečnost karotického stentingu – srovnání protekčních systémů - Průkaz boreliové DNA u pacientů s neuroboreliózou
- Vztah likvorových hladin IL-6 ke změnám parciálního tlaku kyslíku v mozku a k rozvoji vazospazmů u pacientů po subarachnoidálním krvácení z ruptury aneuryzmatu mozkové tepny
- Stereotaktické biopsie mozkových patologií systémem Varioguide – zkušenosti ze 101 výkonů
- Myasthenia Gravis Composite – validace české verze
- Pilotní studie využití tenzometrické plošiny v domácí terapii poruch rovnováhy
- Neurofyziologická vyšetření u traumatických lézí brachiálního plexu
-
Komentář k článku Vaško et al
Neurofyziologická vyšetření u traumatických lézí brachiálního plexu - Paroxyzmálna kinezigénna dystónia ako primomanifestácia roztrúsenej sklerózy – kazuistika
- Idiopatická hypertrofická kraniální pachymeningitida – dvě kazuistiky
- Metodika stanovení smrti mozku pomocí transkraniální sonografie vypracovaná Neurosonologickou komisí a Cerebrovaskulární sekcí České neurologické společnosti ČLS JEP
- Webové okénko
-
Analýza dat v neurologii
LIX. Koncept atributivního rizika v analýze populačních studií – VI. Kauzalita vztahů
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Současná kortikoterapie u nádorů mozku
- Rasmussenova encefalitída
- Neurofyziologická vyšetření u traumatických lézí brachiálního plexu
- Průkaz boreliové DNA u pacientů s neuroboreliózou
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



