-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Sympatická kožní odpověď v diagnostice neuropatie tenkých vláken
Sympathetic Skin Response in the Diagnosis of Small Fibre Neuropaty
Introduction:
Sympathetic skin response (SSR) is a simple and widely available test of sudomotor functions. Afferent part of this polysynaptic reflex is variable, while the efferent direction of the reflex arch is via thin unmyelinated C fibres. No reliable study of the SSR diagnostic validity in patients with sensory small fiber neuropathy (SFN) has so far been published. In clinical practice, however, we repeatedly meet patients, who have been diagnosed with SFN based solely on abnormal SSR. The aim of the study was to evaluate diagnostic validity of SSR in patients with sensory small fibre neuropathy.Methods:
SSR was recorded from palms and soles of 69 patients with painful sensory neuropathy (33 of them with pure SFN and 36 with mixed small and large nerve fibre dysfunction) using electrical stimulation and inspiratory gasp stimuli. Small nerve fiber involvement was confirmed by reduced intraepidermal nerve fiber densities in skin biopsy samples of all cases. The results were compared with those of 89 healthy controls. The outcome for health controls were also used to establish age-stratified normative data. We assessed electric stimuli and sudden inspiration response recall end their reproducibility, amplitude and latency.Results:
Both the SSR latencies and amplitudes showed very low diagnostic validity in small fibre neuropathy patients. The absence of SSR response represented the most reliable abnormality. However, using this parameter, dysfunction of small autonomic nerve fibres has only been found in a small part of our sensory neuropathy patients: sensitivity did not exceed 10% in pure SFN patients and 33% in those with mixed small and large nerve fibre dysfunction (where more pronounced small sensory nerve fibre involvement has previously been found).Conclusion:
Considering its low sensitivity, SSR should not be used as the only test to confirm sensory small fibre neuropathy.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Autoři: E. Vlčková 1,2; I. Šrotová 1,2; J. Bednařík 1,2
Působiště autorů: Neurologická klinika LF MU a FN Brno 1; CEITEC – Středoevropský technologický institut, MU, Brno 2
Vyšlo v časopise: Cesk Slov Neurol N 2016; 79/112(1): 52-60
Kategorie: Původní práce
Souhrn
Úvod:
Sympatická kožní odpověď (SSR) je jednoduchý a široce dostupný test sudomotorických funkcí. Jedná se o polysynaptický reflex s variabilní aferentací a eferentní částí, zprostředkovanou tenkými nemyelinizovanými vlákny typu C. Cílem práce bylo zhodnocení validity SSR v diagnostice neuropatie s postižením tenkých senzitivních nervových vláken.Metodika:
SSR byla vyšetřena na horních a dolních končetinách u 69 pacientů s bolestivou periferní neuropatií. U 33 pacientů této skupiny šlo o izolovanou neuropatii tenkých nervových vláken (NTV). Třicet šest pacientů mělo kombinované postižení vláken tenkých a silných. Nálezy byly srovnány se souborem 89 zdravých kontrol. Hodnocena byla výbavnost odpovědí elektrickým proudem a prudkým inspiriem a jejich reprodukovatelnost, amplituda a latence.Výsledky:
Hodnocení latencí ani amplitud odpovědí neprokázalo jasný přínos pro diagnostiku postižení tenkých nervových vláken. Nejspolehlivější typ SSR abnormity je tedy nevýbavnost odpovědí. Postižení tenkých autonomních vláken však bylo v našem souboru pomocí SSR prokazatelné pouze u malé části pacientů se senzitivní neuropatií – senzitivita dosáhla necelých 10 % u pacientů s čistou NTV a 33 % u pacientů s kombinovaným postižením vláken tenkých a silných (u nichž je současně pravděpodobnější těžší stupeň postižení vláken tenkých).Závěr:
Při zohlednění nízké senzitivity není SSR optimální metoda využitelná jako jediný diagnostický test neuropatie tenkých vláken.Klíčová slova:
neuropatie tenkých vláken – polyneuropatie – onemocnění autonomního nervového systému – vyšetření potivosti – sympatická kožní odpověďÚvod
Sympatická kožní odpověď (Sympathetic Skin Response; SSR) je definována jako přechodná změna elektrického potenciálu kůže, která může být reflexně vyvolána řadou vnitřních či zevních stimulů [1 – 3]. Vyvolávajícím podnětem může být např. nadprahová elektrická či magnetická stimulace, neočekávaný sluchový podnět, prudké inspirium, úleková reakce, ale i emoce [2]. SSR stejně jako alternativa metody, při níž je místo změny kožního potenciálu měřena změna kožního odporu (tzv. galvanická kožní odpověď; galvanic skin response) [4], byly mj. široce testovány jako „detektor lži“. Podkladem změny kožního potenciálu je pohyb iontů zejména přes membránu buněk ekrinních potních žláz [4]. Proto je SSR obvykle řazena mezi testy sudomotorických funkcí, i když na rozdíl od jiných sudomotorických testů ve skutečnosti netestuje vlastní potivost. Sudomotorické funkce lze hodnotit i dalšími testy, k nimž patří např. kvantitativní sudomotorický test (Quantitative Sudomotor Axon Reflex Test; QSART) či termoregulační testování potivosti (thermoregulatory sweat testing) [2]. Tyto testy jsou však složitější než SSR a vyžadují specializované vybavení, takže nejsou tak široce dostupné jako vyšetření SSR.
SSR je polysynaptický reflex s variabilní aferentací a společnou eferentní částí sestávající z míšních autonomních neuronů, pre - a postganglionárních sympatických nervových vláken a potní žlázy jako efektoru. Reflex je modifikován suprasegmentálními strukturami, především hypothalamem a retikulární formací horního kmene. Experimentální práce prokazují, že 95 % doby potřebné k vyvolání odpovědi představuje vedení nemyelinizovanými tenkými nervovými vlákny typu C s rychlostí 1 – 2 m/ s [5].
Jedná se o velmi jednoduchý a v současnosti široce dostupný test [2,3,5] proveditelný pomocí jakéhokoli standardního elektromyografického přístroje a běžně používaných elektrod. V praxi je nejčastěji testována odpověď na nadprahovou elektrickou stimulaci periferního nervu (nejčastěji nervus medianus, ulnaris nebo tibialis) s intenzitou dostatečnou k vyvolání bolestivého vjemu, případně reakce na prudké inspirium [5].
Reprodukovatelnost odpovědi je nutno ověřit opakovanou stimulací (obvykle je doporučováno 5 – 10 opakování), kterou je však nutno provádět s maximální frekvencí 2/ min, protože odpověď jeví tendenci k tzv. habituaci (tj. snížení či vymizení odpovědí při opakované stimulaci, zejména s vyšší frekvencí) [2,3,5].
Hodnocena bývá výbavnost odpovědi a její reprodukovatelnost, latence, amplituda, event. vybavitelnost různými typy užívané stimulace [2,3,5]. V publikované literatuře dosud neexistuje jednoznačná shoda v definici abnormity SSR. Za nejspolehlivější indikátor abnormity je považována nevýbavnost odpovědi [1,6 – 9], zatímco hodnocení amplitud (a méně i latencí) je pokládáno za méně spolehlivé zejména vzhledem vysoké intraindividuální variabilitě odpovědí a širokému překryvu hodnot těchto parametrů mezi zdravými jedinci a pacienty se susp. autonomní dysfunkcí v rámci onemocnění centrálního či periferního nervového systému [1,6 – 9].
SSR je nejčastěji využívána pro testování sudomotorických cholinergních funkcí, přičemž iniciální a nadále dominantní využití metodiky je v testování eferentních nemyelinizovaných sympatických nervových vláken v rámci periferních neuropatií [1,9]. Test však lze využít i pro testování změn autonomních funkcí při alteraci centrálních struktur zapojených do regulace odpovědi [2,3].
Pre - i postgangliová autonomní nervová vlákna patří mezi tenká nervová vlákna [10]. SSR je tedy především testem autonomních tenkých nervových vláken. Neuropatie postihující autonomní tenká nervová vlákna patří spolu se senzitivní neuropatií tenkých vláken (NTV) do širší skupiny NTV. U pacientů s NTV nemusí být senzitivní a autonomní vlákna postižena současně, a klinickému obrazu tudíž může dominovat postižení vegetativní či senzitivní.
V rámci klinické praxe se v posledních letech přesto opakovaně setkáváme s využitím SSR jako jediného provedeného testu funkce tenkých nervových vláken, na základě jehož výsledků (s variabilní definicí abnormity v různých elektrofyziologických laboratořích) je stanovena či vyloučena diagnóza NTV.
Přínos SSR pro diagnostiku NTV přitom dosud cíleně reflektuje jediná práce [11], která prokázala u většiny pacientů s NTV signifikantní prolongaci latence SSR na některé z vyšetřovaných končetin. Tyto nálezy jsou ovšem v přímém rozporu s výsledky většiny dalších publikací zaměřených na diagnostickou validitu SSR u polyneuropatií obecně. Např. Bril et al prokázali u pacientů s diabetickou polyneuropatií nevýbavnost SSR jako nejspolehlivější typ abnormity, zatímco hodnocení latencí odpovědí nebylo v diagnostice periferní neuropatie výtěžné [9]. Přínos SSR pro diagnostiku NTV tak nadále zůstává nejasný.
Cílem práce bylo proto zhodnocení diagnostické validity metodiky a jednotlivých sledovaných parametrů v diagnostice dysfunkce tenkých nervových vláken pomocí vyšetření velmi dobře definovaného souboru pacientů s NTV nebo s kombinovaným postižením vláken tenkých a silných.
Soubor
Do studie bylo zařazeno 69 pacientů s bolestivou distální polyneuropatií s prokázaným postižením tenkých senzitivních nervových vláken (41 mužů, 28 žen, průměrný věk 56,8 ± 12,7 let, rozmezí 23–83 let) (tab. 1). Postižení tenkých nervových vláken bylo konfirmováno pomocí vyšetření intraepidermální hustoty tenkých nervových vláken z kožní biopsie a dále pomocí vyšetření termické či termoalgické senzitivity v rámci kvantitativního testování senzitivity. Obě uvedené diagnostické metody vykazovaly abnormitu u všech zařazených pacientů. Dle aktuální klasifikace NTV pro výzkumné účely [10] šlo tedy ve všech případech o postižení jisté nebo pravděpodobné. Třicet tři zařazených jedinců mělo izolovanou neuropatii tenkých nervových vláken (tab. 1), a tedy normální nález v kondukčních studiích periferních nervů, 36 pacientů mělo převážně senzitivní polyneuropatii s kombinovaným postižením vláken tenkých a silných (PNP; tab. 1), a tudíž abnormitu kondukčních studií, především v senzitivním neurogramu. Etiologie periferně neurogenního postižení byla různá, nejčastěji šlo o polyneuropatii diabetickou či toxickou (v rámci chronického abúzu alkoholu či po aplikované chemoterapii). U čtvrtiny pacientů bylo postižení idiopatické neboli u nich nebylo možné prokázat žádný běžně hodnocený příčinný faktor periferně neurogenní léze.
Tab. 1. Základní charakteristiky souboru a hodnocené parametry sympatické kožní odpovědi (SSR) v souboru zdravých kontrol (ZK) a v souborech pacientů s neuropatií tenkých vláken (NTV) a s polyneuropatií s kombinovaným postižením vláken silných (PNP). 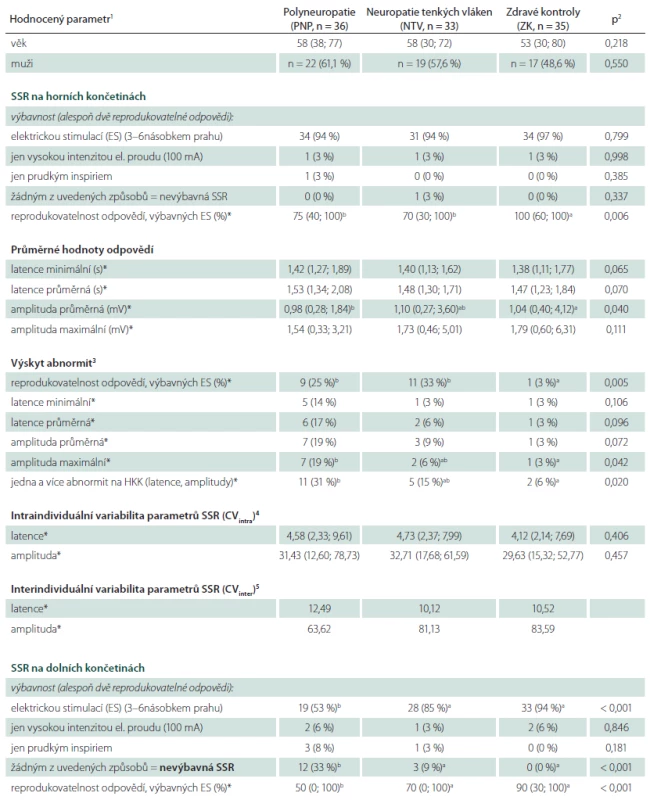

U parametrů označených * byly statisticky zpracovány pouze odpovědi získané elektrickou stimulací o intenzitě odpovídající 3–6násobku stimulačního prahu (tzn. že z analýzy byly vyloučeni pacienti s odpovědí nevýbavnou oběma typy stimulace i jedinci s odpovědí evokovatelnou pouze prudkým inspiriem). <sup>1</sup> Hodnoty jsou vyjádřeny jako absolutní (relativní) frekvence pro kategoriální proměnné a jako medián (rozsah hodnot definovaný 5. a 95. percentilem) pro kontinuální proměnné. <sup>2</sup> Srovnání provedeno Fisherovým exaktním testem pro kategoriální proměnné a ANOVA testem pro data kontinuální. <sup>3</sup> Výskyt abnormity příslušného parametru při hodnocení při hodnocení s použitím normativních dat získaných v širším souboru zdravých kontrol (tab. 2). <sup>4</sup> Intraindividuální koeficient variability vypočtený jako poměr směrodatné odchylky a průměru hodnot 5 (event. v případě nižší výbavnosti méně) SSR odpovědí získaných elektrickou stimulací o intenzitě 3–5násobku senzitivního prahu u daného pacienta v příslušné lokalizaci (na HKK nebo DKK). <sup>5</sup> Interindividuální variabilita hodnot příslušného parametru, vypočtená jako poměr směrodatné odchylky a průměru všech odpovědí všech pacientů v daném souboru, získaných elektrickou stimulací o intenzitě 3–5násobku senzitivního prahu. <sup>a,b,c</sup> Odlišná písmena představují statisticky významně rozdílné výsledky daného parametru mezi příslušnými skupinami na základě odpovídajících post hoc testů (Fisherův exaktní test pro kategoriální proměnné, Tukeyho test pro proměnné kontinuální). CV – koeficient variability, DKK – dolní končetiny, ES – elektrická stimulace o intenzitě 3–6násobku senzitivního prahu, HKK – horní končetiny, NTV – neuropatie tenkých vláken, PNP – polyneuropatie, SSR – sympatická kožní odpověď, ZK – zdravé kontroly. Kontrolní soubor tvořilo 89 zdravých dobrovolníků (40 mužů, 49 žen, průměrný věk 42,8 ± 15,2 let, rozmezí 20 – 80 let), především z řad zaměstnanců kliniky, jejich příbuzných a známých. Tito jedinci měli normální klinické neurologické vyšetření a nevykazovali pozitivní ani negativní senzitivní symptomy, korelující s event. polyneuropatií. Další vylučující kritérium byla anamnestická přítomnost rizikových faktorů periferně neurogenních lézí (zejména diabetu mellitu, chronického abúzu alkoholu či stavu po aplikaci chemoterapie). Asi u třetiny pacientů byla současně provedena kožní biopsie, 70 % pacientů mělo vyšetřené kondukční studie periferních nervů a kvantitativní testování senzitivity – tato vyšetření nebyla požadována obligátně, byla však doplněna u jedinců s nízkou výbavností SSR či zřetelně nízkými hodnotami amplitud odpovědí k vyloučení postižení neuropatie silných nebo tenkých vláken jako podkladu možné SSR abnormity.
Nálezy v tomto rozsáhlém kontrolním souboru byly využity pro tvorbu věkově stratifikovaných normativních dat (tab. 2). Pro tento účel byl soubor podle věku rozdělen na pět podskupin, odpovídajících jednotlivým dekádám. Normativní data pro jednotlivé parametry pak byla vytvořena zvlášť pro každou z těchto podskupin (tab. 2).
Tab. 2. Věkově stratifikovaná demografická data a nálezy SSR v širším souboru zdravých kontrol a derivovaná normativní data pro jednotlivé hodnocené parametry. 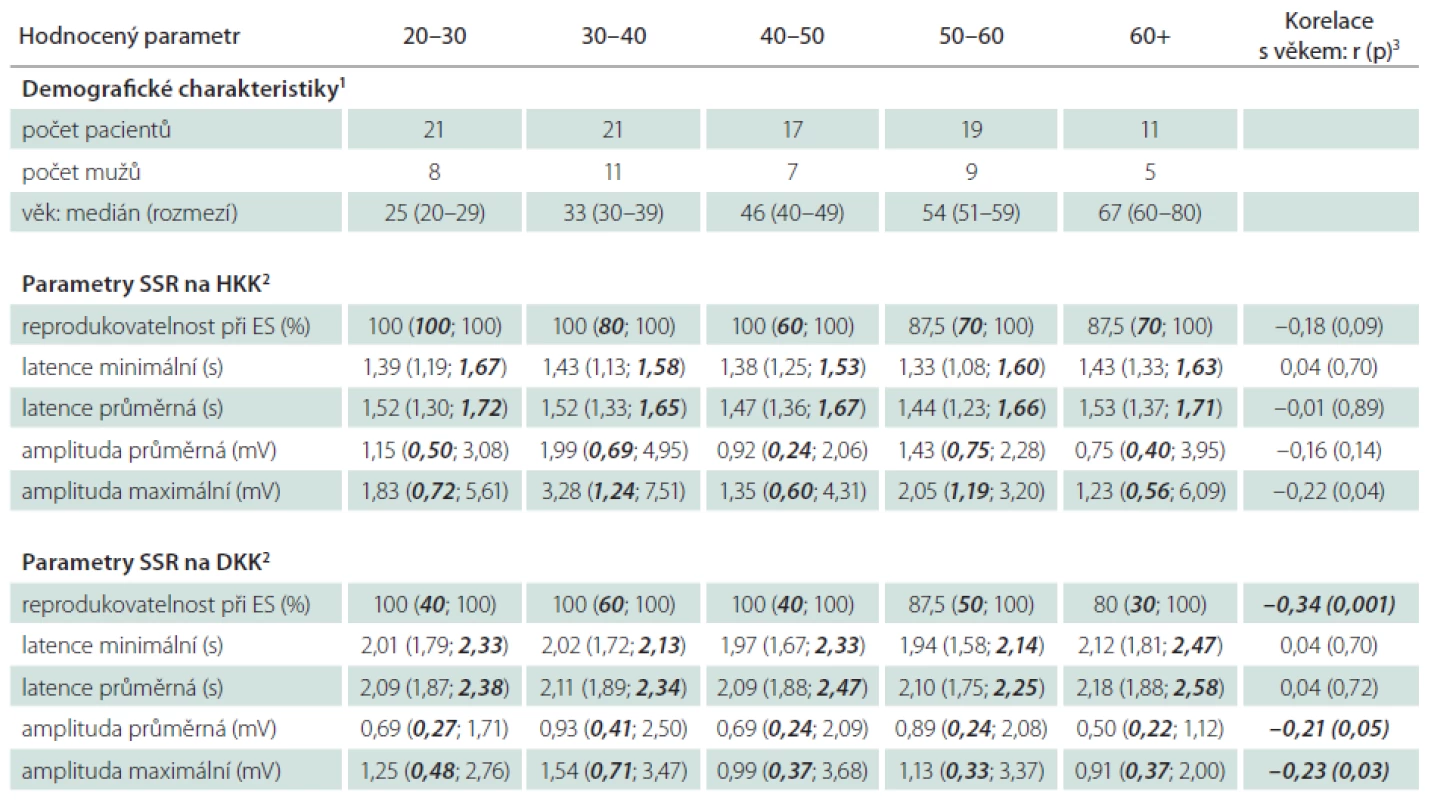
1 Hodnoty jsou vyjádřeny jako absolutní frekvence pro kategoriální proměnné a jako medián (rozsah hodnot) pro kontinuální proměnné. 2 Hodnoty jsou vyjádřeny jako medián (rozsah hodnot definovaný 5. a 95. percentilem). Doporučený dolní normální limit pro hodnocení výbavnosti a amplitud lze odvodit jako 5. percentil hodnot pro příslušnou věkovou kategorii, horní normální limit pro hodnocení latencí představuje 95. percentil hodnot v daném věkovém rozmezí. Pro lepší orientaci jsou limitní hodnoty v tabulce vyznačeny kurzívou. 3 Hodnoty vyjádřeny jako Spearmanův korelační koeficient r (statistická významnost p). ES – elektrická stimulace o intenzitě 3–6násobku senzitivního prahu, SSR – sympatická kožní odpověď. Za účelem srovnávacích analýz byla ze souboru zdravých dobrovolníků následně vybrána podskupina 35 zdravých jedinců obdobného věku a pohlaví, jaké vykazovaly oba podsoubory pacientů s neuropatií (ZK; tab. 1).
Všichni zařazení pacienti i zdravé kontroly byli informováni o účelu vyšetření a podepsali informovaný souhlas. Projekt byl schválen etickou komisí FN Brno.
Metodika
U všech zařazených pacientů i zdravých kontrol bylo provedeno vyšetření SSR, a to na horních (HKK) a následně i na dolních končetinách (DKK). Vyšetření probíhalo v tichém klidném prostředí, před započetím testování byli vyšetřovaní jedinci detailně obeznámeni s jeho průběhem. Při vyšetření HKK byly aktivní elektrody umístěny na dlaních a referenční na hřbetech obou rukou a stimulován byl nervus ulnaris (jednostranně, obvykle vpravo), na DKK byly aktivní elektrody na ploskách a referenční na dorzech obou nohou a odpověď byla vyvolána stimulací n. tibialis (opět jednostranně, obvykle vpravo). Před započetím vlastní stimulace byl u vyšetřovaného jedince stanoven práh cítivosti pro stimulaci elektrickým proudem ve vyšetřované lokalizaci (tedy na zápěstí nad průběhem nervus ulnaris při vyšetření HKK a za vnitřním kotníkem nad průběhem nervus tibialis při vyšetření DKK). Vlastní stimulace probíhala ve zmíněných lokalizacích iniciální intenzitou rovnou trojnásobku takto stanoveného senzitivního prahu. Stimulace byla provedena vždy alespoň 5× v každé lokalizaci, intenzita stimulace postupně narůstala (maximálně k hodnotě odpovídající šestinásobku senzitivního prahu), zejména nebyla-li při úvodních stimulech odpověď vybavena. Pokud se při tomto způsobu stimulace nepodařilo vybavit odpověď i přes dosažení maximální stimulační intenzity (tj. 100 mA při délce trvání podnětu 0,3 ms), byla opět po předchozí instruktáži testována ještě výbavnost prudkým inspiriem. Metodika vyšetření odpovídá publikovaným doporučením [2,3,5].
Hodnocena byla výbavnost odpovědí příslušným typem stimulace (tedy elektrickým proudem o základní intenzitě 3 – 6násobku senzitivního prahu, elektrickým proudem o intenzitě 100 mA a prudkým inspiriem) a (v případě výbavnosti odpovědi) dále reprodukovatelnost při stimulaci základní intenzitou elektrického proudu (tj. počet vybavených odpovědí/ počet stimulů), průměrná (a nejkratší) latence vybavených odpovědí a jejich průměrná (a maximální) amplituda.
Hodnoceny byly jednak absolutní hodnoty jednotlivých parametrů (reprodukovatelnost, minimální a průměrná latence, průměrná a maximální amplituda), jednak výskyt jejich abnormit ve srovnání s nálezy v odpovídající věkové skupině širšího souboru zdravých dobrovolníků. Doporučený dolní normální limit pro hodnocení reprodukovatelnosti a amplitud odpovědí byl odvozen jako 5. percentil hodnot v příslušné věkové kategorii širšího souboru zdravých dobrovolníků. Horní normální limit pro hodnocení latencí byl vypočten jako 95. percentil hodnot v daném věkovém rozmezí v tomto souboru. Použitá normativní data jsou uvedena v tab. 2. Pro lepší orientaci jsou limitní hodnoty v tabulce vyznačeny kurzívou.
Posledním hodnoceným parametrem byla variabilita parametrů SSR odpovědí. Testována byla intraindividuální variabilita latencí a amplitud, vyjádřená u každého pacienta jako intraindividuální variační koeficient (CVintra), vypočtený z průměru a směrodatné odchylky hodnot příslušného parametru při opakovaných stimulacích u daného pacienta (CVintra = x/ SD × 100).
Interindividuální variační koeficient (CVinter) byl vypočten identickým způsobem souhrnně ze všech hodnot daného parametru (tedy latencí nebo amplitud) získaných základní elektrickou stimulací o intenzitě odpovídající 3 – 6násobku senzitivního prahu v dané skupině pacientů a lokalizaci.
Srovnání hodnot mezi jednotlivými skupinami bylo provedeno Fisherovým exaktním testem pro kategoriální proměnné a ANOVA testem s Tukeyho post hoc korekcí pro data kontinuální.
Výsledky
Sumarizace výsledků všech hodnocených parametrů v každé ze tří sledovaných skupin (NTV, PNP, ZK) a jejich vzájemné srovnání je uvedena v tab. 1.
Alespoň dvě reprodukovatelne odpovědi byly na HKK vybaveny u všech zdravych jedinců a s vyjimkou jednoho pacienta s NTV i u všech jedinců s periferni neuropatii (tab. 1). Ve všech připadech (vyjma jednoho pacienta s PNP a jednoho vyše uvedeného s NTV) bylo odpověď možne vybavit elektrickou stimulaci. Vybavnost prudkym inspiriem proto s výjimkou těchto dvou pacientů na HKK nebyla testována (tab. 1). K vybavení odpovědí byla u většiny pacientů dostačující stimulace elektrickým proudem o intenzitě odpovídající 3 – 6násobku senzitivního prahu. Pouze u jednoho pacienta v každé skupině (NTV, PNP, ZK) byla pro vybavení alespoň dvou reprodukovatelných odpovědí nezbytná stimulace vysokou intenzitou elektrického proudu (100 mA).
Na DKK byla odpověď při stimulaci elektrickým proudem vybavena u všech zdravých jedinců a u 50 z 69 testovaných pacientů s neuropatií, čtyři další pacienti s PNP nebo NTV měli pak odpověď výbavnou po stimulaci prudkým inspiriem. Celkem se tak SSR nezdařilo vybavit žádným z použitých typů stimulace u 15 z 69 pacientů s periferní neuropatií (22 %), přičemž nevýbavnost odpovědi (ať už elektrickou stimulací nebo obecně některou z použitých stimulačních metod) byla statisticky významně častější ve skupině pacientů s kombinovaným postižením silných a tenkých vláken než mezi jedinci s izolovanou lézí vláken tenkých (tab. 1). Naopak rozdíly výbavnosti mezi pacienty s izolovaným postižením tenkých nervových vláken a zdravými kontrolami nedosáhly statistické významnosti, i když byl přítomen jednoznačný trend k nižší výbavnosti u pacientů s NTV (p = 0,20 pro výbavnost základní stimulační intenzitou elektrického proudu a 0,068 pro nevýbavnost SSR) (tab. 1).
Reprodukovatelnost SSR (tedy počet výbavných odpovědí z počtu stimulací) byla na HKK signifikantně nižší u pacientů s PNP i NTV oproti zdravým kontrolám (tab. 1). Také výskyt abnormit tohoto parametru ve srovnání s věkově stratifikovanými normami byl v obou skupinách pacientů signifikantně vyšší oproti souboru zdravých kontrol (tab. 1).
Na DKK byla reprodukovatelnost významně nižší jen ve skupině pacientů s kombinovaným postižením silných a tenkých vláken. U pacientů s NTV byl také patrný trend k nižší reprodukovatelnosti odpovědí oproti ZK, který však nedosáhl statistické významnosti (p = 0,15) (tab. 1). Prakticky identické výsledky byly patrné při hodnocení výskytu abnormit v porovnání s normativními daty. Abnormálně nízká reprodukovatelnost odpovědí byla signifikantně častější u pacientů s PNP, zatímco u pacientů s NTV byl patrný trend k vyššímu výskytu abnormit tohoto parametru, bez statistické významnosti (p = 0,20) (tab. 1).
Amplitudy SSR byly obecně vyšší a latence kratší na HKK oproti DKK, a to jak u zdravých jedinců, tak u pacientů s neuropatií. Tyto rozdíly mezi HKK a DKK byly u všech zmíněných parametrů vysoce statisticky významné ve všech sledovaných skupinách (statistická významnost detailně neuvedena, rozdíly hodnot jsou patrné z tab. 1).
V širším souboru zdravých kontrol byla prokázána negativní korelace amplitud a výbavnosti odpovědí s věkem (nebo alespoň trend k takové korelaci), zatímco vliv věku na hodnoty latencí odpovědí nebyl přesvědčivě prokázán (tab. 2).
Při hodnocení latencí odpovědí nebyl prokázán významný rozdíl mezi vyšetřovanými skupinami (NTV, PNP, ZK) na HKK ani na DKK, i když zejména na HKK byl naznačen trend k mírně vyšším latencím odpovědí u pacientů neuropatií, a to především s kombinovaným typem postižení silných a tenkých vláken, nicméně bez statistické významnosti a s malými absolutními hodnotami rozdílů a vysokým překryvem hodnot mezi sledovanými skupinami. Rozdíly latencí mezi pacienty s NTV a zdravými kontrolami byly jednoznačně nevýznamné v obou hodnocených lokalizacích (tab. 1). Obdobně nebyl u pacientů s PNP ani NTV prokázán významně vyšší výskyt abnormit latencí SSR na HKK ani DKK oproti skupině zdravých dobrovolníků (tab. 1). Záchyt abnormit pomocí hodnocení latencí byl obecně velmi nízký v obou testovaných lokalizacích (max. 17 % jedinců ve sledovaných souborech pacientů) (tab. 1).
Amplitudy odpovědí byly zejména na HKK poněkud nižší u pacientů s neuropatií se smíšeným postižením tenkých a silných nervových vláken oproti zdravým kontrolám. Tento trend byl výraznější při hodnocení průměrných amplitud (kde dokonce dosáhl statistické významnosti) než při zohlednění amplitud maximálních (tab. 1). Podobný trend (bez statistické významnosti) byl ve skupině pacientů s PNP prokázán i na DKK. U pacientů s izolovaným postižením tenkých nervových vláken redukce amplitud prokázána nebyla. Obecně však byly absolutní rozdíly amplitud v jednotlivých skupinách poměrně malé a byl patrný velmi výrazný překryv hodnot mezi skupinami pacientů a kontrol (tab. 1). S touto skutečností koreluje i poměrně nízký záchyt abnormit tohoto parametru při srovnání s normativními daty – ty byly častější u jedinců s PNP, vyskytovaly se však u méně než 1/ 4 hodnocených pacientů (tab. 1).
Souhrnný výskyt abnormit latencí a/ nebo amplitud byl ve všech hodnocených skupinách poměrně nízký. Na HKK byla v souboru pacientů s PNP alespoň jedna abnormita těchto parametrů sice zachycena významněji než v souboru zdravých kontrol, přesto kumulativní senzitivita těchto parametrů dosáhla pouze 31 %. V souboru NTV byla alespoň jedna abnormita latencí nebo amplitud zachycena jen u 15 % pacientů, což se od souboru zdravých kontrol statisticky nelišilo.
Na DKK byl výskyt abnormit dokonce ještě méně častý. Jedna či více abnormit latencí či amplitud byla na DKK zachycena pouze u necelé 1/4 pacientů s periferní neuropatií s výbavnou SSR odpovědí (tab. 1).
Intra - i interindividuální variabilita hodnot latencí i amplitud byla obdobná ve všech třech skupinách pacientů a prakticky identická na HKK a DKK. Na intra - i interindividuální úrovni byla prokázána poměrně nízká variabilita latencí, zatímco variabilita amplitud byla několikanásobně vyšší (tab. 1).
Diskuze
Prezentovaná práce je první publikovaná systematická studie, zaměřená na validitu vyšetření SSR v diagnostice neuropatie s izolovaným postižením tenkých nervových vláken a s kombinovaným postižením vláken tenkých a silných na poměrně velkém a velmi dobře definovaném souboru pacientů v porovnání s rozsáhlým souborem zdravých kontrol.
Naše studie potvrdila nevýbavnost odpovědi jako nejspolehlivější typ SSR abnormity, a to především na DKK, kde jsme však takový nález prokázali u méně než 10 % pacientů s izolovaným postižením tenkých nervových vláken. Hodnocení latencí a amplitud prokázalo nízkou senzitivitu i spolehlivost vzhledem k vysokému překrytu hodnot mezi pacienty s periferními neuropatiemi a zdravými kontrolami a zejména v případě amplitud také z důvodu vysoké intra - i interindividuální variability hodnot. Přes zohlednění všech výše uvedených typů abnormit se tak SSR jeví jako málo senzitivní test v diagnostice senzitivní NTV.
Využití SSR v diagnostice NTV má nesporné racionální opodstatnění s ohledem na skutečnost, že SSR odráží vedení tenkými cholinergními nemyelinizovanými sympatickými nervovými vlákny. Současně jde o test snadno proveditelný a široce dostupný, na rozdíl od ostatních diagnostických metod NTV (tedy kvantitativního testování senzitivity a kožní biopsie či korneální konfokální mikroskopie) [10]. Jedná se ale o metodu, jejíž diagnostická validita nebyla v této indikaci dosud systematicky hodnocena. U části pacientů s NTV zcela dominuje senzitivní postižení a klinické známky i subjektivní symptomy autonomní dysfunkce u nich nejsou patrné. SSR navíc není specifický test reflektující autonomní dysfunkce pouze u periferních neuropatií postihujících tenká nervová vlákna. Jedná se o polysynaptický reflex s aferentní částí reflexního oblouku, zprostředkovanou silnými nervovými vlákny, a významnou suprasegmentální modulací. Abnormity odpovědi jsou tak prokazovány u řady onemocnění centrálního nervového systému (např. u míšních lézí, Alzheimerovy či Parkinsonovy choroby a dalších extrapyramidových onemocnění, roztroušené sklerózy i stavech po cévních mozkových příhodách) [2,8], stejně jako u jedinců s chronickými bolestivými stavy, např. fibromyalgií [12] či recentně u pacientů s chronickým lumbagem a/ nebo bolestmi zad po operacích páteře (tzv. failed back surgery syndromem) [13]. Jedná se tedy o vysoce nespecifickou metodu odrážející dysfunkci silných i tenkých nervových vláken i suprasegmentální modulační vlivy, jejíž abnormita je prokazatelně přítomna u řady různých neurologických onemocnění, což významně snižuje využitelnost metodiky jako klíčového diagnostického testu NTV.
SSR je výbavná řadou různých stimulačních metod. Nejčastěji je v klinické praxi využívána stimulace elektrickým proudem. Použitá intenzita stimulace by měla být dostatečná pro vyvolání odpovědi. Většinou je doporučováno volit intenzitu odpovídající troj - a vícenásobku senzitivního prahu pro stimulaci elektrickým proudem a použít dostatečný počet stimulací, pokud možno ve zvyšující se intenzitě jako prevence habituace odpovědí [5]. Tato metodika byla zvolena i v naší studii. Není-li odpověď výbavná tímto způsobem, je vhodné zvážit testování výbavnosti vyšší intenzitou elektrického proudu nebo prudkým inspiriem [5]. Při nedostatečné intenzitě stimulace totiž případná nevýbavnost odpovědi nemusí odrážet přítomnost abnormit v eferentní části reflexního oblouku (zprostředkované tenkými nervovými vlákny), ale v části aferentní. Studie používající k vybavení odpovědi pouze stimulaci elektrickým proudem nižší konstantní intenzity tak prokazují nevýbavnost odpovědi daleko častěji než naše práce [9]. Jde však v podstatě o falešně pozitivní výsledky testu, přinejmenším z hlediska průkazu dysfunkce tenkých nervových vláken, na který je zaměřena naše studie. Například Bril et al prokázali u rozsáhlého souboru pacientů s diabetickou neuropatií (definovanou na základě přítomnosti senzitivních symptomů a abnormity kondučních studií a/ nebo kvantitativního testování senzitivity pro chlad a vibrace) nevýbavnost SSR na HKK v 31 % případů a u diabetiků bez prokázané polyneuropatie v 11 %, na DKK pak nebyla odpověď výbavná dokonce u 85 % pacientů s diabetickou polyneuropatií a pouze u 8 % diabetiků bez známek PNP [9]. Tyto nálezy by svědčily pro velmi dobrou senzitivitu SSR v diagnostice periferních neuropatií. Testovány ovšem byly pouze tři podněty o konstantní intenzitě 15 – 20 mA v každé z obou lokalizací. Naše nálezy však prokazují, že u významné části pacientů s periferními neuropatiemi je odpověď výbavná až při použití vyšších intenzit stimulace elektrickým proudem či dokonce až s využitím stimulace prudkým inspiriem. Odpověď lze přesto vybavit, a to s jinak fyziologickými parametry (latence, amplitudy), což svědčí proti významné dysfunkci tenkých nervových vláken. Při zohlednění této skutečnosti je tedy spolehlivost průkazu nevýbavnosti odpovědi způsobem použitým ve studii Bril et al poměrně nízká, resp. poskytuje odlišnou informaci: odráží pravděpodobně určitou periferně neurogenní dysfunkci (např. horší stimulovatelnost periferních nervů nižšími intenzitami elektrického proudu), není však spolehlivým indikátorem dysfunkce tenkých nervových vláken [9].
Spornou otázkou je definice abnormity SSR. Za nejspolehlivější abnormální nález je považována nevýbavnost odpovědi (pokud není způsobena habituací či technickou chybou, např. nedostatečnou stimulací) [1,6 – 9]. Naopak názory na význam hodnocení amplitudy SSR a její latence se různí. Někteří autoři nedoporučují hodnocení těchto parametrů a jako jedinou známku abnormity připouštějí absenci odpovědi [1], jiní zohledňují snížení amplitudy (přičemž je vzhledem k variabilitě odpovědí a jejich habituaci obvykle doporučováno hodnotit spíše nejlepší odpověď z 5 – 10 stimulací než odpověď průměrnou) [6,7,14] a další práce připouštějí jako známku abnormity SSR i prolongaci průměrné latence odpovědí [6,7].
V naší studii jsme alespoň dvě reprodukovatelné SSR odpovědi vybavili u všech zdravých kontrol. Ve shodě s dříve publikovanými pracemi [6 – 9] tak naše nálezy prokazují, že SSR je výbavná u všech zdravých jedinců a její nevýbavnost je spolehlivou známkou abnormity na HKK i DKK. U většiny zdravých kontrol (97 % na HKK, 94 % na DKK) byla pro vybavení odpovědi dostačující stimulace základní intenzitou elektrického proudu (tedy 3 – 6násobkem prahu). Situace, kdy není SSR výbavná tímto způsobem a pro její vybavení je nutné použití jiných typů stimulace, je proto s vysokou pravděpodobností také ukazatelem abnormity, pravděpodobně však neodráží dysfunkci tenkých nervových vláken, protože v našem souboru byl tento vzorec významně častější u pacientů s kombinovaným postižením silných a tenkých vláken než u jedinců s izolovaným postižením vláken tenkých (kde se výskyt tohoto typu abnormity nelišil od souboru zdravých kontrol).
Nevýbavnost odpovědi jako spolehlivá známka abnormity SSR však byla v naší studii prokázána na DKK pouze u 9 % pacientů s NTV. Častěji byla tato abnormita zachycena u pacientů s kombinovaným postižením vláken tenkých a silných, kde jsme ji prokázali u 1/ 3 všech zařazených jedinců. Vyšší výskyt abnormit u této skupiny pacientů zřejmě odráží skutečnost, že u pacientů se smíšeným postižením silných a tenkých vláken je postižení senzitivních tenkých nervových vláken pokročilejší než u jedinců s izolovanou NTV [15] a lze u nich častěji předpokládat i postižení vláken autonomních. Zcela raritní pak byla nevýbavnost odpovědi na HKK (kde byla zachycena pouze u jednoho pacienta s NTV). Nevýbavnost SSR tedy sice představuje spolehlivou abnormitu, senzitivita tohoto parametru v diagnostice NTV je však nízká. Důvody diskrepance nízké senzitivity nevýbavnosti odpovědi v naší studii s některými dříve publikovanými pracemi [9] jsou dominantně podmíněny metodicky a byly vysvětleny výše. Při zaměření na diagnostiku NTV se nicméně metodika použitá v naší studii jeví jako racionálnější. Určitý podíl na rozdílných výsledcích obou studií pak může mít i odlišné spektrum pacientů. Ve studii publikované Brilem et al měla většina pacientů abnormitu kondukčních studií periferních nervů a/ nebo vibračního čití jako známku dysfunkce silných nervových vláken [9]. Lze u nich tedy předpokládat více vyjádřené postižení tenkých nervových vláken [15], vč. častější léze autonomních vláken, což je pravděpodobně jedním z důvodů vyšší prokázané senzitivity vyšetření SSR v této studii [9] v porovnání s výsledky naší studie. Také v našem souboru pacientů s kombinovaným postižením silných a tenkých nervových vláken jsme prokázali nevýbavnost odpovědí základní intenzitou elektrického proudu podstatně častěji (u 47 % pacientů) než u jedinců s izolovaným postižením vláken tenkých.
Reprodukovatelnost odpovědí (počet vybavených odpovědí z počtu stimulací) byla v našem souboru prokazatelně nižší v obou souborech pacientů s neuropatií (tedy při postižení tenkých nervových vláken i jeho kombinaci s postižením vláken silných) než u zdravých kontrol. Tento parametr je tudíž také možné považovat za poměrně spolehlivý ukazatel dysfunkce tenkých autonomních nervových vláken a méně než 40 % vybavitelných odpovědí je pravděpodobnou známkou dysfunkce SSR.
Všechny ostatní parametry SSR (latence, amplitudy) byly v naší studii hodnoceny pouze u odpovědí získaných elektrickou stimulací (z analýzy byli tedy vyloučeni nejen pacienti s odpovědí nevýbavnou žádným typem stimulace, ale i jedinci s odpovědí evokovatelnou pouze prudkým inspiriem). Důvodem pro vyloučení odpovědí stimulovaných prudkým inspiriem byla v minulosti prokázaná odlišnost parametrů odpovědí výbavných tímto typem stimulace. Shahani et al prokázali u zdravých jedinců statisticky významně vyšší amplitudu odpovědí po stimulaci prudkým inspiriem než po stimulaci elektrické. Také hodnocení latencí je při stimulaci prudkým inspiriem málo spolehlivé a stejně tak lze při tomto typu stimulace očekávat vyšší intra - i interindividuální variabilitu obou parametrů, protože stimulační podnět nelze validně kvantifikovat ani standardizovat [1].
Latence SSR odpovědí v naší studii plně odpovídaly dosud publikovaným normálním hodnotám tohoto parametru [2,9,16]. Průměrné ani minimální latence nevykazovaly na HKK ani DKK statisticky signifikantní rozdíly mezi zdravými kontrolami a pacienty s neuropatií silných ani tenkých vláken. Také výskyt abnormit tohoto parametru při srovnání s věkově stratifikovanými normativními daty byl nízký a ze statistického hlediska se nelišil od výskytu ojedinělých abnormálních nálezů v souboru zdravých kontrol. Tyto výsledky jsou zcela v korelaci s dalšími publikovanými soubory pacientů s polyneuropatií [9] a implikují skutečnost, že se hodnocení latencí SSR v diagnostice dysfunkce polyneuropatie tenkých ani silných nervových vláken nejeví jako přínosné.
Význam hodnocení amplitud je méně jednoznačný. Naše studie prokázala hraničně statisticky významný pokles amplitud SSR odpovědí u pacientů s neuropatií v porovnání se zdravými kontrolami, a to především na HKK (a méně na DKK, kde byl přítomen pouze trend v tomto smyslu, bez statistické významnosti). Rozdíly však byly patrné pouze u pacientů s kombinovaným postižením silných a tenkých nervových vláken, zatímco u pacientů s izolovaným postižením tenkých nervových vláken nebyla významná redukce amplitud SSR odpovědí zachycena. Podobně i výskyt abnormit amplitud odpovědí ve srovnání s věkově stratifikovanými normativními daty byl vyšší pouze u pacientů s kombinovaným postižením silných a tenkých vláken, ale nikoli u jedinců s izolovanou NTV. Tyto nálezy naznačují, že redukce amplitud SSR pravděpodobně není spolehlivou známkou dysfunkce tenkých nervových vláken, ale může souviset např. s nedostatečnou intenzitou stimulace při dysfunkci silných vláken v aferentní části reflexního oblouku. Rozdíly absolutních hodnot amplitud mezi jednotlivými skupinami pacientů v naší studii byly navíc velmi malé a prokázali jsme široký překryv hodnot amplitud odpovědí mezi všemi hodnocenými soubory a jejich vysokou variabilitu, což dále významně limituje validitu hodnocení tohoto parametru. V souhrnu tak naše nálezy (v korelaci s dalšími publikovanými pracemi – např. Bril et al [9]) neprokázaly přínos hodnocení amplitud SSR v diagnostickém procesu pacientů s polyneuropatií, zejména pak ne v diagnostice dysfunkce tenkých nervových vláken.
Jako poměrně překvapivá se v naší studii může jevit vyšší statistická významnost rozdílů amplitud mezi pacienty s neuropatií a zdravými kontrolami na HKK než na DKK (kdy by dle očekávání měly být změny související s periferní neuropatií více vyjádřeny). Tyto rozdíly jsou však podmíněny statistickou metodologií a souvisejí s poměrně malým počtem jedinců s neuropatií a hodnotitelnou odpovědí SSR na DKK. Důvodem je častá nevýbavnost SSR na DKK a také skutečnost, že ze statistických analýz byli z výše uvedených důvodů vyřazeni pacienti s odpovědí výbavnou pouze po stimulaci prudkým inspiriem. Nižší počet hodnocených jedinců pak samozřejmě snižuje významnost zachycených rozdílů.
Jedním z přínosů naší studie je vytvoření normativních dat pro řadu hodnocených parametrů na poměrně rozsáhlém souboru zdravých dobrovolníků. Naše výsledky prokázaly v souboru zdravých kontrol mírnou negativní korelaci řady hodnocených parametrů (zejména amplitud odpovědí a jejich reprodukovatelnosti) s věkem. Tyto nálezy jsou očekávatelné vzhledem k obecně známým, věkově podmíněným změnám většiny elektrofyziologických parametrů. Korelace SSR parametrů s věkem je však pouze mírná, což je zřejmě důvod, proč nebyla v některých předešlých studiích s podstatně menšími soubory zdravých dobrovolníků prokázána [9]. Průkaz korelace parametrů s věkem současně implikuje nutnost použití věkově stratifikovaných normativních dat, která poskytuje naše studie.
Výsledky SSR a využitelnost metodiky jsou významně limitovány variabilitou odpovědí. Hoeldtke et al nalezli při opakovaném vyšetření zdravých jedinců během téhož dne průměrnou intraindividuální variabilitu amplitud kolem 35 %, zatímco variabilita latencí byla pouze 8 % [14]. Námi zjištěné hodnoty CV jsou prakticky identické a je nutno je zohlednit při interpretaci nálezů a zejména při longitudinálním sledování pacientů, resp. při hodnocení event. změn jednotlivých parametrů SSR (ať už v souvislosti s přirozeným vývojem onemocnění nebo např. v souvislosti s event. terapeutickou intervencí). Variabilita amplitud i latencí je obdobná na HKK i DKK a významně se neliší ani mezi zdravými jedinci a pacienty s periferně neurogenní lézí.
V souhrnu prezentovaná studie poskytla validní normativní data pro řadu hodnocených parametrů SSR a potvrdila abnormální nález SSR u části pacientů s periferními neuropatiemi. Postižení tenkých autonomních vláken je však touto metodou prokazatelné pouze u malé části pacientů s čistou NTV (u nichž v našem souboru senzitivita SSR vyšetření nepřesáhla 10 % pro žádný z hodnocených parametrů vč. nevýbavnosti odpovědí jako nejspolehlivějšího typu abnormity). Daleko častěji je abnormita testu prokazována u pacientů s polyneuropatií s kombinovaným postižením tenkých a silných nervových vláken (u nichž je současně pravděpodobnější těžší stupeň postižení vláken tenkých). Ani v této skupině však senzitivita testu v našem souboru nepřesáhla 33 %. Při zohlednění nízké specificity SSR tedy SSR není optimální jako jediný diagnostický test NTV.
Seznam použitých zkratek
SSR – sympatická kožní odpověď (Sympathetic Skin Response)
QSART – kvantitativní sudomotorický test (Quantitative Sudomotor Axon Reflex Test)
NTV – neuropatie tenkých vláken
PNP – polyneuropatie s kombinovaným postižením silných a tenkých vláken
ZK – zdravé kontroly
HKK – horní končetiny
DKK – dolní končetiny
mA – miliampér
ms – milisekunda
CV – variační koeficient
CVintra – intraindividuální variační koeficient
CVinter – interindividuální variační koeficient
Práce byla podpořena z prostředků MZ ČR – RVO (FNBr, 65269705), interními zdroji CEITEC MUNI a projektem specifického výzkumu č. MUNI/A/0935/2013 z programu podpory studentských projektů na Masarykově univerzitě. Práce byla podpořena grantovým projektem IGA MZ ČR NT 13523-4.
Autoři práce děkují spolupracovníkům, příbuzným a známým, kteří se studie zúčastnili jako zdravé kontroly.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Přijato k recenzi: 17. 9. 2015
Přijato do tisku: 11. 11. 2015
MUDr. Eva Vlčková, Ph.D.
Neurologická klinika
LF MU a FN Brno
Jihlavská 20
625 00 Brno
e-mail: evlckova@email.cz
Zdroje
1. Shahani BT, Halperin JJ, Boulu P, Cohen J. Sympathetic skin response – a method of assessing unmyelinated axon dysfunction in peripheral neuropathies. J Neurol Neurosurg Psychiatry 1984; 47(5): 536 – 542.
2. Illigens BM, Gibbons CH. Sweat testing to evaluate autonomic function. Clin Auton Res 2009; 19(2): 79 – 87. doi: 10.1007/ s10286-008-0506-8.
3. Hilz MJ, Dütsch M. Quantitative studies of autonomic function. Muscle Nerve 2006; 33(1): 6 – 20.
4. Wang GH. The galvanic skin reflex; a review of old and recent works from a physiologic point of view. Am J Phys Med 1957; 36(5): 295 – 320.
5. Claus D, Schondorf R. Sympathetic skin response. The International Federation of Clinical Neurophysiology. Electroencephalogr Clin Neurophysiol 1999; 52 (Suppl): 277 – 282.
6. Knezevic W, Bajada S. Peripheral autonomic surface potential. A quantitative technique for recording sympathetic conduction in man. J Neurol Sci 1985; 67(2): 239 – 251.
7. Baba M, Watahiki Y, Matsunaga M, Takebe K. Sympathetic skin response in healthy man. Electromyogr Clin Neurophysiol 1988; 28(5): 277 – 283.
8. Arunodaya GR, Taly AB. Sympathetic skin response: a decade later. J Neurol Sci 1995; 129(2): 81 – 89.
9. Bril V, Nyunt M, Ngo M. Limits of the sympathetic skin response in patients with diabetic polyneuropathy. Muscle Nerve 2000; 23(9): 1427 – 1430.
10. Lacomis D. Small-fiber neuropathy. Muscle Nerve 2002; 26(2): 173 – 188.
11. Wang HX, Jia ZR, Shi X, Liang W, Sun XR, Huang YN. Significance of sympathetic skin response in diagnosis diabetic small fiber neuropathy. Zhonghua Yi Xue Za Zhi 2008; 88(25): 1753 – 1755.
12. Martínez-Martínez LA, Mora T, Vargas A, Fuentes-Iniestra M, Martínez-Lavín M. Sympathetic nervous system dysfunction in fibromyalgia, chronic fatigue syndrome, irritable bowel syndrome, and interstitial cystitis: a review of case-control studies. J Clin Rheumatol 2014; 20(3): 146 – 150. doi: 10.1097/ RHU.0000000000000089.
13. El-Badawy MA, El Mikkawy DM. Sympathetic Dysfunction in Patients with Chronic Low Back Pain and Failed Back Surgery Syndrome. Clin J Pain 2015; in press.
14. Hoeldtke RD, Davis KM, Hshieh PB, Gaspar SR, Dworkin GE. Autonomic surface potential analysis: assessment of reproducibility and sensitivity. Muscle Nerve 1992; 15(8): 926 – 931.
15. Vlckova-Moravcova E, Bednarik J, Belobradkova J, Sommer C. Small-fibre involvement in diabetic patients with neuropathic foot pain. Diabet Med 2008; 25(6): 692 – 699. doi: 10.1111/ j.1464-5491.2008.02446.x.
16. Kucera P, Goldenberg Z, Kurca E. Sympathetic skin response: review of the method and its clinical use. Bratisl Lek Listy 2004; 105(3): 108 – 116.
Štítky
Dětská neurologie Neurochirurgie Neurologie
Článek vyšel v časopiseČeská a slovenská neurologie a neurochirurgie
Nejčtenější tento týden
2016 Číslo 1- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Magnosolv a jeho využití v neurologii
- Zolpidem může mít širší spektrum účinků, než jsme se doposud domnívali, a mnohdy i překvapivé
- Nejčastější nežádoucí účinky venlafaxinu během terapie odeznívají
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
-
Všechny články tohoto čísla
- Konsenzus a návrh k algoritmu léčby – mechanická trombektomie u akutního mozkového infarktu
- Webové okénko
-
Analýza dat v neurologii
LV. Koncept atributivního rizika v analýze populačních studií – II. Vícenásobný vliv rizikových faktorů -
Zomrel prof. MU Dr. Ján Faguľa, DrSc.
1. 8. 1930– 4. 11. 2015 - Recenze knih
- Moderní dlouhodobá léčba pacientů s RS – vyvážení přínosů a rizik
- Parkinsonova choroba JE priónové ochorenie
- Parkinsonova nemoc NENÍ prionové onemocnění
-
Komentář ke kontroverzím
Je Parkinsonova choroba prionové onemocnění? - Psychické poruchy a kardiovaskulární onemocnění
- Použití optické koherenční tomografie u roztroušené sklerózy
- Pozorovanie hrúbky vrstvy nervových vlákien sietnice u pacientov so sklerózou multiplex pomocou optickej koherentnej tomografie
- Sympatická kožní odpověď v diagnostice neuropatie tenkých vláken
- Editorial
- Kardioembolizace je nejčastější příčinou akutní ischemické cévní mozkové příhody u pacientů přijatých do Komplexního cerebrovaskulárního centra do 12 hodin od začátku příznaků – výsledky studie HISTORY
- Dynamické metody kvantitativního testování senzitivity
- Indikace dekompresivní kraniektomie
- Projekt ncRNAPain
- Komplikace kranioplastik po dekompresivní kraniektomii
- Možnosti terapie pacientů s meningeomem grade III
- Promptní resorpce traumatického akutního subdurálního hematomu – kazuistika
- Neobvyklá příčina spánkové apnoe – kazuistika
- Spinální epidurální lipomatóza – tři kazuistiky
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Sympatická kožní odpověď v diagnostice neuropatie tenkých vláken
- Pozorovanie hrúbky vrstvy nervových vlákien sietnice u pacientov so sklerózou multiplex pomocou optickej koherentnej tomografie
- Komplikace kranioplastik po dekompresivní kraniektomii
- Indikace dekompresivní kraniektomie
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



