-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Pozorovanie hrúbky vrstvy nervových vlákien sietnice u pacientov so sklerózou multiplex pomocou optickej koherentnej tomografie
Investigation of the Retinal Nerve Fiber Layer in Multiple Sclerosis Using Spectral Domain Optical Coherence Tomography
Background:
Optic neuritis (ON) is an inflammatory optic nerve disease that is strongly associated with multiple sclerosis (MS). Axonal damage in the optic nerve is manifested as retinal nerve fiber layer (RNFL) deficits that can be detected by the optical coherence tomography (OCT).Aim:
To characterize the inner retinal layer changes in patients with clinically isolated syndrome (CIS) and MS while utilizing the spectral domain OCT (SD-OCT) and a comparative sample of healthy controls.Participants and methods:
30 eyes of 15 patients with CIS, 104 eyes of 52 MS patients with or without history of ON and 30 eyes of healthy patients that underwent SD-OCT examination. Results: CIS ON eyes had lower mean RNFL thickness (92.1 µm; p = 0.007) compared to the comparative sample (100.8 µm). The mean RNFL thickness decrease (97.5 µm; p = 0.25) was not detected in the eyes unaffected by CIS ON. Reduction of the mean RNFL thickness was not found in the post-ON eyes compared to unaffected eyes of CIS patients (p = 0.14). Eyes of MS patients with a history of ON showed significantly reduced mean RNFL thickness (73.1µm; p < 0.001) compared to the comparative sample (100.8 µm). Patients with MS with no history of ON also had lower mean RNFL thickness (91.4µm; p = 0.002). Statistically significant RNFL thinning was detected in the ON eyes compared to unaffected eyes (p = 0.04).Conclusions:
SD-OCT is a promising tool designed to detect subclinical changes in RNFL thickness in patients with MS.Key words:
multiple sclerosis – optic neuritis – clinically isolated syndrome – optical coherence tomography – retinal nerve fiber layer
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Autoři: M. Michalec 1; P. Praksová 2; M. Hladíková 2; V. Matušková 1; E. Vlková 1; P. Štourač 2; L. Michalcová 1
Působiště autorů: LF MU a FN Brno Oční klinika 1; LF MU a FN Brno Neurologická klinika 2
Vyšlo v časopise: Cesk Slov Neurol N 2016; 79/112(1): 41-50
Kategorie: Původní práce
Souhrn
Úvod:
Neuritída zrakového nervu alebo optická neuritída (ON) je zápalová afekcia zrakového nervu, často asociovaná so sklerózou multiplex (SM). Redukcia axónov zrakového nervu ako následok ON sa prejavuje znížením hrúbky nervových vlákien sietnice (RNFL), čo možno zmerať pomocou optickej koherentnej tomografie (Optical Coherence Tomography; OCT).Cieľ:
Pozorovanie hrúbky RNFL u pacientov po ON v rámci klinicky izolovaného syndrómu (CIS) a u pacientov so SM pomocou spektrálneho OCT (SD-OCT) a porovnanie výsledkov so zdravou kontrolnou skupinou.Súbor a metodika:
Vyšetrenie 30 očí 15 pacientov s CIS, 94 očí 47 pacientov s SM (oči s manifestáciou ON v anamnéze i bez nej) a 30 očí zdravých kontrol pomocou SD-OCT. Výsledky: V skupine pacientov s CIS po jednostrannej ON bol preukázaný štatisticky signifikantný rozdiel v priemernej hrúbke RNFL (92,1 µm; p = 0,007) oproti kontrolnej skupine (100,8 µm). U nepostihnutých očí rovnakej skupiny pacientov nebol zaznamenaný rozdiel oproti kontrolnej vzorke (97,5 µm; p = 0,25). Rovnako nebol preukázaný rozdiel pri porovnaní priemernej hrúbky RNFL očí postihnutých a nepostihnutých ON (p = 0,14). V skupine pacientov s manifestnou ON a klinicky definitívnou SM bol zaznamenaný štatisticky významný pokles hrúbky RNFL (73,1 µm; p < 0,001) oproti kontrolnej skupine (100,8 µm). Zároveň bol tento pokles preukázaný i u pacientov s SM bez manifestnej neuritídy (91,4 µm; p = 0,002). Štatisticky významný rozdiel poklesu hrúbky RNFL bol zaznamenaný i porovnaním očí postihnutých a nepostihnutých ON v rámci SM (p = 0,04).Záver:
Spektrálne OCT predstavuje vhodnú vyšetrovaciu metódu umožňujúcu sledovanie subklinických zmien hrúbky RNFL u pacientov so sklerózou multiplex.Kľúčové slová:
skleróza multiplex – optická neuritída –klinicky izolovaný syndróm – optická koherentná tomografia – vrstva nervových vlákien sietniceÚvod
Optická neuritída (ON) je zápalová afekcia zrakového nervu. Štatisticky je najčastejšou príčinou poklesu zrakovej ostrosti u pacientov v produktívnom veku. U asi 20 % prípadov je prvým prejavom sklerózy multiplex (SM) [1]. Vzťah ON k SM ilustruje aj fakt, že podľa štúdie Optic Nerve Treatment Trial (ONTT) pacienti s prvou epizódou ON bez prítomnosti lézií centrálneho nervového systému (CNS) majú 25% riziko vývoja SM v priebehu 15 rokov, ďalej pri prítomnosti jednej alebo viac lézií CNS je riziko vývoja SM v priebehu 15 rokov dokonca 72 % [2 – 4].
Typické príznaky ON sú náhly pokles centrálnej zrakovej ostrosti (CZO), retrobulbárna bolesť a dyschromatopsia. Medzi ďalšie klinické znaky patria poruchy zorného poľa (ZP) a relatívny aferentný pupilárny defekt (RAPD) [1]. Vo väčšine prípadov sa zraková ostrosť upraví, pričom reštitúcia zrakových funkcií má pozvoľnejší charakter (rádovo týždne) ako ich nástup (rádovo hodiny). Po úprave zrakových funkcií u časti pacientov môžu pretrvávať subjektívne príznaky ako porucha farbocitu, neostré videnie a pod. Počas reštitúcie sa môže vyvinúť nablednutie terča zrakového nervu ako známka postneuritickej atrofie zrakového nervu. Atrofia zrakového nervu vo všeobecnosti je výsledný stav rôznych patologických afekcií prednej časti zrakovej dráhy, napr. ischemických či posttraumatických neuropatií [5].
Vrstva nervových vláken sietnice (Retinal Nerve Fiber Layer; RNFL) je tvorená axónmi gangliových buniek sietnice, ktoré prenášajú zrakovú informáciu zo sietnice do nucleus geniculatum laterale. Tieto axóny sú až po lamina cribrosa v oblasti terča zrakového nervu bez myelínového obalu. Za touto anatomickou štruktúrou získavajú axóny gangliových buniek myelínové obaly a spolu s obalmi CNS tvoria zrakový nerv [6]. Následkom rôznych afekcií zrakového nervu, ako je napr. ON, je retrográdna degenerácia gangliových buniek sietnice prejavujúca sa redukciou vrstvy gangliových buniek (Ganglion Cell Layer, GCL) a tiež RNFL, ktorú tvoria predovšetkým zmieňované nemyelinizované axóny gangliových buniek [7]. Hrúbka RNFL môže byť ovplyvnená inými faktormi, napr. vekom a rasou. Rozdiely na základe pohlaví sa nepreukázali [8]. Nižšie hodnoty hrúbky RNFL boli dokázané u axiálnej myopie (krátkozrakosti) [9,10] a u glaukómu [11]. Z neurologických ochorení sú to okrem SM predovšetkým neurodegeneratívne choroby, ako napr. Parkinsonova [12,13] či Alzheimerova choroba [14 – 17].
Sietnica je jediná časť CNS, kde možno nervové vlákna pozostávajúce z axónov pozorovať priamo. Predstavuje tak potenciál pre monitoring jej hrúbky a diagnostiku stavu neurodegenerácie [18].
V súčasnosti možno hrúbku RNFL presne merať a kvantifikovať pomocou tzv. optickej koherentnej tomografie (Optical Coherence Tomography; OCT). OCT je moderná neinvazívna vyšetrovacia metóda v oftalmológii, ktorá je analógiou B-skenu ultrazvukového vyšetrenia s tým rozdielom, že namiesto akustickej využíva optickú reflektivitu. Princípom je nízkokoherenčná interferometria, ktorá meria vzdialenosť rôznych štruktúr vo vnútri tkanív s vysokou citlivosťou k signálu svetla odrazeného od štruktúr oka [19]. Vyšetrenie OCT umožňuje zobrazenie jednotlivých vrstiev sietnice a predstavuje tak akúsi biopsiu in vivo bez porušenia kontinuity a funkcie sietnice. Pomocou dostupných skenovacích protokolov možno vyšetriť rôzne oblasti sietnice, ako je oblasť makuly alebo oblasť zrakového nervu so súčasnou interpretáciou hrúbky RNFL. V klinickej praxi je používaná hlavne v diagnostike a sledovaní glaukómu, vekom podmienenej makulárnej degenerácie, makulárneho edému a pod. Súčasná generácia OCT s vysokým rozlíšením využíva tzv. spektrálnu doménu (SD-OCT) a predstavuje tak metodiku trojrozmerného hodnotenia štruktúr sietnice a cievnatky. SD-OCT nahradzuje staršiu generáciu tzv. time domain OCT (TD-OCT), ktorú prekonáva hlavne významne lepším rozlíšením a kvalitou skenu. Toto vyšetrovacie zariadenie umožňuje dosiaľ najpresnejšiu interpretáciu zaznamenaných výsledkov, vrátane možnosti sledovania hrúbky RNFL [20,21]. Viaceré štúdie ukazujú, že redukciu RNFL pomocou OCT možno dokázať už v subklinických štádiách mnohých očných i neurologických ochorení [7,11,12,15,22].
Redukciu gangliových buniek sietnice (a tým nepriamo i redukciu RNFL) po afekciách zrakového nervu priamo či nepriamo dokazujú rôzne práce. Levkovitch-Verbin et al dokázali sekundárnu degeneráciu gangliových buniek sietnice a defekt RNFL pri afekcii zrakového nervu na zvieracích modeloch [23]. Shindler et al popísali indukciu apoptózy gangliových buniek vplyvom axonálneho poškodenia pri experimentálnej autoimunitnej encefalomyelitíde [24]. Redukciu gangliových buniek po afekciách zrakového nervu dokazujú i štúdie s využitím elektrofyziologických vyšetrovacích metód (elektroretinografia) [25]. Post mortem štúdie preukazujú zmeny vo vrstve nervových vláken sietnice a vrstve gangliových buniek a dokonca i vo vnútornej nukleárnej vrstve sietnice [26].
Zmeny, ktoré prebiehajú vo vrstve nervových vlákien sietnice, možno zaznamenať a kvantitatívne merať pomocou OCT. OCT je užitočný nástroj na detekciu straty axónov ako následku ON [6,27,28], vrátane detekcie subklinických axonálnych strát u pacientov s SM bez manifestnej ON [29]. Niektorí autori dokonca naznačujú, že analýza hrúbky RNFL môže byť užitočná v detekcii týchto degeneratívnych procesov v CNS už v počiatočných štádiách ochorenia [30].
Prvý in vivo klinický výzkum v súvislosti s SM a využitím OCT publikovali Parisi et al v roku 1999 [31]. Práca preukázala pokles hrúbky RNFL u pacientov s SM oproti zdravým pacientom a u očí postihnutých ON oproti nepostihnutým očiam. Ďalej dokazuje, ako axonálne zmeny v prednej časti zrakovej dráhy odzrkadľujú celkové zmeny v CNS u pacientov s SM, a stala sa tak základom pre ďalšie vedecké práce prehlbujúce poznatky o tomto ochorení [32].
Zaujímavé výsledky prináša súhrnná práca Petzolda et al [18], ktorá hodnotí úbytok RNFL v celkom 35 dostupných štúdiách vhodných pre metaanalýzu hrúbky RNFL. Striktne rozlišuje tri skupiny:
- A) postihnuté oči pacientov s SM s kontrolami,
- B) oči u pacientov s SM bez prejavov neuritídy s kontrolami,
- C) postihnuté a nepostihnuté oči tej istej skupiny pacientov.
Súbor a metodika
Do našej štúdie boli zaradení pacienti s klinicky izolovaným syndrómom (CIS), ktorý sa manifestoval jednostrannou ON, a pacienti s klinicky definitívnou SM. Celkovo bolo vyšetrených 124 očí u 62 pacientov vo veku od 22 do 63 rokov (priemerného veku 41,6 ± 12,8 roka), z toho 51 žien (82 %) a 11 mužov (18 %). Pacienti boli rozdelení do troch skupín: prvá skupina predstavovala 15 pacientov s CIS po jednostrannom ataku ON, druhá skupina zahŕňala 14 pacientov s SM bez výskytu manifestnej ON v anamnéze a tretiu skupinu tvorilo 33 pacientov s SM a anamnézou ON na jednom alebo oboch očiach. Túto skupinu sme ďalej podľa postihnutia očí rozdelili na podskupiny s monokulárnym a binokulárnym postihnutím. Do štúdie neboli zahrnutí pacienti s akútnou ON s trvaním menej ako tri mesiace od počiatku nástupu symptómov. Každé postihnuté oko bolo po maximálne dvoch atakoch ON.
Kontrolnú skupinu predstavovalo celkovo 30 očí 15 zdravých kontrol so zastúpením oboch pohlaví (štyri muži a 11 žien) a obdobného vekového zloženia (34,4 ± ± 10,1 roka) bez očných a neurologických chorôb.
Pacienti boli vyšetrení na našej klinike v období od januára 2013 do decembra 2014.
Zo štúdie boli vylúčené oči s inou očnou patológiou vrátane glaukómu, vekom podmienenej makulárnej degenerácie, amblyopie či vyšších refrakčných chýb (stredná a vysoká myopia, hypermetropia, vysoký astigmatizmus). Vylúčenie sa netýkalo refrakčných chýb v rozpätí od – 3,0 do+1,0 hodnoty sférickej dioptrie a ± 1,5 cylindrickej dioptrie.Vnútroočný tlak oboch očí pacien-tov bol opakovane menej ako 21 torrov,vstupná najlepšie korigovaná zraková ostrosť 0,5 a lepšia, nález na očnom pozadí oboch očí bez glaukómovej exkavácie na terči zrakového nervu, bez vrodených anomálií terča a bez iných ložiskových sietnicových nálezov. V osobnej anamnéze pacientov neboli prítomné iné diagnostikované či suspektné neurologické choroby.
Oči všetkých pacientov boli vyšetrené pomocou prístroja Cirrus HD OCT 4000 (Carl Zeiss Meditec, Dublin, CA, USA). Všetky OCT skeny robil jeden vyšetrujúci (M. M.). Vyšetrenia boli urobené v arteficiálnej mydriáze kvôli dosiahnutiu čo možno najlepšej kvality skenu. Vyradení boli pacienti, u ktorých nebolo možné dosiahnuť kvality skenu aspoň 7 bodov z celkových 10 možných. Bol použitý skenovací protokol ONH a RNFL Analysis: Optic disc cube 200 × 200, kde bola zmeraná priemerná hrúbka RNFL v peripapilárnej oblasti a hrúbka v jednotlivých kvadrantoch. Cirkulárny sken (A-sken) s priemerom 3,4 mm bol centrovaný na stred terča zrakového nervu. Pomocou softvéru príslušného zariadenia bola automaticky prepočítaná hrúbka RNFL v jednotlivých kvadrantoch. Typický fyziologický nález je uvedený na obr. 1. Príklady patologických nálezov sú na obr. 2 (pacient s CIS po unilaterálnej ON) a obr. 3 (SM po ON na oboch očiach).
Obr. 1. Fyziologický nález OCT. 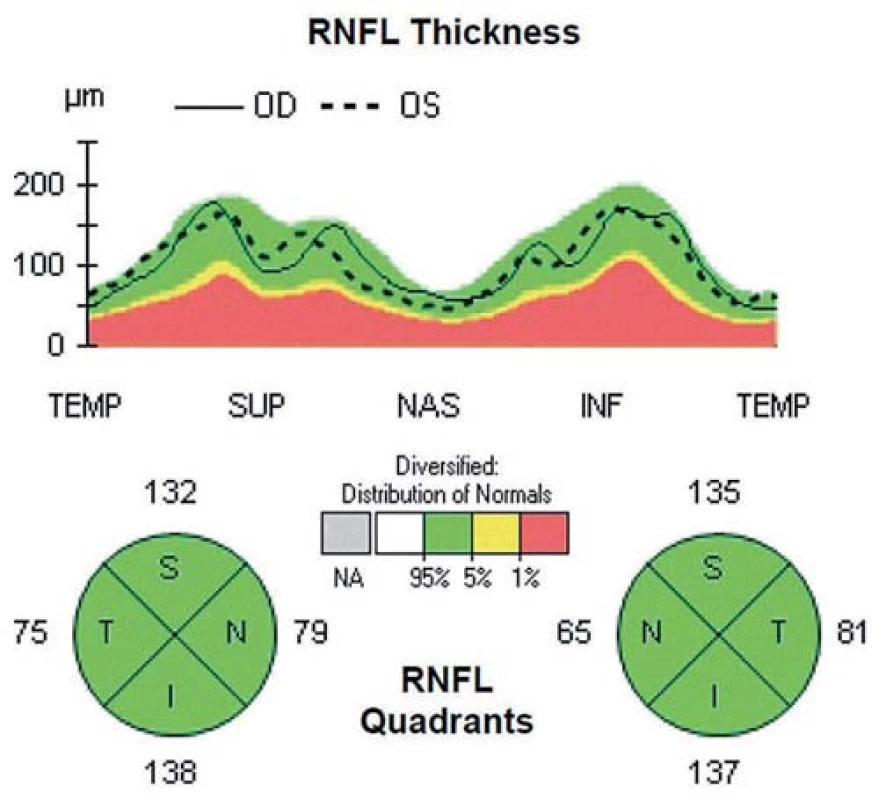
V hornej časti je schematicky zobrazená hrúbka RNFL v podobe tzv. TSNIT mapy, v dolnej časti je zobrazená hrúbka RNFL v jednotlivých kvadrantoch. Obr. 2. Patologický nález OCT u pacienta s CIS po ON na ľavom oku, kde je viditeľný pokles hrúbky RNFL v temporálnom kvadrante do hraničných hodnôt (podľa normatívnej databázy prístroja OCT). 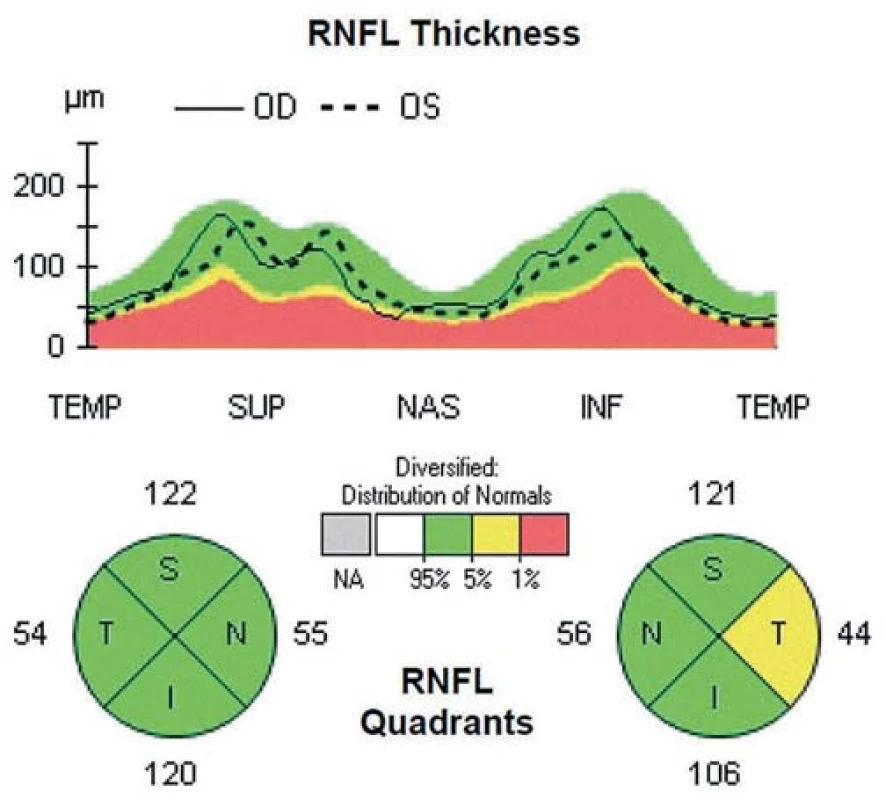
Obr. 3. Patologický nález OCT u pacienta s SM po opakovaných atakách ON na oboch očiach v priebehu ochorenia, kde je evidentná významná redukcia hrúbky RNFL vo viacerých kvadrantoch vrátane temporálneho kvadrantu na oboch očiach. 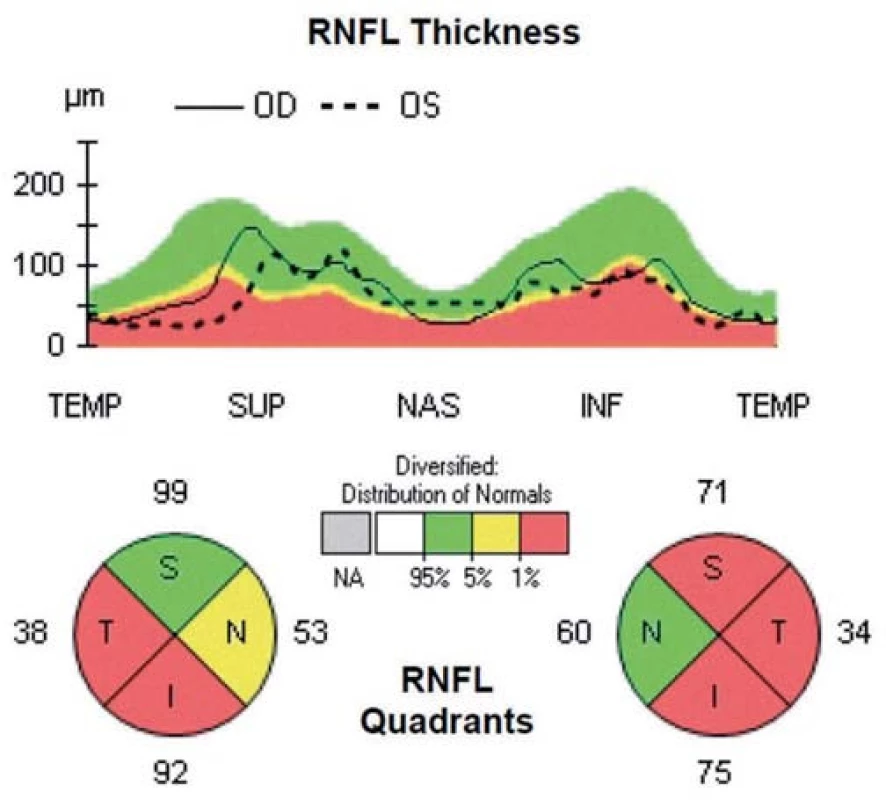
V hornej časti obrázkov je znázornená tzv. TSNIT mapa (názov pozostáva zo začiatočných písmen kvadrantov: T pre temporálny, S pre horný, N pre nazálny, I pre dolný a T opäť pre temporálny kvadrant). Na tejto mape je do roviny prekreslený 360-stupňový cirkulárny sken sietnice okolo terča zrakového nervu, so znázornenou hrúbkou RNFL, začínajúci i končiaci v temporálnom kvadrante. Plná čiara predstavuje hrúbku RNFL pravého oka, prerušovaná čiara hrúbku RNFL ľavého oka. V dolnej časti obrázkov je numerické vyjadrenie priemernej hrúbky RNFL v jednotlivých kvadrantoch pre každé oko. Hrúbka RNFL v jednotlivých kvadrantoch je tiež na základe normatívnej databázy vyjadrená kvalitatívne pomocou farieb, kde zelená predstavuje normálnu hrúbku RNFL, žltá hraničnú hrúbku a červená predstavuje významný pokles hrúbky RNFL.
Analýza výsledkov bola urobená v programe Statistica, verzia 12. Ako štatisticky významná hladina významnosti bola stanovená hodnota p ≤ 0,05.
Výsledky
Všetky namerané výsledky priemerných hodnôt hrúbky RNFL či hrúbky v jednotlivých kvadrantoch u jednotlivých skupín pacientov i kontrolnej skupiny sú uvedené v tab. 1 a v grafe 1.
Tab. 1. Priemerné hodnoty hrúbky RNFL v μm u rôznych skupín pacientov v porovnaní s kontrolnou skupinou. 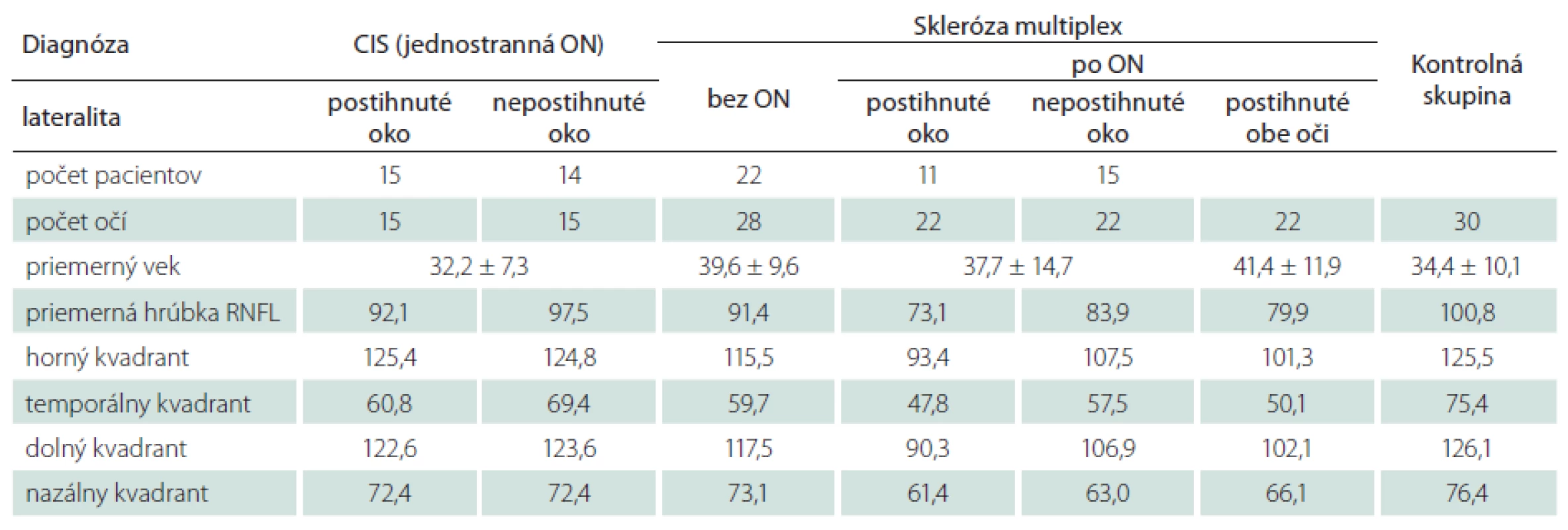
CIS – klinicky izolovaný syndróm, ON – optická neuritída, RNFL – vrstva nervových vláken sietnice. Graf 1. Priemerné hodnoty hrúbky RNFL v jednotlivých kvadrantoch u jednotlivých skupín pacientov v porovnaní s kontrolami. 
CIS – klinicky izolovaný syndróm, ON – optická neuritída, SM – skleróza multiplex. Hodnotenie zmien celkovej hrúbky RNFL
Z výsledku spracovania jednotlivých skupín vyplýva, že k najväčšiemu poklesu priemernej hrúbky RNFL dochádza u pacientov s SM po ataku ON. Na oku postihnutom ON u týchto pacientov bola priemerná hrúbka RNFL 73,1 ± 10,5 µm, na nepostihnutom oku rovnakého súboru pacientov priemerne 83,9 ± 13,8 µm. V súbore pacientov SM, kde boli v priebehu ochorenia obe oči postihnuté ON, bola priemerná hrúbka RNFL 79,9 ± 10,9 µm. U pacientov s CIS sú priemerné hodnoty hrúbky RNFL na nepostihnutom oku (97,5 ± 9,6 µm) porovnateľné s kontrolnou skupinou (100,8 ± 5,9 µm). Naopak mierne zníženú hodnotu priemernej hrúbky RNFL (92,1 ± 10,2 µm) sme zaznamenali na oku postihnutom ON u pacientov s CIS. Táto je porovnateľná s priemernou hodnotou hrúbky RNFL na očiach pacientov s diagnostikovanou SM bez prekonanej ON (91,4 ± 8,1 µm).
Hodnotenie zmien hrúbky RNFL v hornom kvadrante
V hornom kvadrante terča zrakového nervu boli najväčšie zmeny hrúbky RNFL zaznamenané u pacientov s potvrdenou SM a súčasne po ON, kde priemerná hrúbka činila iba 93,4 ± 10,3 µm. Mierne znížené hodnoty boli zaznamenané vo všetkých porovnávaných skupinách pacientov s SM po ON či bez nej. Naopak výsledky porovnateľné s hodnotou zdravej kontrolnej skupiny boli u pacientov s klinicky izolovaným syndrómom na postihnutom i nepostihnutom oku.
Hodnotenie zmien hrúbky RNFL v temporálnom kvadrante
V temporálnom kvadrante bol pokles hrúbky RNFL najvyšší opäť v skupine pacientov s SM po prekonanej ON na jednom oku (47,8 ± 12,0 µm) a tiež v skupine pacientov SM po obojstrannej ON (50,1 ± 11,9 µm). V ostatných skupinách boli výsledky v tomto kvadrante porovnateľné, tzn. znížené vo všetkých skupinách, vrátane skupiny pacientov s CIS na postihnutom (60,8 ± 11,1 µm) i nepostihnutom oku (69,4 ± 6,1 µm) proti kontrolám.
Hodnotenie zmien hrúbky RNFL v dolnom kvadrante
V dolnom kvadrante došlo k najväčšiemu zníženiu hrúbky RNFL v skupine pacientov s SM, a to najviac po prekonanej ON (90,3 ± 13,2 µm). V skupine s CIS boli hodnoty porovnateľné s kontrolami.
Hodnotenie zmien hrúbky RNFL v nazálnom kvadrante
V nazálnom kvadrante bol najväčší pokles opäť pozorovaný v skupine pacientov s SM, tak na oku postihnutom jednostrannou ON, ako i druhom, nepostihnutom oku. V ostatných skupinách, tzn. u pacientov s CIS a SM bez neuritídy, bol pokles hrúbky RNFL proti kontrolám minimálny.
Hrúbka RNFL v jednotlivých kvadrantoch u jednotlivých diagnóz v porovnaní s kontrolami je graficky znázornená v grafe 2.
Graf 2. Priemerné hodnoty hrúbky RNFL v jednotlivých kvadrantoch u jednotlivých skupín pacientov v porovnaní s kontrolami. 
CIS – klinicky izolovaný syndróm, ON – optická neuritída, SM – skleróza multiplex. Klinicky izolovaný syndróm s jednostrannou ON
Z výsledkov meraní a štatistického spracovania je zrejmé, že pri porovnaní súboru očí postihnutých ON u pacientov s CIS a kontrolnou skupinou je zreteľný štatisticky významný pokles celkovej hrúbky RNFL (p = 0,007), a to najmä v temporálnom kvadrante (p = 0,001), zatiaľ čo v ostatných kvadrantoch štatisticky významný rozdiel dokázaný nebol (p = 0,98; p = 0,61; p = 0,34) (tab. 2a). U kontralaterálneho, teda nepostihnutého oka sa štatistický významný rozdiel v hrúbke RNFL oproti kontrolám nepreukázal (p = 0,25) (tab. 2b).
Pri vzájomnom porovnaní jednotlivých kvadrantov postihnutých a nepostihnutých očí rovnakého súboru pacientov s CIS bol opäť zistený štatisticky významný rozdiel hrúbky RNFL v temporálnom kvadrante (p = 0,015). Pri porovnaní celkových priemerných hodnôt RNFL však rozdiel dokázaný nebol (p = 0,14) (tab. 3).
Tab. 2a. Priemerné hrúbky RNFL u pacientov CIS po ON, postihnuté oko pri porovnaní s kontrolami – štatistické spracovanie. 
Zvýraznené hodnoty predstavujú štatisticky signifikantný rozdiel oproti kontrolám. Vysvetlivky viz tab. 1. Tab. 2b. Priemerné hrúbky RNFL u pacientov s CIS po ON, nepostihnuté (tj. kontralaterálne) oko pri porovnaní s kontrolami – štatistické spracovanie. 
Vysvetlivky viz tab. 1. Tab. 2. Priemerné hodnoty hrúbky RNFL u pacientov s CIS po ON, porovnanie postihnutého s nepostihnutým okom toho istého súboru pacientov – štatistické spracovanie. 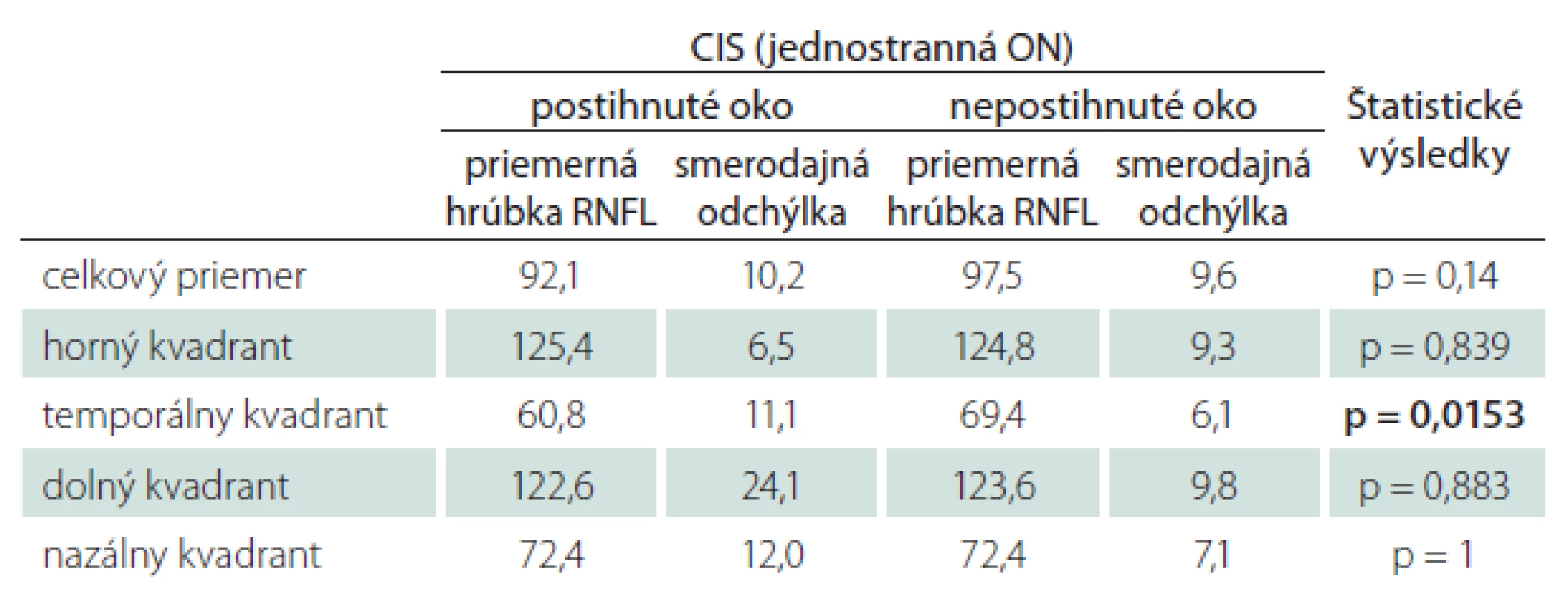
Vysvetlivky viz tab. 1. Zvýraznené hodnoty predstavujú štatisticky signifikantný rozdiel. SM bez ON
U pacientov s diagnostikovanou SM bez manifestnej ON bol zaznamenaný štatisticky významný rozdiel oproti kontrolnej skupine v celkovej priemernej hrúbke RNFL (p = 0,0003), a ďalej v troch kvadrantoch: hornom (p = 0,00078), temporálnom (p < 0,001) a dolnom (p = 0,0125). V nazálnom kvadrante rozdiel oproti kontrolám zaznamenaný nebol (p = 0,34) (tab. 4).
Tab. 3. Priemerné hodnoty hrúbky RNFL u pacientov s SM bez ON v anamnéze – štatistické spracovanie. 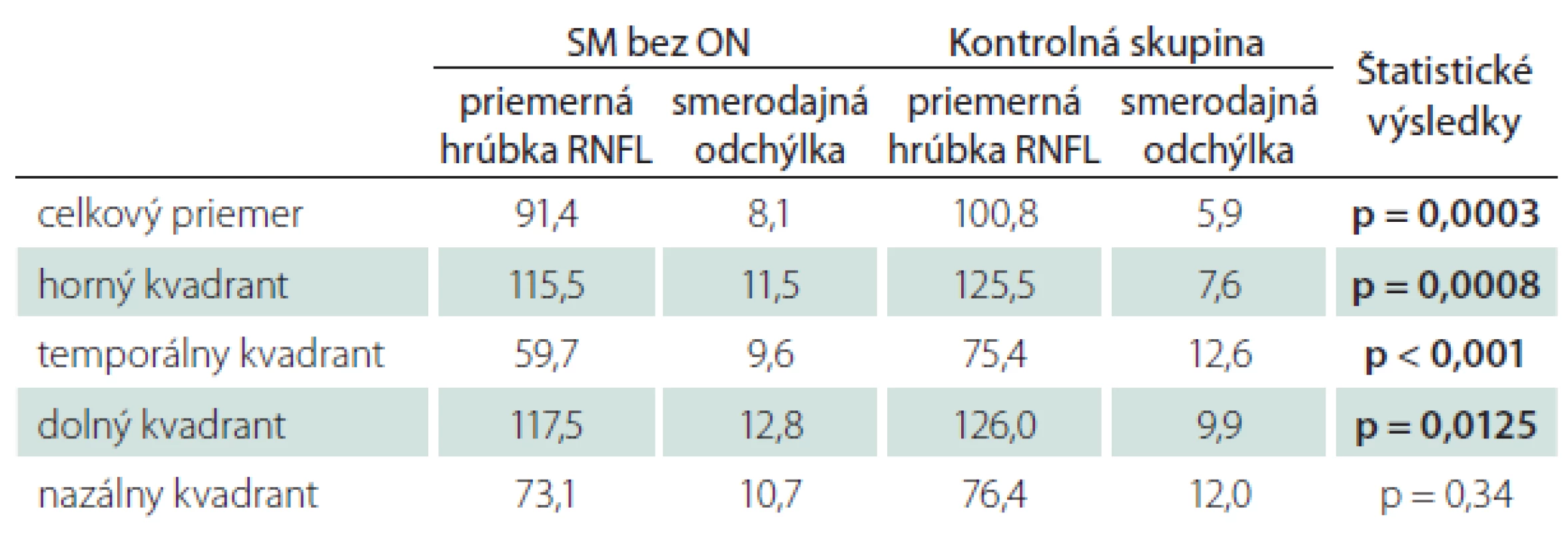
Vysvetlivky viz tab. 1. Zvýraznené hodnoty predstavujú štatisticky signifikantný rozdiel oproti kontrolám. SM s jednostranným výskytom ON
Oči pacientov s SM po ON mali podľa očakávania nižšiu priemernú hrúbku RNFL (73,1 µm ± 10,5 µm) v porovnaní s kontrolami (99,3 µm), čo predstavuje štatisticky významný rozdiel (p < 0,001) (tab. 5a). Tento rozdiel bol potvrdený i vo všetkých sledovaných kvadrantoch (p < 0,001). Na druhom, nepostihnutom oku tej istej skupiny pacientov tiež bola preukázaná štatisticky významná nižšia priemerná hrúbka RNFL (83,9 µm) i vo všetkých kvadrantoch (p < 0,001) oproti kontrolnej skupine (tab. 5b).
Tab. 5a. Priemerné hodnoty hrúbky RNFL u pacientov s SM s jednostrannou ON v anamnéze (postihnuté oko) – štatistické spracovanie. 
Vysvetlivky viz tab. 1. Zvýraznené hodnoty predstavujú štatisticky signifikantný rozdiel oproti kontrolám. Tab. 5b. Priemerné hodnoty hrúbky RNFL u pacientov s SM a jednostrannou ON v anamnéze (nepostihnuté oko) – štatistické spracovanie. 
Vysvetlivky viz tab. 1. Zvýraznené hodnoty predstavujú štatisticky signifikantný rozdiel oproti kontrolám. Pri štatistickom vzájomnom porovnaní postihnutých a nepostihnutých očí pacientov s SM bol preukázaný štatisticky významný rozdiel v celkovej priemernej hrúbke RNFL (p = 0,04), a tiež vo všetkých kvadrantoch (p = 0,0012; p = 0,016; p = 0,0003), okrem nazálneho kvadrantu (p = 0,64)(tab. 6).
Tab. 4. Priemerné hodnoty hrúbky RNFL u pacientov s SM a jednostrannou ON v anamnéze, vzájomné porovnanie postihnutého a nepostihnutého oka – štatistické spracovanie. 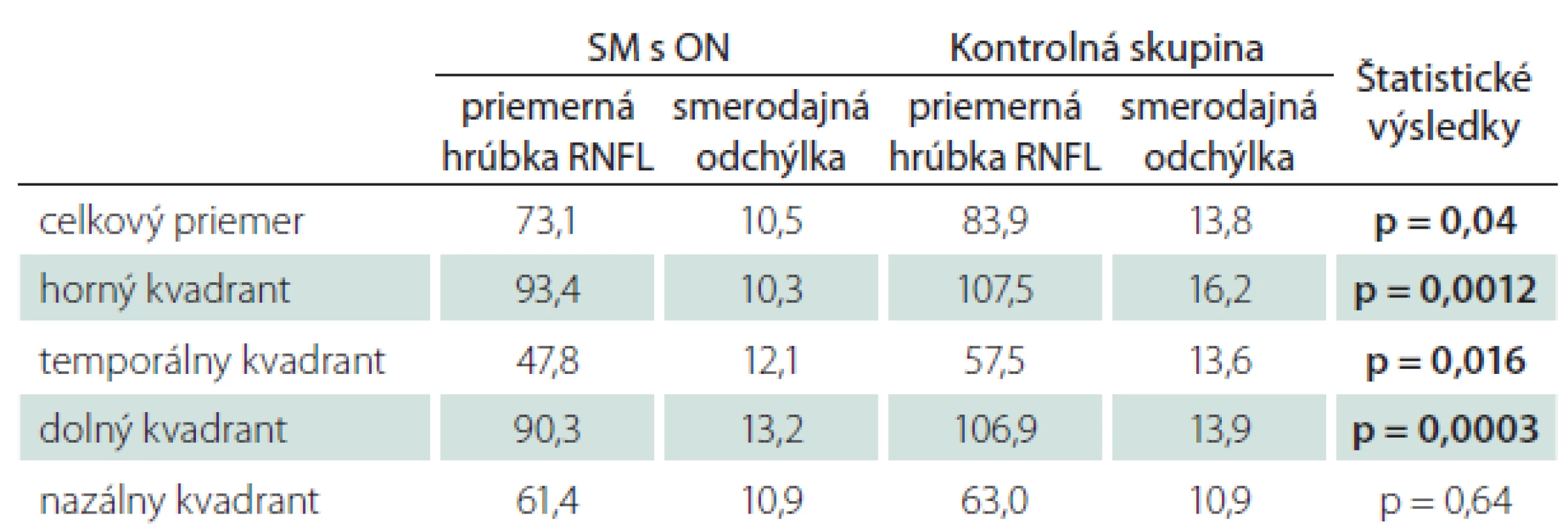
Vysvetlivky viz tab. 1. Zvýraznené hodnoty predstavujú štatisticky signifikantný rozdiel oproti kontrolám. SM s obojstranným výskytom ON
U pacientov s obojstranným výskytom ON pri klinicky definitívnej SM boli štatistické rozdiely oproti kontrolnej skupine preukázané vo všetkých kvadrantoch, vrátane celkového priemeru RNFL (p < 0,001; p = 0,0076) (tab. 7).
Tab. 5. Priemerné hodnoty hrúbky RNFL u pacientov s SM a ON v anamnéze na oboch očiach. Štatistické spracovanie. 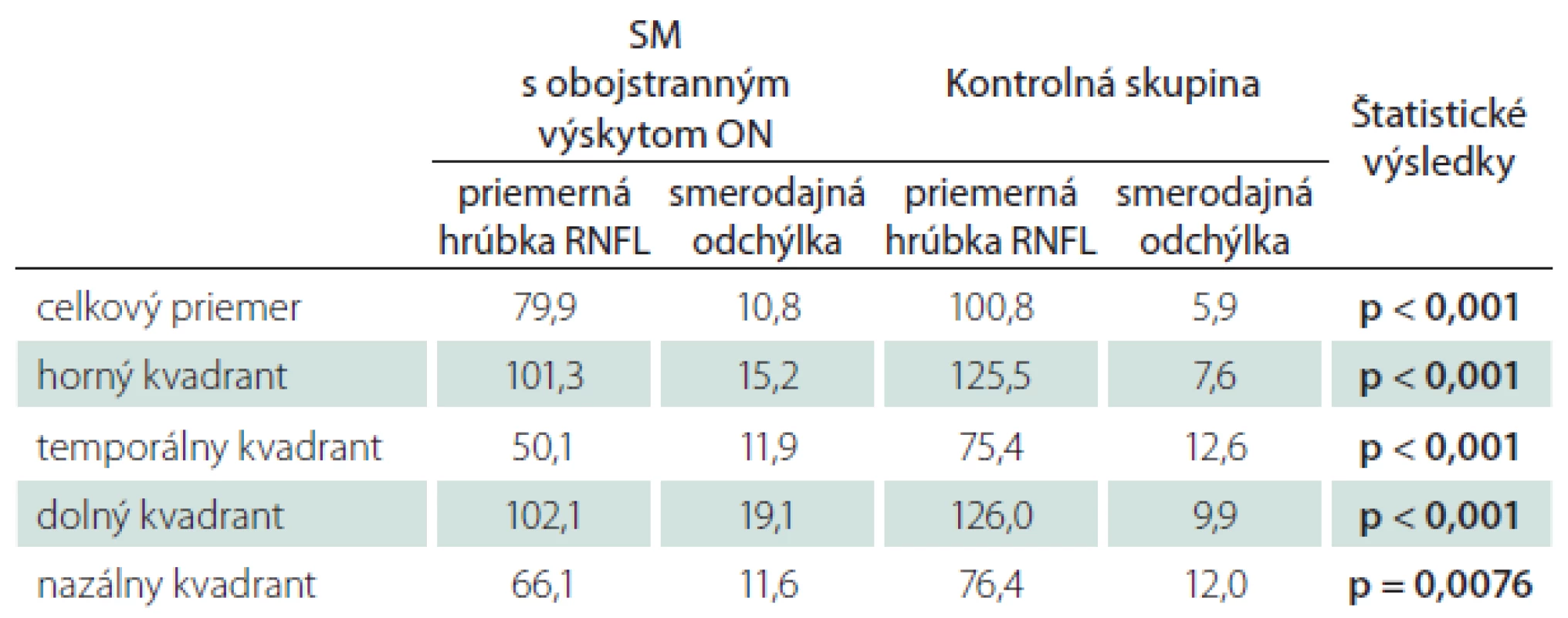
Vysvetlivky viz tab. 1. Zvýraznené hodnoty predstavujú štatisticky signifikantný rozdiel oproti kontrolám. Diskusia
SM je chronické zápalové ochorenie CNS charakterizované demyelinizáciou nervových vlákien s následným poškodzovaním vlastných axónov. V súčasnej dobe je preukázané, že k strate axónov môže dochádzať ihneď v úvode choroby behom prvého ataku SM. S ďalšou progresiou ochorenia postupne ubúda zápalových zmien a pribúda degenerácia, ktorá je charakterizovaná práve poškodením vlastných nervových vlákien a je zodpovedná za klinickú mieru disability daného pacienta.
Stratu axónov v ložiskových léziách CNS u SM popísal už Charcot v roku 1868 [33]. Friesen a Hoyt v roku 1973 zaznamenali defekty RNFL pri oftalmoskopickom vyšetrení sietnice u pacientov s SM a vyslovili predpoklad, že strata týchto axónov by mohla byť senzitívnym indikátorom demyelinizácie zrakového nervu [34].
Následne boli defekty u pacientov s SM potvrdené rôznymi autormi. Elbol a Work dokázali priamo pomocou oftalmoskopie (s použitím bezčerveného svetla) defekty RNFL u väčšiny pacientov s SM s ON (89 %) i bez ON (68 %) v anamnéze [35]. Defekty boli buď fokálneho alebo difúzneho charakteru. Fokálne (izolované) defekty v nazálnej časti sietnice dokázané neboli. Difúzne defekty boli prítomné najčastejšie v temporálnej oblasti sietnice (76 %) [35].
Klinicky izolovaný syndróm je považovaný za počiatočnú fázu vzniku SM [6,36]. Mnoho pacientov s CIS po prekonanej ON má na magnetickej rezonancii CNS nešpecifické zápalové zmeny (50 – 70 % prípadov). Výnimkou nie je ani abnormálny likvorový nález, ktorý zvyšuje pravdepodobnosť následnej diagnózy SM (60 – 70 % prípadov) [37 – 39].
Podobne ako v iných štúdiách bol u všetkých našich pacientov s CIS prítomný príznak manifestnej ON na jednom oku v anamnéze [6,28]. Štatisticky významný rozdiel v priemernej hrúbke RNFL u pacientov s CIS s prekonanou ON pri porovnaní so zdravou skupinou je v našej štúdii jednoznačný. Prospektívne štúdie udávaju redukciu priemernej hrúbky RNFL u pacientov s CIS o 20 – 25 % na postihnutom oku oproti oku nepostihnutému [27,40 – 42]. Takýto rozdiel v našom súbore však preukázaný nebol (iba 6 %), podobne ako v štúdii Yaua et al [43]. Tieto rozdiely v hrúbke RNFL medzi našou a ostatnými štúdiami možno vysvetliť použitím staršej generácie OCT v doposiaľ publikovaných štúdiách s danou problematikou a tiež individuálnymi rozdielmi v daných súboroch pacientov. Výsledky získané pomocou novšieho spektrálneho OCT sú presnejšie, a dávajú nám tak kvalitatívne hodnotnejšiu informáciu o hrúbke RNFL, čo sme využili v našej štúdii. Axonálna strata v rámci CIS postihuje difúzne celú peripapilárnu oblasť RNFL, s najväčším postihnutím temporálneho kvadrantu [41,44]. Kerrison et al dokázali, že atrofia RNFL je najmarkantnejšia práve v temporálnej časti sietnice [45]. Uvedené zistenia podporujú hypotézu, že nervové vlákna v temporálnej časti sietnice, teda v oblasti tzv. makulopapilárneho zväzku, ktoré vedú informáciu predovšetkým priamo z makuly, sú najcitlivejšie na ataky ON spojené s SM. To by vysvetľovalo významnú koreláciu so známym klinickým nálezom poklesu zrakových funkcií u takýchto pacientov. Tento záver podporujú i klinické štúdie [22,27,31]. Podľa niektorých autorov sa jednalo o redukciu hrúbky RNFL v temporálnom kvadrante až o 25 – 34 % [27,31,40]. V našom súbore pacientov to však bolo iba o 19 %. Rovnako ako naša práca, štúdie ďalej nepreukázali významnú redukciu RNFL na nepostihnutom oku u pacientov s CIS v porovnaní s kontrolami [28,40,41,46,47]. U našich pacientov s CIS po jednostrannej ON je pokles hrúbky RNFL evidentne spojený práve s touto afekciou. Túto teóriu podporuje okrem iného aj fakt, že hrúbka RNFL na druhom nepostihnutom oku je u týchto pacientov prakticky rovnaká v porovnaní s kontrolnou vzorkou zdravých kontrol.
Z našich výsledkov je zrejmé, že štatisticky významná strata axónov, a tým redukcia hrúbky RNFL, je prítomná i u očí pacientov s preukázanou SM bez manifestnej ON v anamnéze. Rovnaké závery uvádzajú aj iní autori [22,29,46]. Gundogan et al však popisujú signifikantný rozdiel hrúbky RNFL iba v temporálnom kvadrante [48]. Príčina úbytku axónov nie je úplne objasnená, ale predpokladá sa vplyv klinicky nemých demyelinizačných lézií zrakového nervu ako príčina poškodenia a následná retrográdna degenerácia axónov [49]. Priemerná strata je však u týchto očí nižšia než u očí s manifestnou ON v rámci SM [19,46,50], čo potvrdzuje i naše pozorovanie. Rovnako tak je táto strata nižšia než u očí nepostihnutých ON, kde však druhé oko už postihnuté bolo [29]. Pri porovnaní očí bez ON v anamnéze u pacientov s CIS a skupinou pacientov s klinicky definitívnou SM pozorujeme priemerne vyššie hodnoty v hrúbke RNFL u pacientov s CIS bez neuritídy, čo sa zhoduje s výsledkami iných autorov [50].
Vplyv možných klinicky nemých lézií zrakového nervu na hrúbku RNFL u pacientov s SM bez ON je síce teoreticky možný, ale toto vysvetlenie sa nezdá byť úplne uspokojivé. Pravdepodobnejšou príčinou sa zdá byť vplyv možnej celkovej neurodegenerácie CNS vplyvom SM na hrúbku tejto vrstvy sietnice.
Zmeny hrúbky RNFL u pacientov s SM a s ON v anamnéze sú preukázané klinickými štúdiami [29,31,46,50 – 54], a to najmä v prípade recidív ON [50]. Zníženie hrúbky RNFL bolo oproti kontrolám v našom súbore zaznamenané vo všetkých kvadrantoch. Pri vzájomnom porovnaní postihnutých a nepostihnutých očí bola nižšia priemerná hodnota hrúbky RNFL na postihnutom oku podobne ako v iných prácach [22,29,31,46]. Znížená hrúbka RNFL bola potvrdená v klinických štúdiách i u pacientov s SM na druhom nepostihnutom oku [22,31,46].
Súhrnne preto možno povedať, že podobne ako v práci Costella et al bol pri porovnaní priemernej hrúbky RNFL u pacientov s SM po ataku ON a u pacientov s CIS úbytok výraznejší u pacientov s SM [50].
Záver
Naša štúdia potvrdila úbytok vrstvy nervových vlákien sietnice u pacientov s SM oproti zdravej populácii a preukázala štatisticky signifikantné zmeny i u pacientov v počiatočnej fáze tohoto ochorenia (CIS).
Väčšina dosiaľ publikovaných prác iných autorov použila v meraní hrúbky RNFL OCT s časovou doménou (TD-OCT). Naše výsledky však boli získané pomocou OCT so spektrálnou doménou (SD-OCT). SD-OCT predstavuje novšiu, presnejšiu generáciu OCT, preto sa výsledky hodnôt získaných pomocou oboch typov OCT môžu vzájomne líšiť [55,56]. Absolútne hodnoty získané pomocou TD-OCT sú vo všeobecnosti vyššie ako hodnoty získané pomocou SD-OCT [55]. Bock et al demonštrovali vysokú koreláciu merania RNFL pomocou TD-OCT a SD-OCT, ale tiež zaznamenali významné rozdiely v meraní absolútnych hodnôt hrúbky RNFL [57].
Naša prierezová práca hodnotí aktuálny stav hrúbky RNFL u pacientov s CIS a SM. V ďalšom sledovaní by mohlo mať význam sledovanie možných zmien hrúbky RNFL v čase, resp. po každých ďalších atakoch ON. Ďalej z našej štúdie vyplýva, že pri sledovaní zmien RNFL má význam hlavne sledovanie celkovej hrúbky a sledovanie hrúbky v temporálnom kvadrante, kde je redukcia hrúbky tejto časti sietnice najčastejšia a klinicky najvýznamnejšia.
Pre dosiahnutie čo možno najobjektívnejších zmien hrúbky RNFL je nepochybne vhodné rozšíriť už existujúci súbor pacientov o ďalších pacientov s CIS a SM. U pacientov s SM môžu byť zaujímavé rozdiely v hrúbke RNFL u jednotlivých subtypov SM.
OCT je rýchla, neinvazívna, lacná a ľahko dostupná metóda (na rozdiel napr. od vyšetrenia MR), ktorá okrem iného umožňuje presne merať hrúbku RNFL, a dať tak informáciu o integrite axónov prednej časti zrakovej dráhy. Naša práca poukazuje na to, že vyšetrenie hrúbky RNFL pomocou čoraz viac dostupného SD-OCT môže mať význam pri hodnotení stavu možnej neurodegenerácie pri SM, ako preukazujú početné zahraničné publikácie [18]. OCT tak ponúka možnosti sledovania progrese vlastného ochorenia a tiež predstavuje sľubný nástroj k sledovaniu prípadného neuroprotektívneho vplyvu liečby SM.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Prijaté k recenzii: 9. 7. 2015
Prijaté do tlače: 9. 11. 2015
MUDr. Marek Michalec
Oční klinika
LF MU a FN Brno
Jihlavská 20
625 00 Brno
e-mail: marek.michalec@fnbrno.cz
Zdroje
1. Shams PN, Plant GT. Optic neuritis: a review. Int MS J 2009; 16(3): 82 – 89.
2. Rizzo JF, Lessell S. Risk of developing multiple sclerosis after uncomplicated optic neuritis: a long-term prospective study. Neurology 1988; 38(2): 185 – 190.
3. Optic Neuritis Study Group. Multiple sclerosis risk after optic neuritis: final optic neuritis treatment trial follow--up. Arch Neurol 2008; 65(6): 727 – 732. doi: 10.1001/ archneur.65.6.727.
4. Volpe N. The optic neuritis treatment trial. A definitive answer and profound impact with unexpected results. Arch Ophthalmol 2008; 126(7): 996 – 999. doi: 10.1001/ archopht.126.7.996.
5. Sadun AA. Optic atrophy and papilledema. In: Albert DM, Jakobiec FA (eds). Principle and practice of ophthalmology. 2nd ed. Philadelphia: WB Saunders 2000 : 4108 – 4116.
6. Noval S, Contreras I, Munoz S, Oreja-Guevara C, Manzano B, Rebolleda G. Optical coherence tomography in multiples sclerosis and neuromyelitis optica: an update. Mult Scler Int 2011; 2011 : 472790. doi: 10.1155/ 2011/ 472790.
7. Kusuhara S, Nakamura M, Nagai-Kusuhara A, Nakanishi Y, Kanamori A, Negi A. Macular thickness reduction in eyes with unilateral optic atrophy detected with optical coherence tomography. Eye (Lond) 2006; 20(8): 882 – 887.
8. Alasil T, Wang K, Keane PA, Lee H, Baniasadi N, de Boer JF et al. Analysis of normal retinal nerve fiber layer thickness by age, sex, and race using spectral domain optical coherence tomography. J Glaucoma 2013; 22(7): 532 – 541. doi: 10.1097/ IJG.0b013e318255bb4a.
9. Mohammad Salih PA. Evaluation of peripapillary retinal nerve fiber layer thickness in myopic eyes by spectral-domain optical coherence tomography. J Glaucoma 2012; 21(1): 41 – 44. doi: 10.1097/ IJG.0b013e3181fc8053.
10. Rauscher FM, Sekhon N, Feuer WJ, Budenz DL. Myopia affects retinal nerve fiber layer measurements as determined by optical coherence tomography. J Glaucoma 2009; 18(7): 501 – 505. doi: 10.1097/ IJG.0b013e318193c2be.
11. Leung CK, Cheung CY, Weinreb RN, Qiu K, Liu S, Li H et al. Evaluation of retinal nerve fiber layer progression in glaucoma: a study on optical coherence tomography guided progression analysis. Invest Ophthalmol Vis Sci 2010; 51(1): 217 – 222. doi: 10.1167/ iovs.09-3468.
12. Kirbas S, Turkyilmaz K, Tufekci A, Durmus M. Retinal nerve fiber layer thickness in Parkinson disease. J Neuroophthalmol 2013; 33(1): 62 – 65. doi: 10.1097/ WNO.0b013e3182701745.
13. Altintas O, Iseri P, Ozkan B, Caglar Y. Correlation between retinal morphological and functional findings and clinical severity in Parkinson’s disease. Doc Ophthalmol 2008; 116(2): 137 – 146.
14. Frohman EM, Fujimoto JG, Frohman TC, Calabresi PA, Cutter G, Balcer LJ. Optical coherence tomography: a window into the mechanisms of multiple sclerosis. Nat Clin Pract Neurol 2008; 49(12): 664 – 675. doi: 10.1038/ ncpneuro0950.
15. Kirbas S, Turkyilmaz K, Anlar O, Tufekci A, Durmus M. Retinal nerve fiber layer thickness in patients with Alzheimer’s disease. J Neuroophthalmol 2013; 33(1): 58 – 61. doi: 10.1097/ WNO.0b013e318267fd5f.
16. Berisha F, Feke GT, Trempe CL, McMeel JW, Schepens CL. Retinal abnormalities in early Alzheimer‘s dis ease. Invest Ophthalmol Vis Sci 2007; 48(5): 2285 – 2289. doi: 10.1167/ iovs.06-1029.
17. Parisi V, Restuccia R, Fattapposta F, Mina C, Bucci MG, Pierelli F. Morphological and functional retinal impairment in Alzheimer‘s disease patients. Clin Neurophysiol 2001; 112(10): 1860 – 1867.
18. Petzold A, de Boer JF, Schippling S, Vermersch P, Kardon R, Green A et al. Optical coherence tomography in multiple sclerosis: a systematic review and meta-analysis. Lancet Neurol 2010; 9(9): 921 – 932. doi: 10.1016/ S1474-4422(10)70168-X.
19. Newman N, Hoyt W. Ophthalmologic observation of retinal nerve fiber layer damage. West J Med 1975; 122(3): 238 – 239.
20. Syc SB, Warner CV, Hiremath GS, Farrell SK, Ratchford JN, Conger A et al. Reproducibility of high-resolution optical coherence tomographx in multiple slerosis. Mult Scler 2010; 16(7): 829 – 839. doi: 10.1177/ 1352458510371640.
21. Matušková V, Lízrová Preiningerová J, Vysloužilová D, Michalec M, Kasl Z, Vlková E. Použití optické koherenční tomografie u roztroušené sklerózy. Cesk Slov Neurol N 2016; 79/ 112(1): 33–40.
22. Henderson AP, Trip SA, Schlottmann PG, Altmann DR, Garway-Heath DF, Plant GT et al. An investigation of the retinal nerve fiber layer in progressive multiple sclerosis using optical coherence tomography. Brain 2008; 131(1): 277 – 287.
23. Levkovitch-Verbin H, Quigley HA, Kerrigan-Baumrind LA, Danna S, Kerrigan D, Pease ME. Optic nerve transection in monkeys may result in secondary degeneration of retinal ganglion cells. Invest Ophthalmol Vis Sci 2001; 42(5): 975 – 982.
24. Shindler KS, Ventura E, Dutt M, Rostami A. Inflammatory demyelination induces axonal injury and retinal ganglion apoptosis in experimental optic neuritis. Exp Eye Res 2008; 87(3): 208 – 213. doi: 10.1016/ j.exer.2008.05.017.
25. Kaufman D, Celesia GG. Simultaneous recording of pattern electroretinogram and visual evoked responses in neuro-ophthalmic disorders. Neurology 1985; 35(5): 644 – 651.
26. Green AJ, McQuaid S, Haser SL, Allen IV, Lynnes R. Ocular pathology in multiple sclerosis: retinal atrophy and inflammation irrespective of disease duration. Brain 2010; 133(6): 1591 – 1601. doi: 10.1093/ brain/ awq080.
27. Costello F, Coupland S, Hodge W, Lorello GR, Koroluk J, Pan YI et al. Quantifying axonal loss after optic neuritis with optical coherence tomography. Ann Neurol 2006; 59(6): 963 – 969.
28. Trip SA, Schlottmann PG, Jones SJ, Altmann DR, Garway-Heath DF, Thompson AJ et al. Retinal nerve fiber layer axonal loss and visual dysfunction in optic neuritis. Ann Neurol 2005; 58(3): 383 – 391.
29. Pulicken M, Gordon-Lipkin E, Balcer LJ, Frohman E, Cutter G, Calabresi PA. Optical coherence tomography and disease subtype in multiple sclerosis. Neurology 2007; 69(22): 2085 – 2092. doi: 10.1212/ 01.wnl.0000294876.49861.dc.
30. Kim JS, Ishikawa H, Sung KR, Xu J, Wollstein G, Bilonic RA et al. Retinal nerve fiber layer thickness measurement reproducibility improved with spectral domain optical coherence tomography. Br J Ophthalmol 2009; 93(8): 1057 – 1063. doi: 10.1136/ bjo.2009.157875.
31. Parisi V, Mannini G, Spadaro M, Colacino G, Restuc-cia R, Marchi S et al. Correlation between morphological and functional retinal impairment in multiple sclerosis patients. Invest Ophthalmol Vis Sci 1999; 40(11): 2520 – 2527.
32. Costello F. Evaluating the use of optical coherence tomography in optic neuritis. Mult Scler Int 2011; 2011 : 148394. doi: 10.1155/ 2011/ 148394.
33. Charcot JM. Histologie de la sclérose en plaques. Gaz Hop (Paris) 1868; 41 : 554 – 555, 557 – 558, 566.
34. Friesen L, Hoyt WF. Insidious atrophy of retinal nerve fibers in multiple sclerosis. Funduscopic identification in patients with and without visual complaints. Arch Ophthalmol 1974; 92(2): 91 – 97.
35. Elbol P, Work K. Retinal nerve fibre layer in multiple sclerosis. Acta Ophthalmol 1990; 68(4): 481 – 486.
36. Oreja-Guevara C, Noval S, Manzano B, Diez-Tejedor E. Optic neuritis, multiple sclerosis-related or not: structural and functional study. Neurologia 2010; 25(2): 78 – 82.
37. Hickman SJ, Dalton CM, Miller DH, Plant GT. Management of acute optic neuritis. Lancet 2002; 360(9349): 1953 – 1962.
38. Beck RW, Trobe JD, Moke PS, Gal RL, Xing D, Bhatti MT et al. High - and low-risk profiles for the development of multiple sclerosis within 10 years after optic neuritis: experience of the optic neuritis treatment trial. Arch Ophthalmol 2003; 121(7): 944 – 949.
39. Beck RW, Moke PS, Trobe JD. The 5-year risk of MS after optic neuritis. Neurology 1998; 51(4): 1237 – 1238.
40. Bertuzzi F, Suzani M, Tagliabue E, Cavaletti G, Angeli R, Balgera R et al. Diagnostic validity of optic disc and retinal nerves fibre layer evaluations in detecting structural changes after optic neuritis, Ophthalmology 2010; 117(6): 1256 – 1264. doi: 10.1016/ j.ophtha.2010.02.024.
41. Costello F, Hodge W, Pan YI, Eggenberger E, Coupland S, Kardon RH. Tracking retinal nerve fiber layer loss after optic neuritis: a prospective study using optical coherence tomography. Mult Scler 2008; 14(7): 893 – 905. doi: 10.1177/ 1352458508091367.
42. Klistorner A, Arvind H, Nguyen T, Garrick R, Paine M, Graham S et al. Axonal loss and myelin in early ON loss in postacute optic neuritis. Ann Neurol 2008; 64(3): 325 – 331. doi: 10.1002/ ana.21474.
43. Yau GS, Lee JW, Lau PP, Tam VT, Wong WW, Yuen CY. Longitudinal changes in retinal nerve fibre layer thickness after an isolated unilateral retrobulbar optic neuritis: 1-year results. Neuroophthalmology 2015; 39(1): 22 – 25. doi: 10.3109/ 01658107.2014.984230.
44. Halliday AM, McDonald WI, Mushin J. Visual - evoked response in diagnosis of multiple sclerosis. Br Med J 1973; 4(5893): 661 – 664.
45. Kerrison JB, Flynn T, Green WR. Retinal changes in multiple sclerosis. Retina 1994; 14(5): 445 – 451.
46. Fisher JB, Jacobs DA, Markowitz CE, Galetta SL, Volpe NJ, Nano-Schiavi ML et al. Relation of visual function to retinal nerve fiber layer thickness in multiple sclerosis. Ophthalmology 2006; 113(2): 324 – 332.
47. Outteryck O, Zephyr H, Defoort S, Bouyon M, Debruyne P, Bouacha I et al. Optical coherence tomography in clinically isolated syndrome: no evidence of subclinical retinal axonal loss. Arch Neurol 2009; 66(11): 1373 – 1377. doi: 10.1001/ archneurol.2009.265.
48. Gundogan FC, Demirkaya S, Sobaci G. Is optical coherence tomography really a new biomarker candidate in multiple sclerosis? A structural and functional evaluation. Invest Ophthalmol Vis Sci 2007; 48(12): 5773 – 5781. doi: 10.1167/ iovs.07-0834.
49. Khanifar AA, Parlitsis GJ, Ehrlich JR, Aaker GD, D‘Amico DJ, Gauthier AS et al. Retinal nerve fiber layer evaluation in multiple sclerosis with spectral domain optical coherence tomography. Clin Ophthalmol 2010; 4 : 1007 – 1013.
50. Costello F, Hodge W, Pan YI, Eggenberger E, Freedman MS. Using retinal architecture to help characterize multiple sclerosis patients. Can J Ophthalmol 2010; 45(5): 520 – 526. doi: 10.3129/ i10-063.
51. Burkholder BM, Osborne B, Loguidice MJ, Bisker E, Frohman TC, Conger A et al. Macular volume determined by optical coherence tomography as a measure of neuronal loss in multiple sclerosis. Arch Neurol 2009; 66(11): 1366 – 1372. doi: 10.1001/ archneurol.2009.230.
52. Talman LS, Bisker ER, Sackel DJ, Long DA jr, Galetta KM, Ratchford JN et al. Longitudinal study of vision and retinal nerve fiber layer thickness in multiple sclerosis. Ann Neurol 2010; 67(6): 749 – 760. doi: 10.1002/ ana.22005.
53. Pueyo V, Martin J, Fernandez J, Almarcegui C, Ara J, Egea C et al. Axonal loss in the retinal nerve fiber layer in patients with multiple sclerosis. Mult Scler 2008; 14(5): 609 – 614. doi: 10.1177/ 1352458507087326.
54. Frohman E, Costello F, Zivadinov R, Stuve O,Conger A, Winslow H. Optical coherence tomography in multiple sclerosis. Lancet Neurol 2006; 5(10): 853 – 863.
55. Knight OJ, Chang RT, Feuer WJ, Budenz DL. Comparison of retinal nerve fiber layer measurements using time domain and spectral domain optical coherent tomography. Ophthalmology 2009; 116(7): 1271 – 1277. doi: 10.1016/ j.ophtha.2008.12.032.
56. Giani A, Cigada M, Choudhry N, Deiro AP, Oldani M, Pellegrini M et al. Reproducibility of retinal thickness measurements on normal and pathologic eyes by different optical coherence tomography instruments. Am J Ophthalmol 2010; 150(6): 815 – 824. doi: 10.1016/ j.ajo.2010.06.025.
57. Bock M, Brandt AU, Dörr J, Pfueller CF, Ohlraun S, Zipp F et al. Time domain and spectral domain optical coherence tomography in multiple sclerosis: a comparative cross-sectional study. Mult Scler 2010; 16(7): 893 – 896. doi: 10.1177/ 1352458510365156.
Štítky
Dětská neurologie Neurochirurgie Neurologie
Článek vyšel v časopiseČeská a slovenská neurologie a neurochirurgie
Nejčtenější tento týden
2016 Číslo 1- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Magnosolv a jeho využití v neurologii
- Zolpidem může mít širší spektrum účinků, než jsme se doposud domnívali, a mnohdy i překvapivé
- Nejčastější nežádoucí účinky venlafaxinu během terapie odeznívají
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
-
Všechny články tohoto čísla
- Konsenzus a návrh k algoritmu léčby – mechanická trombektomie u akutního mozkového infarktu
- Webové okénko
-
Analýza dat v neurologii
LV. Koncept atributivního rizika v analýze populačních studií – II. Vícenásobný vliv rizikových faktorů -
Zomrel prof. MU Dr. Ján Faguľa, DrSc.
1. 8. 1930– 4. 11. 2015 - Recenze knih
- Moderní dlouhodobá léčba pacientů s RS – vyvážení přínosů a rizik
- Parkinsonova choroba JE priónové ochorenie
- Parkinsonova nemoc NENÍ prionové onemocnění
-
Komentář ke kontroverzím
Je Parkinsonova choroba prionové onemocnění? - Psychické poruchy a kardiovaskulární onemocnění
- Použití optické koherenční tomografie u roztroušené sklerózy
- Pozorovanie hrúbky vrstvy nervových vlákien sietnice u pacientov so sklerózou multiplex pomocou optickej koherentnej tomografie
- Sympatická kožní odpověď v diagnostice neuropatie tenkých vláken
- Editorial
- Kardioembolizace je nejčastější příčinou akutní ischemické cévní mozkové příhody u pacientů přijatých do Komplexního cerebrovaskulárního centra do 12 hodin od začátku příznaků – výsledky studie HISTORY
- Dynamické metody kvantitativního testování senzitivity
- Indikace dekompresivní kraniektomie
- Projekt ncRNAPain
- Komplikace kranioplastik po dekompresivní kraniektomii
- Možnosti terapie pacientů s meningeomem grade III
- Promptní resorpce traumatického akutního subdurálního hematomu – kazuistika
- Neobvyklá příčina spánkové apnoe – kazuistika
- Spinální epidurální lipomatóza – tři kazuistiky
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Sympatická kožní odpověď v diagnostice neuropatie tenkých vláken
- Pozorovanie hrúbky vrstvy nervových vlákien sietnice u pacientov so sklerózou multiplex pomocou optickej koherentnej tomografie
- Komplikace kranioplastik po dekompresivní kraniektomii
- Indikace dekompresivní kraniektomie
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



