-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Penilní vibrostimulace u pacientů s míšním poraněním
Penile Vibratory Stimulation in Patients with Spinal Cord Injury
Objectives:
Following spinal cord injury (SCI), ejaculatory dysfunctions are frequent. In men who wish to father children, assisted sperm retrieval is often necessary. Penile vibratory stimulation (PVS) is a non-invasive method for sperm retrieval in patients with a lesion above T10. The aim of our research was to evaluate the effectiveness and safety of PVS, semen quality and further utilization of the ejaculate.Methods:
Between 2010 and 2014, we performed PVS in 20 patients. An injury of the cervical (C) and thoracic (T) spinal cord was present in 13 and seven patients, respectively. The mean age of patients was 30.8 years. The mean time from the injury to PVS was 64 months. Seven patients had the first PVS more than 3.5 years after the injury and 13 patients less than 3.5 years. FERTI CARE Multicept was used for PVS.Results:
Ejaculation was achieved in 11 patients (55%) – in nine with C and in two with T SCI. Success rate of PVS in patients less than 3.5 years after the injury was 77%, compared to 14% in patients more than 3.5 years after the injury, p = 0.027. Total sperm count (p = 0.03), sperm concentration (p = 0.025) and the number of sperm with progressive motility (p = 0.027) increased in the semen from the second PVS. Obtained ejaculate is mostly (72%) cryopreserved only for further use. The ejaculate was used for fertilisation in two patients. One patient had azoospermia. Autonomic dysreflexia during PVS occurred in seven patients, symptoms resolved within 3 mins.Conclusion:
PVS is a safe method for sperm retrieval. Semen quality improved with repeated PVS. The ejaculate was successfully used for fertilisation in two patients.Key words:
penile vibratory stimulation – spinal cord injury – anejaculation
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Autoři: M. Čechová 1; J. Kříž 2; P. Paulasová 3; J. Černíková 3; M. Chocholatý 1
Působiště autorů: Urologická klinika 2. LF UK a FN v Motole, Praha 1; Spinální jednotka při Klinice RHB a TVL 2. LF UK a FN v Motole, Praha 2; Ústav biologie a lékařské genetiky, 2. LF UK a FN v Motole, Praha 3
Vyšlo v časopise: Cesk Slov Neurol N 2015; 78/111(2): 200-204
Kategorie: Krátké sdělení
Souhrn
Úvod, cíle:
Poruchy ejakulace jsou po míšním poranění velmi časté. U nemocných s přáním vlastního potomka je většinou nutný asistovaný odběr spermií. Penilní vibrostimulace (PVS) je neinvazivní metoda k získání ejakulátu u pacientů s lézí nad úrovní T10. Cílem práce je zhodnocení efektivity a bezpečnosti PVS, vyhodnocení kvality a dalšího využití ejakulátu.Metodika:
Od 2010 do 2014 jsme provedli PVS u 20 pacientů. Poranění krční (C) míchy bylo u 13 pacientů, hrudní (T) míchy u sedmi pacientů. Průměrný věk byl 30,8 let. Průměrná doba od úrazu do PVS byla 64 měsíců. První PVS mělo sedm nemocných déle než 3,5 roku a 13 do 3,5 roku od úrazu. K PVS jsme užili přístroj FERTI CARE Multicept.Výsledky:
Ejakulace jsme dosáhli u 11 pacientů (55 %), z toho devět mělo poranění C míchy a dva T míchy. U nemocných se začátkem PVS do 3,5 roku od poranění byla úspěšnost 77 % a nad 3,5 roku 14 %, p = 0,027. Při srovnání ejakulátu z druhé PVS došlo ke zvýšení celkového počtu spermií (p = 0,03), koncentrace spermií (p = 0,025) a počtu progresivně pohyblivých spermií (p = 0,027) oproti první PVS. Získaný ejakulát je v 72 % pouze kryoprezervován k pozdějšímu využití. U dvou pacientů byl ejakulát použit k fertilizaci. Jeden nemocný měl azoospermii. Autonomní dysreflexie se vyskytla v průběhu PVS u sedmi pacientů, příznaky odezněly do 3 min.Závěr:
PVS je bezpečná metoda asistovaného odběru ejakulátu. Při opakování PVS jsme zjistili zlepšení kvality ejakulátu. U dvou pacientů byl ejakulát úspěšně použit k fertilizaci.Klíčová slova:
penilní vibrostimulace – míšní poranění – anejakulace
Incidence traumatických poranění míchy je celosvětově odhadována na 23 případů na 1 000 000 obyvatel na rok [1]. Incidence netraumatických míšních lézí není přesně známa, odhady pro západní Evropu udávají šest případů na 1 000 000 obyvatel na rok [2]. V České republice dochází každoročně přibližně k 300 novým poraněním míchy [3]. Z toho okolo 200 poranění je traumatického a 100 netraumatického původu [3]. Mezi nejčastější příčiny traumatického míšního poranění patří auto ‑ a motonehody, pády z výšky, skoky do vody a sportovní úrazy. Netraumatické poškození míchy vzniká nejčastěji vlivem zánětlivých, vaskulárních a nádorových procesů. K traumatickému míšnímu poranění dochází nejčastěji mezi 20 – 40 rokem života, výrazně častěji postihuje muže (poměr muži : ženy je 4 : 1) [3]. V České republice je nejčastěji úroveň přerušeného míšního segmentu cervikální (44 – 49 %), dále torakální (40 – 42 %), méně častá jsou poranění lumbálního segmentu (11 – 15 %) [3]. Poranění míchy může být kompletní, častější je poranění inkompletní. Míšní poranění je spojeno se zhoršením fertility, které je dáno především poruchami ejakulace a snížením kvality ejakulátu. Poruchy ejakulace jsou u mužů po míšním poranění velmi časté. Spontánní ejakulace bývá zachována u pacientů s kompletní míšní lézí pouze v 11 %, s nekompletní lézí ve 33 % [4]. U většiny nemocných je tedy nutný asistovaný odběr spermií při přání vlastního potomka. Ejakulát můžeme získat penilní vibrostimulací (PVS), elektroejakulací nebo masáží prostaty. Spermie je také možné chirurgicky odebrat z varlete či nadvarlete.
Od 90. let 20. století je PVS metodou první volby k odběru ejakulátu u pacientů po míšním poranění trpících anejakulací [5]. Stimulací glandu či frenula vibrostimulátorem dochází u některých nemocných k vyvolání reflexní ejakulace. Vibrační stimuly jsou přenášeny aferentními vlákny nervus dorsalis penis do sakrálních parasympatických jader (S2 – S4) podílejících se spolu se somatickými motoneurony na reflexní ejakulaci [5 – 7]. V torakolumbální míše (T11 – L1) se nachází emisní centrum, sympatické motoneurony, zodpovědné za emisi ejakulátu [6,8]. K vyvolání reflexní ejakulace vibrostimulací je nutný intaktní dorzální nerv a intaktní reflexní ejakulační oblouk, který závisí na zachování integrity míšních segmentů T11 – S4 [9]. U pacientů s poraněním nad T10 je tedy šance na vyvolání reflexní ejakulace a jsou vhodnými kandidáty pro PVS. U pacientů s lézí nad míšním segmentem T6 bývá ejakulační reflex zachován v 74,7 %, s lézí mezi segmenty T7 – T12 v 16,9 %, při lézi v lumbosakrální oblasti pouze v 8,4 % [10]. Navíc v porovnání s dalšími metodami je kvalita získaného ejakulátu pomocí PVS vyšší [11,12].
Cílem naší práce bylo zhodnocení efektivity a bezpečnosti PVS na vlastním souboru pacientů, vyhodnocení kvality a dalšího užití získaného ejakulátu. Současně bychom chtěli přispět ke zvýšení informovanosti o této metodě asistovaného odběru ejakulátu, která zatím v České republice není široce dostupná.
Metodika
Charakteristika souboru
Od října 2010 do června 2014 jsme provedli PVS u 20 pacientů. Neurologickou úroveň léze v oblasti krční páteře mělo 13 pacientů a sedm pacientů v oblasti hrudní páteře. U většiny pacientů (75 %) se jednalo o kompletní míšní lézi AIS A (American spinal Injury association impairment Scale A), senzitivně nekompletní léze AIS B byla přítomna u čtyř pacientů a motoricky nekompletní léze AIS Cu dvou pacientů. K poranění míchy došlo u devíti pacientů při automobilové či motocyklové nehodě, u sedmi pacientů při skoku do vody, u dvou při pádu z výšky a u dvou pacientů při sportovním úrazu. Metody čisté intermitentní katetrizace k vyprazdňování měchýře využívalo 11 nemocných, osm nemocných mělo založenou epicystostomii a jeden nemocný s lézí C4 využíval metodu triggerování k vyvolání spontánní mikce. Průměrný věk pacientů v době první PVS byl 30,8 let (20 – 44 let). Průměrná doba od úrazu do PVS byla 64 měsíců, medián 34 měsíců. První PVS mělo sedm nemocných déle než 3,5 roku a 13 nemocných do 3,5 roku od úrazu.
Klinické vyšetření, vyšetření krve
U všech pacientů jsme před první vibrostimulací provedli klinické vyšetření se zaměřením na břicho a genitál. U tří pacientů jsme zjistili fenulum breve a u jednoho současně relativní fimózu. Dále jsme vyšetřovali přítomnost bulbokavernózního reflexu – při současné rektální palpaci jsme stlačili druhou rukou glans penis, pozitivní odpovědí byl stah análního sfinkteru. U 17 pacientů byl bulbokavernózní reflex přítomný, u tří pacientů zachován nebyl.
Součástí vstupního vyšetření bylo i ultrazvukové vyšetření orgánů močových cest a varlat. U většiny pacientů byly vyšetřované orgány bez zjevné patologie. U dvou pacientů jsme prokázali spermatokélu, u dvou pacientů dilatované žíly plexus pampiniformis (více než 3 mm) a u jednoho pacienta byly v jednom varleti přítomny mikrokalcifikace.
Odebrali jsme krev ke stanovení hormonálního profilu (FSH, LH, testosteron). Hladina FSH i LH byla u všech pacientů v našem souboru v rozmezí referenčních hodnot (1,5 – 12, 4 IU/ l resp. 1,7 – 8,6 IU/ l). U tří pacientů byla hladina testosteronu nižší než 10 nmol/ l (u dvou pacientů byla PVS neúspěšná, u jednoho pacienta byla úspěšná), u ostatních byla hladina nad 10 nmol/ l.
Provedení PVS
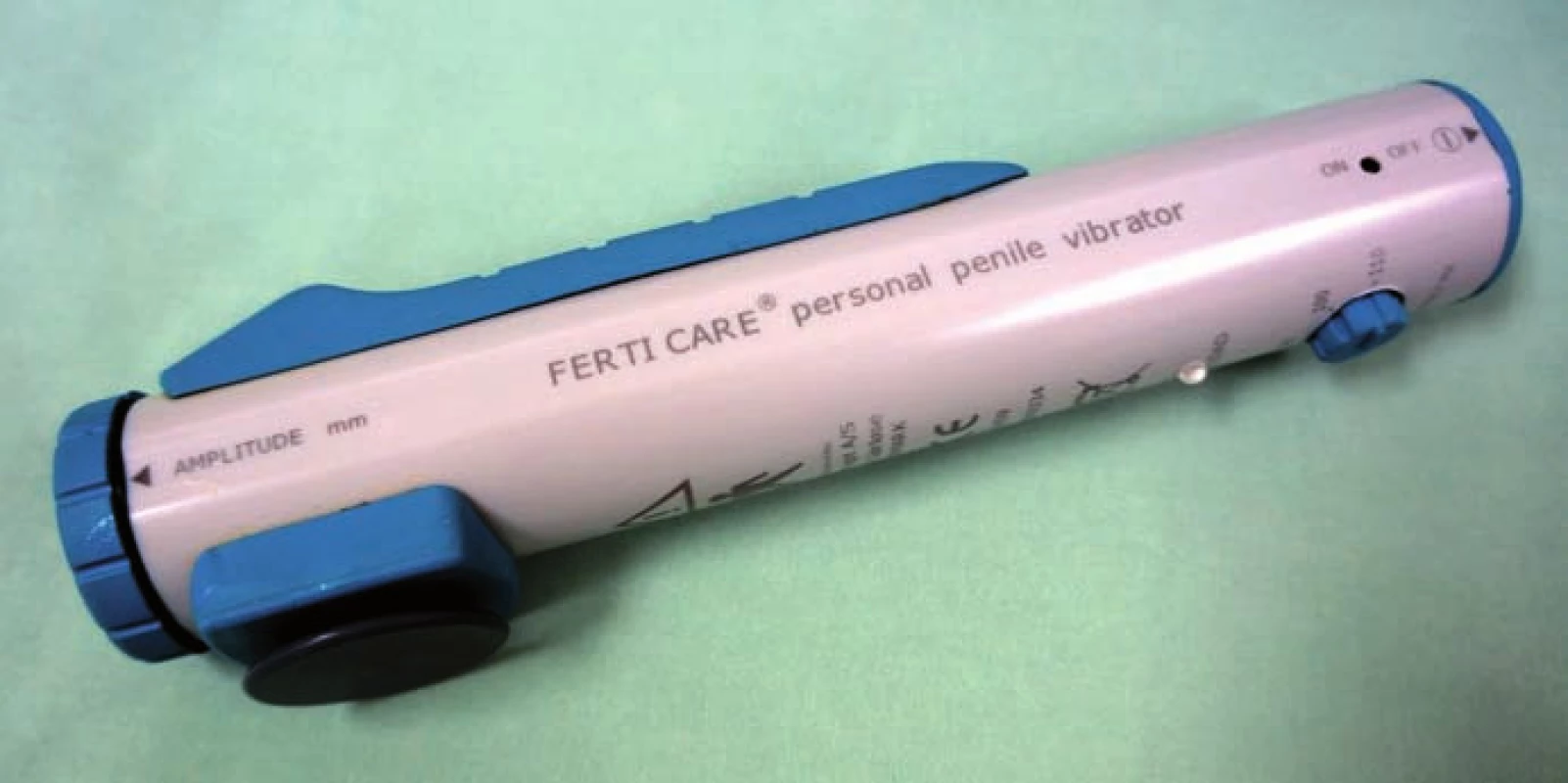
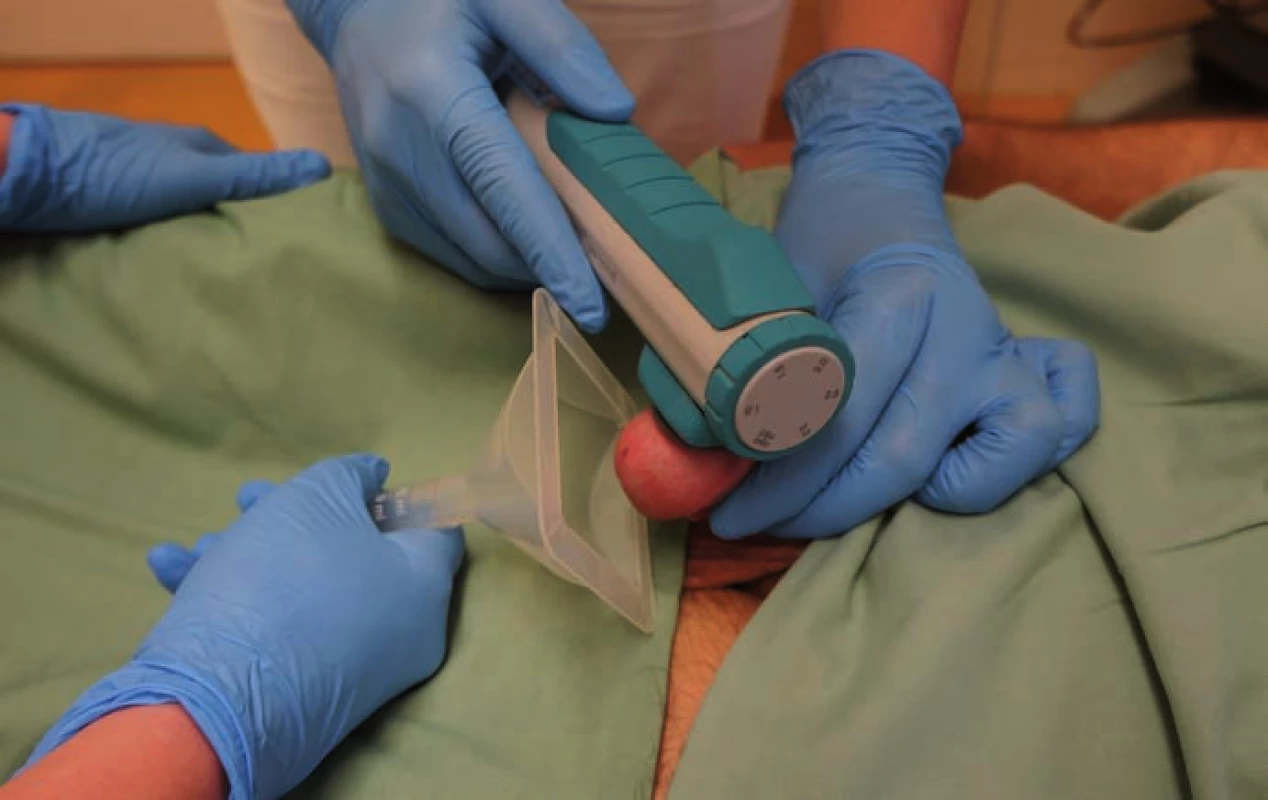
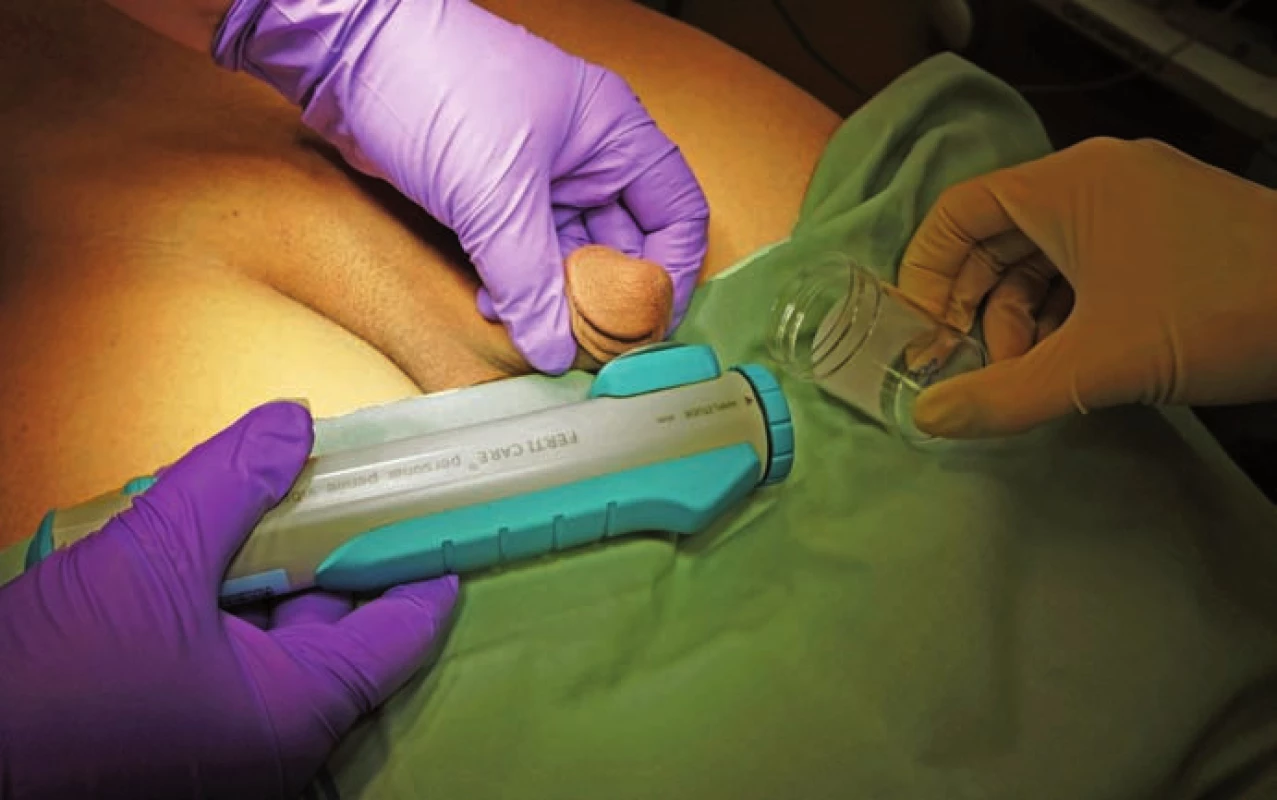
PVS jsme prováděli vždy vleže. Před zahájením stimulace jsme pacienta jednorázově vycévkovali nebo přes epicystostomii vypustili měchýř. K PVS jsme užili přístroj FERTI CARE Multicept (obr. 1). Vstupně jsme přístroj nastavili na amplitudu 2,5 mm a frekvenci 100 Hz. Nejprve jsme vibrostimulátor přiložili na oblast frenula (obr. 2). Stimulaci jsme prováděli vždy do dosažení ejakulace nebo po dobu 3 min. Pokud nedošlo k ejakulaci, stimulaci jsme na 1 – 2 min přerušili. Další cyklus stimulace jsme prováděli shodnou amplitudou i frekvencí, ale změnili jsme místo stimulace – vibrostimulátor jsme přiložili na glans penis (obr. 3). Při třetím cyklu jsme zvýšili amplitudu na 3 mm a stimulovali glans penis. Při jedné návštěvě jsme provedli max. tři cykly. Vzhledem k možnosti retrográdní ejakulace jsme pacienty po skončení PVS, pokud nedošlo k antegrádní ejakulaci, opět jednorázově vycévkovali nebo vypustili měchýř přes epicystostomii. Nebyla‑li PVS při první návštěvě úspěšná, při další návštěvě jsme již při prvním cyklu použili vyšší amplitudu 3 – 3,5 mm.
V průběhu PVS jsme monitorovali kontinuálně EKG, v minutových intervalech tlak a tepovou frekvenci. U každého nemocného jsme před zahájením stimulace zajistili periferní žílu. Pokud se v průběhu PVS vyskytly varovné příznaky autonomní dysreflexie (AD) (hypertenze, bradykardie, bolesti hlavy, zarudnutí a pocení nad úrovní léze, nebo piloerekce pod úrovní léze), stimulaci jsme ukončili a podali 12,5 – 25 mg captoprilu sublinguálně. U pacientů s lézí nad úrovní T6 jsme aplikovali 12,5 mg captoprilu sublinguálně již před zahájením stimulace.
PVS jsme u pacientů opakovali dvakrát až pětkrát. Časový odstup mezi jednotlivými stimulacemi byl 2 – 3 týdny. Jeden pacient po dvou PVS dále prováděl vibrostimulace v domácím prostředí.
Hodnocení kvality ejakulátu, kryoprezervace
Materiál získaný od pacienta (ejakulát, cévkovaná moč) byl odeslán na Centrum reprodukční genetiky Ústavu biologie a lékařské genetiky, 2. LF UK a FN v Motole, Praha. K ejakulátu jsme bezprostředně po odběru přidali médium pro proplach spermií (Sage Sperm Washing Medium) zahřáté na teplotu 37 °C. Podle množství získaného materiálu byl ejakulát dále zpracován centrifugací v mediu pro proplach spermií nebo centrifugací v hustotním gradientu. Koncentrace spermií byla stanovena počítáním spermií v Maklerově komůrce. Celkový počet spermií byl dopočítán vynásobením koncentrace spermií objemem ejakulátu před dilucí. Motilita spermií byla hodnocena v Maklerově komůrce podle WHO kritérií: a – rychle progresivně pohyblivé, b – pomalu progresivně pohyblivé, c – neprogresivně pohyblivé, d – nepohyblivé.
Při průkazu spermií byl ejakulát dále použit k metodám asistované reprodukce nebo kryoprezervován. Při kryoprezervaci bylo k ejakulátu přidáno kryoprezervační medium (Sperm Freezing Medium) v poměru 1 : 1.Poté byl ejakulát rozdělen do slámek High Security sperm straw (Cryo Bio System) po 0,5 ml a zmražen v tekutém dusíku.
Statistika
Kategorické proměnné byly vyjádřeny v procentech a kontinuální proměnné byly prezentovány jako průměr. K vyhodnocení rozdílu parametrů spermiogramu mezi první a druhou PVS jsme použili párový t‑test. U kategorických proměnných jsme rozdíl mezi jednotlivými skupinami analyzovali pomocí chí ‑ kvadrát testu. Všechny výsledky byly považovány za statisticky významné při p < 0,05. Ke statistické analýze jsme použili softwarový statistický program MedCalc (verze 13, Ostend, Belgium).
Výsledky
Ejakulace jsme dosáhli u 11 pacientů (55 %), z toho devět nemocných (82 %) mělo poranění C páteře a dva nemocní (18 %) T páteře, p = 0,57. Úspěšnost PVS u pacientů s poraněním C páteře byla 69 %, u pacientů s poraněním T páteře pouze 29 %. Při úspěšné vibrostimulaci došlo k ejakulaci průměrně za 59 s (20 – 160 s) od zahájení stimulace. U sedmi pacientů (64 %) bylo dosaženo ejakulace při stimulaci frenula při vstupním nastavení vibrostimulátoru – frekvence 100 Hz, amplituda 2,5 mm. U dvou pacientů (18 %) došlo k ejakulaci při stimulaci glandu amplitudou 2,5 mm. U dvou pacientů (18 %) při stimulaci glandu vyšší amplitudou 3 – 3,5 mm.
U 17 pacientů byl bulbokavernózní reflex přítomný. Úspěšnost PVS u pacientů se zachovalým bulbokavernózním reflexem byla 65 % (11 pacientů). U tří pacientů bulbokavernózní reflex nebyl výbavný, u všech pacientů byla PVS neúspěšná (p = 0,17).
U nemocných se začátkem PVS do 3,5 roku od poranění byla úspěšnost 77 % a nad 3,5 roku 14 %, p = 0,027.
Při srovnání ejakulátu z druhé PVS došlo ke zvýšení celkového počtu spermií (p = 0,03), koncentrace spermií (p = 0,025) a počtu progresivně pohyblivých spermií (p = 0,027) oproti první PVS (tab. 1). V našem souboru došlo i ke zvýšení objemu ejakulátu, výsledek nebyl statisticky významný (p = 0,09).
Tab. 1. Srovnání kvality ejakulátu z I. a II. PVS. 
U většiny pacientů (72 %) je získaný ejakulát pouze kryoprezervován k pozdějšímu využití. U jednoho pacienta byl ejakulát opakovaně použit k intrauterinní inseminaci (IUI). IUI byla i přes vysokou koncentraci spermií (213 × 10 exp6) při progresivní pohyblivosti 20 % opakovaně neúspěšná. V červenci 2014 byl již dříve kryoprezervovaný ejakulát úspěšně použit k fertilizaci metodou intracytoplazmatické injekce spermie do oocytu (ICSI). U jednoho pacienta byl ejakulát získaný při domácí PVS úspěšně použit k fertilizaci. Intravaginální ani intraurterinní inseminace nebyla úspěšná, k početí došlo s využitím konvenční in vitro fertilizace (IVF). Tento pacient se stal otcem zdravého potomka. Jeden nemocný měl azoospermii.
Příznaky AD se vyskytly v průběhu PVS u sedmi pacientů, z toho u šesti s lézí C páteře, u jednoho pacienta s lézí T5. Při těchto příznacích jsme vždy vibrostimulaci ukončili a podali 12,5 – 25 mg captoprilu sublinguálně. Příznaky AD odezněly do 3 min. Drobné eroze a ragády jsme po skončení PVS zaznamenali u pěti pacientů.
Diskuze
Míšní poranění je spojeno s poruchou sexuálních a reprodukčních funkcí. Především poruchy ejakulace po poranění míchy jsou velmi časté. U většiny nemocných je tedy nutný asistovaný odběr ejakulátu při přání vlastního potomka.
V literatuře na velkých souborech pa-cientů je úspěšnost PVS udávána v rozmezí 50 – 60 % [4,13]. V našem souboru byla úspěšnost 55 %. Zachovalý bulbokavernózní reflex, svědčící o zachování integrity segmentů S2 – S4, je jedním z prediktorů úspěšnosti PVS [14]. Úspěšnost PVS v našem souboru pacientů se zachovalým bulbokavernózním reflexem byla 65 % (11 pacientů). U tří pacientů s nevýbavným bulbokavernózním reflexem nebyla v našem souboru žádná PVS úspěšná. Při hodnocení úspěšnosti PVS na velkých souborech pacientů nebyl statisticky významný rozdíl v úspěšnosti PVS u pacientů s kompletní a inkompletní míšní lézi [4]. U většiny pacientů (89 %) při úspěšné PVS dochází k ejakulaci do 2 min od zahájení stimulace [15], to potvrdily i naše výsledky.
V našem souboru byla signifikantně vyšší úspěšnost PVS u pacientů s kratší dobou od míšní léze než 3,5 roku. Provedení první PVS je vhodné až ve fázi stabilního onemocnění, ve většině případů ne dříve než za 12 měsíců od poranění, z důvodu postupného navrácení ejakulačního reflexu po odeznění fáze míšního šoku [16]. Podle dat z velkých souborů však účinnost PVS provedená ve stabilní fázi onemocnění signifikantně nekoreluje s dobou od poranění míchy [4].
Mezi nežádoucí účinky PVS patří poranění kůže v místě stimulace. Po skončení PVS jsme pozorovali drobné ragády či eroze v místě stimulace u pěti pacientů. Závažnější kožní defekty jsme nezaznamenali. PVS není vhodná u pacientů s neléčenou hypertenzí nebo kardiálním onemocněním pro riziko vzestupu krevního tlaku v průběhu stimulace [17]. Mezi nejzávažnější komplikace PVS patří u pacientů s lézí nad úrovní T6 rozvoj AD [18,19]. AD je způsobena neinhibovanou reflexní reakcí sympatickou na stimulus pod místem léze. Důsledkem je těžká vazokonstrikci vyvolávající paroxyzmální hypertenze. Nekontrolovaná hypertenze může vyústit v krvácení do mozku, srdeční selhání až smrt [20]. V průběhu PVS je proto nutné včas odhalit presymptomy a symptomy AD. U pacientů s lézí nad T6 je doporučeno k prevenci rozvoje AD podat 20 mg nifedipinu či 12,5 – 25 mg captoprilu sublinguálně 15 min před zahájením stimulace pro jejich rychlý nástup účinku a krátký biologický poločas [18,21]. V našem souboru pacientů se příznaky AD v průběhu PVS vyskytly u sedmi pacientů. Při těchto příznacích jsme vždy vibrostimulaci ukončili a podali 12,5 mg captoprilu sublingválně s dobrým efektem.
PVS je jediná metoda umožňující získání ejakulátu v domácím prostředí za předpokladu, že v průběhu stimulace nedochází k rozvoji příznaků AD. Získaný ejakulát je možné použít k intravaginální inseminaci, bez nutnosti dalších metod asistované reprodukce. Šance na úspěšné početí jsou závislé na kvalitě ejakulátu. Četnost těhotenství po domácí intravaginální inseminaci ejakulátem získaným z PVS je v literatuře udávána mezi 25 – 65 % [22,23]. Sperma získané PVS je dále možno kryoprezervovat či ho přímo použít k metodám asistované reprodukce. Získaný ejakulát u našich pacientů je ve většině případů (72 %) pouze kryoprezervován k budoucímu užití. U dvou nemocných byl ejakulát úspěšně použit k fertilizaci, z toho u jednoho nemocného byl ejakulát získán při PVS v domácím prostředí.
U mužů s míšním poraněním je zhoršená kvalita ejakulátu, častá je nízká motilita a viabilita spermií, počet spermií zůstává srovnatelný se zdravou populací [24,25]. Faktory přispívající ke zhoršení kvality spermií jsou mimo jiné hypertermie v oblasti skrota, stáza prostatického sekretu a rekurentní infekce močových cest [26]. Vliv na kvalitu ejakulátu má i management vyprazdňování močového měchýře, lepší kvalita ejakulátu je u pacientů s režimem čisté intermitentní katetrizace [27]. V našem souboru pacientů jsme tyto výsledky nepotvrdili.
Poranění míchy je také spojeno s hormonálními změnami, především dysfunkce hypothalamo ‑ pituitární ‑ gonadální osy vede k negativnímu ovlivnění spermiogeneze. Přestože jsou hormonální změny velmi časté, nejsou považovány za hlavní důvod infertility [28,29]. Jako hlavní příčina zhoršené kvality spermatu po míšním poranění se předpokládají změny ve složení seminální tekutiny v důsledku porušením autonomní inervace [30,31]. Dochází také ke zvýšení počtu leukocytů, prozánětlivých cytokinů a volných radikálů, které nepříznivě působí na motilitu spermií, zvyšují fragmentaci DNA a snižují tak šance na úspěšnou fertilizaci [10,30 – 33].
Někteří autoři předpokládají, že stáza spermatu v ejakulatorních duktech při nízké frekvenci ejakulací přispívá ke zhoršení kvality ejakulátu [34,35]. Otázka zlepšení kvality ejakulátu zvýšením frekvence ejakulací (např. opakováním PVS) je však sporná. V našem souboru jsme prokázali, že při opakování PVS docházelo ke zvýšení celkového počtu spermií, koncentrace spermií a počtu progresivně pohyblivých spermií. Tento závěr je shodný s dalšími pracemi [34 – 36]. V jiných pracích zlepšení kvality ejakulátu prokázáno nebylo [37 – 39].
Závěr
PVS je jednoduchá, bezpečná a neinvazivní metoda k získání ejakulátu u pacientů s míšní lézí nad úrovní T10. Je doporučována jako metoda první volby u pacientů s anejakulací s přáním vlastního potomka. Současně se jedná o jedinou metodu asistovaného odběru spermatu, kterou lze provádět i v domácím prostředí, za předpokladu dostatečné kvality ejakulátu a absenci AD při PVS. Při opakování PVS jsme zjistili zvýšení celkového počtu spermií, koncentrace spermií i počtu progresivně pohyblivých spermií. U dvou pacientů byl ejakulát získaný při PVS úspěšně použit k fertilizaci. Jeden pacient se stal otcem zdravého potomka. Těhotenství partnerky druhého pacienta probíhá bez komplikací, narození potomka je očekáváno na jaře 2015.
Podpořeno projekty FNM00064203, IGA MZČR NT13770/3 a CZ.2.16/3.1.00/24022OPPK.
Přijato k recenzi: 28. 11. 2014
Přijato do tisku: 12. 1. 2015
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Marcela Čechová
Urologická klinika
2. LF UK a FN v Motole
V Úvalu 84
150 06 Praha 5
e-mail: marcela.cechova@fnmotol.cz
Zdroje
1. Fitzharris M, Cripps RA, Lee BB. Estimating the global incidence of traumatic spinal cord injury. Spinal Cord 2014; 52(2): 117 – 122. doi: 10.1038/ sc.2013.135.
2. New PW, Cripps RA, Bonne Lee BB. Global maps of non‑traumatic spinal cord injury epidemiology: towards a living data repositury. Spinal Cord 2014; 52(2): 97 – 109. doi: 10.1038/ sc.2012.165.
3. Česká společnost pro míšní léze ČSL JEP, statistiky [online]. Dostupné z URL: http:/ / www.spinalcord.cz/ cz/ statistiky.
4. Chéhensse C, Bahrami S, Denys P, Clément P, Barnabé J,Giuliano F. The spinal control of ejaculation revisited: A systematic review and meta‑analysis of anejaculation in spinal cord injured patients. Human Reproduction Update 2013; 19(5): 507 – 526. doi: 10.1093/ humupd/ dmt029.
5. Brackett NL, Lynne CM, Ibrahim E, Ohl DA, Sønksen J. Treatment of infertility in men with spinal cord injury. Nat Rev Urol 2010; 7(3): 162 – 172. doi: 10.1038/ nrurol.2010.7.
6. Giuliano F. Neurophysiology of erection and ejaculation. J Sex Med 2011; 8 (Suppl 4): 310 – 315. doi: 10.1111/ j.1743 ‑ 6109.2011.02450.x.
7. Brindley GS. Reflex ejaculation under vibratory stimulation in paraplegic men. Paraplegia 1981; 19(5): 299 – 302.
8. Giuliano F, Clément P. Physiology of ejaculation: emphasis on serotonergic control. Eur Urol 2005; 48(3): 408 – 417.
9. Wieder JA, Brackett NL, Lynne CM, Green JT, Aballa TC. Anestetic block of the dorsal penile nerve inhibits vibratory‑induced ejaculation in men with spinal cord injuries. Urology 2000; 55(6): 915 – 917.
10. Anderson KD, Borisoff JF, Johnson RD, Stiensen SA, Elliott SL. Long‑term effects of spinal cord injury on sexual function in men: implications for neuroplasticity. Spinal cord 2007; 45(3): 338 – 348.
11. Brackett NL, Padron O F, Lynne CM. Semen quality of spinal cord injured men is better when obtained by vibratory stimulation versus electroejaculation. J Urol 1997; 157(1): 151 – 157.
12. Ohl DA, Quallich SA, Sønksen J, Brackett NL, Lynne CM. Anejaculation and retrograde ejaculation. Urol Clin North Am 2008; 35(2): 211 – 220. doi: 10.1016/ j.ucl.2008.01.014.
13. Beckerman H, Becher J, Lankhorst GJ. The effectiveness of vibratory stimulation in anejaculatory men with spinal cord injury. Review article. Paraplegia 1993; 31(11): 689 – 699.
14. Bird VG, Brackett NL, Lynne CM, Aballa TC, Ferrell SM. Reflexes and static responses as predictors of ejaculation by penile vibratory stimulation in men with spinal cord injury. Spinal Cord 2001; 39(10): 514 – 519.
15. Brackett NL, Ferrell SM, Aballa TC, Amador MJ, Pad-ron OF, Sonksen J et al. An analysis of 653 trials of penile vibratory stimulation in men with spinal cord injury. J Urol 1998; 159(6): 1931 – 1934.
16. Sipski ML, Brackett NL, Bodner D, Elliott S, Jackson A, Sonksen J. Measurement of sexual functioning after spinal cord injury: preferred instruments. J Spinal Cord Med 2009; 32(3): 226 – 236.
17. Courtois FJ, Charvier KF, Leriche A, Vézina JG, Côté M, Bélanger M. Blood pressure changes during sexual stimulation, ejaculation and midodrine treatment in men with spinal cord injury. BJU Int 2008; 101(3): 331 – 337.
18. Sheel AW, Krassioukov AV, Inglis JT, Elliott SL. Autonomic dysreflexia during sperm retrieval in spinal cord injury: influence of lesion level and sildenafil citrate. J Appl Physiol 2005; 99(1): 53 – 58.
19. Ekland MB, Krassioukov AV, McBride KE, Incidence of autonomic dysreflexia and silent autonomic dysreflexia in men with spinal cord injury undergoing sperm retrieval: implications for clinical practice. J Spinal Cord Med 2008; 31(1): 33 – 39.
20. Kříž J, Rejchrt M. Autonomní dysreflexie – závažná komplikace u pacientů po poranění míchy. Cesk Slov Neurol N 2014; 77/ 110(2): 168 – 173.
21. Ekland MB, Krassioukov AV, McBride KE, Elliott SL. Incidence of autonomic dysreflexia and silent autonomic dysreflexia in men with spinal cord injury undergoing sperm retrieval: implications for clinical practice. J Spinal Cord Med 2008; 31(1): 33 – 39.
22. Sonksen J, Fode M, Lochner ‑ Ernst D, Ohl DA. Vibratory ejaculation in 140 spinal cord injured men and home insemination of their partners. Spinal Cord 2012; 50(1): 63 – 66.
23. Sonksen J, Sommer P, Biering ‑ Sorensen F, Ziebe S, Lindhard A, Loft A et al. Pregnancy after assisted ejaculation procedures in men withspinal cord Injury. Arch Phys Med Rehabil 1997; 78(10): 1059 – 1061.
24. Restelli AE, Bertolla RP, Spaine DM, Miotto A Jr, Borrelli M jr, Cedenho AP. Quality and functional aspects of sperm retrieved through assisted ejaculation in men with spinal cord injury. Fertil Steril 2009; 91(3): 819 – 825. doi: 10.1016/ j.fertnstert.2007.12.060.
25. Patki P, Woodhouse J, Hamid R, Craggs M, Shah J. Effects of spinal cord injury on semen parameters. J Spinal Cord Med 2008; 31(1): 27 – 32.
26. Linsenmeyer TA, Perkash I. Infertility in men with spinal cord injury. Arch Phys Med Rehabil 1991; 72(10): 747 – 754.
27. Rutkowski SB, Middleton JW, Truman G, Hagen DL, Ryan JP. The influence of bladder management on fertility in spinal cord injured males. Paraplegia 1995; 33(5): 263 – 266.
28. Naderi AR, Safarinejad MR. Endocrine profiles and semen quality in spinal cord injured men. Clin Endocrinol (Oxf) 2003; 58(2): 177 – 184.
29. Rajasekaran M, Monga M. Cellular and molecular causes of male infertility in spinal cord injury. J Androl 1999; 20(3): 326 – 330.
30. Brackett NL, Lynne CM, Aballa TC, Ferrell SM. Sperm motility from the vas deferens of spinal cord injured men is higher than from the ejaculate. J Urol 2000; 164(1): 712 – 715.
31. Iremashvili VV, Brackett NL, Ibrahim E, Aballa TC, Lynne CM. A minority of men with spinal cord injury have normal semen quality – can we learn from them? A case ‑ control study. Urology 2010; 76(2): 347 – 351. doi: 10.1016/ j.urology.2009.11.063.
32. Basu S, Aballa TC, Ferrell SM, Lynne CM, Brackett NL. Inflammatory cytokine concentrations are elevated in seminal plasma of men with spinal cord injuries. J Androl 2004; 25(2): 250 – 254.
33. Brackett NL, Ibrahim E, Grotas JA, Aballa TC, Lynne CM. Higher sperm DNA damage in semen from men with spinal cord injuries compared with controls. J Androl 2008; 29(1): 93 – 99.
34. Beretta G, Chelo E, Zan A. Reproductive aspects in spinal cord injured males. Paraplegia 1989; 27(2): 113 – 118.
35. Siosteen A, Forssman L, Steen Y, Sullivan L, Wickström I.Quality of semen after repeated ejaculation treatment in spinal cord injury men. Paraplegia 1991; 28(2): 96 – 104.
36. Hamid R, Patki P, Bywater H, Shah PJ, Craggs MD. Effects of repeated ejaculations on semen characteristics following spinal cord injury. Spinal Cord 2006; 44(6): 369 – 373.
37. Sonksen J, Ohl DA, Giwercman A, Biering ‑ Sorensen F, Skakkebaek NE, Kristensen JK. Effect of repeated ejaculation on semen quality in spinal cord injured men. J Urol 1999; 161(4): 1163 – 1165.
38. Momen MN, Fahmy I, Amer M, Arafa M, Zohdy W, Naser TA. Semen parameters in men with spinal cord injury: changes and etiology. Asian J Androl 2007; 9(5): 684 – 689.
39. Engh E, Clausen OPF, Purvis K, Stien R. Sperm quality assessed by flow cytometry and accessory sex gland function in spinal cord injured men after repeated vibration‑induced ejaculation. Paraplegia 1993; 31(1): 3 – 12.
Štítky
Dětská neurologie Neurochirurgie Neurologie
Článek Neuromyelitis opticaČlánek Agresivní hemangiom obratleČlánek Projekt ncRNAPainČlánek Webové okénkoČlánek Recenze knih
Článek vyšel v časopiseČeská a slovenská neurologie a neurochirurgie
Nejčtenější tento týden
2015 Číslo 2- Magnosolv a jeho využití v neurologii
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Zolpidem může mít širší spektrum účinků, než jsme se doposud domnívali, a mnohdy i překvapivé
- Nejčastější nežádoucí účinky venlafaxinu během terapie odeznívají
-
Všechny články tohoto čísla
- Neuromyelitis optica
- Radiologické hodnocení lumbální spinální stenózy a jeho klinická korelace
- Agresivní hemangiom obratle
- Použití antipsychotik u nemocných s demencí
- Skrat u karotických endarterektomií zvyšuje riziko ischemického iktu
- Chirurgická léčba laterální bederní stenózy perkutánně zavedeným interspinózním implantátem
- Chirurgický přístup k tumorům thalamu
- Možnosti ovlivnění diplopie při paralytickém strabizmu konzervativní léčbou
- Dotazník funkcionální komunikace (DFK) – validace originálního českého testu
- Rozdiely medzi pohlaviami v klinických prejavoch a výskyte porúch spánku u pacientov s Parkinsonovou chorobou – populačná štúdia
- Penilní vibrostimulace u pacientů s míšním poraněním
- Registr mechanických rekanalizací u akutního iktu – pilotní výsledky multicentrického registru
- Progredující demence s parkinsonizmem a poruchami chování – od prvních příznaků k neuropatologické diagnóze (kazuistika)
- Projekt ncRNAPain
- Kongenitální centrální hypoventilační syndrom (Ondinina kletba)
- Neurologická komplikace hepatitidy E – kazuistika
- Neurologické projevy Behçetovy nemoci – kazuistika
- Úspešne liečená depresia u pacienta s epilepsiou – kazuistika
- Zánětlivý pseudotumor imitující intrakraniální, konvexitární meningeom – kazuistika
- Odešel prof. MU Dr. Jiří J. Vítek (29. 3. 1935– 19. 12. 2014)
- Padesát let prof. MU Dr. Milana Brázdila, Ph.D., FCMA
- Webové okénko
-
Analýza dat v neurologii
L. Vybrané komentáře k odhadům a interpretaci poměru šancí - Recenze knih
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Agresivní hemangiom obratle
- Neuromyelitis optica
- Kongenitální centrální hypoventilační syndrom (Ondinina kletba)
- Radiologické hodnocení lumbální spinální stenózy a jeho klinická korelace
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání