-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Nálezy v mozkomíšním moku u dětí s akutním paretickým postižením
Findings in Cerebrospinal Fluid among Children with Paretic Involvements
Aim:
To evaluate cerebrospinal fluid (CSF) findings in children with paretic involvements and to establish the benefit of such examination with a view to aetiological diagnosis.Material and methods:
CSF findings among 227 hospitalized children with paretic involvements of the peripheral or central nervous system were evaluated retrospectively. CSF was analysed cytologically and biochemically. Detected were antibodies against neurotropic viruses, Borrelia and viral nucleic acids by means of PCR.Results:
Inflammatory changes due to aseptic meningitis were found in 125 (55%) children, elevation of proteins only in nine (4%) children, and CSF examination was negative in the remaining 93 (41%) children. Cytological examination revealed white blood cells with a predominance of lymphocytes (mean 110, median 10). Median CSF protein was 0.4 g/ l and median CSF glucose was 3.34 mmol/ l. Disruption of the blood‑CSF barrier was determined in 55/ 113 (51%) children, while this condition was severe in 9% of the examined children. Borrelial aetiology was confirmed in 52% of the children, while pleocytosis was revealed in 86% of those samples. Viral and mycoplasmal aetiology was proven in 11% of the children only serologically. The aetiology remained unproven in 37% of the children.Conclusion:
CSF examination contributed to the diagnosis of paretic involvements in children. Even despite negative meningeal signs in children, spinal tap should be performed to exclude or confirm meningitis. In our geographic conditions, peripheral facial palsy is diagnosed in 95% of children with the predominance of borrelial aetiology. Paretic involvements of other aetiologies occur only rarely.Key words:
cerebrospinal fluid – pleocytosis – peripheral facial palsy – neuroborreliosis – herpes virus
Autoři: L. Krbková 1; K. Holečková 2; Z. Blechová 3; V. Marešová 3; K. Labská 3
; H. Štroblová 4; J. Bednářová 4
Působiště autorů: Klinika dětských infekčních nemocí LF MU a FN Brno 1; Klinika infektológie a geografickej medicíny LF SZU, LF UK a UN Bratislava 2; I. infekční klinika 2. LF UK a Nemocnice Na Bulovce, Praha 3; Oddělení klinické mikrobiologie, FN Brno 4
Vyšlo v časopise: Cesk Slov Neurol N 2014; 77/110(4): 496-500
Kategorie: Krátké sdělení
Souhrn
Cíl:
Zhodnocení nálezů v mozkomíšním moku u dětí s paretickým onemocněním a stanovení výtěžnosti vyšetření vzhledem k etiologické diagnóze.Soubor a metodika:
Retrospektivně bylo zhodnoceno vyšetření mozkomíšního moku u 227 hospitalizovaných dětí s paretickým postižením periferního nebo centrálního nervového systému. Mozkomíšní mok byl hodnocen cytologicky a biochemicky. Stanovovány byly protilátky proti neurotropním virům, proti borreliím a ve sporných případech byla provedena i detekce bakteriálních antigenů nebo virové nukleové kyseliny pomocí PCR.Výsledky:
Zánětlivé změny ve smyslu aseptické meningitidy byly zjištěny u 125 dětí (55 %), proteinocytologická disociace u devíti dětí (4 %), vyšetření mozkomíšního moku ostatních 93 dětí (41 %) bylo negativní. V cytologickém vyšetření převažovaly lymfocyty (průměr 110, medián 10). Hladina bílkoviny v mozkomíšním moku byla 0,4 g/ l (medián) a hladina glukózy 3,34 mmol/ l (medián). Porucha hemato‑likvorové bariéry byla zjištěna u 55/ 113 dětí (51 %), z toho v 9 % těžká. Borreliová etiologie byla prokázána u 52 % dětí, z toho 86 % vzorků mělo současně pleocytózu. Virová a mykoplazmová etiologie byla zjištěna u 11 % dětí pouze sérologicky. Etiologie zůstala neprokázána u 37 % dětí.Závěry:
Vyšetření mozkomíšního moku přispívá k diagnostice paretických onemocnění. Navzdory negativním meningeálním příznakům u dětí by měla být provedena lumbální punkce k potvrzení nebo vyloučení meningitidy. V našich zeměpisných podmínkách je periferní paréza n. facialis diagnostikována u 95 % dětí s převahou borreliové etiologie. Paretická postižení jiné etiologie se vyskytují vzácně.Klíčová slova:
mozkomíšní mok – pleocytóza – periferní paréza n. facialis – neuroborrelióza – herpes virusÚvod
Aseptické neuroinfekce u dětí mohou být provázeny paretickým postižením. Klíšťové nákazy – klíšťová borrelióza a klíšťová encefalitida patří opakovaně na přední místa hlášených infekcí v ČR. Nervové projevy v rámci borreliózy se v Evropě vyskytují u 25 % nemocných. Klinicky je neuroborrelióza provázena kraniální neuritidou, nejčastěji parézou n. facialis [1]. Klíšťová encefalitida u dětí probíhá klinicky jako meningitida a typické paretické projevy dospělého věku – paréza pletence pažního, mono ‑ a tetraparézy – jsou v dětském věku raritní [2].
Enterovirová etiologie je udávána u aseptických meningitid u dětí a ty nejsou obvykle provázeny paretickým postižením. Navzdory tomuto faktu patří mezi enteroviry i viry poliomyelitidy a nové enteroviry 68 až 71, z nichž enterovirus 71 může způsobit paretické postižení podobné poliomyelitidě [3].
Herpetické viry, především herpes simplex virus (HSV), varicela ‑ zoster virus (VZV) v rámci Ramsayova ‑ Huntova syndromu, méně často virus Epsteina‑Barrové (EBV) a cytomegalovirus (CMV), jsou spojovány obvykle s parézou n. facialis. Paretické postižení v průběhu EBV infekce může proběhnout pod obrazem klinicky typické infekční mononukleózy nebo izolovaně jako transverzní myelitida nebo Guillainův‑Barrého syndrom [4]. Role šestého herpetického viru (HHV-6) ve vztahu k paretickému postižení není objasněna.
Respirační viry, převážně paramyxoviry, jsou uváděny jako původci paretických postižení vzácně, převážně ve spojení s kraniální neuritidou [5].
Soubor a metodika
V restrospektivní studii 273 dětí ve věku do 18 let přijatých s paretickým postižením, periferním i centrálním, bylo hodnoceno vyšetření mozkomíšního moku (mm) a jeho přínos k diagnostice. Děti byly hospitalizovány na třech velkých infekčních klinikách: na I. infekční klinice 2. LF UK v Praze (n = 54), na Klinice dětských infekčních nemocí LF MU v Brně (n = 133) a na Klinice infektológie a geografickej medicíny UK v Bratislavě (n = 86). Lumbální punkce nebyla provedena u 46 dětí s parézou n. facialis (17 %). Zhodnoceno bylo celkem vyšetření mm u 227 hospitalizovaných dětí. Mm byl vyšetřen cytologicky (smíšená nebo lymfocytární pleocytóza > 5/ μl) a biochemicky (bílkovina > 0,45 g/ l a glukóza 2,2 – 3,6 mmol/ l). Stanovovány byly protilátky proti neurotropním virům (herpes virus 1 a 2, virus klíšťové encefalitidy) a proti borreliím. Intratékální syntéza antiborreliových protilátek byla hodnocena protilátkovým indexem dle Reibera [6], pozitivní byl AI ≥ 1,4. Ve sporných případech byla provedena i detekce bakteriálních antigenů latexovou aglutinací a průkaz virových nukleových kyselin pomocí PCR. Za poruchu funkce hemato‑likvorové bariéry byla považována hodnota Q albuminu (Qalb) > 5,0. V indikovaných případech byly stanoveny oligoklonální pásy.
Statistické zhodnocení: pro spojité veličiny byl ve všech případech použit Mann‑Whitneyho test. Nulová hypotéza by se zamítala při hladině významnosti 0,05, kdyby výsledná p hodnota byla < 0,05.
Výsledky
Z celkového počtu 273 nemocných dětí mělo 258 (95 %) parézu n. facialis a pouze 15 (5 %) dětí bylo hospitalizováno s jiným paretickým postižením. Mm byl hodnocen u 227 dětí, z nich 212 dětí mělo periferní parézu n. facialis a 15 dětí parézu n. abducentis nebo jiná paretická postižení. Zánětlivé změny ve smyslu aseptické meningitidy byly zjištěny u 125 dětí (55 %), proteinocytologická disociace u devíti dětí (4 %), vyšetření mm ostatních 93 dětí (41 %) bylo negativní (tab. 1). U dětí s negativním výsledkem v mm se jednalo o parézu n. facialis (89), parézu n. abducentis (jedno dítě), hemiparézu (jedno dítě) a monoparézu HKK (dvě děti). Periferní paréza n. facialis borreliové etiologie byla diagnostikována u 16/ 89 (18 %) dětí. Etiologie izolované parézy n. abducentis a mono/ hemiparetického postižení nebyla objasněna. Jedno dítě s monoparézou horní končetiny bez zánětlivých změn v mm mělo anamnestický údaj o očkování proti chřipce do horní končetiny na ipsilaterální straně, ale kauzální souvislost nebyla prokázána. U většiny dětí 73/ 89 (82 %) nebyla specifická etiologie zjištěna. Ve dvou případech byla paréza n. facialis recidivující na stejné straně bez prokázané patologie v průběhu nervu či okolních strukturách.
Tab. 1. Abnormální nálezy v mozkomíšním moku dle diagnózy (n = 134). 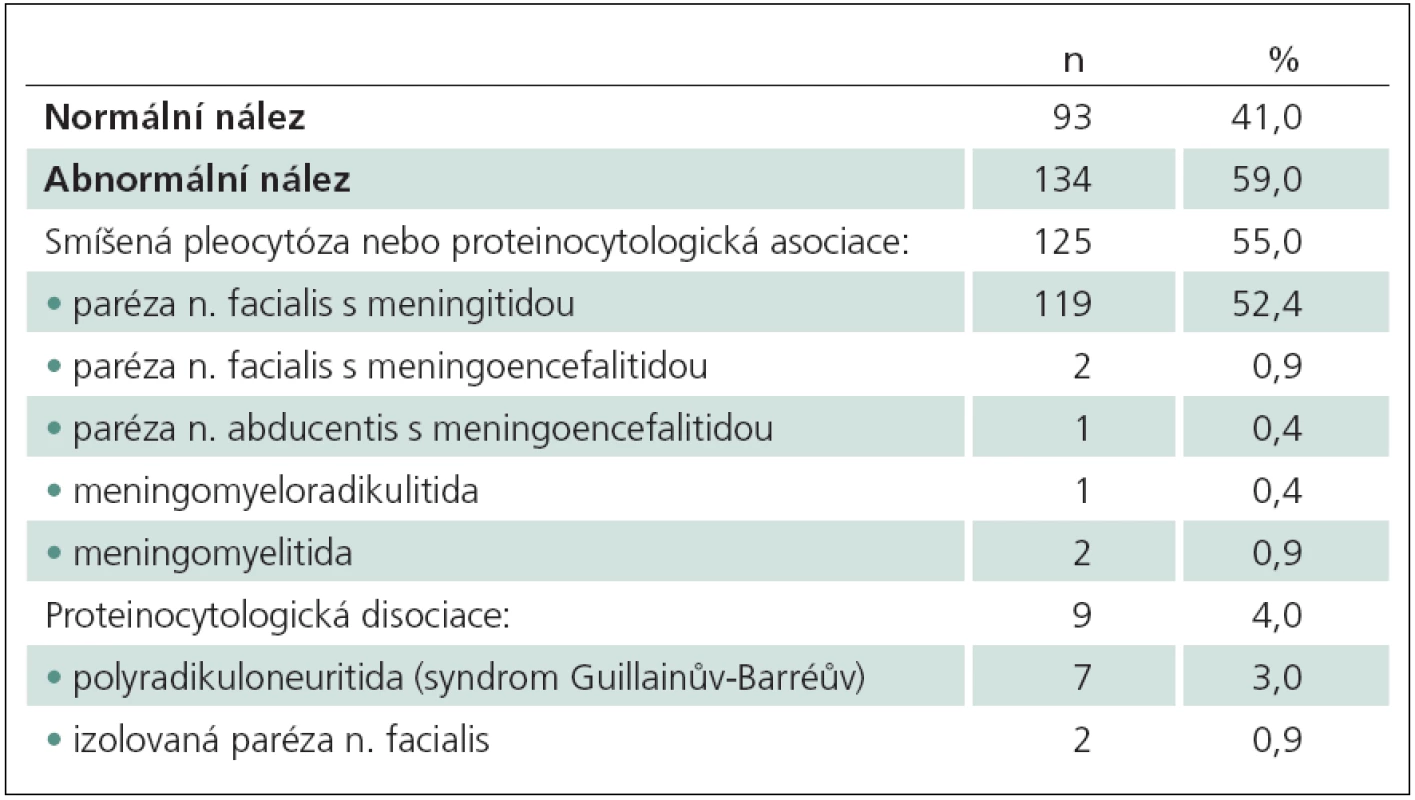
Výsledky cytologického a biochemického vyšetření 134 dětí s abnormálními nálezy v mm jsou uvedeny v tab. 2.
Tab. 2. Abnormální nálezy v mozkomíšním moku (n = 134). 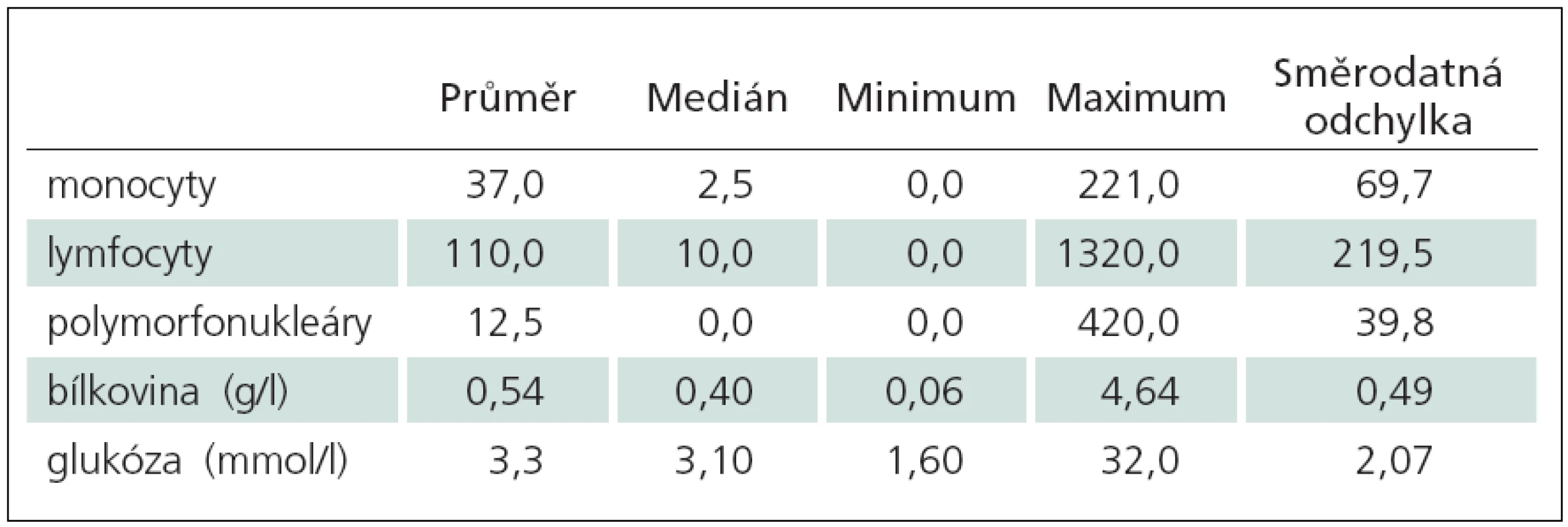
Porucha hemato‑likvorové bariéry byla zjištěna u 55/ 113 dětí (51 %), z toho u 10 dětí (9 %) těžká s hodnotou Qalb ≥ 10. Srovnání nálezů v mm u dětí s poruchou a bez poruchy hemato‑likvorové bariéry je znázorněno v tab. 3. Pět dětí s těžkou poruchou bariéry mělo v mm proteinocytologickou disociaci, tři z nich byly hospitalizovány pro Guillainův‑Barrého syndrom a dvě s oboustrannou parézou n. facialis. U neuroborreliózy se těžká porucha vyskytla vzácně, pouze u šesti dětí (5 %) s meningoneuritidou. V cytologickém hodnocení byl statisticky vysoce významný rozdíl v počtu polymorfonukleárních buněk (p < 0,01) a hraniční rozdíl v lymfocytech v mm (p = 0,042). Z biochemických parametrů byl vysoce významný rozdíl v hodnotě bílkoviny (p < 0,01). Intratékální syntéza antiborreliových protilátek obou skupin nevykazovala rozdíl.
Tab. 3. Srovnání nálezů u dětí bez a s poruchou hematolikvorové bariéry (n = 113). 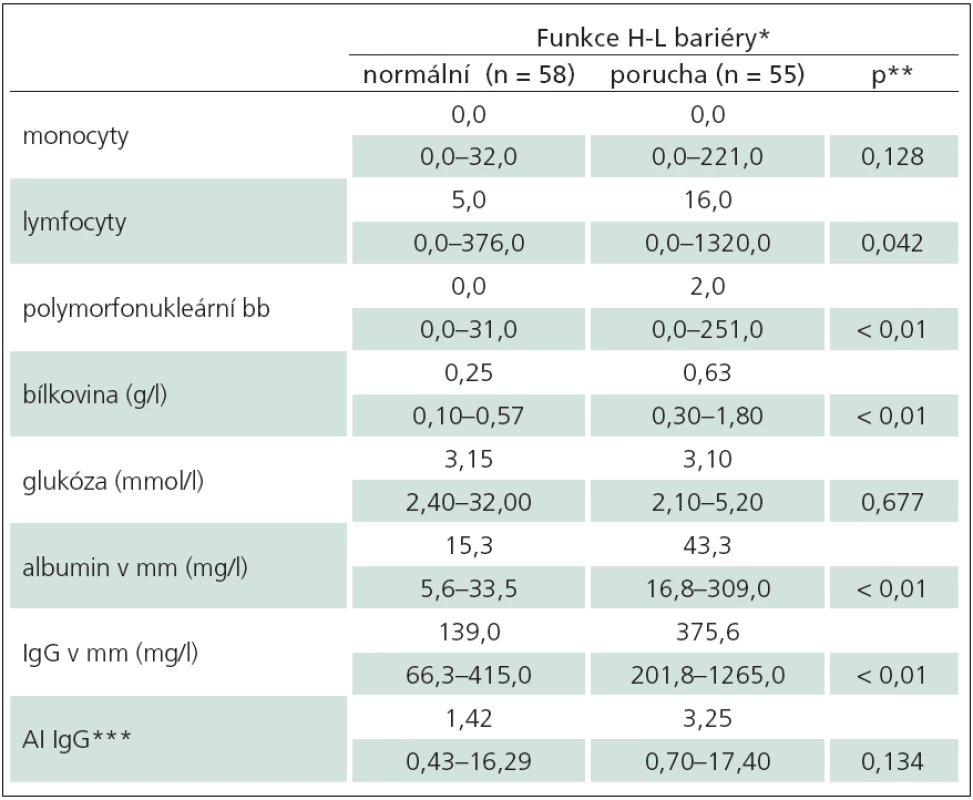
* – je udáván vždy medián a rozsah hodnot (minimum–maximum), ** – statistická významnost (při hodnotě < 0,05), AI IgG*** – intratékální syntéza antiboreliových protilátek třídy IgG hodnocená protilátkovým indexem (AI – Antibody Index). Borreliová etiologie byla diagnostikována průkazem specifických intratékálních protilátek u 118/ 227 dětí (52 %). Zánětlivé postižení CNS bylo přítomno u 102/ 118 (86 %) vzorků mm všech dětí s neuroborreliózou. Periferní paréza n. facialis borreliové etiologie bez zánětlivých změn v mm byla prokázána u dalších 16/ 118 dětí (14 %). Z toho vyplývá, že z celkového počtu 89 dětí s izolovanou periferní parézou n. facialis bez zánětlivých změn v mm má borreliovou etiologii jen 18 % dětí. Naproti tomu ze 122 dětí s meningoneuritidou je 84 % borreliové etiologie. Intratékální průkaz antiborreliových protilátek z I. vzorku mm byl pozitivní u 94/ 118 (80 %) dětí v hodnotách IgG = 2,45 (medián), u 21/ 118 (18 %) byla syntéza antiborreliových protilátek v mm prokázána z II. vzorku. Současně klinicky verifikované erythema migrans mělo v průběhu neuroborreliózy 18 dětí.
Virová etiologie byla zjištěna u 23/ 227 dětí(10 %) a protilátky proti Mycoplasma pneumoniae třídy IgM byly pozitivní u dvou dětí s polyradikuloneuritidou. Průkaz byl pouze sérologický v korelaci s klinickým nálezem. Pět dětí s nálezem pozitivních IgM protilátek proti HSV mělo při paréze n. facialis klinicky herpes simplex auriculae, nasalis, labialis a aftózní stomatitidu. Jedno dítě mělo při pozitivní VZV sérologii herpes zoster oticus a dvě děti měly varicelu. Pozitivní IgM protilátky proti EBV se sérokonverzí byly u čtyř dětí s parézou n. facialis a u jednoho dítěte s polyradikuloneuritidou. U čtyř dětí byly pozitivní protilátky proti enterovirům.
Průkaz bakteriálních antigenů latexovou aglutinací ani kultivační vyšetření mm prováděné v úvodu onemocnění při podezření na jinou bakteriální než borreliovou etiologii nebyly pozitivní u žádného dítěte. Rovněž provedené PCR vyšetření na virová agens nepřispělo k objasnění diagnózy. Kultivační vyšetření stolice na enteroviry bylo negativní. Etiologie zůstala neprokázána u 84/ 227 (37 %) dětí.
Diskuze
Vyšetření mm může odlišit neuroinfekci od jiných neurologických lézí zvláště při náhle vzniklém paretickém postižení. Lymfocytární nebo smíšená pleocytóza svědčící pro zánětlivé postižení CNS byla nalezena u 55 % nemocných dětí navzdory mnohdy chybějícím meningeálním příznakům.
Kraniální neuritida v rámci časné neuroborreliózy je nejčastěji diagnostikované paretické postižení u dětí na všech třech infekčních klinikách. Vyšetření mm přispívá k rozlišení mezi izolovanou parézou n. facialis a meningoneuritidou, jejíž terapie je odlišná. Při borreliové etiologii meningoneuritidy u dětí je indikována antimikrobiální terapie intravenózně, zatímco izolovanou parézu n. facialis je možno léčit perorálně. Včasná diagnóza a zahájení terapie snižuje riziko rozvoje postborreliového syndromu.
Na řadě pediatrických pracovišť u nás i ve světě probíhá dlouhodobá diskuze o provedení lumbální punkce u každé periferní parézy n. facialis. V našich zeměpisných podmínkách je od jara do podzimu nejčastější etiologické agens tohoto postižení Borrelia burgdorferi sensu lato, konkrétně neurotropní genospecies B. garinii a B. bavariensis. Při meningoneuritidě je borreliová etiologie prokazována v 90 % bez typického meningeálního dráždění. Tento nález je pro dětský věk specifický [7 – 9]. Belman et al uvádějí ve studii 40 dětí s borreliovou parézou n. facialis 90 % dětí se zánětlivými abnormitami v mm a přitom žádné dítě nemělo meningeální dráždění [10]. V námi prezentovaném souboru byla borreliová etiologie meningoneuritidy prokázána v 86 % případů a u izolované periferní parézy bez zánětlivých změn v mm ve 14 % případů. Jednoznačně se proto přikláníme k názoru, že provedení lumbální punkce a vyšetření mm je při respektování pravidel a techniky tohoto zákroku základní vyšetření v diferenciální diagnostice periferních paréz n. facialis u dětí.
Typická meningopolyradikuloneuritida (Garin‑Bujadoux ‑ Bannwarthův syndrom) je u dětí vzácností a prokázána byla pouze v jednom případě v celém souboru. Jiná paretická postižení – hemiparézy, tetraparézy v rámci meningomyelitidy, encefalomyelitidy a fokální encefalitidy borreliové etiologie jsou ojedinělé [11].
Stanovení parametrů hemato‑likvorové bariéry umožňuje výpočet hladiny autochtonních specifických protilátek a jejich průkaz společně s klinickým nálezem a lymfocytární pleocytózou má význam při stanovení diagnózy neuroborreliózy [1,12,13]. Pozitivní nález intratekálně syntetizovaných specifických protilátek s pleocytózou je téměř vždy důkazem probíhající neuroinfekce. Izolovaná intratékální syntéza, převážně IgG protilátek, může přetrvávat dlouhodobě a bez zhodnocení ostatních parametrů v mm a klinického nálezu je bezvýznamná. Vyšetření mm pomocí PCR není pro diagnostiku neuroborreliózy obecně přínosné, specifita metody je vysoká (99 %), ale citlivost je nízká, maximálně do 30 % [14,15], v pediatrických studiích pouze 5 % [16]. V americké studii zaměřené na etiologická agens neuroinfekcí bylo vyšetřeno 471 vzorků mm k průkazu borreliové DNA pomocí PCR a všechny byly negativní [17]. Rovněž další metody přímého průkazu jako elektronová mikroskopie mm nepřispívají ke stanovení etiologické diagnózy. Slibnou metodou převážně u akutní neuroborreliózy je kvantitativní stanovení chemokinu CXCL13 [18,19], zvláště u pacientů s opožděnou protilátkovou odpovědí.
Klíšťová encefalitida u dětí probíhá většinou pod obrazem akutní aseptické meningitidy či meningoencefalitidy. V prezentovaném souboru nebylo prokázáno paretické postižení způsobené virem klíšťové encefalitidy. Paréza n. facialis provázející klíšťovou encefalitidu není častá, ve slovinské studii 1 218 pacientů se vyskytla pouze u 11 pacientů a u tří byla současně diagnostikována neuroborrelióza [20]. Přímý průkaz virové RNA z krve a mm pomocí PCR je možný pouze v první viremické fázi nemoci, v druhé fázi je virus z tělesných tekutin eliminován [21] a vyšetření není v klinické praxi přínosné. Rozvoj humorální imunitní odpovědi v séru a v mm v druhé neurologické fázi onemocnění umožňuje diagnózu detekcí protilátek [22].
Herpetická etiologie parézy n. facialisu dětí hraje méně významnou roli než u dospělých. Reaktivace VZV dokonce při nepřítomnosti herpetického výsevu (herpes sine herpete) byla příčinou periferní parézy n. facialis u dětí v 37 % [23]. VZV a HSV-1 byly prokazovány ze slin pacientů pomocí PCR a průkazem IgM a IgG protilátek ze séra. K opačným výsledkům dospěla finská studie s testováním 36 vzorků pacientů s idiopatickou periferní parézou n. facialis bez zánětlivých změn v mm a objasnila etiologii pouze u jednoho pacienta průkazem HHV ‑ 6 DNA. Jiné herpetické viry (HSV ‑ 1 a VZV) nebyly v mm zjištěny. Autoři vysvětlují nízký záchyt skutečnou absencí herpetických virů v mm nebo technickými nedostatky [24]. Naše výsledky korelují s nálezy této studie, nukleová kyselina herpetických virů v mm nebyla prokázána u žádného dítěte s izolovanou periferní parézou n. facialis. Většina autorů doporučuje testovat mm na herpetické viry pomocí PCR technik pouze v případě zánětlivých změn [17, 25 – 27].
Enterovirová etiologie byla prokázána pouze ve čtyřech případech bez bližší specifikace viru.
Postvakcinační diseminovaná encefalomyelitida s hemiparézou a demyelinizačními ložisky v CNS byla předpokládána u jednoho dítěte s anamnestickým údajem očkování proti chřipce, ale kauzální souvislost nebyla prokázána. Nález v mm byl negativní.
Idiopatické periferní parézy n. facialis se mohou vyskytovat u familiárních syndromů, u jiných zánětlivých onemocnění včetně autoimunitních, u systémových onemocnění, při útlaku n. facialis z důvodů kostních anomálií či tumorů, z cévních příčin nebo po traumatech [28]. Akutní idiopatická periferní paréza n. facialis (Bellova obrna) s neobjasněnou etiologií je uváděna ve studiích v 50 až 75 % [29,30]. V našem souboru zůstala neobjasněna etiologie izolované periferní parézy n. facialis u 34 % (73/ 212) dětí.
Neexistuje neuroinfekce, u které by bylo cytologické a biochemické vyšetření mm jediným zdrojem informací ke stanovení diagnózy. Epidemiologické údaje a klinická data jsou stěžejní při stanovení diagnózy, ale vyšetření mm je nedílnou součástí každého podezření na neuroinfekci s paretickým postižením, stejně důležité jako sérologická vyšetření. Přestože PCR techniky se staly zlatým standardem mikrobiologického vyšetření, výtěžnost se pohybuje mezi 5 a 12 % [17,25 – 27]. V indikacích je nutné zvážit přínos vyšetření k definitivní diagnóze, zvláště u neuroinfekcí, které je možné diagnostikovat konvenčními metodami. PCR je vhodné limitovat na detekci herpetických virů a enterovirů a provádět v akreditovaných laboratořích s využitím správných primerů.
Závěr
Vyšetření mm přispívá k diagnostice paretických onemocnění. Navzdory negativním meningeálním příznakům u dětí by měla být provedena lumbální punkce k potvrzení nebo vyloučení meningitidy. V našich zeměpisných podmínkách je periferní paréza n. facialis diagnostikována u 95 % dětí s převahou borreliové etiologie. Paretická postižení jiné etiologie se vyskytují vzácně a v 37 % není u dětí stanovena etiologická diagnóza.
Autorky deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Lenka Krbková, CSc.
Klinika dětských infekčních nemocí
LF MU a FN Brno
Černopolní 22a
625 00 Brno
e-mail: lkrbkova@fnbrno.cz
Přijato k recenzi: 24. 1. 2014
Přijato do tisku: 20. 3. 2014
Zdroje
1. Stanek G, Fingerle V, Hunfeld KP, Jaulhac B, Kaiser R,Krause A et al. Lyme borreliosis: clinical case definition for diagnosis and management in Europe. Clin Microbiol Infect 2011; 17(1): 79 – 79. doi: 10.1111/ j.1469 ‑ 0691.2010.03175.x.
2. Logar M, Arnez M, Kolbl J, Avsic ‑ Zupanc T, Strle F. Comparison of the epidemiological and clinical features of tick ‑ borne encephalitis in children and adults. Infection 2000; 28(2): 74 – 77.
3. Chen CY, Chang YC, Huang CC, Lui CC, Lee KW,Huang SC. Acute flaccid paralysis in infants and young children with enterovirus 71 infection: MR paging and clinical correlates. Am J Neuroradiol 2001; 22(1): 200 – 205.
4. Doja A, Bitnun A, Ford Jones EL, Richardson S, Tellier R, Petric M et al. Pediatric Epstein Barr virus – associated encephalitis: 10‑year review. J Child Neurol 2006; 21(5): 384 – 391.
5. Endo A, Izumi H, Miyashita M, Okubo O, Harada K. Facial palsy associated with mumps parotitis. Pediatr Infect Dis J 2001; 20(8): 815 – 816.
6. Reiber H, Felgenhauer K. Protein transfer at the blood cerebrospinal fluid barrier and the quantitation of the humoral immune response within the central nervous system. Clin Chem Acta 1987; 163(3): 319 – 328.
7. Christen HJ. Lyme neuroborreliosis in children. Ann Med 1996; 28(3): 235 – 240.
8. Tveitnes D, Oymar K, Natas O. Acute facial palsy in children: how often is it lyme borreliosis? Scand J Infect Dis 2007; 39(5): 425 – 431.
9. Tuerlinckx D, Glupczynski Y. Lyme neuroborreliosis in children. Expert Rev Anti Infect Ther 2010; 8(4): 455 – 463. doi: 10.1586/ eri.10.15.
10. Belman AL, Reynolds L, Preston T, Postels D, Grimson R, Coyle PK. Cerebrospinal fluid findings in children with Lyme disease associated facial nerve palsy. Arch Pediatr Adolesc Med 1997; 151(12): 1224 – 1228.
11. Halperin JJ. Nervous system Lyme disease. Vector Borne Zoonotic Dis 2002; 2(4): 241 – 247.
12. Mygland A, Ljostad U, Fingerle V, Rupprecht T, Schmutzhard E, Steiner I. EFNS guidelines on the diagnosis and management of European Lyme neuroborreliosis. Eur J Neurol 2010; 17(1): 8 – 16. doi: 10.1111/ j.1468 ‑ 1331.2009.02862.x.
13. Dlouhý P, Honegr K, Krbková L, Pícha D, Roháčová H, Štruncová V. Lymeská borrelióza: doporučený postup v diagnostice, léčbě a prevenci. Klin Mikrobiol Inf Lek 2011; 17(4): 144 – 149.
14. Lebech AM, Hansen K, Brandrup F, Clemmensen O, Halkier ‑ Sorensen L. Diagnostic value of PCR for detection of Borrelia burgdorferi DNA in clinical specimens from patients with erythema migrans and Lyme neuroborreliosis. Molecular Diagnosis 2000; 5(2): 139 – 150.
15. Cerar T, Ogrinc K, Cimperman J, Lotric ‑ Furlan S, Strle F, Ruzic ‑ Sabljic E. Validation of cultivation and PCR methods for diagnosis of Lyme neuroborreliosis. J Clin Microbiol 2008; 46(10): 3375 – 3379. doi: 10.1128/ JCM.00410 ‑ 08.
16. Avery RA, Frank G, Eppes SC. Diagnostic utility of Borrelia burgdorferi cerebrospinal fluid polymerase chain reaction in children with Lyme meningitis. Pediatr Infect Dis J 2005; 24(8): 705 – 708.
17. Tang YW, Hibbs JR, Tau KR, Qian Q, Skarhus HA, Smith TF et al. Effective use of polymerace Chin reaction for diagnosis of central nervous system infections. Clin Infect Dis 1999; 29(4): 803 – 806.
18. Rupprecht TA, Pfister HW, Angele B, Kastenbauer S,Wilske B, Koedel U. The chemokine CXCL13 (BLC): a putative marker for neuroborreliosis. Neurology 2005; 65(3): 448 – 450.
19. Silanpää H, Skogman BH, Sarvas H, Seppälä IJ,Lahdenne P. Cerebrospinal fluid chemokine CXCL13 in the diagnosis of neuroborreliosis in children. Scand J Infect Dis 2013; 45(7): 526 – 530. doi: 10.3109/ 00365548.2013.776700.
20. Lotric ‑ Furlan S, Strle F. Peripheral facial palsy in patients with tick ‑ borne encephalitis. Clin Microbiol Infect 2012; 18(10): 1027 – 1032. doi: 10.1111/ j.1469 ‑ 0691.2011.03719.x.
21. Saksida A, Duh D, Lotric ‑ Furlan S, Strle F, Petrovec M, Avsic ‑ Zupanc T. The importance of tick ‑ borne encephalitis virus RNA detection for early differential diagnosis of tick ‑ borne encephalitis. J Clin Virol 2005; 33(4): 331 – 335.
22. Holzmann H. Diagnosis of tick ‑ borne encephalitis. Vaccine 2003; 21 (Suppl 1): S36 – S40.
23. Furuta Y, Ohtani F, Aizawa H, Fukuda S, Kawabata H, Bergström T. Varicella ‑ zoster virus reactivation is an important cause of acute peripheral facial paralysis in children. Pediatr Infect Dis J 2005; 24(2): 97 – 101.
24. Kanerva M, Mannonen L, Piiparinen H, Peltomaa M, Vaheri A, Pitkäranta A. Search for Herpesviruses in cerebrospinal fluid of facial palsy patients by PCR. Acta Otolaryngol 2007; 127(7): 775 – 779.
25. Hanson KE, Alexander BD, Woods CH, Petti C, Reller LB. Validation of laboratory screening criteria for herpes simplex virus testing of cerebrospinal fluid. J Clin Microbiol 2007; 45(3): 721 – 724.
26. Jeffery KJ, Read SJ, Peto TE, Mayon ‑ White RT, Bangham CR. Diagnosis of viral infections of the central nervous system: clinical interpretation of PCR results. Lancet 1997; 349(9048): 313 – 317.
27. Davies NW, Brown LJ, Gonde J, Irish D, Robinson RO, Swan AV et al. Factors influencing PCR detection of viruses in cerebrospinal fluid of patients with suspected CNS infections. J Neurol Neurosurg Psychiatry 2005; 76(1): 82 – 87.
28. Finsterer J. Management of peripheral facial nerve palsy. Eur Arch Otorhinolaryngol 2008; 265(7): 743 – 752. doi: 10.1007/ s00405 ‑ 008 ‑ 0646 ‑ 4.
29. Gilden DH. Clinical praktice. Bell’s palsy. N Engl J Med 2004; 351(13): 1323 – 1331.
30. Bremell D, Hagberg L. Clinical characteristics and cerebrospinal fluid parameters in patients with peripheral facial palsy caused by Lyme neuroborreliosis compared with facial palsy of unknown origin (Bell’s palsy). [online] BMC Infect Dis 2011; 11 : 215. Available from: http:/ www.biomedcentral.com/ 1471 – 2334/ 11/215.
Štítky
Dětská neurologie Neurochirurgie Neurologie
Článek Vyšetření senzitivityČlánek Projekt ncRNAPainČlánek Informace o členstvíČlánek Nabídka pro partneryČlánek Neurovaskulární kongres 2014Článek Webové okénkoČlánek Recenze knih
Článek vyšel v časopiseČeská a slovenská neurologie a neurochirurgie
Nejčtenější tento týden
2014 Číslo 4- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Magnosolv a jeho využití v neurologii
- Zolpidem může mít širší spektrum účinků, než jsme se doposud domnívali, a mnohdy i překvapivé
- Nejčastější nežádoucí účinky venlafaxinu během terapie odeznívají
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
-
Všechny články tohoto čísla
- Vyšetření senzitivity
- Postižení nervového systému z nutriční nedostatečnosti po bariatrických operacích
- Genetická variabilita u poruchy pozornosti s hyperaktivitou (ADHD)
- Anaplastické oligodendrogliomy – nadešel čas pro personalizovanou medicínu?
- Prospektivní paměť a její vyšetření – validace Testu paměti pro záměry
- Přínos opakování nepotvrzujícího testu mnohočetné latence usnutí (MSLT) pro stanovení diagnózy narkolepsie
- Rozdíly v postižení prostorové orientace u demencí neurodegenerativní etiologie
- Hodnocení písma u pacientů s Parkinsonovou nemocí
- Projekt ncRNAPain
- AMETYST – observační studie fáze 4 sledující vliv intramuskulárně podávaného interferonu beta‑1a u pacientů s klinicky izolovaným syndromem/ klinicky definitivní roztroušenou sklerózou
- Informace o členství
- Význam (CA)n repetitivní sekvence genu pro beta‑3 podjednotku GABA(A) receptoru při manifestaci tinnitu
- Dědičné ulceromutilující senzitivní neuropatie – klinická, elektrofyziologická a molekulárně genetická studie tří rodin
- Limity zkoušky verbální fluence v diferenciální diagnostice neurologických onemocnění
- Nabídka pro partnery
- Validace dotazníkové sady pro diagnostiku syndromu neklidných nohou v populaci českých těhotných žen
- Nálezy v mozkomíšním moku u dětí s akutním paretickým postižením
- Dlouhodobé sledování kognitivních, emočních a behaviorálních změn u pacientky s roztroušenou sklerózou – kazuistika
- Neurovaskulární kongres 2014
- Spinální arteriovenózní malformace – dvě kazuistiky
- Totální avulze bulbu kombinovaná s poraněním chiazmatu – kazuistika
- Výsledky soutěže o ceny ČNS za rok 2013
- Primář MUDr. Svatopluk Káš, CSc., zemřel
- Zemřel doc. MU Dr. Otakar Keller, CSc. (1945– 2014)
- Vzpomínka na pplk. MU Dr. Ladislava Houšťavu, Ph.D.
- Webové okénko
-
Analýza dat v neurologii
XLVI. Různé typy observačních studií nesou různá rizika zkreslení - Výroční kongres České neurochirurgické společnosti
- Recenze knih
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Vyšetření senzitivity
- Genetická variabilita u poruchy pozornosti s hyperaktivitou (ADHD)
- Spinální arteriovenózní malformace – dvě kazuistiky
- Přínos opakování nepotvrzujícího testu mnohočetné latence usnutí (MSLT) pro stanovení diagnózy narkolepsie
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



